- Home
- volume 10 (2006)
- numéro 2
- Evaluation préliminaire de l’activité larvicide des extraits aqueux des feuilles du ricin (Ricinus communis L.) et du bois de thuya (Tetraclinis articulata (Vahl) Mast.) sur les larves de quatre moustiques culicidés : Culex pipiens (Linné), Aedes caspius (Pallas), Culiseta longiareolata (Aitken) et Anopheles maculipennis (Meigen)
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Evaluation préliminaire de l’activité larvicide des extraits aqueux des feuilles du ricin (Ricinus communis L.) et du bois de thuya (Tetraclinis articulata (Vahl) Mast.) sur les larves de quatre moustiques culicidés : Culex pipiens (Linné), Aedes caspius (Pallas), Culiseta longiareolata (Aitken) et Anopheles maculipennis (Meigen)

Editor's Notes
Reçu le 23 juin 2004, accepté le 5 avril 2006
Résumé
Les extraits aqueux des feuilles du ricin Ricinus communis L. et du bois de thuya Tetraclinis articulata (Vahl) Mast. présentent des effets toxiques sur des larves de moustiques culicidés. Dans ce travail, l’activité insecticide de ces extraits a été étudiée sur les larves des stades 2 et 4 de Culex pipiens (Linné), Aedes caspius (Pallas), Culiseta longiareolata (Aitken) et Anopheles maculipennis (Meigen). Les tests de toxicité ont révélé au bout de 24 heures d’exposition des concentrations létales CL50 très faibles. Dans le cadre de lutte anti-moustique, les extraits de ces plantes peuvent être utilisés comme des biocides naturels.
Abstract
Preliminary evaluation of larvicidal activity of aqueous extracts from leaves of Ricinus communis L. and from wood of Tetraclinis articulata (Vahl) Mast. on the larvae of four mosquito species: Culex pipiens (Linné), Aedes caspius (Pallas), Culiseta longiareolata (Aitken) and Anopheles maculipennis (Meigen). Aqueous extracts of Ricinus communis leaves and Tetraclinis articulata wood showed strong toxic activity against larvae of several mosquitoes. In this study, insecticide effects of these plant extracts have been investigated on 2nd and 4th instars larvae of Culicidae insects, Culex pipiens (Linné), Aedes caspius (Pallas), Culiseta longiareolata (Aitken) and Anopheles maculipennis (Meigen). After 24 hours of exposition, bioassays revealed low lethal concentrations LC50. To control mosquitoes, these plant extracts might be used as natural biocides.
Table of content
1. Introduction
1Les moustiques ont toujours été considérés comme source de nuisance pour l’homme, principalement en raison du fait qu’ils peuvent être des vecteurs de maladies. Les femelles en période de reproduction ont besoin de sang pour le développement des œufs et certaines espèces ont une préférence marquée pour le sang humain. Parmi les espèces connues dans la transmission des maladies à l’homme, nous citons celles appartenant aux genres Culex, Aedes et Anopheles. Les espèces du genre Culex transmettent des maladies parasitaires telles la filariose et la fièvre jaune alors que les espèces du genre Anopheles transmettent le paludisme. Au Maroc, le paludisme, maladie parasitaire d’origine hydrique, continue à poser un problème de santé publique (Alaoui Slimani et al., 1999).
2Dans les campagnes de lutte anti-moustique, les matières actives des insecticides utilisés appartiennent aux organophosphorés, pyréthrinoïdes et carbamates de synthèse. Ces préparations, bien qu’elles se soient révélées très efficaces sur les moustiques culicidés, présentent plusieurs inconvénients. En effet, en plus de leur coût élevé, elles peuvent être à l’origine de divers problèmes environnementaux. Pour Barbouche et al. (2001), l’accumulation significative de matières actives dans les écosystèmes traités, aquatiques et terrestres est un problème de pollution. Par ailleurs, les substances actives des produits utilisés présentent un large spectre d’action et n’épargnent pas les organismes non cibles. A tous ces inconvénients s’ajoute aussi un grand problème de développement de résistance aux insecticides chimiques, chez les insectes traités (Georghiou et al., 1975 ; Sinegre et al., 1977).
3Pour assurer une meilleure intervention, tout en préservant au maximum le milieu naturel, de nouvelles méthodes préventives ainsi que de nouveaux produits sont constamment recherchés. Ainsi, pour contribuer à une gestion durable de l’environnement, la mise en place de nouvelles alternatives de contrôle des moustiques est davantage encouragée. Les substances naturelles qui présentent un large spectre d’action en pharmacologie, comme bactéricides, fongicides, acaricides, etc., peuvent aussi être utilisées comme insecticides de remplacement. L’utilisation des extraits de plantes comme insecticides est connue depuis longtemps, en effet le pyrèthre, la nicotine et la roténone sont déjà connus comme agents de lutte contre les insectes (Crosby et al., 1966). Dans certaines régions d’Afrique noire, les feuilles de tabac malaxées dans l’eau étaient utilisées pour lutter contre les moustiques. Au Maroc, l’utilisation de plantes contre les invasions de moustiques est une pratique très courante, surtout dans les régions rurales. En effet, les odeurs du basilic Ocimum basilicum, Basil (Labiée) et de Sarghina, Corrigiola telephiifolia (Caryophyllacée) sont des répulsifs très efficaces. D’après Jacobson (1989), plus de 2000 espèces végétales possédant une activité insecticide sont déjà identifiées. Récemment, la litière de l’aulne, plante riche en polyphénols s’est révélée être douée de propriétés toxiques importantes vis-à-vis des larves des moustiques Culex pipiens, Aedes aegypti et A. albotropus (David et al., 2000). Dans des travaux encore plus récents, les propriétés insecticides de certaines plantes ont été testées sur les larves d’insectes. Nous citons à cet effet, les travaux de Jang et al. (2002 a) sur A. aegypti et C. pipiens en testant l’activité larvicide de certaines légumineuses et les travaux d’Alaoui Slimani (2002) dans lesquels la toxicité de Mentha pulegium (Labiée) a été confirmée sur des larves de culicidés. L’activité larvicide des extraits de plantes médicinales aromatiques a aussi été confirmée dans les travaux de Jang et al. (2002b). Par ailleurs, la protection des cultures contre les ravageurs par des extraits végétaux a été étudiée aussi bien sur des larves de lépidoptères (Lee et al., 2002) que sur des larves d’acridiens (Barbouche et al., 2001).
4Au Maroc, les études menées sur l’activité insecticide des extraits végétaux vis-à-vis des larves de moustiques sont très limitées. En effet, à l’exception des travaux d’Alaoui Slimani (2002) et ceux de Bouallam Tifnouti (2001), aucune autre étude n’a été effectuée sur des larves de moustiques culicidés. Ainsi, dans le cadre de recherches menées au sein de notre laboratoire sur la « démoustication », la toxicité des extraits aqueux de quelques espèces végétales locales a été étudiée sur les larves de stades L2 et L4 de quatre moustiques culicidés : Culex pipiens (Linné), Aedes caspius (Pallas), Anopheles maculipennis (Meigen) et Culiseta longiareolata (Aitken).
2. Matériel et méthodes
2.1. Choix des larves
5Les larves soumises aux tests de toxicité proviennent de gîtes larvaires non traités situés dans des zones rurales de Mohammedia, ville côtière de l’atlantique marocain. Elles sont maintenues en élevage au laboratoire dans des bocaux en verre à une température moyenne de 21,3 °C ± 1,8 °C. Elles ont été déterminées à l’aide d’une clé d’identification des culicidés du Maroc (Himmi, 1995). Les espèces ont été triées et isolées les unes des autres afin d’éviter des interactions interspécifiques.
2.2. Préparation des extraits aqueux
6La matière végétale (feuilles, tiges et bois) de 5 plantes locales (Ammi visnaga Lam., Tetraclinis articulata L., Ricinus communis L., Nerium oleander L. et Inula viscosa (L.) Ait.), traditionnellement utilisées contre des insectes, est préalablement lavée à l’eau distillée puis séchée dans une étuve portée à 40 °C pendant 48 h à 92 h. Elle est ensuite broyée à l’aide d’un mixeur jusqu’à sa réduction en poudre. Une quantité de 100 g de poudre de chaque plante est diluée dans un litre d’eau distillée préalablement portée à ébullition, puis laissée refroidir sous agitation magnétique pendant 30 minutes. Le mélange obtenu est filtré à l’aide du papier Whatman (3 MM). Le filtrat récupéré représente une solution stock initiale à 100 g par l soit 10 %.
2.3. Estimation des quantités du résidu sec
7Dans le but de donner une signification plus logique aux quantités de matières végétales solubles dans les extraits aqueux, ces derniers ont été concentrés par évaporation dans une étuve portée à 40 °C pendant 48 h, jusqu’à l’obtention d’un résidu sec dont la quantité est exprimée en mg. Cela permet d’exprimer les concentrations létales des résidus secs solubles dans l’eau en mg/l.
2.4. Tests de toxicité
8La méthodologie de nos tests est inspirée de la technique des tests de sensibilité normalisés par l’Organisation Mondiale de la Santé, adoptée pour tester la sensibilité des larves, vis-à-vis des insecticides utilisés en campagnes de lutte (OMS, 1963).
9A partir de l’extrait initial (solution stock 100 g/l ou 10 %) de chaque plante et l’eau du gîte larvaire, des concentrations de 5 %, 4 %, 3 %, 2 % et 1 % ont été préparées. Les tests sont réalisés dans des béchers de 5 cm de diamètre contenant chacun 100 ml de solution et 10 larves de moustiques de la même espèce et du même calibre. Le même nombre de larves est placé dans un bécher témoin contenant 100 ml d’eau du gîte larvaire. Pour chacune des concentrations de l’extrait ainsi que pour le témoin, quatre répétitions sont effectuées. Le taux de mortalité est calculé en terme de moyenne des quatre déterminations portant chacune sur 10 individus. L’analyse statistique des moyennes est réalisée à l’aide du test de l’analyse de la variance ANOVA 2. Les moyennes de mortalité ont été traitées et comparées par le test de Scheffe au seuil de P = 0,05 (Sas, 1990). Les concentrations létales CL50 sont déterminées après 24 heures d’exposition, elles sont calculées à l’aide du logiciel Spearman-Kaber (Hamilton et al., 1977).
3. Résultats et discussion
3.1. Variation du taux de mortalité
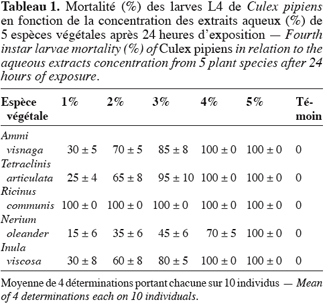
10Après avoir exposé des larves du stade 4 de l’espèce C. pipiens aux différentes concentrations des cinq extraits aqueux pendant 24 h, le taux de mortalité varie selon les concentrations (Tableau 1). Pour tous les extraits, à l’exception de celui du laurier rose, la mortalité des larves atteint un taux de 100 % à partir d’une concentration de 4 %. Cependant, dans l’extrait du Ricinus communis, la mortalité est plafonnée à 100 % dès la concentration de 1 %. De l’ensemble de ces résultats un premier classement de l’efficacité toxique des extraits testés est mis en évidence, ainsi les extraits les plus toxiques sont ceux des feuilles du ricin et du bois de thuya et le moins toxique celui des feuilles du laurier rose.
3.2. Concentrations létales CL50
11Les CL50 calculées pour des larves du quatrième stade (L4) de l’espèce Culex pipiens (Tableau 2), ont montré que parmi les 5 extraits testés, deux se sont révélés intéressants en terme de toxicité, l’extrait de T. articulata et celui du R. communis. Ils présentent en effet les CL50 les plus faibles qui sont respectivement de 530 mg/l et de 600 mg/l. Ces résultats, bien qu’ils soient préliminaires, illustrent bien l’intérêt que présentent les extraits aqueux du bois du thuya et des feuilles du ricin dans la lutte anti-larvaire. Par ailleurs, la toxicité de ces mêmes extraits a été étudiée sur d’autres espèces de moustiques, aussi bien sur le stade larvaire avancé L4, que sur le stade jeune L2. Les tableaux 3 et 4 regroupent les résultats des tests de toxicité en terme de CL50. Ils concernent quatre espèces de moustiques C. pipiens, A. caspius, C. longiareolata et Anopheles maculipennis.
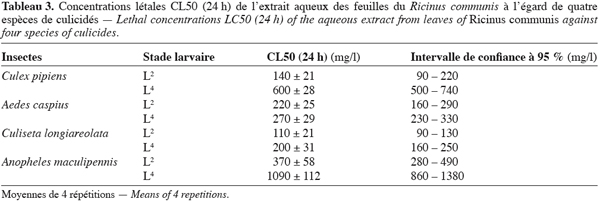
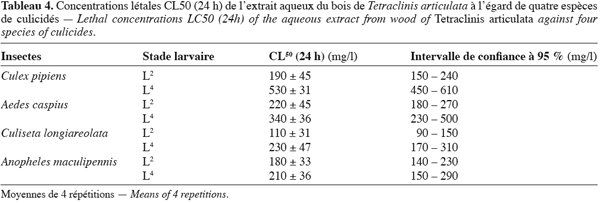
12Dans l’ensemble des tests réalisés, les CL50 paraissent toujours plus faibles pour le deuxième stade larvaire (L2) que pour le quatrième stade (L4) et ce quels que soient l’espèce considérée et l’extrait utilisé. Les larves les plus vulnérables à l’extrait du ricin sont celles du stade (L2) des espèces C. pipiens et C. longiareolata avec respectivement des CL50 (24 h) de 140 mg.l-1 et de 110 mg.l-1 soit des CL50 bien inférieures à celles obtenues dans la phase aqueuse des galles de Quercus lusitania, CL50 (24 h) = 256 mg/l (Bouallam Tifnouti, 2001), et de la phase aqueuse de Mentha pulegium, CL50 (24 h) = 750 mg.l-1 (Alaoui Slimani, 2002). Par ailleurs, pour le stade (L4), ce sont les larves de C. longiareolata qui sont les plus touchées avec une CL50 (24 h) = 200 mg.l-1.
13L’extrait aqueux du bois de Thuya est également plus toxique pour les stades (L2) avec des CL50 allant de 110 mg.l-1 pour C. longiareolata à 220 mg.l-1 pour A. caspius. Alors qu’il est moins toxique pour les larves L4 avec des CL50 allant de 210 mg.l-1 pour A. maculipennis à 530 mg.l-1 pour C. pipiens. Cependant, à l’exception des larves de A. maculipennis, plus résistantes à l’extrait du ricin, la toxicité de ce dernier et celle de l’extrait du thuya, se manifestent généralement de la même façon sur les autres espèces. Ils présentent en effet des CL50 très proches. Cependant bien qu’elles paraissent élevées, ces concentrations létales restent relativement inférieures à celles des extraits aqueux des galles de Quercus lusitania et des feuilles de Mentha pulegium.
4. Conclusion
14Ces résultats bien que préliminaires, témoignent d’une bonne activité larvicide des extraits aqueux des poudres végétales. Parmi plusieurs extraits testés, ceux du bois de Tetraclinis articulata et des feuilles du Ricinus communis constituent des larvicides prometteurs pour la lutte contre les moustiques nuisibles (Culex pipiens, Aedes caspius, Culiseta longiareolata et Anopheles maculipennis). Ils sont en effet plus efficaces sur les larves du deuxième stade (L2) que sur celles du quatrième stade (L4), avec des CL50 (24 h) plus faibles, oscillant entre 110 mg.l-1 et 370 mg.l-1 pour l’extrait du ricin et entre 110 mg.l-1 et 220 mg.l-1 pour l’extrait du thuya. Comparés à d’autres extraits aqueux déjà testés sur les mêmes espèces, à savoir, les galles de Quercus lusitania et Mentha pulegium, les CL50 (24 h) de la phase aqueuse du thuya et du ricin sont relativement plus faibles et par conséquent plus efficaces. Les extraits de la phase aqueuse brute de ces deux plantes devront être soumis à une séparation de manière à isoler et concentrer les substances actives, qui certainement pourront présenter des CL50 beaucoup plus faibles et devraient pouvoir être valorisés en tant qu’insecticides de remplacement.
15Remerciements
16Nous remercions le docteur M. Lyagoubi et l’ingénieur C. Faraj du laboratoire de l’Institut national d’Hygiène de Rabat qui nous ont autorisé une formation sur les tests de toxicité. Nous remercions également le Docteur O. Himmi de l’Institut scientifique de Rabat pour son aide pour la détermination des espèces culcidiennes.
Bibliographie
Alaoui Slimani N., Jouid N., Benhoussa A., Hajji K. (1999). Typologie des habitats d’Anopheles dans une zone urbaine (Diptera Culicidae). Entomologiste 55 (5) , p. 181–190.
Alaoui Slimani N. (2002). Faune culicidienne d’une zone marécageuse de Rabat-Salé : Biotypologie et contribution à la lutte par des substances naturelles. Thèse Doct. es Sci. Biol., Fac. Sci. Univ. Mohammed V., Rabat, Maroc, 192 p.
Barbouche N., Hajjem B., Lognay G., Ammar M. (2001). Contribution à l’étude de l’activité biologique d’extraits de feuilles de Cestrum parqui L’Hérit. (Solanaceae) sur le criquet pèlerin Schistoceraca gregaria (Forsk.). Biotechnol. Agron. Soc. Environ. 5 (2), p. 85–90.
Bouallam Tifnouti S. (2001). écologie des diptères culicidés de la région de Marrakech : Contribution à l’amélioration des moyens de lutte chimique et biologique. Thèse. doct. es Sci., Fac. Sci. Semlalia., Univ. Cadi Ayyad., Marrakech, Maroc, 148 p.
Crosby DG. (1966). Natural pest control agents. In Gould, R.F. (Ed.). Natural Pest Control Agents. Adv. Chem. Ser. 53, p. 1-16
David JP., Rey D., Pautou MP., Meyran JC. (2000). Differential toxicity of leaf litter to Dipteran larvae of mosquito developmental sites. J. Invertebr. Pathol. 75, p. 9–18.
Georghiou GP., Ariaratnam V., Pasternak ME., Lin CS. (1975). Organophosphorus multiresistance in Culex quinquefasciatus in California. J. Econ. Entomol. 68, p. 461–467.
Hamilton MA., Russo RC., Thurston RV. (1977). Trimmed Spearman-Kaber method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11 (7), p. 714–719 ; correction 12 (4), p. 417 (1978)
Himmi O., Dakki M., Trabi B., Elagbani M. (1995). Les Culicidae du Maroc : Clés d’identification, avec données biologiques et écologiques. Rabat : Institut Sciences, Trav. Série Zoologie 44, 51 p.
Jacobson M. (1989). Botanical pesticides, past present and future In Arnason JT. et al. (Ed.). Insecticides of plant origin. Washington, D.C. : American Chemical Society Symposium, series 387, p. 1-10.
Jang YS., Baek BR., Yang YC., Kim MK., Lee HS. (2002 a). Larvicidal activity of leguminous seeds and grains against Aedes aegypti and Culex pipiens pallens. J. Am. Mosq. Control. Assoc. 18 (3), p. 210–213.
Jang YS., Kim MK., Ahn YJ., Lee HS. (2002 b). Larvicidal activity of Brazilian plants against Aedes aegypti and Culex pipiens pallens (Diptera : Culicidae). Agric. Chem. Biotechnol. 45 (3), p. 131–134.
Kabaru JK., Gichia L. (2001). Insecticidal activity of extracts derived from different parts of the mangrove tree Rhizophora mucronata (Rhizophoraceae) Lam. against three arthropods. AJST, 2 (2), p. 44–49.
Koua HK., Han SH., D’Almeida MA. (1998). Histopathologie d’Anopheles gambiae s.l Giles, 1902 (Diptera, Culicidae) soumis à l’activité larvicide de l’extrait aqueux de Persea americana Miller, 1768 (Lauraceae). Entomologie médicale. Bull. Soc. Path. Ex. 91 (3), p. 252–256.
Lee HK., Park C., Ahn YJ. (2002). Insecticidal activities of asarones identified in Acorus gramineus rhizome against Nilaparvata lugens (Homoptera: Delphacidae) and Plutella xylostella (Lepidoptera: Yponomeutoidae). Jap. Soc. Appl. Entomol. Zool. 37 (3), p. 459–464.
Organisation Mondiale de la Santé (1963). Méthode à suivre pour déterminer la sensibilité ou la résistance des larves de moustiques aux insecticides. In Résistance aux insecticides et lutte contre les vecteurs. Treizième rapport du comité OMS d’experts des insecticides, Genève : OMS, Sér. Rapp. Techn. 265, p. 55–60.
Sas (1990). SAS User’s guide: Statistics. Cary, North Calorina, USA: SAS Institute.
Sinegre G., Jilien JL., Gaven B. (1977). Acquisition progressive de la résistance au chlorpyrifos chez les larves de Culex pipiens (L.) dans le Midi de la France. Parasitologia 19 (1/2), p. 79–94.
To cite this article
About: Brahim Aouinty
Laboratoire de Physiologie et Pharmacologie, UFR Santé et Environnement. FST, Université Hassan II-Mohammedia (Maroc). e-mail : aouinty2002@yahoo.fr
About: Saadia Oufara
Laboratoire de Physiologie et Pharmacologie, UFR Santé et Environnement. FST, Université Hassan II-Mohammedia (Maroc).
About: Fouad Mellouki
Laboratoire de Chimie bioorganique et analytique, UFR 35/97 FST Université Hassan II-Mohammedia (Maroc).
About: Saadia Mahari
Laboratoire de Physiologie et Pharmacologie, UFR Santé et Environnement. FST, Université Hassan II-Mohammedia (Maroc).






