- Home
- Volume 18 (2014)
- Numéro 3
- Aperçu des connaissances actuelles sur la gestion de la pollution des mangroves par les hydrocarbures
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Aperçu des connaissances actuelles sur la gestion de la pollution des mangroves par les hydrocarbures

Editor's Notes
Reçu le 12 aout 2013, accepté le 20 janvier 2014
Résumé
Les forêts de mangrove revêtent une importance capitale en termes de production de la biomasse et du maintien de l'équilibre naturel dans les zones côtières des régions tropicales. Cependant, les mangroves sont sujettes à une pollution causée par les activités anthropiques. La pollution par les hydrocarbures est l'une des causes qui entrainent le dépérissement de cette forêt qui ne représente que 1 % de la superficie de l'ensemble des forêts tropicales du monde. Plusieurs techniques de dépollution des zones contaminées par les hydrocarbures existent. La biodégradation semble être la mieux adaptée aux écosystèmes des mangroves, seulement cette technique reste confinée au niveau du laboratoire. Des essais in situ en milieu naturel doivent être réalisés pour évaluer les résultats obtenus en laboratoire.
Abstract
Overview of current knowledge on management of hydrocarbon pollution in mangroves. Mangrove forests are vital in terms of biomass production and maintenance of the natural balance in coastal areas in the tropics. However, mangroves are subject to pollution from human activities. Oil pollution is one of the causes leading to the decline of mangroves, which represent only 1% of the area of all the world's tropical forests. Several techniques are available for the remediation of oil contaminated areas. Biodegradation appears to be the best suited to mangrove ecosystems. However this technique remains confined to the laboratory. Field tests in situ need to be conducted in order to evaluate the results obtained in the laboratory.
Table of content
1. Les mangroves dans le monde et leur importance
1Les mangroves sont peuplées de plantes ligneuses que l'on retrouve à l'interface entre la mer et les terres dans les zones tropicales et sub-tropicales (Kathiresan et al., 2001). Ce sont des formations sempervirentes qui poussent en dessous du niveau de la mer et sont étroitement liées à la dynamique hydrique du milieu qui les caractérise (Dupuy et al., 1999). Les mangroves couvrent seulement 1 % de la superficie de l'ensemble des forêts tropicales, 75 % des côtes tropicales du monde (FAO, 2007). Les espèces végétales, peu nombreuses, sont sujettes à une immersion temporaire en milieu halophile. Les espèces ligneuses les plus importantes sont les palétuviers, du genre Rhizophora et Avicennia (Marius, 1977). Le genre Rhizophora se caractérise par des racines échasses qui s'allongent depuis la partie inférieure du tronc, d'abord horizontalement puis s'infléchissent vers la vase dans laquelle elles pénètrent. Elles forment un enracinement profond et dense de radicelles fibreuses. Le genre Avicennia se caractérise par la présence de pneumatophores qui forment un véritable tapis autour des arbres et leurs feuilles sont toujours recouvertes d’une couche de sel. L'organe de dissémination ou de propagation est une propagule (viviparité) (Dupuy et al., 1999). Les limites latitudinales de cet écosystème sont établies avec la température (isotherme 24 °C) et l'aridité (Saenger, 1998). À l’échelle mondiale, les formations arborées de mangroves occupent une superficie estimée à 181 680 km2. En Afrique, les mangroves sont principalement localisées sur la façade atlantique du continent (83 %) et représentent 18 % des mangroves à l’échelle mondiale (Guiral et al., 1999). Ces plantes, les micro-organismes associés (bactéries, champignons) et la faune, constituent ce qu'on appelle les « forêts de mangrove » ou « mangal ». Le mangal et les facteurs abiotiques associés constituent l'écosystème de mangrove. Dans la littérature, pour éviter toute confusion, il a été proposé que « mangal » devrait se référer à la communauté forestière (Guiral et al., 1999), tandis que les « mangroves » doivent se référer aux espèces végétales uniquement (Kathiresan et al., 2001).
2Des points de vue écologique, social et économique, l'importance des mangroves n'est plus à démontrer et leur dégradation rapide est devenue une préoccupation majeure. Sur le plan écologique, les mangroves sont en effet les écosystèmes les plus productifs de biomasse (Saenger, 2003), assurant le maintien d’une bonne qualité de l’eau en retenant les charges alluviales, en filtrant et en retenant les polluants. La litière est à la base d'un réseau trophique détritique complexe où intervient une succession d'organismes reliés par des relations de types syntrophiques (Guiral et al., 1999). Les mangroves constituent des stabilisateurs efficaces pour certaines zones côtières fragiles, car elles contribuent à la résilience écologique des écosystèmes après les cyclones et les tsunamis (Saenger, 2003). Les mangroves sont à la base de la vie de plusieurs espèces halieutiques, fauniques et aviaires vivant dans ce milieu ou migratrices car elles constituent des habitats terrestres et marins qui sont des milieux de reproduction, de conservation et de développement de ces espèces (Tanaka et al., 2007).
3Sur le plan social, la productivité des mangroves définit la survie d'un grand nombre de communautés locales et des populations riveraines qui y pratiquent plusieurs activités telles que l'agriculture, la chasse et la pêche. Elles s’en servent surtout dans la construction (toitures, décorations, boites, pontons, ustensiles traditionnels de pêche, etc.) et pour la production de charbon. Les mangroves sont également pour ces populations une source de produits forestiers non ligneux tels que les tannins, entre autres (FAO, 2007).
4Sur le plan économique, les populations locales bénéficient aussi des retombées touristiques. Malgré leurs potentialités remarquables, les mangroves manquent de protection (Aijiki, 2000).
5En 2007, la FAO a publié une étude mettant en exergue la diminution des surfaces des mangroves dans certains pays en Afrique et dans le monde. Au Cameroun, par exemple, la superficie des mangroves est passée de 272 000 ha en 1980 à 250 000 ha en 2005, soit un taux de dépérissement de 8 % (Figure 1). Au cours de la même période, les mangroves du Gabon (de 218 500 à 150 000 ha), de la République Démocratique du Congo (63 700 à 19 500 ha), de la Guinée Bissau (276 000 à 210 000 ha), du Sénégal (16 900 à 10 000 ha), de la Sierra Léone (167 700 à 100 000 ha), de la Tanzanie (152 000 à 125 000 ha), entre autres, ont connu des taux de dépérissement importants. En Indonésie, 75 % des grandes villes de plus de 100 000 habitants sont situées sur les zones côtières dont la majorité abritaient des mangroves. En 1990, environ 269 000 ha de mangroves y ont été convertis à la pisciculture. Même dans de petits pays comme Fidji, les mangroves ont dû faire place à l’urbanisation à grande échelle. Aux Philippines, 169 852 ha de mangroves ont disparu entre 1967 et 1976. La forêt de mangrove de la Thaïlande est passée de 360 000 ha en 1960 à 174 000 ha en 1991 et celle de la Malaisie de 505 300 à 269 000 ha entre 1980 et 1990.
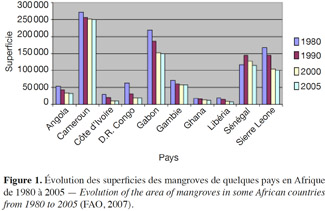
6Entre les années 1980 et 2000, on a noté un dépérissement d'environ 35 % de la superficie mondiale des mangroves (Valiela et al., 2001). Cette destruction a pour origine l'augmentation d'activités industrielles (aquaculture, barrages hydro-électriques, industries portuaire et pétrolière) et de l'urbanisation, elles-mêmes liées à une augmentation importante des populations vivant sur le littoral (FAO, 2007). Du fait de cette forte démographie, les mangroves sont sujettes à de fortes pressions qui ne sont pas que locales. Par exemple, la forte demande mondiale pour les crevettes entraine l'installation de fermes aquacoles extensives en opposition avec une gestion à long terme du milieu côtier (Sathirathai et al., 2005). L'insuffisance des politiques et des législations (ou leur défaut d’application) contribue également à la destruction et à la dégradation des mangroves (OIBT, 2002).
7L'exploitation excessive du bois des palétuviers contribue aussi à la destruction des mangroves. Ces zones sont exposées aux pollutions engendrées par les rejets urbains de produits pétroliers, les émissions provenant de la combustion et des procédés industriels (Tam et al., 2008). L'exploration et l'exploitation pétrolière et gazière, les déversements accidentels d'hydrocarbures observés lors des opérations de chargement des tankers dans les plateformes pétrolières, le déballastage des cuves des navires qui s'effectue le plus souvent près des côtes continentales et le transport du brut au niveau des pipelines ont des incidences graves sur la flore et la faune des mangroves. Ces pollutions d'origine tellurique ou par lixiviation aboutissent toujours au niveau des mangroves. Les effets des hydrocarbures sur les mangroves, particulièrement sur les palétuviers, sont désastreux. Le rapport d’ITOPF (2013) indique que les déversements d’hydrocarbures peuvent avoir des répercussions sérieuses dans les zones intertidales des littoraux, tant par engluement physique particulièrement par les hydrocarbures et les produits pétroliers lourds (fuels lourds, hydrocarbures très visqueux, etc.) que par toxicité s’il s’agit d’une pollution par les hydrocarbures et les produits pétroliers légers (essence, diesel, etc.). La sévérité de l’impact dépend généralement de la quantité et du type d’hydrocarbure déversé, des conditions ambiantes ainsi que de la sensibilité aux hydrocarbures des organismes touchés et de leurs habitats.
8Les palétuviers dépendent généralement de l’apport de l’oxygène à travers les petits pores de leurs racines aériennes. Le recouvrement de ces pores par les hydrocarbures lourds avec la marée haute et les surfaces sédimentaires avec la marée sortante, bloque l’arrivée de l’oxygène et provoque la mort des palétuviers. Les hydrocarbures lourds et visqueux recouvrent les pneumatophores, étouffent les racines qui reçoivent normalement de l'oxygène par les pores aériens. Les composants toxiques des hydrocarbures, surtout les fractions aromatiques à faibles poids moléculaires, attaquent en profondeur les membranes cellulaires des racines. Ils perturbent les systèmes végétaux de régulation de la salinité et sont, ainsi, une source de stress pour eux (IPIECA, 1993 ; ITOPF, 2013).
9L'effet des hydrocarbures sur les palétuviers se voit avec l'assèchement et l'absence totale des feuilles sur les arbres des mangroves (IPIECA, 1993). D'autres pollutions concernent l'épandage excessif des engrais azotés et des pesticides non biodégradables dans les plantations agro-industrielles voisines des zones de mangroves.
10La prise de conscience suite à la dégradation des mangroves s'est traduite, d'une part, à travers la convention de Ramsar (2002) qui a reconnu aux mangroves une valeur réelle sur le triple plan écologique, social et économique ; d'autre part, à travers une recherche scientifique visant à caractériser les facteurs de pollution et de dégradation des mangroves. Cette synthèse concerne la pollution des mangroves par les hydrocarbures et met en évidence les potentialités de biodégradation de ces polluants liées à cet écosystème.
2. Quelques polluants présents dans les mangroves
11Plusieurs types de polluants se retrouvent généralement dans les mangroves. Les éléments traces métalliques tels que le fer, le manganèse, le nickel, le cuivre, le cobalt, le zinc, le plomb, le cadmium et le chrome, les phosphates, les sulfates, etc. sont présents dans les racines, les feuilles et dans les sédiments de mangroves. Macfarlane et al. (2003), Defew et al. (2005), Ray et al. (2006) et Ramos e Silva et al. (2006) ont démontré que les activités anthropiques dans des zones côtières tropicales sont responsables de la présence de fer, de zinc et plomb dans les sédiments de mangroves. Les polluants organiques tels que les hydrocarbures raffinés, les hydrocarbures chlorés (DDT, PCB), les phénols, etc. sont également présents dans les sédiments des mangroves. Certains de ces polluants sont présents de façon naturelle et proviennent soit de la combustion de la matière organique, soit de l'altération de la roche mère du sous-sol ; cependant, les concentrations les plus importantes dans les mangroves sont d’origine anthropique (Lemière et al., 2008). Les hydrocarbures pétroliers figurent parmi les principaux polluants rencontrés dans les écosystèmes de mangroves.
2.1. Les hydrocarbures pétroliers
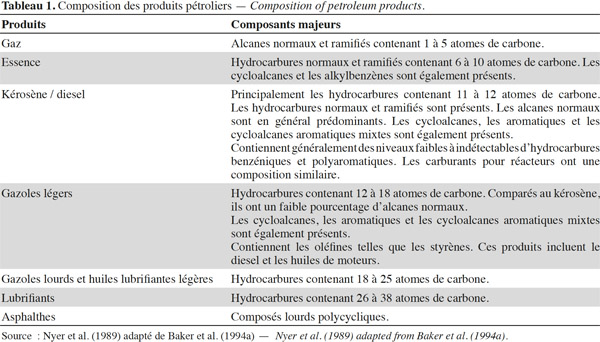
12Ce sont des produits pétroliers (pétrole brut, pétrole raffiné, kérosène, essences, fuel, lubrifiants, huiles à moteurs) regroupés sous le nom d'hydrocarbures. Ils comprennent principalement des hydrocarbures aliphatiques dont la caractéristique est la présence de chaines linéaires ou ramifiées (Baker et al., 1994a). Les produits pétroliers comprennent aussi parfois en proportion significative des hydrocarbures aliphatiques cycliques (cyclanes), des hydrocarbures aromatiques monocycliques (benzène, toluène, xylène, etc.) et des hydrocarbures aromatiques polycycliques (anthracène, fluorène, naphtalène, pyrène, benzo(a)pyrène, etc.).
13De manière générale, le comportement d’un produit pétrolier dans l’eau dépend du rapport de sa densité avec celle de l’eau. Les produits pétroliers non persistants sont moins denses que l’eau, ce qui les amène à flotter sur l’eau. Leur dégradation rapide est due au fait de leur exposition aux conditions météorologiques. Les hydrocarbures persistants plus denses sont submergés par l’eau et le processus de dégradation est plus lent (EPPR, 1998). Ces derniers ont montré que les produits pétroliers non persistants comme le fuel, l’essence ou le diesel se dégradent habituellement facilement lorsqu’ils sont exposés à certaines conditions météorologiques telles que l’air et une température élevée. Pour une température comprise entre 0 et 5 °C, on note 5 à 20 % de diesel qui s’évapore en deux jours. Cette même quantité est observée en cinq jours pour des températures comprises entre 20 et 0 °C. Les hydrocarbures persistants s’évaporent plus lentement. Lorsqu’une émulsion se produit, le processus devient plus complexe du fait des propriétés physiques qui changent. Le tableau 1 résume les principales composantes des différents produits pétroliers.
14Les HAP (hydrocarbures aromatiques polycycliques) sont des composés ubiquistes, fréquemment retrouvés dans l'environnement notamment, issus de la combustion de la matière organique (Gabet, 2004). Les sources naturelles incluent les émissions liées aux feux de forêts, aux éruptions volcaniques, mais aussi aux réactions biogènes dans les plantes et les bactéries, ainsi que les réactions géologiques associées à la production de fuel fossile et minéral. Ces émissions concernent les sources diffuses.
15Les sources anthropiques sont majoritaires. Elles sont, suivant les cas, diffuses ou ponctuelles. Elles regroupent aussi bien les processus de combustion de fuel fossile (automobiles, usines de production de coke, etc.) que les processus de transformation tels que la production et l'utilisation de créosote, la raffinerie du pétrole (Gabet, 2004).
16Leur distribution dans les écosystèmes est déterminée par leurs propriétés physico-chimiques qui diffèrent d'une molécule à l'autre et qui sont fonction de leur masse moléculaire et de leur structure. Les principales caractéristiques sont : une faible solubilité à l'eau (Hébrard-Labit et al., 2004), une forte hydrophobicité, une volatilité faible, sauf pour le naphthalène ; une persistance dans les sols et une forte toxicité pour l'homme et l'environnement (Costes et al., 1997).
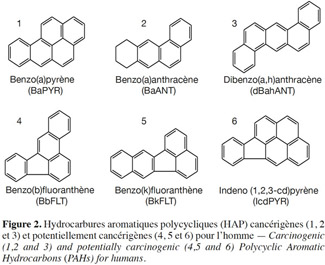
17Les propriétés toxicologiques sont très différentes selon les HAP. Trois HAP dont la toxicité est élevée (Figure 2) sont classés par le Centre international de recherche contre le cancer comme cancérigènes probables pour l’homme : il s'agit du benzo(a)pyrène, du benzo(a)anthracène et du dibenzo(a,h)anthracène. Trois autres sont classés comme cancérigènes possibles pour l’homme : benzo(b)fluoranthène, benzo(k)fluoranthène, indéno(c,d)pyrène. Le risque de cancer lié aux HAP est l’un des plus anciennement connus, depuis la description des cancers de la peau et du scrotum des ramoneurs dont l'exposition aux HAP se faisait par contact et par respiration de la suie des cheminées (Costes et al., 1997).
2.2. Techniques de traitement des sols pollués par les hydrocarbures
18En fonction de la persistance du polluant, très souvent due à une cinétique d'évolution très lente des mécanismes de dispersion ou de dégradation (Hermine, 2000), certaines techniques sont plus appropriées que d'autres. On distingue des procédés physico-chimiques et biologiques.
19Pour le traitement des sites pollués, il existe quatre grandes familles de traitement : les traitements in situ, où le sol est laissé sur place, le polluant étant soit extrait et traité en surface, soit dégradé dans le sol ou encore fixé dans le sol ; les traitements hors site, où on procède à l’excavation et à l’évacuation des terres ou des eaux polluées vers un centre de traitement adapté (incinérateur, centre d’enfouissement technique, centre de traitement des terres polluées, etc.) ; les traitements sur site où la terre ou les eaux polluées sont extraites et traitées sur le site même et le confinement où la terre ou les eaux sont laissées sur le site, les travaux consistant à empêcher la migration des polluants et limiter le risque (Bernheim, 1999).
20Les traitements hors site sont inapplicables aux mangroves. La bioremédiation est le procédé le mieux adapté pour le traitement des mangroves in situ ou sur site.
21La bioremédiation est l'utilisation d’organismes vivants, en particulier via les procédés microbiens, pour dégrader les polluants organiques (Baker et al., 1994b). Les micro-organismes sont depuis très longtemps utilisés dans le processus de transformation et de traitement des déchets (Edeline, 1993). Par exemple, l'épuration des eaux usées municipales est basée sur l'exploitation des micro-organismes à travers les systèmes contrôlés comme les stations d'épuration. Tous ces systèmes d'épuration des eaux usées (boues activées, biomasse fixée ou lit bactérien, etc.) dépendent de l'activité métabolique des micro-organismes (Edeline, 1993). La bioremédiation peut se résumer comme un procédé qui encourage les processus naturels de biodégradation visant à réduire ou éliminer les polluants (Prince, 1992). Le tableau 2 présente les différentes techniques pouvant être utilisées dans le traitement des sédiments de mangroves à partir des micro-organismes.

22La phytoremédiation est une technique in situ de bioremédiation des sites contaminés. Son principe est de mettre à profit les propriétés des plantes et les micro-organismes associés pour dépolluer des milieux (sols, eaux, etc.) contaminés par divers polluants (organiques et inorganiques). Elle utilise les capacités des plantes à extraire, transformer ou accumuler les éléments toxiques. Elle est particulièrement adaptée au traitement de larges superficies contaminées par des niveaux faibles de polluants (Ballerini, 1999). Des exemples d'expériences de phytoremédiation par la pollution diffuse ont été réalisées avec succès dans l'industrie d'assainissement (de-Bashan et al., 2011). L'inconvénient majeur de la phytoremédiation est qu'elle nécessite un engagement à long terme et de la patience. En effet, le procédé est dépendant de la croissance végétale, de la tolérance de la plante aux polluants et de sa capacité de bioaccumulation ; tous ces processus sont lents. Deux mécanismes d’action des plantes peuvent être appliqués aux mangroves polluées par les hydrocarbures : la phytotransformation et la rhizodégradation. Ces mécanismes vont dépendre de la quantité et de la qualité d’hydrocarbures présents dans les sédiments (ITOPF, 2013). La phytotransformation réduit la toxicité du polluant ou la rend non toxique ; elle transforme les molécules organiques complexes en composés plus simples ; elle absorbe et dégrade le polluant (Ballerini, 1999 ; de-Bashan et al., 2011). La rhizodégradation quant à elle augmente l'activité microbienne du sol et permet la dégradation du polluant par les bactéries de la rhizosphère (de-Bashan et al., 2011).
23Les plantes seules ont l'inconvénient d'être inefficaces et n'éliminent que de petites quantités de polluant. Pour obtenir une dégradation plus efficace de composés organiques, les plantes dépendent de l'association avec leurs micro-organismes spécifiques en plus des facteurs tels que la disponibilité d’accepteurs d’électrons, le pH du milieu, la température, la salinité, la disponibilité des nutriments (azote et phosphore) et la nature du polluant, sa concentration dans le milieu et son accessibilité (Ballerini, 1999 ; Tam et al., 2002 ; Chen et al., 2008 ; de-Bashan et al., 2012).
2.3. Cas particulier de la rhizosphère des mangroves
24Par définition, la rhizosphère est l'ensemble des microrégions du sol en contact avec les racines des plantes supérieures. De par sa teneur plus élevée en composés organiques qui sont à la fois des complexes enzymatiques et une source de carbone et d'énergie, elle favorise la croissance et l'activité des micro-organismes. L'atmosphère au niveau de la rhizosphère est généralement plus pauvre en O2 et plus riche en CO2 que celle du sol éloigné de cette région (Lynch et al., 1990).
25Bien que les écosystèmes de mangroves dépendent de bactéries pour recycler les nutriments, les bactéries à leur tour semblent bénéficier de leur association avec les arbres des mangroves. Elles colonisent la surface racinaire des palétuviers et induisent la production d'exsudats racinaires qui peuvent stimuler leur métabolisme (Lynch et al., 1990). En plus de la modification de certaines conditions physico-chimiques du sol (pH, salinité, etc.), les palétuviers peuvent également fournir aux bactéries de l'oxygène dont le transport est assuré par les racines aériennes. Toutes ces modifications influencent la prolifération de la population bactérienne dans la rhizosphère (Holguin et al., 2001 ; Lu et al., 2011 ; Moreira et al., 2011).
26Un certain nombre de souches microbiennes (bactéries et champignons) aptes à dégrader les hydrocarbures ont été isolées au niveau des sédiments des mangroves, aussi bien dans la rhizosphère que dans la zone non rhizosphérique. Plusieurs expériences de bioremédiation des sédiments pollués par les produits pétroliers réalisées dans des laboratoires en bioréacteurs (Liu et al., 2011) ou dans des microcosmes (Ke et al., 2005 ; Guo et al., 2005 ; Tam et al., 2008) ont montré qu'une élimination des hydrocarbures est possible à travers des techniques de bioaugmentation, biostimulation et atténuation naturelle. Cependant, au niveau de la rhizosphère des mangroves, d'autres composantes viennent renforcer le métabolisme bactérien à l'égard des polluants. La densité du système racinaire y est notamment très intense, ce qui entraine une activité bactérienne accrue (Lu et al., 2011). Outre la présence des exsudats racinaires, une abondante litière végétale pourrait améliorer la dégradation du polluant en fournissant plus de substrat aux bactéries. Enfin, la rhizosphère pourrait jouer un rôle de stabilisateur du polluant à travers des réactions de polymérisation telles que l'humification (Lee et al., 2008). Le gradient descendant de dégradation pour des polluants organiques dans les mangroves suit l'ordre suivant :
27– proximité de la rhizosphère ;
28– compartiment des racines ;
29– zone éloignée de la rhizosphère.
3. Mécanisme de dégradation des hydrocarbures par les bactéries
3.1. Voies de dégradation des alcanes et des HAP
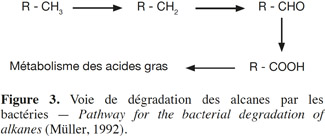
30Dégradation des alcanes. De nombreuses bactéries ayant la capacité de dégrader les alcanes ont été décrites dans la littérature (Müller, 1992 ; Baker et al., 1994a ; Molina-Barahona et al., 2004 ; Liu et al., 2008 ; Zhang et al., 2011, etc.). Cette dégradation commence par l'oxydation du groupe méthyle terminal. L'alcool formé est ensuite déshydrogéné via l'aldéhyde en l'acide carboxylique correspondant. Celui-ci est dégradé via la ß-oxydation (comme chez les acides gras). De manière générale, les alcanes à chaine courte sont plus vite dégradés que ceux à longue chaine et les alcanes à chaine ramifiée sont moins dégradables que les linéaires (Figure 3).
31Les HAP sont généralement biodégradables dans les sols (Lemière et al., 2008). Les molécules les plus légères peuvent être rapidement dégradées si le milieu est suffisamment aérobie (Hébrard-Labit et al., 2004).
32Dégradation des HAP
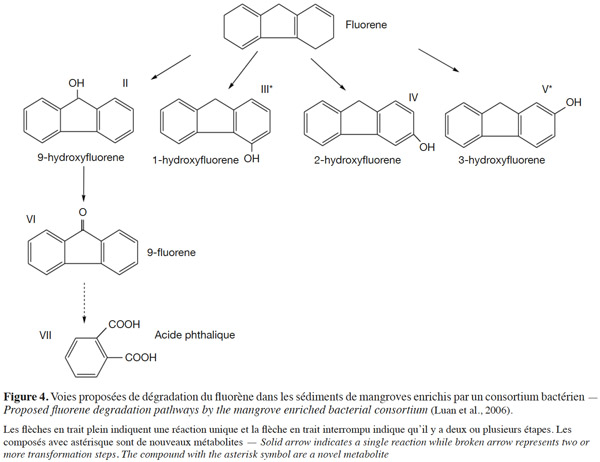
33Dégradation du fluorène. L'étude de la dégradation des HAP dans les mangroves propose plusieurs voies de dégradation de ces polluants par les bactéries. Ainsi, sur la base de l’identification des métabolites, deux voies possibles de dégradation du fluorène par un consortium bactérien sont proposées. Ces voies se caractérisent par une ou plusieurs réactions (représentées par les flèches en trait plein). On note, au cours de la dégradation du fluorène, la formation de nouveaux métabolites tels que le 1-hydroxyfluorène et le 3-hydroxyfluorène. La formation de l’acide phtalique en passant par le 9-hydroxyfluorène et le 9-fluorène à travers une ou plusieurs réactions marque la fin du processus de dégradation du fluorène (Figure 4).
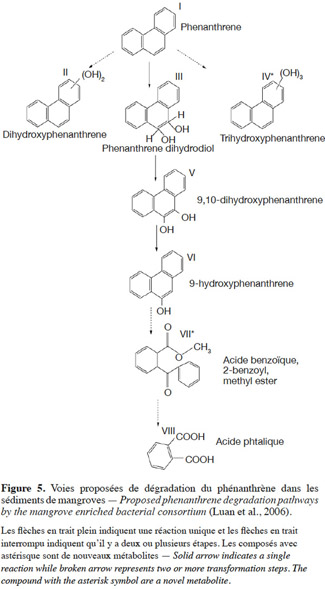
34Dégradation du phénanthrène. La dégradation du phénanthrène aboutit à l'acide phtalique en passant par une ou plusieurs réactions. Il apparait également de nouveaux métabolites comme l'acide benzoïque, le 2-benzoyl méthyle ester et le trihydroxyphénanthrène (Figure 5). Le phénanthrène peut être transformé par un consortium en mono-hydroxyle phénanthrène par la mono-oxygénase. La présence de trois groupes hydroxyles pourrait être due à des réactions enzymatiques par des systèmes combinés mono- et dioxygénase.
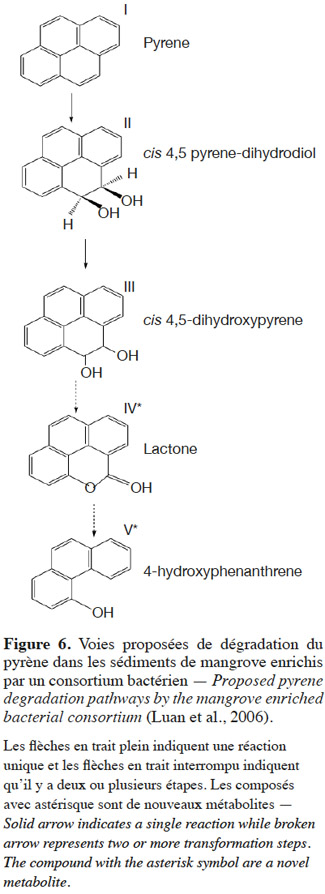
35Dégradation du pyrène. La dégradation du pyrène par un consortium bactérien composé de Rhodococcus sp., Acinetobacter sp. et Pseudomonas sp., fait apparaitre de nouveaux métabolites comme le lactone et le 4-hydroxyphénanthrène. Cette dégradation se passe en une ou plusieurs réactions (Figure 6).
3.2. Revue de différentes études de gestion de la pollution des mangroves
36Plusieurs études ont été menées à travers le monde visant à réduire ou à éliminer les hydrocarbures contenus dans les sols de mangroves. Les procédés de traitements biologiques sont les plus répandus du fait de la qualité du polluant à éliminer et des conditions particulières propres à ces zones. Dans le cas des mangroves précisément, l'intérêt de la biodégradation réside dans le fait qu'elle ne nécessite ni excavation, ni transport des terres, ce qui rend sa mise en œuvre bien moins couteuse, si on la compare aux techniques les plus répandues que sont les traitements thermiques et physico-chimiques. Ainsi, des résultats satisfaisants ont été obtenus dans plusieurs sites concernant l'élimination d'une large gamme d'hydrocarbures (Bidoia et al., 2010). Cependant, de nombreux composés ramifiés avec plusieurs atomes de carbone ne sont pas facilement métabolisés (Bidoia et al., 2010).
37Les sédiments de mangroves renferment une microflore abondante et diversifiée. L'étude sur la diversité de la microflore nous permet de comprendre les voies et moyens pour la protection et la conservation des mangroves. Cette microflore est composée en majorité de bactéries et de champignons. Selon Holguin et al. (2001), les bactéries et les champignons représentent 91 % de la biomasse microbienne totale des mangroves tropicales, alors que les algues et les protozoaires ne représentent que 7 % et 2 %, respectivement.
38La dégradation des hydrocarbures par les bactéries a été largement étudiée et de nombreuses souches microbiennes aptes à dégrader ces composés ont été isolées. On peut citer Pseudomonas, Vibrio, Achromonas, ainsi que des genres abondants dans les sols tels que Actinomyces, Corynebacterium, Mycobacterium et Nocardia (Pelmont, 2005).
39Plusieurs expériences avec différentes souches bactériennes ont été menées sur des sols de mangroves contaminés par les hydrocarbures et les résultats obtenus au cours des différents traitements sont l'expression de l'adaptation des micro-organismes aux différentes doses du polluant (Haritash et al., 2009). Les expériences sur la biodégradation des hydrocarbures dans les mangroves sont généralement effectuées dans des microcosmes in vitro. Les expériences in situ sont moins nombreuses (Brito et al., 2009).
40Brito et al. (2006) ont isolé et identifié un certain nombre de bactéries dégradant les HAP dans les mangroves. L'expérience réalisée a montré que les genres Marinobacter et Pseudomonas étaient capables de dégrader le fluoranthène et le pyrène, le genre Alcanivorax était capable de dégrader l'octane, le genre Microbulbifer le fluoranthène et le naphtalène, et le genre Sphingomonas le pristane.
41Tam et al. (2002) ont réalisé une expérience de dégradation du phénanthrène en laboratoire à partir d'un consortium bactérien isolé dans les sédiments des mangroves pollués par les hydrocarbures. Ce consortium a été utilisé comme inoculum dans les fioles contenant des sédiments de mangroves enrichis en phénanthrène (concentration 200 mg·l-1) comme seule source de carbone. Six jours après ce traitement, 78 % de phénanthrène était dégradé.
42En 2008, Tam et al. ont réalisé une expérience en serre dans un microcosme à partir d’échantillons de sédiments de mangroves. Le niveau de pollution de départ des échantillons était de 170 ng·g-1 de matière sèche (somme totale des 16 HAP prioritaires de l'US EPA). Après 154 jours de culture, 90 % du fluorène, 80 % du phénanthrène, 70 % du fluoranthène, 68 % du pyrène et 32 % du benzo(a)pyrène ont été dégradés par atténuation naturelle. Ces résultats démontrent que dans un environnement contrôlé, il est possible de dégrader de façon quasi complète les HAP dans les sédiments de mangroves. Il faut cependant noter que les résultats obtenus dans les microcosmes in vitro doivent être confirmés in situ en milieu naturel.
43Pour la dégradation de trois HAP (fluorène, phénanthrène et pyrène) contenus dans les sédiments de mangroves, Yu et al. (2005) ont utilisé un consortium bactérien enrichi, contenant trois espèces bactériennes Rhodococcus sp., Acinetobacter sp. et Pseudomonas sp. Les concentrations de départ des HAP (somme des 16 HAP prioritaires de l'US EPA) dans les sédiments variaient entre 1 162 et 3 322 ng·g-1 de matière sèche. Quatre semaines après le traitement, plus de 99 % du fluorène et du phénanthrène et seulement 30 % du pyrène ont été dégradés par atténuation naturelle. Plus de 97 % des trois HAP ont été dégradés par biostimulation avec ajout d'un amendement nutritif. Les pourcentages de dégradation par bioaugmentation étaient similaires à ceux de l'atténuation naturelle.
44Ramsay et al. (2000) ont mené une étude de bioremédiation sur une mangrove à Rhizophora en Australie. Cette étude a été réalisée sur 6 parcelles de terrain de 40 m2 dont trois parcelles mazoutées et trois autres parcelles non mazoutées considérées comme témoin. La méthode utilisée consistait à aérer activement les sédiments et ajouter un engrais afin de favoriser la biodégradation des hydrocarbures par les micro-organismes indigènes. Les sédiments de mangrove renfermaient 104 à 105 cellules·g-1 de sédiment. Le traitement réalisé sur les parcelles mazoutées a augmenté significativement le nombre de cellules de 105 à 108 cellules·g-1 de sédiment avec une augmentation des bactéries dégradant les aromatiques de 104 à 106 cellules·g-1 de sédiment.
45Moreira et al. (2011) ont réalisé une expérience qui met en évidence deux modèles de biodégradation : la phytoremédiation assistée avec des espèces de Rhizophora mangle et la bioremédiation seule afin de comparer le modèle le plus efficace dans la dégradation des hydrocarbures présents dans les sédiments des mangroves. Après 90 jours, les résultats obtenus présentaient un taux d'abattement du polluant de 87 % pour la phytoremédiation assistée et de 70 % pour la bioremédiation. Le dénombrement de la microflore totale a permis de constater une augmentation du nombre de bactéries passé de 2 x 105 à 2 x 107 CFU·g-1 au-delà de 30 jours où il y avait la présence des palétuviers. Au niveau de la bioremédiation, on a noté une légère augmentation de la microflore totale (de 2 x 105 à 1,8 x 106 CFU·g-1), ce qui démontre que la présence des plantes et les exsudats racinaires qui sont sécrétés au niveau de la rhizosphère offrent à la microflore des conditions favorables pour sa croissance (Espinosa et al., 2005) et stimulent la dégradation du polluant (Joner et al., 2005).
46La phytoremédiation assistée dans les sédiments de mangroves contaminés pourrait être un moyen efficace d'élimination ou de dégradation des hydrocarbures pétroliers. Ke et al. (2003) ont mis en évidence dans des microcosmes la dégradation du pyrène dans les sédiments de surface et de fond contaminés. La performance de deux espèces de mangroves Kandelia candel (L.) Druce et Bruguiera gymnorrhiza dans la dégradation du pyrène a également été étudiée. Pendant une période expérimentale de six mois, la croissance des plantes a été mesurée. Les résultats ont montré que cette croissance, aussi bien dans les sédiments de surface que de fond, est semblable. Par contre, elle est comparable à celles des plantes cultivées dans les microcosmes témoins où les sédiments ne contiennent pas le polluant. La concentration du pyrène dans les sédiments contaminés est passée de 3 µg·g-1 initialement à moins de 0,4 µg·g-1. Le taux d'élimination du pyrène dans les sédiments de surface et de fond se situe autour de 96,4 % et 93 %, respectivement, avec l'espèce K. candel. Ce taux est légèrement inférieur dans les microcosmes contenant B. gymnorrhiza. Par contre, le taux d'abattement du pyrène dans les microcosmes ne contenant pas les plantes a été de 89 %, comparable aux microcosmes contenant B. gymnorrhiza (86 %) et légèrement inférieur aux microcosmes contenant l'espèce K. candel (93 %).
47L’activité bactérienne est plus importante au niveau de la rhizosphère dans le modèle de la phytoremédiation assistée. Moreira et al. (2011) ont démontré dans les sédiments pollués des mangroves que la microflore passe de 2 x 105 à 2 x 107 CFU·g-1 au niveau de la rhizosphère. Les auteurs ont aussi montré que la croissance des plantes exposées au polluant est plus importante (46,3 cm de longueur) que celle des plantes cultivées dans les sédiments témoins (34,4 cm de longueur), ce qui suggère que les plantes et les bactéries en association développeraient contre le polluant des mécanismes pour leur survie.
48La rhizosphère joue un rôle efficace dans la dégradation des HAP dans les sols contaminés des mangroves. Lu et al. (2011) ont mené une expérience en serre pour évaluer le taux de dégradation du phénanthrène (10 mg·kg-1) et du pyrène (10 mg·kg-1) dans la rhizosphère de K. candel. Le système a été mis en place en utilisant des rhizoboxes laminaires divisés en huit compartiments séparés à différentes distances de la surface des racines. Après 60 jours de croissance des plantes, ils ont observé les taux d'abattement de 47,7 et 37,6 % respectivement pour le phénanthrène et pour le pyrène. L'intense activité microbienne qui se déroule au niveau de la rhizosphère a considérablement amélioré le taux de dégradation des contaminants. Il a été observé une plus grande dégradation à 3 mm de la zone des racines où 56,8 % de phénanthrène et 47,7 % de pyrène étaient dégradés.
4. Facteurs accélérant la biodégradation dans les mangroves
49De manière générale, l’action des micro-organismes sur les hydrocarbures et autres produits pétroliers est limitée par deux facteurs essentiels : la faible solubilité dans l'eau et les effets toxiques des hydrocarbures sur les cellules vivantes. Ainsi, les bactéries exposées au stress des produits pétroliers présentent des altérations dans leur structure membranaire, dues au caractère lipophile des hydrocarbures (Pelmont, 2005).
50Dans le cas particulier des mangroves, la salinité du milieu apparait comme l’élément le plus important qui influence le processus de biodégradation. En effet, dans les zones estuariennes, la salinité varie périodiquement suite aux balancements des marées, les apports d’eau douce des rivières et les rejets vers la terre. Ceci pourrait avoir pour conséquence la diminution du potentiel de biodégradation des bactéries ayant colonisé les sédiments des mangroves. Selon Spain et al., 19801, cités par Tam et al. (2002), la biodégradation dans un milieu estuarien est réduite par une augmentation de la salinité qui influe de façon négative sur la croissance bactérienne et la diversité des espèces. Tam et al. (2002), dans une étude sur la biodégradation du phénanthrène, ont démontré qu’une salinité élevée (35 ‰) inhibe la croissance bactérienne et diminue fortement la biodégradation de ce polluant. Chen et al. (2008) ont conclu également, dans une étude réalisée sur la cinétique de biodégradation des HAP sur les sédiments des mangroves, que la salinité a plus d’effets négatifs sur la biodégradation que la température ou même l’addition d’une solution nutritive. Une corrélation a été déterminée entre la salinité et le taux de minéralisation du phénanthrène et du naphtalène, démontrant que le taux de métabolisme des hydrocarbures dans les sédiments des estuaires diminue lorsque la salinité augmente (de 3,3 à 28,4 ‰) (Chen et al., 2008).
51En plus de la salinité, d’autres facteurs jouent également un rôle catalyseur sur la biodégradation des hydrocarbures en milieu marin. On peut citer notamment les facteurs géographiques et la concentration des matières en suspension. Kuznetsov et al. (2011) ont démontré la dépendance de la biodégradation aux facteurs géographiques du milieu tels que les conditions thermiques, la vitesse d’écoulement des eaux, la profondeur et le type de sédiments. Dans une étude comparative de la dynamique de transformation de la pollution par les hydrocarbures dans des conditions géographiques différentes en milieu aquatique, ces auteurs ont mis en évidence que le processus de dégradation naturelle du polluant n’est pas le même. La plus forte dégradation naturelle est observée au niveau des côtes rocheuses, des plages de sable et de graviers exposées à l’air libre, au rayonnement solaire, aux tempêtes et à l’action des vagues. Cette forte activité est également observée au niveau des secteurs avoisinants caractérisés par des sédiments grossiers, les flux rapides des eaux et une bonne saturation en oxygène. Au contraire, les zones marécageuses des côtes et les cours d’eau caractérisés par des vitesses lentes de circulation des eaux, l’accumulation de sédiments vaseux, une teneur en matières organiques élevée et un déficit en oxygène présentent les plus faibles taux de dégradation naturelle de la pollution par les hydrocarbures.
52La matière organique est également considérée comme un des facteurs les plus importants qui influent sur la biodégradation des HAP et les faibles concentrations en matières inorganiques dans le sol réduisent le nombre de bactéries capables de dégrader les HAP. En effet, deux ratios différents carbone/azote/phosphore sont recommandés pour la dégradation des HAP. Il s’agit du ratio C/N/P en masse molaire de l’ordre de 100/1,3/0,05. L’autre ratio C/N/P en masse molaire est basé sur des valeurs moyennes de la composition microbienne élémentaire et sur les extraits bruts cellulaires en général, qui est de l’ordre de 100/10/1 (Chen et al., 2008).
53À côté de ces facteurs, la maitrise d'autres paramètres, tels l'humidité du sol, le pH et la température, est nécessaire (Talaat Balba et al., 1991 ; Baker, 1994 ; Kuznetsov et al., 2013). La biodégradation va dépendre d'un approvisionnement adéquat en eau dans le sol. L'eau est nécessaire non seulement pour répondre aux exigences physiologiques des micro-organismes, mais aussi pour le transport des nutriments et des sous-produits métaboliques et l'apport de l'oxygène dans le sol (Kuznetsov et al., 2011). La biodégradation est généralement plus rapide lorsqu'elle se déroule à des valeurs de pH neutre (Baker, 1994). Certaines études ont d'ailleurs démontré que la minéralisation de certains polluants est plus lente dans les eaux souterraines et dans certains lacs où le pH est plus acide (pH 4,87). La température peut influencer soit directement, soit indirectement la biodégradation. C’est un facteur important dans la croissance et l'activité des micro-organismes. Elle favorise l'augmentation du niveau des réactions métaboliques. Selon une étude menée par Song et al. (1990) en appliquant différentes températures (17 °C, 27 °C et 37 °C), le taux d'abattement des hydrocarbures est maximum à 27 °C pour tous les polluants testés. S'il est bien établi que la température est un facteur important dans la croissance et l'activité des micro-organismes dans le processus de biodégradation des polluants organiques, certaines études ont démontré une inhibition presque complète de la biodégradation à 5 °C (Baker, 1994).
5. Conclusion
54Les écosystèmes de mangroves sont d'une importance capitale dans le monde. La spécificité de leur milieu et la richesse de leur diversité biologique (faune et flore) sont reconnues et font localement l'objet d'une protection par les organismes internationaux en charge de la sauvegarde des zones humides. La lutte contre toutes les formes de risques qui pourraient entrainer le dépérissement des mangroves doit se poursuivre. La pollution des mangroves par les hydrocarbures impacte négativement la chaine alimentaire jusqu'à l'homme. C'est ainsi que plusieurs études et recherches sont mises en œuvre pour éliminer les hydrocarbures dans les mangroves. L'accent est mis sur des procédés biologiques moins couteux et compatibles avec l'environnement pour assainir ces milieux. Les bactéries sont au centre de ces recherches. Les expériences de dégradation sont fonction du type d'hydrocarbure, de sa concentration et de sa localisation dans le milieu. Ces expériences, in vitro pour la majorité, sont basées sur les capacités dégradatives d'une souche spécifique de bactérie ou d'un consortium soit sur les sédiments, soit au niveau de la zone racinaire, soit encore dans leur association avec les palétuviers. Il serait intéressant d'une part de caractériser les micro-organismes indigènes exposés au stress des hydrocarbures dans les mangroves pour affiner les procédés biologiques in vitro mis en œuvre et, d'autre part, de mettre en place des essais sur site pour évaluer l'adaptation et la capacité des micro-organismes utilisés dans les expériences en milieu contrôlé à dégrader les hydrocarbures dans les mangroves.
Bibliographie
Aijiki K., 2000. Socio-economic study on the utilisation of mangrove forests in Southeast Asia. In: Proceedings of an International Workshop, Asia-Pacific cooperation on research for conservation of mangroves, 26-30 March 2000, Okinawa, Japan, UNU, Tokyo, 130-138.
Baker K.H., 1994. Bioremediation of surface and subsurface soils. In: Baker K.H. & Herson D.S., eds. Bioremediation. New York, USA: McGraw-Hill Inc., 203-259.
Baker K.H. & Herson D.S., 1994a. Microbiology and biodegradation. In: Baker K.H. & Herson D.S., eds. Bioremediation. New York, USA: McGraw-Hill Inc., 9-60.
Baker K.H. & Herson D.S., 1994b. Introduction and overview of bioremediation. In: Baker K.H. & Herson D.S., eds. Bioremediation. New York, USA: McGraw-Hill Inc., 1-7.
Ballerini D., 1999. Traitements biologiques des sols. Tech. Ing., G2-620, 1-2.
Bernheim Y., 1999. Typologie des techniques de réhabilitation des sites pollués. Tech. Ing, G2-600, 1-6.
Bidoia E.D., Montagnolli R.N. & Lopes P.R.M., 2010. Microbial biodegradation potential of hydrocarbons evaluated by colorimetric technique: a case study. In: Méndez Vila A., ed. Current research, technology and education topics in applied microbiology and microbial biotechnology. Badajoz, Spain: Formatex, 1277-1288.
Brito E.M.S. et al., 2006. Characterization of hydrocarbonoclastic bacterial communities from mangrove sediments in Guanabara Bay, Brazil. Res. Microbiol., 157, 752-762.
Brito E.M.S. et al., 2009. A case study of in situ oil contamination in a mangrove swamp (Rio De Janeiro, Brazil). Mar. Pollut. Bull., 58, 418-423.
Chen J., Wong M.H., Wong Y.S. & Tam N.F.Y., 2008. Multi-factors on biodegradation kinetics of polycyclic aromatic hydrocarbons (PAHs) by Sphingomonas sp. a bacterial strain isolated from mangrove sediment. Mar. Pollut. Bull., 57, 695-702.
Costes J.M. & Druelle V., 1997. Les hydrocarbures aromatiques polycycliques dans l’environnement : la réhabilitation des anciens sites industriels. Rev. Inst. Fr. Pet., 52(4), 425-440.
de-Bashan L.E., Schmid M., Hartmann A. & Bashan Y., 2011. Cell-cell interaction in the eukaryote-prokaryote model using the microalgae Chlorella vulgaris and the bacterium Azospirillum brasilense immobilized in polymer beads. J. Phycol., 47, 1350-1359.
de-Bashan L.E., Hernandez J.P. & Bashan Y., 2012. The potential contribution of plant growth-promoting bacteria to reduce environmental degradation – A comprehensive evaluation. Appl. Soil Ecol., 61, 171-189.
Defew L.H., Mair J.M. & Guzman H.M., 2005. An assessment of metal contamination in mangrove sediments and leaves from Punta Mala Bay, Pacific Panama. Mar. Pollut. Bull., 50, 547-552.
Dupuy B., Maître H.-F. & Amsallem I., 1999. Techniques de gestion des écosystèmes forestiers tropicaux : état de l'art. Rome : FAO Paper for the World Bank Forest Policy Implementation Review and Strategy Forestry Policy and Planning Division.
Edeline F., 1993. L'épuration biologique des eaux. Théorie et technologie des réacteurs. Liège, Belgique : CEBEDOC ; Paris : Lavoisier Tech et Doc, 299.
EPPR (Emergency Prevention, Preparedness and Response), 1998. Field guide for oil spill response in arctic waters 1998. Yellowknife, NT, Canada: Environment Canada.
Espinosa E., Martinez M.E., Torres E.F. & Rojas M.G., 2005. Improvement of the hydrocarbon phytoremediation rate by Cyperus laxus Lam. inoculated with a microbial consortium in a model system. Chemosphere, 59, 405-413.
FAO, 2007. The world's mangroves 1980-2005. A thematic study prepared in the framework on the Global Forest Resources Assessment 2005. Roma: FAO Forestry Paper 153, 89.
Gabet S., 2004. Remobilisation d'Hydrocarbures Aromatiques Polycycliques (HAP) présents dans les sols contaminés à l'aide d'un tensioactif d'origine biologique. Thèse de doctorat : Université de Limoges (France).
Guiral D. et al., 1999. Les écosystèmes à mangrove. In : Cormier Salem M.C., ed. Rivières du Sud, sociétés et mangroves ouest-africaines. Paris : IRD éditions, 63-117.
Guo C.L., Zhou H.W., Wong Y.S. & Tam N.F.Y., 2005. Isolation of PAH-degrading bacteria from mangrove sediments and their biodegradation potential. Mar. Pollut. Bull., 51, 1054-1061.
Haritash A.K. & Kaushik C.P., 2009. Biodegradation aspects of Polycyclic Aromatic Hydrocarbons (PAHs): a review. J. Hazard. Mater., 169, 1-15.
Hébrard-Labit C. & Meffray L., 2004. Comparaison de méthodes d'analyse des éléments traces métalliques (ETM) et des hydrocarbures aromatiques polycycliques (HAP) sur les sols et les végétaux. Lyon, France : Centre d'études sur les réseaux, les transports, l'urbanisme et les constructions publiques (CERTU), 121.
Hermine J.P., 2000. Sites pollués : contamination des sols et des nappes phréatiques. Tech. Ing., G2-500, 1-3.
Holguin G., Vazquez P. & Bashan Y., 2001. The role of sediment microorganisms in the productivity, conservation, and rehabilitation of mangrove ecosystems: an overview. Biol. Fertil. Soils, 33, 265-278.
IPIECA (International Petroleum Industry Environmental Conservation Association), 1993. Biological impacts of oil pollution: mangroves. London: IPIECA.
ITOPF (The International Tanker Owners Pollution Federation Limited), 2013. Effet de la pollution par les hydrocarbures sur l’environnement. Guide d’informations techniques 13. London: ITOPF.
Joner E.J., Corgie S., Amellal N. & Leyval C., 2005. Nutritional constraints to PAH degradation in a rhizosphere model. Soil Biol. Biochem., 34, 859-864.
Kathiresan K. & Bingham B.L., 2001. Biology of mangroves and mangrove ecosystems. Adv. Mar. Biol., 40, 81-251.
Ke L. et al., 2003. Removal of pyrene from contaminated sediments by mangrove microcosms. Chemosphere, 51, 25-34.
Ke L., Yu K.S.H., Wong Y.S. & Tam N.F.Y., 2005. Spatial and vertical distribution of polycyclic aromatic hydrocarbons (PAHs) in mangrove sediments. Sci. Total Environ., 340, 177-187.
Kuznetsov A.N., Fedorov Yu.A. & Fattal P., 2011. Regularities of oil spilled oil transformation in watercourses and coastal zone (results of long-term observations). In: Proceedings of the International Multidisciplinary Scientific GeoConference SGEM (Surveying Geology & Ecology Management), vol. 3, 579-586.
Kuznetsov A.N., Fedorov Y., Fattal P. & Zagranitchny K.A., 2013. Peculiarities of fuel oil natural transformation in the strait of kerch polluted in November 2007 in consequence of tanker accident. In: Proceedings of 13th International Multidisciplinary Scientific Geo-Conference on water resources, forest, marine and ocean ecosystems, June 16-22, 2013, Bulgaria, 839-846.
Lee S.H., Lee W.S., Lee C.H. & Kim J.G., 2008. Degradation of phenanthrene and pyrene in rhizosphere of grasses and legumes. J. Hazard. Mater., 153, 892-898.
Lemière B. et al., 2008. Guide sur le comportement des polluants dans les sols et les nappes. Document du BRGM 300 – Nouvelle édition. Orléans, France : Éditions BRGM.
Liu C.W. & Liu H.S., 2011. Rhodococcus erythropolis strain NTU-1 efficiently degrades and traps diesel and crude oil in batch and fed-batch bioreactors. Process Biochem., 46, 202-209.
Lu H. et al., 2011. Rhizodegradation gradients of phenanthrene and pyrene in sediment of mangrove (Kandelia candel (L.) Druce). J. Hazard. Mater., 196, 263-269.
Liu P.-W.G., Whang L.-M., Yang M.-C. & Cheng S.-S., 2008. Biodegradation of diesel-contaminated soil: a soil column study. J. Chin. Inst. Chem. Eng., 39, 419-428.
Luan T.G. et al., 2006. Study of metabolites from the degradation of polycyclic aromatic hydrocarbons (PAHs) by bacterial consortium enriched from mangrove sediments. Chemosphere, 65, 2289-2296.
Lynch J.M. & Whipps J.M., 1990. Substrate flow in the rhizosphere. Plant Soil, 129, 1-10.
MacFarlane G.R., Pulkownik A. & Burchett M.D., 2003. Accumulation and distribution of heavy metals in the grey mangrove, Avicennia marina (Forsk.) Vierh: biological indication potential. Environ. Pollut., 123, 139-151.
Marius C., 1977. Propositions pour une classification française des sols de mangroves tropicales. Cah. ORSTOM sér. Pédol., 15(1), 89-102.
Molina-Barahona L. et al., 2004. Diesel removal from contaminated soils by biostimulation and supplementation with crop residues. Appl. Soil Ecol., 27, 165-175.
Moreira I.T.A. et al., 2011. Phytoremediation using Rhizophora mangle L. in mangrove sediments contaminated by persistent total petrolum hydrocarbons (TPH's). Microchem. J., 29, 376-382.
Müller R., 1992. Bacterial degradation of xenobiotics. In: Fry J.C. et al., eds. Microbial control of pollution. Cambridge, UK: Cambridge University Press, 35-57.
Nyer E.K. & Skladany G.J., 1989. Relating the physical and chemical properties of petroleum hydrocarbons to soil and aquifer remediation. Ground Water Monit. Rev., Winter, 54-60.
OIBT, Conseil international des bois tropicaux, 2002. Gestion durable et conservation des écosystèmes forestiers de la mangrove. Plan d’action OIBT sur la mangrove. 32e session, 13-18 mai, Bali, Indonésie.
Pelmont J., 2005. Biodégradations et métabolismes, les bactéries pour les technologies de l'environnement. Collection Grenoble Sciences 798. Les Ulis, France : EDP Sciences.
Prince R.C., 1992. Bioremediation of oil spills, with particular reference to spill from the Exxon Valdez. In: Fry J.C. et al., eds. Microbial control of pollution. Cambridge, UK: Cambridge University Press, 19-34.
Ramos e Silva C.A., da Silva A.P. & de Oliveira S.R., 2006. Concentration, stock and transport rate of heavy metals in a tropical red mangrove, Natal, Brazil. Mar. Chem., 99, 2-11.
Ramsar, 2002. Résolution VIII.32. Conservation, gestion intégrée et utilisation durable des écosystèmes de mangroves et de leurs ressources. In : Actes de la 8e session de la Conférence des Parties, novembre 2002, Ramsar, Valence.
Ramsay M.A. et al., 2000. Effect of bioremediation on the microbial community in oiled mangrove sediments. Mar. Pollut. Bull., 41(12), 413-419.
Ray A.K., Tripathy S.C., Patra S. & Sarma V.V., 2006. Assessment of Godavari estuarine mangrove ecosystem through trace metal studies. Environ. Int., 32, 219-223.
Saenger P., 1998. Mangrove vegetation: an evolutionary perspective. Mar. Freshwater Res., 49(4), 277-286.
Saenger P., 2003. Mangrove ecology, sylviculture and conservation. Dordrecht, The Netherlands: Kluwer Academic Publishers.
Sathirathai S. & Barbier E.B., 2005. Valuing mangrove conservation in Southern Thailand. Contemp. Econ. Policy, 19(2), 109-122.
Song H.G., Wang X. & Bartha R., 1990. Bioremediation potential of terrestrial fuel spills. Appl. Environ. Microbiol., 56, 652-656.
Talaat Balba M. & Bewley R.J.F., 1991. Organic contaminants and microorganisms. In: Jones K.C., ed. Organic contaminants in the environment: environmental pathways and effects. Environmental Management series. Cambridge, UK: Cambridge University Press, 237-274.
Tam N.F.Y., Guo C.L., Yau W.Y. & Wong Y.S., 2002. Preliminary study on biodegradation of phenanthrene by bacteria isolated from mangrove sediments in Hong-Kong. Mar. Pollut. Bull., 42, 316-324.
Tam N.F.Y. & Wong Y.S., 2008. Effectiveness of bacterial inoculum and mangrove plants on remediation of sediment contaminated with polycyclic aromatic hydrocarbons. Mar. Pollut. Bull., 57, 716-726.
Tanaka N. et al., 2007. Coastal vegetation structures and their functions in tsunami protection: experience of the recent Indian Ocean tsunami. Landscape Ecol. Eng., 3(1), 33-45.
Valiela I., Bowen J.L. & York J.K., 2001. Mangrove forests: one of the world's threatened major tropical environments. BioScience, 51(10), 807-815.
Yu S.H., Ke L., Wong Y.S. & Tam N.F.Y., 2005. Degradation of polycyclic aromatic hydrocarbons (PAHS) by a bacterial consortium enriched from mangrove sediments. Environ. Int., 31, 149-154.
Zhang Z. et al., 2011. Degradation of n-alkanes and polycyclic aromatic hydrocarbons in petroleum by a newly isolated Pseudomonas aeruginosa DQ8. Bioresour. Technol., 102, 4111-4116.
Notes
1 Spain J.C., Pritchard P.H. & Bourquin A.W., 1980. Effect of adaptation on biodegradation rates in sediment/water cores from estuarine and freshwater environments. Appl. Environ. Microbiol., 40, 726-734.






