- Portada
- Volume 18 (2014)
- numéro 4
- Les porcheries : réservoirs des Culicoides (Diptera : Ceratopogonidae), vecteurs des virus de la Maladie de la Langue bleue et de Schmallenberg ?
Vista(s): 0 (0 ULiège)
Descargar(s): 0 (0 ULiège)
Les porcheries : réservoirs des Culicoides (Diptera : Ceratopogonidae), vecteurs des virus de la Maladie de la Langue bleue et de Schmallenberg ?

Notes de la rédaction
Reçu le 28 décembre 2013, accepté le 1 juillet 2014
Résumé
La fièvre catarrhale ovine (FCO) est une arbovirose qui affecte les ruminants domestiques et sauvages. Depuis sa récente apparition en Europe du Nord, cette épizootie virale a engendré des pertes économiques considérables. Les vecteurs biologiques du virus de la FCO sont des moucherons piqueurs appartenant au genre Culicoides (Diptera : Ceratopogonidae). Plusieurs campagnes de piégeage lumineux de ces moucherons adultes ont été réalisées précédemment en Belgique au sein d’exploitations bovines et ovines, mais aucune à l’intérieur des exploitations porcines. Cette étude vise donc à évaluer, au moyen de pièges lumineux, les populations de culicoïdes éventuellement présentes à l’intérieur de deux porcheries belges au cours de l’automne et de l’hiver 2008. La présence des espèces (potentiellement) vectrices du genre Culicoides a ainsi été mise en évidence à l’intérieur de ces bâtiments durant l’automne : 8 et 749 spécimens appartenant à 2 et 7 espèces ont ainsi respectivement été piégés au sein des porcheries, avec une majorité de femelles du complexe Obsoletus. L’ouverture des bâtiments semble fortement influencer leur présence. L’observation du statut alimentaire des femelles laisse supposer que ces moucherons sont susceptibles de se nourrir ou de pondre au sein des porcheries, même si le sang de porc n’a pas pu être identifié dans l’abdomen des femelles gorgées et que le lisier n’a pas révélé la présence de larves. Les porcs pourraient ainsi intervenir dans le maintien des populations d’espèces potentiellement vectrices du virus de la FCO, ou du nouveau virus dénommé virus Schmallenberg.
Abstract
Pig farms: reservoirs of vectors of Bluetongue and Schmallenberg viruses? Bluetongue (BT) is a vector-borne disease that affects domestic and wild ruminants. Since its recent outbreak in northern Europe, this viral disease has caused considerable economic losses. The biological vectors of the bluetongue virus are biting midges belonging to the genus Culicoides (Diptera: Ceratopogonidae). Several light trapping campaigns targeting these adult midges have been previously conducted in Belgium within cattle and sheep farms, but none have been performed inside pig farms. This study therefore aims to assess, using light traps, the levels of Culicoides populations that may have been present inside two Belgian pig farms during the fall and winter of 2008. The presence of (potential) Culicoides vector species was demonstrated inside the pig buildings during the fall: 8 and 749 specimens belonging to 2 and 7 species were respectively trapped inside the pigsties, with the majority being Obsoletus complex females. The opening up of the buildings seemed to strongly influence their presence. Observation of the females’ nutritional status suggests that these midges were likely to have fed or to have laid eggs inside the pig farms, despite the fact that pig’s blood could not be identified in the abdomen of engorged females and that pig manure did not reveal the presence of larvae. Pigs could thus be involved in the maintenance of potential vector species populations of the BT virus, or of the new Schmallenberg virus.
Tabla de contenidos
1. Introduction
1La fièvre catarrhale ovine (FCO) – également dénommée Maladie de la Langue bleue – est une maladie virale vectorielle, dont le sérotype 8 est apparu en Europe du Nord en aout 2006 (Thiry et al., 2006) ; cette maladie s’est alors propagée à travers l’Europe (Saegerman et al., 2008). Cette arbovirose non contagieuse affecte les ruminants domestiques (élevages bovin, ovin et caprin) et/ou sauvages (Ruiz-Fons et al., 2014), en entrainant des pertes économiques directes (pertes de production, mortalités, infertilité, mortinatalités, retards d’abattage, avortements, anomalies fœtales, etc.) et indirectes (restrictions de transport d’animaux vivants, de leur sperme et de quelques autres produits) considérables (Saegerman et al., 2008 ; Velthuis et al., 2010). Le cout des mesures de prévention et de contrôle devrait aussi être pris en compte (Sperlova et al., 2011). La production porcine ne semble par conséquent pas visée par cette épizootie. Toutefois, Huang et al. (2003) ont suggéré que les porcs pourraient jouer un rôle important dans le cycle d’infection du virus Akabane, un autre virus des herbivores (ruminants) (Cybinski et al., 1978) appartenant au sérogroupe Simbu.
2Les vecteurs biologiques du virus de la FCO – et d’autres agents pathogènes – sont des moucherons piqueurs hématophages appartenant à la famille des Ceratopogonidae, genre Culicoides Latreille 1809 (Du Toit, 1944). Ces moucherons, dont environ 1 400 espèces sont actuellement décrites à travers le monde (Borkent, 2014), ont une taille comprise entre 1 et 4 mm. Seule une trentaine d’espèces de ces moucherons principalement crépusculaires à nocturnes est cependant impliquée dans la transmission de ce virus (Mellor, 1990 ; Mellor et al., 2000 ; Caracappa et al., 2003 ; Meiswinkel et al., 2004 ; Mehlhorn et al., 2007 ; Meiswinkel et al., 2007 ; Balenghien et al., 2008 ; Carpenter et al., 2008a ; Dijkstra et al., 2008 ; Hoffmann et al., 2009 ; Vanbinst et al., 2009). Certaines espèces de culicoïdes – notamment Culicoides impunctatus Goetghebuer 1920 – constituent aussi une source de nuisance pour l’homme, suite au désagrément causé par les piqûres des moucherons femelles (Hendry et al., 1988). Leur présence peut par conséquent gêner l’essor économique de certaines régions, en entravant les activités agricoles et forestières ainsi que le développement du tourisme (Hendry et al., 1988). Depuis le déclenchement de cette épizootie, plusieurs campagnes de piégeage lumineux de ces moucherons piqueurs ont été réalisées précédemment en Europe du Nord, mais principalement au sein d’exploitations bovine et ovine ; c’est notamment le cas pour la Belgique (Losson et al., 2007 ; Zimmer et al., 2008b ; Zimmer et al., 2009 ; Rigot et al., 2013 ; Zimmer et al., 2013d), dont le programme de surveillance entomologique entrepris entre 2007 et 2012 par l’Agence Fédérale pour la Sécurité de la Chaîne Alimentaire (AFSCA). Les exploitations porcines belges n’ont, quant à elles, jamais fait l’objet d’un suivi des populations de culicoïdes. Nous avons donc entrepris d’évaluer leur présence à l’intérieur de deux porcheries, les porcs étant susceptibles de participer au maintien des populations de ces moucherons.
2. Matériel et méthodes
2.1. Sites d’étude
3Cette étude a été réalisée entre la fin du mois de septembre 2008 et la fin du mois de janvier 2009, au sein de deux exploitations porcines belges. La première exploitation, d’une capacité totale d’environ 2 000 porcs, est située à Perwez (50°38' N ; 4°48' E), en province de Namur. Cette exploitation porcine sur fosse est constituée de trois bâtiments : le premier abrite une maternité de 48 truies et une batterie de 160 truies gestantes, le second accueille deux batteries de sevrage pour un total de 400 porcelets et le dernier est destiné à l’engraissement avec une capacité de 1 350 porcs. Le piégeage d’insectes est entrepris dans une des deux batteries de sevrage, dont l’âge des porcelets varie de 4 à 11 semaines. La température est contrôlée par une régulation thermostatique de la ventilation ; l’hygrométrie n’est pas contrôlée. Aucune fenêtre n’est présente au sein du local où s’effectue le piégeage, mais la clarté est assurée par l’aération située au plafond. Signalons que l’exploitant possède également une vingtaine de bovins situés dans un bâtiment voisin.
4La seconde exploitation, d’une capacité totale de près de 1 500 porcs, se situe à Blégny (50°40' N ; 5°43' E), en province de Liège. Cette exploitation exclusivement porcine de type hors sol est constituée d’un grand bâtiment subdivisé en différents locaux : deux locaux destinés à la gestation accueillant respectivement 120 (60 en logettes individuelles et 60 réparties par groupes) et 200 truies (en logettes individuelles), un local servant de maternité susceptible d’accueillir une centaine de bêtes et quatre locaux destinés au post-sevrage, avec une capacité de 270 porcelets chacun. Le piégeage d’insectes est mené dans le local contenant les 200 truies en gestation, âgées de 1 à 6 ans. Une régulation thermostatique de la ventilation maintient la température constante au sein de l’exploitation et un système « cooling » contrôle l’hygrométrie en été. La présence de fenêtres assure la luminosité naturelle et participe à la ventilation des pièces d’élevage. Notons la présence d’une quarantaine de vaches Blanc Bleu Belge et de deux chevaux dans les prairies avoisinant la porcherie.
2.2. Piégeages lumineux
5Les moucherons piqueurs du genre Culicoides ont été capturés à l’aide de pièges lumineux de type « OVI » (Onderstepoort Veterinary Institute) munis d’un tube ultraviolet d’une puissance de 8 W, d’un filet présentant des mailles de 5 x 5 mm permettant exclusivement le passage des insectes de petites dimensions et d’une hélice en mouvement qui les dirige dans un flacon collecteur contenant environ 300 ml d’un mélange d’eau et de détergent. Ces pièges sont alimentés par des batteries de 12 V et suspendus de façon à placer le flacon collecteur à environ 1,5 m de hauteur. Les piégeages sont réalisés une fois par semaine durant 48 h, du 23 septembre 2008 au 27 janvier 2009, directement à l’intérieur des bâtiments d’élevage porcin, soit 19 piégeages pour chaque site d’étude, à proximité immédiate des porcs. Un thermomètre numérique est fixé sur chaque piège afin de connaitre les températures minimales et maximales atteintes durant le piégeage. Ce dernier est réalisé simultanément pour les deux exploitations porcines retenues.
2.3. Traitement des échantillons
6Les échantillons collectés par les piégeages lumineux sont tout d’abord filtrés et placés dans une solution d’alcool à 80 %. De retour au laboratoire, ces derniers sont triés sous loupe binoculaire (grossissement de 10× à 40×) afin d’extraire les individus du genre Culicoides, sur base des taches de leurs ailes et de leur morphologie générale. Ceux-ci sont alors sexés, dénombrés et identifiés sous loupe binoculaire – voire sous microscope (grossissement de 100× à 400×) après un montage entre lame et lamelle si nécessaire – jusqu’à l’espèce sur base morphologique, en utilisant la clé de détermination de Delécolle (1985). Les femelles des espèces Culicoides obsoletus (Meigen 1818) et Culicoides scoticus Downes & Kettle 1952 étant morphologiquement difficiles à différencier, elles sont réunies au sein du complexe Obsoletus. L’observation de la pigmentation abdominale des femelles (Dyce, 1969) permet finalement la détermination de leur statut physiologique, en tenant compte de la recommandation d’Harrup et al. (2013) préconisant l’utilisation des termes « non pigmenté » et « pigmenté » au lieu de « nullipare » et « pare ». On distingue ainsi les femelles présentant un abdomen vide non pigmenté ou pigmenté, celles qui se sont récemment nourries et dont l’abdomen est de ce fait gorgé de sang (abdomen rouge et enflé) et enfin les femelles gravides (abdomen présentant des œufs). Signalons que certains spécimens peuvent également être parasités par un nématode ou endommagés.
2.4. Analyses supplémentaires
7Des prélèvements sanguins ont été réalisés le 28 octobre 2008 sur cinq truies de l’exploitation de Blégny. Ces prélèvements de sang ont ensuite été testés par RT-qPCR et cELISA, respectivement pour la détection du virus de la FCO et des anticorps associés, selon la méthodologie décrite par Zanella et al. (2013).
8Un échantillon de lisier a finalement été prélevé le 14 janvier 2009 au sein de l’exploitation de Blégny, ramené au laboratoire et soumis à une technique d’incubation à 24 °C adaptée de Kremer (1965), permettant ainsi le développement des éventuelles larves jusqu’au stade adulte.
3. Résultats et discussion
9L’exploitation de Perwez dénote un très faible nombre de culicoïdes, exclusivement capturés entre le 23 septembre et le 6 octobre 2008 : 7 spécimens femelles appartenant au complexe Obsoletus et 1 individu de l’espèce Culicoides punctatus (Meigen 1804). L’exploitation de Blégny est quant à elle caractérisée par des captures bien plus importantes entre le 23 septembre et le 5 novembre 2008 : 749 spécimens appartenant à 7 espèces (Tableau 1). Après cette date et jusqu’à la fin de l’étude (27 janvier 2009), plus aucun culicoïde n’a été capturé à l’intérieur de cette exploitation. Les captures diminuent en effet à partir du 21 octobre pour être nulles après le 5 novembre 2008, date à laquelle les températures extérieures extrêmes étaient comprises entre 5 °C et 16 °C. Rappelons que Losson et al. (2007) avaient quant à eux enregistré quelques captures de culicoïdes durant l’hiver 2006-2007 au sein d’une étable bovine belge, pour des températures minimales comprises entre 6 °C et 12 °C. Des études ultérieures ont confirmé le piégeage d’espèces paléarctiques du genre Culicoides à des températures minimales similaires, voire légèrement plus faibles (Baldet et al., 2008 ; Venail et al., 2012). Les températures extrêmes enregistrées durant l’étude à l’intérieur des porcheries sont comprises entre 17,5 °C et 23,0 °C pour l’exploitation de Blégny et entre 15,1 °C et 28,4 °C pour celle de Perwez ; la température semble donc plus stable au sein de la porcherie de Blégny. Les températures moyennes relevées au sein des locaux soumis au piégeage sont proches pour les deux exploitations, de même que la taille du cheptel. L’âge des porcs occupant ces locaux est cependant très différent, puisqu’il varie de quelques semaines à peine pour Perwez à quelques années pour Blégny. L’importante différence de capture observée entre ces deux exploitations porcines est toutefois sans doute principalement liée à l’ouverture des bâtiments. Les fenêtres battantes participant à l’éclairage naturel et à la ventilation des truies gestantes de Blégny permettent en effet aux Culicoides – et autres moucherons – de pénétrer plus aisément dans la porcherie. Barnard (1997) a de fait observé que l’entrée de moucherons du genre Culicoides dans les écuries semble liée à la taille de l’entrée du bâtiment. L’importance de l’ouverture des bâtiments d’élevage sur l’entrée des culicoïdes a également été soulignée par Meiswinkel et al. (2000), Baldet et al. (2008) ainsi que Baylis et al. (2010).
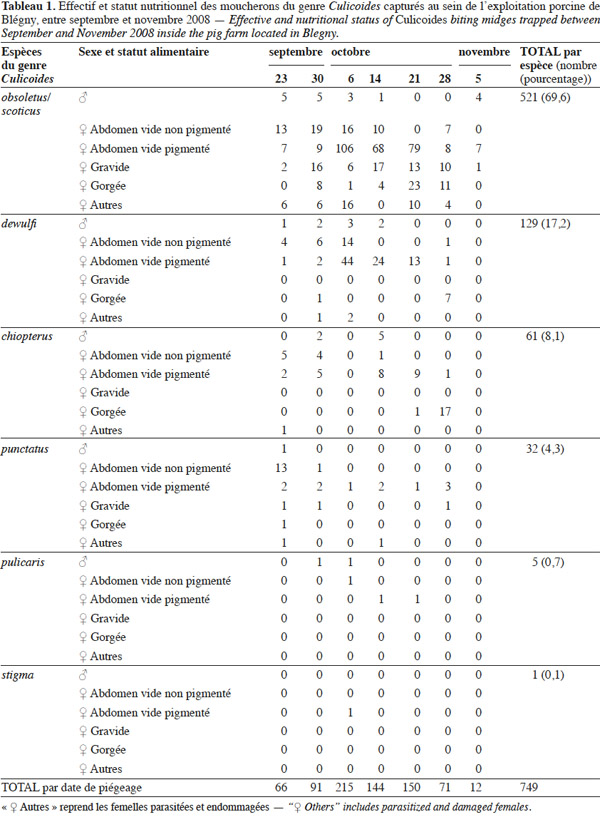
10L’identification des culicoïdes capturés à Blégny montre que les espèces reconnues comme étant (potentiellement) vectrices du virus de la FCO en Belgique – en particulier C. obsoletus, C. scoticus, Culicoides dewulfi (Goetghebuer 1936) et Culicoides chiopterus (Meigen 1830) (Mellor et al., 2000 ; Mehlhorn et al., 2007 ; Meiswinkel et al., 2007 ; Balenghien et al., 2008 ; Carpenter et al., 2008a ; Dijkstra et al., 2008 ; De Regge et al., 2012) – sont fortement majoritaires ; elles représentent en effet 94,9 % des culicoïdes piégés dans la porcherie de Blégny. Les deux espèces formant le complexe Obsoletus dominent largement puisqu’elles correspondent à elles seules à 69,6 % des captures réalisées. L’importance de ce complexe est mise en évidence par la plupart des études entreprises au niveau d’exploitations agricoles d’Europe du Nord (Baldet et al., 2008 ; Meiswinkel et al., 2008 ; Takken et al., 2008 ; Zimmer et al., 2008b ; Clausen et al., 2009 ; Mehlhorn et al., 2009 ; Zimmer et al., 2009 ; Baylis et al., 2010 ; Venail et al., 2012 ; Zimmer et al., 2013d). Précisons que les mâles de ce complexe Obsoletus sont majoritairement constitués de l’espèce C. obsoletus (88,9 %). L’espèce C. dewulfi correspond à 17,2 % des captures menées dans la porcherie de Blégny et est, de ce fait, mieux représentée que pour les piégeages lumineux effectués dans la plupart des exploitations bovines et ovines d’Europe du Nord (Baldet et al., 2008 ; Takken et al., 2008 ; Zimmer et al., 2009 ; Baylis et al., 2010 ; Venail et al., 2012 ; Zimmer et al., 2013d). Les espèces C. chiopterus et C. punctatus représentent quant à elles respectivement 8,1 % et 4,3 % du total des captures. Notons que le nombre de spécimens de l’espèce C. chiopterus capturé par piégeage lumineux est probablement sous-estimé, comme suggéré par Carpenter et al. (2008b). Précisons également que C. punctatus, vecteur possible du virus Schmallenberg (Larska et al., 2013), est généralement peu présent (< 1 %) – voire absent – dans la plupart des piégeages entrepris à l’intérieur de bâtiments d’élevage d’Europe du Nord (Baldet et al., 2008 ; Zimmer et al., 2008b ; Zimmer et al., 2009 ; Zimmer et al., 2013d). De très faibles effectifs de Culicoides pulicaris (L. 1758) (0,7 %) et Culicoides stigma (Meigen 1818) (0,1 %) complètent la diversité spécifique observée au sein de la porcherie de Blégny. Remarquons l’absence de l’espèce C. impunctatus – vecteur potentiel du virus de la FCO (Jennings et al., 1988) et d’autres pathogènes (Valkiunas et al., 2004) – commune voire très abondante au sein des tourbières (Goetghebuer, 1952 ; Takken et al., 2008 ; Zimmer et al., 2013b) mais peu représentée – voire absente – dans les exploitations agricoles (Losson et al., 2007 ; Baldet et al., 2008 ; Meiswinkel et al., 2008 ; Takken et al., 2008 ; Zimmer et al., 2008b ; Zimmer et al., 2009 ; Baylis et al., 2010 ; Venail et al., 2012 ; Zimmer et al., 2013d).
11Les femelles représentent 95,2 % des culicoïdes piégés dans la porcherie de Blégny. Cela pourrait s’expliquer par une moindre attraction des mâles pour la lumière ou par la différence de régime alimentaire, hématophage pour les femelles et floricole pour les mâles (Goetghebuer, 1952 ; Rieb, 1982). Ces derniers ne seraient par conséquent pas attirés par des hôtes potentiels et se retrouveraient, de ce fait, en faible nombre dans les bâtiments d’élevage. La plupart des études ayant recours à un piégeage lumineux entrepris à proximité immédiate du bétail affichent également une large prépondérance des femelles (Baldet et al., 2008 ; Zimmer et al., 2008b ; Bartsch et al., 2009 ; Zimmer et al., 2009 ; Baylis et al., 2010 ; Zimmer et al., 2013d).
12Finalement, l’observation du statut physiologique des femelles capturées à Blégny met en évidence 60,0 % de femelles présentant un abdomen vide et pigmenté, 16,9 % de femelles caractérisées par un abdomen vide et non pigmenté, 10,9 % de femelles dont l’abdomen est gorgé de sang (C. obsoletus/C. scoticus, C. chiopterus, C. dewulfi et C. punctatus) et 10,0 % de femelles gravides (C. obsoletus/C. scoticus et C. punctatus). Rappelons toutefois que le nombre réel de femelles nouvellement émergées est probablement sous-estimé (Harrup et al., 2013). Pour les quatre espèces les plus abondantes, on observe une succession temporelle des statuts physiologiques durant la période d’étude : les femelles dont l’abdomen est vide et non pigmenté semblent en effet majoritaires fin septembre, celles dont l’abdomen est vide et pigmenté début octobre, et celles dont l’abdomen est gorgé de sang fin octobre. La proportion assez élevée de femelles gorgées de sang laisse supposer que les femelles de certaines espèces de culicoïdes – principalement C. chiopterus, C. obsoletus/C. scoticus et C. dewulfi – étaient particulièrement actives au cours de la période d’étude et pourraient entrer dans les porcheries pour se nourrir. L’activité et la possibilité de se nourrir à l’intérieur des bâtiments d’élevage ont de fait déjà été mises en évidence pour certaines espèces des régions tempérées, telle que C. obsoletus (Baldet et al., 2008 ; Viennet et al., 2012), même si le comportement exophile de cette espèce semble être signalé par plusieurs auteurs (Anderson et al., 1993 ; Meiswinkel et al., 2008). Même si les bovins semblent être les hôtes privilégiés par de nombreuses espèces paléarctiques du genre Culicoides (Bartsch et al., 2009 ; Ninio et al., 2011), ces derniers sont susceptibles de réaliser leur repas sanguin sur une large gamme d’hôtes (Mellor et al., 2000) ; du sang de porc a ainsi déjà été identifié dans l’abdomen de femelles gorgées (Bartsch et al., 2009 ; Ninio et al., 2011). Malgré certaines préférences trophiques, la plupart de ces moucherons piqueurs peuvent en effet avoir un comportement alimentaire opportuniste (Garros et al., 2011).
13L’identification du sang présent dans l’abdomen des culicoïdes piégés au cours de cette étude a été entreprise selon la méthode décrite par Bartsch et al. (2009) et Lassen et al. (2011), pour la détection de trois espèces animales : vache, mouton et porc. Cette identification n’a cependant malheureusement pas permis de préciser l’origine des repas sanguins, probablement suite à une conservation prolongée des insectes dans la solution alcoolique. Notons finalement que sur l’ensemble des culicoïdes piégés à Blégny, seules 15 femelles appartenant au complexe Obsoletus étaient parasitées (par des nématodes).
14Les tests virologiques et sérologiques effectués sur les prélèvements de sang de truies se sont tous deux révélés négatifs. L’échantillon de lisier incubé au laboratoire visait à vérifier l’hypothèse de la présence de substrats propices au développement des larves de culicoïdes à l’intérieur d’une exploitation porcine, comme cela a été démontré pour le complexe Obsoletus à l’intérieur (bouses et litière usagée collées aux murs) et à proximité immédiate (résidus d’ensilage) d’étables bovines belges (Zimmer et al., 2008a ; Zimmer et al., 2010 ; Zimmer et al., 2013a ; Zimmer et al., 2013c ; Zimmer et al., 2014a ; Zimmer et al., 2014b). Plus de 10 % des culicoïdes femelles piégés dans la porcherie de Blégny étaient en effet gravides et, de ce fait, susceptibles de rester ou de pénétrer dans les bâtiments d’élevage pour y pondre. Aucun moucheron du genre Culicoides n’a cependant émergé de cet échantillon.
4. Conclusions
15Les vecteurs biologiques (potentiels) du virus de la FCO en Belgique sont également présents au niveau des bâtiments d’élevage porcin ; leur présence semble liée à la ventilation et à l’ouverture des bâtiments. Malgré l’absence de risque pour la production porcine vis-à-vis de ces deux maladies touchant les ruminants, les porcs sont susceptibles de participer au maintien des populations de moucherons vecteurs. Même si l’origine du sang présent dans l’abdomen des culicoïdes gorgés n’a pu être identifiée dans le cadre de cette étude, les porcs pourraient en effet procurer à certaines espèces de culicoïdes le repas sanguin nécessaire à leur survie et à leur ponte. L’absence d’émergence de culicoïdes dans le prélèvement de lisier réalisé au cours de cette étude n’exclut pas le fait que l’élevage porcin puisse également fort probablement fournir des gites larvaires propices au développement de ces moucherons piqueurs. La mise en évidence et la caractérisation des substrats favorables au développement larvaire des principales espèces de culicoïdes permettraient leur traitement éventuel (compostage, acidification, etc.), mais surtout de formuler des recommandations pratiques pour limiter la création de nouveaux gites ou de développer des méthodes de contrôle efficaces. Ces mesures, couplées à l’amélioration de l’étanchéité des bâtiments (Shaw et al., 2013) et/ou à la mise en place de mesures de protection anti-intrusion au sein des bâtiments d’élevage, permettraient de limiter les populations de culicoïdes adultes présentes à proximité ou à l’intérieur des exploitations agricoles ; cela limiterait le risque de transmission d’agents pathogènes et participerait ainsi à la protection du cheptel. Cette protection est d’autant plus importante qu’un nouveau virus animal également véhiculé par les culicoïdes et appartenant au sérogroupe Simbu a été identifié en Europe du Nord fin 2011 (De Regge et al., 2012 ; Hoffmann et al., 2012 ; Rasmussen et al., 2012 ; Steukers et al., 2012 ; Veronesi et al., 2013) ; ce virus, qui semble étroitement lié au virus Akabane, est dénommé virus Schmallenberg. Les culicoïdes – ou d’autres diptères piqueurs – pourraient de plus dans le futur acquérir la capacité de transmettre d’autres virus ou parasites dommageables envers l’élevage porcin (Haubruge et al., 2008). L’étude des vecteurs d’agents pathogènes responsables de maladies sévissant actuellement accélérera le temps de réaction en cas d’apparition de nouvelles épizooties affectant, par exemple, la production porcine.
16Remerciements
17Nos remerciements s’adressent à Grégory Simonon (Entomologie fonctionnelle et évolutive, Gembloux Agro-Bio Tech, Université de Liège) pour son implication dans le relevé des pièges et sa contribution à l’identification des culicoïdes, ainsi qu’à Sophie Vandermoten et Nicolas Poncelet (Entomologie fonctionnelle et évolutive, Gembloux Agro-Bio Tech, Université de Liège) pour leurs tentatives d’identification du sang présent dans l’abdomen des culicoïdes. Les auteurs remercient également les agriculteurs et éleveurs ayant accepté de participer à cette étude.
Bibliographie
Anderson G.S., Belton P. & Belton E.M., 1993. A population study of Culicoides obsoletus Meigen (Diptera: Ceratopogonidae), and other Culicoides species in the Fraser Valley of British Colombia. Can. Entomol., 125, 439-447.
Baldet T. et al., 2008. Indoor activity of Culicoides associated with livestock in the bluetongue virus (BTV) affected region of northern France during autumn 2006. Prev. Vet. Med., 87, 84-97.
Balenghien T. et al., 2008. Culicoides chiopterus: confirmation of its status as potential vector of bluetongue virus in Europe, http://www.promedmail.org, archive number 20080403.1222, (12/12/08).
Barnard B.J.H., 1997. Some factors governing the entry of Culicoides spp. (Diptera: Ceratopogonidae) into stables. Onderstepoort J. Vet. Res., 64, 227-233.
Bartsch S. et al., 2009. Feeding patterns of biting midges of the Culicoides obsoletus and Culicoides pulicaris groups on selected farms in Brandenburg, Germany. Parasitol. Res., 105(2), 373-380.
Baylis M. et al., 2010. Evaluation of housing as a means to protect cattle from Culicoides biting midges, the vectors of bluetongue virus. Med. Vet. Entomol., 24, 38-45.
Borkent A., 2012. World species of biting midges (Diptera: Ceratopogonidae), http://wwx.inhs.illinois.edu/files/9913/9144/3328/CeratopogonidaeCatalog.pdf, (14/08/14).
Caracappa S. et al., 2003. Identification of a novel bluetongue virus vector species of Culicoides in Sicily. Vet. Rec., 153(3), 71-74.
Carpenter S. et al., 2008a. Experimental infection studies of UK Culicoides species midges with bluetongue virus serotypes 8 and 9. Vet. Rec., 163, 589-592.
Carpenter S. et al., 2008b. An assessment of Culicoides surveillance techniques in northern Europe: have we underestimated a potential bluetongue virus vector? J. Appl. Ecol., 45, 1237-1245.
Clausen P.-H. et al., 2009. Seasonal dynamics of biting midges (Diptera: Ceratopogonidae, Culicoides spp.) on dairy farms of Central Germany during the 2007/2008 epidemic of bluetongue. Parasitol. Res., 105, 381-386.
Cybinski D.H., George T.D.S. & Paull N.I., 1978. Antibodies to akabane virus in Australia. Aust. Vet. J., 54, 1-3.
De Regge N. et al., 2012. Detection of Schmallenberg virus in different Culicoides spp. by real-time RT-PCR. Transboundary Emerging Dis., 59(6), 471-475.
Delécolle J.-C., 1985. Nouvelle contribution à l’étude systématique et iconographique des espèces du genre Culicoides (Diptera : Ceratopogonidae) du Nord-Est de la France. Thèse de doctorat : Université Louis Pasteur de Strasbourg (France).
Dijkstra E. et al., 2008. Culicoides chiopterus as a potential vector of bluetongue virus in Europe. Vet. Rec., 162, 422.
Du Toit R.M., 1944. The transmission of bluetongue and horse sickness by Culicoides. Onderstepoort J. Vet. Sci. Anim. Ind., 19, 7-16.
Dyce A.L., 1969. The recognition of nulliparous and parous Culicoides (Diptera: Ceratopogonidae) without dissection. J. Aust. Entomol. Soc., 8, 11-15.
Garros C. et al., 2011. Adaptation of a species-specific multiplex PCR assay for the identification of blood meal source in Culicoides (Ceratopogonidae: Diptera): applications on Palaearctic biting midge species, vectors of Orbiviruses. Infect. Genet. Evol., 11(5), 1103-1110.
Goetghebuer M., 1952. Le genre Culicoides (Diptères, Cératopogonidés) et ses représentants en Belgique. Biol. Jaarb., 19, 185-191.
Harrup L.E. et al., 2013. Larval development and emergence sites of farm-associated Culicoides in the United Kingdom. Med. Vet. Entomol., 27(4), 441-449.
Haubruge É. & Zimmer J.-Y., 2008. Les vecteurs de maladies infectieuses émergentes et la production porcine. Essent. Porc, 4, 12-14.
Hendry G. & Godwin G., 1988. Biting midges in Scottish forestry: a costly irritant or a trivial nuisance? Scottish For., 42, 113-119.
Hoffmann B. et al., 2009. Monitoring of putative vectors of bluetongue virus serotype 8, Germany. Emerging Infect. Dis., 15, 1481-1484.
Hoffmann B. et al., 2012. Novel orthobunyavirus in cattle, Europe, 2011. Emerging Infect. Dis., 18(3), 469-472.
Huang C.C. et al., 2003. Natural infections of pigs with akabane virus. Vet. Microbiol., 94, 1-11.
Jennings D.M. & Mellor P.S., 1988. The vector potential of British Culicoides species for bluetongue virus. Vet. Microbiol., 17, 1-10.
Kremer M., 1965. Contribution à l’étude du genre Culicoides Latreille particulièrement en France. Paris : Paul Lechevalier, Encyclopédie Entomologique Série A - XXXIX.
Larska M., Lechowski L., Grochowska M. & Zmudzinski J.F., 2013. Detection of the Schmallenberg virus in nulliparous Culicoides obsoletus/scoticus complex and C. punctatus – The possibility of transovarial virus transmission in the midge population and of a new vector. Vet. Microbiol., 166, 467-473.
Lassen S.B., Nielsen S.A., Skovgard H. & Kristensen M., 2011. Molecular identification of bloodmeals from biting midges (Diptera: Ceratopogonidae: Culicoides Latreille) in Denmark. Parasitol. Res., 108(4), 823-829.
Losson B. et al., 2007. Biting midges overwintering in Belgium. Vet. Rec., 160, 451-452.
Mehlhorn H. et al., 2007. First occurrence of Culicoides obsoletus-transmitted Bluetongue virus epidemic in Central Europe. Parasitol. Res., 101, 219-228.
Mehlhorn H. et al., 2009. Bluetongue disease in Germany (2007-2008): monitoring of entomological aspects. Parasitol. Res., 105, 313-319.
Meiswinkel R., Baylis M. & Labuschagne K., 2000. Stabling and the protection of horses from Culicoides bolitinos (Diptera: Ceratopogonidae), a recently identified vector of African horse sickness. Bull. Entomol. Res., 90(6), 509-515.
Meiswinkel R. et al., 2004. The taxonomy of Culicoides vector complexes – unfinished business. Vet. Ital., 40(3), 151-159.
Meiswinkel R., Van Rijn P., Leijs P. & Goffredo M., 2007. Potential new Culicoides vector in northern Europe. Vet. Rec., 161, 564-565.
Meiswinkel R. et al., 2008. Endophily in Culicoides associated with BTV-infected cattle in the province of Limburg, south-eastern Netherlands, 2006. Prev. Vet. Med., 87, 182-195.
Mellor P.S., 1990. The replication of bluetongue virus in Culicoides vectors. Curr. Top. Microbiol. Immunol., 162, 143-161.
Mellor P.S., Booman J. & Baylis M., 2000. Culicoides biting midges: their role as arbovirus vectors. Annu. Rev. Entomol., 45, 307-340.
Ninio C. et al., 2011. Contribution to the knowledge of Culicoides (Diptera: Ceratopogonidae) host preferences in France. Parasitol. Res., 108(3), 657-663.
Rasmussen L.D. et al., 2012. Culicoids as vectors of Schmallenberg virus. Emerging Infect. Dis., 18(7), 1204-1206.
Rieb J.-P., 1982. Contribution à la connaissance de l’écologie et de la biologie des Cératopogonidés (Diptera, Nematocera). Thèse de doctorat : Université Louis Pasteur de Strasbourg (France).
Rigot T., Vercauteren Drubbel M., Delécolle J.-C. & Gilbert M., 2013. Farms, pastures and woodlands: the fine-scale distribution of Palearctic Culicoides spp. biting midges along an agro-ecological gradient. Med. Vet. Entomol., 27(1), 29-38.
Ruiz-Fons F., Sánchez-Matamoros A., Gortázar C. & Sánchez-Vizcaíno J.M., 2014. The role of wildlife in bluetongue virus maintenance in Europe: lessons learned after the natural infection in Spain. Virus Res., 182, 50-58.
Saegerman C. et al., 2008. Fièvre catarrhale ovine : l’Europe au carrefour de l’enzootie. Point Vétérinaire, 290, 41-47.
Shaw A.E. et al., 2013. Transmission of Schmallenberg virus in a housed dairy herd in the UK. Vet. Rec., 173(24), 609.
Sperlova A. & Zendulkova D., 2011. Bluetongue: a review. Vet. Med.-Czech., 56, 430-452.
Steukers L., Bertels G., Cay A.B. & Nauwynck H.J., 2012. Schmallenberg virus: emergence of an Orthobunyavirus among ruminants in Western Europe. Vlaams Diergeneeskd. Tijdschr., 81, 119-127.
Takken W. et al., 2008. The phenology and population dynamics of Culicoides spp. in different ecosystems in The Netherlands. Prev. Vet. Med., 87, 41-54.
Thiry E. et al., 2006. Bluetongue in northern Europe. Vet. Rec., 159, 327.
Valkiunas G. & Iezhova T.A., 2004. The transmission of Haemoproteus belopolskyi (Haemosporida: Haemoproteidae) of blackcap by Culicoides impunctatus (Diptera: Ceratopogonidae). J. Parasitol., 90, 196-198.
Vanbinst T. et al., 2009. Bluetongue virus detection by real-time RT-PCR in Culicoides captured during the 2006 epizootic in Belgium and development of an internal control. Transboundary Emerging Dis., 56(5), 170-177.
Velthuis A.G. et al., 2010. Financial consequences of the Dutch bluetongue serotype 8 epidemics of 2006 and 2007. Prev. Vet. Med., 93(4), 294-304.
Venail R. et al., 2012. Assessing diversity and abundance of vector populations at a national scale: example of Culicoides surveillance in France after bluetongue virus emergence. In: Mehlhorn H., ed. Arthropods as vectors of emerging diseases. Berlin, Heidelberg, Germany: Springer-Verlag, Parasitology Research Monographs Vol. 3, 77-102.
Veronesi E. et al., 2013. Implicating Culicoides biting midges as vectors of Schmallenberg virus using semi-quantitative RT-PCR. PLoS ONE, 8(3), e57747.
Viennet E. et al., 2012. Host-seeking activity of Bluetongue virus vectors: endo/exophagy and circadian rhythm of Culicoides in Western Europe. PLoS ONE, 7(10), e48120.
Zanella G. et al., 2013. Clinical pattern characterization of cattle naturally infected by BTV-8. Transboundary Emerging Dis., 60(3), 231-237.
Zimmer J.-Y. et al., 2008a. Breeding sites of bluetongue vectors in northern Europe. Vet. Rec., 162, 131.
Zimmer J.-Y. et al., 2008b. Distribution of potential bluetongue vectors on Belgium farms. Vet. Rec., 162, 700.
Zimmer J.-Y., Losson B., Saegerman C. & Haubruge É., 2009. Écologie et distribution des espèces de Culicoides Latreille 1809 (Diptera : Ceratopogonidae) à proximité d’une exploitation bovine en Belgique. Ann. Soc. Entomol. Fr., 45(3), 393-400.
Zimmer J.-Y., Saegerman C., Losson B. & Haubruge É., 2010. Breeding sites of bluetongue virus vectors, Belgium. Emerging Infect. Dis., 16, 575-576.
Zimmer J.-Y. et al., 2013a. Chemical composition of silage residues sustaining the larval development of the Culicoides obsoletus/Culicoides scoticus species (Diptera: Ceratopogonidae). Vet. Parasitol., 191(1-2), 197-201.
Zimmer J.-Y. et al., 2013b. Are bogs reservoirs for emerging disease vectors? Evaluation of Culicoides populations in the Hautes Fagnes Nature Reserve (Belgium). PLoS ONE, 8(6), e66893.
Zimmer J.-Y. et al., 2013c. Breeding sites and species association of the main Bluetongue and Schmallenberg virus vectors, the Culicoides species (Diptera: Ceratopogonidae), in northern Europe. Ann. Soc. Entomol. Fr., 49(3), 335-344.
Zimmer J.-Y. et al., 2013d. Comparaison des populations de Culicoides Latreille 1809 (Diptera : Ceratopogonidae) présentes au sein d’une bergerie belge et d’une prairie ovine associée. Ann. Soc. Entomol. Fr., 49(4), 446-459.
Zimmer J.-Y., Haubruge É. & Francis F., 2014a. Synthèse bibliographique : l’écologie larvaire des culicoïdes (Diptera : Ceratopogonidae). Biotechnol. Agron. Soc. Environ., 18(2), 301-312.
Zimmer J.-Y., Brostaux Y., Haubruge É. & Francis F., 2014b. Larval development sites of the main Culicoides species (Diptera: Ceratopogonidae) in northern Europe and distribution of coprophilic species larvae in Belgian pastures. Vet. Parasitol., 205(3-4), 676-686.






