- Portada
- Volume 18 (2014)
- numéro 4
- Préparation et caractérisation d’un charbon actif à partir de la coquille d’amande (Prunus amygdalus) amère
Vista(s): 0 (0 ULiège)
Descargar(s): 0 (0 ULiège)
Préparation et caractérisation d’un charbon actif à partir de la coquille d’amande (Prunus amygdalus) amère

Notes de la rédaction
Reçu le 20 janvier 2014, accepté le 8 septembre 2014
Résumé
Description du sujet. Cet article aborde la préparation et la caractérisation d’un charbon actif (CA) à partir de la coquille d’amande (Prunus amygdalus) amère (BASh), fruit qui pousse spontanément dans la région de Sétif (nord-est algérien).
Objectifs. L’objectif de cette étude est d’élucider la faisabilité de l’activation chimique des BASh comme voie d’obtention de deux types de CA.
Méthode. Les deux CA sont obtenus à partir des BASh par activation acide (CAa) et basique (CAb). Les produits finaux sont caractérisés par différentes analyses physico-chimiques : angle de repos, taux de cendres, analyse thermique, etc. Dans le cas du CAa, la modélisation de la cinétique et des isothermes d’adsorption du bleu de méthylène (BM) est aussi abordée.
Résultats. Le mode d’activation semble influer inégalement sur les différentes caractéristiques physico-chimiques des deux charbons actifs obtenus. La cinétique d’adsorption du BM par le CAa est correctement décrite par le modèle pseudo-2e-ordre (R2 = 0,999). Concernant la modélisation de l’isotherme d’adsorption, parmi les trois modèles testés, celui de Freundlich s’avère le plus adéquat pour rendre compte des données expérimentales : R2 = 0,898, erreur relative moyenne (mean relative error, MRE) = 38,638 et la racine carrée de l’erreur moyenne (root mean square error, RMSE = 1,039). D’autre part, la coquille activée montre une capacité intéressante d’adsorption du BM, estimée à 99,05 %.
Conclusions. Les résultats obtenus démontrent la possibilité de valorisation des coquilles d’amandes amères sous forme de CA avec ce que tout cela implique comme impacts socio-économiques positifs sur la région et même au-delà.
Abstract
Preparation and characterization of activated coal from bitter almond shells (Prunus amygdalus).
Description of the subject. The present study concerns the preparation of activated coal (AC) from bitter almond (Prunus amygdalus) shells (BASh), a fruit that grows spontaneously in the Setif region (northeast Algeria). Obtaining and characterizing activated coal was the valorization method adopted here.
Objectives. The aim of this study was to elucidate the feasibility of the chemical activation of BASh in order to obtain two types of activated coal (AC).
Method. The two ACs were obtained from BASh by acid (CAa) and basic (CAb) activation. The final products were investigated for their different physicochemical characteristics: angle of repose, ash, differential screening calorimetry, etc. In the case of CAa, the modeling of the adsorption kinetic of methylene blue (MB), as well as of adsorption isotherms, was also performed.
Results. The activation mode seemed to affect unequally the different physicochemical characteristics of both the obtained coals. On the other hand, the adsorption kinetics of the MB by CAa was correctly described by the pseudo-2nd-order model (R² = 0.999). Concerning the modeling of the adsorption isotherm, of the three models tested, the Freundlich model appeared to be the most appropriate to fit the experimental data (R2 = 0.898, mean relative error (MRE) = 38.638 and root mean square error (RMSE) = 1.039). In addition, the activated shell showed an interesting capacity for MB adsorption, estimated at 99.05%.
Conclusions. Results confirmed the possibility of the valorization of BASh in the form of AC, taking into account the positive socio-economic impacts for the region and beyond.
Tabla de contenidos
1. Introduction
1Le charbon actif (CA) est un adsorbant connu depuis longtemps se caractérisant par, entre autres, sa grande surface spécifique, sa structure poreuse et sa thermostabilité (Chen et al., 2011). Il peut être préparé à partir de toute matière solide contenant une grande proportion de carbone (Ioannidou et al., 2007 ; Soleimani et al., 2008), souvent par carbonisation suivie d’une activation physique ou chimique. Cependant, un processus combinant les deux étapes peut être appliqué (Ioannidou et al., 2007). La carbonisation a essentiellement pour but d’enrichir la matière en carbone et créer les premiers pores, tandis que l’activation vise à développer une structure poreuse (Prakash et al., 2006). Le CA résultant de ces traitements acquiert en conséquence une capacité adsorbante (Rivera-Utrilla et al., 2011) et catalysante (Lee et al., 2006) très recherchée dans plusieurs domaines (Ioannidou et al., 2007) : pharmaceutique, agro-alimentaire et l’industrie de l’automobile. En particulier, le CA est largement utilisé dans la purification des eaux. Il permet d’en éliminer les matières organiques (pesticides, par exemple) et inorganiques (métaux lourds comme le Pb, par exemple) (Ahmedna et al., 2004).
2Durant la dernière décennie, l’aptitude des sous-produits agricoles à donner des CAs à forte capacité d’adsorption et dotés de propriétés physico-chimiques très avantageuses dont, entre autres, un faible taux de cendres, ne cesse de retenir l’attention des chercheurs (Ioannidou et al., 2007). De nombreux travaux sont alors entrepris sur un matériel végétal de provenances diverses : pailles de maïs (Lanzetta et al., 1998), noyaux d’olives (Minkova et al., 2001), coquilles des graines de tournesol (Haykiri-Acma et al., 2006), bagasses de canne à sucre (Cetin et al., 2004), coquilles d'amandes (Aygun et al., 2003), noyaux de pêches (Tsai et al., 1997), graines de raisins (Savova et al., 2001), amandes d'abricots (Aygun et al., 2003), noyaux de cerises (Savova et al., 2001), coques d'arachides (Girgis et al., 2002), coquilles de noix (Lua et al., 2004), coques de riz (Ahmedna et al., 2000), coques de maïs (Zhang et al., 2004).
3Les avantages liés à l’utilisation de ces déchets sont nombreux et nous en retenons :
4– la valorisation des agro-ressources en tant que matière première disponible, renouvelable et bon marché,
5– la répercussion positive sur le prix de revient du CA obtenu,
6– un impact socio-économique certain sur les populations locales : création d’activités génératrices d’emploi et, dans la mesure du possible, non polluantes.
7Souvent réalisée au moyen de solutions de KOH et H3PO4 (Ioannidou et al., 2007), l’activation chimique est décrite dans de nombreux travaux (Ahmedna et al., 2004 ; Sudaryanto et al., 2006). Son choix peut être dû à ses divers avantages, notamment (Ioannidou et al., 2007) :
8– manipulations à températures basses,
9– les deux opérations de carbonisation et d’activation sont combinées en une seule étape.
10Le but de la présente étude est d’obtenir dans un premier temps un CA par activation chimique à chaud des coquille d’amande amère (BASh, Bitter Almond Shells), puis d’investiguer sa capacité d’adsorption sur le bleu de méthylène (BM), cette propriété étant déterminante dans la dépollution de divers effluents industriels. Précisons que ces coquilles sont issues de fruits d’amandiers sauvages poussant spontanément dans la région de Sétif (nord-est algérien) et qu’en dépit de leur abondance, ces fruits restent abandonnés et ne suscitent, à ce jour à notre connaissance, aucune étude scientifique.
2. Matériel et méthodes
2.1. Matériel
11La BASh étudiée est collectée en juillet 2010 dans les monts de la région de Sétif, au nord-est de l’Algérie. Il s’agit de déchets de fruits issus d’amandiers qui poussent spontanément mais ne bénéficient d’aucune valorisation, à part quelques tentatives limitées d’extraction de l’huile à partir de l’amande.
2.2. Activation de la BASh
12Dans un premier temps, la BASh est lavée avec de l’eau distillée, séchée, broyée puis tamisée. L’activation est réalisée chimiquement par les deux voies, acide et basique. Cette dernière est effectuée en se servant de la solution d’hydroxyde de potassium (KOH) (Olivares-Marin et al., 2006). La BASh est d’abord trempée dans la solution d’acide sulfurique (H2SO4) à 98 % (déshydratant, oxydant et agent d’élimination des matières minérales) pendant 24h puis lavée avec l’eau distillée jusqu’à atteindre un pH 6 dans le liquide résiduel. La BASh (25 g) est dans un deuxième temps immergée dans 100 ml de KOH sous agitation à 85 °C pendant 2 h. Le liquide est ensuite séparé par filtration et la poudre de coquille ainsi activée par la base (CAb) est séchée à 120 °C pendant 24 h.
13L’activation acide est réalisée au moyen de l’acide phosphorique (H3PO4), comme décrit par Soleimani et al. (2008) avec quelques modifications mineures. La BASh est imprégnée avec une solution de H3PO4 à 85 % avec un rapport massique de 1:1. Le mélange est chauffé dans une étuve (type Memert) à 100 °C pendant 24 h. La coquille activée par l’acide (CAa) est lavée avec de l’eau distillée puis avec la solution de NaHCO3 pour neutraliser l’acidité. Avant séchage à 100 °C, la CAa est lavée de nouveau avec l’eau distillée, jusqu’à atteindre un pH de 6 dans l’eau résiduelle.
14Dans la suite de l’exposé, on peut lire CAa et CAb indifféremment comme charbon activé ou coquille d’amande activée par l’acide et la base, respectivement.
2.3. Caractérisation de la coquille d’amande activée
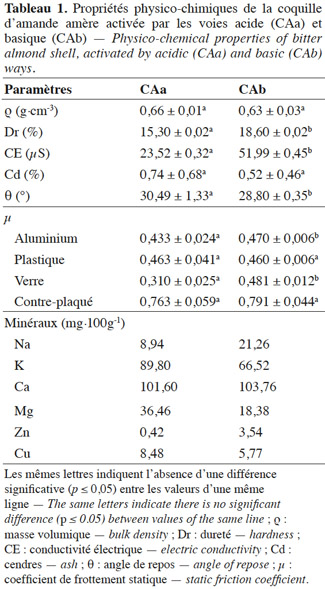
15Cette caractérisation concerne les produits obtenus par les deux méthodes d’activation (CAa et CAb) et porte d’abord sur quelques indices physico-chimiques de base : teneur en cendres (Cd, %) (ASTM International, 2006), masse volumique (ρ, en g·cm-3) (Snell et al., 1968), dureté (Dr, en %) en se servant du test d’usure (Toles et al., 2000), conductivité électrique (CE, en µS) d’une suspension formée d’1 g CAa/CAb dans 100 ml d’eau distillée et laissée au repos pendant 20 min à température ambiante (Ahmedna et al., 2000), coefficient de frottement statique (µ) sur différentes surfaces (fer, verre, aluminium, plastique et contre-plaqué) selon la méthode du plan incliné (Nimkar et al., 2001), angle dynamique du repos (θ, en °) en suivant la méthode dite de « Vidange » (Garnayak et al., 2008).
16L’analyse par MEB permet une caractérisation microscopique de la surface de contact de CAa/CAb au moyen d’un appareil de type PHILIPS XL 30 ESEM.
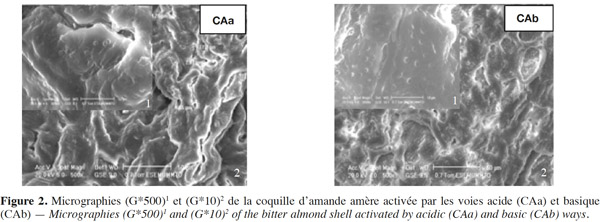
17Les spectres d’absorption IR-TF sont enregistrés dans le domaine 4 000 – 400 cm-1 au moyen d’un spectrophotomètre IR (SHIMADZU FT-IR 8400 X) à raison de 20 balayages par min et une vitesse de 2 mm·s-1 (résolution égale à 4 cm-1). Les pastilles sont préparées par compression (2 MPa·min-1) à partir d’un mélange de 3 mg de l’échantillon avec 300 mg de KBr.
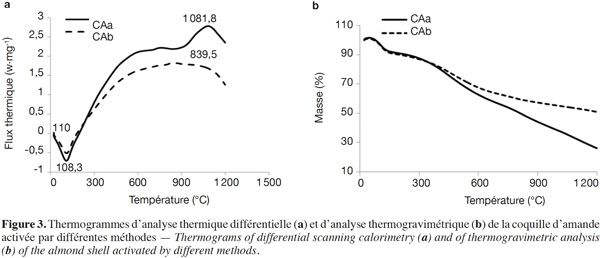
18Les diagrammes de l’analyse thermogravimétrique (ATG) et de l’analyse thermique différentielle (ATD) sont obtenus en mesurant la variation de la masse et du flux thermique d'un échantillon (15 mg) de CAa/CAb en fonction de la température (25-1 200 °C à raison de 10 °C·min-1). Elle est effectuée sur une thermo-balance de marque NETZSH STA 409 PC/PG sous atmosphère contrôlée (azote) pour éviter la combustion de la matière.
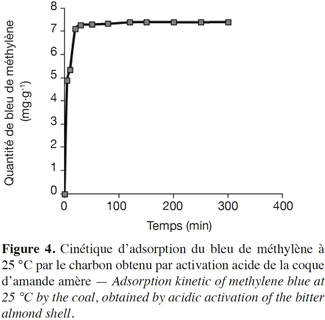
2.4. Étude de l’adsorption
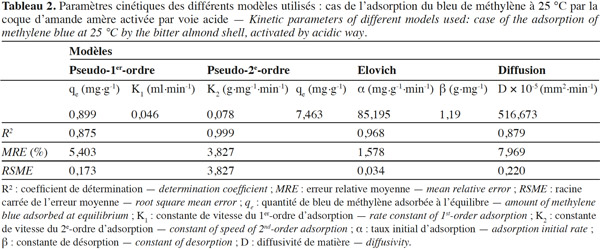
19L’adsorption en « batch » en présence d’un agitateur « Jar test, type JLT6-VELP » est étudiée en utilisant la CAa comme adsorbant et le BM (trois fois hydraté) comme adsorbat.
20Cinétique d’adsorption. L’étude de la cinétique d’adsorption est réalisée uniquement sur la CAa, en opérant dans des conditions optimales (pH 2,2 ; dose d’adsorbant [0,2 - 0,63 mm] = 0,01g·ml-1 ; vitesse d’agitation = 150 tr·min-1) obtenues au préalable grâce à la méthode de Taguchi (non présentée ici), la matrice d’expérience étant adaptée à partir d’autres travaux (Soleimani et al., 2008). Dans des béchers appropriés, 2 g de l’adsorbant sont mélangés avec 200 ml de la solution du BM (0,2 mM = 74,7 mg·l-1). La suspension est mise sous agitation de 150 tr·min-1 à la température ambiante (25 °C). À des intervalles de temps définis antérieurement (dans la gamme variant de 0,00 à 300 min), la CAa est séparée du liquide par centrifugation. La concentration du BM dans la phase liquide est ensuite déterminée par mesure de l’absorbance à 600 nm et lecture sur une courbe d’étalonnage établie à partir d’une gamme de concentrations du BM allant de 0,0 à 0,10 mM. La quantité du BM (qt) adsorbée par la CAa, en fonction du temps, est calculée selon la formule suivante :
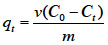
21C0 : concentration (mg·l-1) en BM dans la phase liquide ; v : volume (l) de la solution du colorant ; m : masse de l’adsorbant (g).
22Les quatre modèles suivants sont testés pour modéliser la cinétique d’adsorption du BM :
23- Pseudo-1er-ordre (Lagergren, 1898) :
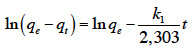
24où qe et qt sont les quantités (mg·g-1) du BM adsorbé à l’équilibre et au temps t respectivement et k1 est la constante (ml·min-1) de vitesse d’adsorption. Les constantes du modèle sont déterminées graphiquement en traçant (ln(qe-qt)) en fonction de t.
25– Pseudo-2e-ordre (Ho et al., 1999) :
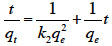
26où k2 (g·mg-1·min) est la constante de vitesse d’adsorption. Les constantes (k2 et qe) sont aussi déterminées graphiquement en traçant (t/qt) en fonction de t.
27– Elovich (Chien et al., 1980) :
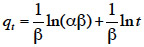
28α est la capacité d'adsorption initiale (mg·g-1·min) et β est la constante de désorption (g·mg-1). La courbe de qt en fonction de ln(t) donne une droite de régression avec une pente correspondant à (1/β) et une ordonnée à l’origine donnant le terme (1/β) ln(αβ).
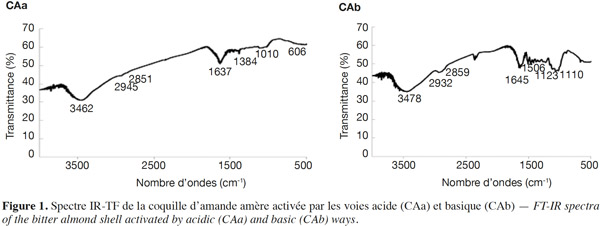
29– Modèle de diffusion (Urano et al., 1991) :
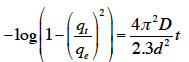
30où d est le diamètre moyen des particules (cm). En traçant (– log [1− (qt/qe)2]) en fonction de t, la diffusivité de matière D (cm2·s-1) peut être déterminée.
31Obtention et modélisation de l’isotherme d’adsorption. Pour obtenir l’isotherme d’adsorption, une série de béchers est utilisée. Dans chaque bécher sont versés 200 ml de solution du BM de concentrations variables : 0,00 ; 0,10 ; 0,15 ; 0,20 ; 0,25 et 0,30. L’étude de l’équilibre d’adsorption est réalisée dans les mêmes conditions optimales indiquées plus haut. Après équilibre, les particules de l’adsorbant sont séparées par centrifugation et la solution clarifiée est analysée par détermination de la concentration d’équilibre (Ce) du BM en se servant de la même courbe d’étalonnage utilisée précédemment. La quantité du réactif adsorbée à l’équilibre (qe, en mg·g-1) est calculée comme suit :
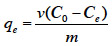
32C0 : concentration (mg·l-1) du BM dans la phase liquide ; v : volume (l) de la solution du colorant ; m : masse de l’adsorbant (g).
33Les trois modèles classiques suivants, sous leurs formes linéaires, sont utilisés pour décrire les isothermes d’adsorption :
34– Le modèle de Langmuir (Langmuir, 1918) :
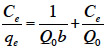
35qe est la quantité (mg·g-1) du BM adsorbée à l'équilibre ; Ce est la concentration d'équilibre (mg·l-1) ; Q0 : la capacité d'adsorption en monocouche (mg·g-1) ; b : la constante (l·mg-1) de Langmuir liée à l'énergie libre d'adsorption. La variation de (Ce/qe) en fonction de (Ce) donne une droite de pente (1/Q0) et d'ordonnée à l’origine (1/Q0b).
36– L'équation de Freundlich (Freundlich, 1907) :
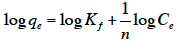
37Kf est une constante indicatrice de la capacité d’adsorption relative de l’adsorbant (mg·g-1) et 1/n indique l’intensité d’adsorption. Ces constantes sont déterminées à partir de l’équation de la droite (log qe) = f(logCe)).
38– L’équation de Tempkin (Tempkin et al., 1940) :
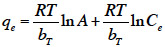
39où T : température absolue en °K, R : constante des gaz parfaits (8,314 J·mol-1·K-1), bT (J·mol-1) : chaleur d'adsorption ; A (l·mg-1) : constante correspondant à l'énergie de liaison d’équilibre maximum.
2.5. Statistiques
40Les résultats de la caractérisation physico-chimique de la CAa et CAb sont exprimés par la moyenne ± écart type, sauf pour les minéraux.
41La vérification des modèles proposés pour décrire les cinétiques d’adsorption et les isothermes d’adsorption est basée sur le coefficient de détermination (R2), l'erreur relative moyenne « mean relative error, MRE» et l'erreur de la racine carrée des moyennes « root mean square error, RMSE » :
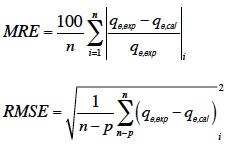
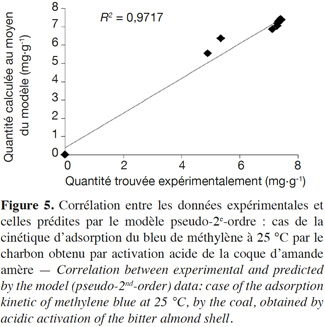
42Microsoft Excel 2007 est le logiciel utilisé pour effectuer ces calculs.
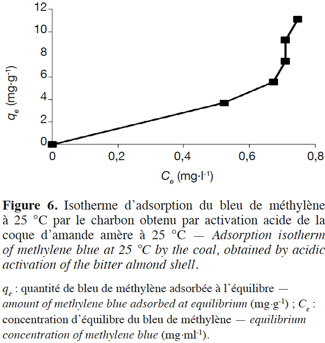
3. Résultats
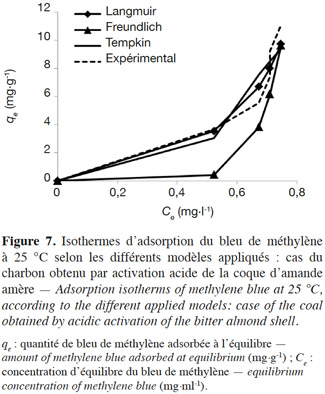
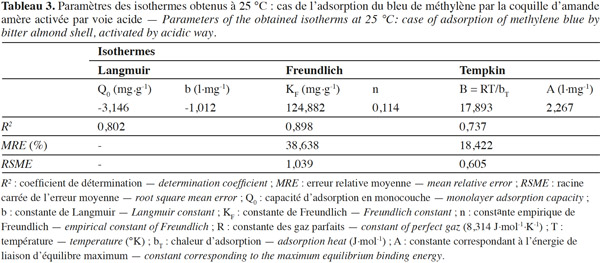
3.1. Caractérisation de la BASh activée
43Le tableau 1 récapitule les résultats concernant la caractérisation physico-chimique de la BASh activée chimiquement par les deux procédures acide (CAa) et basique (CAb). En complément de l’analyse physico-chimique, l’analyse spectroscopique par IR-TF permet de mettre en évidence les groupements chimiques présents dans les deux matériaux (Figure 1).
44La figure 2 présente les résultats obtenus par MEB sur des particules (0,2 – 0,63 mm de dimensions) de la BASh activée par les deux procédés chimiques, tandis que la figure 3 montre les thermogrammes relatifs à l’ATD (Figure 3a) et à l’ATG (Figure 3b).
3.2. Cinétique d’adsorption
45Tenant compte des avantages liés à l’activation acide, seul le produit final obtenu par l’activation acide (CAa) est maintenu pour la suite de l’étude.
46La figure 4 montre la quantité du BM adsorbée par la CAa à différents intervalles de temps à partir d’une phase liquide se caractérisant par une concentration initiale de 74,7 mg·l-1 (0,2 mM).
47À propos de la modélisation de la cinétique d’adsorption, les expressions obtenues après linéarisation permettent de déterminer les constantes caractéristiques correspondantes (Tableau 2) et de vérifier la corrélation entre les valeurs expérimentales et celles prédites par le modèle sélectionné (Figure 5).
3.3. Isothermes d’adsorption
48L’isotherme d’adsorption indique comment les molécules se distribuent entre la phase liquide et la phase solide quand l’adsorption atteint l’équilibre.
49Il est bien connu que la modélisation des isothermes d’adsorptions est le premier objectif à atteindre dans toute investigation scientifique puisqu’elle sert d’outil mathématique rationnel permettant de passer de la phase expérimentale de laboratoire à celle de la conception à l’échelle de prototype.
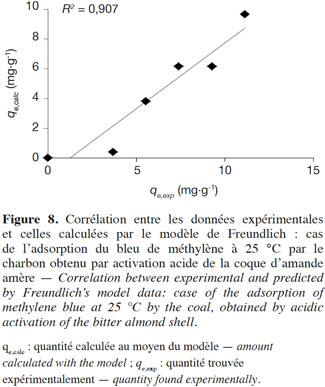
50La variation de la quantité (qe) du colorant BM adsorbée par la CAa en fonction de la concentration d’équilibre (Ce) est montrée à la figure 6. D’autre part, plusieurs modèles sont cités dans la littérature pour décrire les données expérimentales des isothermes d’adsorption. Les modèles de Langmuir et de Freundlich sont les plus fréquemment utilisés (Hameed et al., 2007). Dans cette étude, ces deux modèles, en plus de celui de Tempkin, sont employés pour décrire l’interdépendance entre la quantité du colorant adsorbée et sa concentration d’équilibre (Figure 7). Les constantes des isothermes obtenues par linéarisation des différents modèles considérés sont récapitulées dans le tableau 3, tandis que la corrélation entre les valeurs expérimentales et celles prédites par le meilleur modèle est illustrée par la figure 8.
4. Discussion
4.1. Caractérisation des BASh activées
51D’après les données du tableau 1, le mode d’activation semble influer inégalement sur les différentes caractéristiques physico-chimiques du charbon actif obtenu, certaines (Dr, CE, θ et µ/aluminium + verre) présentant des valeurs statistiquement différentes (p ≤ 0,05). Dans le cas des minéraux, la CAb montre une teneur deux fois (cas de Na) et huit fois (cas du Zn) supérieure à celle de la CAb, celui-ci étant en revanche deux fois plus riche en Mg.
52Comme il fallait s’y attendre, les charbons obtenus présentent des indices différents de ceux rapportés pour les autres espèces de graines. À titre d’exemple, la dureté et la conductivité dans le cas du CAb présentent des valeurs qui sont cinq fois supérieures à celles du CA obtenu à partir du noyau d’abricot (Soleimani et al., 2008).
53Les masses volumiques des deux types de charbon obtenus présentent des valeurs qui ne sont pas statistiquement différentes. Ces valeurs sont par ailleurs environ deux fois moins élevées que celles (1,07-1,20 g·cm-3) rapportées par Estevinho et al. (2006) à propos de la coque d’amandes douces du nord du Portugal.
54Le coefficient de frottement statique varie en fonction de la surface-support et de la méthode d’activation. Cependant, c’est le contre-plaqué qui donne le coefficient de frottement le plus élevé, les deux types de charbons (CAa et CAb) ne présentant pas de différence significative (p ≤ 0,05) dans le cas de ce matériau.
55Concernant l’angle de repos, la CAa montre une valeur plus élevée par comparaison au CAb (p ≤ 0,05). Notons que ce paramètre peut être un indicateur de cohésion entre les différentes unités d’un matériau (Karaj et al., 2010).
56En fait, l’angle de repos et le coefficient de frottement sont des outils qui sont pris en compte dans les opérations de manutention des pulvérulents. Mais il n’y a pas, malheureusement, de données disponibles dédiées à ces paramètres dans le cas des charbons actifs.
57La figure 1 montre que les deux modes d’activation donnent des spectres IR-TF de profils semblables, mais d’intensités de bandes très différentes. En effet, sur ces spectres, sont relevées les bandes caractéristiques suivantes déchiffrées à l’aide d’un spectre de référence (Estevinho et al., 2006) :
58– une large bande à 3 478 cm-1 et 3 462 cm-1 correspondant à l’allongement des groupements OH (de structure de la coquille et de l’eau),
59– une large bande à 2 932 cm-1 et 2 945 cm-1 relative à l'élongation du groupement C−H,
60– une bande à 1 645 cm-1 et 1 637 cm-1 qui peut se rapporter fort probablement aux élongations des C=C des oléfines (alcènes) et des aromatiques,
61– de très faibles bandes entre 1 392 – 1 506 cm-1 qui sont à mettre en relation avec les déformations C-H dans les chaines aliphatiques,
62– une large bande entre 1 000 et 1 120 cm-1 caractéristique de la déformation dans le plan des C-O aliphatiques.
63Les bandes obtenues résulteraient, peut-être, de la présence de la cellulose, des hémicelluloses et de la lignine, constituants majeurs de la coquille, comme cela a été rapporté par Estevinho et al. (2006) pour la coquille d’amande douce.
64Notons que les bandes précédemment décrites sont plus intenses après traitement basique, ce qui est une preuve de la meilleure efficacité de l’activation acide aboutissant à un matériel résiduel (cellulose, lignine) moins important.
65L’examen par MEB a pour but d’illustrer la porosité, surtout celle créée par l’activation. Une porosité développée permet d’augmenter la surface spécifique du charbon et, en conséquence, le nombre de sites actifs sur lesquels peuvent se fixer éventuellement les molécules du BM. La figure 2 montre que l’opération d’activation, surtout acide (CAa), induit un développement conséquent de la porosité par éclatement des pores naturellement existants dans la coquille ou induits par le traitement.
66Il convient de rappeler que l’ATG consiste à suivre la perte en masse d’un composé en fonction de la température de pyrolyse ; l’ATD se base, quant à elle, sur les réactions thermiques qui se produisent lorsqu’un composé est chauffé.
67D’après l’ATD (Figure 3a), la pyrolyse de la BASh est une réaction exothermique. Les deux modes d’activation conduisent à des allures comparables des courbes. Cependant, l’activation alcaline (Figure 3a) permet d’obtenir un produit ayant une température de cristallisation (1 081,8 °C) plus élevée que celle (839,5 °C) du produit obtenu par l’activation acide. D’autre part, les deux produits obtenus ont le même comportement de perte en masse jusqu’à 400 °C environ (Figure 3b). Au-delà, c’est l’activation alcaline qui engendre un comportement uniforme avec une perte en masse moindre : la CAb est plus résistante à ces niveaux de température.
68Les avantages de l’activation acide, révélés par l’analyse IR-TF, appuient l’intérêt reconnu pour ce type d’activation : rendement élevé en CA, capacité d’échange cationique impressionnante et double stabilité chimique et thermique.
4.2. Cinétique d’adsorption
69On déduit de la figure 4 que la capacité d’adsorption du colorant augmente avec le temps d’une manière exponentielle, pour atteindre sa valeur maximale après 50 min environ ; au-delà, survient l’état d’équilibre. Il devient ainsi clair que le CAa présente un pouvoir d’adsorption considérable (99,05 % de la concentration initiale de la phase liquide).
70La valeur de la capacité d’adsorption d’équilibre, déterminée expérimentalement avec une concentration initiale de 74,7 mg·l-1 du BM, est de l’ordre de 7,40 mg·g-1. Les résultats obtenus sont conformes à toutes les données de la littérature consultée et qui se rapportent à des charbons actifs issus d’autres matières végétales, incluant la coquille de noisette (Demirbas et al., 2009), les noyaux de dattes (Alhamed, 2009) et la coquille d’amande douce (Bulut et al., 2007).
71Le résultat le plus pertinent de la modélisation de la cinétique d’adsorption (Tableau 2) concerne la bonne adéquation du modèle pseudo-2e-ordre (R2 ~1). Cette constatation est confirmée par les faibles valeurs des erreurs statistiques appliquées ainsi que la bonne corrélation (R2 = 0,986) entre les données expérimentales et celles prédites par le modèle (Figure 5). Déterminée à partir de la forme linéaire du modèle le plus approprié, la valeur de la capacité d’adsorption expérimentale (qe,exp = 7,399 mg·g-1) s’accorde bien avec celle prédite par le modèle (qe,calc= 7,457 mg·g-1).
4.3. Isothermes d’adsorption
72En se servant de la figure 6, il est possible d’observer que la quantité adsorbée à l’équilibre (qe) augmente avec l’augmentation de la concentration en colorant (Ce), ce qui est conforme aux données bibliographiques : adsorption du BM par la bentonite (Hong et al., 2009), adsorption du 4-chlorophénol par le charbon actif préparé à partir de sciure de rotin (Hameed et al., 2008), adsorption du cuivre par le charbon actif issu de la coquille d’amande (Demirbas et al., 2008), adsorption des colorants basiques (bleu de méthylène, rouge basique 22, jaune basique 21) par le charbon actif (El Qada et al., 2008), etc.
73Comme on peut le constater globalement avec les allures des courbes de la figure 7 et surtout les données du tableau 3, le modèle de Freundlich est le plus approprié avec R² = 0,898, tandis que les constantes négatives du modèle de Langmuir impliquent l’inadéquation de celui-ci pour la description des données expérimentales (Uçar et al., 2011). Rappelons que le modèle de Freundlich, de nature empirique, est employé pour décrire l’adsorption hétérogène, alors que le modèle de Langmuir suggère que l’adsorption des molécules a lieu sur une surface homogène en monocouche sans interaction entre les molécules adsorbées (Hameed et al., 2007). Toutefois, la plupart des auteurs cités dans ce document trouvent généralement que l’isotherme d’adsorption est d’allure de type L, auquel est associé le modèle de Langmuir. Enfin, nos résultats (concernant l’allure de l’isotherme et le type de modèle) sont conformes à ceux communiqués par Estevinho et al. (2006) ayant travaillé sur l’adsorption du pentachlorophénol par la coquille d’amandes douces à l’état brut (sans aucun traitement d’activation, ni carbonisation).
74L’adéquation révélée ici est appuyée par la bonne corrélation entre (qe,exp) et (qe,calc) (Figure 8).
75Abréviations
76A : constante correspondant à l’énergie de liaison d’équilibre maximum (l·mg-1)
77ATD : analyse thermique différentielle
78ATG : analyse thermogravimétrique
79b : constante de Langmuir (l·mg-1)
80BASh : bitter almond shells (coquille d’amandes amères)
81BM : bleu de méthylène
82bT : chaleur d’adsorption (J·mol-1)
83CA : charbon actif
84CAa : coquille activée par l’acide
85CAb : coquille activée par la base
86C0: concentration en bleu méthylène (mg·l-1)
87Ce : concentration d’équilibre (mg·l-1) du bleu de méthylène
88CE : conductivité électrique (µS)
89Cd : teneur en cendres (%)
90D : diffusivité de matière (cm2·s-1)
91d : diamètre moyen des particules (cm)
92Dr : dureté (%)
93K1 : constante de vitesse de premier-ordre d’adsorption (1·min-1)
94K2 : constante de vitesse de deuxième-ordre d’adsorption (g·mg-1·min)
95KF : constante de de Freundlich (mg·g-1)
96m : masse de l’adsorbant (g)
97Q0 : capacité d’adsorption en monocouche (mg·g-1)
98qe : quantité du bleu de méthylène adsorbée à l’équilibre (mg·g-1)
99qt : quantité (mg/g) du bleu de méthylène adsorbée au temps
100r : masse volumique (g·cm-3)
101R : constante des gaz parfaits (8,314 J·mol-1·K-1)
102t : temps (min)
103T : température (°C)
104µ : coefficient de frottement statique
105q : angle dynamique du repos (°)
106v : volume ( l)
107α : taux initial d’adsorption (mg·g-1·min)
108β : constante de désorption (g·mg-1)
5. Conclusions
109Les résultats obtenus dans cette étude montrent qu’il est possible d’obtenir, à partir des coquilles d’amandes amères (sauvages), un charbon activé par voies chimiques alcaline (en utilisant KOH) ou acide (en utilisant H3PO4) et sans recours au procédé de carbonisation. En plus, le charbon final se caractérise par des propriétés physico-chimiques globalement comparables aux charbons classiques issus d’autres types de biomatériaux. L’adsorption correspondante est de type hétérogène.
110En conséquence, une telle valorisation des amandes amères qui restent une biomasse disponible et sous-utilisée, est de nature à susciter un intérêt auprès des différents secteurs industriels, ce qui peut contribuer à la sauvegarde de la biodiversité.
Bibliographie
Ahmedna M., Marshall W.E. & Rao R.M., 2000. Production of granular activated carbons from select agricultural by-products and evaluation of their physical, chemical and adsorption properties. Bioresour. Technol., 71, 113-123.
Ahmedna M. et al., 2004. The use of nutshell carbons in drinking water filters for removal of trace metals. Water Res., 38, 1062-1068.
Alhamed Y.A., 2009. Adsorption kinetics and performance of packed bed adsorber for phenol removal using activated carbon from dates’ stones. J. Hazard. Mater., 170, 763-770.
ASTM International, 2006. Standard test method for total ash content of activated carbon. Designation D4607-94. West Conshohocken, PA, USA: ASTM International.
Aygun A., Yenisoy-Karakas S. & Duman I., 2003. Production of granular activated carbon from fruit stones and nutshells and evaluation of their physical, chemical and adsorption properties. Microporous Mesoporous Mater., 66, 189-195.
Bulut Y. & Tez Z., 2007. Adsorption studies on ground shells of hazelnut and almond. J. Hazard. Mater., 149, 35-41.
Cetin E., Moghtaderi B., Gupta R. & Wall T.F., 2004. Influence of pyrolysis conditions on the structure and gasification reactivity of biomass chars. Fuel, 83, 2139-2150.
Chen Y. et al., 2011. Application studies of activated carbon derived from rice husks produced by chemical-thermal process. A review. Adv. Colloid Interface Sci., 163, 39-52.
Chien S.H. & Clayton W.R., 1980. Application of Elovich equation to the kinetics of phosphate release and sorption in soils. Soil Sci. Soc. Am. J., 44, 265-268.
Demirbas E., Kobya M. & Konukman A.E.S., 2008. Error analysis of equilibrium studies for the almond shell activated carbon adsorption of Cr(VI) from aqueous solutions. J. Hazard. Mater., 154, 787-794.
Demirbas E., Dizge N., Sulak M.T. & Kobya M., 2009. Adsorption kinetics and equilibrium of copper from aqueous solutions using hazelnut shell activated carbon. Chem. Eng. J., 148, 480-487.
El Qada E.N., Allen S.J. & Walker G.M., 2008. Adsorption of basic dyes from aqueous solution onto activated carbons. Chem. Eng. J., 135, 174-184.
Estevinho B.N., Ratola N., Alves A. & Santos L., 2006. Pentachlorophenol removal from aqueous matrices by sorption with almond shell residues. J. Hazard. Mater., 137, 1175-1181.
Freundlich H., 1907. Ueber die Adsorption in Loesungen. J. Phys. Chem., 57, 385-470.
Garnayak D.K., Pradhan R.C., Naik S.N. & Bhatnagar N., 2008. Moisture-dependent physical properties of jatropha seed (Jatropha curcas L.). Ind. Crops Prod., 27, 123-129.
Girgis B.S., Yunis S.S. & Soliman A.M., 2002. Characteristics of activated carbon from peanut hulls in relation to conditions of preparation. Mater Lett., 57, 164-172.
Hameed B.H., Ahmad A.L. & Latiff K.N.A., 2007. Adsorption of basic dye (methylene blue) onto activated carbon prepared from rattan sawdust. Dyes Pigm., 75, 143-149.
Hameed B.H., Chin L.H. & Rengaraj S., 2008. Adsorption of 4-chlorophenol onto activated carbon prepared from rattan sawdust. Desalination, 225, 185-198.
Haykiri-Acma H., Yaman S. & Kucukbayrak S., 2006. Gasification of biomass chars in steam-nitrogen mixture. Energy Convers. Manage., 47(7-8), 1004-1013.
Ho Y.S. & McKay G., 1999. Pseudo-second-order model for sorption processes. Process Biochem., 34, 451-465.
Hong S. et al., 2009. Adsorption thermodynamics of methylene blue onto bentonite. J. Hazard. Mater., 167, 630-633.
Ioannidou O. & Zabaniotou A., 2007. Agricultural residues as precursors for activated carbon production. A review. Renewable Sustainable Energy Rev., 11, 1966-2005.
Karaj S. & Mülle J., 2010. Determination of physical, mechanical and chemical properties of seeds and kernels of Jatropha curcas L. Ind. Crops Prod., 32, 129-138.
Lagergren S., 1898. About the theory of so called adsorption of soluble substances. Ksver Veterskapsakad Handl, 24, 1-6.
Langmuir I., 1918. Adsorption of gases on plain surfaces of glass mica platinum. J. Am. Chem. Soc., 40, 1361-1403.
Lanzetta M. & Di Blasi C., 1998. Pyrolysis kinetics of wheat and corn straw. J. Anal. Appl. Pyrol., 44, 181-192.
Lee J., Kim J. & Hyeon T., 2006. Recent progress in the synthesis of porous carbon materials. Adv. Mater., 18, 2073-2094.
Lua A.C., Yang T. & Guo J., 2004. Effects of pyrolysis conditions on the properties of activated carbons prepared from pistachio-nut shells. J. Anal. Appl. Pyrol., 72, 279-287.
Minkova V. et al., 2001. Effect of water vapour and biomass nature on the yield and quality of the pyrolysis products from biomass. Fuel Proc. Technol., 70(1), 53-61.
Nimkar M.P. & Chattopadhyay K.P., 2001. Some physical properties of green gram. J. Agric. Eng. Res., 80, 183-189.
Olivares-Marin M., Fernández-González C., Macías-García A. & Gómez-Serrano V., 2006. Preparation of activated carbons from cherry stones by activation with potassium hydroxide. Appl. Surf. Sci., 252, 5980-5983.
Prakash Kumar B.G., Shivakamy K., Miranda L.R. & Velan M., 2006. Preparation of steam activated carbon from rubberwood sawdust (Hevea brasiliensis) and its adsorption kinetics. J. Hazard. Mater. B, 136, 922-929.
Rivera-Utrilla J. et al., 2011. Activated carbon modifications to enhance its water treatment applications. An overview. J. Hazard. Mater., 187, 1-23.
Savova D. et al., 2001. Biomass conversion to carbon adsorbents and gas. Biomass Bioenergy, 21, 133-142.
Snell F.D. & Ettre L.S., 1968. Encyclopedia of industrial chemical analysis. New York, USA: John Wiley & Sons.
Soleimani M. & Kaghazchi T., 2008. Adsorption of gold ions from industrial wastewater using activated carbon derived from hard shell of apricot stones. An agricultural waste. Bioresour. Technol., 99, 5374-5383.
Sudaryanto Y. et al., 2006. High surface area activated carbon prepared from cassava peel by chemical activation. Bioresour. Technol., 97, 734-739.
Tempkin M.J. & Pyzhev V., 1940. Kinetics of ammonia synthesis on promoted iron catalysts. Acta Physiochim., 12, 217-222.
Toles C.A. et al., 2000. Acid-activated carbons from almond shells: physical, chemical and adsorptive properties and estimated cost of production. Bioresour. Technol., 71, 87-92.
Tsai W.T., Chang C.Y. & Lee S.L., 1997. Preparation and characterization of activated carbons from corn cob. Carbon, 35, 1198-1200.
Uçar B., Güvenç A. & Mehmetoğlu Ü., 2011. Use of aluminium hydroxide sludge as adsorbents for the removal of reactive dyes: equilibrium, thermodynamic, and kinetic studies. Hydrol. Curr. Res., 2(2), 1-8.
Urano K. & Tachikawa H., 1991. Process development for removal and recovery of phosphorus from waste water by a new adsorbent. II. Adsorption rates and breakthrough curves. Ind. Eng. Chem. Res., 30, 1897-1899.
Zhang T. et al., 2004. Preparation of activated carbon from forest and agricultural residues through CO2 activation. Chem. Eng. J., 105, 53-59.






