- Accueil
- Volume 19 (2015)
- Numéro 1
- Le genre Guibourtia Benn., un taxon à haute valeur commerciale et sociétale (synthèse bibliographique)
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Le genre Guibourtia Benn., un taxon à haute valeur commerciale et sociétale (synthèse bibliographique)

Notes de la rédaction
Reçu le 15 juin 2014, accepté le 9 décembre 2014
Résumé
Introduction. Connu comme étant un genre de grande importance socio-culturelle et économique, Guibourtia Benn. regroupe des espèces sœurs multi-usages à forte ressemblance morphologique inféodées à des climats et sols variés. Les densités des populations de ces espèces sont faibles et il urge qu’une attention particulière leur soit portée en raison de surexploitations locales.
Littérature. Cette revue bibliographique résume les informations disponibles sur les espèces du genre Guibourtia notamment en botanique, écologie, génétique, sylviculture et ethnobotanique. Elle démontre le caractère lacunaire des connaissances écologiques et sylvicoles sur le genre et la difficulté de différencier des espèces sœurs morphologiquement semblables. Une nouvelle clé de détermination des espèces du genre Guibourtia est également proposée.
Conclusions. Considérant le manque actuel d’informations, il est impossible de conclure sur le statut de conservation des différentes espèces et de proposer des mesures de gestion adaptées. Par ailleurs, la diversité spécifique au sein de ce genre ainsi que sa distribution au sein des biomes tropicaux en font un excellent modèle biologique permettant de comprendre les mécanismes historiques, biologiques et environnementaux à l'origine de la diversité des écosystèmes forestiers tropicaux.
Abstract
Guibourtia Benn.: a high conservation value genus. A review
Introduction. Known as a genus of great socio-cultural and economical importance, Guibourtia Benn. includes morphologically very similar multipurpose sister species, found in various habitats with different climate and soil conditions. In many places, Guibourtia is subject to local overexploitation by forest companies and local communities. As the population density of Guibourtia species is generally very low, it may be necessary to conduct scientific investigations that will provide valuable information for the management of the populations concerned.
Literature. This paper is based on an extensive literature review and summarizes the available information on the genus Guibourtia, in terms of botany, ecology, genetics, forestry and ethnobotany. Our review provided evidence that, to date, ecological and silvicultural knowledge regarding Guibourtia species is lacking and that it is very difficult to morphologically differentiate very similar sister species. In addition, we provide a new determination key for the genus Guibourtia.
Conclusions. Based on the available information, it is difficult to assess the conservation status of these taxa. Further investigations are needed to suggest appropriate management strategies for Guibourtia. Moreover, species diversity within this genus and its distribution in various tropical biomes make it an excellent biological model for understanding the historical, biological and environmental mechanisms that explain the diversity of tropical moist forests.
Table des matières
1. Introduction
1De la famille des Fabaceae (sous-famille des Caesalpinioideae), le genre Guibourtia Benn. compte 13 espèces en Afrique dont certaines à forte valeur culturelle (arbre sacré chez les Pygmées, par exemple) et commerciale (Benoit, 2011). Reconnus pour la qualité exceptionnelle de leur bois, les taxons d’Afrique centrale font l'objet d'un important commerce (ATIBT, 2010). Actuellement, il est toutefois difficile pour les exploitants forestiers de différencier certaines espèces, très similaires morphologiquement et dont les aires de distribution se chevauchent, ce qui facilite le commerce illégal (Betti, 2012). Le problème est en outre exacerbé par une importante demande des pays asiatiques, des densités très faibles et des aires de distribution souvent réduites. Actuellement, le manque de données sur l'écologie des espèces de Guibourtia semble être un handicap majeur à la définition de stratégies de gestion des populations et d'identification de statuts de conservation adéquats (IUCN Red List).
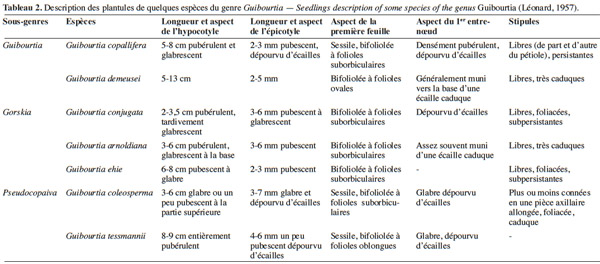
2Le présent article dresse une synthèse des connaissances scientifiques actuelles sur le genre Guibourtia et met en exergue les aspects méritant davantage d’investigations scientifiques. Les recherches ont été menées en utilisant la base de données Scopus, Google scholar et les ressources documentaires disponibles dans les bibliothèques de Gembloux Agro Bio-Tech (Université de Liège) et du Jardin botanique national de Belgique. Les mots-clés suivants en français – et leur équivalent en anglais – ont été utilisés : Guibourtia, bubinga, taxonomie, écologie, ethnobotanique, exploitation forestière, génétique, technologie du bois, commerce.
2. Origine et taxonomie du genre Guibourtia
2.1. Histoire taxonomique
3L'histoire du genre Guibourtia remonte à 1762 quand Linné décrit le genre Copaifera et désigne comme espèce-type Copaifera officinalis L. originaire du Brésil et à feuilles multifoliolées. En 1833, Moricand décrit Copaifera hymenaefolia Moric., un Copaifera américain à feuilles bifoliolées. En 1857, un nouveau genre, Guibourtia, est décrit en Afrique par John Joseph Bennett qui y rattache Copaifera copallina Baill. originaire de Sierra Leone et dont il fait l'espèce-type Guibourtia copallifera Benn. Le nom Guibourtia donné à ce genre est inspiré du nom du pharmacien français Nicolas Jean-Baptiste Gaston Guibourt (1790-1867) qui a mené des recherches sur le copal, une substance résineuse produite par certaines espèces de Guibourtia, utilisée en médecine et dans l'art (Glen, 2004). La légitimité taxonomique de ce nouveau genre fut contestée par Bentham (1865) dans une étude sur les légumineuses. Il estimait que la taille, la persistance des bractéoles et le nombre de folioles n'étaient pas suffisamment pertinents pour autoriser une subdivision du genre. Ainsi, Bentham (1865) et Kuntze (1891) élargirent le genre Copaifera en y incluant les espèces bifoliolées africaines. Par la suite, plusieurs espèces bifoliolées furent décrites tant en Amérique qu'en Afrique.
4Plus d'un demi-siècle après, toute la nomenclature des Guibourtia et Copaifera fut revisitée par Léonard. En 1949, cet auteur mena une étude taxonomique approfondie des espèces africaines du genre Copaifera et décida de restaurer le genre Guibourtia. Il montra qu'aux caractères, aisément observables relatifs au nombre et à la forme des folioles, s'ajoutent d'autres, non signalés par les travaux précédents, beaucoup plus constants et de valeurs taxonomiques manifestes, notamment la préfloraison du calice, la disposition des fleurs et l'anatomie du bois. En effet, il montra clairement que la préfloraison du calice est nettement imbriquée chez les espèces uni- et bifoliolées africaines, alors qu'elle est subvalvaire chez les espèces multifoliolées (Léonard, 1949). Quant à la disposition des fleurs le long de l'axe floral, elle consiste en deux rangs opposés avec de très jeunes inflorescences comprimées chez Copaifera et en plus de deux rangs avec de très jeunes inflorescences strobiliformes cylindriques chez Guibourtia (Figure 1). Le tableau 1 présente la liste des noms actuels validés et/ou reclassés des espèces du genre Guibourtia présentes en Afrique tropicale.
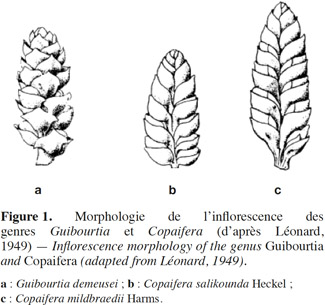
5En se basant sur les travaux de Normand (1948), Léonard (1949) nota que les Copaifera ont un bois avec les canaux sécréteurs verticaux disposés en zones plus ou moins concentriques, tandis que celui des Guibourtia en est dépourvu. Enfin, la répartition géographique des espèces fournit à Léonard (1949) quelques informations utiles. Du point de vue chorologique, il définit Copaifera comme étant un genre tropical surtout américain regroupant 35 espèces américaines et quatre espèces africaines, et Guibourtia comme un genre tropical principalement africain avec 13 espèces africaines et quatre espèces américaines.
6Par la suite, Léonard (1950) proposa de regrouper également sous Guibourtia les espèces des genres Gorskia (Bolle) et Pseudocopaiva (Britton & Wilson) qui ont été abaissés au même titre que Guibourtia au rang de sous-genre, le tout chapeauté par le genre Guibourtia. Cette classification en trois sous-genres Guibourtia, Gorskia et Pseudocopaiva était basée sur des caractères ayant trait aux fruits, graines, plantules et à l'anatomie du bois, mais elle restera peu utilisée (Tableau 1). Ce dernier travail de révision ne sembla pas satisfaire Dwyer (1951) qui estima que les Guibourtia d'origine américaine devaient appartenir au genre Copaifera, une hypothèse contredite par Voorhoeve (1965) et Normand et al. (1976). Finalement, Van der Maesen et al. (1996) considèrent que la systématique du genre mérite des réflexions complémentaires. Par exemple, ces auteurs ont noté que Léonard souhaitait reclasser certaines espèces – Guibourtia coleosperma (Benth.) J.Léonard, Guibourtia leonensis J.Léonard, Guibourtia pellegriniana J.Léonard et Guibourtia tessmannii (Harms) J.Léonard – dans le genre Pseudocopaiva Britton. Mais l'absence de caractères distinctifs au niveau des fleurs (texture, pubescence et coloration des sépales, longueur du style) et des organes végétatifs (nombre et forme des folioles) l’ont fait hésiter et renoncer finalement à cette réorganisation.
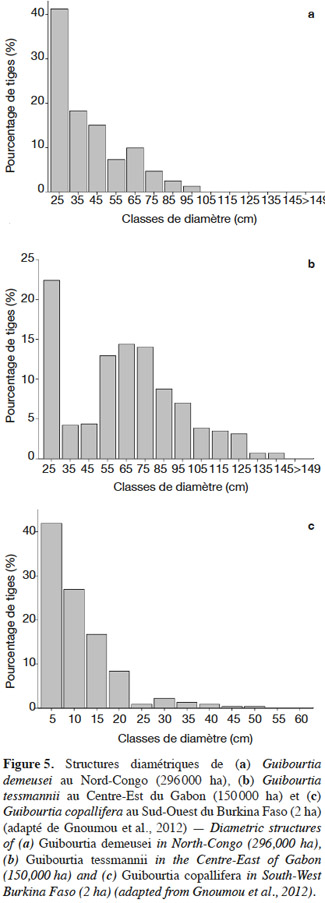
2.2. Les nouveaux apports de la génétique
7Selon Mangenot et al. (1957), le genre Guibourtia est diploïde avec 2n = 24 chromosomes. Il est phylogénétiquement proche des genres Hymenaea et Peltogyne, qui ensemble forment un clade bien résolu (Fougère-Danezan, 2006). Leur ancêtre commun serait le genre purement africain Daniellia Benn. (Fougère-Danezan et al., 2003). Guibourtia daterait d’environ 20 Ma, tandis que Hymenaea, Peltogyne et Daniellia dateraient d'environ 25 MA, 33 MA et 40 MA respectivement (Fougère-Danezan, 2006). Les travaux de Fougère-Danezan (2006) montrent également que le genre n’est monophylétique que si l’espèce Guibourtia ehie en est exclue. Cependant, l'auteur insiste sur la nécessité d'études phylogénétiques complémentaires. En dépit du fait qu'il ait eu recours à plusieurs séquences chloroplastiques et nucléaires des régions trnL, trnF et ITS, la phylogénie mériterait d'être vérifiée en utilisant les séquences des régions trnC et psbA, également recommandées en « barcoding » (Gonzalez et al., 2009 ; Tripathi et al., 2013).
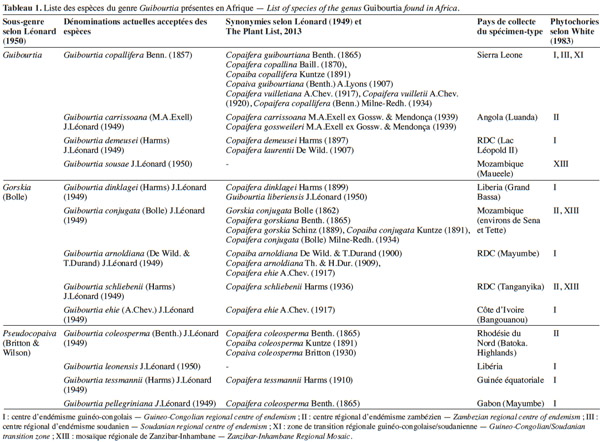
8Finalement, Guibourtia hymenaeifolia serait la seule espèce américaine (Fougère-Danezan, 2006) et serait une espèce sœur des Guibourtia africains (Crawford, communication personnelle). La séparation Afrique / Amérique au sein du genre daterait de 12 MA environ (Crawford, communication personnelle). Elle pourrait être issue d'évènements de dispersion sur une longue distance par les courants marins puisqu'elle est nettement postérieure à la fragmentation du Gondwana qui date de plus de 100 Ma (Thorne, 1973). Des études biogéographiques menées par Fougère-Danezan (2006) semblent confirmer cette hypothèse, démontrant que les fruits ou graines de certaines des espèces de Guibourtia ont la capacité de flotter ou peuvent être associés à des ensembles flottants. En conclusion, le genre serait bien d’origine africaine (Léonard, 1949 ; Fougère-Danezan, 2006 ; Ulibarri, 2008) où son aire de répartition s’étendrait sur 22 pays, du Sénégal jusqu’au Mozambique (Figure 2).
9Selon la classification phytogéographique de White (1983), le genre Guibourtia s’étend de la zone soudanienne à la Mosaïque régionale de Zanzibar-Inhambane (Tableau 1).
3. Description botanique des espèces africaines
10Les espèces africaines du genre Guibourtia sont des arbres ou des arbustes avec un bois dépourvu de canaux sécréteurs (Léonard, 1949). Les feuilles sont alternes, généralement composées de deux folioles falciformes opposées, acuminées, entières, souvent parsemées de ponctuations translucides, à stipules petites et stipelles nulles (Léonard, 1949 ; Léonard, 1950). Les inflorescences sont des panicules. Les fleurs hermaphrodites ont un réceptacle discifère sans pétales, à quatre sépales inégaux, à préfloraison nettement imbriquée avec des étamines libres dont le nombre varie de huit à dix et de un à deux (rarement quatre) ovules (Watson et al., 1993). Quant aux fruits, ils appartiennent à trois types distincts, à savoir :
11– indéhiscents, coriaces, à graines sans arille ;
12– indéhiscents, membraneux, à graines sans arille ;
13– déhiscents, épais, coriaces, à graines avec arille.
14Selon Léonard (1950), les espèces de ce genre, quoique bien distinctes pour un œil averti, demeurent morphologiquement très proches. Selon Taylor (1960), ces affinités morphologiques limiteraient considérablement les possibilités de détermination botanique sur base d’échantillons stériles.
3.1. Différenciation des espèces du genre Guibourtia
15L’annexe 1 résume les caractéristiques botaniques pouvant servir à distinguer les espèces africaines du genre Guibourtia. Cette distinction peut se faire sur base de deux types de traits qualitatifs et quantitatifs.
16La clé présentée ci-après permet de différencier les espèces en partant des caractéristiques chorologiques et végétatives. Pour les espèces les plus difficiles à distinguer sur base de ces seuls critères, sont ajoutées les particularités des fleurs et des fruits. La figure 3 présente les folioles, les fleurs et les fruits.


3.2. Description des plantules
17Chez de nombreux arbres tropicaux, la morphologie foliaire des plantules diffère nettement de celle des adultes et il importe donc d’y consacrer une attention particulière. Les individus du genre Guibourtia sont issus de plantules à germination épigée avec des cotylédons qui s'épanouissent au-dessus du sol et dont les deux premières feuilles sont alternes (Léonard, 1994). Elles se différencient des Copaifera par la présence :
18– d'une petite pointe entre les deux folioles de la première feuille des plantules,
19– d'une seconde petite pointe en face de ces deux folioles,
20– d'un bourgeon à l'aisselle de la première feuille (Figure 4).
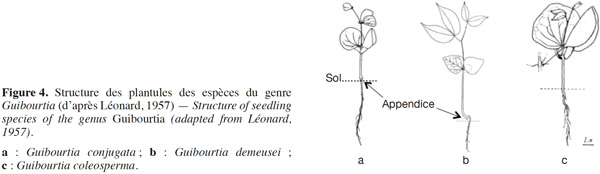
21Une telle structure commune à toutes les espèces des sous-genres décrits par Léonard (1957) n'a été rencontrée jusqu'à présent que chez les Trachylobium. Toutefois, les plantules des sous-genres Guibourtia et Gorskia restent différentes de celles du sous-genre Pseudocopaiva (Léonard, 1957). En effet, les premières possèdent un appendice typique au collet, contrairement aux deuxièmes qui en sont dépourvues (Léonard, 1957 ; Léonard, 1994). Le tableau 2 fait la synthèse de la description des plantules de sept espèces du genre Guibourtia étudiées par Léonard.
4. Écologie du genre Guibourtia
4.1. Exigences climatiques, topographiques, pédologiques et optimum de végétation
22En zone soudanienne, G. copallifera est la seule espèce rencontrée. Elle est établie sur des sols variés gréseux à argilo-limoneux (Aubréville, 1950 ; Burkill, 1995).
23En région guinéo-congolaise, Guibourtia demeusei est présente sur des sols hydromorphes (Léonard, 1950 ; Gillet, 2013) des forêts périodiquement inondées et marécageuses (Léonard, 1952 ; Vivien et al., 1985). Guibourtia pellegriniana, G. tessmannii et G. ehie sont des espèces de forêts denses humides sempervirentes (Vivien et al., 1985 ; Laird et al., 1996). Guibourtia pellegriniana est toutefois limitée aux forêts littorales du Cameroun et du Gabon (Souane, 1985). Guibourtia arnoldiana se rencontre sur des sols bien drainés jusqu’à 200 m d’altitude (Vivien et al., 1985). Elle est inféodée aux sols calcaires du versant du Mayumbe (Léonard, 1950) et vit dans l’écotone forêt-savane (Monteiro, 1962). Guibourtia leonensis et Guibourtia dinklagei sont des espèces de forêt dense sèche (Wilczek et al., 1952 ; Burkill, 1995).
24Les espèces de Guibourtia de la zone zambézienne et de la mosaïque régionale de Zanzibar-Inhambane sont localisées dans les formations décidues (Wilczek et al., 1952 ; Burke, 2006). Guibourtia carrissoana est un arbuste des zones littorales sèches semi-arides en Angola (Aubréville, 1970). Guibourtia coleosperma est une espèce xérophile retrouvée sur les sols sablonneux profonds (Giess, 1998) à une altitude allant de 750 à 1 400 m. Elle préfère des zones où la pluviométrie annuelle est comprise entre 650 et 1 100 mm et dont la température annuelle moyenne oscille entre 20 et 28 °C (Storrs, 1979). Guibourtia conjugata est un arbre de forêts claires ou de forêts sèches sur sols rocailleux, du niveau de la mer jusqu’à 1 500 m d’altitude (Aubréville, 1970). Guibourtia schliebenii et Guibourtia sousae sont également des espèces xérophiles, mais rencontrées au sud de la mosaïque régionale de Zanzibar-Inhambane à une pluviométrie inférieure à 750 mm et sur sol brun eutrophe (Bullock, 1995). Enfin, G. schliebenii préfère des forêts côtières (Léonard, 1950).
25Les espèces de Guibourtia ont des sensibilités variées au feu. Par exemple, G. ehie y est très sensible (Vivien et al., 1985), contrairement à G. coleosperma (Storrs, 1979).
4.2. Tempérament des espèces et structure des populations
26Guibourtia copallifera est une espèce héliophile sempervirente (White, 1983). Guibourtia tessmannii, G. pellegriniana et G. ehie sont vraisemblablement des espèces dont les exigences en lumière sont intermédiaires (Doucet, 2003). Pour Hawthorne (1995), ces espèces sont dites héliophiles non-pionnières. Guibourtia demeusei serait considérée comme une espèce sempervirente et tolérante à l’ombrage (Gillet, 2013). Guibourtia leonensis et G. arnoldiana seraient probablement des espèces héliophiles sempervirentes (Monteiro, 1962 ; Voorhoeve, 1965). Les Guibourtia de la zone zambézienne et de la mosaïque régionale de Zanzibar-Inhambane, G. carrissoana, G. coleosperma, G. conjugata, G. schliebenii et G. sousae seraient également des espèces héliophiles sempervirentes (Léonard, 1950 ; Brummitt et al., 2007).
27Les Guibourtia des forêts denses humides tropicales de terre ferme sont généralement très disséminés avec des densités faibles. Selon les données de plan d’aménagement forestier de certaines concessions forestières du Gabon et du Cameroun, les densités de G. tessmannii varient respectivement entre 0,035 à 0,231 tiges·ha-1 et 0,001 à 0,12 tiges·ha-1 pour les individus de DBH ≥ 20 cm (Doucet, communication personnelle). De telles informations ne sont pas disponibles pour les autres espèces.
28Ces faibles densités expliquent la difficulté de dresser la structure de population de ces taxons. La figure 5 donne néanmoins quelques exemples. Les trois structures globalement décroissantes indiquent a priori une bonne régénération puisque les tiges de faibles diamètres sont abondantes (Figures 5a, 5b et 5c).
4.3. Phénologie et dispersion
29Peu d'auteurs se sont intéressés à ces aspects. On sait toutefois que G. copallifera fleurit en fin de saison des pluies, de janvier à février (Arbonnier, 2004). Selon Aubréville (1968) au Gabon, G. demeusei et Guibourtia arnoldiana fleurissent pendant la grande saison des pluies (septembre à décembre). Les travaux de Doucet (2003) ont décrit la phénologie de G. ehie. Il en ressort que le pic de floraison pour cette espèce s’observe vers la fin de la saison sèche (septembre à décembre). Au Libéria et en Côte d'Ivoire, les arbres de G. ehie fleurissent au début de la saison sèche (novembre à décembre) et les fruits mûrissent en saison pluvieuse, entre janvier et février (Aubréville, 1970). Il existerait donc probablement un conservatisme de ces caractères de floraison et de fructification sur l’aire de répartition de cette espèce. En ce qui concerne G. tessmannii et G. pellegriniana, la fructification est étendue de la petite saison des pluies à la grande saison sèche au Gabon, de décembre à juillet (Aubréville, 1968). Au Cameroun, G. tessmannii fructifie pendant la saison pluvieuse (aout) (Aubréville, 1970). La floraison de G. leonensis s’effectue à la fin de la saison des pluies (septembre à décembre) et la fructification démarre pendant la saison sèche, de janvier à mars (Savill et al., 1967).
30Contrairement aux espèces d’Amérique, dont certains agents responsables de la pollinisation sont bien identifiés, ceux qui participent à la pollinisation des espèces d’Afrique restent peu connus. Guibourtia hymenaeifolia est en effet pollinisé par l’abeille Apis mellifera adansonii qui est capable d’assurer le transport du pollen sur plusieurs kilomètres (Ojeda-Camacho et al., 2013). Il est probable que les espèces africaines de Guibourtia soient aussi pollinisées par des Apidae (Motte-Florac, 1980).
31Concernant la dispersion des diaspores, les connaissances sont tout aussi lacunaires. On peut supposer que le vent intervient dans la dispersion des gousses coriaces indéhiscentes de G. copallifera et G. ehie (Burkill, 1995). Par contre, lorsque les gousses sont arillées, on peut supposer une dispersion de type zoochore (Gautier-Hion et al., 1985).
5. Qualités technologiques et sylviculture des espèces de Guibourtia
5.1. Qualités technologiques
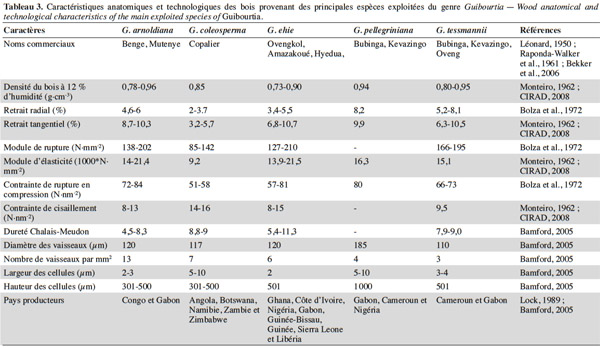
32L’anatomie des Guibourtia a été relativement bien décrite par Bamford (2005). Les essences principales productrices de bois sont G. arnoldiana, G. coleosperma, G. ehie, G. tessmannii et G. pellegriniana (Lemmens et al., 2012). Le tableau 3 présente les caractéristiques anatomiques et technologiques les plus importantes de leur bois. Celui-ci est en général stable, lourd, dense, dur, résistant aux champignons et aux termites. Il sèche bien, à condition que l’opération soit faite lentement, ensuite il acquiert une bonne stabilité (CTFT, 1983). L'aubier est blanchâtre, plutôt épais et son grain varie de fin à moyen (Benoit, 2011). Selon cette dernière source, les utilisations du bois varient d’une espèce à une autre. Globalement, les espèces de Guibourtia sont sollicitées en menuiserie, ébénisterie de luxe, artisanat, construction navale et chemins de fer, mais aussi en fabrication d’instruments de musique (guitare, harpe, flûte, tambour, etc.) (Léonard, 1950 ; CIRAD, 2008). Il existe une différence assez nette du point de vue texture et couleur du bois entre espèces (Simpson et al., 1999).
5.2. Sylviculture
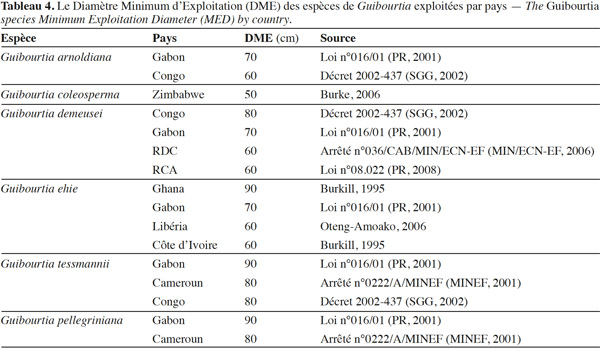
33L’exploitation forestière en Afrique centrale et de l’Ouest est sujette à une série de mesures légales censées assurer une gestion durable. Sur le plan technique, l’une des contraintes imposées aux exploitants est la fixation d’un Diamètre Minimum d’Exploitation (DME). Le tableau 4 donne les DME en fonction des espèces et des pays. Ces diamètres doivent être revus à la hausse par les exploitants s'ils ne permettent pas une reconstitution suffisante après une première rotation. Mais le principal défaut de ces valeurs est qu’elles ne sont généralement pas établies sur une base scientifique. Il faudrait effectivement que les diamètres de fructification soient pris en compte afin de garantir le maintien de semenciers. Malheureusement, de telles données font défaut pour les espèces du genre Guibourtia.
34La sylviculture des espèces du genre en est à ses balbutiements. Des essais de reboisement ont été effectués avec G. ehie à l’Ouest du Gabon. Après six années d’observation, Zaou et al. (1998) ont montré que les plants avaient un accroissement moyen en hauteur de 1,42 m par an dans le sous-bois et 1,45 m par an en plein éclairement. Quant à l’accroissement moyen en diamètre, il était de 1,15 m par an et 1,05 m par an respectivement dans le sous-bois et en plein éclairement. Des travaux similaires sont en cours dans le centre du Gabon (Doucet, communication personnelle).
6. Le commerce international du bois de Guibourtia
35Reconnus pour la qualité exceptionnelle de leur bois d’œuvre, les Guibourtia sont commercialisés sous les noms de Bubinga, Kevazingo, Ovengkol, Amazakoue ou African rosewood. Ils font l'objet d'un important commerce. Selon ATIBT (2010), l'exportateur le plus important est le Gabon. Il commercialise ses bois vers 10 pays principaux : Chine, Hong-Kong, Japon, Italie, Belgique, Turquie, États-Unis, Portugal, Espagne, Angleterre (Figure 6).
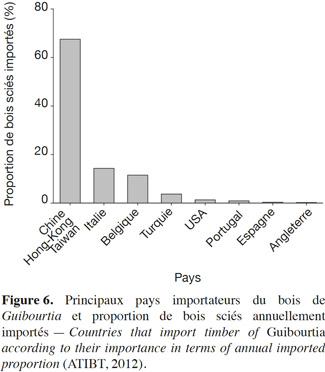
36Il est à noter que le continent asiatique est le principal importateur des bois de Guibourtia. Le Gabon en a exporté près de 90 000 m3 par an sous forme de grumes de 2007 à 2010. Suite à l'interdiction d'exporter du bois non transformé, instaurée dans ce pays en 2010, seuls des bois sciés ont été exportés entre 2011 et 2012, à raison de 11 000 m3 par an. Au cours de cette même période, le Cameroun, la Guinée Équatoriale et la RDC n’ont chacun exporté que de 350 à 1 580 m3 par an de bois sciés (ATIBT, 2008 ; ATIBT, 2009 ; ATIBT, 2010 ; ATIBT, 2012). En Côte d’Ivoire, G. ehie fut un bois très recherché et sa production entre 1970 et 1974 est estimée à 36 000 m3 de bois ronds (Aubréville, 1959). Aujourd'hui, le bois de G. ehie a été hissé au rang de bois d’exportation de première qualité au Ghana (Lemmens et al., 2012).
37Les autres espèces sont actuellement moins valorisées qu’elles ne le furent par le passé. En 1960, 6 000 m3 de bois de G. arnoldiana ont été exportés par le Congo et en 1983, 10 000 m3 par le Gabon (Normand et al., 1976). Le bois de cette espèce possède des propriétés technologiques proches de celles de l’iroko (Milicia excelsa [Welw.] C.C.Berg) et du teck (Tectona grandis L.f) (Fouarge et al., 1970).
7. Utilisations traditionnelles
38Toutes les espèces de Guibourtia sont productrices de copal, une résine fraiche, translucide, de couleur ambrée ou jaune clair, à odeur parfumée (Léonard, 1950). Il s’agit d’une substance résineuse appelée « Guibourtacacidin » qui est localisée dans le cœur du bois des Guibourtia (Roux, 1959). Léonard (1950) a utilisé le terme de copal pour désigner ces résines dont les propriétés (dureté, solubilité, etc.) sont favorables, entre autres, à la production de laques et de vernis. L'utilisation de ce copal est avérée depuis plusieurs millénaires. Pendant l’époque du Moyen Empire (2022 à 1786 avant J.C.), les Égyptiens l'ont utilisé pour la momification des morts (Aufrère, 1983). À l'époque coloniale, les pygmées collectaient le copal pour les essarteurs qui le revendaient aux colons. Ce produit était utilisé dans l'industrie des vernis, mais a été finalement remplacé par des résines synthétiques (Gillet, 2013). Aujourd’hui, il pourrait présenter divers intérêts pour les industries pharmaceutiques, cosmétiques et surtout pour l’artisanat (Gillet, 2013).
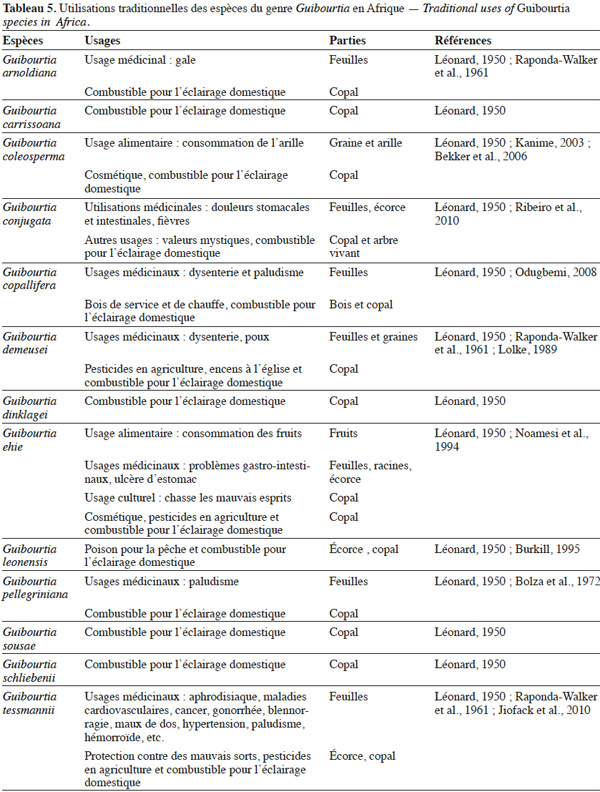
39Le Bubinga, dénomination courante des Guibourtia des forêts d’Afrique Centrale, surnommé le géant de la forêt, est un arbre fétiche ou sacré pour les pygmées (Bahuchet, 1985). Diverses parties (écorce, racines, sève et fruits) sont utilisées pour divers usages (Adjanohoun, 1984 ; Fuendjiep et al., 2002 ; Ihenyen et al., 2009). Le tableau 5 fait la synthèse de ces différentes utilisations traditionnelles.
8. Quel statut de conservation pour les espèces du genre Guibourtia ?
40Le manque de données écologiques sur les Guibourtia est la cause principale du faible niveau d’évaluation des taxa de ce genre par l’UICN. En effet, à part G. ehie (catégorie IUCN : Least concern) et G. schliebenni (catégorie IUCN : Vulnerable), les autres espèces n’ont pas fait l’objet d’une évaluation de leur statut de conservation (Contu, 2012). Pourtant, des menaces localement importantes existent. Ainsi, G. copallifera est menacé par les feux de végétation, la surexploitation du bois et de la résine au Burkina Faso (Gnoumou et al., 2012). L’effet combiné de ces facteurs en fait une espèce à haut risque d’extinction (Begon et al., 2006). En Afrique centrale, plus particulièrement au Cameroun, l’exploitation illégale du bois, exporté vers l’Asie, fait subir aux Bubinga une pression considérable dont l’ampleur nécessiterait d’être précisée.
9. Conclusions
41Il ressort de cette synthèse bibliographique que les connaissances restent globalement limitées sur les espèces du genre Guibourtia. Si les propriétés technologiques de certaines espèces, du fait qu’elles sont exploitées pour leur bois d’œuvre, sont assez bien documentées, la présente synthèse démontre que la littérature relative aux aspects écologiques est très pauvre.
42On retiendra particulièrement que le genre Guibourtia comporte plusieurs espèces sœurs morphologiquement semblables, rassemble des espèces rencontrées dans des formations végétales contrastées (forêt et savane) et regroupe des espèces inféodées à des sols différents (sableux, argilo-limoneux, calcaire, hydromorphe). Ces caractéristiques, parfois très différentes, font de ce genre un modèle particulièrement intéressant pour aborder les mécanismes de spéciation et d'adaptation écologique.
43Par ailleurs, les caractères botaniques pouvant servir sur le terrain à distinguer des espèces en sympatrie sont soit rares, soit difficilement observables, quand leur pouvoir de discrimination n’est pas simplement limité. Par exemple, il n’est pas possible d’avoir à disposition en tout temps les fleurs de G. tessmannii et de G. pellegriniana pour les différencier. Il est donc important de compléter les descriptions botaniques. À tout le moins, il importerait d’apporter des éléments scientifiques nouveaux relatifs à la délimitation botanique des Guibourtia de forêt, grâce aux facilités désormais offertes par la génétique moléculaire ou la physiologie. Dans un second temps, sur base des données environnementales (climatiques, édaphiques) et de modèles de distribution passée et présente des populations, il serait possible d’évaluer la dynamique probable d’espèces de ce genre dans un contexte d’exploitation forestière et de changement climatique. Ces informations sont les préalables à toute volonté de gérer durablement les populations et de statuer sur les statuts de conservation des espèces.
Remerciements
44Nous remercions l’Université de Liège (Belgique), le Fonds de la Recherche Scientifique (F.R.S.), le Fonds National de la Recherche Scientifique (FNRS)(subvention FRFC 2.4577.10) et l’ASBL Nature+ (Belgique) pour leurs soutiens scientifique et financier. Que le Professeur Achille Assogbadjo, le Professeur Rachidatou Sikirou, Dr Orou Gaoué, Dr Valentin Kindomihou, Jean-Yves Devleeschouwer, Michèle Federspiel, Achille Biwolé et Armel Loïc Donkpêgan Sègbédji soient remerciés pour leurs divers conseils et contributions.
Bibliographie
Adjanohoun E.J., 1984. Contribution aux usages ethnobotaniques et floristiques du Gabon. Paris : ACCT.
Arbonnier M., 2004. Trees, shrubs and lianas of West African dry zones. Versailles, France : Éditions Quæ.
ATIBT (Association Technique Internationale des Bois Tropicaux), 2008. La lettre de l'ATIBT n° 28 : statistiques 2007. Paris : ATIBT.
ATIBT (Association Technique Internationale des Bois Tropicaux), 2009. La lettre de l'ATIBT n° 30 : statistiques 2008. Paris : ATIBT.
ATIBT (Association Technique Internationale des Bois Tropicaux), 2010. La lettre de l'ATIBT n° 32 : statistiques 2009. Paris : ATIBT.
ATIBT (Association Technique Internationale des Bois Tropicaux), 2012. La lettre de l'ATIBT n° 34 : statistiques 2010. Paris : ATIBT.
Aubréville A., 1950. Flore forestière soudano-guinéenne. Paris : Société d'éditions géographiques, maritimes et coloniales.
Aubréville A., 1959. La flore forestière de la Côte d’Ivoire. Vol. I. 2e éd. révisée. Publication n° 15. Nogent-sur-Marne, France : Centre Technique Forestier Tropical.
Aubréville A., 1968. Légumineuses. Césalpinioidées. Flore du Gabon. Vol. 15. Paris : Museum National d’Histoire Naturelle, 111-118.
Aubréville A., 1970. Légumineuses. Césalpinioidées. Flore du Cameroun. Vol. 9. Paris : Museum National d’Histoire Naturelle.
Aufrère S., 1983. Études de lexicologie et d'histoire naturelle. I-III. Bull. Inst. Fr. Archéologie Orientale Le Caire, 83, 1-31.
Bahuchet S., 1985. Les Pygmées Aka et la forêt centrafricaine. Ethnologie écologique. Paris : SELAF.
Bamford M.K., 2005. Early Pleistocene fossil wood from Olduvai Gorge, Tanzania. Quat. Int., 129(1), 15-22.
Begon M., Townsend C.R. & Harper J.L., 2006. Ecology: from individuals to ecosystems. Oxford, UK: Blackwell Publishing Ltd
Bekker M., Bekker R. & Brandt V.E., 2006. Two flavonoid glycosides and a miscellaneous flavan from the bark of Guibourtia coleosperma. Phytochemistry, 67(8), 818-823.
Benoit Y., 2011. Le guide des essences de bois : 74 essences, les choisir, les reconnaître, les utiliser-13 nouvelles essences. Paris : Éditions Eyrolles.
Bentham G., 1865. Tropical Leguminosae. Trans. Linn. Soc. London, 25(2), 316.
Betti J.L., 2012. Background information on the conservation status of Bubinga and Wenge tree species in Africa countries. Douala, Cameroun: University of Douala.
Bolza E. & Keating W.G., 1972. African timbers: the properties, uses and characteristics of 700 species. Melbourne, VIC, Australia: Division of Building Research, Commonwealth Scientific and Industrial Research Organization
Brenan J.P.M., Polhill R.M., Milne-Redhead E. & Hubbard C.E., 1959. Flora of tropical East Africa: Leguminosae. PICCIN.
Brummitt R., Chikuni A., Lock J. & Polhill R., 2007. Leguminosae, subfamily Caesalpinioideae. Flora Zambesiaca, 3(2), 1-218.
Bullock S.H., 1995. Seasonally dry tropical forests. Cambridge, UK: Cambridge University Press.
Burke A., 2006. Savanna trees in Namibia. Factors controlling their distribution at the arid end of the spectrum. Flora, 201(3), 189-201.
Burkill H.M., 1995. The useful plants of West Tropical Africa. Families J-L. 2nd ed. Kew, UK: Royal Botanic Gardens.
CIRAD (Centre de coopération Internationale en Recherche Agronomique pour le Développement), 2008. Fiche technique de Bubinga. Fiche n° 139 : Tropix 6.0. Caractéristiques technologiques de 245 essences tropicales. Montpellier, France : CIRAD.
Coates Palgrave K., 2002. Trees of Southern Africa. 3rd ed. Cape Town, South Africa: Struik.
Contu S., 2012. Guibourtia ehie. The IUCN red list of threatened species. Version 2014.3, http:www.iucnredlist.org, (19 novembre 2014).
CTFT (Centre Technique Forestier Tropical), 1983. Bois tropicaux. Versailles, France : Éditions Quæ.
Doucet J.L., 2003. L’alliance délicate de la gestion forestière et de la biodiversité dans les forêts du centre du Gabon. Thèse de doctorat : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Dwyer J.D., 1951. The central American, west Indian, and South American species of copaifera (Caesalpiniaceae). Brittonia, 7(3), 143-172.
Fouarge J., Quoilin J. & Roosen P., 1970. Essais physiques, mécaniques et de durabilité de bois de la République démocratique du Congo. Bruxelles : Institut national pour l'étude agronomique du Congo.
Fougère-Danezan M., 2006. Phylogénie moléculaire et morphologique des Detarieae résinifères (Leguminosae: Caesalpinioideae) : contribution à l'étude de l'histoire biogéographique des légumineuses. Thèse de doctorat : Université Toulouse III - Paul Sabatier 1 (France) ; Université de Montréal (Canada).
Fougère-Danezan M., Maumont S. & Bruneau A., 2003. Phylogenetic relationships in resin-producing Detarieae inferred from molecular data and preliminary results for a biogeographic hypothesis. Adv. Legume Syst., 10, 161-180.
Fuendjiep V. et al., 2002. Chalconoid and stilbenoid glycosides from Guibourtia tessmanii. Phytochemistry, 60(8), 803-806.
Gautier-Hion A. et al., 1985. Fruit characters as a basis of fruit choice and seed dispersal in a tropical forest vertebrate community. Oecologia, 65(3), 324-337.
Giess W., 1998. A preliminary vegetation map of Namibia. Windhoek, Namibia: Namibia Scientific Society.
Gillet J.F., 2013. Les forêts à Marantaceae au sein de la mosaïque forestière du Nord de la République du Congo : origines et modalités de gestion. Thèse de doctorat : Université de Liège - Gembloux Agro-Bio Tech (Belgique).
Glen H.F., 2004. Sappi what's in a name: the meanings of the botanical names of trees. Johannesburg, South Africa: Jacana Media.
Gnoumou A., Bognounou F., Hahn K. & Thiombiano A., 2012. A comparison of Guibourtia copallifera Benn. stands in South West Burkina Faso – community structure and regeneration. J. For. Res., 23(1), 29-38.
Gomes e Sousa A.F., 1966. Dendrologia de Moçambique. Estudo geral. Moçambique: Instituto de Investigaç o Agronómica de Moçambique.
Gonzalez M.A. et al., 2009. Identification of Amazonian trees with DNA barcodes. PLoS one, 4(10), e7483.
Hawthorne W., 1995. Ecological profiles of Ghanaian forest trees. Oxford, UK: University of Oxford, Oxford Forestry Institute, Department of Plant Sciences.
Ihenyen J., Okoegwale E. & Mensah J., 2009. Composition of tree species in Ehor forest reserve, Edo State, Nigeria. Nature Sci., 7(8), 8-18.
Jiofack T. et al., 2010. Ethnobotanical uses of medicinal plants of two ethnoecological regions of Cameroon. Int. J. Med. Sci., 2(3), 60-79.
Kanime N., 2003. Woody resource of Ncamangoro community forest. Windhoek: Ministry of Environment and Tourism, Directorate of Forestry.
Kuntze O., 1891. 1891-1898. Revisio generum plantarum. Part I. Leipzig, Germany: Arthur Felix.
Laird S.A. & Sunderland T., 1996. The over-lapping uses of “medicinal” species in South West Province, Cameroon: implications for forest management. Paper presented at the Society of Economic Botany Annual Meeting, London, July 1996.
Lemmens R., Louppe D. & Oteng-Amoako A., 2012. Bois d’oeuvre 2. Wageningen, Pays-Bas : PROTA.
Léonard J., 1949. Notulae systematicae IV (Caesalpiniaceae-Amherstieae africanae americanaeque). Bull. Jardin Bot. Natl. Belg., 19, 383-408.
Léonard J., 1950. Notulae systematicae IX. Nouvelles observations sur le genre Guibourtia (Caesalpiniaceae). Bull. Jardin Bot. Natl. Belg., 20, 269-284.
Léonard J., 1952. Notulae systematicae XIII. Caesalpiniaceae africanae (Cynometra, Didelotia, Zingania, Cryptosepalum, Pynaertiodendron). Bull. Jardin Bot. Natl. Belg., 22(3/4), 201-210.
Léonard J., 1957. Genera des Cynometeae et des Amhestieae africaines: (Leguminosae -Caesalpinioideae) ; essai de blastogénie appliquée à la systématique. Mem. Acad. R. Belg. Cl. Sci., 30(2), 1-314.
Léonard J., 1994. Nouveaux apports de la blastogénie à la délimitation générique des Caesalpiniaceae africaines (Detariea et Amherstieae). Bull. Jardin Bot. Natl. Belg., 63(3-4), 357-395.
Linné C., 1762. Species Plantarum. 2nd ed. Vol. 1. Holmiae.
Lock J.M., 1989. Legumes of Africa: a check-list. Kew, UK: Royal Botanic Gardens.
Mangenot S. & Mangenot G., 1957. Nombres chromosomiques nouveaux chez diverses dicotylédones et monocotylédones d'Afrique occidentale. Bull. Jardin Bot. Natl. Belg., 27(4), 639-654.
Mayaux P., Bartholomé E., Fritz S. & Belward A., 2004. A new land‐cover map of Africa for the year 2000. J. Biogeogr., 31(6), 861-877.
MIN/ECN-EF (Ministère de l’Environnement, Conservation de la Nature, Eaux et Forêts), 2006. Arrêté ministériel n° 036/CAB/MIN/ECN-EF/2006 du 5 octobre 2006 fixant les procédures d’élaboration, d’approbation et de mise en œuvre des plans d’aménagement des concessions forestières de production des bois d’œuvre. Kinshasa : MIN/ECN-EF .
MINEF (Ministère de l’Environnement et des Forêts), 2001. Arrêté n° 0222/A/MINEF du 25 mai 2001 fixant les procédures d’élaboration, d’approbation, de suivi et de contrôle de la mise en œuvre des plans d’aménagement des forêts de production du domaine forestier permanent. Yaoundé: MINEF.
Monteiro R.F.R., 1962. Le massif forestier du Mayumbe angolais. Bois For. Trop., 82, 3-17.
Motte-Florac E., 1980. Les plantes chez les pygmées Aka et les Monzombo de La Lobaye (Centrafrique) : contribution à une étude ethnobotanique comparative chez des chasseurs-cueilleurs et des pêcheurs cultivateurs vivant dans un même milieu végétal. Leuven, Belgique : Peeters Publishers.
Noamesi B.K. et al., 1994. Antiulcerative properties and acute toxicity profile of some African medicinal plant extracts. J. Ethnopharmacol., 42(1), 13-18.
Normand D., 1948. Vrais et faux Tchitola du Mayombe. Bois For. Trop., 6, 145-157.
Normand D. & Paquis J., 1976. Manuel d’identification des bois commerciaux. Vol. 2. Afrique guinéo-congolaise. Nogent-sur-Marne, France : CTFT.
Odugbemi T., 2008. A textbook of medicinal plants from Nigeria. Lagos, Nigeria: University of Lagos Press.
Ojeda-Camacho M., Kjær E. & Philipp M., 2013. Population genetics of Guibourtia chodatiana (Hassl.) J.Leonard, in a dry Chiquitano forest of Bolivia. Forest Ecol. Manage., 289, 525-534.
Oteng-Amoako A., 2006. 100 Tropical African timber trees from Ghana.
PR (Présidence de la République), 2001. Loi n° 016/01 du 31 décembre 2001 portant code forestier en République gabonaise.
PR (Présidence de la République), 2008. Loi n° 08/022 du 17 octobre 2008 portant code forestier de la République centrafricaine.
Raponda-Walker A. & Sillans R., 1961. Les plantes utiles du Gabon. Libreville : Édition Sépia.
Ribeiro A., Romeiras M.M., Tavares J. & Faria M.T., 2010. Ethnobotanical survey in Canhane village, district of Massingir, Mozambique: medicinal plants and traditional knowledge. J. Ethnobiol. Ethnomed., 6, 33.
Robyns W., 1949. Une flore du Congo Belge et du Ruanda-Urundi. Bull. Jardin Bot. Natl. Belg., 19, 231-235.
Roux D., 1959. Flavan-3.4-diols and leuco-anthocyanidins of Guibourtia spp. Nature, 183, 890-891.
Savill P. & Fox J., 1967. Trees of Sierra Leone. Freetown: Forest Department.
SGG (Secrétariat Général du Gouvernement), 2002. Décret n° 2002-437 du 31 décembre 2002 fixant les conditions de gestion et d’utilisation des forêts. République du Congo.
Simpson W. & TenWolde A., 1999. Physical properties and moisture relations of wood. Chapter 3. In: Wood handbook—wood as an engineering material. Report FPL–GTR-113. Madison: US Department of Agriculture, Forest Service, Forest Products Laboratory.
Souane T., 1985. Manual of dendrology, Cameroon. Québec, Canada: Groupe Poulin, Thériault Ltée.
Storrs A.E.G., 1979. Know your trees: some of the common trees found in Zambia. Ndola, Zambia: Forest Department.
Taylor C.J., 1960. Synecology and silviculture in Ghana. Edinburgh: Nelson.
The Plant List, 2013. Version 1, http://www.theplantlist.org/, (2 octobre 2014).
Thorne R.F., 1973. Floristic relationships between tropical Africa and tropical America. In: Meggers B.J., Ayensu E.S. & Duckworth W.D., eds. Tropical forest ecosystems in Africa and South America: a comparative review. Washington: Smithsonian Institution Press, 27-47.
Tripathi A.M. et al., 2013. The internal transcribed spacer (ITS) region and trnhH-psbA are suitable candidate loci for DNA barcoding of tropical tree species of India. PloS One, 8(2), e57934.
Ulibarri E.A., 2008. Los géneros de Caesalpinioideae (Leguminosae) presentes en Sudamérica. Darwiniana, 46(1), 69-163.
Van der Maesen L., Van der Burgt X. & de Rooy J.V.M., 1996. The biodiversity of African plants. Proceedings of the 14th AETFAT Congress, 22-27 August 1994, Wageningen, The Netherlands. Dordrecht, The Netherlands: Kluwer Academic Publishers.
Vivien J. & Faure J.J., 1985. Arbres des forêts denses d'Afrique Centrale. Paris : ACCT.
Voorhoeve A.G., 1965. Liberian high forest trees. Wageningen, The Netherlands: Centrum voor landbouwpublikaties en landbouwdocumentatie.
Watson L. & Dallwitz M., 1993. The genera of Leguminosae-Caesalpinioideae and Swartzieae: descriptions, identification, and information retrieval, http://www.delta-intkey.com/caes/en/, (18 décembre 2014).
White F., 1983. The vegetation of Africa, a descriptive memoir to accompany the UNESCO/AETFAT/UNSO vegetation map of Africa (3 Plates, Northwestern Africa, Northeastern Africa, and Southern Africa, 1: 5,000,000). Paris : United Nations Educational, Scientific and Cultural Organization.
Wilczek R. et al., 1952. Caesalpiniaceae. In: Robyns W. et al., eds. Flore du Congo belge et du Ruanda-Urundi. Spermatophytes. Vol. 3. Bruxelles : INEAC, 234-554.
Zaou K.P., Nze Nguema S., Mapaga D. & Deleporte P., 1998. Croissance de 13 essences de bois d'œuvre plantées en forêt gabonaise. Bois For. Trop., 256, 21-33.






