- Accueil
- volume 10 (2006)
- numéro 2
- Etude des caractéristiques botaniques, agronomiques et de la biologie florale du melon africain (Cucumis melo L. var. agrestis Naudin, Cucurbitaceae)
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Etude des caractéristiques botaniques, agronomiques et de la biologie florale du melon africain (Cucumis melo L. var. agrestis Naudin, Cucurbitaceae)

Notes de la rédaction
Reçu le 30 septembre 2005, accepté le 21 novembre 2005
Résumé
Le melon africain, Cucumis melo var. agrestis, est une espèce cultivée dont les graines à l’état séché sont utilisées pour faire la sauce pistache, un mets très prisé en Côte d’Ivoire. L’espèce reste cependant peu étudiée contrairement aux espèces de melon cultivées dans les pays tempérés. Les caractéristiques agromorphologiques de C. melo var. agrestis ont été étudiées à partir de huit caractères : le taux de germination, le temps d’émergence, la date de floraison, la durée du cycle, le poids des baies matures, le nombre moyen de graines par baie, le poids de 100 graines et la forme des graines. La biologie florale et le système de reproduction ont été étudiés à l’aide de 19 paramètres. Les résultats de ces études ont montré que C. melo var. agrestis a un cycle de développement de 110 à 150 jours selon les saisons. Le nombre moyen de baies par plante est variable (5 à 15) et la production en graines par baie est faible (6,83 %). Le melon africain est une espèce andromonoïque avec un décalage phénologique entre l’apparition des fleurs mâles et hermaphrodites. Le pollen de la fleur hermaphrodite est viable et les stigmates sont réceptifs avant l’ouverture de la fleur. Les implications de la biologie florale sur le système de reproduction sont discutées dans une perspective d’amélioration génétique du rendement et d’étude du flux génique entre individus au sein de la culture.
Abstract
Study of botanic, agronomic characters and floral biology of African melon (Cucumis melo L. var. agrestis Naudin, Cucurbitaceae). African melon, Cucumis melo var. agrestis, is a cultivated crop for which dried seeds are used in preparation of sauce pistachio, a valuable food in Côte d’Ivoire. Few studies are concerned with this crop as compared to melon species cultivated in temperate countries. Agronomic and morphological characteristics of C. melo var. agrestis are studied based on eight characters: germination rate, emergence time, date of flowering, duration of life cycle, weight of mature berries, mean number of seeds per berry, weight of 100 seeds and seeds shape. Floral biology and mating system are studied on the basis of 19 parameters. Results of these studies showed that C. melo var. agrestis has a life cycle duration of 110 to 150 days varying with seasons. The mean number of berries per plant is variable (5 to 15) and the percentage of seeds per berry is low (6,83%). African melon is andromonoecious with a phenological interval between male and hermaphrodite flowers occurrence. The pollen grains of hermaphrodite flowers are viable and the stigmata are mature before flowers are opening. The implications of floral biology on the mating system are discussed in view of yield breeding and study of gene flow among individuals on fields.
Table des matières
1. Introduction
1Les ressources alimentaires mondiales sont constituées d’un nombre réduit d’espèces qui représentent à elles seules les bases de l’alimentation de la planète. Cette globalisation des ressources alimentaires a engendré la disparition progressive de nombreuses espèces cultivées tandis que d’autres ne restent connues que dans des zones géographiques restreintes. De telles espèces se rencontrent notamment dans les régions tropicales où des croyances tenaces et des traditions séculaires contribuent au maintien de plusieurs cultures désignées comme cultures mineures. C’est le cas notamment des cucurbitacées d’origine africaine qui sont consommées localement à l’état de la graine séchée et connues sous le nom générique de « pistaches » en Côte d’Ivoire ou « Egussi » au Bénin et au Nigeria (Vodouhé et al., 2000 ; Zoro Bi et al., 2003). Les graines, extraites de la baie en décomposition avancée, sont lavées et séchées au soleil puis décortiquées. Les amandes obtenues sont transformées en pâtes qui servent à épaissir les sauces qui accompagnent traditionnellement les repas. Les « pistaches » sont des plantes menacées de disparition, nécessitant la mise en place de programmes de conservation de leur réservoir génétique (Chweya, Eyzaguirre, 1999). En Côte d’Ivoire, des essais de caractérisation des espèces de « pistaches » ont permis d’identifier cinq espèces dans plusieurs zones de production (Zoro Bi et al., 2003). Le melon africain (Cucumis melo var. agrestis L. Naudin) figure au nombre de ces espèces. Les premières études effectuées sur cette plante la caractérisent comme une espèce monoïque (Dupriez, de Leener, 1987) ou andromonoïque (Messiaen, 1989).
2En Côte d’Ivoire, l’espèce C. melo var. agrestis est principalement cultivée dans les régions de l’est et du centre. La région de l’est se caractérise par une végétation constituée d’un mélange de forêts primaire et secondaire avec un sol riche en humus. La pluviométrie oscille entre 1300 et 1800 mm par an. On y distingue deux saisons sèches (décembre à mars et août à septembre) et deux saisons des pluies (avril à juillet et octobre à novembre). Les principales cultures de rente sont le caféier et le cacaoyer, présents dans des plantations âgées et de taille modeste. Les principales cultures vivrières sont l’igname et le bananier plantain. La pluviométrie de la région du centre oscille entre 1000 et 1700 mm par an. On y distingue également quatre saisons (deux saisons sèches et deux saisons des pluies) mais la petite saison des pluies est caractérisée par des pluies irrégulières. Le sol est peu profond avec une végétation de savane dominée par des arbustes et arbres de taille moyenne. Le cotonnier et l’anacardier y représentent les cultures de rente, l’igname étant la principale culture vivrière.
3Le melon africain est une culture traditionnelle produite par les femmes sur des petites surfaces en association avec les principales cultures. Les récoltes sont destinées principalement à la consommation locale au cours de deux principales fêtes : la fête des ignames (août à octobre selon les localités) et la fête du nouvel an. Les paysannes vendent le surplus de leur production sur les marchés locaux.
4En dehors de quelques informations sur les données botaniques, il n’existe pas à notre connaissance d’étude détaillée sur cette espèce. Le travail présenté ici porte sur une évaluation des caractères botaniques, agronomiques et une analyse de la biologie florale et du système de reproduction de l’espèce C. melo var. agrestis.
2. Site d’étude
5Les essais ont été conduits à la station expérimentale de l’Université d’Abobo-Adjamé localisée à Abidjan (4 ° 41 ’ latitude nord, 4 ° 00 ’ longitude ouest) dans le sud de la Côte d’Ivoire. Le climat de la région sud de la Côte d’Ivoire comprend quatre saisons dont deux pluvieuses (avril à juillet et octobre à novembre) et deux sèches (décembre à mars et août à septembre). Les périodes de novembre à février sont marquées par des jours courts (photopériode de 11 à 12 heures) et celles d’avril à août par des jours longs (photopériode de 13 à 14 heures). Le sud du pays est caractérisé par une forêt tropicale dense et une pluviométrie élevée (1400 à 2400 mm par an). Le sol est riche en matière organique. L’humidité relative est très élevée (> 80 %). Les cultures traditionnelles de la région sud sont le caféier, le cacaoyer, l’ananas, l’hévéa et le bananier doux (pour l’exportation). Le manioc et le bananier plantain représentent les principales cultures vivrières.
3. Matériel et Méthodes
3.1. Matériel végétal
6Le matériel végétal est constitué des graines de C. melo var. agrestis (accession NI 022) obtenues en septembre 2001 dans le village d’Ananda, lequel est situé dans le centre est de la Côte d’Ivoire (sous préfecture de Ouellé, région administrative du N’ZI COMOE) avec pour chef lieu la ville de Dimbokro (06 ° 39 ’ latitude nord, 04 ° 42 ’ longitude ouest). Ces graines ont été extraites de baies et séchées au soleil pendant un mois par une agricultrice de ce village. Les graines récoltées ont été conservées dans les récipients de matière plastique à température ambiante (25 à 30 °C) et sous une humidité relative ambiante de 80 % jusqu’au semis.
3.2. Méthodes d’études
7Cinq parcelles expérimentales ont été installées entre juillet 2002 et mars 2003 à partir des graines de l’introduction NI 022 et en tenant compte des saisons. Les parcelles 1 à 3 (P1, P2 et P3) ont été mises en place le 15 juillet 2002. Elles comportent chacune 42 plantes alignées sur 6 rangées de 7 plantes. L’espacement entre les rangées et entre poquets de la rangée est de 4 m. Les parcelles 4 (P4) et 5 (P5) ont été mises en place le 28 novembre 2002 et le 25 mars 2003, respectivement. Elles comportent chacune 40 plantes alignées sur 5 rangées de 8 plantes avec un espacement de 3 m entre elles. Les observations et mesures ont porté sur la germination et l’émergence des graines en fonction du temps de conservation, sur plusieurs caractères botaniques et agronomiques et sur la biologie florale. Il est à noter que la balance utilisée pour les pesées ainsi que le pied à coulisse utilisé pour les mesures de distance affichent des valeurs à la troisième décimale.
8Germination et émergence des graines. Le taux de germination et le temps d’émergence ont été mesurés à partir de 100 graines de l’accession NI 022 récoltées en septembre 2001 et de 100 graines de la même accession issues de la parcelle 1 et récoltées en décembre 2002. Ces dernières ont été séchées au soleil pendant un mois comme en milieu paysan et ont été conservées de la même manière que celles collectées en septembre 2001. Les essais de germination avec ces deux lots de graines ont été réalisés le 10 février 2003 en laboratoire à une température ambiante de 25 °C et une humidité relative ambiante de 80 %. L’éclairage du laboratoire est assuré par des néons de 80 W de 7 heures à 20 heures. Les semis ont été réalisés dans des bacs de 35 cm de long, 25 cm de large et 7 cm de profondeur, remplis de sol prélevé sur les parcelles expérimentales sans traitement préalable. L’âge des deux lots de graines était donc de 18 et de 3 mois, pour le matériel récolté respectivement en septembre 2001 et en décembre 2002.
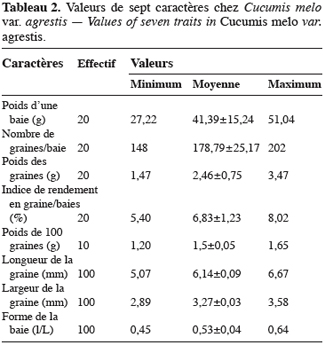
9Caractères botaniques et agronomiques. Les observations ont porté sur 13 caractères utilisés dans la caractérisation des cucurbitacées d’origine américaine (Loy, 1988 ; Staub, Fredrick, 1988). Les dates de semis, d’apparition du premier bouton floral et de la récolte ont été notées pour les parcelles P1, P4 et P5 afin d’établir les durées des phases végétative et reproductive en fonction des saisons. A la récolte, 10 baies de la parcelle 1 ont été pesées à la balance électronique de précision (Melter Toledo) et ensuite concassées. Les baies sont laissées en décomposition pendant sept jours. Lorsque les coques sont suffisamment ramollies, les graines sont extraites de chaque baie et comptées. Les graines de chaque baie, séchées séparément puis pesées, ont servi à établir l’indice de rendement en graines par baie qui est le rapport entre le poids des graines et le poids du fruit (Nerson, 2002). Cent graines de chacune des 10 baies (soit 10 lots de 100 graines) ont été pesées à la balance électronique de précision (Melter Toledo). La longueur (L) et la largeur (l) des graines d’un seul lot de 100 graines de la récolte de la parcelle 1 ont été mesurées à l’aide d’un pied à coulisse à affichage digital. Le rapport l / L donne une indication sur la forme des graines (Cowan, Smith, 1993).
10Paramètres de la biologie florale. Pour l’examen morphologique des organes floraux, 10 boutons floraux choisis sur 5 plantes des parcelles P1 à P4 (soit 50 boutons par parcelle) et 5 boutons sur 5 plantes de la parcelle P5 (25 boutons) ont été observés. L’examen morphologique des 225 boutons floraux provenant des 5 parcelles expérimentales a pour but d’identifier les stades évolutifs successifs depuis le bouton floral à la fleur épanouie ainsi que le temps nécessaire pour passer d’un stade à un autre. Chaque jour et sur une période de 6 jours, 40 boutons floraux choisis à la veille de leur ouverture ont été étiquetés. Les heures d’ouverture et de fermeture de ces fleurs ont été notées journellement. Le sexe de la première fleur a été noté pour 55 plantes (respectivement 25 de la parcelle P1, 20 de la parcelle P2 et 10 de la parcelle P3). Le nombre total de fleurs mâles ou hermaphrodites de même que la position des fleurs sur les ramifications de la plante ont été déterminés pour 20 plantes de chacune des 5 parcelles. Cette étude a permis d’établir le sex ratio (nombre de fleurs mâles / nombre de fleurs hermaphrodites). Des mesures quantitatives de la floraison, réalisées sur un total de 100 fleurs mâles et 100 fleurs hermaphrodites, ont porté sur la largeur des fleurs ainsi que la longueur et le diamètre des pédoncules floraux. Ces mesures ont concerné toutes les plantes des parcelles P1 et P4 en raison du nombre réduit de fleurs hermaphrodites par plante. La fécondité a été mesurée sur 28 fleurs hermaphrodites dans chacune des 3 parcelles P1, P2 et P4 (soit 84 fleurs) en notant celles qui ont évolué en fruits matures à la récolte. Dans la parcelle P1, 5 fruits de 7 plantes différentes ont servi à mesurer les indicateurs de maturité des baies, notamment l’évolution du diamètre et de la taille du fruit (en mm) et les changements qualitatifs observés sur la baie (évolution de la couleur) et sur le pédoncule floral (rétrécissement et séchage).
11Le rapport pollen / ovule (P / O) ou indice de Cruden donne une indication sur le système de reproduction (Cruden, 1977). Les espèces préférentiellement allogames ont des valeurs du rapport P / O élevées (de 500 jusqu’à 200000 pour les espèces auto-incompatibles) tandis que les espèces autogames ont des valeurs plus faibles (de 2 à 400). Pour déterminer l’indice de Cruden, nous avons calculé le nombre de grains de pollen et d’ovules à partir de 15 boutons floraux par parcelle, à raison de 5 boutons sur 3 plantes. Les grains de pollen ont été prélevés sur des boutons floraux mâles et hermaphrodites à la veille de leur épanouissement et observés sous microscope optique (CETI, Gx400) entre lame et lamelle dans une goutte de solution contenant 10 % de sucrose et 0,5 % de carmin acétique (Hardy et al., 1997). Pour déterminer le nombre d’ovules, nous avons compté le nombre de graines contenues dans les baies matures obtenues à partir des fleurs hermaphrodites utilisées pour calculer le nombre de grains de pollen.
12La réceptivité du stigmate a été observée dans une goutte de solution de H2O2 à 3 % (Kearns, Inouye, 1993). Les activités métaboliques du stigmate se traduisent par un dégagement gazeux observable à la loupe binoculaire (Gx40). Pour cette étude, nous avons utilisé 12 boutons floraux hermaphrodites de chacun des 4 stades définis lors de l’examen morphologique des organes floraux, 24 fleurs épanouies et 12 fleurs fanées ; tous ces organes floraux étant prélevés sur les plantes de la parcelle P1. L’anthèse et la viabilité des grains de pollen ont été observées sur 10 plantes par parcelle en choisissant, pour chaque plante, 5 boutons floraux pour chacun des stades définis par l’examen morphologique des organes floraux (soit 20 au total), 5 fleurs épanouies à 3 périodes différentes de la journée (8 heures, 12 heures et 16 heures, soit 15 fleurs épanouies) et 5 fleurs fanées. Les grains de pollen extraits sont observés dans une solution de carmin acétique 1 % au microscope optique (Gx100). Le carmin acétique colore les structures vitales du pollen en rouge, ce qui permet de distinguer les grains viables. Dans la parcelle P4, 40 fleurs hermaphrodites ont été ensachées à l’aide de toile de popeline, dans le but de vérifier le pouvoir fécondant des grains de pollen. Enfin des pièges à bacs colorés jaunes ont été déposés dans les parcelles P1 et P4 afin de récolter les insectes visitant les fleurs de Cucumis melo var. agrestis durant le cycle cultural.
13Les moyennes des caractères mesurés ont été comparées par une analyse de la variance (ANOVA) à l’aide du logiciel Minitab 12.0 version Windows.
3. Résultats
3.1. Germination des graines et caractères botaniques et agronomiques des plantes
14Le taux de germination des graines utilisées dans les essais de germination est de 5 % pour les semences âgées de 18 mois et de 32 % pour les semences âgées de 3 mois. Le temps d’émergence est de 6 et 8 jours pour les semences âgées de 18 mois et de 5 et 14 jours pour les semences de 3 mois.
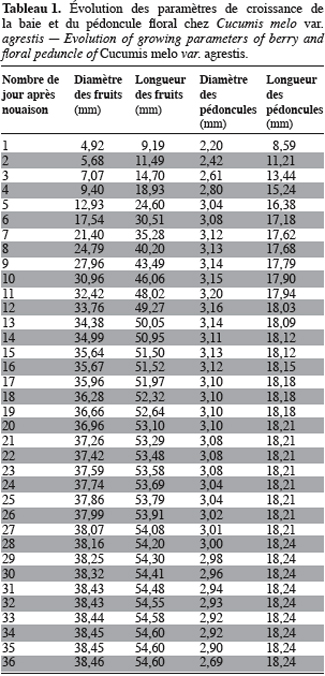
15Cucumis melo var. agrestis est une espèce rampante à feuilles entières, andromonoïque avec des baies et des graines de dimensions relativement petites en comparaison des baies et graines de très grandes tailles observées chez plusieurs autres espèces de cucurbitacées (Figure 1a à 1c). Les premiers boutons floraux apparaissent entre 39 et 43 jours après semis (JAS) en saison sèche et entre 70 et 78 JAS en saison des pluies. Le développement des baies, à partir de la nouaison, dure en moyenne 36 jours avec un changement au niveau de la longueur et du diamètre des pédoncules floraux et des fruits (Tableau 1). L’augmentation en volume et en longueur de l’ovaire comporte trois phases : une croissance rapide du premier au 15e jour après la nouaison (2,05 mm par jour pour le diamètre et 2,82 mm / jour pour la longueur), ensuite une très faible croissance jusqu’au 31e jour (0,17 mm par jour pour le diamètre et 0,19 mm / jour pour la longueur) et enfin un arrêt de croissance jusqu’à la maturité complète. L’arrêt de la croissance est marqué par d’importants changements qualitatifs au niveau de la baie et du pédoncule floral. La baie change de coloration et vire du vert au jaune vert, les pédoncules floraux rétrécissent et sèchent puis finissent par se détacher complètement de la plante. Ce rétrécissement s’observe par une diminution très marquée du diamètre des pédoncules floraux : de 2, 90 mm à 2, 69 mm (Tableau 1). Si la récolte n’est pas faite à ce moment, les baies commencent à pourrir au champ. La période entre le semis et la récolte de Cucumis melo var. agrestis varie entre 110 et 150 jours selon les saisons. Cette période est plus longue au cours de la saison des pluies (130 à 150 jours) qu’au cours de la saison sèche (110 à 120 jours). En effet, au cours de la saison sèche, la plante se dessèche totalement tandis qu’en saison des pluies, de nouvelles ramifications se développent à partir des bourgeons axillaires des nœuds d’anciennes ramifications donnant une production en fleurs et en fruits plus échelonnée. Sur base des observations faites dans les cinq parcelles expérimentales, le nombre de baies par plante varie de 2 à 15 et la majorité des plantes produisent de 5 à 10 baies. Le tableau 2 donne les valeurs de caractères relatifs aux graines et aux baies. Le poids d’une baie varie entre 27,22 g et 51,04 g, avec une valeur moyenne de 41,39 ± 15,24 g. Ces valeurs moyennes cachent une différence dans la taille des baies selon le moment de leur formation et leur position sur la plante. En effet, le cycle reproductif très échelonné dans le temps a permis de constater que les premières baies formées au début du cycle de reproduction et situées près de la base de la plante sont de grande taille (47, 29 ± 7, 24 g). Les baies qui se développent plus tard sont situées vers le sommet des plantes et sont de petite taille (31, 38 ± 5, 20 g). Le nombre de graines par baie est égal à 178, 79 ± 25, 17 ; le poids moyen de 100 graines est de 1, 5 ± 0, 05 g et le rapport (l / L) des graines est de 0, 53 ± 0, 04 (Tableau 2).
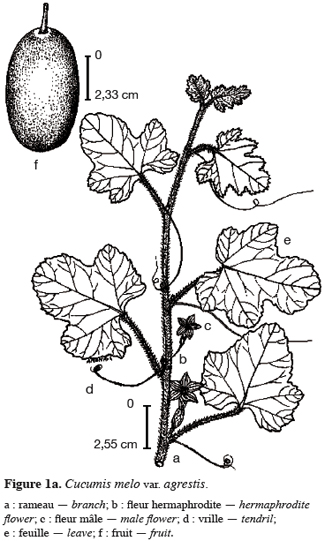


3.2. Etude de la biologie florale
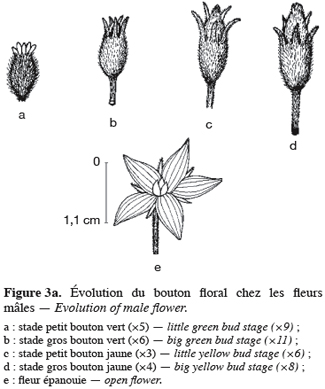
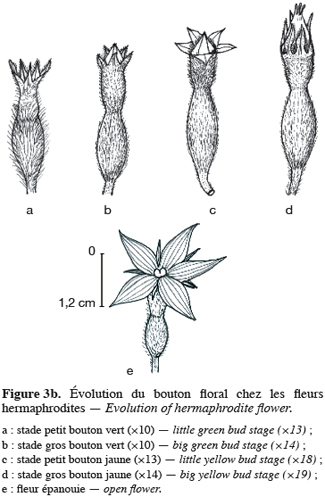
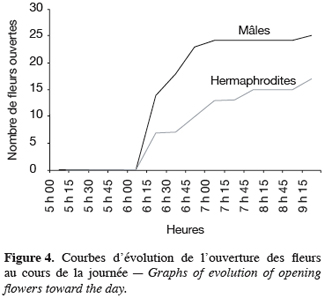
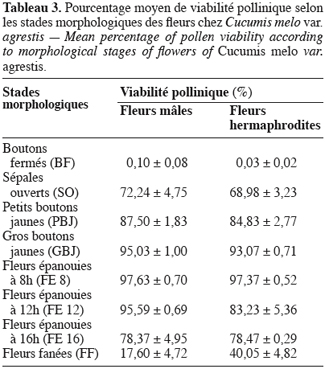
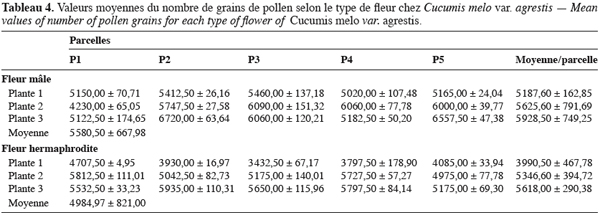
16Pour toutes les parcelles, les premiers boutons floraux qui apparaissent sont mâles, les boutons floraux femelles apparaissant en moyenne sept jours plus tard. Par contre, au niveau de chaque individu, la première fleur peut être mâle ou hermaphrodite. En effet, sur 55 plantes analysées, nous avons observé que la première fleur apparue était une fleur mâle chez 32 d’entre elles (58, 2 %) tandis qu’elle était une fleur hermaphrodite chez les 23 autres plantes (41, 8 %). Le pied de C. melo var. agrestis est constitué d’une tige principale qui porte des ramifications (ramifications primaires). Ces dernières se ramifient à leur tour (ramifications secondaires) et cela se poursuit toute la vie de la plante. Ces ramifications successives favorisent l’étalement de la plante. Nous avons constaté que les fleurs qui prennent naissance sur la tige principale et les ramifications primaires sont des fleurs mâles. Les ramifications suivantes portent une ou deux fleurs hermaphrodites (♀) et plusieurs fleurs mâles (Figure 2). Le suivi de la croissance du bouton floral jusqu’à la fleur épanouie effectué sur 225 boutons floraux mâles et hermaphrodites a permis d’identifier cinq stades évolutifs identiques chez la fleur mâle comme chez la fleur hermaphrodite (Figure 3a et 3b). Le premier stade : bouton fermé BF est caractérisé par un bouton floral de petit diamètre entièrement fermé et de couleur verte. Ensuite le bouton floral augmente de volume en même temps que les sépales s’allongent et s’ouvrent (deuxième stade : sépales ouverts, SO). Le passage du stade BF au stade SO dure en moyenne trois jours. Il est suivi par une plus large ouverture des sépales, ce qui laisse entrevoir les pétales qui sont de couleur jaune citron (troisième stade : petit bouton jaune, PBJ). La phase suivante est caractérisée par des pétales toujours fermés mais plus allongés et de couleur jaune (quatrième stade : gros bouton jaune, GBJ) qui est le stade précédant l’épanouissement de la fleur (cinquième stade : fleur épanouie, FE). A partir du stade SO, le passage à chaque stade dure un jour de sorte que six jours après l’apparition du bouton floral, la fleur est épanouie. La fleur reste ouverte l’espace d’une journée puis les pétales se fanent et tombent. Chez la fleur hermaphrodite, ces différents stades morphologiques s’accompagnent d’une augmentation du diamètre de l’ovaire qui passe de 2,26 mm au stade bouton floral à 4,62 mm au stade fleur épanouie. La longueur du pédoncule floral et la largeur de la fleur épanouie sont de 10, 14 ± 2, 72 mm et 16, 54 ± 2, 26 mm pour les fleurs mâles et de 8, 06 ± 3, 21 mm et 20, 73 ± 3, 43 mm pour les fleurs hermaphrodites. L’analyse statistique indique une différence hautement significative entre la longueur des pédoncules (F = 23, 20 ; P < 0, 001) et la largeur des fleurs (F = 100, 23 ; P < 0, 001) chez les deux types de fleurs. On a observé pour chaque plante, un pourcentage de fleurs mâles (82, 86 ± 11, 91 %) largement supérieur à celui des fleurs hermaphrodites (17, 13 ± 11, 91 %). Le nombre de fleurs mâles par individu varie de 8 à 125 contre 2 à 15 pour les fleurs hermaphrodites. Le nombre de fleurs de chaque type varie significativement d’une plante à une autre (F = 3, 38 ; P < 0, 001 pour les fleurs mâles et F = 6, 2 ; P < 0, 001 pour les fleurs hermaphrodites). Malgré cette grande variation dans le nombre de fleurs, le sex ratio n’est pas statistiquement différent d’une plante à l’autre (P = 0, 432 ; F = 1, 01). L’ouverture des fleurs est progressive au cours de la journée. Elle débute très tôt (5 heures du matin) et, progressivement, toutes les fleurs s’ouvrent au lever du jour (au plus tard à 9 heures du matin) (Figure 4). Les fleurs se ferment progressivement à partir de 14 heures et ce jusqu’à 15 heures ou 17 heures en fonction du degré d’ensoleillement. Lorsque le couvert nuageux est important, la fermeture des fleurs est rapide et une heure après le début du processus, toutes les fleurs sont fermées. Les grains de pollen issus des deux types de fleurs sont viables dès le stade sépales ouverts (SO), soit trois jours après l’apparition du bouton floral. La proportion de pollen viable est très faible voire nulle au stade bouton floral (moins de 1 %). Elle atteint sa valeur maximale (97, 63 ± 0, 70 % chez la fleur mâle et 97, 37 ± 0, 52 % chez la fleur hermaphrodite) tôt le matin du jour de l’épanouissement de la fleur puis décroît progressivement (Tableau 3). L’observation à la loupe binoculaire de la coupe de l’anthère et de la face interne de la corolle a montré que l’anthère demeure fermée dans le bouton floral. Par contre, le jour de l’ouverture de la fleur, dès six heures du matin, les anthères sont déjà ouvertes et les grains de pollen sont visibles sur toutes les parties de la fleur, suggérant que l’anthèse a lieu soit la veille de l’ouverture de la fleur soit en même temps que celle-ci. Une fleur mâle produit en moyenne 5580, 58 ± 668, 09 grains de pollen contre 4985, 03 ± 821, 07 pour la fleur hermaphrodite (Tableau 4). Le rapport pollen / ovule (P / O) ou indice de Cruden est du même ordre de grandeur chez les fleurs mâles (31, 57 ± 3, 40) et chez les fleurs hermaphrodites (28, 22 ± 3, 02), ce qui permet de classer C. melo var. agrestis dans la catégorie des plantes autogames facultatives. Le stigmate est réceptif au stade sépales ouverts (SO) mais le dégagement gazeux observé devient plus important au stade précédant l’ouverture de la fleur, soit cinq jours après l’émission du bouton floral. Sur un total de 84 fleurs hermaphrodites en pollinisation libre que nous avons observé, 22 ont donné des baies matures ; ce qui donne une fécondité de 26, 19 %. Sur 40 fleurs hermaphrodites ensachées à l’état de bouton floral, toutes ont évolué en fruit avec cependant un très fort taux d’avortement dès la première semaine suivant la nouaison (26 sur 40, soit 65 %). Sur les 14 fruits restants, seuls deux ont atteint la maturité (soit 5 % du total des fleurs) avec des baies de plus petite taille que les baies obtenues en pollinisation libre. Les piégeages ont permis de noter la présence prépondérante des homoptères (41, 68 %), diptères (20, 68 %) et hyménoptères (20, 09 %) pendant le cycle végétatif. Dès le début du cycle reproductif, les thysanoptères très faiblement présents durant le cycle végétatif (2, 81 %) deviennent prépondérants (87, 25 %) et précèdent en importance les hyménoptères (11, 61 %).
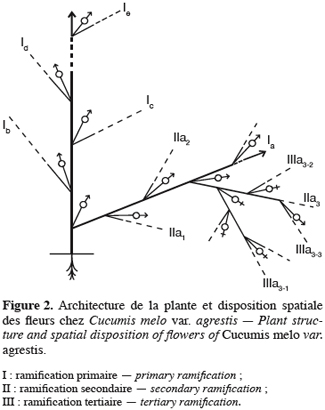
4. Discussion
17Le melon (Cucumis melo) comprend plusieurs variétés dont certaines présentent une bonne valeur commerciale. Ces variétés ont fait l’objet de très nombreuses études portant sur la phylogénie (Perl-Treves et al., 1985), la diversité enzymatique (Akashi et al., 2002) et la diversité moléculaire à partir de l’étude de l’ADN (Garcias-Mas et al., 2002 ; Lopez-Sesé et al., 2002). Cependant, la variété de melon africain, Cucumis melo var. agrestis, est une espèce de cucurbitacée très peu étudiée. Les descriptions botaniques et morphologiques données par Dupriez et de Leener (1987) et par Messiaen (1989) ne concordent pas toujours, notamment en ce qui concerne la biologie de la reproduction. Certains auteurs la considèrent comme une espèce sauvage ou spontanée (Akashi et al., 2002 ; Perl-Treves et al., 1985). L’espèce C. melo var. agrestis est pourtant une plante cultivée dont les graines à l’état séché sont consommées dans plusieurs régions africaines. Cette méconnaissance pourrait résulter d’une confusion entre les différents cultivars de C. melo var. agrestis présents sur le continent africain. En effet, en plus du cultivar consommé sous forme de pistaches, un autre cultivar est cultivé occasionnellement ou s’observe à l’état spontané sous la forme de pieds isolés près des cases en bordure des villages. Dans les villages où ce cultivar a été observé, les paysans lui attribuent le même nom vernaculaire que le cultivar consommé sous forme de pistaches. Les baies de ce cultivar sont de couleur orange à maturité, les graines sont jaunâtres et de plus grosse taille. Dans certaines régions du sud de la Côte d’Ivoire, ce cultivar à l’état immature, sert de légume en tant que substitut des aubergines au cours de périodes prolongées de disette. Les aubergines étant commercialisées régulièrement sur les marchés locaux depuis quelques décennies, son utilisation est devenue rare, ce qui expliquerait son abandon et sa rareté en milieu paysan. Ce cultivar se consomme quelque fois cru lorsqu’il est à maturité.
18La durée du cycle cultural des plantes de C. melo var. agrestis analysées dans nos essais est similaire à celle de 120 à 140 jours rapportée par Ndabalishye (1995). C. melo var. agrestis est une espèce andromonoïque dont la phénologie florale est marquée par l’apparition des fleurs mâles précédant de 7 à 10 jours celle des fleurs hermaphrodites. Cette expression dans le temps du sexe des fleurs en phases a déjà été observée chez d’autres espèces de Cucumis. Chez Cucumis sativus L., l’expression du sexe se déroule en trois phases : les premières fleurs sont toutes mâles, les fleurs qui apparaissent ensuite sont hermaphrodites et les dernières sont toutes femelles (Tcherkez, 2002). Chez C. melo var. agrestis, le sex ratio est largement en faveur des fleurs mâles (♂ / ♀ = 15, 3). Malgré la très forte variation dans le nombre de fleurs entre les individus, le sex ratio observé est statiquement identique entre les plantes. Odet (1991) attribue cette constance à l’intervention d’hormones (gibbérelline, acide abcissique, éthylène et auxines) qui réguleraient les proportions des fleurs de sexe différent chez les individus. Chez Cucurbita pepo L. (Cucurbitaceae), Nepi et Paccini (1993) ont noté une prédominance moins forte des fleurs mâles (♂ / ♀ = 7, 9). Chez la Cucurbitacée sauvage Schizopepon bryoniaefolius Maxim., Akimoto et al. (1999) ont observé un sex ratio largement en faveur des fleurs hermaphrodites, les fleurs mâles ne représentant que 5, 5 à 28, 3 % de l’ensemble des fleurs. Selon Mayer et Charlesworth (1991), plusieurs espèces végétales androdioïques ou andromonoïques se révèlent fonctionnellement dioïques ou monoïques car les grains de pollen de la fleur hermaphrodite ne sont pas viables. Dans nos essais, l’observation des grains de pollen de la fleur hermaphrodite de C. melo var. agrestis a montré que ceux-ci sont viables et fonctionnels car toutes les fleurs ensachées ont montré une nouaison. La très faible production finale en fruits des fleurs ensachées pourrait résulter d’un faible nombre de grains de pollen déposés sur les stigmates en l’absence de grains de pollen extérieurs. En effet, chez l’espèce auto-incompatible Campsis radicans (L.) Seem. (Bignoniaceae), Bertin (1982) a observé une corrélation entre la quantité de grains de pollen déposés sur les stigmates et le pourcentage de fruits formés. En dessous de 200 grains de pollen, aucun fruit n’est formé ; seulement 20 % des fruits sont formés entre 200 et 800 grains de pollen. Au-delà de 800 grains de pollen, toutes les fleurs fécondées ont évolué en fruits.
19En raison de décalage phénologique important entre les fleurs mâles et hermaphrodites ainsi que de la prédominance des fleurs mâles, C. melo var. agrestis possède une prédisposition à l’allogamie. Les résultats des essais d’ensachage des fleurs hermaphrodites ont montré également que l’autofécondation ne serait pas suffisante à elle seule pour expliquer la production de baies dans une culture de C. melo var. agrestis. Pourtant, le faible rapport P / O obtenu range C. melo var. agrestis dans la catégorie des plantes préférentiellement autogames (Cruden, 1977). Ces faibles valeurs du rapport P / O suggèrent également un taux efficace de transfert de pollen (Cruden, 1977). Ces résultats pourraient suggérer l’existence d’une forte proportion de transfert de pollen entre fleurs de la même plante (géitonogamie). La maturation synchrone des grains de pollen et du stigmate peut favoriser un tel phénomène. Les grains de pollen des deux types de fleurs sont libérés dans la nuit précédant l’ouverture de la fleur comme cela a été observé chez Cucurbita pepo (Nepi, Paccini, 1993) ; mais à l’inverse de celle-ci, les fleurs de C. melo var. agrestis restent ouvertes plus longtemps au cours de la journée. La quantité de grains de pollen viables diminue rapidement durant les 24 heures qui suivent l’ouverture de la fleur chez ces deux espèces de Cucurbitacées cultivées. Cependant, chez Cucurbita pepo, une très grande quantité de grains de pollen par plante (16 487 ± 231) est observée, ce qui se traduit par un rapport P / O plus élevé (P / O = 317) (Nepi, Paccini, 1993). Le poids des baies et le nombre de graines par baie de C. melo var. agrestis sont relativement faibles par rapport à ceux des trois autres espèces de pistaches (Citrullus lanatus Thumb, Lagenaria siceraria (Molina) Standl et Cucumeropsis mannii Naudin) cultivées en Côte d’Ivoire (Zoro Bi et al., 2003). L’effet de la position du fruit sur la taille des baies a aussi été constaté dans d’autres études sur le piment doux (Osman, George, 1984) et le gombo (Yadav, Dhankar, 2001). Cependant, contrairement à ces études, nous n’avons pas constaté que les graines issues des grosses baies étaient de plus grande dimension que celles issues des petites baies.
5. Conclusions et perspectives
20Cucumis melo var. agrestis est une espèce monoïque avec fleurs mâles et hermaphrodites séparées, préférentiellement autogame. Elle est fonctionnellement andromonoïque car les grains de pollen de la fleur hermaphrodite sont viables mais l’autofécondation se traduit par un taux élevé d’avortement des fruits. La conservation traditionnelle des graines à température ambiante, comme le pratiquent les paysans, se traduit par une perte rapide du pouvoir de germination des graines. L’ensemble des données obtenues dans cette étude permet d’envisager plusieurs axes de recherche. La durée du cycle biologique de C. melo var. agrestis de quatre à cinq mois autorise deux cultures par an dans la région de l’est tenant compte des deux saisons humides de l’année. Les pistaches étant destinées à une utilisation lors des cérémonies importantes, un cycle de culture peut démarrer à la fin de la petite saison des pluies (novembre) pour une récolte prévue en mars avant le début de la saison régulière. Cela permettra de disposer des graines de pistaches lors des festivités pascales qui constituent avec la fête des ignames et le nouvel an les trois grandes fêtes dans la région de production de C. melo var. agrestis. Des mesures directes de la fécondité (viabilité du pollen et des stigmates) devront être réalisées après pollinisation artificielle. Plusieurs techniques de pollinisation artificielle ou contrôlée sont décrites dans la littérature et peuvent être utilisées sur le melon africain (Kearns, Inouye, 1993). Des analyses histologiques pourront permettre de comparer la croissance du tube pollinique en fonction de l’origine des grains de pollen fécondant la fleur (auto et allo-pollen). L’utilisation des marqueurs neutres tels que les enzymes peut fournir indirectement une estimation du taux d’allogamie. Des études d’identification du ou des pollinisateurs potentiels de l’espèce doivent être envisagées pour mieux comprendre le flux génique à l’aide des colorants à bonne capacité de fixation in vitro (Hardy et al., 1997). Enfin, des essais de conservation des semences de C. melo var. agrestis à basse température combinés à différents taux d’humidité relative doivent être menés pour identifier les conditions de conservation à court terme du pouvoir de germination des graines.
21Remerciements
22Ce travail a été réalisé dans le cadre d’un projet interuniversitaire ciblé 2004 (PIC 2004) financé par la Direction Générale de la Coopération au développement (DGCD, Belgique) et supervisé par la Commission Universitaire pour le Développement (CUD, Belgique).
Bibliographie
Akashi Y., Fukuda N., Wako T., Masuda M., Kato K. (2002). Genetic variation and phylogenetic relationships in east and south Asian melons, Cucumis melo L., based on the analysis of five isozymes. Euphytica 125, p. 385–396.
Akimoto J., Fukuhara T., Kikuzawa K. (1999). Sex ratio and genetic variation in a functionally androdioecious species, Schizopepon bryoniaefolius (Cucurbitaceae). Amer. J. Bot. 86, p. 880–886.
Bertin R. (1982). Floral biology, hummingbird pollination and fruit production of trumpet creeper (Campsis radicans, Bignoniaceae). Amer. J. Bot. 69, p. 122–134.
Chweya JA., Eyzaguirre PB. (1999). The biodiversity of leafy vegetables. Rome: IPGRI.
Cowan WC., Smith BD. (1993). New perspectives on a wild gourd in Eastern North America. J. Ethnobiol. 13 (1), p. 17–54.
Cruden RW. (1977) Pollen - ovule ratios: a conservation indicator of breeding systems in flowering plants. Evolution 31, p. 32–46.
Dupriez H., de Leener P. (éds.) (1987). Jardins et vergers d’Afrique. Nivelles, Belgique : Terres et Vie. 354 p.
Garcia-Mas J., Oliver M., Gomez-Paniagua H., de Vicente MC. (2000). Comparing AFLP, RAPD and RFLP markers for measuring genetic diversity in melon. Theor. Appl. Genet. 101, p. 860–864.
Hardy O., Dubois S., Zoro Bi IA., Baudoin JP. (1997). Gene dispersal an its consequences on the genetic structure of wild populations of Lima bean (Phaseolus lunatus) in Costa Rica. Plant Genet. Res. Newsl. 97, p. 1–6.
Kearns CA., Inouye DW. (1993). Techniques for pollination biologists. Niwot, CO, USA: University Press of Colorado, 583 p.
Lopez-Sesé AI., Staub J., Katzir N., Gomez-Guillamon ML. (2002). Estimation of between and within accession variation in selected Spanish melon germplasm using RAPD and SSR markers to assess strategies for large collection evaluation. Euphytica 127, p. 41–51.
Loy JB. (1988). Improving seed yield in hull-less seeded strains of Cucurbita pepo. Cucurbit Genet. Coop. Rep. 11, p. 72–73.
Mayer SS., Charlesworth D. (1991). Cryptic dioecy in flowering plants. Trends Ecol. Evol. 6, p. 320–325.
Messiaen CM. (1989). Le potager tropical. (2nd éd.). Coll. Techniques vivantes. Paris : Presses Universitaires de France, 580 p.
Ndabalishye I. (1995). Agriculture vivrière ouest africaine à travers le cas de la Côte d’Ivoire. Monographie, IDESSA, 320 p.
Nerson H. (2002). Relationships between plant density and fruit and seed production in muskmelon. J. Amer. Soc. Hort. Sc. 127, p. 855–859.
Nepi M., Paccini E. (1993). Pollinisation, pollen viability and pistil receptivity in Cucurbita pepo. Ann. Bot. 72, p. 527–536.
Odet J. (1991). Le melon. Paris : Ctifl. 293 p.
Osman OA., George RAT. (1984). The effect of mineral nutrition and fruit position on seed yield and quality in sweet pepper (Capsicum annuum L.). Acta Hort. 143, p. 133-141.
Perl-Treves R., Zamir D., Navot N., Galun E. (1985). Phylogeny of Cucumis based on isozyme variability and its comparison with plastome phylogeny. Theor. Appl. Genet. 71, p. 430–836.
Staub JE., Fredrick LR. (1988). Evaluation of fruit quality in Cucumis sativus var hardwickii (R.) Alef.-derived lines. Cucurbit Genet. Coop. Rep. 11, p. 25–28.
Tcherkez G. (2002). Les fleurs : évolution de l’architecture florale des angiospermes. Paris : Dunod éd. 178 p.
Vodouhé S., Kouké A., Adjakidjé V., Achigan E. (2000). Observation sur la diversité génétique du « egussi» au Bénin (Citrullus spp. ; Cucumeropsis mannii ; Lagenaria sieraria : Cucurbitaceae). Cotonou, Bénin : IPGRI.
Yadav SK., Dhankar BS. (2001). Seed production and quality of okra [Abelmoschus esculentus (L.) Moench.] cv. ‘Varsha Uphar’ as affected by sowing time and position of fruit on plant. Seed Res. 29, p. 47–51.
Zoro Bi IA., Koffi KK., Djè Y. (2003). Caractérisation botanique et agronomique de trois espèces de cucurbites consommées en sauce en Afrique de l’Ouest : Citrullus sp., Cucumeropsis mannii Naudin et Lagenaria siceraria (Molina) Standl. Biotechnol. Agron. Soc. Environ. 8, p. 189–199.
Pour citer cet article
A propos de : Yao Djè
Université d’Abobo-Adjamé, UFR des Sciences de la Nature. Laboratoire de Génétique. 02 BP 801 Abidjan 02 (Côte d’Ivoire). E-mail : saticlan@yahoo.fr
A propos de : Léonie C. Kouonon
Université d’Abobo-Adjamé, UFR des Sciences de la Nature. Laboratoire de Génétique. 02 BP 801 Abidjan 02 (Côte d’Ivoire).
A propos de : Arsène I. Zoro Bi
Université d’Abobo-Adjamé, UFR des Sciences de la Nature. Laboratoire de Génétique. 02 BP 801 Abidjan 02 (Côte d’Ivoire).
A propos de : Glawdys Y. Gnamien
Faculté universitaire des Sciences agronomiques. Unité de Phytotechnie tropicale et d’Horticulture. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
A propos de : Jean-Pierre Baudoin
Faculté universitaire des Sciences agronomiques. Unité de Phytotechnie tropicale et d’Horticulture. Passage des Déportés, 2. B-5030 Gembloux (Belgique).






