- Portada
- Volume 19 (2015)
- Numéro 2
- Influence de différents traitements de prégermination des graines de Vigna unguiculata (L.) Walp. sur les performances germinatives et la tolérance au stress hydrique
Vista(s): 0 (0 ULiège)
Descargar(s): 0 (0 ULiège)
Influence de différents traitements de prégermination des graines de Vigna unguiculata (L.) Walp. sur les performances germinatives et la tolérance au stress hydrique

Notes de la rédaction
Reçu le 6 juillet 2014, accepté le 9 janvier 2015
Résumé
Description du sujet. L’amorçage (priming) ou endurcissement est une technique de traitement prégerminatif. Elle consiste à faire subir aux semences un traitement osmotique (osmopriming) ou hormonal (hormopriming) et/ou une redéshydratation (hydropriming) qui permettent la levée de la dormance, l’homogénéisation (la synchronisation) de la germination, une meilleure croissance, une floraison plus précoce et, dans certains cas, une tolérance aux stress abiotiques tels que la sècheresse et la salinité. Ces prétraitements consistent à imbiber la semence, puis à la redéshydrater avant la percée de la radicule, c’est-à-dire au cours de la phase réversible de la germination. Ainsi, la graine peut revenir à son état initial déshydraté sans que l’embryon ne subisse de dommages.
Objectifs. Notre travail consiste à étudier les conséquences de l’hydropriming et de l’osmopriming (par du PEG6000 à 10 et 30 %) sur les performances germinatives des graines du haricot à œil noir (Vigna unguiculata) ainsi que sur la tolérance au stress hydrique des plantes qui en sont issues.
Méthode. Des graines de V. unguiculata ayant subi un simple hydropriming, un double hydropriming ou un osmopriming sont mises à germer dans des conditions non stressantes et stressantes (dans du PEG6000 à 20 %). Les performances germinatives (capacité et vitesse de germination) et de croissance sont mesurées pour chaque traitement.
Résultats. Les résultats obtenus montrent que les traitements de prégermination permettent d’avoir une germination plus rapide et plus homogène et une meilleure croissance des radicules et des parties aériennes en conditions favorables et non favorables. Nous avons également démontré qu’une double redéshydratation (double hydropriming) est plus efficace dans l’amélioration de ces paramètres.
Conclusions. L’application de ces prétraitements, adaptés à chaque espèce, permettra d’améliorer significativement la germination des semences et la croissance de différentes espèces cultivées, ainsi que la tolérance au déficit hydrique.
Abstract
Influence of different pre-germination treatments of Vigna unguiculata (L.) Walp. seeds on germination performance and water stress tolerance
Description of the subject. Priming or hardening is a pregermination treatment. This treatment consists of incorporating an osmotic seed treatment (osmopriming) or a hormonal (hormopriming) and/or a redehydration (hydropriming) treatment. The approach allows the elimination of dormancy, homogenization (synchronization) of germination, better growth, earlier flowering and a tolerance to abiotic stresses such as drought and salinity. In this kind of treatment, the seed is soaked and then dehydrated before radicle breakthrough, i.e. during the reversible phase of germination. Thus, the seed can return to its initial stage without any damage.
Objectives. In this paper, we aimed to study the consequences of hydropriming and osmopriming (by PEG6000 at 10 and 30%) on cowpea seeds (Vigna unguiculata), on germination performance and on the water stress tolerance of plants from these seeds.
Method. Vigna unguiculata seeds were hydroprimed, hydroprimed twice or osmoprimed (with PEG6000 10 and 30%). For each treatment, germination performance (germination capacity, speed) and the water stress tolerance of the plants were studied.
Results. Results showed that increased hardness of the seed allowed a faster, more uniform germination and better growth of both the radicle and aerial parts. We also demonstrated that a double redehydration was more effective in improving these parameters.
Conclusions. Application of these pretreatments, adapted according to the plant species, will has the capacity to improve seed germination and crop yield, as well as tolerance to water deficit.
Tabla de contenidos
1. Introduction
1La production végétale et l'établissement de bonnes cultures agricoles dépendent étroitement de la germination des semences qui est une étape cruciale dans le cycle de vie des végétaux supérieurs (Cheng et al., 1999). Or, la germination peut être hétérogène vu que les semences ne germent pas toutes de la même manière ni en même temps. Afin de résoudre ces problèmes et d’améliorer le développement et le rendement des espèces végétales, plusieurs approches ont été utilisées depuis plusieurs années (Basra et al., 2003). La technique la plus fréquente et la plus commune est l’amorçage ou l'endurcissement connue sous le nom de « priming ». C’est une méthode physiologique qui améliore la production végétale en modulant les activités métaboliques de la germination avant l'émergence de la radicule (Bradford, 1986 ; Taylor et al., 1990), c’est-à-dire au cours de la phase réversible de la germination. Pendant cette phase, la semence peut être redéshydratée tout en gardant sa capacité à germer (Mazliak, 1998). Au cours de l’amorçage, les semences sont hydratées partiellement à un niveau d'humidité suffisant pour permettre le déroulement des processus métaboliques prégerminatifs, mais insuffisant pour assurer la percée de la radicule (McDonald, 2000 ; Ghassemi-Golezani et al., 2010).
2Beaucoup d’auteurs ont montré chez différentes espèces de grandes cultures telles que le haricot, la lentille, le blé, le maïs, le riz, la pastèque, le melon, la tomate, la carotte et l'amarante, que l’endurcissement des semences permet l'accélération et la synchronisation de la germination (Heydecker et al., 1973 ; McDonald, 2000), ainsi qu'une meilleure croissance, une floraison plus précoce, une plus grande tolérance aux stress et un rendement plus élevé (Harris et al., 2002 ; Basra et al., 2006 ; Moosavi et al., 2009).
3L’osmopriming est le type d'amorçage des semences le plus communément utilisé. Il consiste à faire subir aux graines un prétraitement osmotique seul ou suivi d’une redéshydratation. Cette hydratation contrôlée des semences est réalisée grâce à des agents osmotiques tels que le polyéthylène glycol (PEG), les sels (KNO3, NaCl, KCl) ou les polyols (mannitol) (Bradford, 1986 ; Yari et al., 2010). Plusieurs auteurs ont montré que les plantes issues de graines osmoconditionnées avaient une émergence accélérée conduisant à un taux final d'implantation accru et même des effets favorisants sur le rendement ont également été observés (Bradford, 1986).
4L'hydropriming ou la redéshydratation est la technique d’amorçage la plus simple qui consiste à imbiber avec de l'eau les semences puis à les déshydrater avant de les semer (Tarquis et al., 1992). Cette technique est peu couteuse et évite l'utilisation de produits chimiques qui peuvent être indésirables pour l'environnement et la santé humaine (Harris et al., 1999 ; McDonald, 2000 ; Harris et al., 2001 ; Ghassemi-Golezani et al., 2008).
5Il a été bien montré que les effets positifs de l’endurcissement sont associés à diverses modifications physiologiques, biochimiques, cellulaires, moléculaires et génétiques telles que la mobilisation des réserves, la dégradation de l'albumen, l’activation des systèmes antioxydatifs, la stimulation de la synthèse des osmolytes et l’activation du cycle cellulaire et de certains gènes de tolérance aux stress abiotiques (Bray et al., 1989 ; Dell'Aquila et al., 1989 ; Davison et al., 1991 ; De Castro et al., 2000 ; Varier et al., 2010).
6L’objectif de notre travail est d’étudier les effets de l’osmopriming (PEG6000 à 10 et 30 %), de l’hydropriming (un cycle de redéshydratation) et du double hydropriming (deux cycles de redéshydratation) sur la germination et la croissance des graines de Vigna unguiculata (L.) Walp. (haricot à œil noir), étant donné que les effets de l'amorçage sur les performances du haricot à œil noir restent à approfondir.
7Vigna unguiculata est l’une des principales légumineuses alimentaires en Afrique (Nkouannessi, 2005). La teneur élevée de ses graines en protéines lui confère un rôle important dans l’équilibre nutritionnel des populations rurales (Sarr et al., 2001) et constitue une excellente source de vitamine C. Elle contient aussi des quantités intéressantes de minéraux, notamment du fer, du zinc et du calcium (Davis et al., 1991).
2. Matériel et méthodes
2.1. Matériel végétal
8Notre travail s’est porté sur les semences du haricot à œil noir, V. unguiculata, qui fait partie du cultigroupe unguiculata, une variété commerciale, lojy bemaso, originaire de Madagascar. Des graines saines, toutes de même taille, sont sélectionnées et rincées avec de l’eau javellisée afin de les décontaminer.
2.2. Cinétique d'imbibition de Vigna unguiculata
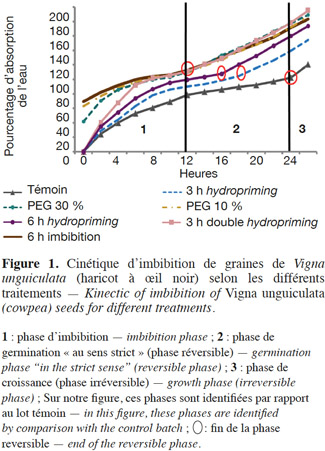
9Afin d’identifier la phase réversible de la germination de V. unguiculata pour déterminer le moment du prétraitement, dix graines ont été mises à germer dans l'étuve à 26° C (à l'obscurité) dans une boite de Petri, de 90 mm de diamètre, tapissée d’une triple couche de papier absorbant imbibé de 20 ml d’eau distillée. Ensuite, ces graines ont été pesées toutes les 2 h durant 36 h. La courbe de la cinétique d’imbibition est déterminée par la mesure du pourcentage d'eau absorbée cumulé (Figure 1).
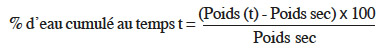
2.3. Prétraitements des semences (endurcissement)
10La concentration de polyéthylène glycol (PEG) et la durée de l'imbibition ont été déterminées suite à plusieurs essais préliminaires (données non présentées).
11Pour l'efficacité du traitement prégerminatif, l'imbibition des graines se fait à 26 °C dans des plateaux de germination (20 cm x 20 cm) tapissés d’une triple couche de papier absorbant et recouverts par des plaques de verre. L’imbibition est réalisée en ajoutant 100 ml d'eau distillée ou de solution de PEG6000.
2.4. Osmopriming
12Deux lots de semences sont mis à imbiber pendant 6 h (phase réversible de la germination) à 26 °C dans une solution de PEG6000 à 10 % (PEG 10 %) correspondant à -0,148 MPa et une solution à 30 % (PEG 30 %) correspondant à -1,027 MPa.
2.5. Hydropriming
13Deux lots de graines ont subi une simple redéshydratation qui consiste à imbiber les graines dans de l’eau distillée pendant 3 h (3 h hydropriming) ou pendant 6 h (6 h hydropriming). Cette imbibition est suivie d’un séchage sous ventilation, jusqu’à ce que les graines reprennent leur poids initial.
2.6. Double hydropriming
14Un autre lot de semences a subi un double hydropriming, c’est-à-dire que les graines sont imbibées dans de l'eau distillée pendant 3 h puis redéshydratées et cette opération est répétée une deuxième fois (3 h double hydropriming).
15Nous avons considéré deux lots témoins : le premier (Témoin) n’a subi aucun traitement avant la mise en germination des graines et le deuxième (6 h imbibition) pour lequel les graines ont été imbibées dans l’eau durant 6 h avant la mise en germination.
2.7. Cinétique d’imbibition des semences prétraitées de Vigna unguiculata
16La cinétique d’imbibition a été suivie pour les graines ayant subi un prétraitement selon le même protocole décrit précédemment.
2.8. Mise en germination en conditions normales
17Les graines prétraitées ou pas sont mises à germer dans des boites de Petri, de 90 mm de diamètre, tapissées d’une double couche de papier absorbant imbibé de 20 ml d’eau distillée. Chaque boite de Petri contient 20 graines.
2.9. Mise en germination en conditions stressantes
18Les graines prétraitées ou pas sont mises à germer selon le même protocole, mais dans une solution de PEG6000 à 20 % correspondant à un potentiel osmotique de -0,491 MPa.
19Les expériences de germination se déroulent dans l’étuve à 26 °C (à l'obscurité).
2.10. Le taux de survie
20Il représente le pourcentage des plantules ayant survécu huit jours dans des conditions osmotisantes (PEG à 20 %).

2.11. Mise en pot
21La croissance des plantules âgées de cinq jours et issues de la germination des graines ayant subi les différents traitements a lieu dans des pots dont le fond est troué, contenant du terreau (1/3), de la terre argileuse (1/3) et du sable (1/3) afin de faciliter le drainage de l’eau.
2.12. Application de stress
22Au bout de quinze jours, toutes les plantes subissent un stress hydrique par arrêt d’arrosage de quinze jours.
23L’expérimentation se déroule dans une chambre de culture à 26 °C avec une photopériode de 14 h à 100 µmoles·m-1·sec-1.
24La croissance est suivie par la mesure de la longueur de la radicule, après cinq jours de germination et de la longueur de la partie aérienne, après croissance dans les pots. Chaque valeur représente la moyenne de dix mesures.
2.13. Analyses statistiques
25Les expériences ont été répétées au moins cinq fois. Les tests statistiques (ANOVA et test de Student) ont été réalisés à l’aide du logiciel Excel 2007. Les erreurs standards sont représentées sous forme de barres sur les histogrammes.
3. Résultats
3.1. Germination
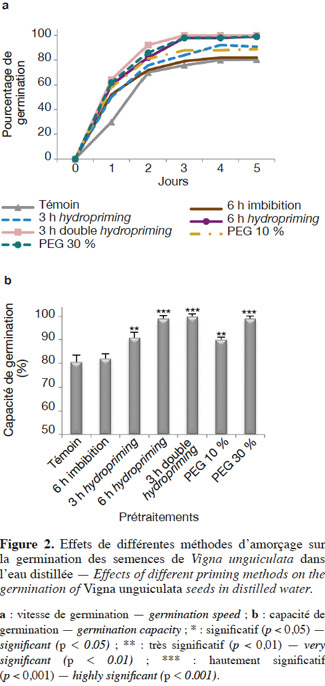
26En conditions normales. La germination a été étudiée à travers la cinétique (Figure 1), la capacité et la vitesse de germination (Figures 2a et 2b ; Tableaux 1 et 2).

27Cinétique d’imbibition. Selon les courbes obtenues, nous pouvons déduire qu'au cours de la germination des graines du haricot à œil noir, l'absorption de l'eau se caractérise par un modèle triphasique, ce qui est similaire à la configuration de la plupart des semences (Bewley, 1997). Mais l'absorption de l'eau est beaucoup plus rapide chez les semences amorcées particulièrement pendant les premières heures d'imbibition (Figure 1 et Tableau 1). Ceci induit une accélération des phases de germination, surtout pour les graines osmoconditionnées par PEG à 30 % et les semences doublement redéshydratées (3 h double hydropriming) dont la phase de croissance semble commencer après 12 h pour les deux traitements (PEG 30 % et double hydropriming), alors que pour le témoin, elle ne commence qu’après 24 h (Figure 1 et Tableau 1). Par ailleurs, nos résultats indiquent que la vitesse de ces phases dépend étroitement du type et de la durée de l’amorçage. Nous remarquons, par exemple, que les graines redéshydratées après 6 h d'imbibition (6h hydropriming) atteignent leur phase de croissance avant les semences redéshydratées après 3 h d'imbibition (3h hydropriming) (Figure 1 et Tableau 1).
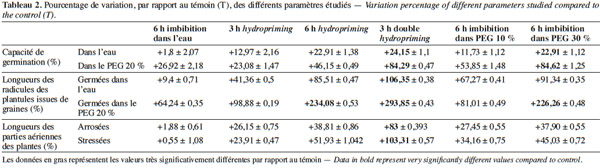
28Vitesse et capacité de germination. Les résultats et nos analyses statistiques indiquent que l'endurcissement permet l'accélération de la vitesse de germination et l'augmentation de la capacité germinative des semences de V. unguiculata (Figures 2a et 2b ; Tableaux 1 et 2). Mais cette amélioration dépend étroitement du type d'amorçage. En effet, pour l'osmopriming, nous remarquons que plus la concentration du PEG est élevée, plus les semences germent rapidement avec un taux de germination plus élevé : +11,73 % pour le PEG à 10 % et +22,9 % pour le PEG à 30 %. Pour l'hydropriming, nous observons que plus la durée de l'imbibition (suivie d'une redéshydratation) est longue, plus les graines germent de manière performante. Cela est confirmé par l'augmentation de la capacité germinative qui est de +12,97 % chez les graines imbibées pendant 3 h d'imbibition et de +22,9 % quand l'imbibition est de 6 h. Mais un double cycle de redéshydration est plus efficace pour améliorer les performances germinatives du haricot à œil noir avec une capacité de germination de 100 % au bout de trois jours. Par ailleurs, l'imbibition seule dans l'eau distillée pendant 6 h n'a pas un effet significatif sur la capacité germinative (Figures 2a et 2b ; Tableaux 1 et 2).
29En conditions de stress osmotique. La germination a été étudiée à travers la capacité et la vitesse de germination (Figures 3a et 3b ; Tableaux 1 et 2). D'après nos résultats, nous constatons que, même en conditions de stress osmotique (PEG à 20 %), l'amorçage améliore les performances germinatives (Figures 3a et 3b ; Tableaux 1 et 2) et le taux de survie qui représente le nombre de plantules continuant leur croissance après leur germination (Tableau 3). Nous observons que les graines amorcées ont une vitesse plus rapide et un taux de germination plus élevé avec des différences hautement significatives (P < 0,001). Ainsi, une capacité germinative plus élevée et une meilleure vitesse caractérisent les semences osmoconditionnées par le PEG à 30 % et celles qui ont subi une double redéshydratation, avec une augmentation de 84 % au bout du cinquième jour. Les résultats indiquent également que les graines redéshydratées après 6 h d'imbibition (6 h hydropriming) tolèrent mieux le stress osmotique par rapport aux semences redéshydratées après 3 h d'imbibition (3 h hydropriming) avec une augmentation de 46 % contre 28,5 % (Figures 3a et 3b ; Tableaux 1 et 2). Ainsi, l'osmopriming par le PEG 30 % a un effet beaucoup plus significatif sur la germination des graines dans les conditions d'un stress osmotique par rapport à l'osmopriming par du PEG à 10 %. Par ailleurs, notre étude indique qu’une simple imbibition des semences dans l’eau distillée pendant 6 h avant la mise en germination dans le PEG a un effet significatif (P < 0,05) sur la vitesse et la capacité de germination comparativement aux semences non imbibées (Figures 3a et 3b ; Tableaux 1 et 2). D’autre part, nos résultats (Tableau 3) montrent également que 90 % de plantules issues de graines doublement redéshydratées et osmoconditionnées par le PEG à 30 % ont pu survivre dans des conditions osmotisantes (PEG 20 %), contre 15 % seulement de plantules issues de graines témoins.
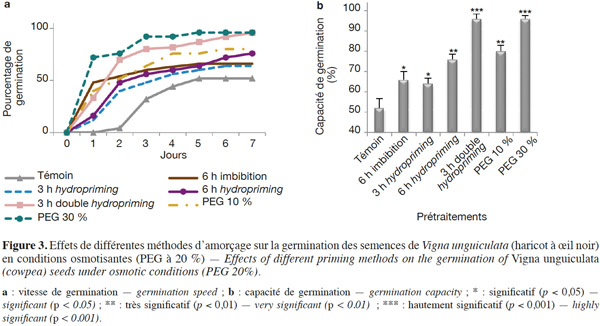

3.2. Croissance
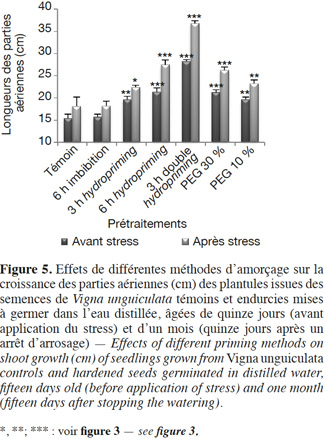
30La croissance linéaire est étudiée par la mesure de la longueur des radicules en conditions normales et stressantes (par du PEG à 20 %) en boite de Petri (Figure 4) et par la longueur de la partie aérienne des plantes, après croissance dans les pots et après un arrêt d’arrosage (Figure 5).
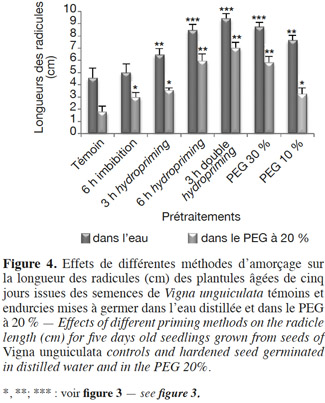
31Radicules : en conditions normales et en conditions de stress osmotique (PEG à 20 %). En conditions non stressantes, l’amélioration de la croissance radiculaire varie selon le type de prétraitement (Figure 4 et Tableau 2). En effet, nous remarquons que pour l’osmopriming, le taux de variation est de +67,27 % chez le lot PEG 10 %, alors qu’il est de +91,34 % pour le lot PEG 30 %. Dans le cas de l’hydropriming, l’augmentation de la croissance est de 81,51 % chez le lot « 6 h hydropriming », mais elle est de l’ordre de 41,36 % seulement chez le lot « 3 h hydro ». La meilleure croissance radiculaire est observée chez les plantules issues des semences ayant subi un double hydropriming avec un taux de variation de +106,35 %. Ces plantules sont à un stade de développement plus avancé par rapport aux autres lots. Par ailleurs, nos résultats indiquent qu’une simple imbibition des semences dans l’eau distillée pendant 6 h avant la mise en germination n’a pas un effet significatif sur l’allongement des radicules avec une augmentation de 9,4 % seulement (Figure 4 et Tableau 2).
32En conditions osmotisantes, l'endurcissement améliore la croissance des radicules. En revanche, les résultats de nos tests statistiques montrent que plus on augmente la concentration du PEG (osmopriming), la durée de l'imbibition avant la redéshydratation (hydropriming) ou le nombre de cycles d'hydratation-déshydratation, plus l'effet de l'amorçage est significatif (Figure 4 et Tableau 2). En effet, la croissance des radicules augmente de 81,01 % chez le lot « PEG 10 % » et de 226,26 % chez le lot « PEG 30 % ». De même, le taux de variation de la longueur des radicules est de +98,88 % chez le lot « 3 h hydropriming », alors qu'il est de +234,08 % chez le lot « 6 h hydropriming » et de +293,85 % chez les plantules issues des semences ayant subi une double redéshydratation (Figures 4 et 6). De surcroit, une simple imbibition des semences dans l’eau distillée pendant 6 h avant la mise en germination a un effet significatif sur la longueur des radicules en conditions stressantes avec une augmentation de +64,25 %, contrairement aux conditions non stressantes (+9,4 % seulement) (Figure 4 et Tableau 2).

33Partie aérienne : avant et après stress hydrique par arrêt d'arrosage. En conditions non stressantes, une nette amélioration de la croissance des parties aériennes est notée chez toutes les plantes issues de semences prétraitées. Nos résultats montrent également que l'endurcissement permet d'accélérer le développement des plantes (Figures 5 et 6 ; Tableau 2). En effet, nous observons qu'au quinzième jour, les plantes issues de graines non traitées sont au stade de première feuille, alors que celles issues des semences endurcies sont à un stade plus avancé (deuxième et troisième feuilles). Cette amélioration de la croissance dépend étroitement de la méthode de l'amorçage. En effet, chez le lot « 6 h hydropriming », l'augmentation est de 38,8 %, alors qu'elle est de 26,15 % chez le lot « 3 h hydropriming » (Figure 5 ; Tableau 2). Pour l'osmopriming, nous remarquons également que le taux de variation de la croissance par rapport au témoin est de +27,44 % chez le lot « PEG 10 % », alors qu'il est de +37,9 % chez le lot « PEG 30 % ». Cependant, une meilleure croissance caractérise les plantes issues de semences doublement redéshydratées avec une augmentation de 83 %. D'ailleurs, ces plantes sont à un stade de développement plus avancé (troisième feuille) (Figures 5 et 6 ; Tableau 2). Par ailleurs, le lot « 6 h imbibition dans l'eau » est totalement semblable au lot témoin.
34Après l'application d'un stress hydrique, nous observons un flétrissement et un jaunissement des feuilles des plantes issues de graines non prétraitées (Figures 7 et 8). En revanche, les plantules issues de semences endurcies semblent être plus tolérantes puisque nous observons une augmentation de la croissance des parties aériennes par rapport au lot témoin (Figures 5, 7 et 8 ; Tableau 2). De même, nous remarquons qu'après un réarrosage, les plantes issues de graines amorcées sont au stade de floraison et même de formation de fruit, alors que les plantes issues de graines non traitées sont au stade feuilles (Figure 8). Cependant, le degré de cette résistance varie selon le type du prétraitement. En effet, l'augmentation de la croissance est de 34,16 % chez le lot « PEG 10 % », alors qu’elle est de 45,02 % chez le lot « PEG 30 % ». En ce qui concerne le traitement par hydropriming, nous observons également que le taux de variation varie selon la durée de l'imbibition qui précède la redéshydratation avec une augmentation de 51,93 % chez le lot « 6 h hydropriming » et de 23,91 % chez le lot « 3 h hydropriming ». Les effets bénéfiques d'un double hydropriming sur la croissance des parties aériennes en conditions non stressantes sont également observés en conditions stressantes. Dans ces conditions, la meilleure tolérance caractérise le lot « 3 h double hydropriming » (Figures 5, 7 et 8 ; Tableau 2). En effet, nous remarquons une augmentation de la croissance de 103,31 %, avec des feuilles plus vertes et un stade de développement très avancé (formation de la gousse) malgré la contrainte hydrique (Figures 5, 7 et 8 ; Tableau 2). À noter qu’une simple imbibition des semences dans l’eau distillée pendant 6 h avant la mise en germination n’a aucun effet sur la croissance des parties aériennes, quelles que soient les conditions (stressantes ou pas) (Figure 5 ; Tableau 2).


4. Discussion
35D'après cette étude, nous constatons que, quel que soit le type de prétraitement, l’endurcissement améliore les performances germinatives, la croissance et le développement du haricot à œil noir V. unguiculata d'une manière hautement significative (p < 0,001). Ainsi, l’endurcissement permet d'avoir une tolérance plus vigoureuse aux stress hydrique et osmotique.
36Nos résultats sont en accord avec ceux rapportés par Maroufi et al. (2011), Singh et al. (2011) et Fabunmi et al. (2012) qui ont également observé que l'amorçage améliore les performances et la vigueur du niébé en conditions stressantes et non stressantes.
37Cependant, ce qui est totalement nouveau dans notre étude, c’est l'application d'un nouveau type d'amorçage qui est le double hydropriming qui consiste à redéshydrater deux fois les semences. Nos résultats montrent que ce double hydropriming est meilleur qu'un simple hydropriming ou même qu'un osmopriming par PEG. Ceci pourrait être expliqué par le fait qu'une double redéshydratation permettrait de déclencher et de réguler des processus pré-germinatifs et d’induire, également, une forte activation de certains gènes responsables de la tolérance au stress hydrique (Tanou et al., 2012). Ainsi, le priming correspond à une acclimatation vu que cette dernière se rapporte à des modifications physiologiques qui se produisent lors d’une exposition graduée à un stress (ici la déshydratation) permettant à l’individu de vivre et de se reproduire dans un environnement stressant (Hopkins, 2003).
38Notre étude indique également que l'effet de l'amorçage dépend étroitement du type et de la durée du prétraitement. Ceci a été déjà suggéré par Ghassemi- Golezani et al. (2008). Ainsi, l'hydropriming est plus efficace avec 6 h d'imbibition, comparativement à une imbibition de 3 h. Ceci a été confirmé par Maroufi et al. (2011) qui ont montré que 6 h de prétraitement représente la durée optimale pour améliorer les performances germinatives de V. unguiculata. Cette durée est suffisante pour permettre le déroulement des processus métaboliques prégerminatifs, mais insuffisante pour assurer la percée de la radicule. La durée d'hydro-amorçage (durant la phase réversible de la germination) diffère selon les espèces végétales (Harris et al., 1999). D'autre part, l'osmopriming a un effet beaucoup plus significatif avec le PEG à 30 % qu’avec le PEG à 10 %. Ceci peut être expliqué par le fait que le stress osmotique que nous avons appliqué aux semences avec le PEG à 30 % avait plus d’impact par rapport à 10 %. Cette acclimatation a permis aux graines de déclencher certains mécanismes de défenses aux stress tels que l'augmentation de l’expression des protéines de stress (Gao et al., 1999) et la stimulation de la synthèse des osmolytes (Gelormini, 1995), ce qui peut traduire les effets bénéfiques remarqués chez le lot PEG à 30 %. Ce résultat est en accord avec Dezfuli et al. (2008) qui a déjà montré que l'amorçage est influencé par la concentration de la solution osmotisante et par d'autres facteurs.
39De même, nos résultats montrent qu'une simple imbibition des semences dans l'eau distillée pendant 6 h avant la mise en germination n'avait pas un effet significatif sur l'amélioration des performances germinatives et de la vigueur du haricot à œil noir, ce qui confirme l'efficacité de la redéshydratation et de l'imbibition dans une solution osmotisante.
4.1. Effets du prétraitement sur la germination et la croissance en conditions normales
40La germination des semences est un processus clef du développement dans le cycle de vie des végétaux. Notre étude indique que l'endurcissement permet l’amélioration des performances germinatives des semences de V. unguiculata, ce que confirment les études antérieures sur plusieurs espèces cultivées telles que le haricot, les lentilles, le blé, l'orge, le maïs, le pois chiche, le riz, la pastèque, le melon, la tomate, l'amarante, le concombre et l'oignon (Caseiro et al., 2004 ; Ahmadi et al., 2007 ; Janmohammadi et al., 2008 ; Moosavi et al., 2009 ; Amoaghaie et al., 2010 ; Ghassemi Golezani et al., 2010 ; Kalsa et al., 2011) qui ont montré que l'amorçage est une méthode efficace pour améliorer les performances germinatives, en donnant des cultures uniformes et homogènes.
41En appliquant des prétraitements (osmopriming et hydropriming), nous remarquons que les effets positifs qui apparaissent au cours de la germination et l’émergence se répercutent sur le développement, la croissance des radicules et des parties aériennes et même sur la floraison et la formation des gousses. Par ailleurs, les plantules issues des graines endurcies évoluent d’une manière plus homogène. Ces résultats sont similaires aux résultats d'autres chercheurs qui ont révélé une amélioration de la croissance du rendement chez les plantules issues de semences endurcies (Giri et al., 2003 ; Zarei et al., 2011).
42Plusieurs auteurs ont expliqué cette germination rapide et synchronisée par une activation des processus pré-germinatifs qui induisent des modifications biochimiques quantitatives et qualitatives au niveau de la semence (Varier et al., 2010 ; Maroufi et al., 2011) telles que la réparation des membranes (Jowkar et al., 2012), une forte synthèse et activation des enzymes impliquées dans la dégradation et la mobilisation des réserves (Varier et al., 2010 ; Wattanakulpakin et al., 2012), ainsi qu'une activation de l'endo-β-mannase qui est l'enzyme responsable de la synthèse de l'éthylène (hormone qui permet la dégradation de l'albumen pour la levée de la dormance) (Varier et al., 2010). De Castro et al. (2000) ont montré que l'amorçage améliore et synchronise la réplication de l'ADN dans toutes les cellules de l'embryon permettant l'avancement du cycle cellulaire de la phase G1 à G2. Cette pré-activation de cycle cellulaire est l'un des mécanismes par lesquels l'amorçage induit une meilleure performance de la germination. Ce mécanisme est régulé par l'activation des protéines du cycle cellulaire comme la β-tubuline, les cyclines et protéines kinases cycline dépendante. L'amélioration de la germination chez les semences endurcies pourrait dépendre largement de l'augmentation des activités des enzymes antioxydantes (Ahmed et al., 2012). D’autre part, les effets bénéfiques de l'amorçage sur la croissance ont été expliqués par Varier et al. (2010) par une accélération de la réplication nucléaire au niveau des racines et des feuilles.
4.2. Effets du prétraitement sur la germination et la croissance en conditions stressantes
43En conditions de stress osmotique (PEG à 20 %), les graines non traitées ont une capacité germinative et un taux de survie trop faible, ainsi qu'une croissance limitée des radicules. En effet, Demir et al. (2006) ont rapporté que les semences soumises à des contraintes de plus de -2 MPa ne peuvent pas absorber des quantités suffisantes en eau et en oxygène qui permettent la croissance de l'embryon. Ainsi, Hamidi (2000) a montré que la longueur des racines était réduite sous stress osmostique. Par contre, notre étude révèle que l'endurcissement permet d'améliorer les performances germinatives et la croissance des radicules en conditions osmotisantes. Ces résultats rejoignent ceux de Kaya et al. (2006). Par conséquent, les effets bénéfiques de l'amorçage peuvent être plus efficaces sous des conditions défavorables plutôt que sous des conditions favorables (Parera et al., 1994 ; Bradford, 1995). Ainsi, l'amorçage peut être utile pour atténuer les effets néfastes de la sècheresse et améliorer la germination dans un environnement de stress hydrique. À cet effet, et pour vérifier cette hypothèse, nous avons soumis des plantules issues de graines prétraitées à un stress hydrique simulé par un arrêt d’arrosage.
4.3. Effet d'un arrêt d'arrosage sur les plantules issues de graines témoins et prétraitées
44Il est connu que la plante dépend étroitement de l’eau qui lui est fournie et le moindre déficit dans le bilan hydrique entraine une réduction de la croissance et peut aboutir à la fanaison. Ceci est observé à travers nos propres résultats. En effet, un arrêt d'arrosage a provoqué un jaunissement et un fort flétrissement des plantes issues des graines non traitées. A contrario, une meilleure croissance et un bon développement sont observés chez les plantes issues de semences amorcées, même en conditions stressantes. Nos résultats sont en accord avec Fabunmi et al. (2012) qui ont également remarqué que les plantules de V. unguiculata issues des semences amorcées se caractérisent par une meilleure croissance et une floraison précoce en conditions de stress hydrique, contrairement aux plantules témoins.
45Les effets bénéfiques de l'endurcissement en conditions de stress hydrique peuvent êtres dûs à une augmentation de l’expression des aquaporines et des protéines moléculaires de choc thermique HSP (Gao et al., 1999), ainsi qu'une stimulation de la biosynthèse des osmolytes au niveau des embryons, ceci étant corrélé avec une forte expression génétique et à des niveaux élevés de l'ARNm (Gelormini, 1995). Il a été également montré chez les semences redéshydratées que les effets de l'endurcissement pouvaient s'expliquer par l'activation du gène Lea qui code pour les protéines LEA, impliquées dans la tolérance à la dessiccation (Goyal et al., 2005). Les mécanismes de la régulation de cette expression ne sont pas bien connus.
5. Conclusions
46À l'issue de cette étude, nous pouvons conclure que le prétraitement, aussi bien l’hydropriming que l’osmopriming, des semences de V. unguiculata permet d’améliorer les performances germinatives, la croissance et le développement des plantes sous des conditions favorables et stressantes. Mais le double hydropriming, traitement inédit, offre les meilleurs résultats. Nous pouvons ainsi déduire que cette double redéshydratation pourrait représenter une méthode très efficace pour l'amélioration de la production végétale et en particulier dans des conditions hydriques défavorables. L'amorçage des semences provoque des modifications physiologiques, cellulaires, biochimiques et moléculaires fortement régulées et contrôlées par l’expression de nombreux gènes (Soeda et al., 2005 ; Varier et al., 2010). Certaines conséquences de l'endurcissement, en particulier du double hydropriming, sont peut-être dues aux phénomènes épigénétiques qui jouent un rôle déterminant dans l’adaptation des plantes à leur environnement (Hebrard, 2012). En conséquence, l'usage d’approches d'ordres moléculaire et génétique s'avère incontournable pour mieux identifier l'expression des gènes activés au cours du priming et plus particulièrement au cours du double hydropriming.
Bibliographie
Ahmadi A., Mardeh A.S., Poustini K. & Jahromi M.E., 2007. Influence of osmo and hydropriming on seed germination and seedling growth in wheat (Triticum aestivum L.) cultivars under different moisture and temperature conditions. Pak. J. Biol. Sci., 10(22), 4043-4049.
Ahmed Z., Sheikh M.A., Hameed A. & Salah ud Din, 2012. Investigation of antioxidant enzymes and biochemical changes in the wheat seeds (freed) induced by different pre-sowing treatments. World Appl. Sci. J., 18(1), 31-36.
Amoaghaie R., Nikzad K. & Shareghi B., 2010. The effect of priming on emergence and biochemical changes of tomato seeds under suboptimal temperatures. Seed Sci. Technol., 38, 508-512.
Basra S.M.A., Pannu I.A. & Afzal I., 2003. Evaluation of seedling vigor of hydro and matriprimed wheat (Triticum aestivum L.) seeds. Int. J. Agric. Biol., 5(2), 121-123.
Basra S.M.A. et al., 2006. Alleviation of salinity stress by seed invigoration techniques in wheat (Triticum aestivum L.). Seed Technol., 28, 36-46.
Bewley J., 1997. Seed germination and dormancy. Plant Cell, 9, 1055-1066.
Bradford K.J., 1986. Manipulation of seed water relations via osmotic priming to improve germination under stress conditions. HortScience, 21, 1105-1112.
Bradford K.J., 1995. Water relations in seed germination. In: Kigel J. & Galili G., eds. Seed development and germination. New York, USA: Marcel Dekker Inc., 351-396.
Bray C.M., Davison P.A., Ashraf M. & Taylor R.M., 1989. Biochemical processes during osmopriming of leek seeds. Ann. Bot., 63, 185-193.
Caseiro R., Bennett M.A. & Marcos-Filho J., 2004. Comparison of three priming techniques for onion seed lots differing in initial seed quality. Seed Sci. Technol., 32, 365-375.
Cheng Z. & Bradford K.J., 1999. Hydrothermal time analysis of tomato seed germination responses to priming treatments. J. Exp. Bot., 33, 89-99.
Davis D.W. et al., 1991. Cowpea. Madison, WI, USA: University of Wisconsin-Madison.
Davison P.A. & Bray C.M., 1991. Protein synthesis during osmopriming of leek (Allium porrum) seeds. Seed Sci. Res., 1, 29-35.
De Castro R.D. et al., 2000. Cell division and subsequent radicle protrusion in tomato seeds are inhibited by osmotic stress but DNA synthesis and formation of microtubular cytoskeleton are not. Plant Physiol., 122, 327-335.
Dell'Aquila A. & Bewley J.D., 1989. Protein synthesis in the axes of polyethylene glycol-treated pea seeds and during subsequent germination. J. Exp. Bot., 40, 1001-1007.
Demir Kaya M., Atak M., Çikili Y. & Kolsarici Ö., 2006. Seed treatment to overcome salt and drought stress during germination in sunflower (Helianthus annuus L.). Eur. J. Agron., 24, 291-295.
Dezfuli P.M., Sharif-Zadeh F. & Janmohammadi M., 2008. Influence of priming techniques on seed germination behavior of maize inbred lines (Zea mays L.). J. Agric. Biol. Sci., 3(3), 22-25.
Fabunmi T.O., Gbadamosi B.K. & Adigbo S.O., 2012. Seed hydropriming and early moisture stress impact on biomass production and grain yield of cowpea. J. Appl. Sci. Technol., 2(10), 112-122.
Gao Y.P., Young L., Bonham-Smith P. & Gusta L.V., 1999. Characterization and expression of plasma and tonoplast membrane aquaporins in primed seed of Brassica napus during germination under stress conditions. Plant Mol. Biol., 40, 635-644.
Gelormini G., 1995. Optimisation des propriétés germinatives des graines de colza par initialisation : aspects méthodologiques et fondamentaux. Thèse de doctorat : Université de Rennes (France).
Ghassemi-Golezani K., Sheikhzadeh-Mosaddegh P. & Valizadeh M., 2008. Effects of hydropriming duration and limited irrigation on field performance of chickpea. Res. J. Seed Sci., 1, 34-40.
Ghassemi-Golezani K., Chadordooz-Jeddi A., Nasrullahzadeh S. & Moghaddam M., 2010. Influence of hydro-priming duration on field performance of pinto bean (Phaseolus vulgaris L.) cultivars. Afr. J. Agric. Res., 5(9), 893-897.
Giri G.S. & Schilinger W.F., 2003. Seed priming winter wheat for germination, emergence, and yield. Crop Sci., 43, 2135-2141.
Goyal K., Walton L.J. & Tunnacliffe A., 2005. LEA proteins prevent protein aggregation due to water stress. J. Biochem., 388, 151-157.
Hamidi H., 2000. Experiment on alfalfa to measure its tolerance to drought using texture culture technique. M.A. Agriculture thesis: Agriculture University, Tarbiat Moddares University, Tehran (Iran).
Harris D. et al., 1999. Onfarm seed priming in semi-arid agriculture: development and evaluation in maize, rice and chickpea in India using participatory methods. Exp. Agric., 35, 15-29.
Harris D. et al., 2001. On-farm seed priming: using participatory methods to revive and refine a key technology. Agric. Syst., 69(1-2), 151-164.
Harris D. et al., 2002. Prospects of improving maize yields with ‘on-farm’ seed priming. In: Rajbhandari N.P., Ransom J.K., Adikhari K. & Palmer A.F.E., eds. Sustainable maize production systems for Nepal. Kathmandu: NARC & CIMMYT, 180-185.
Hebrard C., 2012. Contrôle épigénétique de l’induction et de la tolérance à la montaison chez la betterave sucrière. Thèse de doctorat : Université d’Orléans (France).
Heydecker W., Higgins J. & Gulliver R.L., 1973. Accelerated germination by osmotic seed treatment. Nature, 246, 42-44.
Hopkins W.G., 2003. Physiologie végétale. Traduction de la 2e édition américaine. Bruxelles : Ed. de Boeck.
Kalsa K.K., Tomer R.P.S. & Abebie B., 2011. Effects of storage duration and hydro-priming on seed germination and vigour of common vetch. J. Sci. Dev., 1(1), 65-73.
Kaya M.D. et al., 2006. Seed treatments to overcome salt and drought stress during germination in sunflower (Helianthus annuus L.). Eur. J. Agron., 24, 291-295.
Janmohammadi M., Dezfuli P.M. & Sharifzadeh F., 2008. Seed invigoration techniques to improve germination and early growth of inbred line of maize under salinity and drought stress. Gen. Appl. Plant Phys.,, special issue, 34(3-4), 215-226.
Jowkar M., Ghanbari A., Moradi F. & Heidari M., 2012. Alterations in seed vigor and antioxidant enzymes activities in Silybum marianum under seed priming with KNO3. J. Med. Plants Res., 6(7), 1176-1180.
Maroufi K., Farahani H.A. & Moradi O., 2011. Increasing of seedling vigor by hydro priming method in cowpea (Vigna sinensis L.). Adv. Environ. Biol., 5(11), 3668-3671.
Mazliak P., 1998. Physiologie végétale. 2. Croissance et développement. Paris : Hermann éditeurs.
McDonald M.B., 2000. Seed priming. In: Black M. & Bewley J.D., eds. Seed technology and its biological basis. Sheffield, UK: Sheffield Academic Press Ltd, 287-325.
Moosavi A., Tavakkol-Afshari R., Sharif-Zadeh F. & Aynehband A., 2009. Effect of seed priming on germination characteristics, polyphenoloxidase, and peroxidase activities of four amaranth cultivars. J. Food Agric. Environ., 7(3-4), 353-358.
Nkouannessi M., 2005. The genetic, morphological and physiological evaluation of African cowpea genotypes. Thesis: University of the Free State Bloemfontein (South Africa).
Parera C.A. & Cantliff D.J., 1994. Presowing seed priming. Hortic. Rev., 16, 109-141.
Sarr B., Diouf O., Diouf M. & Roy-Macauley H., 2001. Utilisation de paramètres agronomiques comme critères de résistance à la sécheresse chez trois variétés de niébé cultivées au Sénégal et au Niger. Sécheresse, 12, 259-266.
Singh A. et al., 2011. Seed hydropriming effects on germination, emergence and growth of cowpea (Vigna unguiculata L. Walp.). Trends Adv. Sci. Eng., 1(3), 37-42.
Soeda Y. et al., 2005. Gene expression programs during Brassica oleracea seed maturation, osmopriming, and germination are indicators of progression of the germination process and the stress tolerance level. Plant Physiol., 137, 354-368.
Tanou G., Fotopoulos V. & Molassiotis A., 2012. Priming against environmental challenges and proteomics in plants: update and agricultural perspectives. Frontiers Plant Sci., 3(216), 1-5.
Tarquis A.M. & Bradford K.J., 1992. Prehydration and priming treatments that advance germination also increase the rate of deterioration of lettuce seeds. J. Exp. Bot., 43, 307-317.
Taylor A.G. & Harman G.E., 1990. Concepts and technologies of selected seed treatments. Ann. Rev. Phytopathol., 28, 321-339.
Varier A., Vari A.K. & Dadlani M., 2010. The subcellular basis of seed priming. Curr. Sci., 99, 450-456.
Wattanakulpakin P. et al., 2012. Hydropriming effects on carbohydrate metabolism, antioxidant enzyme activity and seed vigor of maize (Zea mays L.). Afr. J. Biotechnol., 11(15), 3537-3547.
Yari L., Aghaalikani M. & Khazaei F., 2010. Effect of seed priming duration and temperature on seed germination behavior of bread wheat (Triticum aestivum L.). J. Agric. Biol. Sci., 5(1), 1-6.
Zarei I. et al., 2011. Effect of different hydropriming times on the quantitative and qualitative characteristics of chickpea (Cicer arietinum L.). Afr. J. Biotechnol., 10(66), 14844-14850.






