- Startpagina tijdschrift
- volume 10 (2006)
- numéro 2
- Variation de l’activité biologique dans les zipella (sols nus) en zone subsahélienne du Burkina Faso et impact de la technique du zaï (techniques des poquets)
Weergave(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Variation de l’activité biologique dans les zipella (sols nus) en zone subsahélienne du Burkina Faso et impact de la technique du zaï (techniques des poquets)

Nota's van de redactie
Reçu le 24 août 2004, accepté le 8 novembre 2005
Résumé
L’étude a porté sur deux types de sols nus (zipella) du centre nord du Burkina Faso : un sol ferrugineux tropical lessivé et un sol brun eutrophe. Il a été évalué l’activité biologique en fonction des états de surface et de la profondeur au niveau des deux pédons et l’impact des traitements du zaï (technique de poquets) sur cette activité biologique. Les caractéristiques physico-chimiques sont dans l’ensemble plus faibles en sol ferrugineux qu’en sol brun, et plus faibles au niveau des états dénudés qu’au niveau des états végétalisés pour le même type de sol. La biomasse microbienne globale est plus faible en sol nu qu’en sol végétalisé quel que soit le type de sol. Elle est plus faible en sol ferrugineux qu’en sol brun. Au niveau de tous les états de surface et sur les deux types de sol, l’activité biologique est plus importante en surface qu’en profondeur. Elle est améliorée par les traitements de zaï notamment sur le sol brun.
Abstract
Changes in the biological activity of zipella (bare soils) in the subsahelian zone of Burkina Faso and impact of the technique of zaï. The study focused on the two types of bare soils (zipella) located in the north-center of Burkina Faso: a lixivied ferruginous soil and an eutrophic brown soil. The biologic activity was evaluated in relation to soil surface characteristics and soil depth.The impact of the «zaï» technique processing on the biological activity was also investigated. The physico-chemical characteristics of the ferruginous soils were globally lower than those of the brown soils. For the same type of soil these characteristics were lower in the bare surfaces compared to ones of surface covered by vegetal. The global microbial biomass was lower in the bare soils compared to the one of the soil covered by vegetal.The microbial biomass of the ferruginous soils was lower than the brown soils one. Irrespective of the soil surface characteristics and the type of soil surface, the biological activity was more important in the soil surface layer than in the deep soil. The processings of zaï technique improved notably the biological activity in the brown soils.
Inhoudstafel
1. Introduction
1La dégradation des sols est un problème majeur de l’agriculture dans les régions du Sahel soumises à des processus de dégradation très poussées, conduisant souvent à l’abandon des grandes superficies cultivables et à la désertification dans certains cas extrêmes (Stroosnijder, 1992). Cette dégradation accentuée du sol du fait des conditions pédoclimatiques actuelles en liaison avec les effets de la pression démographique et du surpâturage a entraîné la formation de glacis dénudés (zipella qui signifie étymologiquement clairière ou zone blanche en langue mooré) (Kambou, Zougmoré, 1996). Marchal (1983) les qualifie de lèpre du Yatenga (région nord du Burkina). Ces sols nus sont appelés « hardés » au Cameroun, « wala wala » au Mali et « gangani » au Niger (Mando et al., 2001).
2Dans certaines localités au Sahel, notamment au Burkina, la récupération de ces sols nus a fait mettre en oeuvre une technique culturale appelée « zaï » en langue mooré. Cette technique traditionnelle de récupération des sols est une forme particulière de culture en poquets concentrant les eaux de ruissellement dans un micro bassin (Roose et al., 1993). Cette technique est aussi appelée « tassa » au Mali ou « towalen » au Niger.
3Si de nombreux travaux sur les caractéristiques physico-chimiques des sols dégradés existent, très peu d’études se sont intéressées à la quantification de l’activité biologique dans ces sols. En effet, selon Ambouta et al. (1996), les dégradations physique (encroûtement) et chimique (appauvrissement en éléments nutritifs) sont de loin les plus importantes au Sahel alors que la dégradation biologique constitue une des formes de dégradation des terres, de baisse des capacités de production due à l’altération des caractéristiques des sols. Cette dégradation résulte d’une baisse de l’activité biologique du sol, laquelle activité est entretenue par l’apport de matières organiques et par la présence de divers êtres vivants (faune, microorganismes, racines de plantes, etc.). Ces êtres vivants améliorent la structure du sol, enrichissent la biomasse et parfois permettent la fixation d’azote atmosphérique par les plantes. De ce fait, l’activité biologique reste une composante essentielle de la fertilité du sol. Elle y intervient en agissant d’une part sur le stock d’éléments minéraux assimilables, obtenus par minéralisation de la matière organique et d’autre part sur la structure du sol.
4Les bactéries libres fixatrices d’azote sont considérées comme les plus importants organismes jouant un rôle significatif dans la constitution de la fertilité des sols. L’importance de la fixation non symbiotique d’azote par les azotobacters est remarquablement influencée par les propriétés physico-chimiques des habitats (Dommergues, Mangenot, 1970).
5C’est pourquoi, il nous est apparu utile d’étudier l’activité microbienne de la flore particulièrement l’influence de quelques propriétés physico-chimiques des habitats sur l’abondance des bactéries fixatrices d’azote comme Azotobacter et Azospirillium dans ces sols.
6L’étude a consisté à mesurer la biomasse microbienne et à tester le niveau de l’activité biologique globale (C-CO2) de deux états de surface (nu et végétalisé) de deux milieux pédologiques de la région centre nord du Burkina Faso.
2. Matériels et méthodes
2.1. Matériels
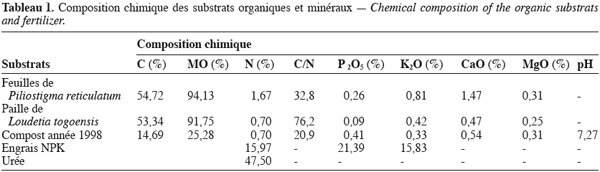
7Substrats organiques et engrais. Les substrats organiques utilisés au cours de l’étude sont : un compost, des feuilles de Piliostigma reticulatum et de la paille de Loudetia togoensis ; les engrais chimiques utilisés sont : NPK (15-20-15) et urée (46 %).
8Les caractéristiques chimiques de ces substrats sont consignées dans le tableau 1.
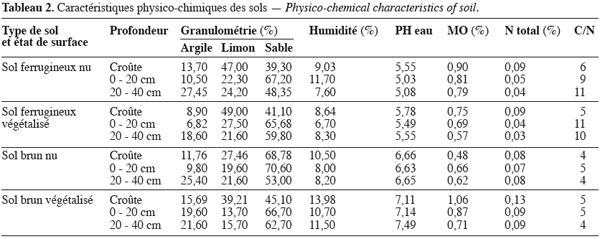
9Sols. Les types de sol examinés dans la présente étude sont les sols ferrugineux tropicaux et les sols brunifiés eutrophes très dégradés à faiblement dégradés. Les caractéristiques physico-chimiques des croûtes et des deux premiers horizons (déterminées au laboratoire) sont données dans le tableau 2.
2.2. Méthodes
10Installation des essais. Les essais ont été installés sur un sol ferrugineux tropical lessivé à Loaga (13 °18 ’ 53,1 ’’ N ; 1 ° 37 ’ 83,4 ’’ W) et sur un sol brun eutrophe à Niénéga (13 ° 20 ’ 49,6 ’’ N ; 1 ° 35 ’ 06 ’’ W) de 1996 à 1998 dans la région de Kongoussi. Les mesures ont été réalisées pendant la campagne 1998.
11Les sites ont fait l’objet d’observations pédologiques fines (état de surface, morphologie du sol, etc.). L’étude a consisté à la mise en place d’une culture de sorgho selon la technique du zaï associée à d’autres techniques de CES/DRS, telles que les diguettes en pierres, le paillage (Kambou, Zougmoré, 1996).
12Le dispositif expérimental combine l’apport d’amendements organiques à des teneurs et qualités variables.
13Le dispositif expérimental. Le dispositif utilisé est un bloc Fisher (ou blocs complets randomisés). On a cinq blocs au total par site. Chaque bloc est constitué de quatre parcelles correspondant aux quatre traitements décrits ci-après.
14Chaque parcelle est un carré de 5 m de côté soit une surface unitaire de 25 m2. La distance qui sépare deux parcelles d’un même bloc est de 2 m.
15Chaque parcelle comporte six lignes de sorgho espacées de 0,8 m. Chaque ligne comporte dix poquets espacés de 0,5 m, soit un total de soixante poquets par parcelle.
16Traitements. Pour l’expérimentation, quatre traitements ont été mis au point : T1 : témoin, semis traditionnel à la houe ; T2 : paillage simple, semis traditionnel à la houe ; T3 : zaï + compost (125 g par poquet soit 3 t.ha-1) ; T4 : zaï + paille de Loudetia togoensis (62,5 g par poquet) + NPK (3,33 g par poquet soit respectivement 12 kg.ha-1 de N, 16 kg.ha-1 de P2O5 et 12 kg.ha-1 de K2O au semis) + urée (2,08 g par poquet soit 23 kg.ha-1 au sarclage).
17Evaluation de l’activité biologique globale et des populations microbiennes du sol. L’activité biologique globale (C-CO2 dégagé) des sols étudiés a été évaluée par la méthode du test respirométrique (Dommergues, 1960 ; Bachelier, 1973 ; Thiombiano, Dianou, 1999) sur les différents états de surface (croûtes), les traitements (T1, T2, T3, T4), les horizons de surface et de profondeur des sols.
18Les échantillons de sols sont séchés à l’air libre et à l’ombre, puis tamisés à 2 mm. Par la suite 100 g de sol humidifié avec deux tiers de la capacité au champ sont placés dans des bocaux de deux litres hermétiquement fermés et contenant un piège à CO2, constitué de 10 ml de soude 0,1 N et un flacon d’eau pour humidifier le milieu. Un témoin par répétition constitué uniquement d’un flacon contenant de la soude et d’un autre contenant de l’eau distillée est placé dans les mêmes conditions pour tenir compte de la carbonisation initiale de la soude dans le bocal et du dispositif randomisé. Pour maintenir la température identique pendant la durée de l’incubation, les bocaux sont maintenus dans une étuve à 30 ° C.
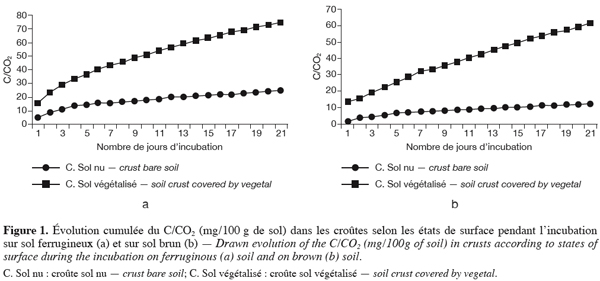
19Le CO2 dégagé est dosé journalièrement par colorimétrie pendant trois semaines, avec de l’acide chlorhydrique 0,1 N en présence de phénol phtaléine (indicateur coloré).
20Au moment du dosage, on utilise du chlorure de baryum (Ba Cl2) pour éviter la fixation du CO2 atmosphérique par la soude exposée dans le bécher.
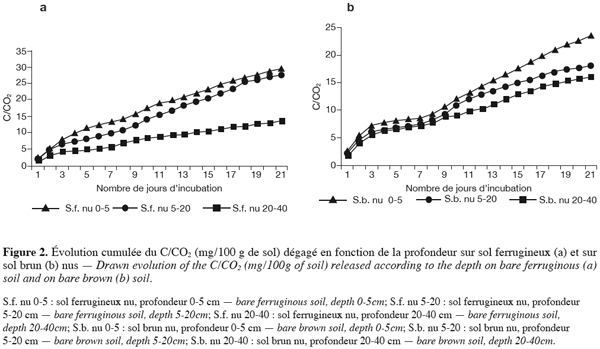
21L’étude des populations microbiennes a pour objectif la détermination de la nature des populations vivant au niveau des états de surface nus et végétalisés, puis sous les 20 premiers centimètres de chaque état de surface.
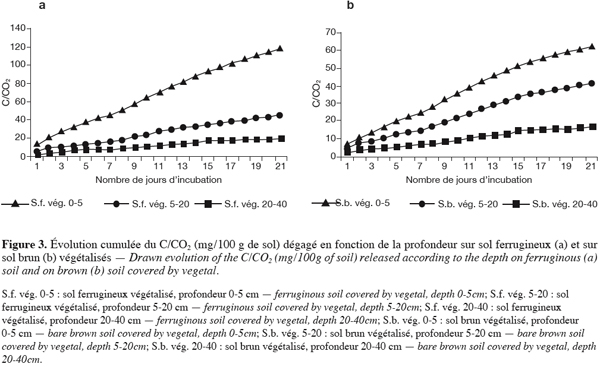
22Les analyses microbiologiques ont porté sur la détermination de la flore microbienne totale, le dénombrement des bactéries sporulantes, des champignons et des bactéries associatives fixatrices d’azote, l’identification d’Azospirillium et d’Azotobacter.
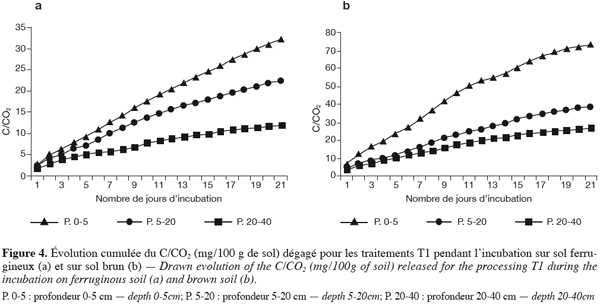
23La flore microbienne totale est déterminée par la technique du nombre le plus probable (MPN) (Alexander, 1982).
24La densité des bactéries sporulantes est déterminée suivant la même méthode que précédemment. La dilution de sol de chaque échantillon est maintenue dans un bain-marie à 80 °C pendant 20 min.
25La densité totale des champignons est déterminée dans un milieu d’agarose à Starch-caseinnitrate-bengal (Ottow, 1972). Les boîtes inoculées sont incubées à une température de 30 °C pendant cinq jours.
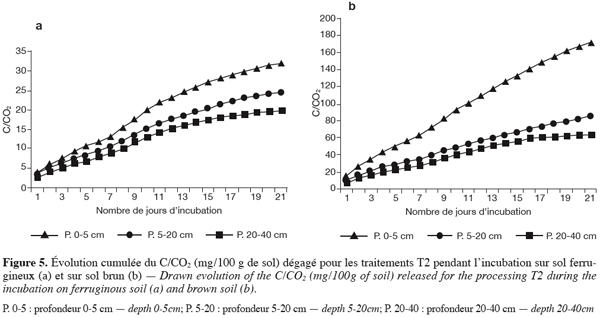
26Les densités d’Azospirilium et d’Azotobacter ont été déterminées par la technique du nombre le plus probable (MPN) sur respectivement un milieu sans azote de malate semi-solide (Döbernier, 1978) et sur le milieu d’Ashby modifié (Abdel-Malek, Ishac, 1968).
27L’isolement des Azospirillium a été fait selon Döbernier (1978) sur un milieu sans azote de malate semi-solide contenant 0,05 % d’acide glutamique pour accélérer la réduction de C2H2.
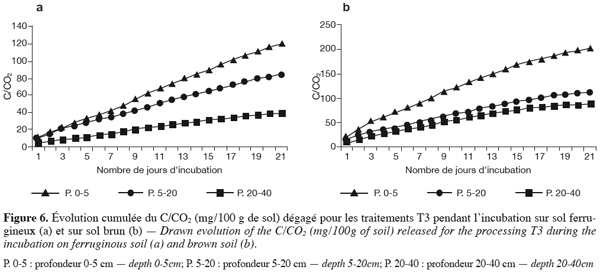
28L’activité nitrogénase des isolats d’Azotobacter et d’Azospirillium a été déterminée en utilisant la technique de réduction acétylène selon la méthode adaptée de Schollhorn et Burris (1967).
3. Résultats
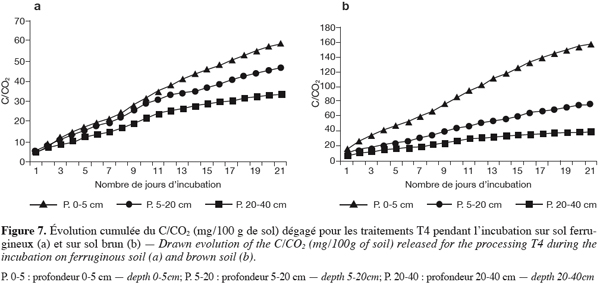
3.1. Densité des différents groupes de micro-organismes
29En examinant le tableau 3 relatif à la densité des différents groupes de micro-organismes dans les deux sites, il ressort que les sols nus sont beaucoup plus faibles en biomasse microbienne totale que les sols végétalisés.
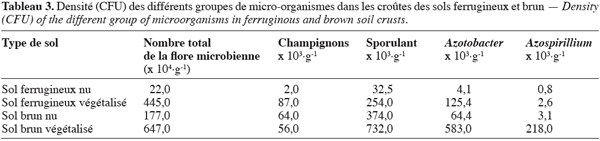
30Sur sol ferrugineux nu, il est dénombré 20 fois moins de microorganismes que sur le faciès végétalisé ; sur sol brun, ce rapport est de 4. En sol brun, la biomasse microbienne est nettement plus élevée qu’en sol ferrugineux, et ce quel que soit l’état de surface considéré.
31En sol ferrugineux, quelque soit l’état de surface, les bactéries sporulantes sont les mieux représentées suivies par les Azotobacter, ensuite par les champignons et enfin par les Azospirillium.
32Le tableau 4 indique la répartition des micro-organismes en fonction de la profondeur. Au niveau du sol ferrugineux, on constate une baisse du taux de microorganismes avec la profondeur. Elle passe de 39,4.104 à 2,3.104 CFU par gramme de sol. Cette baisse est progressive pour les champignons. En ce qui concerne les autres fractions (spores, Azotobacter, Azospirillium), la tendance est à l’augmentation au niveau du deuxième horizon (5-10 cm).
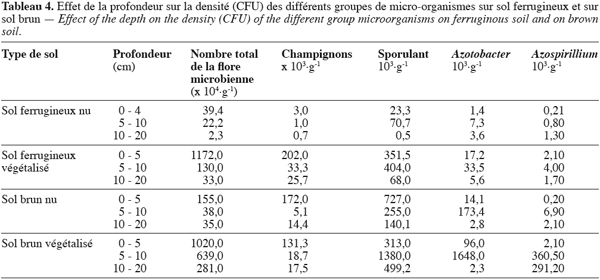
33En milieu végétalisé, les densités sont nettement plus élevées, et les plus fortes se localisent au niveau des dix premiers centimètres. La densité est plus élevée entre 5 et 10 cm pour les spores, les Azotobacter et les Azospirillium ; celle des spores demeure la plus importante.
34Sur sol brun nu, on observe une évolution de la densité microbienne similaire à celle sur sol ferrugineux nu, avec cependant des proportions plus élevées des différents microorganismes.
35Sur sol brun végétalisé, les densités microbiennes sont sept fois plus élevées en surface. Les champignons sont moins représentés en sols nus. Les spores, les Azotobacter et les Azospirillium sont concentrés essentiellement entre 5 et 10 cm. Entre 10 et 20 cm, le taux de microorganismes baisse.
3.2. Evolution cumulée du C/CO2 dégagé dans les croûtes selon les états de surface
36Les dégagements journaliers de CO2 (Figures 1 a et 1 b) présentent des taux de minéralisation journalière pendant 21 jours d’incubation.
37Les pics les plus faibles sont rencontrés au niveau des croûtes nues traduisant une activité biologique plus faible dans ces milieux. L’activité biologique est plus intense dans les sols ferrugineux que dans les sols bruns avec respectivement des cumuls de CO2 de 80 mg / 100 g de sol contre 70 mg / 100 g de sol.
3.3. Evolution du C/CO2 selon les états de surface et en fonction de la profondeur
38En sol ferrugineux comme en sol brun l’intensité des dégagements cumulés baisse avec la profondeur, les plus fortes valeurs sont observées dans les horizons de surface. Les valeurs cumulées sont dans l’ensemble plus élevées en sol ferrugineux qu’en sol brun (Figures 2a et 2b). L’amplitude entre les horizons de surface et l’horizon de profondeur est importante en sol ferrugineux et très faible en sol brun.
39Au niveau des deux types de sol, les dégagements journaliers de CO2 sont plus élevés aussi bien en surface qu’en profondeur, comparés aux états dénudés. Les valeurs cumulées atteignent 60 et 140 mg de C-CO2 / 100 g de sol en fin d’incubation respectivement en sol brun et en sol ferrugineux (Figures 3a et 3b). Les valeurs cumulées sont plus élevées en sol ferrugineux qu’en sol brun.
3.4. Evolution de l’activité biologique en fonction des traitements zaï (0–40 cm)
40En semis traditionnel à la houe (T1).
41En sol ferrugineux tropical lessivé, l’évolution de l’activité biologique reste faible dans l’horizon 20–40 cm et relativement élevé dans les horizons 0–5 cm et 5–20 cm pratiquement durant la toute période de l’incubation.
42En sol brunifié la tendance est exactement la même. Cependant, les valeurs cumulées sont plus fortes qu’en sol ferrugineux (Figures 4a et 4b).
43En paillage simple sur semis traditionnel à la houe (T2). Dans le sol ferrugineux les valeurs sont plus élevées par rapport au témoin, les valeurs cumulées au bout de l’incubation vont de 140 mg de C/CO2 / 100 g de sol en surface à 30 mg de C/CO2 / 100 g entre 20 et 40 cm.
44En sol brunifié, les valeurs sont encore plus élevées et atteignent 170 mg de C/CO2 / 100 g de sol en surface au bout de l’incubation (Figures 5a et 5b).
45En traitement zaï + compost à 3t.ha-1 (T3). En sol ferrugineux, les dégagements journaliers sont tout aussi élevés que les traitements précédents. Les totaux des valeurs cumulées varient de 120 mg de C/CO2 / 100 g de sol en surface à 40 mg de C/CO2 / 100 g de sol entre 20 et 40 cm et 80 mg de C/CO2 / 100 g de sol entre 5 et 20 cm.
46En sol brunifié, le cumul plus élevé atteint 200 mg de C/CO2 / 100 g de sol en surface à 120 mg de C/CO2 / 100 g de sol entre 5 et 20 cm, puis 90 mg de C/CO2/100 g de sol entre 20 et 40 cm. Ces valeurs sont largement supérieures à celles enregistrées en sol ferrugineux pour les mêmes profondeurs. Comme en sol ferrugineux, elles sont aussi supérieures à celles des autres traitements (Figures 6a et 6b).
47En traitement zaï + paille hachée + engrais minéral (T4). En présence de ce traitement, en sol ferrugineux, les dégagements journaliers ont des valeurs inférieures à celles des traitements T3 et T2. Les valeurs totales cumulées décroissent en profondeur.
48En sol brunifié, la présence de l’engrais minéral semble bonifier l’activité biologique, notamment dans les deux premiers horizons (0–20 cm). Les valeurs de cumul, quoique élevées (157 mg de C/CO2 / 100 g de sol) restent inférieures aux valeurs de T3 et T2 (Figures 7a et 7b).
4. Discussion
49L’importance de l’activité biologique se justifie par le rôle de la vie, dans la définition et le maintien des équilibres pédologiques et des caractéristiques physico-chimiques (Bachelier, 1971, 1972, 1973).
50Si l’activité biologique permet de suivre l’état de fertilité d’un sol, elle est en retour fonction des caractéristiques physico-chimiques de celui-ci et de tous les facteurs pouvant les modifier. Le potentiel d’activité biologique du sol dépend de la matière organique avec laquelle elle est en étroite corrélation (Dianou, Thiombiano, 1995 ; Thiombiano, Dianou, 1999).
51Les conditions environnementales du milieu sont reconnues comme jouant un rôle déterminant dans la dynamique de la colonisation de ce milieu par des populations microbiennes. L’influence de ces populations sur leur environnement est gouvernée par les propriétés physico-chimiques des sols. Les facteurs abiotiques peuvent affecter la composition spécifique des communautés microbiennes et leur potentiel biochimique (Alexander, 1977). Cependant, les interactions positives entre les plantes et les micro-organismes de la rhizosphère peuvent améliorer la nutrition des plantes, en augmentant en particulier la fixation biologique de l’azote, en augmentant la tolérance de la plante au stress environnemental et aux pathogènes telluriques réduisant ainsi les besoins d’application d’engrais et de pesticides.
52Les courbes de minéralisation journalière pendant 21 jours présentent plusieurs périodes correspondant à des phases de minéralisation bien précises (Zombre, 1980 ; Sedogo, 1981 ; Hien, 1990).
53Une première phase correspondant à la reprise de l’activité biologique du sol et à la dégradation des produits facilement biodégradables. Cette phase correspond à la biodégradation des microorganismes morts pendant la phase de dessiccation et des composés labiles tels les sucres et composés protéiques. Ce phénomène se traduit par un pic de minéralisation dès le premier jour dont l’importance varie pour chaque site selon l’état de surface et le niveau de profondeur du sol.
54Dans tous les cas, les pics les plus faibles sont rencontrés en croûte nue traduisant une activité biologique plus faible dans ces milieux représentant à peine 1/5 de l’activité des zones végétalisées.
55On note une deuxième phase de décroissance rapide due à la diminution de l’activité biologique suite à la diminution des substances facilement biodégradables, suivie d’une légère reprise correspondant à la bio-dégradation des produits néoformés (Dommergues, 1962).
56Une troisième phase, correspondant à une minéralisation lente intervenant après le onzième jour d’incubation. Elle se traduit par un faible taux de dégagement de CO2. Cette période correspond à la dégradation des composés plus résistants telle que la lignine. Même dans cette phase, les différences demeurent nettes entre les deux états de surface de chaque site.
57Cependant, il faut nuancer cette interprétation car les résultats des tests respirométriques réalisés au laboratoire sont généralement d’une interprétation délicate due aux variations toujours inhérentes aux phénomènes de nature biologique et l’on ne peut être assuré qu’ils représentent exactement les processus naturels. Selon Dommergues et Mangenot (1970), les phases successives distinguées dans l’évolution journalière du CO2 dégagé correspondent à autant d’étapes assurées par des vagues microbiennes différentes.
58Les états de surface végétalisés sont les plus actifs. Cette observation a été déjà faite par Dianou et Thiombiano (1995) qui ont travaillé sur les sols de Katchari dans le Séno en milieu désertifié du Burkina et qui constatèrent que les surfaces comportant de la végétation dégageaient le plus de CO2. L’importance de la respiration au niveau de ces états de surface s’explique par les teneurs relatives en matière organique et par l’aération du sol. Cette conclusion va dans le même sens que celles de nombreux auteurs comme Powel, 1980 ; Habte, El Swaify, 1988 ; Lucas, 1987 ; Thiombiano, Dianou (1999).
59En ce qui concerne les états de surface dénudés qui recouvrent la presque totalité des sites, on constate que la respiration est nettement moins importante et en relation avec la faible aération, les faibles teneurs en matière organique et azote total ainsi que l’acidité élevée. En effet, ces états sont plus exposés à la battance et à l’érosion en raison du manque de couverture végétale.
60Selon Stroosnijder (1992), Thiombiano, Dianou (1999), les facteurs jouant sur la disponibilité de la matière organique telle l’érosion hydrique et éolienne ont une grande influence sur l’activité biologique. Ce qui confirme en partie nos résultats actuels.
61Le type de sol influence l’activité biologique comme l’indiquent les valeurs nettement supérieures en sol ferrugineux plus riche en matière organique au niveau des états nus et moins battant au niveau des états végétalisés.
62Il ressort de l’analyse de l’impact des traitements que les meilleurs traitements demeurent le compost à 3 t.ha-1 (T3) et le paillage (T2) au niveau des deux types de sol. L’activité biologique est améliorée en milieu de paillage même en profondeur (20–40 cm) dans les sols brunifiés (sols à richesse minérale élevée). Le traitement T4 est mieux valorisé sur sol brun. En présence de paille et d’engrais minéral, les résultats sur l’activité biologique sont aussi meilleurs mais la disponibilité de cet engrais reste une contrainte majeure à maîtriser par les producteurs.
5. Conclusion
63Les données sur la biomasse microbienne globale ont montré que quatre groupes de microorganismes se répartissent dans les sols : les champignons, les sporulants, Azotobacter et les Azospirillium, avec une prédominance des sporulants quelque soit le type de sol et l’état de surface ; l’essentiel de cette microflore est concentrée dans les dix premiers centimètres. Au niveau des sols nus, les densités sont beaucoup plus faibles en sol ferrugineux qu’en sol brunifié. En milieu végétalisé, les sols brunifiés demeurent plus riches en biomasse microbienne jusqu’en profondeur en rapport avec les conditions environnementales meilleures de ce milieu.
64La minéralisation exprimée en terme de dégagement potentiel de CO2 des croûtes nues ou des horizons nus est faible comparée aux sols sous végétation.
65Il ressort de l’analyse de l’impact du zaï sur l’activité biologique, que celle-ci est nettement améliorée par l’apport de compost et par le paillage, même à la profondeur de 20 – 40 cm dans les sols brunifiés. La présence de paille et d’engrais minéral dans les poquets valorise également l’activité biologique.
Bibliographie
Abd-El-Malek Y., Ishac YZ. (1968). Evaluation of methods used in counting azotobacters. J. Appl. Bact. 31, p. 267–275.
Alexander M. (1977). Introduction to soil microbiology (2nd ed.). New-York: John Wiley, 467 p.
Alexander M. (1982). Most probable number method for microbial populations. In: Page AI., Muller RH., Keeney DR. Methods of soil analysis (Part 2). Chemical and microbiol properties (2nd ed.). Madison, Wisconsin: ASA–SSSA. p. 815–820.
Ambouta JMK., Valentin C., Laverdiere MR. (1996). Jachère et croûte d’érosion au Sahel. Sécheresse 7, p. 269–275
Bachelier G. (1971). La vie animale dans les sols. I. Déterminisme de la faune des sols II. Action de la faune dans l’évolution des sols considérés en tant qu’équilibres naturels. In: La vie dans les sols. Aspects nouveaux. Etudes expérimentales. Paris : Gauthiers Villars, p. 1–43 ; p. 45–82.
Bachelier G. (1972). Etude expérimentale de l’action des animaux sur l’humification des matériaux végétaux. I. Premières expériences et conclusions préliminaires. Coll. Trav. Doc. n° 14. Paris : ORSTOM, 175 p.
Bachelier G. (1973). Activité biologique et techniques simples qui permettent l’évaluation. Cah. ORSTOM, série pédologie 11 (1), p. 65–77.
Day LD., Sylvia MD., Collins ME. (1987). Interactions among vesicular arbuscular mycorrhizae, soil and landscape position. Soil Sc. Soc. Amer. J. 51, p. 635–639.
Dianou D., Thiombiano L. (1995). Variabilité de l’activité biologique des états de surface des sols de Katchari en milieu désertifié au Burkina Faso. INERA. Documents techniques 3. 9 p.
Döbernier J. (1978). Influence of environnemental factors on the occurence of Spirillum lipoferum in soils and roots. Ecol. Bull. 26, p. 343–352.
Dommergues Y. (1960). La notion de coefficient de minéralisation du carbone dans les sols. Agron. Trop. 15, p. 54–60.
Dommergues Y. (1962). Contribution à l’étude de la dynamique microbienne des sols en zones semi arides et zones tropicales sèche. Ann. Agron. 13 (4), p. 265–324.
Dommergues Y., Mangenot F. (1970). Ecologie microbienne du sol. Paris: Masson et Cie. 53 p.
Kambou N., Zougmore R. (1996). Evolution des états de surface d’un « zipellé » soumis à différentes techniques de restauration des sols (Yilou, Burkina Faso). Bull. Réseau érosion 16, p. 19–32.
Hien V. (1990). Pratiques culturales et évolution de la teneur en azote organique utilisable par les cultures dans un sol ferralitique du Burkina Faso. Thèse de doctorat de l’INPL, Nancy, 149 p.
Mando A., Zougmore R., Zombre NP., Hien V. (2001). Réhabilitation des sols dégradés dans les zones semi-arides de l’Afrique subsahélienne. In: Floret C., Pontanier R. (eds.). La jachère en Afrique tropicale. Vol. II. Paris : John Libbey, p. 311-339.
Marchal JY. (1983). Yatenga ; Haute-Volta : la dynamique d’un espace rural soudano-sahélien. Paris : ORSTOM. Trav. et Doc. 167, 873 p.
Ottow JCG. (1972). Rose Bengal as a selective aid in the isolation of fungi and actinomycetes from natural sources. Mycologia 64, p. 304–315.
Roose E., Kaboré V., Guenat C. (1993). Fonctionnement, limites et améliorations d’une pratique culturale africaine de réhabilitation de la végétation et de la productivité des terres dégradées en région soudano sahélienne (Burkina Faso). Cah. ORSTOM, série pédologie 28 (2), p. 159–173.
Schollhorn R., Burris RH. (1967). Acetylene as a competitive inhibitor of N2-fixation. Proc. Nat. Acad. Sci. USA, p. 58–213.
Sedogo MP. (1981). Contribution à l’étude de la valorisation des résidus culturaux en sol ferrugineux et sous climat tropical semi-aride. Matière organique du sol, nutrition azotée des cultures. Thèse de docteur Ingénieur, INPL, Nancy, 135 p.
Stroosnijder L. (1992). Desertification in Sahelian Africa. Courrier 133, p. 36–39. ECC. Bruxelles, Belgium.
Thiombiano L., Dianou D. (1999). Activité biologique globale dans trois états de surface des sols sahéliens. A.U.O, série B VII, p. 179–187.
Zombre NP. (1980). Etude de la valeur agronomique des résidus de la fermentation méthanique. DEA. Agro-éco-Pédologie, INPL, Nancy, 86 p.
Om dit artikel te citeren:
Over : Prosper N. Zombre
Unité de Formation et de Recherche en Science de la Vie et de la Terre (UFR/SVT). Université de Ouagadougou. Ouagadougou 03 BP 7021 (Burkina Faso). E-mail : prosper.zombre@univ-ouaga.bf






