- Accueil
- Volume 19 (2015)
- numéro 4
- Effet de la profondeur d’enfouissement d’un amendement de moutarde brune sur le développement du piétin échaudage du blé
Visualisation(s): 0 (0 ULiège)
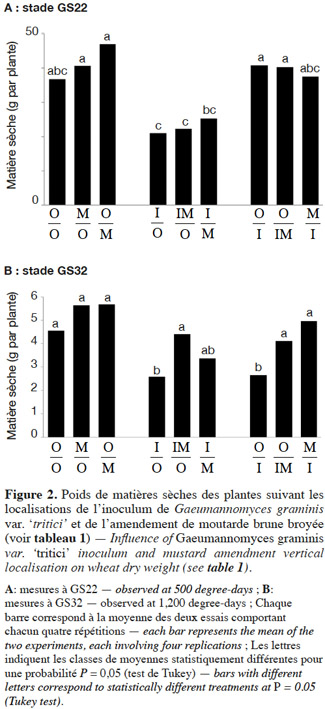
Téléchargement(s): 0 (0 ULiège)
Effet de la profondeur d’enfouissement d’un amendement de moutarde brune sur le développement du piétin échaudage du blé

Notes de la rédaction
Reçu le 11 janvier 2015, accepté le 26 aout 2015
Résumé
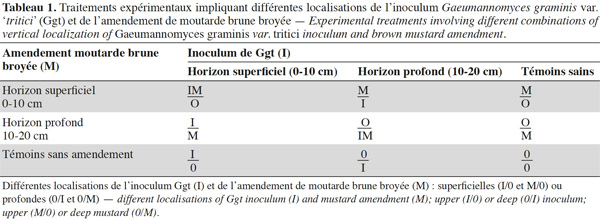
Description du sujet. La période d’interculture est opportune pour réduire l’importance des maladies telluriques.
Objectifs. L’objectif est d’évaluer l’efficacité d’un amendement biofumigant en fonction de sa localisation dans le sol.
Méthode. Une expérimentation combinant différentes localisations d’un inoculum de piétin échaudage et d’un amendement de moutarde brune broyée est conduite en conditions semi-contrôlées.
Résultats. À un stade de développement précoce (GS22), un inoculum présent dans la couche superficielle du sol provoque plus de nécroses qu’un inoculum présent plus profondément. Néanmoins, les infections peuvent être sensiblement réduites par un amendement de moutarde brune, notamment quand il est localisé dans la couche superficielle du sol. À un stade de développement plus tardif (GS32), la localisation de l’inoculum n’a plus d’effet visible sur l’importance des infections racinaires, mais la croissance du blé est accrue là où la moutarde broyée a été incorporée dans la couche superficielle du sol ou au même niveau que l’inoculum.
Conclusions. Ces résultats suggèrent d’une part que l’enfouissement de moutarde broyée dans le sol peut réduire les nécroses dues au piétin échaudage et permettre une croissance végétale accrue et, d’autre part, que l’effet dépend des localisations relatives de l’amendement et de l’inoculum.
Abstract
Effect of the depth of brown mustard amendments in soil on wheat take-all disease
Description of the subject. The intercrop period is opportune for reducing the severity of soilborne diseases.
Objectives. The aim was to evaluate the effectiveness of a biofumigant amendment according to its location in the soil.
Method. An experiment combining different locations of wheat take-all inoculum and of ground brown mustard amendment was conducted under semi-controlled conditions.
Results. At the early plant development stage (GS22), an inoculum localized in superficial soil horizons caused more disease than a deeper inoculum. However, it was possible to reduce significantly the level of infection through the addition of a brown mustard amendment, particularly when located in the top soil. At a later plant development stage (GS32), the location of the inoculum had no further visible effect on the severity of root infections but wheat growth increased when ground mustard was incorporated at the surface layer of the soil or at the same level as the inoculum.
Conclusions. These results suggest firstly, that ground mustard amendment can reduce necrosis caused by wheat take-all and can allow increased plant growth, and secondly, that the effect depends on the relative locations of the amendment and of the inoculum.
1. Introduction
1Les agents pathogènes telluriques sont souvent polyphages et peuvent survivre plusieurs années dans le sol. Les stratégies basées uniquement sur les rotations des cultures ne réduisent pas suffisamment l’importance de ces maladies, les variétés résistantes sont souvent inutilisées, les traitements de désinfection des sols peuvent être néfastes pour l’environnement et les techniques de solarisation sont couteuses. Pour le piétin échaudage du blé (PE) dû à Gaeumannomyces graminis var. ‘tritici’ (Ggt), responsable de nécroses racinaires, la lutte directe est difficile : absence de résistance variétale (Cook, 2003), traitement chimique des semences peu efficace (Schoeny et al., 1999). Les techniques culturales sont partiellement efficaces : rotation avec des cultures non hôtes (Colbach et al., 1994), travail du sol (Colbach et al., 1995), semis tardifs (Gutteridge et al., 2003) et faible densité (Gosme et al., 2007). La biofumigation est proposée dans les stratégies de protection intégrée (Kirkegaard et al., 2000 ; Motisi et al., 2009). Si les effets des biofumigants in vitro de Brassica sont bien documentés (Brown et al., 1997), les résultats en champs sont variables suivant le pathogène, le type et la densité d’inoculum et les conditions expérimentales (Kirkegaard et al., 2004 ; Ennaïfar et al., 2005 ; Motisi, 2009). L’effet dû à l’inversion des horizons du sol (labour) n’a pas été étudié. L’objectif de ce travail est d’estimer l’action de Brassica juncea suivant sa localisation relative à l’inoculum.
2. Matériel et méthodes
2L’inoculum est produit à partir de l’isolat IV26 de Gaeumannomyces graminis var. ‘tritici’ (Ggt) (Willocquet et al., 2008) cultivé sur milieu malt-gélose. Huit explants sont prélevés sur des cultures âgées de sept jours pour ensemencer du millet blanc (125 g de millet et 125 g d’eau, préalablement autoclavés). Après quatre semaines d’incubation à 20 °C dans l’obscurité (Lucas et al., 1989), le millet est colonisé par Ggt.
3Le substrat utilisé pour cultiver la moutarde et le blé est un mélange sable-tourbe (1:1). Son inoculation est obtenue en mélangeant 500 grains de millet colonisés par Ggt par litre de substrat (Lucas et al., 1989).
4La plante biofumigante utilisée est la moutarde brune Brassica juncea (variété 1 420), choisie pour sa haute teneur en glucosinolate à la floraison (1,2 à 21,6 µmol·g-1) (Kirkegaard et al., 1998) et sa toxicité in vitro vis-à-vis de Ggt (Motisi et al., 2007). Les plantes sont cultivées en chambre climatisée (240 plantes par m2) jusqu’à l’apparition des premières gousses. Elles sont alors séparées du substrat, broyées (10 s, broyeur VorWerk) et immédiatement mélangées au substrat de culture (50 g·l-1 de matière fraiche, soit 7,65 g·l-1 de matière sèche).
5Les différents types de substrats (avec ou sans inoculum, avec ou sans moutarde broyée) sont répartis en couches de 10 cm de hauteur dans des pots (20 cm de haut) pour constituer les différents traitements (Tableau 1) et brumisés pour initier l’hydrolyse des glucosinolates et le processus de biofumigation. Les pots sont placés dans une serre froide ventilée (températures maintenues entre 0 et 30 °C) pendant 20 jours avant le semis (12 grains de la variété Caphorn par pot). Pendant toute la durée de l’essai, les substrats sont maintenus humides par apports d’eau réguliers dans les coupelles de chacun des pots.
6Les niveaux de maladie et les quantités de matière sèche des plantes sont estimés à deux stades de croissance du blé (GS22 et GS32 de l’échelle de Zadocks) (Zadoks et al., 1977). Les plantes sont séparées du substrat et lavées avant l’évaluation visuelle de l’importance de la maladie : incidence (pourcentage de plantes présentant les nécroses racinaires typiques de PE), sévérité (pourcentage de racines nécrosées). Elles sont ensuite séchées (2 jours à 75 °C) pour connaitre leur masse de matière sèche (g par plante).
7Deux essais successifs de quatre blocs complets randomisés sont conduits. Les différences statistiquement significatives sont révélées par l’analyse de la variance (logiciel R version 2.11.1, test de Tuckey P = 0,05).
3. Résultats
8Les effets essais et interaction traitements-essais ne sont pas significatifs.
9L’incidence de PE est de 100 %, aux deux stades de notation, que l’inoculum soit superficiel ou profond, avec ou sans moutarde. Sur les traitements sans inoculum, aucune racine ne présente de nécrose.
10Sur la sévérité de PE (Figures 1A et 1B), l’effet traitements n’est significatif qu’à GS22. L’inoculum superficiel donne lieu aux plus grandes sévérités (jusqu’à 42,1 %), mais la moutarde broyée incorporée superficiellement ou profondément permet de la réduire significativement (à 32,7 et 23,9 %, respectivement).
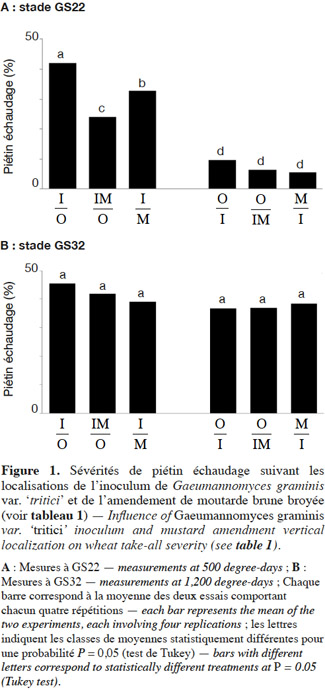
11Sur les matières sèches des plantes (Figures 2A et 2B), l’effet traitements est significatif à GS22 et GS32. À GS22, seul l’inoculum superficiel affecte significativement la production de matières sèches. À GS32, la présence d’inoculum, superficiel ou profond, réduit la production de matière sèche par rapport au témoin, mais l’incorporation de moutarde permet de limiter cet effet et les différences ne sont plus significatives par rapport aux témoins non inoculés.
4. Conclusions
12Cette expérimentation en pots précise l’interaction entre des localisations relatives de l’inoculum de Ggt et de l’amendement biofumigant moutarde brune. Au stade précoce GS22, le PE est plus sévère quand l’inoculum est superficiel et la croissance du blé est affectée : les racines rencontrent rapidement l’inoculum superficiel et les infections primaires interviennent précocement (Gosme et al., 2009). La moutarde broyée réduit l’infection si elle est proche de l’inoculum. Au stade tardif GS32, aucune différence entre les sévérités de la maladie n’est observable : les racines ont atteint la couche profonde du substrat et rencontré l’inoculum profond. L’incorporation de moutarde broyée permet de réduire les pertes de matières sèches, que l’inoculum soit superficiel ou profond.
13En résumé, l’incorporation superficielle de moutarde broyée donne lieu aux meilleurs résultats. Différents mécanismes peuvent coexister : action directe des glucosinolates sur l’inoculum, apport nutritif aux plantes par la moutarde broyée, modification du développement microbiologique dans le sol (Cohen et al., 2006). La préconisation est donc d’incorporer superficiellement la plante biofumigante broyée, que l’inoculum soit profond ou superficiel : cette préconisation doit maintenant faire l’objet d’expérimentations en champs.
Bibliographie
Brown P.D. & Morra M.J., 1997. Control of soil-borne plant pests using glucosinolate-containing plants. Adv. Agron., 61, 167-231.
Cohen M.F. & Mazzola M., 2006. Resident bacteria, nitric oxide emission and particle size modulate the effect of Brassica napus seed meal on disease incited by Rhizoctonia solani and Pythium spp. Plant Soil, 286, 75-86.
Colbach N., Lucas P. & Cavelier N., 1994. Influence of crop succession on foot and root diseases of wheat. Agronomie, 14, 525-540.
Colbach N. & Meynard J.M., 1995. Soil tillage and eyespot. Influence of crop residue distribution on disease development and infection cycles. Eur. J. Plant Pathol., 101, 601-611.
Cook R.J., 2003. Take-all of wheat. Physiol. Mol. Plant Pathol., 62, 73-86.
Ennaïfar S., Lucas P., Meynard J.M. & Makowshi D., 2005. Effects of summer fallow management on take-all of winter wheat caused by Gaeumannomyces graminis var. tritici. Eur. J. Plant Pathol., 112, 167-181.
Gosme M., Willocquet L. & Lucas P., 2007. Size, shape and intensity of aggregation of take-all disease during natural epidemics in second wheat crops. Plant Pathol., 56, 87-96.
Gosme M. & Lucas P., 2009. Combining experimentation and modelling to estimate primary and secondary infections of take-all disease of wheat. Soil Biol. Biochem., 41, 1523-1530.
Gutteridge R.J. & Hornby D., 2003. Effects of sowing date and volunteers on the infectivity of soil infested with Gaeumannomyces graminis var. tritici and on take-all disease in successive crops of winter wheat. Ann. Appl. Biol., 143, 275-282.
Kirkegaard J.A. & Sarwar M., 1998. Biofumigation potential of brassicas. I. Variation in glucosinolate profiles of diverse field-grown brassicas. Plant Soil, 201, 71-89.
Kirkegaard J.A. et al., 2000. Field studies on the biofumigation of take-all by Brassica break crops. Aust. J. Agric. Res., 51, 445-456.
Kirkegaard J.A. & Matthiessen J., 2004. Developing and refining the biofumigation concept. Agroindustria, 3, 233-239.
Lucas P., Sarniguet A., Collet J.M. & Lucas M., 1989. Réceptivité des sols au piétin échaudage (Gaueumannomyces graminis var tritici) : influence de certaines techniques culturales. Soil Biol. Biochem., 21, 1073-1078.
Motisi N., 2009. Réguler les maladies d’origine tellurique par une interculture de Brassicacées : mécanismes d’action et conditions d’expression dans une succession betterave-blé. Thèse de doctorat : Agrocampus Ouest, Rennes (France).
Motisi N. et al., 2009. Growing Brassica juncea as a cover crop, then incorporating its residues provide complementary control of Rhizoctonia root of sugar beet. Field Crops Res., 113, 238-245.
Motisi N., Ravenel C., Limache F. & Montfort F., 2007. In vitro sensitivity of some soil-borne pathogens to allelopathic compounds of some Brassicaceae. Prospects for soil-borne pest management. In: Proceedings of the 32nd International carrot conference, 5-7 September 2007, Palais des Congrès, Arcachon (Bordeaux), France.
Schoeny A. & Lucas P., 1999. Modeling of take-all epidemics to evaluate the efficacy of a new seed-treatment fungicide on wheat. Phytopathology, 89, 954-961.
Willocquet L., Lebreton L., Sarniguet A. & Lucas P., 2008. Quantification of within-season focal spread of wheat take-all in relation to pathogen genotype and host spatial distribution. Plant Pathol., 57, 906-915.
Zadoks J.C., Chang T.T. & Konsack C.F., 1977. Un code décimal pour les stades de croissance des céréales. Phytiatrie Phytopharmacie, 26, 129-140.






