Écologie et gestion des espèces multi-usages du genre Erythrophleum (Fabaceae-Caesalpinioideae) en Afrique (synthèse bibliographique)
Reçu le 7 octobre 2014, accepté le 26 aout 2015
Résumé
Introduction. Largement distribué en Afrique, le genre Erythrophleum regroupe quatre espèces d’arbres d’une grande valeur socio-culturelle et économique : Erythrophleum ivorense, Erythrophleum suaveolens, Erythrophleum africanum et Erythrophleum lasianthum. La connaissance de leur écologie et de leur mode de distribution est nécessaire pour en assurer une gestion durable. Cet article synthétise les données disponibles dans la littérature sur ces espèces, notamment en botanique, phylogéographie, écologie, ethnobotanique et sylviculture.
Littérature. Erythrophleum ivorense, E. suaveolens, E. africanum et E. lasianthum diffèrent morphologiquement et sont présentes dans des aires climatiques distinctes. Elles sont héliophiles non pionnières (E. ivorense et E. suaveolens) ou pionnières (E. africanum). La dispersion primaire est ballochore. Les graines présentent une période de dormance et peuvent rester plusieurs années dans le sol. La phénologie est régulière et annuelle. La croissance annuelle moyenne varie entre les espèces, de la plus élevée pour E. ivorense (0,65 cm par an) à la plus faible pour E. africanum (0,16 cm par an). Elles sont largement utilisées dans la médecine traditionnelle. Seules E. ivorense et E. suaveolens sont exploitées pour le bois d’œuvre et soumises à des normes d’exploitation et des tests sylvicoles.
Conclusions. Les données sur l’écologie des espèces du genre Erythrophleum sont globalement mieux renseignées pour E. ivorense et E. suaveolens en raison de leur importance économique. Cette synthèse a permis de mettre en évidence certains manques de connaissances notamment sur la phénologie (relation avec le climat, périodes de fructifications), les diamètres minimums de fructification et les mécanismes de levée de dormance naturelle des graines. Remédier à ces lacunes contribuerait notablement à améliorer les méthodes de gestion des populations de ces espèces.
Abstract
Ecology and management of the multipurpose Erythrophleum species (Fabaceae-Caesalpinioideae) in Africa. A review
Introduction. Widespread in Africa, the Erythrophleum genus includes four tropical tree species with a high economic and socio-cultural value: Erythrophleum ivorense, Erythrophleum suaveolens, Erythrophleum africanum and Erythrophleum lasianthum. Appropriate knowledge of the ecology and the distribution of these species is required for their sustainable management. This paper is based on an extensive literature review and summarizes the available information on the African Erythrophleum species in terms of botany, phylogeography, ecology, forestry and ethnobotany.
Literature. Erythrophleum ivorense, E. suaveolens, E. africanum and E. lasianthum are morphologically different and occur in distinct climatic areas. They are non-pioneer light demander (E. ivorense and E. suaveolens) or pioneer species (E. africanum). Their primary mode of dispersal is via ballochore. The seeds have a dormancy period and can remain in the soil for several years. Their reproductive and foliar phenologies are regular and annual. Growth rate varies between species, ranging from 0.65 cm per year for E. ivorense to 0.16 cm per year for E. africanum. These trees are used in traditional medicine. Only E. ivorense and E. suaveolens (Tali) are mainly logged for timber.
Conclusions. Erythrophleum species ecological data are better informed for E. ivorense and E. suaveolens because of their economic importance. This review highlights the existing lack of knowledge regarding the phenology (effects of climate, fructification periods), the minimum diameter of fructification and the mechanisms of natural seed dormancy breakage. Targeting such weaknesses is required to create or re-evaluate methods of conservation and/or enhancement of populations and logging practices.
1. Introduction
1Les écosystèmes forestiers tropicaux sont reconnus pour les biens et les services écosystémiques qu’ils procurent. Les forêts africaines ont notamment une grande importance en termes de régulation des cycles biogéochimiques (par exemple, carbone et eau), d’approvisionnement en bois et produits forestiers non ligneux, de services culturaux et coutumiers. Dans le contexte du changement planétaire (« global change ») et notamment de sa composante climatique, les questions de la résilience de ces écosystèmes et de la durabilité de la production des biens et des services qu’ils fournissent se posent avec acuité. Le genre Erythrophleum (Fabaceae-Caesalpinioideae), largement distribué en Afrique, a une grande importance socio-culturelle et économique (bois d’œuvre, pharmacopée traditionnelle et industrielle). Cependant, la faible connaissance de l’écologie des espèces du genre limite la formulation et l’application de normes nécessaires à leur gestion durable.
2Le genre Erythrophleum est représenté par sept espèces d’arbres tropicaux : quatre espèces sont endémiques du continent africain (Erythrophleum ivorense A.Chev, Erythrophleum suaveolens [Guill. & Perr.] Brenan, Erythrophleum africanum [Benth.] Harms et Erythrophleum lasianthum Corbishley), une espèce est présente à Madagascar (Erythrophleum couminga Baill.), une en Australie (Erythrophleum chlorostachys [F.Muell.] Baill.) et une en Chine (Erythrophleum fordii Oliv.). Dans cet article, nous faisons un état des lieux des connaissances des quatre espèces africaines du genre : E. ivorense, E. suaveolens, E. africanum et E. lasianthum afin de :
3– définir les caractéristiques morphologiques permettant de les différencier ;
4– déterminer leurs aires de distribution ;
5– synthétiser les connaissances sur leur écologie ;
6– décrire leurs usages et leurs règles de gestion.
7La recherche bibliographique a été réalisée à partir des bases de données fournies par les moteurs de recherches Google Scholar, ScienceDirect et Scopus ainsi que des ressources disponibles dans les bibliothèques de Gembloux Agro-Bio Tech (Université de Liège) et du Jardin botanique national de Belgique. Plus de 160 références ont été consultées, dont 35 flores, 6 mémoires de master, 4 mémoires de thèses et 10 rapports de projet. Les 65 références les plus pertinentes sont citées dans cet article. Les critères de sélection sont relatifs aux nombres de citations des articles, à la reconnaissance des auteurs, à la rigueur de la méthodologie employée et à la pertinence des résultats présentés.
2. Description botanique et considérations taxonomiques
8Les espèces du genre Erythrophleum sont des arbres inermes à feuilles alternes bipennées à foliolules alternes et pétiolulées. Les stipules sont petites et rapidement caduques. Une glande est située à la base de chaque paire de pinnules sur le rachis principal. L’inflorescence est en panicule de racèmes. Les bractées sont très petites et caduques avant ou pendant l’ouverture de la fleur. Les fleurs ont un calice campanulé à cinq lobes soudés à la base ou presque libres. Les cinq pétales sont libres et égaux, imbriqués dans le bouton, plus ou moins pubescents ou tomenteux. Les dix étamines sont alternativement longues et courtes et ont des filets glabres ou poilus. L’ovaire est longuement stipité à style court, tomenteux ou densément pubescent. Les gousses sont oblongues ou oblongues-elliptiques, ligneuses ou coriaces et déhiscentes. Les graines sont attachées par un assez long funicule, ne sont pas aréolées, présentent un endosperme et sont disposées transversalement dans la gousse (Aubréville, 1959 ; Brenan, 1967 ; Hawthorne, 1995).
9Les espèces africaines du genre Erythrophleum présentent des ressemblances morphologiques qui rendent l’identification souvent difficile et ont conduit à de nombreuses confusions et erreurs taxonomiques. La plupart des flores signalent des distinctions entre les espèces au niveau du degré de pubescence et de la forme de leur limbe. Cependant, des formes intermédiaires des foliolules ont déjà été signalées. Au Gabon, par exemple, Aubréville (1959) décrit les foliolules des individus d’E. suaveolens comme proches de la forme typique des foliolules d’E. ivorense. L’auteur suggère que les individus généralement séparés en deux espèces au Gabon, E. ivorense et E. suaveolens, seraient davantage des variétés écotypiques d’une même espèce. Dans la flore de la Côte d’Ivoire, Aubréville (1968) rend également compte de la variabilité de la forme des feuilles d’E. ivorense qui parfois se rapproche de la feuille d’E. suaveolens.
10La distinction difficile entre les espèces du genre Erythrophleum sur le terrain est un obstacle à la définition exacte de leurs caractéristiques morphologiques et de leurs aires de distribution respectives. Une étude génétique entreprise sur des individus d’E. ivorense et d’E. suaveolens en Afrique de l’Ouest et centrale a permis de valider les différences morphologiques, telles que définies par les taxonomistes, entre ces deux espèces reproductivement isolées (Duminil et al., 2010).
11Afin de faciliter l’identification des espèces du genre Erythrophleum, une synthèse des ouvrages de référence (Aubréville, 1959 ; Brenan, 1967 ; Aubréville, 1968 ; Aubréville, 1970 ; Moll, 1978 ; Vivien et al., 1985 ; Pooley, 1993 ; Hawthorne, 1995 ; Wyk et al., 1997 ; Poorter, 2004 ; Akoègninou et al., 2006 ; Arbonnier, 2009) est présentée ci-dessous sous forme de clés permettant de différencier les espèces à partir de la chorologie et des caractéristiques végétatives et reproductives (Encadré 1).

3. Distribution géographique
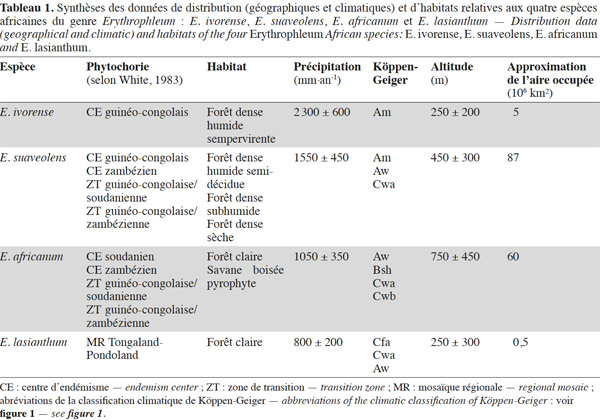
12Le genre Erythrophleum est largement distribué en Afrique. Les différentes espèces occupent des aires géographiques et climatiques adjacentes (Figure 1, Tableau 1).
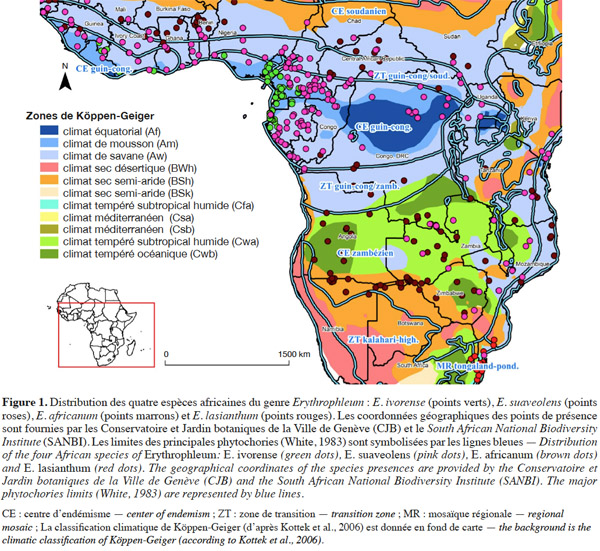
3.1. Aire de distribution
13Erythrophleum ivorense s’étend de la Gambie au Gabon. L’espèce suit une distribution principalement côtière dans le centre régional d’endémisme guinéo-congolais tel que défini par White (1983) (Figure 1). Son aire de distribution est discontinue car l’espèce est totalement absente au niveau de l’intervalle du Dahomey qui correspond à une interruption de la forêt dense humide par une zone de forêts sèches et de savanes au niveau du Togo et du Bénin (Akoègninou et al., 2006 ; Duminil et al., 2013). Le climat est de type Am avec des précipitations annuelles de 2 300 ± 600 mm en moyenne sur l’aire de distribution (Kottek et al., 2006 ; Figure 1).
14Erythrophleum suaveolens est présente du Sénégal au Kenya, du Mozambique au Zimbabwe (Akoègninou et al., 2006). L’aire géographique de cette espèce s’étend sur le centre régional d’endémisme guinéo-congolais, les zones de transition régionales guinéo-congolaise/soudanienne et guinéo-congolaise/zambézienne, le centre régional d’endémisme zambézien et la mosaïque régionale de Zanzibar-Inhambane (Aubréville, 1970 ; Hawthorne, 1995 ; Duminil et al., 2010 ; Figure 1). Le climat est majoritairement de type Am, Aw et Cwa avec des précipitations annuelles de 1 550 ± 450 mm en moyenne sur l’aire de distribution (Kottek et al., 2006 ; Figure 1).
15Erythrophleum africanum est présente du Sénégal au Soudan, du Kenya à la Tanzanie et au Sud de la région du Transvaal en Afrique du Sud dans trois centres régionaux d’endémisme distincts : guinéo-congolais, soudanien, zambézien ainsi que dans leurs zones de transition régionales respectives (White, 1983 ; Arbonnier, 2009 ; Figure 1). Le climat est majoritairement de type Am, Bsh, Cwa et Cwb avec des précipitations annuelles de 1 050 ± 350 mm en moyenne sur l’aire de distribution (Figure 1).
16Erythrophleum lasianthum est présente en Afrique australe et plus précisément à l’est du Transvaal, au sud du Mozambique, au Swaziland et dans la région du Natal en Afrique du Sud, ce qui correspond à la mosaïque régionale du Tongaland-Pondoland (sud du Mozambique et nord-ouest de l'Afrique du Sud aux alentours du Swaziland [Moll, 1978 ; White, 1983 ; Wyk, 1996 ; Figure 1]). Le climat est majoritairement de type Aw, Cfa et Cwa avec des précipitations annuelles de 800 ± 200 mm en moyenne sur l’aire de distribution (Hijmans et al., 2005 ; Figure 1).
3.2. Habitat
17À l’échelle continentale, les espèces du genre semblent parfois distribuées en sympatrie. Néanmoins, elles n’occupent pas les mêmes habitats à l’échelle locale (Tableau 1). Dans le centre d’endémisme guinéo-congolais, la distribution d’E. ivorense est limitée majoritairement aux forêts denses humides sempervirentes côtières, alors qu’E. suaveolens est présente davantage dans les forêts semi-décidues (Aubréville, 1959 ; Vivien et al., 1985). Ces deux espèces suivent une distribution parapatrique avec comme zones de contact les forêts de transition entre le type sempervirent et le type semi-décidu (Duminil et al., 2010 ; Duminil et al., 2013).
18Erythrophleum suaveolens et E. africanum sont sympatriques dans les zones de transition régionales guinéo-congolaise/soudanienne et guinéo-congolaise/zambézienne (Figure 1). Toutefois, elles occupent des habitats distincts. Dans les zones de transition, E. suaveolens est présente dans les forêts denses sèches ou subhumides, alors qu’E. africanum est limitée aux forêts claires et aux savanes boisées pyrophytes sur sols légers (Aubréville, 1950 ; Aubréville, 1970 ; Fairhead et al., 1996 ; Goetze et al., 2006 ; Arbonnier, 2009). En région soudanienne, E. africanum est présente dans les forêts claires basses à Isoberlinia doka, Burkea africana et Daniellia diveri (White, 1983 ; Holdo, 2006).
19Dans le centre d’endémisme zambézien, E. suaveolens et E. africanum occupent également des habitats différents. Dans la grande partie nord de cette région, E. africanum est présente dans la matrice paysagère correspondant à des forêts claires à Brachystegia-Julbernardia et des savanes boisées à Burkea-Erythrophleum appelées respectivement « miombo » et « chipya ». Erythrophleum suaveolens est inféodée aux taches de forêts denses sèches dispersées au sein de cette matrice et nommées « mateshi » (Lawton, 1978 ; Tuite et al., 1990 ; De Wolf, 1998 ; Chidumayo et al., 2010).
20Dans la partie sud du centre d’endémisme zambézien, E. africanum et E. suaveolens sont présentes dans ou en périphérie des zones de forêts claires à Colophospermum mopane ou « mopane ». Contrairement aux forêts claires de type « miombo » qui s’installent sur des sols à texture sableuse, pauvres en nutriments et bien drainés, les forêts claires de type « mopane » sont souvent confinées aux sols plus argileux et riches en nutriments (Chidumayo et al., 2010). Erythrophleum africanum est également présente dans les forêts claires sur sol sableux du Kalahari (Childes et al., 1987 ; Chidumayo et al., 2010).
21Erythrophleum lasianthum a une distribution restreinte, limitée au centre d’endémisme du Maputaland qui correspond à la partie septentrionale de la mosaïque régionale du Tongaland-Pondoland, c’est-à-dire la partie nord de la province du KwaZulu-Natal, en Afrique du Sud entre le Swaziland et la côte de l’océan Indien (Figure 1 ; Moll, 1978 ; White, 1983 ; Wyk, 1996). L’espèce est typique des forêts claires sèches et riveraines de basse altitude sur sols sableux où elle domine avec Dialium schlechteri (Palmer et al., 1972 ; Moll, 1978 ; Pooley, 1993 ; Wyk, 1996 ; Wyk et al., 1997).
3.3. Phylogéographie
22Erythrophleum ivorense et E. suaveolens sont des espèces sœurs plus proches génétiquement l’une de l’autre que d’E. africanum. L’âge du dernier ancêtre commun entre E. ivorense et E. suaveolens d’Afrique centrale est estimé à 0,62 Ma (contre 3,79 Ma entre E. africanum et l’ancêtre commun à E. ivorense et E. suaveolens) (Duminil et al., 2015). Aucune date de spéciation n’a pour le moment été calculée pour E. lasianthum.
23Au sein d’E. ivorense et d’E. suaveolens, une structure génétique spatialisée a été identifiée sur une zone d’étude englobant la côte de la Guinée à l’Afrique centrale (Duminil et al., 2010 ; Duminil et al., 2013 ; Duminil et al., 2015 ; Figure 2). Les patrons de diversité génétique ont été analysés par l’étude de marqueurs microsatellites de type Simple Sequence Repeats (SSRs). Trois pools génétiques distincts ont été identifiés au sein de chaque espèce. La structure génétique supporte la présence d'une barrière nord-sud au flux de gènes à environ 2°N et d’une barrière est-ouest, correspondant à la transition entre les forêts humides et sèches dans le centre du Cameroun pour E. suaveolens et au Nigeria pour E. ivorense (Figure 2, Duminil et al., 2013).
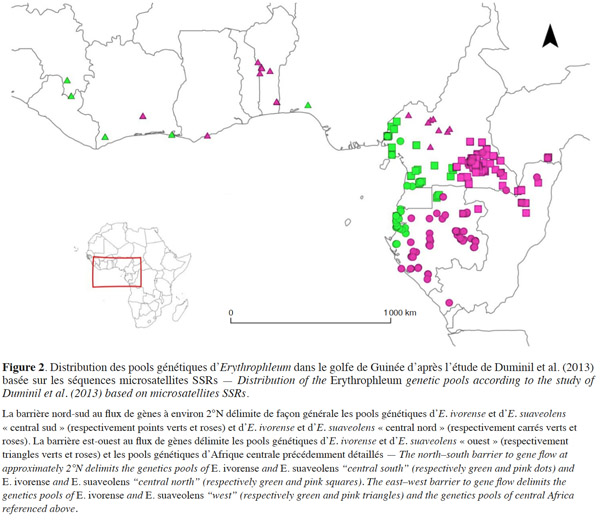
24Ce patron de diversité génétique intra-spécifique a été en partie validé par l’utilisation de marqueurs nucléaires (Duminil et al., 2015). Cette méthode a permis de dater les divergences entre les pools génétiques ainsi que les changements démographiques passés. Trois pools génétiques similaires à ceux identifiés par SSRs ont été détectés pour E. suaveolens. Les dates de divergences entre ces pools ont été estimées au Pléistocène supérieur (120 ka entre les pools génétiques de part et d’autre de la barrière est-ouest au flux de gènes, 60 ka entre les pools génétiques de part et d’autre de la barrière nord-sud). Au sein d’E. ivorense, un seul pool génétique a été mis en évidence au lieu des trois identifiés par SSRs. Les auteurs émettent deux hypothèses pour expliquer ces résultats différents :
25– un taux de mutation plus élevé des SSRs qui leur aurait permis d’accumuler de nouveaux allèles plus rapidement que les gènes nucléaires ;
26– la possibilité que le polymorphisme plus élevé des SSRs permette de détecter des différenciations plus fines entre les pools.
3.4. Hypothèses sur l’origine de la distribution des espèces
27Deux hypothèses majeures sont susceptibles d’expliquer la distribution et la structure génétique des espèces du genre Erythrophleum : l’hypothèse des refuges forestiers et l’hypothèse du gradient écologique. L’hypothèse des refuges forestiers suppose que les phénomènes de fragmentation et d’expansion des forêts pendant les oscillations climatiques du Pléistocène (i.e. entre 2.6 Ma et 12 ka) sont les moteurs de la différenciation des espèces (Maley, 1996). L’hypothèse du gradient écologique suppose que des gradients environnementaux peuvent induire des spéciations parapatriques (ou des différenciations écotypiques) sans que les populations ne soient isolées géographiquement.
28La réévaluation des techniques de datation moléculaire a permis de dater la spéciation entre E. ivorense et E. suaveolens comme contemporaine aux périodes glaciaires du Pléistocène (Duminil et al., 2015). L’hypothèse des refuges forestiers est donc reconsidérée pour expliquer la divergence entre ces deux espèces qui, jusqu’à récemment, était estimée comme largement antérieure aux oscillations climatiques du Pléistocène (Duminil et al., 2013). Erythrophleum ivorense, E. suaveolens et E. africanum étant spécialisées à différents types de climat, et notamment de disponibilité annuelle en eau, ces résultats suggéraient un rôle majeur des gradients climatiques comme pilotes des différenciations entre espèces au sein du genre (Duminil et al., 2010 ; Duminil et al., 2013).
29La datation des changements démographiques et des divergences entre les pools génétiques confirment également le rôle des refuges forestiers dans la définition des patrons de diversité intra-spécifiques au sein d’E. ivorense et d’E. suaveolens. Les divergences entre les pools génétiques au sein d’E. suaveolens sont concomitantes avec les dernières périodes glaciaires du Pléistocène (i.e. entre 200 ka et 130 ka et entre 115 ka et 10 ka). Les trois pools génétiques sont très probablement issus de l’isolation des individus d’E. suaveolens dans trois refuges différents (deux en Afrique centrale et un en Afrique de l’Ouest).
30Néanmoins, la nette différence dans les conditions écologiques, notamment de disponibilité en eau, occupées par les espèces et par les pools génétiques d’E. suaveolens d’Afrique centrale et de l’Ouest, suggère un rôle synergique de l’environnement dans leur divergence (Duminil et al., 2015 ; Duminil, communication personnelle).
4. Caractéristiques écologiques
31Les données sur l’écologie des espèces du genre sont encore assez lacunaires et sont globalement mieux renseignées pour E. ivorense et E. suaveolens largement exploitées pour le bois d’œuvre.
4.1. Tempérament et structure des populations
32Erythrophleum ivorense et E. suaveolens sont définies comme des espèces non pionnières héliophiles (« non-pioneer light demander » ou héliophiles modérées ; Hawthorne, 1995 ; Doucet, 2003). Les juvéniles de ces espèces sont brièvement tolérants à l’ombre mais ont rapidement besoin de lumière pour poursuivre leur développement. Toutefois, Hawthorne (1995) note également une évolution contraire du tempérament en observant des plantules généralement très exposées à la lumière et des arbres de 30 à 90 cm de diamètre plus souvent ombragés. Une importante régénération observée après la pratique du brûlis dans les champs pourrait plaider en faveur de ce tempérament davantage pionnier dans les stades juveniles, bien que Van Gemerden et al. (2003) ne montrent pas de préférence significative d’E.ivorense pour les zones de jachères des champs.
33Généralement, ces tempéraments sont caractérisés par une structure de population en cloche en forêt dense. Les analyses des structures des populations chez E. ivorense et E. suaveolens montrent des effectifs plus élevés dans les classes de diamètres de 70 à 90 cm. Un déficit en jeunes tiges traduit les difficultés de régénération de ces espèces au Cameroun, Gabon et au Nord Congo (Poorter et al., 1996 ; Durrieu De Madron et al., 1997 ; Doucet, 2003 ; Kouadio, 2009).
34Erythrophleum africanum est une espèce pyrophyte s’installant uniquement dans des milieux ouverts souvent après le passage de feux violents (Lawton, 1978). Cette espèce semble donc être de tempérament pionnier héliophile (Pi ; « pioneer » selon la définition de Hawthorne [1995]). Aucune information sur le tempérament d’E. lasianthum et les structures des populations d’E. africanum et d’E. lasianthum n’est disponible à notre connaissance.
4.2. Phénologie
35Une synthèse des données phénologiques disponibles dans la littérature est présentée ci-après (Tableau 2). La phénologie des espèces africaines du genre Erythrophleum semble être relativement régulière, annuelle et calée sur les saisons (Childes, 1988 ; Hawthorne, 1995 ; Richer, 2008 ; Arbonnier, 2009 ; Kouadio, 2009). La phénologie est décalée entre les populations d’une même espèce situées au Sud et au Nord de la charnière climatique, reflet du décalage des saisons entre les deux régimes climatiques boréal et austral (Suchel, 1990 ; Gonmadje et al., 2012).
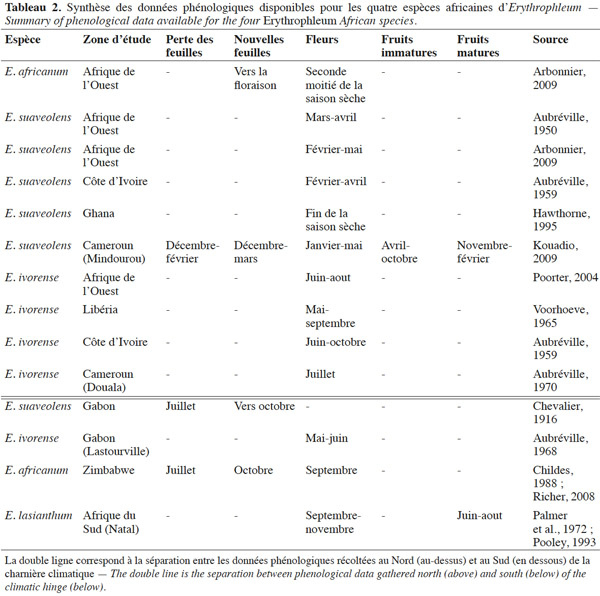
36Phénologie foliaire. Erythrophleum suaveolens et E. africanum sont caducifoliées. La défeuillaison débute pendant la grande saison sèche, en décembre au Nord de la charnière climatique (Cameroun) et en juillet au Sud (Gabon et Afrique du Sud). Elle est probablement initiée par la baisse des précipitations et le dessèchement du sol (Childes, 1988 ; Richer, 2008 ; Arbonnier, 2009 ; Kouadio, 2009). La chute des feuilles n’est pas synchrone entre les individus : elle se déroule de façon progressive d’un arbre à l’autre et d’une branche à l’autre sur le même arbre (Childes, 1988 ; Richer, 2008 ; Kouadio, 2009). Pour ces même espèces, le pic de nouvelles feuilles démarre vers décembre au Nord de la charnière climatique et en octobre au Sud, avec les premières pluies (Childes, 1988 ; Arbonnier, 2009 ; Kouadio, 2009).
37Phénologie reproductrice. Au Nord de la charnière climatique, E. ivorense fleurit entre (mai-) juin et septembre (-octobre), ce qui correspond à la pleine saison des pluies (Aubréville, 1959 ; Voorhoeve, 1965 ; Poorter, 2004). La floraison d’E. suaveolens débute plus tôt, vers le mois de février, ce qui correspond à l’arrivée des premières pluies après les mois les plus secs (Aubréville, 1950 ; Aubréville, 1959 ; Arbonnier, 2009). Erythrophleum africanum présente une période de floraison d’environ un mois, débutant juste avant les premières pluies, quand l’humidité du sol est au plus bas. Au Sud de la charnière climatique, E. ivorense fleurit entre mai et juin (Gabon), E. africanum et E. lasianthum en septembre (Zimbabwe et Afrique du Sud) à l’arrivée des premières pluies après les mois les plus secs (Palmer et al., 1972 ; Pooley, 1993).
38Les fruits murissent pendant huit à neuf mois. Les gousses d’E. ivorense et d’E. suaveolens s’ouvrent sur les arbres aux alentours du début de la saison des pluies et les graines y restent attachées pendant quelques temps (Aubréville, 1950 ; Childes, 1988 ; Arbonnier, 2009). Les gousses peuvent rester accrochées plusieurs mois à l’arbre et il est suggéré que les arbres présentant des gousses persistantes ne fleurissent pas et adoptent donc un cycle de fructification de deux ans (Hawthorne, 1995). Il existe encore très peu de littérature relatant la phénologie reproductive d’E. africanum et d’E. lasianthum.
39Erythrophleum suaveolens fructifie à partir de 30 cm de diamètre au Cameroun, la fructification ne devient toutefois régulière qu’à partir de 40 cm de diamètre (Kouadio, 2009). Cette information n’est pas disponible pour les autres espèces à notre connaissance.
4.3. Pollinisation et dispersion
40Les espèces du genre Erythrophleum sont hermaphrodites. Il n’existe pas d’observation directe de la pollinisation pour les espèces africaines du genre, mais elle se fait probablement par les insectes, comme c’est le cas pour E. fordii en Chine (Zhu et al., 2009 ; Duminil et al., 2010). La dispersion primaire des graines est ballochore : après un temps de maturation, les gousses s’ouvrent sur les arbres et les graines en sont éjectées (Hawthorne, 1995 ; Doucet, 2003). Hawthorne (1995) suggère également que les graines puissent être dispersées par le vent lors d’épisodes de tempêtes.
41Une dispersion secondaire zoochore a été mise en évidence pour les espèces de forêts dense (E. ivorense et E. suaveolens [Poulsen et al., 2001 ; Kone et al., 2008 ; Kunz et al., 2008]). De nombreux primates ont été identifiés comme agents disperseurs tels les gorilles (Gorilla gorilla gorilla Savage & Wyman [Petre, communication personnelle]), les babouins olives (Papio Anubis, Lesson, 1827 [Kunz et al., 2008]), les mangabey à joues blanches (Lophocebus albigena, Gray, 1850), les chimpanzés (Pan troglodytes, Brumenbach, 1799 [Poulsen et al., 2001]) ou encore les cercopithèques diane (Cercopithecus diana, Liannaeus, 1758 [Kone et al., 2008]). Il est probable que ces singes utilisent le mucilage des graines comme aliment de substitution en période de disette (Poulsen et al., 2001).
4.4. Dormance et germination
42Les graines d’E. suaveolens et d’E. lasianthum, qui sont protégées par des téguments lignifiés très coriaces inhibant la réhydratation, présentent une période de dormance (Netshiluvhi, 1999 ; Kouadio, 2009). Les diaspores peuvent rester plusieurs mois à plusieurs années dans le sol, contrairement à la majorité des espèces commerciales héliophiles (par exemple, Aucoumea klaineana Pierre, Entandrophragma cylindricum [Sprague] Sprague et Triplochiton scleroxylon K.Schum.), dont les diaspores ne présentent pas de période de dormance (Daïnou et al., 2011). Cette caractéristique pourrait expliquer les observations de régénération abondante et fréquente d’E. suaveolens au sein des trouées d’abattage et en bord de route, après endommagement des téguments des graines par les engins d’exploitation (Kouadio, 2009). La germination est de type phanérocotyle, épigée à cotylédons charnus (de La Mensbruge, 1966 ; Kouadio, 2009).
4.5. Croissance
43Une synthèse des données relatives à la croissance des quatre espèces africaines d’Erythrophleum disponibles dans la littérature est présentée dans le tableau 3. La croissance moyenne diamétrale d’E. ivorense en Côte d’Ivoire s’élève à 0,65 ± 0,50 cm par an (Detienne et al., 1998). Cependant, son écart-type élevé et l’absence d’information en rapport au nombre d’arbres suivis rendent cette valeur peu fiable. L’accroissement moyen d’E. suaveolens au sein des dispositifs de suivi de croissance est de 0,45 ± 0,09 cm par an au Cameroun et de 0,45 ± 0,41 cm par an en République centrafricaine. En République centrafricaine également, la mesure des cernes de croissance pour cette même espèce fournit une valeur de 0,70 ± 0,13 cm par an (Durrieu de Madron et al., 2000). Ces auteurs signalent que cette méthode semble surestimer l’accroissement sans en expliquer la raison. Cette surestimation est probablement due à une mauvaise identification des cernes. En ce qui concerne E. africanum, une seule étude au Zimbabwe mentionne un accroissement moyen annuel de 0,15 cm par an (écart-type non disponible ; Holdo, 2006).
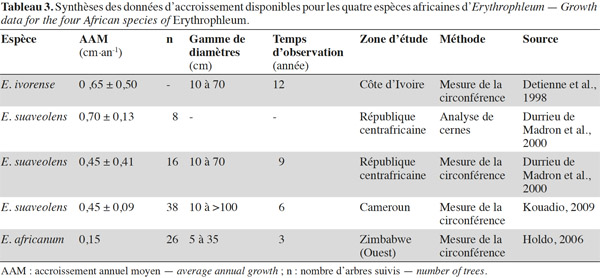
44La croissance varie entre les espèces, de façon décroissante entre les espèces caractéristiques des habitats les plus humides aux habitats les plus secs (croissance d’E. ivorense > croissance d’E. suaveolens > croissance d’E. africanum).
5. Sylviculture et aménagement forestier
45Cette partie concerne les deux espèces de forêts denses, E. ivorense et E. suaveolens, regroupées sous le nom commercial Tali (nomenclature ATIBT), qui sont exploitées à large échelle pour le bois d’œuvre. Selon l’Organisation Internationale des Bois Tropicaux (OIBT, 2012), le Cameroun est le principal exportateur de Tali, qui est la deuxième essence d’exportation en grume (125 000 m³ par an) et la 5e essence d’exportation sciage (18 000 m³ par an). Les points abordés en détail dans cette section sont relatifs aux règles d’exploitation et aux données disponibles sur les tarifs de cubage et la régénération artificielle de ces deux espèces.
5.1. Normes et règles d’exploitation
46Deux mesures légales des pays forestiers concernent directement ces espèces. La première consiste en la fixation, dans chaque pays producteur, des diamètres minima d’exploitation (DME) qui correspondent au seuil légal en dessous duquel aucun pied ne peut être exploité (Cameroun : DME = 50 cm ; République centrafricaine : DME = 60 cm [Loi n°08.022 du 17 septembre 2008], Gabon : DME = 70cm [Loi n°16/01 du 31 décembre 2001], République du Congo : DME = 60 cm [Loi n°11/2002]). La seconde repose sur les taux de reconstitution minima à atteindre entre chaque exploitation. Par exemple, au Cameroun, ce taux ne doit pas être inférieur à 50 % après une période de rotation de 30 ans (Loi 0511/D/MINFOF/SG/DF/BSJ, juin 2010).
5.2. Tarifs de cubage
47D’après GlobAllomeTree, plateforme Internet regroupant les équations allométriques employées pour estimer le volume, la biomasse et le stock de carbone forestier à l’échelle mondiale, il existerait trois études relatives à E. ivorense et E. suaveolens, réalisées au Gabon, au Nigeria et en République centrafricaine (Tableau 4). Cependant, les métadonnées liées à la construction de ces tarifs de cubage ne sont pas disponibles. En toute rigueur, un tarif de cubage n’est valable que sur une gamme de diamètres identiques à celle des arbres ayant servi à sa construction ainsi que sur une zone aux conditions environnementales similaires. De plus, il devrait être systématiquement assorti aux paramètres permettant de calculer les intervalles de confiance des estimations. Une étude récente de Fayolle et al. (2013) au Cameroun propose un tarif de cubage pour E. suaveolens répondant à ces critères. Il est robuste sur une zone couverte par les forêts semi-caducifoliées sur sol ferralitique, dans une gamme de diamètres précise, et dispose de paramètres clairement établis (Tableau 4).

5.3. Régénération artificielle et plantations
48L’élevage des plants en pépinière nécessite une levée de la dormance tégumentaire afin d’augmenter le succès de germination. Dans une étude sur E. suaveolens, Kouadio (2009) montre qu’une levée de dormance peut être obtenue par immersion des graines dans un bain d’acide sulfurique à 60 % pendant 40 min.
49Après la germination, l’inoculation de rhizobium (Bradyrhizobium spp.) a un effet positif sur la croissance des plantules (Diabate et al., 2005). Après quatre mois en pépinière, ces auteurs ont observé une augmentation de la croissance en hauteur et en diamètre en comparaison avec les plants non inoculés de 37 et 40 % pour E. ivorense et de 20 et 30 % pour E. suaveolens.
50Lors d’essais de plantation d’E. ivorense réalisés au Gabon, Koumba Zaou et al. (1998) ont montré que cette espèce est particulièrement bien adaptée à une installation sur coupe à blanc, ce qui confirme son tempérament héliophile. L’espèce présente des croissances en diamètre et en hauteur supérieures dans ces plantations sur coupe à blanc (hauteur : 16,1 ± 0,2 m contre 10,9 ± 2,8 m en sous-bois, diamètre : 13,6 ± 1,1 cm contre 6,8 ± 2,1 cm en sous-bois après six ans). Au Cameroun, il a été aussi observé des taux de reprises de plants d’E. suaveolens de 100 %, deux mois après leur plantation dans des trouées d’abattage (Kouadio, 2009). La sylviculture du Tali est donc envisageable. Toutefois, sa rentabilité doit encore être démontrée (Doucet, 2003).
6. Utilisations
6.1. Bois
51Le bois de Tali est brun-jaunâtre à brun-rougeâtre et fonce à la lumière. Son grain est grossier et présente un contrefil léger à prononcé. Des risques élevés de déformation et de gerces nécessitent un séchage lent (CIRAD, 2008). Il est durable : il résiste aux champignons, aux insectes de bois sec et aux termites (Aubréville, 1959 ; Gerdat, 1977 ; Tableau 5) et a une bonne conservation en forêt. Ce bois, très dur, est utilisé pour les charpentes lourdes, les ponts et les travaux hydrauliques, les traverses, poteaux, piquets et parquets. Il est aussi employé comme bois de terrasse ou de sols industriels. La longueur de fût valorisable est supérieure chez E. suaveolens (supérieure à 10 m contre 4 à 5 m pour E. ivorense) mais selon les exploitants forestiers, son bois serait de moins bonne qualité car de couleur moins uniforme. Les grumes sont parfois difformes et peuvent présenter des pourritures de cœur (Gerdat, 1977). Le bois de Tali est un bon combustible et fait un excellent charbon (Burkill, 1995).
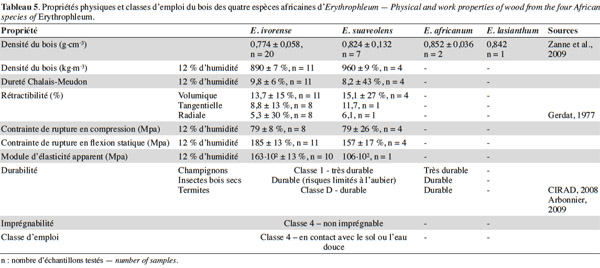
52Le bois d’E. africanum est rouge-brun, dur et également très durable et résistant aux termites et aux insectes de bois sec mais n’est à ce jour pas exploité à des fins commerciales à large échelle (Arbonnier, 2009). On citera tout de même son usage local pour la construction de charpentes, de pirogues, de meubles, de poteaux, de piquets et de manches d’outil. Le bois d’E. africanum est aussi utilisé comme bois de feu et produit du charbon de bonne qualité, apprécié en ferronnerie (Arbonnier, 2009).
6.2. Autres utilisations
53Les espèces du genre Erythrophleum sont connues pour les propriétés des extraits de leur écorce, bois et feuille. Ils contiennent un agent toxique, l’érythrophléine. Selon le dosage, des décoctions à base de ces organes peuvent s’avérer thérapeutiques ou toxiques (Burkill, 1995). L’usage du broyat d’écorce d’E. ivorense, E. suaveolens, E. africanum et E. lasianthum est souvent cité comme poison d’ordalie (Aubréville, 1959 ; Palmer et al., 1972 ; Hawthorne, 1995). Les extraits d’Erythrophleum sont également utilisés comme poisons ou répulsifs contre toutes sortes d’animaux, allant des rongeurs au bétail errant (Palmer et al., 1972 ; Burkill, 1995 ; Hawthorne, 1995 ; Arbonnier, 2009). Les extraits de ces végétaux sont aussi testés comme produits à faible impact environnemental de lutte contre des vecteurs de pathogènes ou des pestes (Akinpelu et al., 2013). Ces espèces sont surtout utilisées dans la pharmacopée traditionnelle par les populations locales. Par exemple, l’écorce d’E. suaveolens est indiquée dans le traitement des convulsions, des douleurs, des problèmes cardiaques ainsi que des œdèmes causés par les nématodes. Des décoctions et des infusions d’E. ivorense et d’E. suaveolens sont également employées pour leurs propriétés émétives, laxatives et antirhumatismales (Burkill, 1995). Les propriétés antioxydantes des molécules contenues dans l’écorce d’E. africanum justifient son large usage lors de soins dentaires (Brice et al., 2011). L’utilisation extensive de l’écorce d’E. lasianthum en médecine traditionnelle est une des causes du déclin visible des effectifs de cette espèce. Erythrophleum lasianthum est inscrite sur la liste rouge des espèces d’Afrique du Sud comme « quasi-menacée » depuis 2009.
54Les scientifiques s’inspirent de ces usages traditionnels et étudient les propriétés des molécules intrinsèques des Erythrophleum à des fins agro-alimentaires ou pharmaceutiques (Akinpelu et al., 2013 ; Fadeyi et al., 2013). Des extraits contenus dans les bois d’E. suaveolens ont été identifiés comme des sources d’antioxydants potentiellement intéressants comme conservateurs d’aliments ou valorisables en thérapeutique anticancéreuse (Fadeyi et al., 2013).
55Les différentes espèces du genre présentent un intérêt comme plantes mellifères (Burkill, 1995).
56La toxicité des Erythrophleum limite leur usage en agroforesterie. Ces espèces nuisent au rendement et à la fertilité du sol en raison de la toxicité de leurs feuilles et ne sont donc pas conseillées en agroforesterie (Burkill, 1995). Pourtant, les agriculteurs hésitent à les couper. Cela est probablement dû à la dureté de leur bois rendant l’abattage difficile et au respect envers ces arbres aux multiples usages traditionnels (Carrière, 1999). En raison de leur toxicité, leur utilisation en sylvopastoralisme est exclue et dans les savanes, les éleveurs sont toujours très attentifs de ne pas laisser leurs animaux brouter le long des routes où pousse E. africanum (Nwude et al., 1981).
7. Conclusions
57Cette synthèse bibliographique a permis de dresser l’état des lieux des connaissances sur le genre Erythrophleum en Afrique. Erythrophleum ivorense, E. suaveolens, E. africanum et E. lasianthum présentent des différences morphologiques ainsi que des aires de distribution distinctes. Elles sont distribuées de façon parapatrique sur un gradient pluviométrique : du plus humide pour E. ivorense au plus sec pour E. lasianthum.
58L’isolation des populations dans des refuges forestiers différents lors des changements climatiques du Pléistocène est sûrement un des pilotes majeurs de la divergence entre E. ivorense et E. suaveolens et de leur diversité intra-spécifique. Néanmoins, une adaptation différentielle des espèces et des pools génétiques du genre Erythrophleum sur un gradient environnemental n’est pas exclue. En effet, leur distribution parapatrique, dans des aires climatiques contrastées, tend aussi à souligner une action de l’environnement dans les phénomènes de spéciation/divergence. Pour répondre totalement à cette problématique, une quantification de l’adaptation des espèces et des pools génétiques à différents stress environnementaux par la mise en place d’expérimentations en milieu contrôlé est requise.
59Les données sur l’auto-écologie des espèces du genre sont encore assez lacunaires et globalement mieux renseignées pour E. ivorense et E. suaveolens de par leur importance économique. Les espèces du genre Erythrophleum sont hermaphrodites, à dispersion primaire ballochore et leurs graines présentent une période de dormance. La croissance varie entre les espèces, de façon décroissante entre les espèces caractéristiques des habitats les plus humides aux habitats les plus secs.
60Ces arbres sont utiles aux populations humaines principalement par l’usage de leur bois et aux multiples propriétés chimiques de leur écorce, bois et feuilles utilisés dans la pharmacopée traditionnelle. Afin d’en assurer une meilleure gestion, nous estimons qu’un certain nombre d’informations sur les caractéristiques écologiques méritent d’être approfondies et notamment sur :
61– la relation entre la phénologie et le climat (notamment la disponibilité en eau) ;
62– les diamètres minimum et optimal de fructification ;
63– les périodes de fructifications et de maturation des fruits ;
64– la levée de dormance « naturelle » des graines ;
65– l’adaptation écologique inter- et intra-spécifique.
66L’approfondissement des connaissances sur ces espèces multi-usages permettra d’ajuster les méthodes de conservation et/ou d’enrichissement des populations ainsi que les pratiques d’exploitation pour E. ivorense et E. suaveolens. D’autre part, le genre Erythrophleum est un modèle biologique permettant de comprendre les mécanismes historiques (isolation dans des refuges forestiers) et environnementaux (spéciation le long d’un gradient environnemental) à l'origine de la diversité des écosystèmes forestiers tropicaux.
67Remerciements
68Nous remercions l’Université de Liège (Belgique) pour les soutiens scientifique et financier accordés à ces travaux de recherche ainsi que les Conservatoire et Jardin botaniques de la Ville de Genève (CJB) et le South African National Biodiversity Institute (SANBI) pour la mise à disposition des données d’occurrence des espèces étudiées. Merci également à Jérôme Duminil, Jean-Yves de Vleeschouwer, Jean-François Gillet, Achille Biwolé et Julie Morin-Rivat pour leurs contributions et conseils.
Bibliographie
Akindele S.O. & LeMay V.M., 2006. Development of tree volume equations for common timber species in the tropical rain forest area of Nigeria. For. Ecol. Manage., 226(1-3), 41‑48.
Akinpelu B.A. et al., 2013. Effect of stem-bark of Erythrophleum suaveolens (Guill. & Perri.) saponin on fresh water snail (Lanistes lybicus) tissues. Afr. J. Environ. Sci. Technol., 6(11), 446-451.
Akoègninou A. et al., 2006. Flore analytique du Bénin. Wageningen, The Netherlands: Backhuys Publishers.
Arbonnier M., 2009. Arbres, arbustes et lianes des zones sèches d’Afrique de l’Ouest. Versailles, France : Éditions Quæ.
Aubréville A., 1950. Flore forestière soudano-guinéenne. Paris : Société d’éditions géographiques, maritimes et coloniales.
Aubréville A., 1959. La flore forestière de la Côte d’Ivoire. 2e éd. Nogent-sur-Marne, France : Centre Technique Forestier Tropical.
Aubréville A., 1968. Flore du Gabon. Légumineuses - Caesalpinioidées. Paris : Museum National d’Histoire Naturelle.
Aubréville A., 1970. Flore du Cameroun. Légumineuses - Caesalpinioidées. Paris : Museum National d’Histoire Naturelle.
Brenan J.P.M., 1967. Flora of tropical east Africa – Leguminosae: subfamily Caesalpinioideae. Richmond, UK: Royal Botanic Gardens, Kew.
Brice K.A., Akhanovna B.J. & Anoubilé B., 2011. Erythrophleum africanum Afzel. (Caesalpiniaceae), an African toothpick: phytochemical screening, total flavonoid content and antioxidant activity. J. Med. Plants Res., 5(27), 6273‑6277.
Burkill H.M., 1995. The useful plants of west tropical Africa. Vol. 1-3. Richmond, UK: Royal Botanic Gardens, Kew.
Carrière S., 1999. Les orphelins de la forêt : influence de l’agriculture itinérante sur brûlis des Ntumu et des pratiques agricoles associées sur la dynamique forestière du sud Cameroun. Montpellier, France : Université de Montpellier.
Chevalier A., 1916. La forêt et les bois du Gabon. Paris : A. Challamel.
Chidumayo E.N. & Gumbo D.J., 2010. The dry forests and woodlands of Africa: managing for products and services. London; Washington: Earthscan.
Childes S.L., 1988. Phenology of nine common woody species in semi-arid, deciduous Kalahari sand vegetation. Vegetatio, 79(3), 151-163.
Childes S.L. & Walker B.H., 1987. Ecology and dynamics of the woody vegetation on the Kalahari sands in Hwange National Park, Zimbabwe. Vegetatio, 72(2), 111-128.
CIRAD, 2008. Tropix 7, http://tropix.cirad.fr/, (17/9/15).
Daïnou K. et al., 2011. Soil seed bank characteristics in Cameroonian rainforests and implications for post-logging forest recovery. Ecol. Eng., 37(10), 1499‑1506.
De La Mensbruge G., 1966. La germination et les plantules des essences arborées de la forêt dense humide de la Côte d’Ivoire. Nogent-sur-Marne, France : Centre technique forestier tropical.
De Wolf J., 1998. Species composition and structure of the woody vegetation of the Middle Casamance region (Senegal). For. Ecol. Manage., 111(2), 249-264.
Detienne P. et al., 1998. L’analyse de cernes : application aux études de croissance de quelques essences en peuplements naturels de forêt dense africaine. Montpellier, France : CIRAD-Forêt.
Diabate M. et al., 2005. Occurrence of nodulation in unexplored leguminous trees native to the West African tropical rainforest and inoculation response of native species useful in reforestation. New Phytol., 166(1), 231-239.
Doucet J.-L., 2003. L’alliance délicate de la gestion forestière et de la biodiversité dans les forêts du centre du Gabon. Thèse de doctorat : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Duminil J. et al., 2010. CpDNA-based species identification and phylogeography: application to African tropical tree species. Mol. Ecol., 19(24), 5469‑5483.
Duminil J. et al., 2013. Large-scale pattern of genetic differentiation within African rainforest trees: insights on the roles of ecological gradients and past climate changes on the evolution of Erythrophleum spp. (Fabaceae). BMC Evol. Biol., 13(1), 1‑13.
Duminil J. et al., 2015. Late Pleistocene molecular dating of past population fragmentation and demographic changes in African rain forest tree species supports the forest refuge hypothesis. J. Biogeogr., 42(8), 1443-1454.
Durrieu De Madron L. & Forni E., 1997. Aménagement forestier dans l’Est du Cameroun. Bois Forêts Trop., 254, 39‑50.
Durrieu de Madron L., Nasi R. & Detienne P., 2000. Accroissements diamétriques de quelques essences en forêt dense africaine. Bois Forêts Trop., 263(1), 63-74.
Fadeyi S.A. et al., 2013. In vitro anticancer screening of 24 locally used Nigerian medicinal plants. BMC Complementary Altern. Med., 13(1), 79.
Fairhead J. & Leach M., 1996. Misreading the African landscape: society and ecology in a forest-savanna mosaic. Cambridge, UK: Cambridge University Press.
Fayolle A. et al., 2013. Réviser les tarifs de cubage pour mieux gérer les forêts du Cameroun. Bois Forêts Trop., 317(3), 36‑49.
Gerdat, 1977. Fiches techniques : Tali. Bois Forêts Trop., 176, 17‑31.
Goetze D., Horsch B. & Porembski S., 2006. Dynamics of forest-savanna mosaics in north-eastern Ivory Coast from 1954 to 2002. J. Biogeogr., 33(4), 653‑664.
Gonmadje C.F. et al., 2012. Analyse phytogéographique des forêts d’Afrique centrale : le cas du massif de Ngovayang (Cameroun). Plant Ecol. Evol., 145(2), 152‑164.
Hawthorne W.D., 1995. Ecological profiles of Ghanaian forest trees. Oxford, UK: University of Oxford.
Henry M. et al., 2013. GlobAllomeTree: international platform for tree allometric equations to support volume, biomass and carbon assessment. iForest Biogeosci. For., 6(5), 326‑330.
Hijmans R.J. et al., 2005. Very high resolution interpolated climate surfaces for global land areas. Int. J. Climatol., 25(15), 1965‑1978.
Holdo R.M., 2006. Tree growth in an African woodland savanna affected by disturbance. J. Veg. Sci., 17(3), 369-378.
Kone I. & Lambert J., 2008. Primate seed dispersal and its potential role in maintaining useful tree species in the Taï region, Côte d’Ivoire: implications for the conservation of forest fragment. Trop. Conserv. Sci., 1(3), 293-306.
Kottek M. et al., 2006. World map of the Köppen-Geiger climate classification updated. Meteorol. Z., 15(3), 259-263.
Kouadio Y.L., 2009. Mesures sylvicoles en vue d’améliorer la gestion des populations d’essences forestières commerciales de l’Est du Cameroun. Thèse de doctorat : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Koumba Zaou P. et al., 1998. Croissance de 13 essences de bois d’œuvre plantées en forêt gabonaise. Bois Forêts Trop., 256, 21‑33.
Kunz B.K. & Linsenmair K.E., 2008. The role of the olive baboon (Papio anubis, Cercopithecidae) as seed disperser in a savanna-forest mosaic of West Africa. J. Trop. Ecol., 24(3), 235-246.
Lawton R.M., 1978. A study of the dynamic ecology of Zambian vegetation. J. Ecol., 66, 175-198.
Maley J., 1996. The African rain forest-main characteristics of changes in vegetation and climate from the Upper Cretaceous to the Quaternary. Proc. R. Soc. Edinburgh, 104, 31-73.
Moll E.J., 1978. The vegetation of Maputaland. Trees S. Afr., 24(2), 3.
Netshiluvhi T.R., 1999. Demand, propagation and seedling establishment of selected medicinal trees. S. Afr. J. Bot., 65, 331‑338.
Nwude N. & Chineme C.N., 1981. Toxic effects of the leaves of Erythrophleum africanum Harms in sheep. Bull. An. Health Prod. Afr., 29(4), 349.
OIBT, 2012. Examen annuel et évaluation de la situation mondiale des bois. Yokohama, Japon : Organisation Internationale des Bois Tropicaux.
Palmer E. & Pitman N., 1972. Trees of Southern Africa, covering all known indigenous species in the Republic of South Africa, South-West Africa, Botswana, Lesotho & Swaziland. Cape Town, South Africa: A. A. Balkema.
Pooley E., 1993. The complete field guide to trees of Natal, Zululand & Transkei. Johannesburg, South Africa: Natal Flora Publications Trust.
Poorter L., 2004. Biodiversity of West African forests: an ecological atlas of woody plant species. Wallingford, UK: CABI.
Poorter L. et al., 1996. Regeneration of canopy tree species at five sites in West African moist forest. For. Ecol. Manage., 84(1), 61-69.
Poulsen J.R., Clark C.J. & Smith T.B., 2001. Seed dispersal by a diurnal primate community in the Dja Reserve, Cameroon. J. Trop. Ecol., 17(6), 787-808.
Richer R.A., 2008. Leaf phenology and carbon dynamics in six leguminous trees. Afr. J. Ecol., 46(1), 88-95.
Suchel J.B., 1990. Les modalités du passage du régime climatique boréal au régime climatique austral dans le Sud-ouest camerounais. Cah. Cent. Rech. Climatol., 13, 63-76.
Tuite P. & Gardiner J.J., 1990. The miombo woodlands of central, eastern and southern Africa. Ir. For., 47(2), 90-107.
Van Gemerden B.S. et al., 2003. The pristine rain forest? Remnants of historical human impacts on current tree species composition and diversity. J. Biogeogr., 30(9), 1381-1390.
Vivien J. & Faure J.J., 1985. Arbres des forêts denses d’Afrique centrale. Paris : Agence de Développement et de Coopération Culturelle et Technique.
Voorhoeve A.G., 1965. Liberian high forest trees. Wageningen, The Netherlands: Centre for Agricultural Publications and Documentation.
White F., 1983. The vegetation of Africa, a descriptive memoir to accompany the UNESCO/AETFAT/UNSO vegetation map of Africa (3 Plates, Northwestern Africa, Northeastern Africa, and Southern Africa, 1: 5,000,000). Paris: UNESCO.
Wyk A.E.V., 1996. Biodiversity of the Maputaland centre. In: van der Maesen L.J.G., van der Burgt X.M. & van Medenbach de Rooy J.M., eds. The biodiversity of African plants. Dordrecht, The Netherlands: Kluwer Academic Publishers, 198‑207.
Wyk B.V. & Wyk P.V., 1997. Field guide to trees of southern Africa. Durban, South Africa: Struik.
Zanne A.E. et al., 2009. Global wood density database. Durham, NC, USA: Dryad.
Zhu P. et al., 2009. Isolation and characterization of ten polymorphic microsatellite in the endangered tree Erythrophleum fordii oliv. Conserv. Genet., 10(4), 1017‑1019.

