- Accueil
- volume 10 (2006)
- numéro 1
- Activités insecticides de Striga hermonthica (Del.) Benth (Scrophulariaceae) sur Callosobruchus maculatus (Fab.) (Coleoptera : Bruchidae)
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Activités insecticides de Striga hermonthica (Del.) Benth (Scrophulariaceae) sur Callosobruchus maculatus (Fab.) (Coleoptera : Bruchidae)

Notes de la rédaction
Reçu le 4 février 2003, accepté le 1er septembre 2005
Résumé
Cette étude se propose d’évaluer les potentialités de Striga hermonthica (Del.) Benth (Scrophulariaceae) comme insecticide botanique pour la protection des récoltes de niébé Vigna unguculata (L.) Walp à l’encontre de Callosobruchus maculatus (Fab.) (Coleoptera : Bruchidae) lors du stockage. L’extrait à l’acétone de S. hermonthica utilisé à la dose de 0,5 % w/w (100 mg d’extrait sec pour 20 g de niébé) occasionne un effet ovicide de 48 % et donc une réduction de moitié du taux d’adultes émergeant des graines. Cet extrait exerce également une faible activité insecticide sur la forme adulte de l’insecte. La fraction éther de pétrole occasionne un effet ovicide (51 %) et larvicide (72 %) à la dose de 0,4 % (80 mg/20 g de graines) avec un taux d’adultes émergeant de seulement 9 %. Les DL50 et DL90 sont estimées à chaque étape du fractionnement de l’extrait brut (extrait acétone) afin de suivre les composés ovicides et larvicides et afin d’évaluer leur efficacité au cours du processus d’isolement. Une fraction essentiellement constituée de molécules triterpéniques a été identifiée comme responsable de l’effet ovicide constaté ; l’origine de l’activité larvicide n’a par contre pas été identifiée.
Abstract
Insecticidal activities of Striga hermonthica (Del.) Benth (Scrophulariacecae) on Callobruchus maculatus (Fab.) (Coleptera Bruchidae). This paper deals with insecticidal potentialities of Striga hermonthica (Del.) (Scrophulariaceae) in protection of cowpea Vigna unguculata (L.) Walp against Callosobruchus maculatus (Fab.) (Coleoptera: Bruchidae) during storage. Crude acetone extract at 0,5% w/w (100 mg of extract for 20 g of grain) exhibits 48% of ovicidal effect and then reduces by half emergence rate of adult beetles at the first generation. This extract shows a weak insecticide activity against adults of C. maculatus. Petroleum ether fraction (0,4% w/w ) of the crude extract reveals ovicidal (51%) and larvicidal (72%) effects which reduce the emergence rate of adults to only 9%. LD50 and LD90 are monitored during crude extract fractionation to follow ovicidal and larvicidal compounds and to evaluate their efficacy during the isolation procedure. One fraction, mainly composed of two triterpenoid compounds has been identified as responsible of the ovicidal activity of S. hermonthica while the origin of the larvicidal activity hasn’t been identified.
Table des matières
1. Introduction
1Striga hermonthica (Del.) Benth (Scrophulariaceae) est une herbacée annuelle parasitant les cultures de sorgho Sorghum bicolor (L.) Moench et de petit mil Penisetum americanum Staph (Poaceae). Elle est utilisée en médecine traditionnelle sur le plateau central du Burkina Faso (Nacoulma, 1996). On lui attribue également des propriétés insecticides ou insectifuges, notamment contre les moustiques (Kerharo, Adam, 1974). La plupart des études menées sur cette plante visent son éradication des champs. Son action contre les insectes en général et contre Callosobruchus maculatus (Fab.) (Coleoptera : Bruchidae) en particulier pourrait constituer un cadre de valorisation de cette espèce hémiparasite. En effet, le Burkina Faso, tout comme l’ensemble des pays sahéliens, est confronté à un très important taux de destruction des récoltes de niébé au cours du stockage, principalement du fait de Callosobruchus maculatus (Bal, 1992 ; Adebayo, Gbolade, 1994). L’infestation par C. maculatus commence dans les champs. La multiplication pendant plusieurs générations des insectes issus de l’infestation primaire (infestation au champ) conjuguée aux infestations en cours de stockage par des insectes venus de l’extérieur conduit à une dynamique de prolifération prononcée de C. maculatus. Les œufs pondus sur les gousses de niébé par les insectes adultes se transforment en larves qui pénètrent ensuite dans les graines. Les larves consomment le cotylédon des graines dans lesquelles elles se développent, occasionnant ainsi d’énormes pertes durant le stockage. En l’absence de tout traitement, 30 % des récoltes peuvent être détruites au bout de six mois de stockage (Mbata, Eppendu, 1992), portant ainsi une atteinte grave à la sécurité alimentaire des populations paysannes.
2L’étude présentée a pour objectif d’évaluer l’impact d’un extrait à l’acétone de Striga hermonthica et de sa fraction éther de pétrole sur les adultes, les œufs et les larves de la bruche du niébé ainsi que sur le taux d’adultes de première génération émergeant des graines traitées par ces extraits (extrait à l’acétone et sa fraction éther de pétrole). Nous formulerons ensuite une hypothèse quant à l’origine moléculaire de l’activité ovicide constatée sur la base de fractionnements chromatographiques et de criblages phytochimiques.
2. Matériel et méthodes
3Striga hermonthica est récolté durant les mois de septembre et d’octobre à la station expérimentale de Gampéla (25 km à l’est de Ouagadougou, Burkina Faso) et identifié au Laboratoire d’Ecologie végétale et de botanique de l’Université de Ouagadougou. Les végétaux sont séchés et finement pulvérisés. Les graines de niébé, Vigna unguiculata (Walp.), utilisées comme support pour les essais biologiques sont débarrassées de toute infestation par un séjour prolongé au congélateur. La souche de Callosobruchus maculatus utilisée pour les essais biologiques a été constituée à partir d’insectes ayant émergé de graines de niébé de la variété « Kamboincé local » récoltées à Gampéla. Dès leur émergence, les adultes étaient introduits par couple dans des boîtes de Petri en présence de graines saines de niébé. Les insectes de la nouvelle génération étaient soit utilisés dans les 12 heures qui suivaient leur émergence pour les tests biologiques, soit pour le maintien de la souche.
2.1. Extraction
4Cent grammes de poudre végétale sont extraits au Soxhlet six heures durant à la température de 65 °C avec de l’acétone. L’extrait brut obtenu est concentré sous pression réduite à l’évaporateur rotatif puis séché dans un dessiccateur muni d’une pompe à vide.
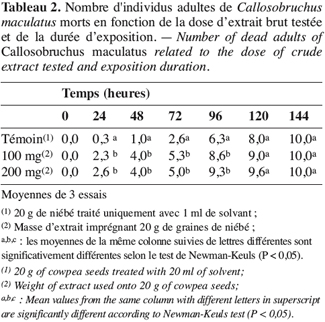
2.2. Fractionnement
5Il faut dissoudre trois grammes d’extrait brut dans 50 ml d’éther de pétrole puis extraire trois fois avec 75 ml de méthanol aqueux (50 %). La phase éther de pétrole résiduelle est évaporée à sec. On chromatographie ensuite 500 mg du résidu éther de pétrole sur colonne de gel de silice (30 g) avec le système d’éluant hexane/acétate d’éthyle (3/2) et on collecte des fractions de 5 ml chacune. Les fractions 24-32 donnant un résultat positif au test de Lieberman/Buchard sont rassemblées, concentrées puis soumises à un deuxième fractionnement chromatographique avec l’éluant chloroforme/acétate d’éthyle (5/1) afin d’en isoler la fraction triterpénique. La fraction triterpénique isolée et la phase éther de pétrole sont également utilisées pour les essais biologiques.
2.3. Criblage phytochimique
6Le criblage phytochimique est effectué par la méthode chromatographique sur couche mince (plaques prêtes pour emploi de Kieselgel 60F254 MERCK) avec des révélateurs plus ou moins spécifiques des molécules recherchées. Comme éluants, les mélanges hexane/acétate d’éthyle (3/2) et hexane/chloroforme (4/3) sont utilisés. La révélation est effectuée de façon non spécifique à l’UV254 nm et spécifiquement au sulfate de cérium et au réactif de Lieberman/Buchard pour les triterpénoïdes et les stéroïdes (Mendez et al., 1995 ; Rasool et al., 1992), à la potasse méthanolique 10 % suivie d’une révélation à l’UV365 nm pour les coumarines, naphtoquinones et anthraquinones (Wagner, Bladt, 1996), au trichlorure d’aluminium pour les flavonoïdes (Merck, 1975) et par le test de Dragendorf pour les alcaloïdes (Wagner, Bladt, 1996).
2.4. Essais biologiques
7Extraits tests. Ils sont préparés en dissolvant les extraits secs (extrait brut à l’acétone, fraction éther de pétrole et fraction isolée) dans le solvant acétone/méthanol (1/1) (Mbata, Eppendu, 1992). Le témoin est uniquement constitué d’acétone/méthanol (1/1).
8Dispositif d’étude. On introduit 20 g de graines saines de niébé dans une boîte de Petri de 9 cm de diamètre. On y ajoute 1 ml de l’extrait à tester puis on secoue la boîte de façon à imprégner uniformément les graines. On laisse sécher les graines durant 45 min sous un courant d’air afin d’évaporer le solvant de dilution (Adebayo, Gbolade, 1994).
9Mortalité des adultes. Les essais sont réalisés avec l’extrait brut (1 ml) à des concentrations de 100 mg.ml-1 et 200 mg.ml-1 soit respectivement des doses de 100 mg et 200 mg d’extrait pour 20 g de niébé (0,5 % w/w et 1 % w/w de taux d’imprégnation). On introduit dans le dispositif d’étude cinq couples de C. maculatus venant d’émerger (Adebayo, Gbolade, 1994). On enregistre la mortalité toutes les 24 heures. Chaque essai est répété trois fois.
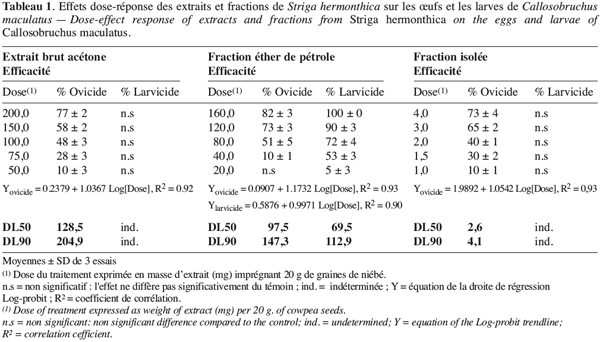
10Mortalité des œufs, des larves et impact sur le taux d’émergence. Pour la mise en évidence des activités ovicide et larvicide, nous avons utilisé (1 ml) l’extrait brut à 100 mg.ml-1, la phase éther de pétrole à 80 mg.ml-1 et la fraction isolée à 4 mg.ml-1. Les doses d’imprégnation étant respectivement de 0,5 %, 0,4 % et 0,2 % w/w. Pour la détermination des DL50 et DL90, 1 ml de chaque concentration (200, 150, 100, 75, 50 mg.ml-1 d’extrait brut ; 160, 120, 80, 40, 20 mg.ml-1 de la fraction éther de pétrole et 4, 3, 2, 1.5, 1 mg.ml-1 de la fraction triterpénique isolée) est utilisé pour 20 g de niébé, donnant cinq doses (Tableau 1) par extrait test. Chaque essai est répété trois fois. Dans chaque boîte de Petri, on fait pondre fraîchement 30 à 40 œufs sur les graines imprégnées avec l’extrait à tester. Une semaine après la ponte, on compte à l’aide d’une loupe les œufs éclos et non éclos. Dès les premières émergences (3e ou 4e semaine), on retire les adultes au fur et à mesure qu’ils apparaissent jusqu’à arrêt total (absence de toute émergence sur une période de deux semaines) des émergences (Mbata, Eppendu, 1992). Les taux de mortalité des œufs et des larves ainsi que le taux d’émergence sont calculés comme suit :
11Taux de mortalité des œufs =
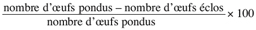
12Taux de mortalité des larves =
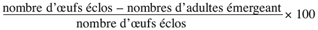
13Taux d’adultes émergeant =
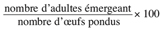
14Les différents types d’activité insecticide sont exprimés en efficacité insecticide selon la formule d’Abbott (Moretti et al., 1998) qui donne les valeurs corrigées de la mortalité en pourcentage en fonction des mortalités des échantillons traités et celle du témoin.
15Cette correction permet d’exclure le biais dû à la mortalité naturelle observée dans nos conditions expérimentales.
16% efficacité =
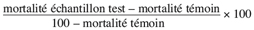
2.5. Traitement des données
17Les analyses statistiques sont effectuées avec le logiciel GraphPad Prism version 2.01. Les données sont soumises à une analyse de la variance (ANOVA), les moyennes (± SD) sont comparées grâce au test de comparaisons multiples de Newman-Keuls (Sanon, Ouedraogo, 1998). Les valeurs de P inférieures à 0,05 sont considérées comme significatives. Les DL50 et DL90 sont calculées à partir des droites de régression log-probit.
18Y = a + Log(X)
19Y : Valeur Probit correspondant à l’effet insecticide
20X : Dose d’extrait test
3. Résultats
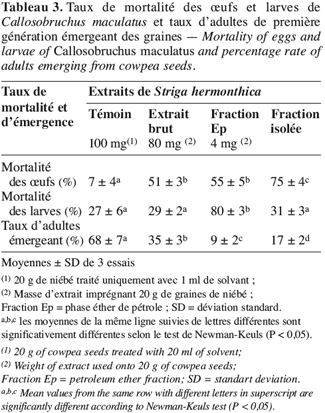
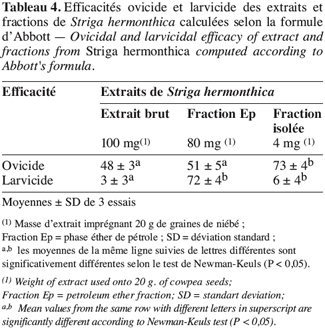
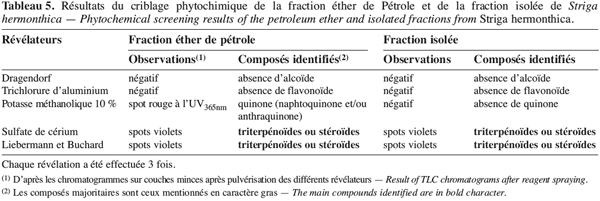
21L’extrait brut à l’acétone de S. hermonthica représente 5 % du matériel végétal sec ; 74 % de l’extrait acétone étant extractible par l’éther de pétrole. La fraction triterpénique isolée constitue 3 % de l’extrait à l’éther de pétrole soit 2 % de l’extrait acétone ou encore près de 0,1 % de la matière végétale sèche. Bien que les doses utilisées pour l’étude de l’activité insecticide de l’extrait brut sur les bruches adultes varient du simple au double (100 mg et 200 mg pour 20 g de niébé), nous enregistrons les mêmes taux de mortalité qui, toutefois, diffèrent du témoin pendant les 96 premières heures (Tableau 2). La durée de vie des adultes de C. maculatus dans les conditions optimales étant de 5 à 7 jours (Bal, 1992), nous n’avons tenu compte que des quatre premiers jours (zéro heure à 96 heures) pour interpréter les données. L’extrait à l’acétone n’exerce donc qu’une faible activité insecticide sur la forme adulte de C. maculatus. L’extrait brut agit par contre fortement sur les œufs. En effet 51 % des œufs traités avec 100 mg d’extrait acétone pour 20 g de niébé ne parviennent pas à éclosion contre seulement 7 % des témoins (Tableau 3). Les œufs non éclos dans les lots traités demeurent translucides comme ceux des lots témoins mais diffèrent de par leur aspect desséché contrairement aux témoins. En accord avec la littérature (Ho et al., 1995), le dessèchement des œufs traités permet de conclure qu’ils ont été tués par l’extrait acétone de S. hermonthica. Ainsi à la dose de 100 mg/20 g (0,5 % w/w), l’extrait acétone de S. hermonthica induit un effet ovicide de 48 % (Tableau 4). Pour ce qui est de l’impact de l’extrait brut sur les larves, nous constatons que le taux de mortalité des larves n’est pas significativement différent du témoin (Tableau 3). L’extrait acétone de S. hermonthica ne présente donc pas d’effet larvicide sur C. maculatus à la dose de 100 mg pour 20 g de niébé. Notons néanmoins que l’émergence des adultes au niveau des graines traitées avec l’extrait brut débute avec un retard de trois jours par rapport au témoin. L’imprégnation des graines avec l’extrait brut à la dose de 100 mg pour 20 g de niébé a pour impact global de réduire de moitié le taux d’adultes qui émergent des graines à la première génération ; soit 35 % d’émergence contre 68 % pour le lot témoin (Tableau 3). Ce résultat serait la conséquence directe du taux de mortalité de 51 % précédemment observée sur les œufs pondus. La fraction éther de pétrole résultant du partage liquide/liquide de l’extrait brut exerce un effet ovicide de 51 % (Tableau 4) lorsqu’elle est utilisée à la dose de 80 mg pour 20 g de niébé. Contre toute attente, nous observons également un effet larvicide de 72 % (Tableau 4). L’effet cumulé des activités ovicide et larvicide sur C. maculatus réduit drastiquement le taux d’insectes adultes émergeant des graines ; seulement 9 % des œufs pondus parviennent au stade adulte contre 68 dans le lot témoin (Tableau 3). Le fractionnement chromatographique a permis d’isoler une fraction douée d’activité ovicide (Tableau 3) ; aucune fraction ne s’est révélée douée de propriété larvicide. Le screening phytochimique de la fraction éther de pétrole met en évidence des quinones (anthraquinones et/ou naphtoquinones) ainsi que des molécules triterpéniques ou stéroïdiques (Tableau 5) ; les composés triterpéniques étant majoritaires. La fraction active partiellement purifiée (à l’issue des fractionnements chromatographiques sur colonnes de gel de silice) ne renferme quant à elle que des composés triterpéniques, en l’occurrence deux génines triterpéniques. L’activité ovicide des différents extraits testés serait donc le fait d’une au moins des deux molécules triterpéniques rencontrées dans la fraction partiellement purifiée. Le tableau 1 donne une idée de l’efficacité des différents extraits au travers de leur DL50 et DL90 sur les œufs et les larves de C. maculatus. L’évolution de ces valeurs pour ce qui concerne l’activité ovicide traduit bien la concentration des molécules ovicides au cours du fractionnement. Ainsi la DL50 de la fraction triterpénique isolée est environ 40 fois plus faible que celle de l’extrait brut (2,6 contre 128,5 mg/20 g). La fraction éther de pétrole présente le plus large spectre d’activités insecticides. Des DL50 de 97,5 et 69,5 mg/20 g de niébé sont respectivement obtenues pour les activités ovicide et larvicide.
4. Discussion
22La faible activité insecticide de l’extrait acétone sur les adultes de C. maculatus ne justifierait pas son utilisation comme insecticide contre la forme adulte de la bruche du niébé. Par contre, l’extrait acétone pourrait avantageusement être utilisé pour son effet ovicide. En effet, les résultats préliminaires obtenus avec la dose de 100 mg d’extrait pour 20 g de niébé révèlent un effet ovicide de 48 % (Tableau 4) avec pour impact une réduction de moitié du niveau d’infestation larvaire des graines et également du taux d’adultes qui en émergent à la première génération (Tableau 3). Le retard dans le début des émergences serait éventuellement la conséquence de molécules larvicides présentes à une concentration sublétale sur les larves. Aucun effet larvicide n’étant constaté au niveau des lots traités avec l’extrait brut, la fraction éther de pétrole présente néanmoins une activité larvicide notable. Dans des travaux similaires (Mwangi, Mukiama, 1989), il a été démontré qu’à forte concentration, l’extrait aqueux de Melia volkensii (Meliaceae) a un effet larvicide tandis qu’à faible teneur on n’observe qu’une inhibition partielle sur les larves de Aedes aegypti L. Toutefois, dans nos conditions expérimentales (fraction éther de pétrole représentant 74 % de l’extrait brut et doses essayées ; 80 et 100 mg/20 g respectivement), l’hypothèse selon laquelle le partage liquide/liquide aurait suffisamment concentré les molécules larvicides dans la fraction éther de pétrole pour occasionner un effet larvicide est à écarter. Par contre, le fractionnement de l’extrait acétone entre l’éther de pétrole et le méthanol aqueux 50 % aurait pu entraîner une modification de la molécule native (dépourvue d’activité larvicide) pour donner un produit dérivé doué de propriétés larvicides marquées. En effet, certains métabolites secondaires sont connus pour leur instabilité dans l’eau ou dans le méthanol. Les naphtoquinones (quinone) par exemple sont méthoxylés en présence de méthanol ; de même les bidesmosides (saponosides à deux unités oligosidiques) sont facilement hydrolysés en milieu aqueux (Bruneton, 1993). L’hédérasaponine C par exemple (bidesmoside inactif) est hydrolysé en hédérine, molécule fortement antibiotique (Bruneton, 1993). En l’état actuel de nos investigations, nous ne saurions toutefois préciser ni la nature de la modification survenue (méthanolyse, hydrolyse, méthoxylation, polymérisation, etc.), ni la nature de la molécule modifiée, encore moins celle de son produit dérivé. Ainsi, la fraction éther de pétrole constitue l’extrait le plus indiqué du fait de son spectre d’activités insecticides. Elle présente en effet, le double avantage, tout comme l’huile de Cassia occidentalis (Lienard et al., 1993), d’exercer à la fois des effets ovicide (51 %) et larvicide (72 %) assez significatifs à la dose de 80 mg d’extrait pour 20 g de niébé. De ce double effet, ne résulte que seulement 9 % d’adultes émergeant des graines. Quand on sait que ce sont exclusivement les larves de C. maculatus qui sont responsables de la perforation des graines de niébé et donc de leur destruction durant le stockage, on peut apprécier positivement l’impact d’un tel traitement sur la conservation des récoltes de niébé ; tout facteur limitant la dynamique de prolifération de la bruche du niébé dans les stocks ayant un effet positif sur la conservation des graines. Dans cet ordre d’idée, l’extrait méthanolique de Piper guineense permettait de préserver les graines de niébé grâce à une activité ovicide de 100 % contre les œufs de C. maculatus (Mbata, Eppendu, 1992). De même, un traitement à base d’huile extraite de graines d’Azadirachta indica A. Juss. (Meliaceae) à raison de 3 ml d’huile par kg de niébé, a permis en laboratoire de réduire à moins de 4 % le taux de destruction des graines en trois mois de stockage (Ivbijaro, 1990). Ce traitement réduisait le taux d’adultes émergeant à 2 % des œufs pondus. Même si le niveau de protection exercé par la fraction éther de pétrole de S. hermonthica est inférieure à ceux induits par Piper guineense et Azadirachta indica, les activités ovicide et larvicide enregistrées pourraient néanmoins être avantageusement exploitées pour préserver les graines de niébé lors du stockage. L’activité ovicide exercée par S. hermonthica serait due à l’une au moins des génines triterpéniques rencontrées dans la fraction isolée. Les triterpènes sont en effet connus pour leurs diverses propriétés insecticides, notamment ovicide comme c’est le cas de l’azadirachtine, isolée d’Azadirachta indica (Su, Mulla, 1998). La molécule larvicide résulterait de la modification d’une molécule native inactive. Les conditions expérimentales de l’analyse chromatographique n’ont pas permis de collecter une fraction douée d’activité larvicide. On pourrait expliquer cela par l’hypothèse suivante : l’activité larvicide de la fraction éther de pétrole serait le résultat d’une synergie d’action d’au moins deux molécules qui n’ont pas été collectées au niveau de la même fraction chromatographique. Certains auteurs (Ivbijaro, Agbaje, 1986) ont en l’occurrence montré que l’activité insecticide de Piper guineense était due à l’action synergisante de la piperine sur la guineensine. Dans certaines régions d’Afrique, les huiles d’arachide ou de palme sont utilisées telles quelles pour imprégner les graines de niébé afin de les préserver contre les larves et les œufs de C. maculatus lors du stockage (Osekre et al., 2002). Les molécules responsables des activités ovicide et larvicide de S. hermonthica étant lipophiles, l’on pourrait, dans les conditions d’utilisation pratique, envisager d’extraire S. hermonthica avec une émulsion eau-alcool-huile végétale telle que l’huile d’arachide, de palme ou de sésame.
5. Conclusion
23Striga hermonthica pourrait avantageusement être utilisé comme insecticide botanique pour conserver les graines de niébé de par les activités ovicide et larvicide de la fraction éther de pétrole sur C. maculatus. Il convient toutefois de noter que les composés larvicides ne seraient formés qu’après réaction avec l’éther de pétrole et/ou le méthanol. En effet, l’activité larvicide n’est pas observée dans l’extrait brut. Il faudrait également envisager de conduire au préalable des essais de conservation dans les conditions de stockage des petits agriculteurs en vue d’évaluer l’efficacité réelle des extraits de Striga hermonthica sur la préservation des graines. Il s’agira également pour nous d’évaluer la toxicité et le pouvoir de germination des graines traitées. L’élucidation structurale du/des triterpène(s) ovicide(s) et l’identification des composés responsables de l’activité larvicide (molécule active et synergisante) sont en cours.
24Remerciements
25Nos remerciements vont au Dr Millogo Jeanne pour l’identification du matériel végétal ainsi qu’au Ministère des Enseignements Secondaires Supérieurs et de la Recherche Scientifique du Burkina Faso pour la bourse ayant permis de financer cette étude.
Bibliographie
Adebayo TA., Gbolade AA. (1994). Protection of stored cowpea from Callosobruchus maculatus using plant product. Insect. Sci. Applic. 15 (2), p. 185–189.
Bal AB. (1992). Les principaux insectes du niébé dans le Sahel et leur contrôle. In John Libey-Eurotext (eds). Lutte intégrée contre les ennemis des cultures vivrières dans le Sahel. Cilss, Institut du Sahel séminaires et colloques, Mali 4–9 janvier 1990.
Bruneton J. (1993). Pharmacognosie : phytochimie, plantes médicinales (2 éd.). Paris : Tec & Doc Lavoisier, 925 p.
Ho SH., Lee LS., Tong Y. (1995). Effect of non polar extract of clove flower buds on some life stage of Tribolium castaneum. Int. Pest Control 37 (4), p. 112–113.
Ivbijaro MF., Agbaje M. (1986). Insecticidal activities of Piper guineense Schum and Thonn, and Capsicum species on the cowpea bruchids Callosobruchus maculatus (F.). Insect. Sci. Applic. 7, p. 521–524.
Ivbijaro MF. (1990). The efficacy of oil of Azadirachta indica A. Juss. and Piper guineense Schum and Thonn on the control of Callosobruchus maculatus F. Insect. Sci. Applic. 11 (2), p. 149–152.
Kerharo J., Adam JG. (1974). La pharmacopée sénégalaise traditionnelle. Plantes médicinales et toxiques. Paris : Vigot Frères, 1011 p.
Lienard V., Seck D., Lognay V. (1993). Biological activity of Cassia occidentalis L. against Callosobruchus maculatus (F.) (Coleoptera: Bruchidae). J. Stored Prod. Res. 29 (4), p. 311–318.
Mbata GN., Ekpendu OT. (1992). The insecticidal action of four botanicals against three storage beetles. Med. Fac. Landbouww. Univ. Gent. 57 (3A), p. 723–733.
Mendez J., Bilia AR., Morrelli I. (1995). Phytochemical investigations of Licania genus. Flavonoids and triterpenoids from Licania pittieri. Pharma. Acta. Helvetica 70 (3), p. 223–226.
Merck (1975). Révélateurs pour la Chromatographie sur couche mince et sur papier. D-61 Darmstadt Francfort, Allemagne : Merck, 138 p.
Moretti MDL., Bazzoni E., Giovanni SP., Romolo P. (1998). Antifeedant effects of some essential oils on ceratitis capitata Wied. (Diptera, Tephritidae). J. Essent. Oil. Res. 10, p. 405–412.
Mwangi RW., Mukiama TK. (1989). Studies of insecticidal and growth-regulating activity in extracts of Melia volkensii (Gurke), an indigenous tree in Kenya. E. Afr. Agric. Form. J. 54 (3), p. 165–171.
Nacoulma OG. (1996). Plantes médicinales et pratiques médicales traditionnelles au Burkina-Faso : cas du plateau central. Thèse doctorat d’état. Université de Ouagadougou, Burkina-Faso, Tome I, 320 p, Tome II, 261 p.
Osekre EA., Gbewonyo WSK., Ayertey JN. (2002). Toxicity of palm oil to eggs and larvae of Callosobruchus maculatus (F.) on stored cowpea. Insect. Sci. Applic. 22 (3), p. 225–234.
Rasool N., Ahmad VU., Malik A. (1992). Two new triterpenoids from Pentatropis spiralis. Fitoterapia 63 (2), p. 156–159.
Sanon A., Ouedraogo AP. (1998). Etude de variation des paramètres démographiques de Callosobruchus maculatus (F.) et de ses parasitoïdes, Dinarmus basalis (Rond.) et Eupelmus vuiletti (Crwf), sur le niébé dans une perspective de lutte biologique. Insect. Sci. Applic. 18 (3), p. 241–250.
Su T., Mulla MS. (1998). Ovicidal activity of neem product (azadirachtin) against Culex tarsalis and Culex quinquefasciatus (Diptera: Culicidae). J. Am. Mosq. Control Assoc. 14 (2), p. 204–209.
Wagner H., Bladt S. (1996). Plant drug analysis, a thin layer chromatography atlas (2nd ed.). Berlin : Springer, 384 p.
Pour citer cet article
A propos de : Martin Kiendrebeogo
Laboratoire de Biochimie et de Chimie appliquée, UFR/SVT, Université de Ouagadougou, 03 BP 7021 Ouagadougou 03 (Burkina Faso). E-mail : martin.k@univ-ouaga.bf ; kmartin71@hotmail.com
A propos de : Albert Patoin Ouedraogo
Laboratoire d’Entomologie appliquée, UFR/SVT, Université de Ouagadougou, 06 BP 9820 Ouagadougou 06 (Burkina Faso).
A propos de : Odile Germaine Nacoulma
Laboratoire de Biochimie et de Chimie appliquée, UFR/SVT, Université de Ouagadougou, 03 BP 7021 Ouagadougou 03 (Burkina Faso).






