- Accueil
- volume 10 (2006)
- numéro 1
- Barrières pré-zygotiques chez les hybrides entre formes sauvages du niébé, Vigna unguilata (L.) Walp.
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Barrières pré-zygotiques chez les hybrides entre formes sauvages du niébé, Vigna unguilata (L.) Walp.

Notes de la rédaction
Reçu le 15 mars 2005, accepté le 6 octobre 2005.
Résumé
Les formes sauvages du niébé, Vigna unguiculata, constituent un pool génétique important jusque là insuffisamment exploité pour l’amélioration de la forme cultivée. Dans le but de favoriser l’utilisation de ces formes sauvages dans les programmes d’amélioration génétique, nous avons entrepris de comprendre les différentes réactions d’incompatibilité qui se manifestent entre elles. Nous nous sommes particulièrement intéressés à la compréhension des causes des avortements massifs observés au cours des hybridations entre la sous-espèce baoulensis NI933 et les autres formes sauvages de V. unguiculata. Les réactions d’incompatibilité détectées grâce à l’utilisation de la fluorescence du bleu d’aniline, sont pour la plupart d’ordre pré-zygotiques. Elles se manifestent en trois sites ; à savoir le tiers supérieur et inférieur du style et au sein de l’ovaire. Cependant, ces réactions ou barrières d’incompatibilité ne sont pas absolues. En effet, au cours des hybridations réalisées durant nos travaux, plus de 4 % des ovules ont été fécondés chez les différentes combinaisons étudiées.
Abstract
Hybrids pre-zygotic barriers between wild forms of cowpea. The wild forms of cowpea, Vigna unguiculata, constitute an important gene pool insufficiently exploited for the improvement of the cultivated form. In order to promote the use of these wild forms in the genetic improvement programmes, we undertook to understand the various incompatibility reactions which appear in the crosses between wild forms. Efforts were concentrated to understand the incompatibility barriers in the hybridizations between subsp. baoulensis NI933 and the other wild forms of V. unguiculata. Thanks to the use of the aniline blue fluorescence, we observed a high frequency of pre-zygotic barriers. They appear in three sites, i.e. the higher and lower third of the style, and within the ovary. However, these incompatibility barriers are not absolute. Indeed, in our hybridizations, more than 4% of the ovules were fertilized in the various studied combinations.
Table des matières
1. Introduction
1Le niébé, Vigna unguiculata (L.) Walp. (Fabaceae) est la principale légumineuse alimentaire cultivée dans les zones de basse altitude d’Afrique. Les formes sauvages sont largement répandues en Afrique, des régions subdésertiques aux forêts de montagne. Cette diversité de milieux se traduit par une importante diversité tant moléculaire que morphologique qui permet d’identifier une douzaine de taxons infraspécifiques, dont certains pourraient être élevés au rang d’espèce sur la base des distances génétiques observées (Pasquet, 1999). Néanmoins, V. unguiculata est très bien caractérisée morphologiquement, l’espèce est bien séparée de ses voisines, Vigna schlechteri Harms et Vigna vexillata (L.) A. Rich., et l’unité de V. unguiculata mise en place par Maréchal et al. (1978) n’a jamais été remise en question.
2à l’intérieur de V. unguiculata, on distingue douze taxons séparés au niveau subspécifique. Ces douze sous-espèces peuvent être classées en trois groupes sur la base de leur écologie (forêts ou savanes) et de leur mode de reproduction (morphologie florale favorisant l’allogamie ou l’autogamie), mais ces trois groupes ne peuvent être séparés sur la base de critères morphologiques. On distingue ainsi un groupe allogame, un groupe allo-autogame et un groupe autogame (Pasquet, 1994 ; 1999 ; Pasquet, Baudoin, 1997).
3Un premier groupe, phylogénétiquement primitif, inclut des sous-espèces pérennes rencontrées dans les zones forestières (forêts guinéennes ou forêts d’altitude), qui présentent toujours un mode de reproduction allogame. Il s’agit de subsp. baoulensis (A. Chev.) Pasquet (forêts guinéennes de la Sierra Leone au Cameroun), subsp. letouzeyi Pasquet (forêts guinéennes du bassin congolais), subsp. burundiensis Pasquet (forêt d’altitude de la région des grands lacs), subsp. pawekiae Pasquet (forêts d’altitude du sud de l’Ethiopie au Zimbabwe) et de subsp. aduensis Pasquet (forêts d’altitude du nord de l’Ethiopie).
4Un second groupe, phylogénétiquement plus évolué, inclut des sous-espèces pérennes rencontrées dans les zones de savanes, qui présentent un mode de reproduction plus autogame, chaque taxon présentant des populations allogames et des populations plus ou moins autogames. On y distingue subsp. alba (G. Don) Pasquet du Gabon à l’Angola, subsp. tenuis (E. Mey.) Maréchal, Mascherpa & Stainier de la Zambie à l’Océan Indien, subsp. stenophylla (Harv.) Maréchal, Mascherpa & Stainier sensu lato de la Namibie à la province du Cap en Afrique du Sud, subsp. pubescens (R. Wilczek) Pasquet de la région des Grands Lacs au Mozambique. Subsp. dekindtiana (Harms) Verdc. sensu stricto, qui se rencontre du sud de l’Angola au Zimbabwe, fait sans doute partie de ce groupe mais aucun échantillon vivant n’a pu en être étudié pour le confirmer. Vigna monantha Thulin, localisé aux zones côtières de Somalie, appartient aussi à ce groupe même si le changement taxonomique n’a pas encore été effectué.
5Le troisième groupe est réduit à la sous-espèce unguiculata qui comprend les formes cultivées (var. unguiculata) et leur progéniteur sauvage (var. spontanea (Schweinf.) Pasquet). Même si subsp. unguiculata pourrait être considérée comme une sous-espèce allo-autogame, les plantes pérennes allogames sont réduites à quelques populations des plaines côtières de l’Océan Indien alors que les plantes annuelles et autogames se rencontrent presque partout en Afrique. Var. spontanea est aussi une plante adventice et colonisatrice qui aime les milieux perturbés, en particulier les champs cultivés où, jusqu’à la fructification, elle est difficilement distinguable de var. unguiculata.
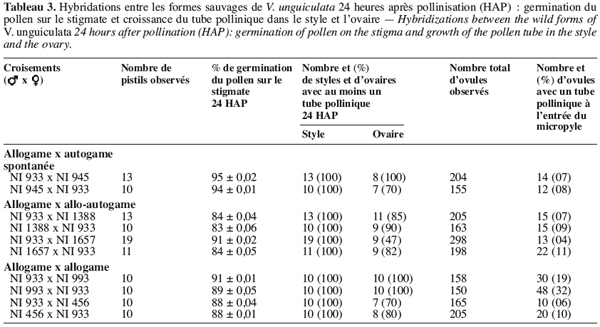
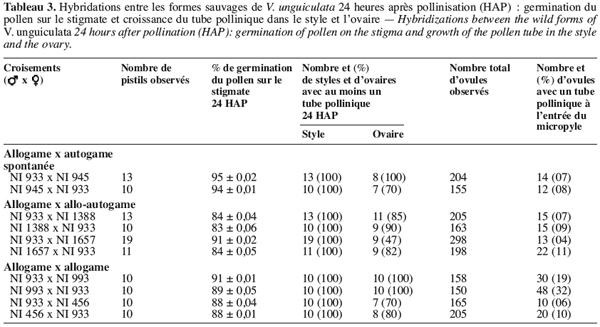
6Dans la perspective de l’amélioration génétique des formes cultivées, les formes sauvages apparaissent comme une source de gènes utiles pour ce qui est de la résistance/tolérance aux pathogènes et autres facteurs biotiques et abiotiques (Fatokun, Singh, 1987). Cependant, leur utilisation dans les programmes d’amélioration nécessite d’identifier de manière précise les barrières d’incompatibilité entre toutes les formes sauvages et cultivées. Chez Vigna, ces barrières peuvent intervenir avant la fécondation de l’ovule (barrières pré-zygotiques) ou après la fécondation de l’ovule (barrières post-zygotiques).
7Dans le premier cas, l’incompatibilité peut se manifester par une faible germination du pollen sur le stigmate comme cela fut observé par Barone et al. (1992) au cours des croisements entre V. vexillata et V. unguiculata. Elle peut également se manifester par un échec à la pénétration des tubes polliniques dans le stigmate comme cela fut observé par Chen et al. (1983) au cours des hybridations entre V. umbellata (Thunb.) Ohwi & Ohashi et Vigna radiata (L.) Wilczek. Enfin, l’incompatibilité pré-zygotique peut se manifester par un ralentissement de la croissance du tube pollinique dans les tissus stylaires et/ou par la distorsion du tube pollinique (Chowdhury, Chowdhury, 1983 ; Barone et al., 1992).
8Quant aux barrières d’incompatibilité post-zygotiques, elles peuvent se manifester par l’absence de développement de l’embryon hybride ou par une stérilité complète ou partielle des graines hybrides, ou encore par une stérilité des hybrides F1 obtenus (Biswas, Dana, 1976 ; Ahn, Hartmann, 1978 ; Chen et al. , 1983 ; Fatokun, 1991 ; Barone et al., 1992).
9Au niveau intra-spécifique, très peu de travaux ont été consacrés à la compréhension de la nature des barrières d’incompatibilité existantes entre les différents taxa que comporte l’espèce Vigna unguiculata et particulièrement entre les formes sauvages. Echikh (2000) a notamment réalisé une étude sur les barrières d’incompatibilité, mais en n’utilisant que les trois taxons : subsp. baoulensis, subsp. letouzeyi et subsp. tenuis sur la dizaine des taxons indiqués dans la classification de Pasquet (1994). Elle a mis en évidence des barrières d’incompatibilité pré-zygotiques, se caractérisant, notamment, par des difficultés de germination des grains de pollen sur le stigmate et le ralentissement du tube pollinique lors de la pénétration dans les tissus stigmatiques. Ces différentes anomalies sont surtout observées lors de l’utilisation de la sous-espèce baoulensis originaire de l’Afrique de l’Ouest et dont l’aire de distribution s’étend dans cette contrée (Pasquet, 1994 ; 1996). Des taux d’avortements très élevés (de 70 à 100 %) sont observés lorsque la subsp. baoulensis est croisée avec les autres formes sauvages.
10Le but de notre travail est de déterminer si les barrières d’incompatibilité de type pré-zygotiques se manifestent au cours des hybridations entre la subsp. baoulensis et d’autres formes sauvages de V. unguiculata. Les résultats de ces croisements pourront contribuer à mieux comprendre l’organisation de la diversité génétique du niébé. Ces informations seront aussi utiles dans l’amélioration variétale de V. unguiculata.
2. Matériel et méthodes
2.1. Matériel végétal
11La liste des génotypes parentaux de V. unguiculata se trouve au tableau 1.
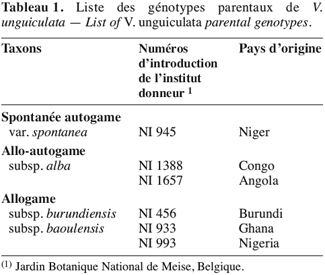
2.2. Semis en serres
12Pour chaque génotype, deux à trois graines ont été scarifiées pour faciliter la germination puis placées dans des boîtes de Petri et mises à l’étuve à 25 °C. Deux à trois jours après la germination, elles ont été placées dans des « jiffy pots » et mises au germoir à température de 7 °C et 100 % d’humidité relative. Après le développement des feuilles primaires, les plantules ont été transplantées dans des serres tropicalisées de la Faculté universitaire des Sciences agronomiques de Gembloux. La température des serres est réglée à 21 °C le jour et 16,5 °C la nuit, avec une humidité relative de 80 %. Les travaux se sont déroulés de février à août 2004, ils ont débuté par les semis répétés des génotypes parentaux aux mois de février, mars et avril afin de favoriser la synchronisation des floraisons entre les génotypes identifiés comme tardifs (NI456, NI933 et NI993) et les génotypes identifiés comme précoces (NI945, NI1388, NI1657) par Echikh (2000).
2.3. Estimation de la fertilité pollinique
13Pour chaque génotype parental, la fertilité pollinique a été estimée sur une moyenne de trois fleurs (pendant les mois d’avril, de juin et d’août) grâce à un test de coloration des grains de pollen à l’acétocarmin. Les grains de pollen colorés et bien ronds sont considérés comme viables (Alexander, 1980).
2.4. Hybridations, germination du pollen et croissance du tube pollinique
14Les premières hybridations ont débuté en avril et se sont poursuivies jusqu’en août. Elles ont été effectuées selon la technique utilisée par Echikh (2000). Les fleurs pollinisées destinées aux observations microscopiques ont été recueillies pour chaque combinaison réalisée à raison de 10 à 19 fleurs après l’échec de la nouaison, 24 heures après pollinisation (HAP). Dans le but de suivre la vitesse de germination du pollen, deux fleurs pollinisées ont été également prélevées pour chaque combinaison à 1, 2, 4, 6, 8, 10 et 16 heures après pollinisation. Des génotypes parentaux ont été autofécondés et prélevés également à différentes heures à raison de 10 à 15 fleurs afin d’être observés comme témoins. La méthode utilisée pour suivre la germination du pollen sur le stigmate et la croissance du tube pollinique dans le style et dans l’ovaire est la méthode de fluorescence du bleu d’aniline (Dumas, Knox, 1983). Pour les différents échantillons à traiter, le gynécée complet est fixé pendant 24 heures à 4 °C dans une solution 1 : 1 glutaraldéhyde et acide formique (v/v). Après la fixation, le matériel est mis à macérer dans de la soude caustique concentrée (8 N) pendant au moins 12 heures. Le style est par la suite rincé plusieurs fois à l’eau courante avant l’observation.
15Les styles et les ovaires sont ensuite séparés et traités différemment à cause de leur différence de structure et de consistance. Les styles sont disséqués longitudinalement et la face sectionnée est disposée vers le haut pour recevoir la lumière incidente. Les ovaires sont ouverts délicatement sur toute la ligne de suture du carpelle, de manière à maintenir les ovules sur les deux demi-carpelles selon l’alternance de leur implantation sur le placenta. Les échantillons sont déposés sur des lames et reçoivent une goutte de fluorochrome de bleu d’aniline qui forme un complexe avec la callose dont l’ensemble émet une fluorescence jaune-vert (Eschrich, Currier, 1964).
16L’ensemble est recouvert d’une lamelle pour observation sur un microscope Nikon (Elipse E 800) fluorescent en lumière réfléchie. Les images sont prises à l’aide d’une camera JVC (3-CCD) et gérée par le programme Image Archive Plus de Sony.
17La mise en évidence des barrières d’incompatibilité pré-zygotiques est faite à partir de l’observation de la germination du pollen sur le stigmate, la croissance des tubes polliniques dans le style et dans l’ovaire, ainsi que la présence du tube pollinique à l’entrée du micropyle de l’ovule. Nous avons considéré comme fécondé tout ovule pénétré par un tube pollinique ou ayant un tube pollinique à l’entrée du côté micropylaire. Le nombre total d’ovules observés et le nombre d’ovules avec un tube pollinique à l’entrée du micropyle ont été comptés. Le pourcentage d’ovules fécondés a été calculé à partir de la formule suivante :
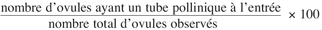
3. Résultats
3.1. Fertilité pollinique et croissance du tube pollinique des parents
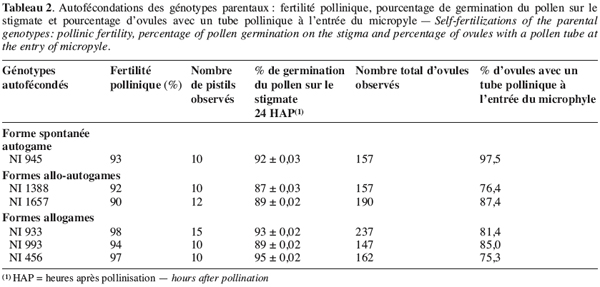
18La fertilité pollinique des différents génotypes parentaux est élevée : elle varie entre 90 et 98 %.
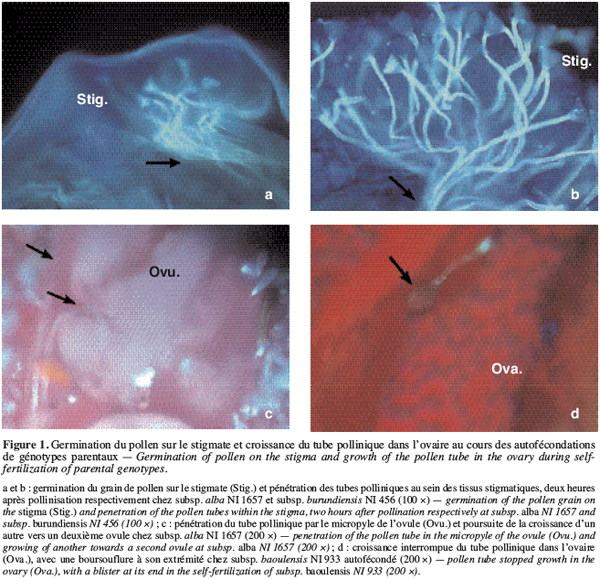
19Lors des autofécondations dans nos conditions de culture, on observe un début de germination des grains de pollen des génotypes parentaux une à deux heures après pollinisation (Figure 1a et 1b). Ces tubes polliniques atteignent l’ovaire, en général, 4 à 6 heures après pollinisation. Le taux de grains de pollen germés sur le stigmate, 24 heures après pollinisation, lors des autofécondations varie entre 87 à 95 % (Tableau 2). Le taux d’ovules avec un tube pollinique à l’entrée est élevé : il varie, en effet, entre 81,4 et 97,4 % (Figure 1c). Cependant, on observe lors de certaines autofécondations du génotype NI933, la présence d’une boursouflure à l’extrémité du tube pollinique bloquant ainsi sa croissance dans l’ovaire (Figure 1d).
3.2. Suivi de la croissance du tube pollinique chez les différentes combinaisons
20Pour les différentes combinaisons étudiées, nous avons observé un taux de germination élevé du pollen sur le stigmate. En effet, la germination du pollen débute 1 à 2 heures après le dépôt sur le stigmate suivant la combinaison ; 24 heures après le dépôt, cette germination est de 83 à 95 % chez la plupart des combinaisons étudiées (Tableau 3). Ce taux est presque identique à celui observé lors des autofécondations. Chez toutes les combinaisons étudiées, les tubes polliniques au cours de leur croissance ont traversé les tissus stigmatiques et ont été aperçus dans le tiers supérieur du style 4 heures environ après pollinisation et 8 à 10 heures successivement dans le tiers inférieur du style et dans l’ovaire. Le pourcentage d’ovaires avec au moins un tube pollinique 24 heures après pollinisation varie d’une combinaison à l’autre. Il varie entre 62 et 70 % chez les combinaisons entre la forme allogame NI933 et la forme spontanée autogame NI945. Ce pourcentage varie entre 47 et 90 % chez les combinaisons entre la forme allogame NI933 et les formes allo-autogames NI1656 et NI1657. Enfin au niveau des combinaisons réalisées entre la forme allogame NI933 et les formes allogames NI993 et NI456, environ 70 à 100 % des ovaires ont montré la présence d’au moins un tube pollinique 24 heures après pollinisation.
21Combinaisons entre allogame et autogame spontanée. On observe chez les fleurs pollinisées qui ont chuté au cours des hybridations entre var. spontanea (spontanée autogame) NI945 et subsp. baoulensis (allogame) NI933, qu’environ 94 à 95 % des grains de pollen ont germé normalement sur le stigmate (Tableau 3). Les tubes polliniques ont traversé les tissus stigmatiques et arrivent pour la plupart dans le tiers supérieur du style (Figure 2a et 2b). Cependant, leur croissance est ralentie dans le tiers inférieur du style et seulement 7 à 8 % des ovules sont fécondés 24 HAP. On observe un arrêt de la croissance des tubes polliniques au niveau de l’ovaire sans que la fécondation se produise. Ce blocage se manifeste parfois après une trajectoire sinueuse du tube pollinique, lequel montre des bouchons callosiques ou un renflement à son extrémité (Figure 2c et 2d).

22Combinaisons entre allogame et allo-autogame. Au niveau des fleurs avortées chez les hybridations entre la forme allogame subsp. baoulensis NI933 et les deux génotypes de la forme allo-autogame subsp. alba NI1388 et NI1657, on observe également une bonne germination du pollen sur le stigmate, avec des taux variant entre 83 et 91 % (Tableau 3). Les tubes polliniques parviennent, dans les différentes combinaisons, au niveau du tiers supérieur du style après avoir traversé les tissus stigmatiques. A ce niveau on observe l’arrêt de leur croissance dans le tiers supérieur du style dans certains cas (Figure 3a) et dans le tiers inférieur dans d’autres cas. Très peu d’entre eux parviennent à l’ovaire. Ainsi, seulement 4,4 à 11,1 % des ovules observés ont présenté un tube pollinique à leur entrée (Figure 3b).

23Combinaisons entre allogames. Chez les hybridations entre les formes sauvages allogames, entre les deux génotypes NI933 et NI993 de subsp. baoulensis, et entre NI933 de subsp. baoulensis et NI456 de subsp. burundiensis, on constate également une bonne germination du pollen sur le stigmate (Figure 4a). Le taux de germination varie entre 88 et 91 %. Cependant, pour ce qui est de la fécondation des ovules, les observations divergent suivant le type de combinaisons. Le taux d’ovules avec un tube pollinique à l’entrée est élevé lorsque l’hybridation est réalisée entre les deux génotypes de la sous-espèce baoulensis (NI933 et NI993), soit 19 et 32 % (Figure 4b). Par contre, le croisement entre NI933 et NI456 présente seulement 6 et 9,7 % d’ovules avec un tube pollinique à leur entrée.

4. Discussion et conclusion
24Selon nos résultats, les causes des nombreux avortements observés au cours des hybridations entre les formes sauvages ne sont pas liées aux réactions d’incompatibilité de type pollen/stigmate. Chez les différentes combinaisons analysées, la germination du pollen et la pénétration du tube pollinique dans les tissus stigmatiques se sont bien déroulées. Cependant, c’est au niveau du style et de l’ovaire que des manifestations d’incompatibilité ont pu être identifiées.
25La première manifestation d’incompatibilité a lieu dans le tiers supérieur du style. En effet, à ce niveau chez certaines combinaisons, la croissance du tube pollinique est ralentie puis bloquée comme cela fut observé au cours des croisements entre la forme allogame NI933 et les formes allo-autogames.
26La seconde manifestation d’incompatibilité a lieu au niveau du tiers inférieur du style, avec également un arrêt de la croissance des tubes polliniques comme cela fut observé chez la plupart des combinaisons étudiées. La troisième manifestation d’incompatibilité a lieu au sein de l’ovaire, avec un arrêt de la croissance du tube pollinique dont l’extrémité présente une boursouflure comme cela fut observé au cours des croisements entre la forme allogame NI933 et la forme spontanée autogame NI945.
27Ces différentes barrières d’incompatibilité ne sont pas absolues. En effet, toutes les combinaisons réalisées montrent plus de 4 % d’ovules fécondés. Chez le genre Medicago, Sangduen et al. (1983) ont également observé un ralentissement de la croissance du tube pollinique dans le style chez des hybridations interspécifiques alors que la germination du pollen sur le stigmate s’était normalement déroulée. Chez le genre Prunus, Socias et Alonso (2004) ont aussi observé que les réactions d’incompatibilité pré-zygotiques pouvaient se manifester parfois par la formation d’une boursouflure à l’extrémité du tube pollinique bloquant, ainsi, sa croissance dans le style ou dans l’ovaire. Chez le genre Phaseolus également, Suy (1979) a mis en évidence la présence d’une boursouflure aussi bien chez des tubes polliniques à croissance normale et anormale.
28Nos observations confirment l’existence des barrières d’incompatiblité pré-zygotiques entre les formes sauvages de V. unguiculata. Cependant, d’autres facteurs pourraient intervenir pour expliquer l’avortement massif des fleurs pollinisées, comme le taux de chute naturel des fleurs, le traumatisme floral dû à la castration et la présence de barrières d’incompatibilité post-zygotiques fréquemment observées chez le genre Phaseolus (Lukoki, Maréchal (1981) ; Weilenmann et al., 1987 ; Baudoin, Maréchal, 1991).
29Malgré le fait que les formes sauvages utilisées dans nos croisements appartiennent à des groupes distincts selon la classification de Pasquet (1994 ; 1999), les barrières pré-zygotiques observées dans les hybridations ne sont pas insurmontables. Toutes ces formes appartiennent à un même réservoir génétique. Les sources sauvages constituent une source de gènes potentiellement utiles pour l’amélioration de la forme cultivée, V. unguiculata subsp. unguiculata var. unguiculata. Des recherches futures pourront être développées à plusieurs niveaux : évaluer agronomiquement ces formes sauvages et identifier des caractères intéressants en sélection variétale du niébé ; analyser les possibilités de croisements entre les génotypes sauvages les plus utiles et la forme cultivée, et profiter d’hybrides entre formes sauvages de V. unguiculata pour faciliter des transferts de gènes chez la forme cultivée.
30Toutes les hybridations réalisées entre formes sauvages et cultivées du niébé permettront aussi de mieux comprendre l’organisation de la diversité génétique de V. unguiculata au sens large.
31Remerciements
32Ces travaux ont été rendus possibles grâce à l’aide financière de la République de Côte d’Ivoire qui finance la bourse d’étude du premier auteur. Nous transmettons nos remerciements aux autorités de l’ambassade de Côte d’Ivoire en Belgique, ainsi qu’aux responsables de l’Unité de Phytotechnie Tropicale et d’Horticulture de la Faculté universitaire des Sciences agronomiques de Gembloux, pour leur aide précieuse dans la réalisation de ce travail.
Bibliographie
Alexander MP. (1980). A versatile stain for pollen, fungi yeast and bacteria. Stain techn. 55, p. 13–18.
Ahn CS., Hartmann RW. (1978). Interspecific hybridization between mung bean (Vigna radiata (L.) Wilczeck) and adzuki bean (V. Angularis (Wild) Ohwi and Ohashi). J. Am. Soc. Hortic. Sci. 103, p. 3–6.
Barone A., Del Guidice Ng NQ. (1992). Barriers to interspecific hybridisation between Vigna unguiculata and V. vexillata. Sex. Plant Reprod. 5, p. 195–200.
Baudoin JP., Maréchal (1991). Taxonomy and wide crosses of pulse crops. In Ng NQ., Perrino P., Attere F., Zedan H. Crop Genet. Resour. of Africa, vol. II, Conf. organized by IITA, CNR, IBPGR and UNEP. Ibadan, Nigeria, 17-20 oct. 1988. p. 287–302.
Biswas MR., Dana S. (1976). Phaseolus aconitifolia x P. trilobata cross. Indian J. Genet. 36, p. 125–131.
Chen NC., Baker LR., Honma S. (1983). Interspecific crossability among four species of Vigna food legumes. Euphytica 32, p. 925–937.
Chowdhury RK., Chowdhury JB. (1983). Compatibility between Vigna radiata (L.) Wilczek and V. umbellata. Genet. Agrar. 37, p. 257–266.
Dumas C., Knox RB. (1983). Callose and determination of pistil viability and incompatibility. Theor. Appl. Genet. 67, p. 1–10.
Echikh N. (2000). Organisation du pool génique de formes sauvages et cultivées d’une légumineuse alimentaire, Vigna unguiculata (L.) Walp. Thèse de doctorat, Fac. Univ. Sci. Agron. Gembloux, Belgique, 307 p.
Eschrich W., Currier HB. (1964). Identification of callose by its diachrome and fluorochrome reaction. Stain Techn. 39 (5), p. 303–308.
Fatokun CA. (1991). Wide hybridization in cowpea: problems and prospects. Euphytica 54, p. 137–140.
Fatokun CA., Singh BB. (1987). Interspecific hybridization between Vigna pubescens and V. unguiculata (L.) Walp. through embryo rescue. Plant Cell Tissue Organ Cult. 9 (3), p. 229–233.
Lukoki L., Maréchal R. (1981). Hybridations interspécifiques entre Vigna radiata (L.) Wilczek et Vigna mungo (L.) Hepper. Bull. Rech. Agron. Gembloux 16 (3), p. 233–248.
Maréchal R., Mascherpa JM., Stainer F. (1978). Etude taxonomique d’un groupe d’espèces des genres Phaseolus et Vigna (Papilionaceae) sur la base de données morphologiques et polliniques traités par l’analyse informatique. Boissiera 28, p. 10–231.
Pasquet RS. (1994). Organisation génétique et évolutive des formes spontanées et cultivées du niébé, Vigna unguiculata (L.) Walp. Biosystématique et processus de domestication. Thèse de doctorat, Paris Grignon, Institut National Agronomique Paris-Grignon-ORSTOM, 284 p.
Pasquet RS. (1996). Wild cowpea (Vigna unguiculata) evolution. In Pickersgill B., Lock JM. (eds). Advances in legumes systematics 8: Legumes of Economic Importance. Kew: Royal Botanic Gardens, p. 95–100.
Pasquet RS. (1997). A new subspecies of Vigna unguiculata (Leguminosae : Papillionoideae). Kew Bull. 52, p. 840.
Pasquet RS. (1999). Genetic relationship among subspecies of Vigna unguiculata (L.) Walp. Based on allozyme variation. Theor. Appl. Genet. 98, p. 1104–1119.
Pasquet RS., Baudoin JP. (1997). Le niébé, Vigna unguiculata. In Charrier A., Jacquot M., Hamon S., Nicolas D. (éd). L’amélioration des plantes tropicales. Montpellier, France : CIRAD-ORSTOM, p. 483–505.
Sangduen N., Sorensen EL., Liang GH. (1983). Pollen germination and pollen tube growth following self-pollination and intra- and interspecific pollination of Medicago species. Euphytica 32, p. 527–534.
Socias RC., Alonso JM. (2004). Cross-incompatibility of ‘ferragnès’ and ‘ferralise’ and pollination efficiency for self-compatibility transmission in almond. Euphytica 135, p. 333–338.
Suy TB. (1979). Observation par fluorescence de la croissance du gamétophytique mâle chez Phaseolus lunatus L. et chez un hybride interspécifique. Bull. Rech. Agron. Gembloux 14 (1), p. 97–108.
Weilenmann de Tau E., Mathieu A., Maréchal R., Baudoin JP. (1987). Observation par fluorescence de la croissance du gamétophyte mâle chez des allotétraploïdes d’un hybride interspécifique entre Phaseolus vulgaris L. et Phaseolus filiformis Benth. Bull. Rech. Agron. Gembloux 22 (2), p. 143–151.
Pour citer cet article
A propos de : Daouda Kouadio
Unité de Phytotechnie tropicale et Horticulture. Faculté universitaire des Sciences agronomiques de Gembloux. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : daoudak70@hotmail.com
A propos de : André Toussaint
Unité de Phytotechnie tropicale et Horticulture. Faculté universitaire des Sciences agronomiques de Gembloux. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
A propos de : Rémy S. Pasquet
International Center of Insect Physiology and Ecology, P.O. Box 30772, Nairobi (Kenya).
A propos de : Jean-Pierre Baudoin
Unité de Phytotechnie tropicale et Horticulture. Faculté universitaire des Sciences agronomiques de Gembloux. Passage des Déportés, 2. B-5030 Gembloux (Belgique).






