- Portada
- Volume 21 (2017)
- Numéro 1
- Le rôle des rongeurs dans la dispersion des diaspores en milieu forestier (synthèse bibliographique)
Vista(s): 0 (0 ULiège)
Descargar(s): 0 (0 ULiège)
Le rôle des rongeurs dans la dispersion des diaspores en milieu forestier (synthèse bibliographique)

Notes de la rédaction
Reçu le 13 mai 2016, accepté le 21 novembre 2016
Cet article est distribué suivant les termes et les conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr)
Résumé
Introduction. La dispersion des diaspores constitue une interaction clé qui influence de nombreux processus écologiques utiles au maintien de la diversité des écosystèmes forestiers. Les rongeurs, considérés la plupart du temps comme prédateurs de diaspores, sont susceptibles de transporter, dissimuler et oublier les diaspores sur des distances considérables favorisant indirectement leur germination. Leur rôle sur la régénération des écosystèmes forestiers dépendra alors de différentes variables environnementales influençant leur comportement.
Littérature. La plupart des publications démontrent que les rongeurs agiraient au détriment des communautés végétales en consommant les diaspores de nombreuses espèces. Toutefois, en raison de la difficulté de définir leur patron de mouvement, l’impact réel des rongeurs sur la régénération est très peu documenté et probablement sous-estimé. Par la pratique du scatter-hoarding, le rôle des rongeurs pourrait s’avérer crucial, plus particulièrement dans les forêts où la grande faune est soumise à une chasse excessive.
Conclusions. Les forêts denses humides africaines sont localement fortement affectées par une importante défaunation, or le rôle des rongeurs y est très peu étudié. Afin de définir plus précisément celui-ci, il est suggéré de réaliser de nouvelles études sur les interactions qui existent entre les diaspores et les rongeurs par des méthodes ayant fait leurs preuves sur d’autres continents.
Abstract
The role of rodents in the regeneration of forest ecosystems. A review
Introduction. Seed dispersal is a key interaction influencing a number of ecological processes that are important to the maintenance of diversity in forest ecosystems. Rodents, mainly considered as seed predators, can carry, hide and discard seeds, often transporting them over considerable distances from the parent tree and thus leading to an enhanced germination rate. The role of rodents in forest regeneration therefore depends upon several environmental variables influencing their behavior.
Literature. Many publications demonstrate that rodents are mostly seed predators for many species. Nevertheless, because it is hard to define their pattern of movement, the role of rodents in forest regeneration could be underestimated. Through scatter-hoarding, rodents may play a crucial role, particularly in those forests where anthropogenic pressures have led to a reduction in the density of large mammals. However, very few studies have been conducted in African moist forests where defaunation can be high, and the role of rodents has been very poorly studied.
Conclusions. To understand the phenomenon, we recommend the further investigation of the interactions between seeds and rodents by employing methods that have been commonly used on other continents.
Tabla de contenidos
1. Introduction
1La dispersion des diaspores, définie comme étant le mouvement de la graine depuis sa plante mère (Beckman & Rogers, 2013), constitue une interaction clé qui influence indirectement de nombreux processus écologiques tels que le recrutement des plantes et leur démographie, l’assemblage des communautés et, in fine, leur diversité spécifique (Steele et al., 2011).
2Les patrons de dispersion des espèces végétales sont fortement influencés par l’identité des vecteurs de dispersion. Entre 70 et 90 % des espèces végétales du globe font l’objet d’une dispersion primaire par les animaux (zoochorie) (Kitamura, 2011 ; Beaune et al., 2013 ; Beckman & Rogers, 2013). Toutefois, certaines espèces animales agissent tant comme disperseurs que comme prédateurs (Steele et al., 2011).
3Qu’ils soient inféodés à une seule espèce (Liu et al., 2012) ou à une communauté végétale étroitement liée du point de vue évolutif (Novotny et al., 2002 ; Gilbert & Webb, 2007), les prédateurs s’attaquent préférentiellement aux zones à fortes densités de diaspores ou de semis, lesquelles sont situées à proximité du pied producteur (Janzen, 1971). En conséquence, les chances de survie et de développement des diaspores sont généralement considérées comme optimales à une certaine distance du pied producteur (Schupp & Jordano, 2011). Toutefois, les patrons d’établissement des semis sont extrêmement variables. Dans tous les cas, la quantité de diaspores dispersées diminue avec la distance mais la variation du taux de survie diffère selon les espèces. En effet, si Janzen (1971) et Connell (1971) considèrent qu’il augmente avec la distance au semencier, d’autres (par exemple Takeuchi & Nakashizuka, 2007) ont démontré qu’il diminuait suite à la satiété du prédateur dans les zones où la nourriture est abondante (voir aussi Forget, 1993). Il en résulte des types de recrutement qualitativement différents permettant la coexistence d’espèces végétales différentes et le maintien de la richesse spécifique (Schupp & Jordano, 2011).
4Le rôle des rongeurs dans les processus de prédation et de dispersion est relativement peu documenté. En effet, la plupart des études de dispersion des diaspores se concentrent sur la dispersion primaire et ne prennent pas en compte la dispersion secondaire dont les rongeurs sont des vecteurs potentiels (Hirsch et al., 2012a). En définitive, les rongeurs pourraient jouer un rôle nettement plus important dans la dynamique des espèces végétales que ce qui est couramment admis (Hirsch et al., 2012b). Ce rôle pourrait même s’avérer crucial dans les écosystèmes affectés par une chasse et un braconnage excessifs (Haurez et al., 2013). En effet, en se concentrant sur les mammifères de grande taille, les rongeurs peuvent modifier durablement la composition des communautés animales et favoriser le développement des communautés de rongeurs (Malcolm & Ray, 2000).
5Le présent article propose une synthèse sur le comportement alimentaire des rongeurs en forêt. La recherche bibliographique a été réalisée en consultant les bases de données Scopus, Google Scholar, ORBI. La combinaison des mots-clés suivants a été utilisée en français et en anglais : scatter-hoarding, rongeur, forêt, larder-hoarding, competition release, cache, pilferage, stockage de nourriture, comportement alimentaire, dispersion, prédation.
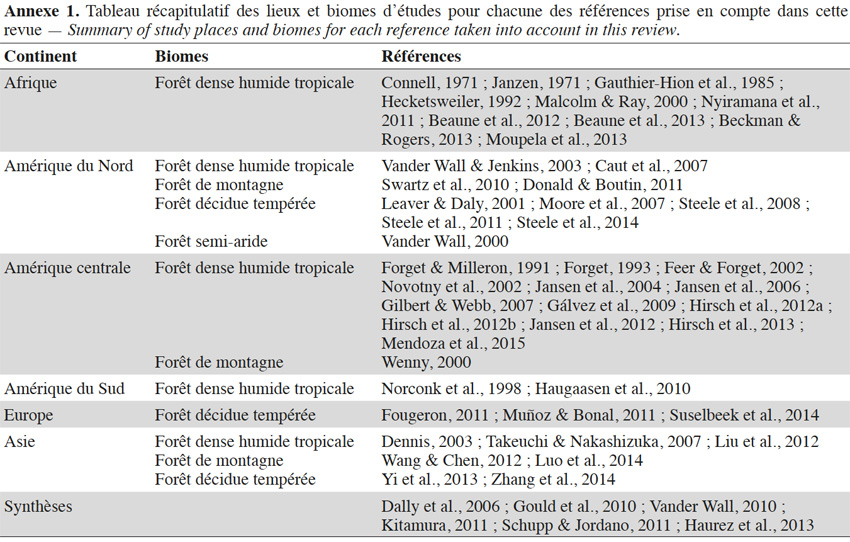
2. Répartition géographique des études
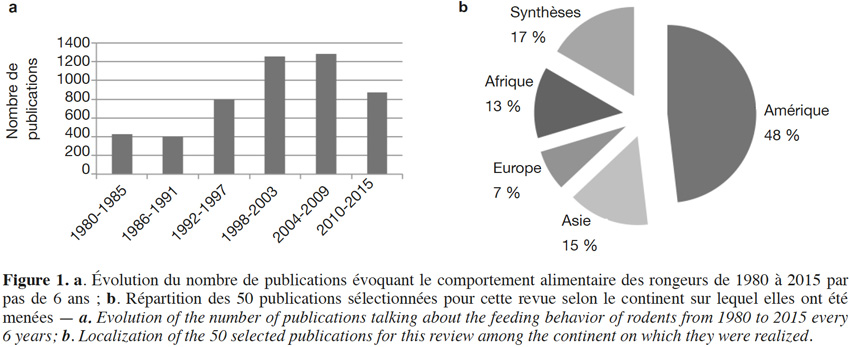
6Au cours des dernières années, de plus en plus d’études ont été menées sur le comportement alimentaire des rongeurs et leur impact sur les écosystèmes forestiers du globe (Figure 1a). La combinaison de mots-clés a permis d’identifier plus de 4 800 publications. Après une première sélection sur base des titres puis une seconde lecture sur base du résumé des articles restants, 74 publications ont été d’abord retenues car elles étaient les seules à avoir mis en avant de nouveaux résultats fondés sur des données relatives aux comportements des rongeurs. Parmi ces 74 publications, 24 ont finalement été rejetées soit parce qu’elles ne faisaient que citer les processus de collecte alimentaire des rongeurs sur base des conclusions d’autres publications prises en compte dans la présente revue, soit en raison de leur moindre pertinence par rapport à d’autres références prises en compte. Les 52 publications sélectionnées concernent principalement l’Amérique (Figure 1b ; Annexe 1).
3. La sélection des diaspores par les rongeurs
7Plusieurs caractéristiques influencent la sélection et le transport des diaspores par les rongeurs : les molécules volatiles, les caractéristiques anatomiques, la valeur nutritive.
8Les molécules volatiles émises par les fruits ou par les diaspores attirent les rongeurs parfois sur des distances considérables (Fougeron, 2011). Certains, comme le rat d’Emin (Cricetomys emini) et le porc-épic (Atherurus africanus), sont également attirés par les odeurs fécales et donc par les diaspores ayant déjà fait l'objet d'une dispersion primaire par d'autres espèces (Beaune et al., 2012).
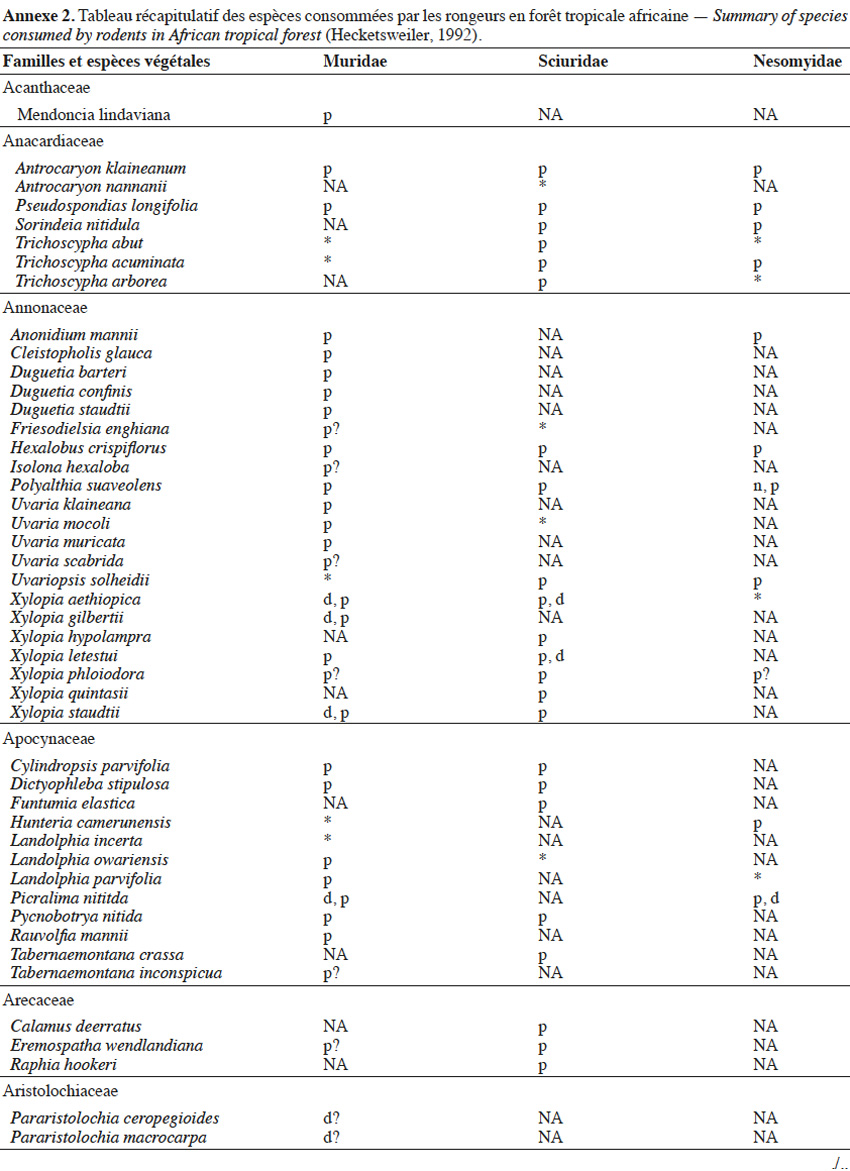
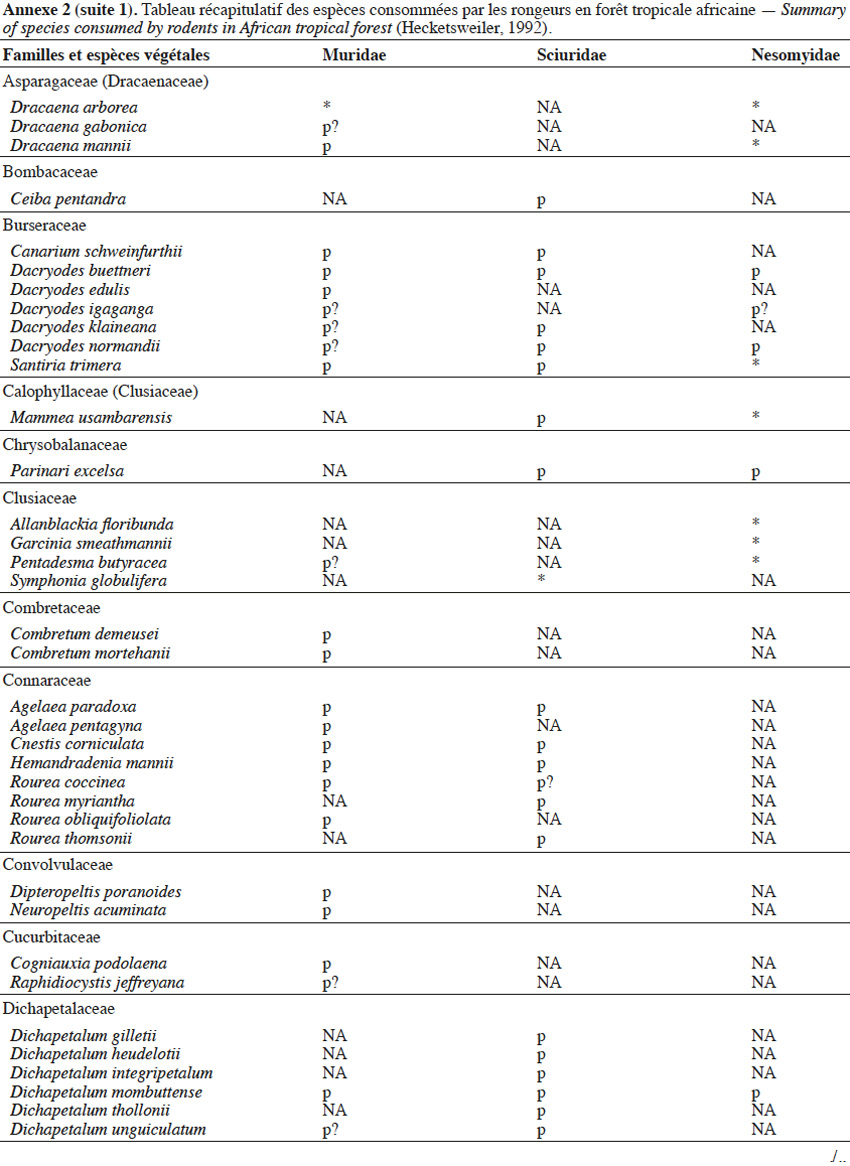
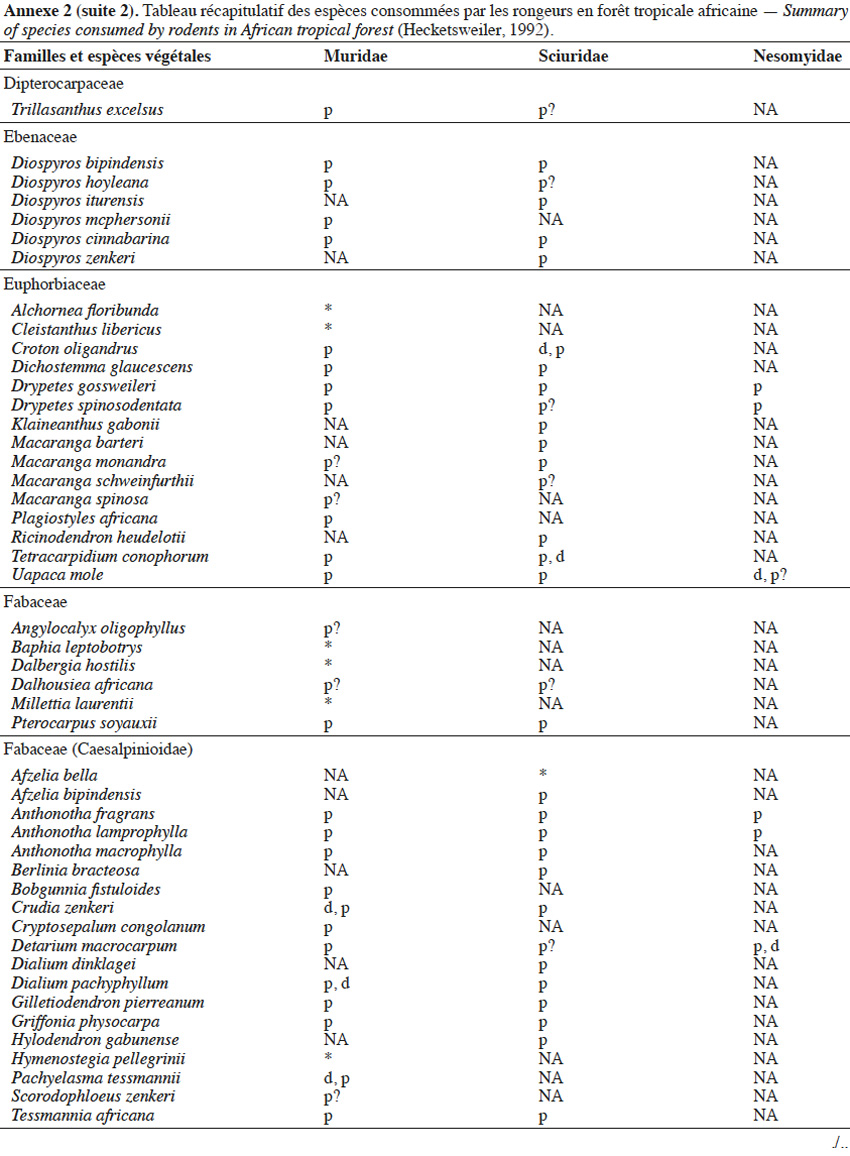
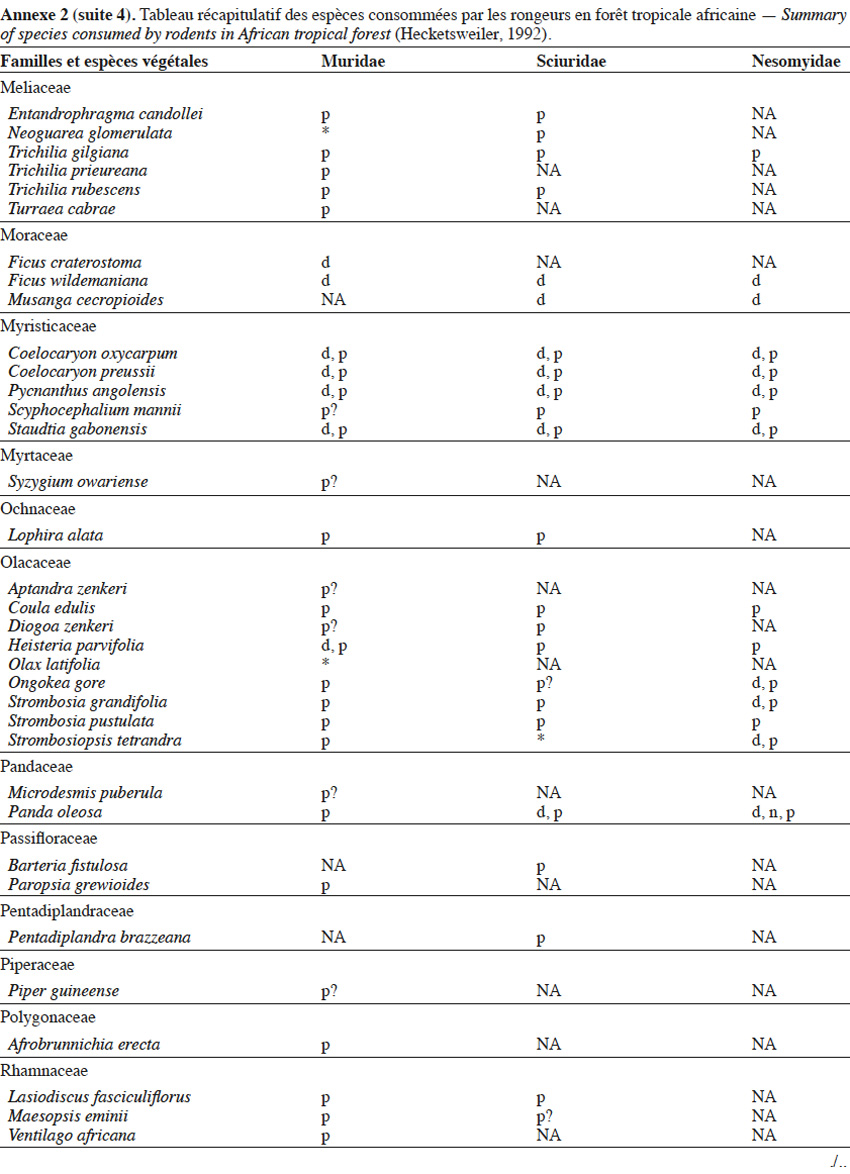
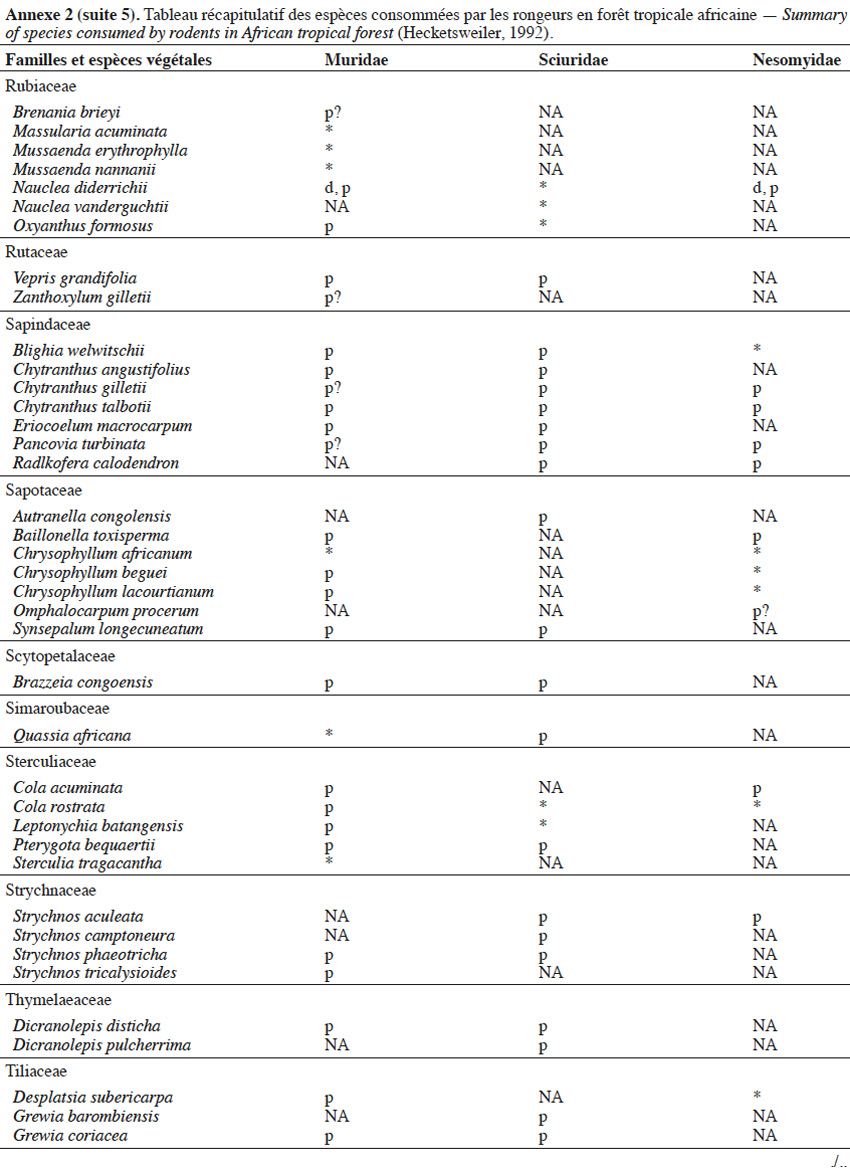
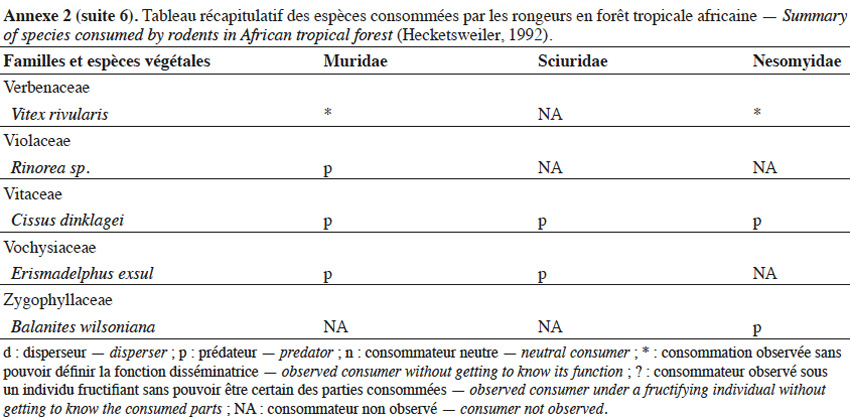
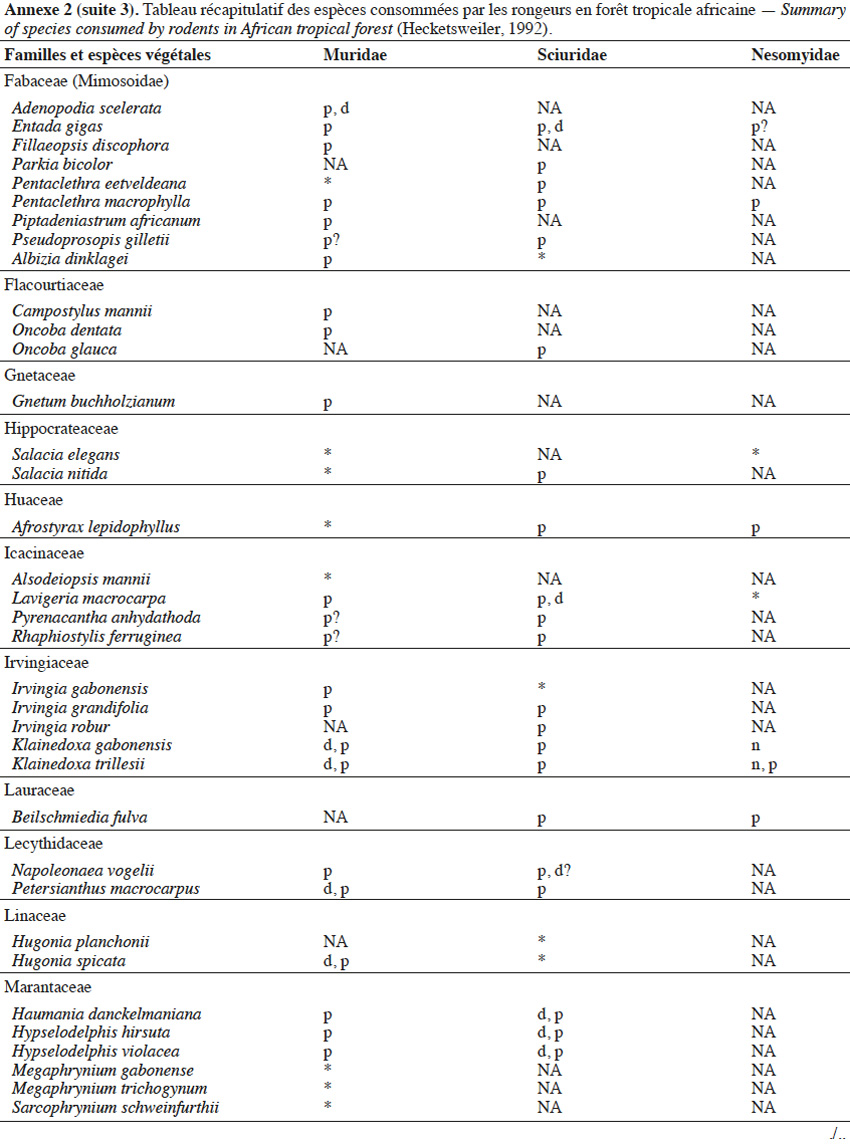
9Les caractéristiques anatomiques ont une influence variable selon les taxons considérés. Les petits rongeurs de la famille des Muridae ne semblent pas sélectionner les diaspores sur base de leurs caractéristiques (Leaver & Daly, 2001). Ils collectent tous les types de diaspores et les stockent dans de nombreux « garde-manger » protégés et situés sous la couronne des arbres producteurs. En général, la majorité de ces diaspores est détruite car elle est consommée (Leaver & Daly, 2001). Les écureuils de la famille des Sciuridae choisissent des fruits fibreux contenant une à deux diaspores et stockent ceux-ci dans des greniers centraux vigoureusement défendus (Luo et al., 2014). Enfin, les rongeurs de grande taille, comme le rat d’Emin, de la famille des Nesomyidae, sont bien plus sélectifs. Ils préfèrent les grands fruits fibreux contenant une ou deux diaspores riches en nutriments (Gauthier-Hion et al., 1985 ; Wenny, 2000 ; Nyiramana et al., 2011). Ils ramassent celles-ci soit tombées directement sous l’arbre mère, soit déplacées préalablement par d’autres animaux et parfois prélevées dans leurs excréments (Nyiramana et al., 2011). Ils les dissimulent dans de nombreuses caches contenant une seule et unique graine enfoncée dans le sol et recouverte de litière. Ils peuvent les déplacer sur une distance atteignant 70 m (Dennis, 2003). Sur base des connaissances actuelles, on peut considérer qu’en zone tropicale les rongeurs de la famille des Muridae consommeraient les diaspores de 196 espèces végétales appartenant à 54 familles. Les écureuils de la famille des Sciuridae consommeraient les diaspores de 157 espèces de 48 familles. Enfin, les rongeurs de grande taille mangeraient 74 espèces appartenant à 29 familles (Annexe 2). Les rongeurs exerceraient donc un rôle très important dans la dynamique des milieux naturels.
10La forte musculature de la mâchoire et les dents des rongeurs leur permettent de briser les structures anatomiques coriaces protégeant les diaspores, pour autant que la récompense nutritive compense l’effort accompli. Celle-ci dépend notamment de leur teneur en tannins, en lipides et en protéines (Wang & Chen, 2012). La concentration en tannins d’une graine augmente avec le temps et a un effet répulsif au-delà d’un certain seuil. Toutefois, une concentration élevée en lipides et en protéines peut atténuer cet effet répulsif (Wang & Chen, 2012).
4. Les stratégies de stockage des diaspores
11Le rôle écologique joué par les rongeurs est lié à la variabilité temporelle et spatiale de la disponibilité alimentaire (Jansen et al., 2004 ; Moore et al., 2007 ; Gálvez et al., 2009). Celle-ci affecte tant les taux saisonniers de dissimulation que l’espacement des caches de stockage (Gálvez et al., 2009 ; Haugaasen et al., 2010).
12Le phénomène de « mass-fruiting », ou fructification massive, est défini comme la production synchronisée et en grande quantité de fruits par une espèce ligneuse à des intervalles supra-annuels (Mendoza et al., 2015). Un tel phénomène peut non seulement provoquer la satiété des prédateurs, mais aussi augmenter la quantité totale de diaspores qui est stockée et, donc, le nombre de diaspores dispersées (Feer & Forget, 2002 ; Vander Wall, 2010). En revanche, le faible nombre de caches décelées lors des périodes de disette reflète le besoin des rongeurs de s'appuyer sur ces ressources pour garantir une nourriture suffisante (Haugaasen et al., 2010 ; Hirsch et al., 2013).
13Deux grandes catégories de stratégies de stockage de nourriture ont été observées. La première, qualifiée de « larder-hoarding », consiste à entreposer l’ensemble des diaspores collectées dans un unique grenier central. La seconde, appelée « scatter-hoarding », vise à répartir ces réserves dans de petites caches largement dispersées (Gauthier-Hion et al., 1985 ; Dennis, 2003 ; Gould et al., 2010 ; Luo et al., 2014). Pour qu'une stratégie de collecte de nourriture soit adoptée, ses bénéfices énergétiques doivent dépasser les couts de collecte et de manipulation (Norconk et al., 1998 ; Steele et al., 2011 ; Luo et al., 2014). La quantité de nourriture stockée doit donc être suffisante pour assurer la survie et la reproduction (Steele et al., 2011 ; Luo et al., 2014). En outre, le positionnement des caches doit minimiser les risques de pillage (Gould et al., 2010).
5. Pillage des ressources et stratégies associées
14Le pillage des caches par des compétiteurs est un facteur déterminant du comportement alimentaire (Steele et al., 2008 ; Suselbeek et al., 2014). En effet, si le sens de l'odorat développé des rongeurs leur permet de retrouver leurs propres caches, il facilite aussi la détection et, par conséquent, le pillage de caches appartenant à d’autres individus (Vander Wall, 2000 ; Muñoz & Bonal, 2011). Le taux de chapardage dépend de la densité et de la structure démographique des populations conspécifiques (Muñoz & Bonal, 2011). Par exemple, les jeunes écureuils, possédant de plus petits greniers, sont davantage susceptibles de piller d'autres caches (Donald & Boutin, 2011).
15Plusieurs stratégies permettent de combattre le vol (Gálvez et al., 2009). Si la défense est aisée lorsque la cache est unique (Dally et al., 2006), elle n'est pas possible pour les rongeurs qui pratiquent le « scatter-hoarding », car ils ne sont pas capables de garder efficacement les multiples caches (Vander Wall & Jenkins, 2003).
16Le choix des lieux d’établissement des caches intervient alors de façon déterminante dans la protection contre le vol (Muñoz & Bonal, 2011). En privilégiant le stockage dans des zones moins fréquentées et/ou dotées d'une faible densité en végétaux conspécifiques, les probabilités de détection et de pillage sont réduites (Swartz et al., 2010 ; Muñoz & Bonal, 2011 ; Hirsch et al., 2012b ; Steele et al., 2014). Ainsi, les milieux ouverts sont généralement mieux protégés contre le pillage (Muñoz & Bonal, 2011 ; Steele et al., 2011).
17Durant la saison de faible disponibilité alimentaire, les diaspores, plus rares, peuvent être emmenées plus loin de leur plante mère et stockées dans des caches encore plus diffuses spatialement. Elles sont alors moins susceptibles d'être retrouvées par des compétiteurs malgré un accroissement des évènements de pillage lors de cette période (Haugaasen et al., 2010). Certains rongeurs procèdent en plusieurs étapes. Dans un premier temps, ils prélèvent et dissimulent rapidement les diaspores à proximité de leur source pour maximiser leur taux de récolte. Ils recachent ensuite plusieurs fois ces diaspores dans des endroits de plus en plus éloignés de la source, à des densités de plus en plus faibles (Zhang et al., 2014). Cette relocalisation semble être un phénomène généralisé pour les espèces qui pratiquent le « scatter-hoarding » en condition de pillage important (Hirsch et al., 2012b). Ce phénomène est favorable au processus de dispersion des espèces végétales puisque la probabilité de survie des diaspores augmente avec le risque de ne pas retrouver une cache et la distance à l’arbre mère (effet Janzen – Connell ; Janzen, 1971 ; Connell, 1971). Toutefois, la probabilité de retrouver une cache peut être améliorée grâce à des visites régulières qui entretiennent la mémoire spatiale des rongeurs (Hirsch et al., 2013). En conséquence, il est fréquent que les caches soient placées dans des endroits régulièrement fréquentés par leur propriétaire, notamment le long des pistes utilisées pour patrouiller au sein du territoire (Hirsch et al., 2013). Des points de repère par rapport à la végétation peuvent également aider à la relocalisation des caches (Gould et al., 2010).
18Une autre adaptation comportementale au pillage est la « déception comportementale ». Certaines espèces d'écureuils conçoivent des caches vides au sein de sites potentiels pour décourager les voleurs. Ces caches sont en réalité des terriers vides recouverts de végétation à la manière d’un terrier classique (Steele et al., 2008).
19Synthétisant l’ensemble de ces processus, Jansen et al. (2012) considèrent que les communautés de rongeurs voleurs peuvent finalement mener à une dispersion des diaspores sur de longues distances, comparables à celle des autres vertébrés considérés comme de bons disperseurs. De ce fait, étant moins impactés par l’accroissement de la pression de chasse au sein des massifs, les rongeurs pourraient se substituer aux grands mammifères dans la dispersion des diaspores et contribuer à la régénération des espèces végétales (Jansen et al., 2012).
6. Impact sur la survie des diaspores
20L’ensemble des comportements alimentaires, en affectant le sort des diaspores, impacte leur survie et, donc, la probabilité de recrutement des plantules qui en émergent (Muñoz & Bonal, 2011). En conséquence, la plasticité comportementale des rongeurs influence indirectement la dynamique des communautés végétales et leur diversité (Dennis, 2003).
21Bien que Nyiramana et al. (2011) aient observé une disparition totale de l’ensemble des diaspores dissimulées au bout d’un mois d’observation, d’autres résultats indiquent que certaines diaspores ne sont ni volées, ni récupérées par leur propriétaire (Muñoz & Bonal, 2011).
22En plus d’engendrer parfois des évènements de dispersion à relativement longue distance, les rongeurs peuvent être impliqués dans des processus de dispersion dirigée. Certains d’entre eux cachent les diaspores essentiellement au sein de milieux ouverts (Muñoz & Bonal, 2011 ; Steele et al., 2011), ce qui peut être favorable pour le développement des espèces héliophiles. Par exemple, l'écureuil de Corée (Tamias sibiricus) cache ses diaspores au sein de milieux caractérisés par des sols plus humides, favorables à la germination et à l’établissement de certaines espèces (Yi et al., 2013). Le recrutement des plantules et leur survie peut en conséquence considérablement augmenter. Ainsi, Jansen et al. (2006) ont mis en évidence un accroissement de 77 % de la survie des diaspores enfouies dans des sols humides par rapport à d’autres diaspores non enterrées. En outre, ces diaspores auront plus de chances d’échapper à la prédation (Forget & Milleron, 1991).
23Le taux de récupération de la nourriture par son propriétaire n'est pas stable au cours du temps et décline une fois que la cache est âgée d'environ deux jours (Steele et al., 2011). En général, seules les diaspores les plus solides, consommées en dernier lieu et donc restant cachées le plus longtemps, restent intactes assez longtemps pour atteindre leur germination.
24Enfin, les diaspores de petite taille (3-4 mm) sont susceptibles d'échapper à la mastication des disperseurs primaires et secondaires. Elles sont alors ingérées intactes dans le bol alimentaire et sont dispersées efficacement à longue distance (Norconk et al., 1998).
25L’initiation de la germination ne signifie toutefois pas toujours que la plantule a échappé à la prédation par le rongeur. Certains rongeurs interrompent le processus de germination en sectionnant la radicule et l'épicotyle au moment de leur germination. Les cotylédons peuvent alors parfois rester physiologiquement actifs en tant que « diaspores zombies » formées uniquement de formation cicatricielle indifférenciée (Jansen et al., 2006 ; Moupela et al., 2013).
7. Conclusions
26La disponibilité spatiale et temporelle des diaspores influence fortement le comportement des rongeurs. Les stratégies de consommation et de stockage des ressources alimentaires varient en fonction de l’espèce de rongeur considérée, des sites d’étude et de la composition de la communauté animale (Feer & Forget, 2002 ; Caut et al., 2007). Les comportements alimentaires des rongeurs peuvent mener à un meilleur taux de survie des diaspores non retrouvées en :
27– les protégeant des autres prédateurs et des agents pathogènes,
28– sélectionnant les diaspores les plus viables,
29– les éloignant les unes des autres.
30Il peut en conséquence en résulter un taux de germination plus élevé que celui issu des diaspores n'ayant pas été dissimulées (Norconk et al., 1998 ; Feer & Forget, 2002 ; Steele et al., 2011 ; Hirsch et al., 2012a ; Hirsch et al., 2012b).
31Les conclusions se fondent sur des études décrivant le comportement alimentaire des rongeurs et leur impact sur les communautés végétales qui ont été majoritairement réalisées sur le continent américain. Malheureusement, le rôle des rongeurs en forêt dense humide africaine a été peu étudié (Annexe 1). Semblant constituer la classe animale la moins affectée par l’activité humaine (Beaune et al., 2013), il est d’autant plus important d’étudier leur rôle dans un contexte de défaunation et de raréfaction des grands mammifères. L’ensemble des procédés et matériels de recherche ayant fait leurs preuves en Amérique pourrait dès lors être utilisé dans ce but. Il serait en conséquence particulièrement intéressant d’étudier :
32– le traitement appliqué par les rongeurs sur les diaspores, notamment par la méthode de télémétrie (voir Hirsch et al., 2012a) ;
33– le lien qui existe entre l’importance de la fructification et le taux de dissimulation des diaspores par les rongeurs en comparant différentes années à intensités de fructification contrastées ;
34– le rôle spécifique exercé par les rongeurs sur les espèces végétales d’intérêt socio-économique.
35Remerciements
36Les auteurs remercient l’ULg et plus particulièrement le centre de recherche TERRA de la faculté de Gembloux Agro-Bio Tech pour la bourse de doctorat accordée à Quentin Evrard. L’étude a également bénéficié de l’appui du projet « Aide à l’application des normes FSC sur la régénération et la diversité génétique des essences du bassin du Congo » financé par le PPECF. Enfin, les auteurs remercient l’ASBL Nature+ et la société forestière Pallisco.
Bibliographie
Beaune D., Bollache L., Bretagnolle F. & Fruth B., 2012. Dung beetles are critical in preventing post-dispersal seed removal by rodents in Congo rain forest. J. Trop. Ecol., 28, 507-510.
Beaune D. et al., 2013. Seed dispersal strategies and the threat of defaunation in a Congo forest. Biodivers. Conserv., 22, 225-238.
Beckman N.G. & Rogers H.S., 2013. Consequences of seed dispersal for plant recruitment in tropical forests: interactions within the seedscape. Biotropica, 45, 666-681.
Caut S. et al., 2007. Rats dying for mice: modelling the competitor release effect. Austral Ecol., 32, 858-868.
Connell J.H., 1971. On the role of natural enemies in preventing competitive exclusion in some marine animals and in forest trees. In: Den Boer P.J. & Gradwell G.R., eds. Dynamics of populations. Wageningen, The Netherlands: Centre for Agricultural Publishing and Documentations, 298-312.
Dally J.M., Clayton N.S. & Emery N.J., 2006. The behaviour and evolution of cache protection and pilferage. Anim. Behav., 72, 13-23.
Dennis A.J., 2003. Scatter-hoarding by musky rat-kangaroos, Hypsiprymnodon moschatus, a tropical rain-forest marsupial from Australia: implications for seed dispersal. J. Trop. Ecol., 19, 619-627.
Donald J.L. & Boutin S., 2011. Intraspecific cache pilferage by larder-hoarding red squirrels (Tamiasciurus hudsonicus). J. Mammalogy, 92, 1013-1020.
Feer F. & Forget P.-M., 2002. Spatio-temporal variations in post-dispersal seed fate. Biotropica, 34, 555-566.
Forget P.-M., 1993. Post-dispersal predation and scatterhoarding of Dipteryx panamensis (Papilionaceae) seeds by rodents in Panama. Oecologica, 94, 255-261.
Forget P.-M. & Milleron T., 1991. Evidence for secondary seed dispersal by rodents in Panama. Oecologica, 87, 596-599.
Fougeron A.-S., 2011. Réponses comportementales et préférences envers les acides gras à longue chaîne chez Drosophila melanogaster. Thèse de doctorat : Université de Bourgogne, Dijon (France).
Gálvez D., Kranstauber B., Kays R.W. & Jansen P.A., 2009. Scatter-hoarding by the Central American agouti: a test of optimal cache spacing theory. Anim. Behav., 78, 1327-1333.
Gautier-Hion A. et al., 1985. Fruit characters as a basis of fruit choice and seed dispersal in a tropical forest vertebrate community. Oecologia, 65, 324-337.
Gilbert G.S. & Webb C.O., 2007. Phylogenetic signal in plant pathogen-host range. Proc. Natl. Acad. Sci. U.S.A., 104, 4979-4983.
Gould K.L., Kelly D.M. & Kamil A.C., 2010. What scatter-hoarding animals have taught us about small-scale navigation. Philos. Trans. R. Soc. London, Ser. B, 365, 901-914.
Haugaasen J.M.T. et al., 2010. Seed dispersal of the Brazil nut tree (Bertholletia excelsa) by scatter-hoarding rodents in a central Amazonian forest. J. Trop. Ecol., 26, 251-262.
Haurez B., Pètre C.-A. & Doucet J.-L., 2013. Impacts of logging and hunting on western lowland gorilla (Gorilla gorilla gorilla) populations and consequences for forest regeneration. A review. Biotechnol. Agron. Soc. Environ., 17, 364-372.
Hecketsweiler P., 1992. Phénologie et saisonnalité en forêt gabonaise. L'exemple de quelques espèces ligneuses. Thèse de doctorat : Université de Montpellier II Sciences et Techniques du Languedoc, Montpellier (France).
Hirsch B.T., Kays R. & Jansen P.A., 2012a. A telemetric thread tag for tracking seed dispersal by scatter-hoarding rodents. Plant Ecol., 213, 933-943.
Hirsch B.T., Kays R., Pereira V.E. & Jansen P.A., 2012b. Directed seed dispersal towards areas with low conspecific tree density by a scatter-hoarding rodent. Ecol. Lett., 15, 1423-1429.
Hirsch B., Kays R. & Jansen P., 2013. Evidence for cache surveillance by a scatter-hoarding rodent. Anim. Behav., 85, 1511-1516.
Jansen P.A., Bongers F. & Hemerik L., 2004. Seed mass and mast seeding enhance dispersal by a neotropical scatter-hoarding rodent. Ecol. Monogr., 74, 569-589.
Jansen P.A., Bongers F. & Prins H. H.T., 2006. Tropical rodents change rapidly germinating seeds into long-term food supplies. Oikos, 113, 449-458.
Jansen P.A. et al., 2012. Thieving rodents as substitute dispersers of megafaunal seeds. Proc. Natl. Acad. Sci. U.S.A., 109, 12610-12615.
Janzen D.H., 1971. Seed predation by animals. Annu. Rev. Ecol. Syst., 2, 465-492.
Kitamura S., 2011. Frugivory and seed dispersal by hornbills (Bucerotidae) in tropical forests. Acta Oecologica, 37, 531-541.
Leaver L.A. & Daly M., 2001. Food caching and differential cache pilferage: a field study of coexistence of sympatric kangaroo rats and pocket mice. Oecologia, 128, 577-584.
Liu X. et al., 2012. Experimental evidence for a phylogenetic Janzen-Connell effect in a subtropical forest. Ecol. Lett., 15, 111-118.
Luo Y. et al., 2014. Hoarding without reward: rodent responses to repeated episodes of complete cache loss. Behav. Processes, 106, 36-43.
Malcolm J.R. & Ray J.C., 2000. Influence of timber extraction routes on central African small-mammal communities, forest structure, and tree diversity. Conserv. Biol., 14, 1623-1638.
Mendoza I. et al., 2015. Does masting result in frugivore satiation? A test with Manilkara trees in French Guiana. J. Trop. Ecol., 31(6), 553-556.
Moore J.E. et al., 2007. Determinants of seed removal distance by scatter-hoarding rodents in deciduous forests. Ecology, 88, 2529-2540.
Moupela C. et al., 2013. Dispersal and predation of diaspores of Coula edulis Baill. in an evergreen forest of Gabon. Afr. J. Ecol., 99, 88-96.
Muñoz A. & Bonal R., 2011. Linking seed dispersal to cache protection strategies. J. Ecol., 99, 1016-1025.
Norconk M.A., Grafton B.W. & Conklin-Brittain N.L., 1998. Seed dispersal by neotropical seed predators. Am. J. Primatology, 45, 103-126.
Novotny V. et al., 2002. Low host specificity of herbivorous insects in a tropical forest. Nature, 416, 841-844.
Nyiramana A., Mendoza I., Kaplin B.A. & Forget P.-M., 2011. Evidence for seed dispersal by rodents in tropical montane forest in Africa. Biotropica, 43, 654-657.
Schupp E.W. & Jordano P., 2011. The full path of Janzen-Connell effects: genetic tracking of seeds to adult plant recruitment. Mol. Ecol., 20, 3953-3955.
Steele M.A. et al., 2008. Cache protection strategies of a scatter-hoarding rodent: do tree squirrels engage in behavioural deception? Anim. Behav., 75, 705-714.
Steele M.A. et al., 2011. Cache placement, pilfering, and a recovery advantage in a seed-dispersing rodent: could predation of scatter hoarders contribute to seedling establishment? Acta Oecologica, 37, 554-560.
Steele M.A. et al., 2014. Do scatter hoarders trade off increased predation risks for lower rates of cache pilferage? Behav. Ecol., 25(1), 206-215.
Suselbeek L. et al., 2014. Scatter hoarding and cache pilferage by superior competitors: an experiment with wild boar, Sus scrofa. Anim. Behav., 96, 107-115.
Swartz M.J., Jenkins S.H. & Dochtermann N.A., 2010. Coexisting desert rodents differ in selection of microhabitats for cache placement and pilferage. J. Mammalogy, 91, 1261-1268.
Takeuchi Y. & Nakashizuka T., 2007. Effect of distance and density on seed/seedling fate of two dipterocarp species. For. Ecol. Manage., 247, 167-174.
Vander Wall S.B., 2000. The influence of environmental conditions on cache recovery and cache pilferage by yellow pine chipmunks (Tamias amoenus) and deer mice (Peromyscus maniculatus). Behav. Ecol., 11, 544-549.
Vander Wall S.B., 2010. How plants manipulate the scatter-hoarding behaviour of seed-dispersing animals. Philos. Trans. R. Soc. London, Ser. B., 365, 989-997.
Vander Wall S.B. & Jenkins S.H., 2003. Reciprocal pilferage and the evolution of food-hoarding behaviour. Behav. Ecol., 14, 656-667.
Wang B. & Chen J., 2012. Effects of fat and protein levels on foraging preferences of tannin in scatter-hoarding rodents. Plos One, 7, 1-10.
Wenny D.G., 2000. Seed dispersal, seed predation, and seedling recruitment of a neotropical montane tree. Ecol. Monogr., 70, 331-351.
Yi X. et al., 2013. Directed seed dispersal by a scatter-hoarding rodent: the effects of soil water content. Anim. Behav., 86, 851-857.
Zhang H. et al., 2014. Rapid sequestration and recaching by a scatter-hoarding rodent (Sciurotamias davidianus). J. Mammalogy, 95, 480-490.