- Home
- Volume 11 (2007)
- numéro 4
- Implication des peptides de fusion des glycoprotéines de fusion virales de classe I dans la fusion membranaire
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Implication des peptides de fusion des glycoprotéines de fusion virales de classe I dans la fusion membranaire

Editor's Notes
Reçu le 5 mars 2007, accepté le 5 juillet 2007
Résumé
L’infection virale, impliquant la fusion entre l’enveloppe virale et la membrane plasmique de la cellule cible, est induite par une glycoprotéine ancrée dans l’enveloppe virale. Après activation, la glycoprotéine subit un changement de conformation lui permettant d’exposer une région appelée « peptide de fusion » indispensable à l’induction de la fusion. L’étude des glycoprotéines ainsi que des peptides de fusion en l’absence du reste de la glycoprotéine a permis de mieux comprendre les mécanismes impliqués dans la fusion membranaire. Il a ainsi été montré que les peptides de fusion induisent la fusion et la perméabilisation de membranes. Ces peptides sont capables de s’insérer de manière oblique dans la membrane sous forme hélicoïdale. Cette orientation induirait la déstabilisation lipidique, favorisant la fusion membranaire. Toutefois, jusqu’à présent, aucune étude in vivo, in vitro ou in silico ne s’était intéressée à déterminer la séquence minimale impliquée dans la fusion membranaire. En utilisant la relation oblicité-fusogénicité, cette séquence a été déterminée par modélisation moléculaire pour deux virus, le Virus de l’Immunodéficience Humaine et le Virus de la Leucémie Bovine. Ces nouveaux résultats sont particulièrement intéressants pour le développement de vaccins et de molécules antivirales.
Abstract
The implication of fusion peptides of class I viral fusion glycoproteins in the membrane fusion. Viral infection involves fusion between the viral envelope and the target cell plasmic membrane. The fusion is induced by a glycoprotein anchored in the viral envelope. After activation, the glycoprotein undergoes a conformational change inducing the exposure of a region named « fusion peptide » essential for the fusion process. Studies on glycoproteins and on isolated fusion peptides have allowed to better understand the mechanisms involved in membrane fusion. It was notably shown that fusion peptides induce fusion and leakage of membranes. These peptides are able to insert obliquely in a membrane when helical. This orientation induces lipid destabilisation, favouring membrane fusion. However, to date, none of these in vitro, in vivo or in silico studies has determined the minimal sequence required for membrane fusion. Using the obliquity-fusogenicity relationship, the latter was determined by molecular modelling for two viruses, the Human Immunodeficiency Virus and the Bovine Leukaemia Virus. These new results are of particular interest in the development of vaccines and antiviral drugs.
Table of content
1. La fusion virale
1La fusion membranaire intervient dans de nombreux processus biologiques, comme le transport intracellulaire (Rothman, 1994), le développement musculaire (Towler et al., 2004), la neurotransmission (Gianinazzi et al., 2005 ; Jena, 2005), la fécondation (Longo, Yanagimachi, 1993) et l’infection virale (Hughson, 1995 ; Chizmadzhev, 2004).
1.1. Etapes de la fusion membranaire
2Qu’elle soit intracellulaire ou extracellulaire, la fusion est un processus qui implique le rapprochement de deux membranes, leur fusion et la formation d’un pore de fusion aqueux (Jahn, Sudhof, 1999) (Figure 1).

3Malgré le développement de techniques permettant de contrôler la fusion, les mécanismes moléculaires impliqués dans le processus de fusion ne sont toujours pas connus avec exactitude. Deux modèles contradictoires de la fusion membranaire ont été proposés : l’hypothèse du pore protéique (« proteinaceous » en anglais) et l’hypothèse du pore lipidique. Selon la première hypothèse, le pore de fusion initial consiste en un canal aqueux constitué de protéines connectées aux deux membranes (Almers, Tse, 1990 ; Lindau, Almers, 1995). Suite à son expansion, ce pore incorpore des lipides des membranes pour atteindre sa taille optimale (Jahn, Grubmüller, 2002). Cette hypothèse n’est cependant pas en accord avec les nombreuses études suggérant que la fusion membranaire implique une étape intermédiaire exclusivement lipidique (Chernomordik et al., 1993 ; 1995 ; Kemble et al., 1994 ; Chernomordik, Zimmerberg, 1995 ; Lee, Lentz, 1998 ; Melikyan et al., 2000 ; Gaudin, 2000 ; Russell et al., 2001 ; Xu et al., 2005 ; Reese et al., 2005 ; Giraudo et al., 2005 ; Dennison et al., 2006). Cette étape est prise en compte dans la deuxième hypothèse. La figure 1 détaille les différentes étapes du modèle du pore lipidique. Tout d’abord, pour que la fusion se réalise, il faut un rapprochement et une mise en contact des deux membranes à fusionner. Un apport énergétique est nécessaire pour contrecarrer la barrière énergétique constituée par la barrière d’eau existant entre les membranes. Dans le cas de la fusion induite par des virus enveloppés, cet apport est fourni par les glycoprotéines de fusion virales ancrées dans l’enveloppe virale. Le mode d’action de ces glycoprotéines sera expliqué plus en détail dans la suite de l’article. Lorsque les deux membranes sont en contact, la fusion des monocouches externes se réalise. Un intermédiaire lipidique, appelé « stalk » est alors formé. Le stalk est constitué des monocouches externes des deux membranes qui ont fusionné et des monocouches internes des deux membranes non fusionnées (Figure 1). Les monocouches externes fusionnées adoptent une courbure négative (Siegel, 1993 ; Chernomordik et al., 1995). Cet état stalk n’est que transitoire et évolue, par expansion radiale, en « diaphragme d’hémifusion » où les deux monocouches internes se mettent en contact (Figure 1) (Melikyan et al., 1995 ; Chernomordik et al., 1998 ; Gaudin, 2000). Que ce soit au niveau du stalk ou du diaphragme d’hémifusion, aucun transfert aqueux n’est possible puisque les monocouches internes n’ont pas fusionné. Tout comme le stalk, le diaphragme d’hémifusion n’est que transitoire et évolue en pore de fusion exclusivement lipidique suite à la fusion des monocouches internes (Jahn, Grubmüller, 2002). En plus d’être supporté par de nombreux résultats expérimentaux, le modèle du pore lipidique est également supporté par de nombreuses études théoriques et de modélisation moléculaire (Kuzmin et al., 2001 ; Noguchi, Tasaku, 2002 ; Kozlovsky et al., 2002 ; 2004 ; Koslovsky, Kozlov, 2002 ; Katsov et al., 2004 ; Marrink, Mark, 2004 ; Smeijers et al., 2006). Récemment, la structure stalk a été observée après déshydratation de bicouches lipidiques, ce qui renforce également la deuxième hypothèse (Yang, Huang, 2002). Toutefois, à l’heure actuelle, ni la structure « stalk », ni un canal de protéines n’ont été observés lors de la fusion in vivo (Lentz, 2006).
1.2. Les glycoprotéines de fusion virales : des protéines indispensables à la fusion virale
4La fusion membranaire ne se réalise pas spontanément et nécessite la présence de catalyseurs (Basanez, 2002). Dans le cas de l’infection virale, ces catalyseurs sont des glycoprotéines localisées à la surface de l’enveloppe des virus. Lorsque ces protéines sont inhibées par des anticorps (Cleveland et al., 2000 ; Zhang, Chen, 2003 ; Heap et al., 2005) ou mutées (Gething et al., 1986 ; Kowalski et al., 1987 ; Bosch et al., 1989 ; Freed et al., 1990 ; Vonèche et al., 1992 ; Buchschacher et al., 1995 ; Schaal et al., 1995 ; Fredericksen, Whitt, 1995 ; Steinhauer et al., 1995 ; Delahunty et al., 1996 ; Durell et al., 1997 ; Zhu et al., 1998 ; Pritsker et al., 1999 ; Rothenberg et al., 2001 ; Russell et al., 2004), la fusion virale est diminuée ou n’est plus observée.
5L’analyse par rayons X ou par RMN de parties solubles de glycoprotéines virales montre deux classes structurales différentes (Figure 2). Les glycoprotéines de classe II sont constituées de 3 domaines principalement repliés en feuillets bêta, « couchés » sur l’enveloppe virale (Figure 2A) (Kielian, 2006). Cette classe contient les protéines de fusion de deux membres des familles Togaviridae et Flaviviridae : les alphavirus et les flavivirus (Rey et al., 1995 ; Gibbons et al., 2004 ; Kielian, 2006). Des études récentes suggèrent que d’autres membres des Togaviridae et Flaviviridae ainsi que certains membres des Bunyaviridae expriment également des protéines de fusion de classe II (Yagnik et al., 2000 ; Garry, Dash, 2003 ; Garry, Garry, 2004 ; Plassmeyer et al., 2005). Malgré des similitudes avec les protéines de classe II concernant leurs mécanismes d’action (Söllner, 2004 ; Schibli, Weissenhorn, 2004 ; Zaitseva et al., 2005), les protéines virales de classe I adoptent une structure complètement différente. Elles sont majoritairement hélicoïdales et forment une projection d’une hauteur de 135 Å (contre 30 Å pour les glycoprotéines de classe II ; Figure 2B) (Skehel, Wiley, 2000 ; Harrison, 2005). Ces glycoprotéines sont exprimées par les familles virales Orthomyxoviridae, Paramyxoviridae, Filoviridae, Coronaviridae et Retroviridae, dont font partie les virus de l’Immunodéficience Humaine de type 1 (VIH-1) et de la Leucémie Bovine (BLV) (Caffrey et al., 1998 ; Weissenhorn et al., 1998 ; Malashkevich et al., 1999 ; Kobe et al., 1999 ; Bosch et al., 2003 ; Schibli, Weissenhorn, 2004). Les analyses cristallographiques et RMN indiquent également que ces protéines sont assemblées sous forme d’homotrimères formant un triple faisceau d’hélices (« coiled-coil » en anglais) (Figure 2B). Récemment, il a été suggéré que d’autres classes de glycoprotéines virales existent (Da Poian et al., 2005 ; Roche et al., 2007).
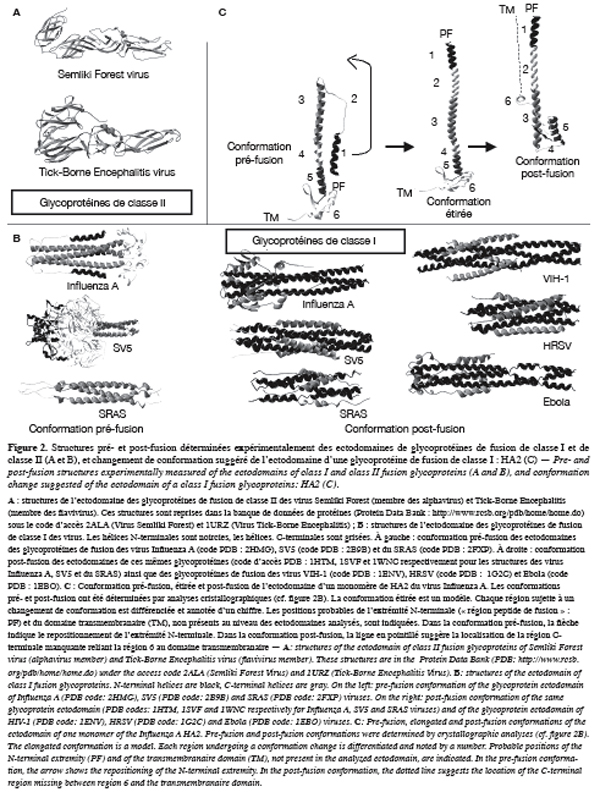
1.3. Mécanismes d’action des glycoprotéines virales de classe I
6Alors que peu de choses sont connues concernant le mode d’action des glycoprotéines de classe II, la compréhension du mode d’action des glycoprotéines de classe I lors de la fusion a progressé suite à l’analyse des glycoprotéines du virus Influenza A, du virus du syndrome respiratoire aigu sévère (SRAS) et du virus para-influenza simien 5 (SV5) (Wilson et al., 1981 ; Carr, Kim, 1993 ; Bullough et al., 1994 ; Baker et al., 1999 ; Ingallinella et al., 2004 ; Supekar et al., 2004 ; Yin et al., 2006 ; Hakansson-McReynolds et al., 2006). Pour ces trois glycoprotéines, deux structures différentes ont été mesurées par analyse R-X ou RMN (Figure 2B). Ces deux structures correspondent à la conformation pré-fusion (avant fusion) et post-fusion (après fusion) des glycoprotéines (Wilson et al., 1981 ; Carr, Kim, 1993 ; Bullough et al., 1994 ; Baker et al., 1999 ; Supekar et al., 2004 ; Yin et al., 2006 ; Hakansson-McReynolds et al., 2006). Sous conformation pré-fusion, les hélices C-terminales des trois monomères (en gris dans la figure 2B) interagissent ensemble pour former un trimère d’hélices. Ce trimère d’hélices C-terminales peut être entouré par les hélices N-terminales (en noir dans la figure 2B), comme dans le cas de la sous-unité membranaire de l’hémagglutinine (HA2) du virus Influenza A. Par contre, sous conformation post-fusion, ce sont les hélices N-terminales qui interagissent ensemble et sont entourées par les hélices C-terminales (Figure 2B). Cette différence structurale frappante entre les deux états révèle que les glycoprotéines de classe I subissent un changement de conformation lors de la fusion virale (Carr, Kim, 1993 ; Schibli, Weissenhorn, 2004). Pour HA2, il a été déterminé que la structure post-fusion est plus stable d’un point de vue thermodynamique que la structure pré-fusion (Carr et al., 1997). L’énergie libre libérée lors du changement de conformation induirait la fusion membranaire (Carr et al., 1997).
7Les glycoprotéines de fusion de nombreux autres virus, dont le VIH-1, ont également été analysées par R-X ou RMN (Fass et al., 1996 ; Chan et al., 1997 ; Weissenhorn et al., 1997 ; 1998 ; Caffrey et al., 1998 ; Kobe et al., 1999 ; Zhao et al., 2000 ; Malashkevich et al., 2001 ; Xu et al., 2004a ; 2004b ; Yin et al., 2005 ; Lou et al., 2006 ; Zheng et al., 2006). Pour ces glycoprotéines, seule la structure correspondant à la conformation post-fusion a pu être mise en évidence (à droite dans la figure 2B). Comme pour les glycoprotéines des virus Influenza A, du SRAS et SV5, les hélices N-terminales interagissent ensemble et sont entourées par les hélices C-terminales. Cette grande similarité entre les structures post-fusion suggère que toutes les glycoprotéines de classe I adoptent une conformation pré-fusion similaire à celle des glycoprotéines des virus Influenza A, du SRAS et SV5 et subissent un changement de conformation lors de la fusion virale.
8Des résultats obtenus sur les glycoprotéines du virus du SRAS, VIH-1 et SV5 ont fourni de nouvelles informations sur le changement de conformation s’opérant entre les conformations pré- et post-fusion : les glycoprotéines adoptent une structure intermédiaire étirée (Figures 1B et 2C). En effet, l’ajout de peptides correspondant aux hélices C de ces protéines (appelés peptides C) bloque la fusion (Wild et al., 1992, 1994 ; Lu et al., 1995 ; Chen et al., 1995 ; Kilby et al., 1998 ; 2002 ; Furuta et al., 1998 ; Eckert, Kim, 2001 ; Russell et al., 2001 ; Bosch et al., 2003 ; 2004). Ces peptides agiraient sur la fusion en se liant aux hélices N du coiled-coil de gp41 (Wild et al., 1994 ; Chen et al., 1995). Pour gp41, il a été montré que l’effet de ces peptides n’est perceptible que lorsque la glycoprotéine est exposée à une membrane cible, indiquant que ces peptides ne sont pas capables d’interagir avec les hélices N lorsque la glycoprotéine adopte une conformation pré-fusion mais en sont capables lorsque la glycoprotéine adopte une conformation différente (Furuta et al., 1998). Des peptides correspondant aux hélices N (peptides N) des glycoprotéines de VIH-1 et du virus du SRAS bloquent également la fusion induite par ces glycoprotéines (Jiang et al., 1993 ; Russell et al., 2001). Il a été suggéré que ces peptides se lient aux hélices C de gp41 (Lu et al., 1995). Toutes ces études d’inhibition suggèrent que lors du changement de conformation intervenant entre les structures pré- et post-fusion, la gp41 adopte une conformation intermédiaire étirée qui expose ses hélices N et C, cibles des peptides C et N respectivement (Figures 1B et 2C).
9La détermination des structures pré- et post-fusion ainsi que les études d’inhibition ont permis l’élaboration de plusieurs modèles expliquant l’action sur les membranes des glycoprotéines de classe I lors de la fusion virale (Stegmann et al., 1989 ; Lindau, Almers, 1995 ; Hughson, 1997 ; Kozlov, Chernomordik, 1998 ; Stegmann, 2000 ; Bentz, 2000 ; Jahn, Grubmüller, 2002 ; Jahn et al., 2003). Le modèle le plus proposé dans la littérature et le mieux accepté est le modèle « jackknife » (Figure 1) (Hughson, 1997 ; Weissenhorn et al., 1997 ; Chernomordik et al., 1999 ; Skehel, Wiley, 2000 ; Eckert, Kim, 2001 ; Russel et al., 2001 ; Jahn et al., 2003 ; Colman, Lawrence, 2003 ; Jardetzky, Lamb, 2004 ; Korazim et al., 2006). Selon ce modèle, les glycoprotéines sont sécrétées sous une forme latente métastable, correspondant à la conformation pré-fusion (Figures 1A et 2C). Lorsque le virus s’approche d’une cellule cible, ses glycoprotéines de fusion sont activées et adoptent alors une structure intermédiaire étirée (Figures 1B et 2C). La partie N-terminale est alors repositionnée vers la membrane cible, permettant son interaction avec elle (Carr, Kim, 1993 ; Bullough et al., 1994). Des mesures de photolabeling ont d’ailleurs montré que l’extrémité N-terminale de HA2 s’insère dans la membrane, comme indiqué dans la figure 1B (Harter et al., 1989 ; Stegmann et al., 1991 ; Tsurudome et al., 1992 ; Durrer et al., 1996). La structure étirée de la glycoprotéine lui permet ainsi d’être connectée aux deux membranes à fusionner : le domaine transmembranaire est ancré dans l’enveloppe virale alors que la partie N-terminale est insérée dans la membrane de la cellule cible (Baker et al., 1999 ; Doms, Moore, 2000 ; Skehel, Wiley, 2000 ; Eckert, Kim, 2001 ; Russel et al., 2001 ; Gruenke et al., 2002). Par la suite, les glycoprotéines subissent de nouveau un changement de conformation leur permettant d’adopter la conformation post-fusion. Les glycoprotéines passent donc d’un état étiré à un état replié. Les glycoprotéines virales étant ancrées à la membrane plasmique et l’enveloppe virale, leur passage d’une conformation étirée à une conformation repliée induit le rapprochement des deux membranes et leur contact (Figure 1C) (Eckert, Kim, 2001). Par la suite, les monocouches externes fusionnent, induisant la formation du stalk (Figure 1D) puis du diaphragme d’hémifusion (Figure 1E). La fusion des monocouches internes permet enfin de finir le processus de fusion, en créant un pore de fusion permettant l’entrée de la capside virale à l’intérieur de la cellule cible.
10Le premier changement de conformation permet de « connecter » la membrane plasmique à l’enveloppe virale. Le second changement de conformation permet le rapprochement de ces deux membranes et leur fusion (Russel et al., 2001 ; Gruenke et al., 2002). Toutefois, il a été montré que ces changements de conformation ne sont pas à eux seuls responsables de la fusion. En effet, gp41 n’est pas capable d’induire la fusion cellulaire ni la déstabilisation membranaire lorsque son extrémité N-terminale est mutée, alors qu’elle subit toujours des changements de conformation (Dimitrov et al., 2003). Cette étude indique un rôle important de l’extrémité N-terminale dans le processus de fusion, confirmé par l’observation d’une diminution ou d’une perte de fusion de HA2 (Gething et al., 1986 ; Steinhauer et al., 1995 ; Durell et al., 1997), gp41 (Freed et al., 1990 ; Schaal et al., 1995 ; Buchschacher et al., 1995 ; Delahunty et al., 1996 ; Pritsker et al., 1999), gp30 (Vonèche et al., 1992) et d’autres protéines virales (Bosch et al., 1989 ; Zhu et al., 1998 ; Rothenberg et al., 2001 ; Russel et al., 2004) lorsque leur extrémité N-terminale est modifiée.
11Il a été suggéré que l’extrémité N-terminale intervient directement dans la fusion virale. De par ses propriétés hydrophobes, l’exposition de l’extrémité N-terminale dans l’espace aqueux intermembranaire pourrait induire une déshydratation de cet espace et favoriser la fusion (Bentz et al., 1990). De nombreuses publications suggèrent plutôt une déstabilisation de la membrane suite à son insertion dans la membrane plasmique (Figure 1B), favorisant la fusion virale (Weissenhorn et al., 1997 ; Dimitrov et al., 2003 ; Nieva, Agirre, 2003). Il a d’ailleurs été proposé que la capacité des glycoprotéines virales à induire la fusion dépend exclusivement de la capacité intrinsèque de leur extrémité N-terminale à désorganiser la membrane après insertion (Nieva, Agirre, 2003). Toutefois, il a été montré que des glycoprotéines mutées pouvaient s’insérer dans les membranes cibles sans toutefois induire leur déstabilisation (Gething et al., 1986 ; Qiao et al., 1999 ; Shome, Kielian, 2001), suggérant que le mode d’insertion de l’extrémité N-terminale dans les membranes est également important.
2. Les peptides correspondant à l’extrémité des glycoprotéines de fusion virales : des peptides de fusion
12Afin de mieux comprendre l’implication de l’extrémité N-terminale des glycoprotéines virales dans la fusion, des études sur l’interaction membranaire de peptides correspondant à ces extrémités ont été menées. Ces dernières montrent que ces peptides induisent la fusion de bicouches lipidiques (Gallaher, 1987 ; Wharton et al., 1988 ; Rafalski et al., 1990 ; 1991 ; Yeagle et al., 1991 ; Martin et al., 1994 ; 1996), confortant l’hypothèse que l’extrémité N-terminale des glycoprotéines joue un rôle direct dans la fusion virale. De par leur capacité à induire la fusion, ces peptides et les segments des glycoprotéines correspondant ont été appelés « peptides de fusion ». Afin de simplifier la compréhension, le terme « peptide de fusion » se référera dans la suite de cet article au peptide alors que la région protéique correspondante sera appelée « région peptide de fusion », comme précédemment proposé (Epand, 2003).
13L’analyse de mutations a permis de montrer une relation entre la capacité des peptides de fusion à déstabiliser les membranes et la capacité des protéines apparentées à favoriser la fusion (HA de Influenza A : Gething et al., 1986 ; Wharton et al., 1988 ; Rafalski et al., 1991 ; gp32 de SIV : Horth et al., 1991 ; Martin et al., 1994 ; gp41 de VIH-1 : Schaal et al., 1995 ; Martin et al., 1996 ; Sendai : Rapaport, Shai, 1994). Par exemple, la mutation V2E abolit le pouvoir fusogène du peptide de fusion de la g41 et de la gp41 entière (Freed et al., 1990 ; Kliger et al., 1997). De plus, des conditions favorables à la fusogénicité du peptide de fusion de HA2 augmentent également la fusogénicité de HA2 (Skehel et al., 2001). La bonne corrélation entre les expériences réalisées sur les peptides de fusion et celles réalisées sur les glycoprotéines entières indique que les peptides de fusion sont de bons modèles pour étudier la fusion virale, comme indiqué par Nieva et Agirre (2003).
2.1. Peptides de fusion et séquence
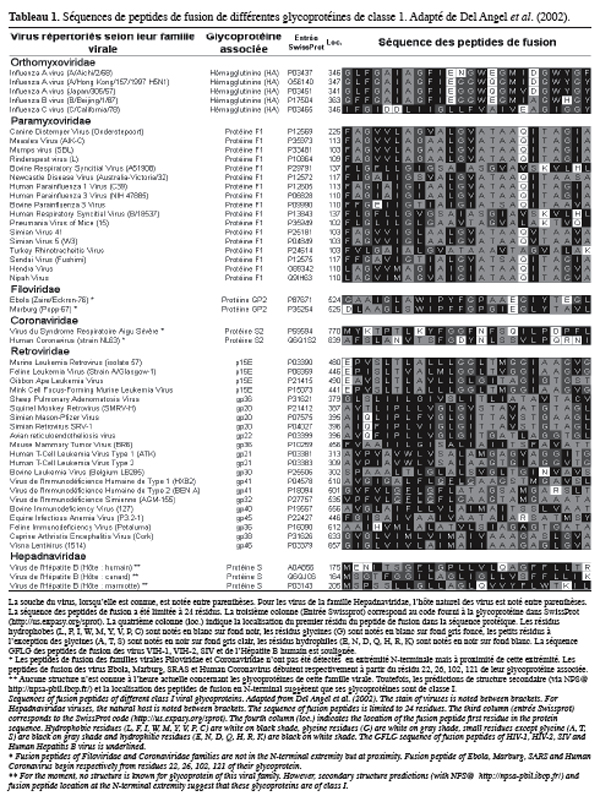
14Les peptides de fusion présentent une séquence conservée au sein d’une même famille virale (White, 1992). L’identité de séquence entre les peptides de fusion de virus de mêmes familles peut être supérieure à 90 % (Gallaher, 1987) (Tableau 1). Par contre, entre des virus appartenant à des familles différentes, l’identité de séquence des peptides de fusion est relativement faible (inférieure à 20 %). Malgré cette faible identité, les peptides de fusion présentent des similarités. Ils sont tous majoritairement hydrophobes et contiennent également des résidus de petite taille (Alanine, Glycine, Thréonine, Sérine) (Hernandez et al., 1996 ; Durell et al., 1997 ; Del Angel et al., 2002) (Tableau 1). Cette haute proportion en petits résidus n’est pas retrouvée dans les autres segments interagissant avec les membranes (Phoenix et al., 2002). De plus, les glycines de nombreux peptides de fusion (VIH-1, SIV, Influenza A, Influenza B) sont répartis de manière bien définie. Lorsque les peptides de fusion sont repliés en hélice α, une face de leur hélice est alors plus riche en glycines (Delahunty et al., 1996 ; Del Angel et al., 2002). Ces données suggèrent un rôle de cette succession de glycines localisée sur une face hélicoïdale dans les propriétés des peptides de fusion. D’ailleurs, le remplacement des résidus glycines des peptides de fusion de gp41 ou HA2 résulte en une diminution de leur fusogénicité (Wharton et al., 1988 ; Delahunty et al., 1996). Il a été suggéré que cette succession de glycines intervient dans l’oligomérisation des peptides de fusion, dans la balance d’amphipathicité nécessaire pour la fusion des membranes et/ou dans l’orientation des peptides de fusion dans la membrane (Delahunty et al., 1996).
15En plus du ratio important en petits résidus, des motifs communs entre peptides de fusion sont également retrouvés. Par exemple, le motif GFLG est retrouvé chez les peptides de fusion des rétrovirus VIH-1, VIH-2, SIV et chez le peptide de fusion du virus de l’hépatite B humain (Durell et al., 1997 ; Allison et al., 2001). Une mutation au sein du motif GFLG du peptide de fusion de gp41 diminue fortement ou abolit la fusogénicité de ce peptide, indiquant un rôle de ce motif dans les propriétés des peptides de fusion (Pritsker et al., 1999).
2.2. Effet des peptides de fusion sur la membrane
16L’utilisation de marqueurs fluorescents lipidiques et solubles a permis de montrer que les peptides de fusion des virus Influenza A (Wharton et al., 1988 ; Rafalski et al., 1991 ; Haque et al., 2001), Influenza A (Gething et al., 1986 ; Haque et al., 2001), VIH-1 (Rafalski et al., 1990 ; Martin et al., 1996 ; Charloteaux et al., 2006), BLV (Lorin et al., 2007), Ebola (Adam et al., 2004) et SIV (Martin et al., 1994) induisent la fusion et la perméabilité de vésicules lipidiques (liposomes). Les peptides de fusion des virus Influenza A, VIH-1 et hépatite B induisent également l’hémolyse de cellules (Wharton et al., 1988 ; Rodriguez-Crespo et al., 1995 ; Mobley et al., 1992 ; 1999 ; Han et al., 1999).
17Même si toutes les études réalisées sur les peptides de fusion n’ont pas permis d’expliquer leur mode d’action de manière précise, elles ont permis de proposer des mécanismes induits par ces peptides, qui favorisent la fusion.
18De nombreuses techniques expérimentales (fluorescence du tryptophane, spectroscopie infrarouge, sensibilité à une acidification, etc.) montrent que les peptides de fusion de gp41, de HA2 et de gp32 pénètrent dans les membranes (Duzgunes, Gambale, 1988 ; Rafalski et al., 1990 ; 1991 ; Clague et al., 1991 ; Martin et al., 1994 ; 1996). Leur tendance à s’insérer dans la membrane est due à leur hydrophobicité élevée (Nir, Nieva, 2000). Le mutant G1E du peptide de fusion de HA2, incapable de s’insérer dans la membrane, n’induit pas de fusion membranaire alors que le peptide sauvage ainsi que le mutant G4E s’insèrent dans la membrane et induisent la fusion (Rafalski et al., 1991). Les mesures expérimentales effectuées sur le peptide de fusion de gp41 et des mutants suggéraient également une relation fusogénicité et insertion (Mobley et al., 1999). Par modélisation moléculaire, cette relation a été confirmée : le peptide sauvage fusogène s’insère dans une membrane modélisée au contraire de peptides mutants non fusogènes (Kamath, Wong, 2002 ; Maddox, Longo, 2002). Une relation entre la fusion membranaire et la profondeur de pénétration des peptides de fusion des virus Influenza A, VIH-1 et Sendai a été observée (Rapaport, Shai, 1994 ; Pereira et al., 1997 ; Morris et al., 2004). L’insertion des peptides de fusion induit un stress latéral au niveau des monocouches externes de bicouches lipidiques (Agirre et al., 2000), expliquant que les peptides ne s’insérant pas dans la membrane n’induisent pas la fusion. Toutefois, de nombreuses études indiquent que l’insertion membranaire des peptides de fusion n’est pas transmembranaire (Ishiguro et al., 1993 ; 1996 ; Martin et al., 1993 ; 1994 ; 1996 ; Lüneberg et al., 1995 ; Kliger et al., 1997 ; Durell et al., 1997). De plus, des résultats de changement de conductance induit par le peptide de fusion de HA2 dans des bicouches lipidiques sont plus caractéristiques de perturbations lipidiques que de canaux (Duzgunes, Gambale, 1988). Au vu de ces résultats, les peptides de fusion ne s’inséreraient que dans une monocouche des membranes.
19Les peptides de fusion de Influenza A, de SIV et du virus de la Leucémie Féline (FLV) favorisent la courbure négative des bicouches lipidiques (Epand, Epand, 1994 ; Epand et al., 1994 ; Colotto et al., 1996 ; Epand, 1998 ; Davies et al., 1998). Or, de nombreuses études indiquent que la fusion est initiée par une augmentation de la courbure négative des deux monocouches externes (Chernomordik, 1996 ; Epand, 2000). En effet, l’addition dans les monocouches membranaires externes de lipides favorisant la courbure négative des membranes augmente la fusion alors que les molécules favorisant la courbure positive inhibent la fusion (Martin et al., 1993 ; Chernomordik et al., 1993 ; 1995 ; Epand, 1997 ; 1998 ; Chizmadzhev, 2004). De plus, une étude récente révèle une corrélation entre la capacité du peptide de fusion de HA2 à induire une courbure négative et sa capacité à induire la fusion (Epand et al., 2001). Les peptides de fusion induiraient donc la fusion des monocouches externes de membranes (stalk), en augmentant la courbure négative des membranes au niveau de leur site d’insertion.
20Longo et al. (1997) ont montré que le peptide de fusion de HA2 induit également la rupture des membranes. Par contre, un mutant non fusogène n’induit pas de rupture. Ces données permettent d’expliquer la capacité des peptides de fusion à perméabiliser les membranes. Durant la fusion, les membranes doivent se rompre puis se reformer afin de générer le pore de fusion. Il a donc été suggéré que les peptides de fusion induisent la rupture des monocouches externes, favorisant ainsi la formation de l’intermédiaire de fusion stalk (Epand, 2000) ou la déstabilisation de cet intermédiaire (Siegel, Epand, 2000). Cette hypothèse est confortée par le fait que le peptide de fusion de HA2 (Epand, Epand, 1994 ; Colotto, Epand, 1997), de gp41 (Pereira et al., 1999) et gp32 (Epand et al., 1994 ; El-Kirat et al., 2006) favorise la formation de phases non lamellaires cubiques ou hexagonales au niveau de bicouches (Epand, 2000). Pour se former, ces structures nécessitent une rupture membranaire.
21Il a également été montré que les peptides de fusion de gp41 et de HA2 forment des pores au sein de la membrane (Slepushkin et al., 1992 ; Schoch, Blumenthal, 1993). Cette propriété serait due à la capacité des peptides de fusion à s’auto-associer dans la membrane (Nieva et al., 1994 ; Pereira et al., 1997 ; Schwarz, Taylor, 1999 ; Pritsker et al., 1999 ; Nir, Nieva, 2000 ; Yang et al., 2001 ; Sackett, Shai, 2005). Ainsi, le mutant V2E du peptide de fusion de gp41, incapable de former de gros complexes, est non fusogène alors que le peptide sauvage en est capable (Kliger et al., 1997). La formation de pores pourrait induire la fusion de monocouches externes, comme suggéré par Monck et Fernandez (1996). Toutefois, il a également été suggéré que la formation de pores peut n’avoir aucune répercussion sur la fusion (Nieva, Agirre, 2003).
22Ces études suggèrent donc que le stress induit par l’insertion des peptides de fusion dans les membranes a deux répercussions : la formation de courbure négative et la rupture des membranes. Ces deux mécanismes réduiraient l’énergie nécessaire à la formation de l’intermédiaire de fusion stalk, et/ou du pore de fusion (Siegel, 1999 ; Siegel, Epand, 2000). Toutefois, des mutants des peptides de fusion de HA2 et gp41 capables de s’insérer dans la membrane mais incapables de déstabiliser la membrane indiquent que d’autres paramètres que l’insertion interviennent dans le processus (Wharton et al., 1988 ; Rafalski et al., 1991 ; Gray et al., 1996 ; Kliger et al., 1997).
2.3. Peptides de fusion et structure
23Les peptides de fusion sont sujets à des changements de conformation selon leur environnement (Davies et al., 1998 ; Chang et al., 2000 ; Pécheur et al., 2000). Par exemple, le peptide de fusion du VIH-1 adopte une structure non ordonnée dans le DMSO (Buzon et al., 2005), une structure β dans un milieu aqueux (Slepushkin et al., 1992 ; Gordon et al., 2002) alors qu’en présence de lipides, il adopte un mélange α/β dont la proportion dépend de la composition lipidique, de l’environnement, de la pression latérale membranaire et du degré d’hydratation (Nieva et al., 1994 ; Schwartz, Taylor, 1999 ; Charloteaux et al., 2006).
24Comme déjà indiqué ci-dessus, les peptides de fusion sont riches en résidus de petite taille (Del Angel et al., 2002). Par exemple, celui de la gp41 contient 20 % de glycines et 23 % d’alanines et celui de HA2 contient 29 % de glycines et 8 % d’alanines (Tamm et al., 2002). Cette composition inhabituelle en acides aminés permet d’expliquer la flexibilité structurale des peptides de fusion.
25De nombreuses études de mutagenèse suggèrent que la plasticité structurelle des peptides de fusion est cruciale pour le processus de fusion. Il a ainsi été montré que des changements de structure du peptide de fusion de HA2 diminuent l’insertion et la déstabilisation membranaire (Longo et al., 1998). Lorsqu’il est inséré dans les membranes, ce peptide adopte une hélice α N-terminale et une hélice 3-10 C-terminale séparées par un coude. Lorsque ce coude est remplacé par une structure plus ordonnée (hélice), le peptide devient non fusogène (Tamm et al., 2002). L’importance de la plasticité structurale pour la fusion est également confortée par des études de mutation montrant que lorsque les glycines des peptides de fusion de HA2 ou de p15E du virus de la Leucémie Murine de Monoley sont remplacées par des résidus plus volumineux, l’activité fusogène de ces peptides diminue (Duzgunes, Gambale, 1988 ; Rafalski et al., 1991 ; Zhu et al., 1998 ; Han et al., 1999).
26Une des principales interrogations est de connaître la structure qu’adoptent les peptides lors de la fusion membranaire. Si les études effectuées à l’heure actuelle n’ont pas permis d’y répondre entièrement, elles ont tout de même permis de livrer la structure des peptides de fusion dans les membranes. De manière générale, la proportion en hélice α des peptides de fusion augmente en présence de lipides (Martin et al., 1994 ; 1996 ; 1999). Une relation entre le taux d’hélicité du peptide de fusion de HA2 dans la membrane et sa fusogénicité a été montrée : sous forme hélicoïdale, il induit la fusion alors que sous conformation β, il en est incapable (Takahashi, 1990). De nombreuses autres études expérimentales, utilisant les techniques EPR, CD, ATR-FTIR, ont confirmé que le peptide de fusion de HA2 adopte une structure majoritairement hélicoïdale dans les membranes (Luneberg et al., 1995 ; Macosko et al., 1997 ; Han et al., 1999 ; Tamm et al., 2002). L’utilisation de ces techniques a également montré que les peptides de fusion de gp30 (Lorin et al., 2007), gp32 (Martin et al., 1994) et de la protéine F1 du Canine Distemper Virus (Aranda et al., 2003) sont majoritairement hélicoïdaux dans les membranes.
27Alors que pour ces peptides de fusion, les études expérimentales indiquent une structure hélicoïdale membranaire, pour le peptide de fusion de gp41, les résultats divergent. En effet, suivant sa longueur, son environnement, sa concentration et la technique d’analyse utilisée, le peptide de fusion de gp41 adopte une structure majoritairement hélicoïdale (Rafalski et al., 1990 ; Gordon et al., 1992 ; 2002 ; 2004 ; Martin et al., 1996), majoritairement β (Rafalski et al., 1990 ; Pereira et al., 1997 ; Yang et al., 2001 ; Sackett, Shai, 2003 ; 2005) ou un mélange des deux (Martin et al., 1993 ; Saez-Cirion, Nieva, 2002 ; Buzon et al., 2005 ; Castano, Desbats, 2005) dans les membranes. Des études suggèrent que la fusion est induite par le peptide de fusion lorsqu’il adopte une structure β (Sackett, Shai, 2003 ; 2005 ; Buzon et al., 2005). Toutefois, il a été montré que le peptide de fusion de gp41 adopte une conformation β en présence de membranes dont il n’induit pas la fusion alors que la structure α est observée en présence de membranes dont il induit la fusion, suggérant que la structure β ne permettrait que l’agrégation des membranes alors que la structure α interviendrait dans la déstabilisation et la fusion membranaire (Rafalski et al., 1990). D’autres études suggèrent également que le peptide de fusion de gp41 induit la fusion lorsqu’il adopte une structure hélicoïdale (Gordon et al., 1992 ; 2002 ; 2004 ; Martin et al., 1996). Ces différences de résultats suggèrent finalement que ces deux structures sont essentielles au bon déroulement de la fusion membranaire, confirmant l’importance de la labilité structurale de ces peptides dans la fusion.
28Toutes ces données indiquent un rôle de la structure hélicoïdale dans la fusion membranaire. Toutefois, il a été montré que des peptides mutants non fusogènes de VIH-1 et SIV adoptent la même proportion en hélice α que le peptide sauvage fusogène (Martin et al., 1994 ; 1996) et ont des affinités membranaires identiques (Morris et al., 2004). Ces résultats montrent qu’un autre paramètre est important dans la fusogénicité des peptides de fusion. De nombreuses études indiquent que ce paramètre est l’orientation adoptée par les peptides de fusion dans la membrane (Martin et al., 1994 ; 1996 ; Maddox, Longo, 2002 ; Charloteaux et al., 2006 ; Lorin et al., 2007).
3. Les peptides obliques
29En 1988, Brasseur et al. ont montré par modélisation moléculaire que, lorsqu’il est replié en hélice α, le peptide de fusion de la glycoprotéine virale du virus de la maladie de Newcastle adopte un angle de 55 ° dans une monocouche de DPPC, suggérant une insertion oblique dans la membrane (Brasseur et al., 1988a). Ce fut la première fois qu’une telle orientation fut prédite.
3.1. Hélices insérées obliquement dans les membranes
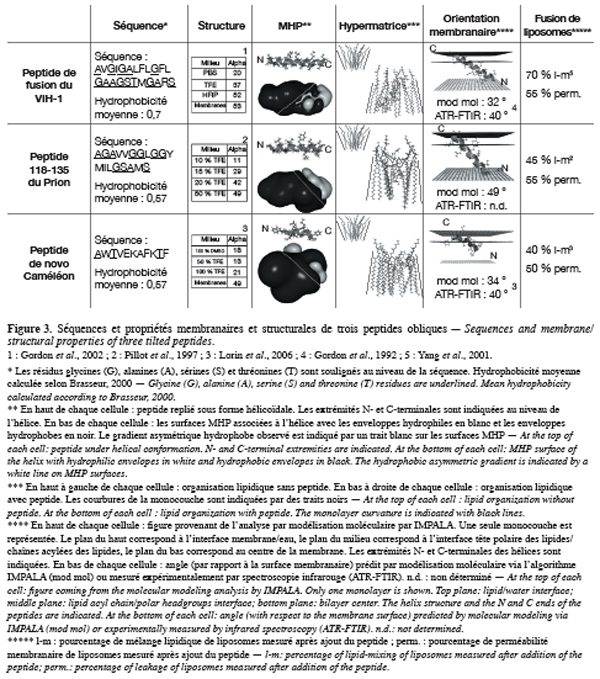
30Quelques années plus tard, l’équipe du professeur Brasseur a également prédit une insertion membranaire oblique des peptides de fusion des virus de la rougeole, VIH-1, SIV, Influenza A, BLV, Ebola et Sendai lorsqu’ils sont hélicoïdaux (Brasseur et al., 1988b ; Brasseur, 1991 ; Peuvot et al., 1999 ; Lins et al., 2001 ; Adam et al., 2004) (Figure 3). Une insertion membranaire oblique du peptide de fusion de HA2 et de gp41 a également été prédite par des études de modélisation entreprises par d’autres laboratoires (Efremov et al., 1999 ; Kamath, Wong, 2002 ; Maddox, Longo, 2002).
31L’orientation oblique des peptides de fusion sous forme hélicoïdale a été confirmée par des analyses expérimentales. L’utilisation de la spectroscopie infrarouge (ATR-FTIR) a permis de mesurer un angle de 50 °, 45 ° et 50 ° respectivement entre le peptide de fusion de gp41 (Martin et al., 1996), de HA2 (Lüneberg et al., 1995) et de gp32 (Martin et al., 1994) et la surface membranaire. D’autres techniques expérimentales ont été utilisées pour connaître plus précisément l’interaction de peptides avec la membrane. L’analyse EPR du peptide de fusion de HA2 indique que la partie hélicoïdale s’insère à environ 15 Å des groupes phosphates avec un angle de 25 ° (Macosko et al., 1997). Les analyses ESR et FTIR ont montré un remaniement de ce peptide lorsqu’il se rapproche de la membrane, suivi d’une insertion oblique et d’une diminution de la mobilité (Lüneberg et al., 1995). Enfin, l’utilisation de l’EPR et de la RMN a fourni la structure complète et l’orientation de ce peptide dans une membrane, confirmant une structure hélicoïdale orientée obliquement (Han et al., 2001). Par diffraction de neutrons, l’équipe de Bradshaw a, quant à elle, confirmé que le peptide de fusion de gp32 pouvait s’insérer dans la membrane avec un angle de 55 ° sous forme hélicoïdale (Bradshaw et al., 2000).
32Une comparaison des résultats expérimentaux avec ceux de modélisation moléculaire montre que cette dernière approche prédit l’orientation membranaire des peptides de fusion. Par exemple, l’algorithme IMPALA développé au Centre de Biophysique Moléculaire Numérique (Ducarme et al., 1998) prédit une insertion membranaire de 50 ° par rapport à la surface membranaire du peptide de fusion de gp32 (Lins et al., 2001), comme la spectroscopie ATR-FTIR (Martin et al., 1994).
33En plus des peptides de fusion, d’autres peptides ont également été prédits comme obliques dans les membranes lorsqu’ils sont hélicoïdaux (Lins et al., 2002 ; Ravault et al., 2005 ; Nguyen et al., 2006). Ces peptides correspondent à des fragments de protéines impliquées dans des processus variés, comme les apolipoprotéines (Apo), les enzymes lypolitiques, les séquences signaux, les protéines membranaires, les protéines anti-angiogénèses et les protéines neurotoxiques (Lins et al., 2001 ; Nguyen et al., 2006) (Figure 3). L’orientation oblique de certains de ces peptides a été confirmée expérimentalement (Lambert et al., 1998 ; Decout et al., 1999). Récemment, une orientation membranaire oblique a également été mesurée pour des peptides de novo (Hsu et al., 2002 ; Lorin et al., 2006) ainsi que pour un peptide composé d’acides aminés non naturels (Lins et al., 2006), indiquant que cette orientation n’est pas spécifique à des fragments de protéines biologiques (Figure 3).
34De par leur capacité à adopter une orientation oblique dans la membrane, tous ces peptides, dont font partie les peptides de fusion, ont été appelés « peptides obliques ».
3.2. Peptides obliques et structure
35La structure des peptides de fusion dépend fortement de leur environnement (cf. section 2.3. Peptide de fusion et structure). Il en est de même pour les autres peptides obliques. Par exemple, le peptide oblique de la protéine prion adopte une structure majoritairement hélicoïdale dans des micelles de SDS qui disparaît dans un milieu aqueux (Figure 3). Tout comme les peptides de fusion, les autres peptides obliques contiennent une proportion importante de petits résidus (alanine, glycine), expliquant leur polymorphisme structural. Lorsque les peptides obliques sont repliés sous forme hélicoïdale, une face est généralement plus riche en glycines (Bosch et al., 1989 ; White, 1990 ; 1992 ; Delahunty et al., 1996 ; Martin et al., 1999 ; Harris et al., 2000 ; Phoenix et al., 2002). Cette distribution asymétrique en résidus glycines a été utilisée récemment pour détecter de nouveaux peptides obliques (Daman et al., 2001).
36La relation peptide oblique-labilité structurale a récemment été renforcée par l’analyse d’un peptide de novo, le peptide caméléon. Ce peptide a été conçu pour adopter une conformation α ou β selon sa position dans une protéine (Minor, Kim, 1996). De plus, le peptide caméléon, sous forme isolée, adopte un mélange d’hélice et de structure β dont les proportions varient suivant l’hydrophobicité du milieu (Figure 3). L’analyse de ce peptide, par des approches expérimentales et de modélisation, a montré que ce peptide adopte une orientation membranaire oblique (Lorin et al., 2006). Cette étude indique donc qu’un peptide connu pour ses propriétés de labilité structurale est un peptide oblique, renforçant le lien peptide oblique-labilité structurale.
37La labilité structurale des peptides obliques semble importante pour leurs propriétés ainsi que pour celles des protéines contenant un peptide oblique. Il a ainsi été proposé que durant les processus pathologiques induits par la protéine prion (PrP), le polymorphisme structural de la zone protéique 119-137, contenant le peptide oblique, joue un rôle dans la déstabilisation membranaire et induit l’agrégation protéine-protéine à la surface membranaire (Saez-Cirion et al., 2003).
3.3. Une asymétrie hydrophobe à l’origine de l’orientation oblique
38Malgré la faible homologie de séquence entre peptides obliques, ils possèdent des caractères communs, étant notamment majoritairement hydrophobes. Toutefois, la répartition de l’hydrophobicité diffère de celle des hélices amphipathiques (adoptant une orientation parallèle par rapport à la surface membranaire) ou transmembranaires (orientation perpendiculaire par rapport à la surface membranaire) (Brasseur, 1991 ; 2000 ; Brasseur et al., 1997 ; Rahman et al., 1997 ; Decout et al., 1999 ; Phoenix et al., 2002 ; Thomas, Brasseur, 2006). En effet, les peptides obliques présentent un gradient d’hydrophobicité le long de l’axe de leur hélice (Brasseur, 1991 ; 2000 ; Lins et al., 2001) (Figure 3). Par contre, sous forme β, les peptides obliques ne présentent pas ce gradient (Brasseur, 2000 ; Lorin et al., 2006).
39Le gradient hydrophobe est responsable de l’orientation oblique des peptides. L’extrémité la plus hydrophobe de l’hélice s’insère profondément dans le cœur apolaire membranaire alors que l’autre extrémité, plus hydrophile, se localise préférentiellement au niveau des têtes polaires ou du milieu aqueux (Perez-Mendez et al., 1998). L’importance du gradient hydrophobe pour l’orientation des peptides obliques a été confirmée par des études de mutation. Des mutations modifiant le gradient d’hydrophobicité modifient l’orientation des peptides (Decout et al., 1999 ; Lins et al., 2001 ; 2002).
40Les peptides de fusion faisant partie des peptides obliques, leur orientation membranaire est également reliée à leur profil hydrophobe. La perte du gradient hydrophobe des peptides de fusion d’Ebola (Adam et al., 2004), SIV (Horth et al., 1991) et BLV (Vonèche et al., 1992) correspond à la perte de l’orientation oblique pour une orientation parallèle ou perpendiculaire. Par contre, l’orientation oblique de ces peptides est récupérée suite à la restauration du gradient hydrophobe.
41La présence d’un gradient hydrophobe au sein d’un peptide oblique est utilisée à l’heure actuelle pour rechercher la présence de tels motifs dans les protéines. De nombreuses méthodes permettent d’identifier le profil hydrophobe d’une protéine et ainsi d’identifier la présence d’un peptide oblique. La méthode Jähnig et Hydrophobic Cluster Analysis (HCA) repose sur l’analyse de l’hydrophobicité de la séquence des protéines (Gaboriaud et al., 1987 ; Jähnig, 1990). La méthode Molecular Hydrophobicity Potential (MHP) permet de visualiser la répartition de l’hydrophobicité le long d’un peptide modélisé (Brasseur, 1991). Ces méthodes sont généralement associées pour prédire l’existence d’un peptide oblique dans une protéine (Lorin et al., 2006).
3.4. Relation oblicité-fusogénicité
42Tout comme les peptides de fusion, les autres peptides obliques induisent la déstabilisation de liposomes. Celle-ci est mesurée par fusion des phases lipidiques et la perméabilisation des liposomes (Pillot et al., 1996 ; 1997 ; Perez-Mendez et al., 1998 ; Lambert et al., 1998 ; Decout et al., 1999 ; Lins et al., 2002 ; Lorin et al., 2004 ; Nguyen et al., 2006 ; Crowet et al., 2007) (Figure 3). Les peptides obliques de la PrP, de α-synucléine, de la protéine prolactine et du peptide β-amyloïde (Aβ), qui induisent de la fusion de liposomes, provoquent également la mort cellulaire, confirmant le pouvoir déstabilisateur de ces peptides (Pillot et al., 1999 ; 2000 ; Nguyen et al., 2006 ; Crowet et al., 2007).
43Cette propriété n’est pas liée au simple caractère hydrophobe des peptides obliques, leur permettant de s’insérer dans les membranes. En effet, des mutants des peptides obliques des protéines ApoC-III (Lins et al., 2002), Apo A-II (Lambert et al., 1998), lécithine cholestérol acyltransférase (Perez-Mendez et al., 1998 ; Decout et al., 1999), Aβ (Pillot et al., 1996) et PrP (Pillot et al., 1997) induisent moins de déstabilisation membranaire que les peptides sauvages alors que l’hydrophobicité générale est conservée. Par contre, ces études indiquent que la perte de l’orientation oblique coïncide avec la perte du pouvoir fusogène des peptides obliques (Pillot et al., 1996 ; 1997 ; Lambert et al., 1998 ; Perez-Mendez et al., 1998 ; Decout et al., 1999 ; Lins et al., 2002). Par contre, lorsque le caractère oblique des peptides est restauré par de nouvelles mutations, sa fusogénicité est également retrouvée (Pillot et al., 1996 ; 1997 ; Perez-Mendez et al., 1998 ; Lambert et al., 1998 ; Lins et al., 2002). Puisque l’orientation oblique des peptides est gouvernée par la présence d’un gradient hydrophobe asymétrique le long de l’axe de l’hélice (cf. section précédente), la perte de ce gradient induit une perte de fusogénicité des peptides (Perez-Mendez et al., 1998 ; Decout et al., 1999 ; Lins et al., 2002).
44La même relation entre oblicité et fusogénicité a également été mesurée pour les peptides de fusion par modélisation moléculaire et analyses FTIR. Des peptides de fusion perdant leur orientation oblique dans la membrane suite à des mutations perdent également leur capacité à déstabiliser les liposomes (Martin et al., 1994 ; 1996 ; Maddox, Longo, 2002 ; Adam et al., 2004 ; Charloteaux et al., 2006 ; Lorin et al., 2007). Une relation entre l’oblicité du peptide de fusion et l’activité fusogène de la glycoprotéine entière a également été mesurée pour gp30 de BLV et gp32 de SIV (Horth et al., 1991 ; Vonèche et al., 1992).
45L’orientation oblique qu’adoptent les hélices semble donc être le mécanisme responsable de la fusion membranaire. Il a été suggéré que l’insertion oblique désorganise le parallélisme des chaînes acylées lipidiques et par conséquent induit l’apparition d’une courbure négative au niveau des membranes (Brasseur, 2000 ; Bradshaw et al., 2000 ; Epand, 2000). De nombreux résultats vont dans le sens de cette hypothèse. Tout d’abord, il a été montré par modélisation moléculaire, via Hypermatrice, que les peptides obliques induisent une perturbation de l’organisation de monocouches de lipides (Brasseur et al., 1990) (Figure 3). Les lipides, qui en l’absence de peptides s’organisent en structure lamellaire avec une courbure positive, adoptent une courbure négative lorsque des peptides obliques y sont insérés. D’autres programmes informatiques montrent également que le peptide de fusion de gp41 induit une déstabilisation membranaire lorsqu’il s’insère obliquement dans celle-ci (Kamath, Wong, 2002). De même, le peptide oblique de la protéine A induit la formation de structures lipidiques non-lamellaires ainsi qu’une courbure négative à l’interface membrane/eau (Mingeot-Leclercq et al., 2002 ; 2003). Par contre, il perd son caractère déstabilisateur lorsque du piracétam, une molécule qui induirait une courbure positive au niveau membranaire, est ajouté (Mingeot-Leclercq et al., 2003). Il a également été montré que les peptides de fusion de gp32 et de HA2 diminuent la température de transition phase lamellaire-phase hexagonale de bicouches lipidiques, alors que des mutants adoptant une orientation perpendiculaire n’ont aucun effet sur la température de transition (Epand et al., 1994 ; Epand et al., 2001).
46Toutefois, l’effet précis des peptides obliques au niveau de l’organisation membranaire n’en reste qu’à l’état de suggestion et est toujours sous débat. Des calculs théoriques proposent ainsi un autre mécanisme : une insertion cylindrique oblique au niveau d’une monocouche résulte en un fléchissement anisotropique de la surface de la monocouche autour de l’insertion, sans inclinaison des chaînes carbonées des lipides (Kozlovsky et al., 2004). Toutefois, selon les auteurs, ce fléchissement ne serait pas à lui seul suffisant pour permettre la fusion.
4. Utilisation de la théorie des peptides obliques pour déterminer la région des peptides de fusion indispensable pour la fusion
47Comme indiqué par Epand (2003), bien que le terme « peptide de fusion » soit largement employé dans la littérature, il n’y a pas de définition précise de ce que ce terme signifie. Bien entendu, un peptide de fusion induit la fusion membranaire. Cependant, suivant les publications, le peptide de fusion a une longueur différente et donc une séquence différente. Par exemple, le peptide de fusion de VIH-1 correspond soit aux 16 (Martin et al., 1993 ; Kamath, Wong, 2002 ; Wong, 2003), 23 (Pereira et al., 1995 ; 1999 ; Delahunty et al., 1996 ; Yang et al., 2001 ; Gordon et al., 2002) ou 33 (Pritsker et al., 1999) premiers résidus de gp41.
48L’équipe du professeur Brasseur s’est donc récemment intéressée à mieux définir les peptides de fusion. Une nouvelle définition fut employée, celle du « peptide de fusion minimal ». Le peptide de fusion minimal correspond à la plus courte séquence du peptide de fusion induisant une déstabilisation membranaire optimale (Charloteaux et al., 2006 ; Lorin et al., 2007).
49Comme indiqué ci-dessus (cf. section 3.4. Relation oblicité-fusogénicité »), un peptide hélicoïdal adoptant une orientation oblique dans la membrane déstabilise cette dernière, ce qui n’est pas le cas des peptides hélicoïdaux adoptant une orientation parallèle ou perpendiculaire (Brasseur, 2000). De plus, il a été montré que plus l’angle de l’hélice est proche de 45 °, plus la membrane est déstabilisée (Brasseur, 2000). Cette relation pouvoir fusogène-angle d’insertion membranaire a été utilisée pour déterminer le peptide de fusion minimal de gp41 et gp30. Pour chacune de ces glycoprotéines virales, le peptide de fusion minimal correspond donc au plus court peptide hélicoïdal adoptant un angle d’insertion oblique optimal (le plus proche de 45 ° par rapport à la surface membranaire) dans la membrane. L’algorithme IMPALA a été utilisé pour prédire l’orientation membranaire de ces peptides.
50Les résultats in silico indiquent que les peptides hélicoïdaux adoptant un angle d’insertion oblique optimal sont respectivement les 12 et 15 premiers résidus de gp41 et gp30 (Charloteaux et al., 2006 ; Lorin et al., 2007). Afin de confirmer ces prédictions, la fusogénicité de ces deux peptides a été analysée expérimentalement (Lorin et al., 2004). Les mesures de fusion et de perméabilité de liposomes montrent que ces deux peptides induisent autant de déstabilisation membranaire que des peptides plus longs mais sont plus fusogènes que des peptides plus courts (Charloteaux et al., 2006 ; Lorin et al., 2007). Ces résultats confirment la prédiction in silico. Les peptides N-terminaux de 12 et 15 résidus sont donc les peptides de fusion minimaux respectivement de gp41 et gp30. Cette étude a également permis de mesurer pour la première fois la capacité fusogène du peptide de fusion de gp30.
51L’algorithme IMPALA a également été utilisé pour analyser des mutations connues pour avoir un effet sur la fusogénicité des gp30 et gp41 entières (Charloteaux et al., 2006 ; Lorin et al., 2007). Les résultats montrent que les glycoprotéines fusogènes sont corrélées avec un peptide de fusion inséré obliquement dans la membrane alors que les glycoprotéines peu fusogènes contiennent un peptide de fusion non oblique. De plus, plus l’angle adopté par le peptide de fusion est proche de 45 °, plus la glycoprotéine correspondante induit de la fusion membranaire. Dans le cas de gp30, des analyses complémentaires sur le peptide de fusion ont été effectuées. Un peptide de fusion mutant adoptant une orientation perpendiculaire dans la membrane n’induit pas de déstabilisation significative de liposomes alors qu’un peptide de fusion mutant adoptant une orientation oblique induit de la déstabilisation membranaire. Ces différences ne sont pas dues à une différence de structure secondaire dans la membrane, puisque les deux peptides, ainsi que le peptide de fusion sauvage, adoptent une structure majoritairement hélicoïdale. Cette étude complémentaire confirme la relation entre la capacité des peptides de fusion à s’insérer obliquement dans la membrane et sa capacité à déstabiliser les membranes.
52Ces résultats obtenus sur gp30 et gp41 indiquent donc que la relation oblicité-fusogénicité de peptides hélicoïdaux permet de déterminer le peptide de fusion nécessaire et suffisant pour induire une déstabilisation membranaire. Ils montrent également que l’étude des propriétés membranaires des peptides de fusion permet d’expliquer les propriétés fusogènes des glycoprotéines entières.
5. Conclusion
53Les nombreuses études réalisées sur les peptides de fusion ont permis de proposer des mécanismes d’action par lesquels ils induisent la déstabilisation et la fusion membranaire. La structure, le niveau d’insertion ainsi que l’orientation de ces peptides dans la membrane semblent cruciaux. Toutefois, de nombreux résultats divergent entre différentes études, suivant la méthode, l’environnement, la concentration et la séquence du peptide de fusion utilisés lors de ces études. La détermination de la région du peptide de fusion de gp41 et gp30 nécessaire et suffisante pour l’induction de la fusion permettra d’éviter les problèmes liés à la longueur du peptide. De plus, de nombreuses études suggèrent des propriétés communes entre les peptides de fusion de ces virus et ceux des autres virus (Lorin et al., 2007), suggérant que la détermination de cette région pour d’autres virus est possible.
54Puisque de nombreuses relations existent entre les résultats obtenus avec les peptides de fusion et ceux obtenus avec la glycoprotéine entière, il a été suggéré que les peptides de fusion étaient de bons modèles pour étudier la fusion virale (Nieva, Agirre, 2003). Toutefois, dans le cas de la fusion in vivo, les nombreuses autres régions de la glycoprotéine doivent être prises en compte. La région cytoplasmique, le domaine transmembranaire, la région pré-transmembranaire ainsi que la région post-« peptide de fusion » de certaines glycoprotéines ont, comme le peptide de fusion, un effet de déstabilisation membranaire, indiquant un rôle de ces domaines protéiques dans la fusion virale (Ghosh, Shai, 1999 ; Epand, 2000 ; Kozerski et al., 2000 ; Shai, 2000 ; Schroth-Diez et al., 2000 ; Sackett, Shai, 2002 ; Peisajovich, Shai, 2002 ; 2003).
55Liste des abréviations
56Å : Angström
57Aβ : peptide -Amyloïde (Amyloid Beta)
58Apo : Apolipoprotéine (Apolipoprotein)
59ATR-FTIR : Spectroscopie Infrarouge par Transformée de Fourier – Réflexion Totale Atténuée (Attenuated Total Reflectance - Fourier Transform InfraRed)
60BLV : Virus de la Leucémie Bovine (Bovine Leukemia Virus)
61CD : Dichroïsme Circulaire (Circular Dichroism)
62DMSO : Diméthylsulfoxyde (Dimethylsulfoxyde)
63EPR : Résonance Paramagnétique Electronique (Electron Paramagnetic Resonance)
64ESR : Résonance de Spin Electronique (Electron Spin Resonance)
65FLV : Virus de la Leucémie Féline (Feline Leukemia Virus)
66FTIR : Spectroscopie Infrarouge par Transformée de Fourier (Fourier Transform InfraRed)
67HA2 : Sous-unité membranaire de l’hémagglutinine (membrane subunit of hemagglutinin)
68HCA : Analyse d’Amas Hydrophobes (Hydrophobic Cluster Analysis)
69HFIP : Hexafluoroisopropanol
70HRSV : Virus Respiratoire Syncytial Humain (Human Respiratory Syncitial Virus)
71IMPALA : Integral Membrane Protein and Lipid Association
72Influenza A : virus de l’Influenza (grippe) de type A
73Influenza B : virus de l’Influenza (grippe) de type B
74MHP : Potentiel Hydrophobicité Moléculaire (Molecular Hydrophobicity Potential)
75PBS : tampon phosphate (phosphate-buffered saline)
76PDB : Banque de Données de Protéines (Protein Data Bank)
77PrP : Protéine Prion (Prion Protein)
78RMN : Résonance Magnétique Nucléaire (NMR : Nuclear Magnetic Resonance)
79SDS : Sodium DodécylSulfate (Sodium DodecylSulfate)
80SIV : Virus de l’Immunodéficience Simienne (Simian Immunodeficiency Virus)
81SRAS : Syndrome Respiratoire Aigu Sévère (SARS : Severe Acute Respiratory Syndrome)
82SV5 : Virus para-influenza Simien 5 (paramyxovirus Simian Virus 5)
83TFE : Trifluoroéthanol (Trifluoroethanol)
84VIH-1 : Virus de l’Immunodéficience Humaine de type 1 (HIV-1 : Human Immunodeficiency Virus type 1)
85VIH-2 : Virus de l’Immunodéficience Humaine de type 2 (HIV-2 : Human Immunodeficiency Virus type 2)
86Remerciements
87Nous remercions le Fonds National de la Recherche Scientifique (FNRS) pour le soutien financier ainsi que toutes les personnes qui ont collaboré à l’étude des interactions peptides-membranes : Benoit Adam, Jean-Marc Crowet, Marc Decaffmeyer, Sébastien Deshayes, Christelle Flore, Gaëtan Gillet, Nicolas Delsaux, Didier Bastogne, Stéphanie Ravault, Sébastien Santini, Marie-Hélène Van Heyck et Annick Thomas. Aurélien Lorin est supporté financièrement par une bourse Télévie (projet Télévie 7.4.511.03.F). Benoit Charloteaux est supporté financièrement par le programme d’attraction des pôles interuniversitaires (contrat PAI phase 6). Robert Brasseur et Laurence Lins sont respectivement Directeur de Recherche et Chercheur Qualifié au FNRS.
Bibliographie
Adam B., Lins L., Stroobant V., Thomas A., Brasseur R. (2004). Distribution of hydrophobic residues is crucial for the fusogenic properties of the Ebola virus GP2 fusion peptide. J. Virol. 78, p. 2131–2136.
Agirre A., Flach C., Goni FM., Mendelsohn R., Valpuesta JM., Wu F.J., Nieva JL. (2000). Interactions of the HIV-1 fusion peptide with large unilamellar vesicles and monolayers. A cryo-TEM and spectroscopic study. Biochim. Biophys. Acta 1467, p. 153–164.
Allison SL., Schalich J., Stiasny K., Mandl CW., Heinz FX. (2001). Mutational evidence for an internal fusion peptide in flavivirus envelope protein E. J. Virol. 75, p. 4268–4275.
Almers W., Tse FW. (1990). Transmitter Release from Synapses - Does A Preassembled Fusion Pore Initiate Exocytosis. Neuron. 4, p. 813–818.
Aranda FJ., Teruel JA., Ortiz A. (2003). Interaction of a synthetic peptide corresponding to the N-terminus of canine distemper virus fusion protein with phospholipid vesicles: a biophysical study. Biochim. Biophys. Acta 1618, p. 51–58.
Baker KA., Dutch RE., Lamb RA., Jardetzky TS. (1999). Structural basis for paramyxovirus-mediated membrane fusion. Mol. Cell 3, p. 309–319.
Basanez G. (2002). Membrane fusion: the process and its energy suppliers. Cell. Mol. Life Sci. 59, p. 1478–1490.
Bentz J., Ellens H., Alford D. (1990). An architecture for the fusion site of influenza hemagglutinin. FEBS Lett. 276,
To cite this article
About: Aurélien Lorin
Gembloux Agricultural University – FUSAGx. Centre de Biophysique moléculaire numérique. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
About: Benoit Charloteaux
Gembloux Agricultural University – FUSAGx. Centre de Biophysique moléculaire numérique. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
About: Laurence Lins
Gembloux Agricultural University – FUSAGx. Centre de Biophysique moléculaire numérique. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
About: Robert Brasseur
Gembloux Agricultural University – FUSAGx. Centre de Biophysique moléculaire numérique. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : brasseur.r@fsagx.ac.be






