- Accueil
- Volume 25 (2021)
- Numéro 3
- Les Dialium de la région guinéo-congolaise (synthèse bibliographique)
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Les Dialium de la région guinéo-congolaise (synthèse bibliographique)

Document(s) associé(s)
Version PDF originaleRésumé
Introduction. Le présent travail dresse une synthèse des connaissances sur le genre Dialium (Fabaceae, Dialioideae) dans la région guinéo-congolaise. Il examine plus particulièrement la possibilité de valoriser durablement le bois de ces espèces et les coproduits de leur transformation en vue de diminuer la pression sur d’autres espèces de bois durs dont les populations se raréfient.
Littérature. Bien qu’il n’existe pas de consensus parmi les botanistes, le genre Dialium comprendrait 44 espèces, dont 22 espèces seraient inféodées à la région guinéo-congolaise. Les différences entre espèces sont parfois ténues et les descriptions reposent sur un nombre limité d’individus. Les espèces vivant en forêt dense humide ont des structures de populations équilibrées. À part leur mode de dispersion, lequel est zoochore, les connaissances écologiques sont très lacunaires. L’absence de données sur la dynamique des populations est particulièrement problématique dans le cadre de l’aménagement durable des forêts. Les propriétés physiques, mécaniques et biochimiques du bois ont seulement été caractérisées pour un nombre limité d’espèces.
Conclusions. Cet article, en proposant une clé de détermination des espèces de la région guinéo-congolaise, a tenté de clarifier la taxonomie du genre Dialium tout en soulevant la nécessité de mener des études génétiques complémentaires. En Afrique centrale, certaines espèces du genre Dialium sont localement abondantes et semblent se régénérer correctement. Elles offrent de nombreuses perspectives de valorisation car leur bois est très durable et pourrait renfermer des molécules intéressantes. Les recherches à venir devraient se concentrer en priorité sur la dynamique démographique de ces espèces et sur les propriétés de leur bois.
Abstract
The Dialium of the Guinean-Congolese region. A review
Introduction. The present study provides a synthesis of current knowledge on the genus Dialium (Fabaceae, Dialioideae), focusing on the species of the Guinean-Congolese region. In particular, it examines the possibility of sustainably using the wood and sawing co-products of Dialium species in order to reduce the pressure on other hardwood species whose populations are declining.
Literature. Although there is no consensus among botanists, the Dialium genus is known to include 44 species, 22 of which are endemic to the Guinean-Congolese region. The differences between species are sometimes tenuous, and descriptions are based on a limited number of individuals. Species living in rainforests have balanced population structures. Apart from their mode of dispersal, which is zoochorous, ecological knowledge of Dialium species is very incomplete. The lack of data on population dynamics is particularly problematic in the context of sustainable forest management. The physical, mechanical and biochemical properties of the wood of these plants have only been characterized for a limited number of species.
Conclusions. By proposing a key for determining the Dialium species of the Guinean-Congolese region, this article has attempted to clarify the taxonomy, while raising the need for further genetic studies. In Central Africa, some species of the genus Dialium are locally abundant and seem to regenerate well. They offer many prospects for development because their wood is very durable and could contain molecules of interest. Future research should focus primarily on the demographic dynamics of these species and the properties of their wood.
Table des matières
Reçu le 4 décembre 2020, accepté le 3 juin 2021, mis en ligne le 30 juin 2021
Cet article est distribué suivant les termes et les conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr)
1. Introduction
1En Afrique, pour des raisons de marché, les rendements de matière de la transformation des bois tropicaux (volume de produits sur volume de grumes entré en usine) sont très faibles (30 % pour les sciages et entre 45 et 50 % pour les placages déroulés et les contreplaqués) (FRM, 2018). Cela s’explique d’une part par les règles exigeantes de classement des bois sur les marchés internationaux (ATIBT, 2017) et, d’autre part, par la concurrence déloyale du bois illégal sur les marchés nationaux (Reborredo, 2013). Cette concurrence empêche toute valorisation des sciages de moindre qualité suite à des coûts de transports prohibitifs. Par ailleurs, la valorisation de certaines espèces (comme les Dialium) demande des investissements supplémentaires car leur bois est très abrasif et nécessite d’utiliser des lames au carbure. Les coproduits de la transformation sont donc généralement brûlés, à défaut de pouvoir être valorisés. Cela se traduit par un gaspillage difficilement acceptable, alors que les espèces de bois durs traditionnels se raréfient (Biwolé, 2015 ; Gorel et al., 2015 ; Makemba et al., 2019), mettant en danger la survie de certaines entreprises.
2Aujourd’hui, les difficultés du secteur bois en Afrique centrale obligent les acteurs à s’orienter progressivement vers des essences regroupées sous le nom d’espèces de promotion (lesser known timber species) ou vers de nouveaux produits (Koyo, 1982 ; ATIBT, 2017). Ce paradigme suppose :
3– la mise sur le marché d’essences dont les propriétés technologiques et mécaniques sont supposées similaires à celles des espèces habituellement commercialisées ;
4– la valorisation éco-efficiente et directement applicable sur les sites de transformation des coproduits actuellement non utilisés par l’industrie du bois (ATIBT, 2017).
5L’exploitation de ces espèces à promouvoir devra en outre intégrer des modalités de gestion adaptées afin de garantir le maintien de leurs populations sur le long terme (Vantomme, 1991). En effet, l’exploitation forestière en Afrique centrale est extensive et s’apparente à une cueillette, en moyenne de moins de deux arbres par hectare tous les 20 à 30 ans. Bien que ce type d’exploitation ait un impact limité sur le couvert forestier, il engendre une raréfaction progressive des espèces héliophiles caractérisées par un déficit de régénération dans les forêts matures (Karsenty & Gourlet-Fleury, 2006). Il est donc indispensable d’avoir une connaissance approfondie de l’écologie des espèces mises sur le marché.
6Le genre Dialium, de la famille des Fabaceae (sous-famille des Dialioideae), regroupe de nombreuses espèces multi-usages, que ce soit pour la valorisation du bois ou des molécules (Raponda-Walker & Sillans, 1961). Le présent article ambitionne de synthétiser les connaissances disponibles sur les espèces de ce genre vivant dans le centre d’endémisme guinéo-congolais (White, 1986). Dans cette optique, ont été consultées les bases de données spécialisées suivantes : Science Finder, Sciences Direct, Scopus, Pubmed et Google Scholar ainsi que les ressources documentaires disponibles dans la bibliothèque de Gembloux Agro-Bio Tech (Université de Liège). La combinaison des mots-clés suivants a été utilisée en français et/ou leurs équivalents en anglais : Dialium, phylogénie, botanique, germination, densité de population, écologie, phénologie, croissance, valorisation, criblage phytochimique, sciures de bois, molécule. En outre, pour la taxonomie, les sites suivants ont été consultés : https://www.jstor.org/, http://www.ville-ge.ch/musinfo/bd/cjb/africa/, https://www.floredafriquecentrale.be, http://www.theplantlist.org/
2. Histoire de la taxonomie et phylogénie du genre
7La création du genre Dialium L. remonte à 1767, avec la description de l’espèce-type Dialium indum L. (Linnaeus, 1767), arbre originaire d’Inde, à feuilles composées pennées (sept paires de folioles) et à fleurs dotées de cinq pétales, de deux étamines avec des anthères oblongues et d’un ovaire supère. Deux autres espèces furent décrites quelques années plus tard : Dialium guianense (Aubl.) Sandwith (basionyme : Arouna guianensis Aubl.) d’Amérique tropicale par Fusée Aublet (1775) et Dialium guineense Willd. d’Afrique de l’Ouest par Willdenow (1796).
8Au cours du 19e siècle, le débat autour de la classification des Dialium fut très animé. Il débuta par De Candolle en 1825 qui classa le genre dans la tribu des Cassieae, famille des Leguminosae et sous-famille des Caesalpinioideae. En 1892, Taubert proposa une subdivision du genre Dialium basée sur la présence ou non de pétales (Taubert, 1892). Il distingua deux sections : Arouna (espèces sans pétales) et Codarium (espèces ayant un ou deux pétales). Deux décennies plus tard, Harms (1915) établit une nouvelle classification basée cette fois sur les étamines et proposa trois sections : Eudialium (espèces à deux étamines), Mesodialium (espèces à cinq étamines) et Neodialium (espèces à dix étamines). Steyaert (1951), suite à la description de nouvelles espèces d’Afrique, d’Amérique tropicale et d’Asie, proposa une subdivision en sous-genres sur base du type de réceptacle. Il identifia deux sous-genres : Arouna (réceptacle en disque pubérulent) et Dialium (réceptacle absent ou peu développé) et scinda le sous-genre Arouna en deux sections sur base de la forme du filament. Plus tard, Hutchinson (1964) reconnut à son tour 70 espèces dans le genre, mais la classification du genre au plan infra-générique ne faisait toujours pas l’unanimité.
9En 1982, Rojo proposa une nouvelle classification en combinant des caractères morphologiques, de la palynologie, de la cytologie et de la phytochimie. Il reconnut finalement 27 espèces dans le genre qu’il réorganisa en sous-genres, sections et sous-sections. Le premier est le sous-genre Arouna dont le réceptacle des fleurs a un disque beaucoup plus large que l’ovaire. Il comprend deux sections : Arouna dont les anthères ont un apex pointu (sous-sections Pirula et Indranentosa dont le filament des étamines est respectivement droit et géniculé et Codarium dont les anthères ont un apex rétu). Les deux autres sous-genres présentent un disque absent, étroit ou aussi large que l’ovaire. Le sous-genre Dialium a cinq sépales. Le sous-genre Dansera a trois sépales et comprend deux sections : Hova (avec trois pétales) et Dansera (dépourvu de pétales).
10Toutefois des incertitudes demeurent. Certaines espèces (par exemple, D. hexasepalum Harms) considérées comme douteuses par Rojo (1982) sont reconnues par l’African Plant Database (version 3.4.0.) qui, à l’inverse, classe d’autres espèces en synonymie (par exemple, D. polyanthum Harms et D. pachyphyllum Harms).
11Finalement, en utilisant les séquences du génome chloroplastique matK, les Dialium ont été classés dans les Dialioidae reconnus comme un clade différent des Caesalpinioideae (LPWG, 2017). Cette sous-famille regroupe à présent 85 espèces et 17 genres dont le plus représenté est le genre Dialium avec 44 espèces recensées (LPWG, 2017 ; Zimmerman et al., 2017).
12Le genre Dialium serait proche des genres Apuleia, Petalostylis et Zenia sur la base de la phylogénie et des séquences chloroplastiques rbcL et matK (Kajita et al., 2001 ; LPWG, 2017).
3. Répartition géographique et description botanique des espèces guinéo-congolaises
3.1. Répartition géographique
13Le genre Dialium a une répartition pantropicale. Il est distribué entre le 19e parallèle nord au Mexique et Belize jusqu'au 23e parallèle sud à Madagascar (Rojo, 1982). En Afrique, on retrouve des représentants du genre du centre du SénégalÒ jusqu’à Maputo en Afrique australe. L’African Plant Database (version 3.4.0.) lui reconnait 30 espèces africaines (y compris malgaches) dont trois incertaines (voir ci-après).
14En considérant les incertitudes susmentionnées, et en confrontant les différents travaux, c’est la région guinéo-congolaise qui comporterait le plus d’espèces. Vingt-deux espèces seraient présentes (en excluant D. graciflorum Harms, D. latifolium Harms, D. poggei Harms dont le statut est unanimement incertain). Ce nombre intègre des espèces rejetées par Rojo (1982) et inclut des espèces qu’il considère comme de bonnes espèces (Tableau 1). La figure 1 présente la distribution géographique par sous-centre d’endémisme (White, 1979 ; White, 1986 ; White, 1993) de 21 espèces pour lesquelles des données d’occurrence sont disponibles.


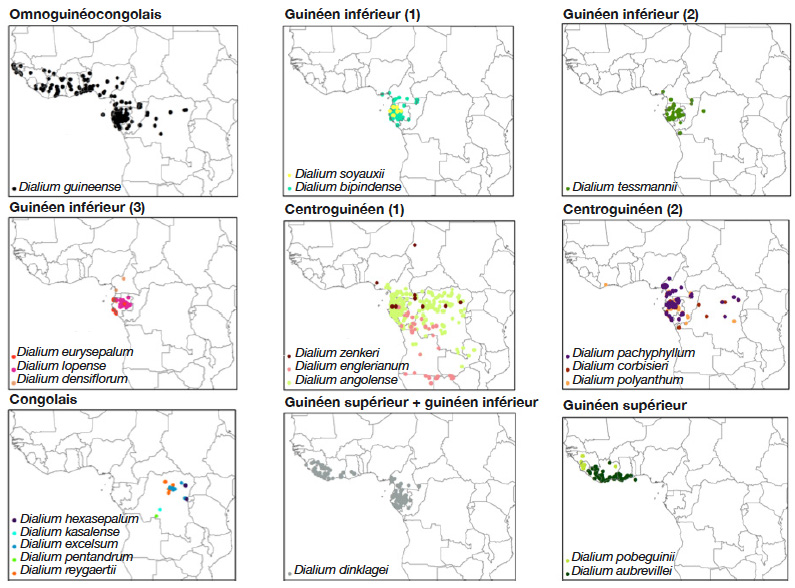 Figure 1. Représentation de la distribution géographique des Dialium par sous-centre d’endémisme dans la région guinéo-congolaise — Geographical distribution of Dialium by sub-centre of endemism in the Guinean-Congolese region.
Figure 1. Représentation de la distribution géographique des Dialium par sous-centre d’endémisme dans la région guinéo-congolaise — Geographical distribution of Dialium by sub-centre of endemism in the Guinean-Congolese region.
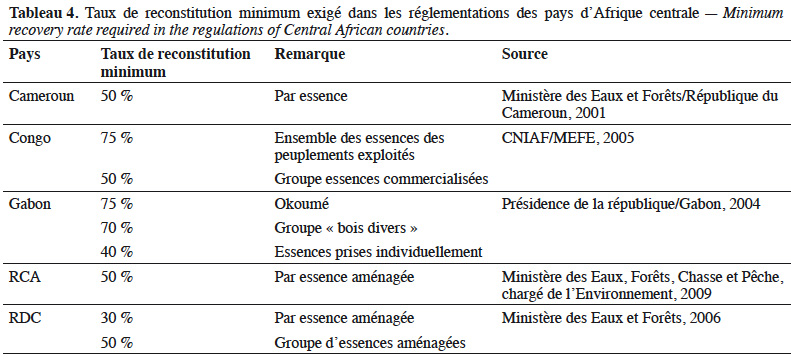
Les points d’occurrence proviennent des bases de données du Conservatoire et Jardin Botaniques de la Ville de Genève (CJBG, 2020), du Catalogue of Life Partnership via Global Biodiversity Information Facility (GBIF, 2020) et de la base de données RAINBIO (ArcGis version 10.4.1) — The points of occurrence come from the databases of the Conservatory and Botanical Garden of the City of Geneva (CJBG, 2020), the Catalogue of Life Partnership via Global Biodiversity Information Facility (GBIF, 2020) and the RAINBIO database (ArcGis version 10.4.1).
3.2. Caractérisation botanique
15La description botanique des espèces du genre Dialium de la région guinéo-congolaise est établie avec détails par plusieurs auteurs. Selon Steyaert (1952), les Dialium sont des arbres moyens ou grands, rarement des arbrisseaux. Leur fût est droit, parfois tortueux. Leur base peut avoir des contreforts moyennement développés. L’écorce est lisse ou écailleuse et la tranche exsude une gomme-résine rouge ou brunâtre. Les feuilles sont composées imparipennées, à pétiole et pétiolules épaissis à la base, ridés transversalement. Les folioles, dont le nombre varie entre 3 et 21, sont généralement subopposées à alternes, parfois opposées. Elles sont entières avec un réticulum plus ou moins dense. Les inflorescences sont des panicules terminales, parfois axillaires. Les bractées cupulaires sont caduques, à indument plus ou moins soyeux. Les boutons pyramidaux ou ellipsoïdes ne dépassent guère 6-7 mm de long, à préfloraison du calice quinconciale. Les fleurs hermaphrodites sont pédicellées ; avec 5 à 6 (7) sépales subégaux ; 0 ou 1(-3), rarement 5 petits pétales, de ± 2 mm de long. Les étamines, généralement 2, parfois 5, rarement 10, sont insérées sur le bord du disque, à filet droit ou géniculé. L’ovaire est sessile et central ou stipité et généralement excentrique, densément velouté. Il est uniloculaire et contient deux ovules. Le style est dressé, aussi long que l'ovaire. Le fruit est une gousse indéhiscente, globulaire ou discoïde, à pulpe entourant une ou deux graines. Celles-ci sont subréniformes, à testa sillonné.
16Rojo (1982) propose une clé d’identification des espèces qui s’avère toutefois peu pratique sur le terrain car elle se base essentiellement sur les caractéristiques des fleurs. Tenant compte d’espèces mises avec certitude en synonymie, de celles pour lesquelles il n’existe pas de consensus et d’autres découvertes ultérieurement (Breteler, 1994), nous proposons une nouvelle clé pour les 22 espèces potentielles de la région guinéo-congolaise. Elle se base essentiellement sur les caractéristiques des feuilles et des fruits, ces derniers demeurant présents assez longtemps à la base des arbres les ayant produits. Toutefois, vu la proximité de certaines espèces, le recours à des caractéristiques florales n’a pu être totalement évité (Tableau 1, Figure 2).
 Figure 2. Partie de (a) fût, (b) plantule et (f) tranche exsudant un liquide poisseux rougeâtre de Dialium lopense ; (c) fleurs de Dialium cf. polyanthum ; (d) fruits et (e) feuilles de Dialium dinklagei — (a) trunck, (b) plant and (f) slash exuding a sticky reddish liquid of Dialium lopense; (c) flowers of Dialium cf. polyanthum; (d) fruits and (e) leaves of Dialium dinklagei.
Figure 2. Partie de (a) fût, (b) plantule et (f) tranche exsudant un liquide poisseux rougeâtre de Dialium lopense ; (c) fleurs de Dialium cf. polyanthum ; (d) fruits et (e) feuilles de Dialium dinklagei — (a) trunck, (b) plant and (f) slash exuding a sticky reddish liquid of Dialium lopense; (c) flowers of Dialium cf. polyanthum; (d) fruits and (e) leaves of Dialium dinklagei.
© J.-L. Doucet
4. Écologie
4.1. Exigences environnementales
17Les espèces du genre Dialium de la région guinéo-congolaise sont rencontrées sous les climats équatoriaux à tropicaux Af, Am et Aw de la classification de Köppen (Kottek et al., 2006). Elles fréquentent divers types d’habitats (Rojo, 1982 ; Pendje, 1994 ; White & Abernethy, 1996 ; Doucet, 2003 ; Lemmens et al., 2012 ; Meunier et al., 2015). Certaines espèces sont observées préférentiellement dans les savanes boisées ou dans les galeries forestières, c’est le cas de D. angolense, D. kasaiensis, D. englerianum et D. guineense. D’autres affectionnent particulièrement les forêts riveraines, notamment D. reygaertii, D. pobeguinii et D. zenkeri. Enfin, certaines sont plutôt indicatrices de forêt sempervirente âgée : D. pachyphyllum, D. pentandrum, etc. La plupart des espèces sont majoritairement retrouvées à des altitudes inférieures à 1 000 m. Toutefois, D. angolense a été observée sur les rochers de quartz entre 700 et 1 275 m d'altitude (Oliver, 1871).
4.2. Densités et structures de population
18Concernant les espèces forestières, les inventaires d’aménagement fournissent, au niveau du genre, de précieuses informations sur les densités et répartitions par classe diamétrique (Réjou-Méchain et al., 2011). L’obtention de données spécifiques est plus délicate, surtout dans le genre Dialium, car la distinction des différentes espèces est une tâche très complexe. Au Gabon, le terme « omvong » regroupe les espèces possédant de 3 à 5 folioles (D. pachyphyllum, D. angolense, D. polyanthum, D. lopense), alors que toutes les autres espèces sont regroupées sous le vocable « eyoum ». Au Cameroun, les espèces ayant 3 à 5 folioles sont appelées « eyoum » et les autres espèces « eyoum rouge, eyoum blanc, eyoum à petites feuilles, etc. ».
19Le tableau 2 présente les données issues d’inventaires d’aménagements de concessions forestières couvrant environ 1 600 000 ha au Cameroun et au Gabon. Ces données indiquent que les densités (diamètre à hauteur de poitrine : dhp ≥ 20 cm) varient selon le type forestier. Elles sont plus élevées en forêts sempervirentes qu’en forêts semi-décidues. Les Dialium ayant de 3 à 5 folioles peuvent atteindre des densités de 6,42 pieds par hectare dans les forêts sempervirentes, alors qu’elles culminent à 0,23 en forêt semi-décidue. Les autres espèces de Dialium atteignent 2,7 pieds en forêt sempervirente et 0,58 dans les forêts semi-décidues. Les figures 3a, 3b, 3c et 3d illustrent les structures de population obtenues pour les deux groupes dans les concessions forestières pour lesquelles les données sont présentées dans le tableau 2. La structure de population est identique pour les deux groupes, qu’on soit en forêt sempervirente ou en forêt semi-décidue. Décroissant de façon exponentielle, elle suggère une régénération assurée dans le long terme. Le groupe des Dialium avec 3 à 5 folioles comprend toutefois des individus pouvant atteindre de plus gros diamètres.
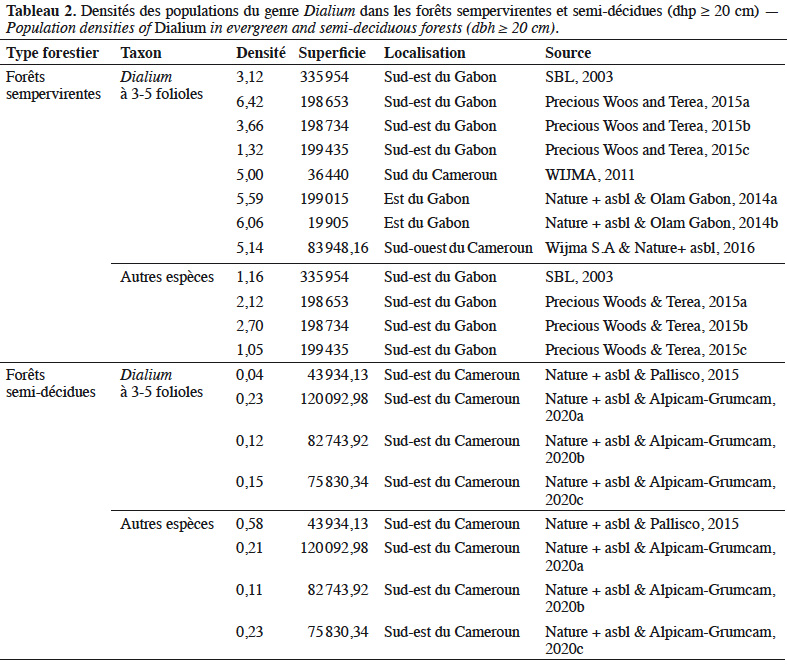
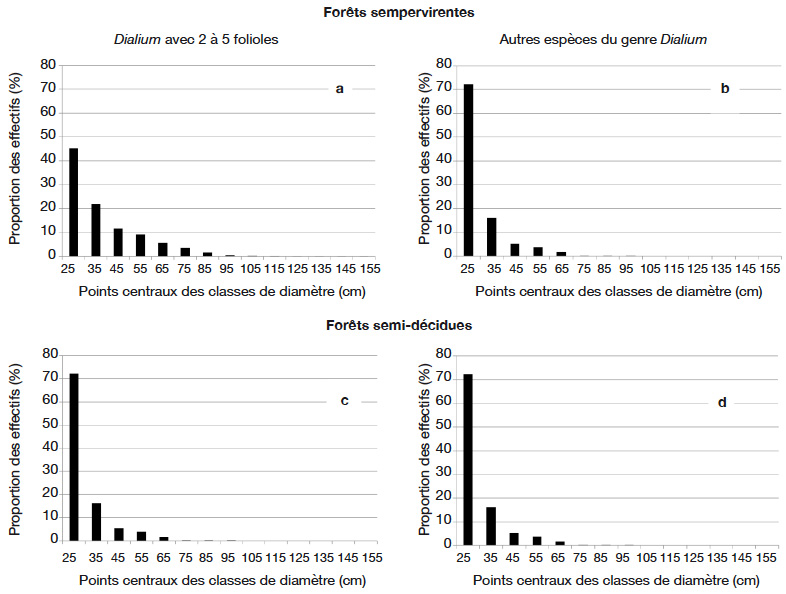 Figure 3. Structures diamétriques globales du genre Dialium dans les forêts sempervirentes et semi-décidues du Cameroun et du Gabon — Global diameter structures of Dialium in evergreen and semi-deciduous forests in Cameroon and Gabon.
Figure 3. Structures diamétriques globales du genre Dialium dans les forêts sempervirentes et semi-décidues du Cameroun et du Gabon — Global diameter structures of Dialium in evergreen and semi-deciduous forests in Cameroon and Gabon.
Source : Tableau 2 — Table 2.
4.3. Phénologie, dispersion des graines et germination
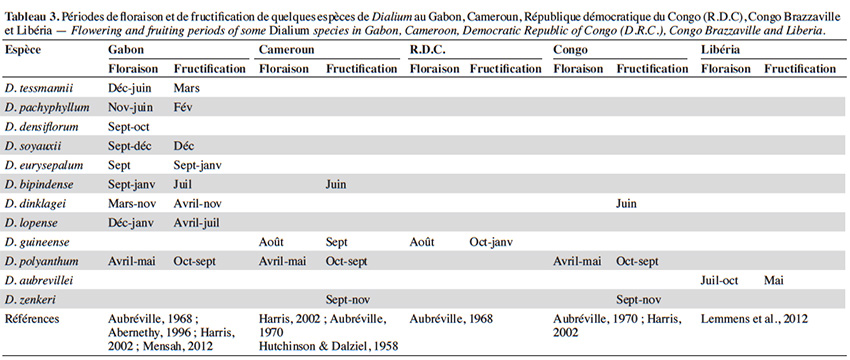
20Les espèces du genre Dialium dominent certaines forêts tropicales sempervirentes de plaine et du bassin central du Congo (Beaune et al., 2013c). La plupart fleurissent en saison des pluies sur une assez longue période (Aubréville, 1968). La présence de fruits a été signalée entre novembre et juillet au Gabon (Lemmens et al., 2012 ; White & Abernethy, 1996). Dialium lopense, par exemple, fleurit entre décembre et janvier et fructifie d’avril à début juillet (White & Abernethy, 2016). Le tableau 3 synthétise les rares informations disponibles sur les périodes de floraison et de fructification des Dialium de la région guinéo-congolaise.
21Les graines de D. aubrevillei ont probablement une dormance de type tégumentaire car les délais de germination peuvent varier de deux semaines à trois mois, avec un taux de germination modéré, généralement proche de 50 % (De La Mensbruge, 1966 ; Lemmens et al., 2012). L’endocarpe des fruits est adapté à l’endozoochorie (Beaune et al., 2013a ; Beaune et al., 2013b). Les graines sont dispersées par les primates (principalement les bonobos et les gorilles), les éléphants ou encore les petits rongeurs (Idani, 1986 ; Beaune et al., 2013a ; Ahoua et al., 2015 ; Haurez, 2015). Plusieurs travaux ont montré que les graines transitant par le tube digestif des primates ont un taux de germination plus élevé que les graines non ingérées (Takasaki, 1983 ; Idani, 1986 ; Beaune et al., 2013b). En outre, d’autres observations ont montré que de petits primates tels que les mangabeys noirs à crête (Lophocebus aterrimus) participaient à la dispersion des graines de Dialium en crachant les graines (souvent égratignées) après dégustation de la pulpe (Beaune et al., 2013a). En l'absence de disperseurs de graines, la dormance peut être interrompue par imitation du processus naturel, permettant à la graine d'absorber de l'eau, de gonfler et d'activer la germination (Beaune et al., 2013b). Beaune et al. (2013b) conseillent, par exemple pour D. corbisieri, de scarifier l’endocarpe à l’aide d’un couteau jusqu’à l’apparition de l’endosperme. Cela permet de passer d’un taux de germination de 0 à 96 %. Par ailleurs, un prétraitement de 5 min à l’acide sulfurique pur (H2SO4) des graines de D. guineense améliorerait sa germination (Todd-Bockarie & Duryea, 1993 ; McDonal & Omoruyi, 2003).
22La germination est phanérocotyle et épigée avec des cotylédons charnus (Rojo, 1982). L’hypocotyle et l’épicotyle mesurent de 2 à 5 cm. Les premières feuilles sont simples et opposées, verticillées par deux ou quatre, à limbe cordiforme ou arrondi à la base et longuement acuminé au sommet (D. aubrevillei, D. dinklagei, D. guineense) (De La Mensbruge, 1966).
5. Aménagement forestier
23En Afrique centrale, les forêts dédiées à la production de bois d’œuvre doivent faire l’objet d’un plan d’aménagement. Celui-ci repose notamment sur un inventaire statistique des ressources ligneuses, l’utilisation de tarifs de cubage, le respect de diamètres minimums légaux d’exploitation, le calcul de taux de reconstitution.
5.1. Tarif de cubage
24Très peu d’équations permettant d’estimer les volumes sont disponibles pour le genre Dialium. L’office national de développement des forêts du Cameroun (Ministère des Forêts et de la Faune, 2005) propose trois tarifs de cubage :
25V = 0,000672D2,07027 (Éq. 1)
26V = 0,00005876 D2,253504 (Éq. 2)
27V = 1,858 - 0,03518D + 0,0010283D2 (Éq. 3)
28où D représente le diamètre de l’arbre en cm, V est le volume de l’arbre en m3.
29L’équation 1 doit être appliquée dans les forêts sempervirentes, l’équation 2 dans les forêts semi-décidues et l’équation 3 dans les forêts de transition (congolaises). Toutefois, ces équations, non spécifiques au genre Dialium, sont potentiellement biaisées (Fayolle et al., 2013 ; Ligot et al., 2018), le nombre d’arbres et la gamme de diamètre ayant permis de les construire n’étant pas précisés (Ligot et al., 2018).
30Pour D. guineense, Akindele (2005) a construit un tarif de cubage à deux entrées (diamètre en cm et hauteur en m), à partir de 12 individus (diamètres compris entre 20 et 158 cm) (Éq. 4) :
31V = -0,0553+ 0,000560D1,3336 H0,9561 (Éq. 4)
32Enfin, au Gabon, pour D. pachyphyllum, Bile Allogho (1999) propose le tarif suivant (Éq. 5) :
33V = 9,72D2,46 (Éq. 5)
34où D représente le diamètre en m et V le volume en m³
5.2. Diamètre minimum d’exploitation (DME)
35Le diamètre minimum d’exploitabilité ou DME est défini par les législations nationales. Il est fixé, pour toutes les espèces du genre Dialium, à 70 cm au Gabon (Loi n°16/01 du 31/12/2001) et en République centrafricaine (Loi n°08.022) et à 60 cm dans les deux Congo (Arrêté n°036/CAB/MIN/ECN-EF ; Décret n°2002-437 du 31/12/2002, article 91). Au Cameroun, il est de 50 cm (D. guineense, D. zenkeri) ou de 60 cm (les autres espèces) (ONADEF, 1992).
5.3. Taux de reconstitution et accroissements diamétriques
36Le taux de reconstitution (%RE) exprime la proportion d’individus exploités au cours d’une rotation (cycle d’exploitation) que l’on retrouvera lors de la rotation suivante. La formule généralement utilisée est celle fournie par Durrieu De Madron & Forni (1997) :
37%RE = 100 [B(1-Δ)(1-α)R)]/A (Éq. 6)
38avec B : effectif des tiges d’avenir susceptibles de dépasser le DME après le temps de rotation, Δ : taux de dégâts dus à l’exploitation, A : nombre de tige de diamètre supérieur au DME en début de rotation, α : taux de mortalité naturelle annuelle, R : rotation (années).
39L’effectif susceptible de dépasser le DME au cours de la rotation dépend de l’accroissement diamétrique moyen. Peu d’informations sont disponibles dans la littérature à ce sujet. Au Cameroun, l’ONADEF (1992) suggère d’utiliser 0,35 cm·an-1 pour D. pachyphyllum et 0,4 cm·an-1 pour les autres espèces. À défaut de données locales, Picard & Gourlet-Fleury (2011) recommandent d’utiliser la valeur de 0,25 cm·an-1 par tous les Dialium.
40Si le taux de reconstitution obtenu n’atteint pas le seuil minimal requis (Tableau 4), le DME devra être relevé afin d’y arriver. On parle alors de DMA (diamètre minimum d’aménagement).
6. Usages
6.1. Bois
41L’anatomie du bois de diverses espèces de Dialium a fait l’objet de plusieurs études et est bien décrite (Steyaert, 1951 ; Steyaert, 1953 ; Rojo, 1982 ; Lemmens et al., 2012). Elle se caractérise par un parenchyme en nombreuses couches tangentielles (2-6 par mm), plus fines que les bandes de tissus fibreux, tantôt continues et rectilignes, tantôt sinueuses et plus ou moins discontinues (Normand & Paquis, 1976).
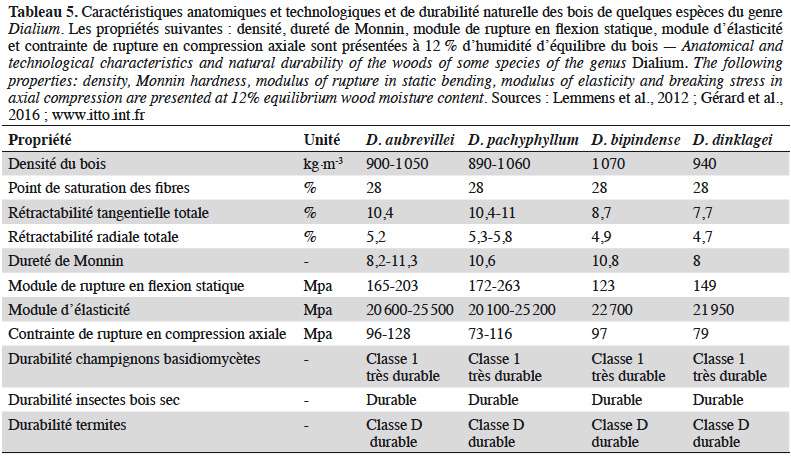
42Les Dialium ont généralement des bois durables, résistants aux champignons, aux termites, aux térébrants marins et aux insectes (Meunier et al., 2015 ; Gérard et al., 2016). Le bois peut être employé en parqueterie, ébénisterie, pour le revêtement extérieur, pour la construction des ponts et d’autres usages industriels en travaux lourds (Gérard et al., 2011 ; Lemmens et al., 2012 ; Meunier et al., 2015 ; Gérard et al., 2016 ; Martin & Vernay, 2016). Par contre, ils ne peuvent être utilisés en milieux marins (Gérard et al., 2016 ; Martin & Vernay, 2016). La classe d’emploi est de type 4 (utilisation en contact avec le sol ou l’eau douce). Le tableau 5 dresse les caractéristiques physico-mécaniques et de durabilité naturelle des espèces étudiées.
43Aucune statistique concernant l’exploitation, la transformation ou la commercialisation des Dialium n’ayant été trouvée, il est raisonnable de penser que les volumes commercialisés sont très faibles. Cela pourrait notamment être dû à la difficulté de transformation de ces espèces. Le bois est en effet particulièrement désaffutant et le recours à des lames au carbure de tungstène est nécessaire (Gérard et al., 2016).
6.2. Usages traditionnels
44Les fruits de Dialium sont récoltés dans certains pays, plus particulièrement dans les régions sèches (Normand & Paquis, 1976 ; Ayessou et al., 2014). Acidulés et sucrés, ils sont très prisés par les populations (Oliver, 1871 ; Wild & Exell, 2007). La poudre des graines est utilisée comme succédané du café en Inde (Rojo, 1982). En pharmacopée, les décoctions d’écorces de D. angolense au Congo ou de D. guineense en Afrique de l’Ouest sont utilisées pour le traitement du paludisme (Yetein et al., 2013 ; Chinsembu, 2015). Dans le domaine magico-religieux, les cendres issues de la combustion d’écorces de D. dinklagei et de la peau de céphalophe bleu (Phitalomba congica) étaient autrefois utilisées au Gabon pour repousser la malchance durant les périodes de chasse et rapporter de gros butins (Raponda-Walker & Sillans, 1961). En artisanat, les écorces étaient utilisées pour la confection d’œuvres d'art et pour sculpter des figures comme des amulettes, des statuettes et des objets d'ornement (Raponda-Walker & Sillans, 1961)
45Enfin, le bois est traditionnellement utilisé dans les constructions de maisons ou de greniers, pour la fabrication de mortiers, de manches d'outils traditionnels, de charbon de bois ou comme bois de chauffage (Raponda-Walker & Sillans, 1961 ; Lokonon et al., 2013).
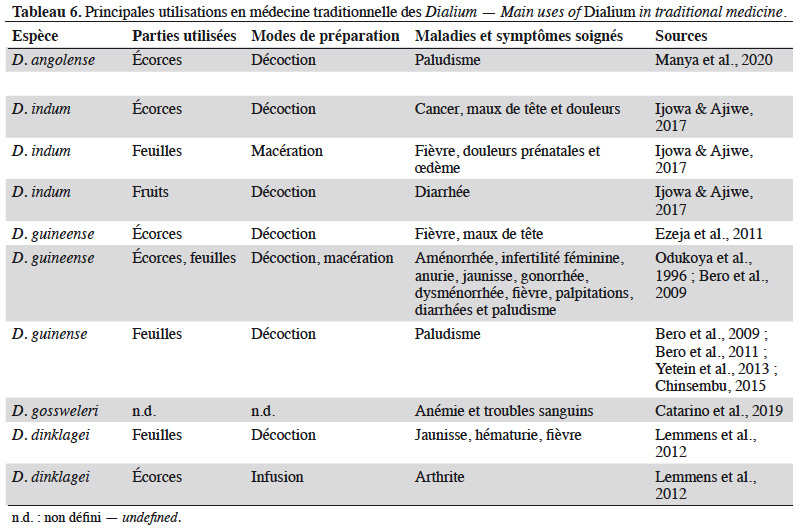
46Le tableau 6 synthétise les principales utilisations connues en médecine traditionnelle de quelques espèces du genre Dialium.
7. Valorisation des propriétés chimiques et biochimiques
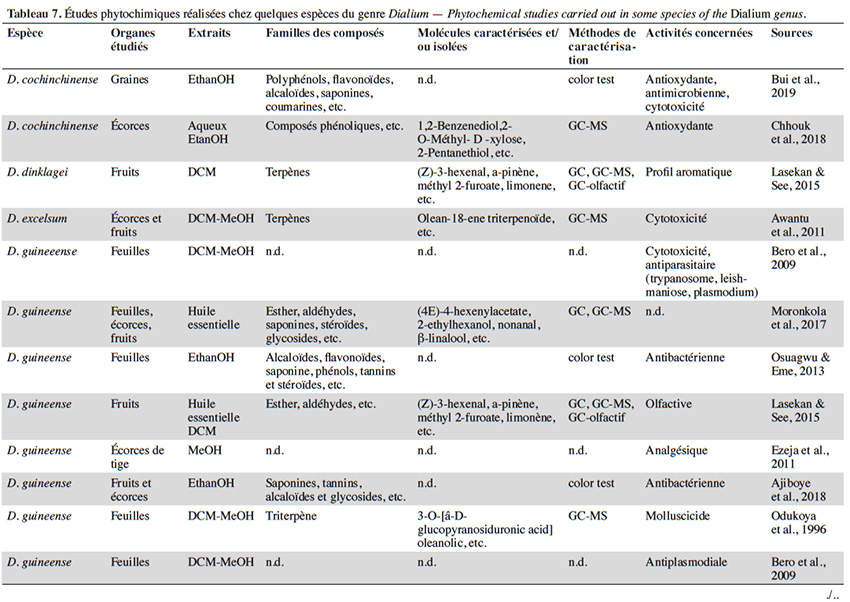
47Les légumineuses comprennent généralement des glycosides cyanogénétiques, des saponines, des tanins, du mucilage et des anthocyanes (Saidi, 2019). Les alcaloïdes y sont aussi généralement communs (Trease & Evans, 2002). De nombreux genres de cette famille ont fait l’objet d’études phytochimiques, mais le genre Dialium demeure encore peu étudié. En effet, sur les 44 espèces de Dialium reconnues à ce jour, nous en avons recensé seulement 5 ayant fait état d’une étude d’activité et/ou d’un screening phytochimique. C’est D. guineense qui est de loin l’espèce la plus étudiée pour ses activités biologiques et sa composition chimique (Ogu et al., 2013 ; Moronkola et al., 2017 ; Ajiboye et al., 2018 ; Gnansounou et al., 2018). Globalement, très peu d’études ont fait état d’un criblage poussé basé sur des méthodes de chromatographie telles que la chromatographie liquide/gazeuse couplée à la spectroscopie de masse (LC-MS/GC-MS). Les activités les plus fréquemment rencontrées chez les espèces du genre Dialium sont de type antioxydant, antibactérien, antimicrobien et antiparasitaire. Certaines espèces permettraient aussi une régulation du taux de sucre dans le sang (Bero et al., 2009 ; Bero et al., 2011 ; Afolabi et al., 2018). Le tableau 7 présente une synthèse des études phytochimiques réalisées sur quelques espèces du genre.
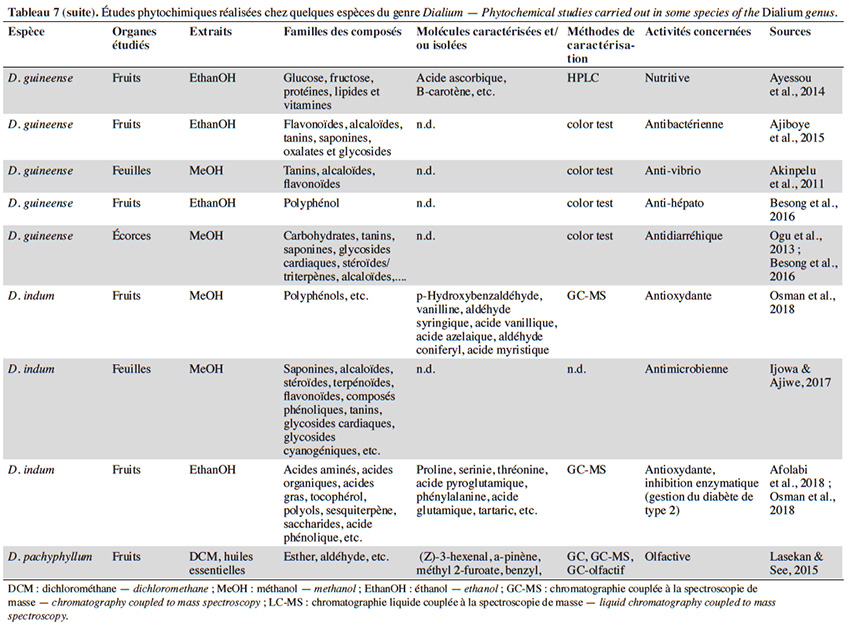
48À ce jour, une seule molécule spécifique au genre a été mise en évidence. Il s’agit d’un triterpène appelé Dialiumoside (ou olean-18-ène) isolé de D. excelsum. Cette molécule a une cytotoxicité contre les cellules KB-3-1 du carcinome du col de l'utérus humain et les cellules KB-V1 multi-résistantes (Awantu et al., 2011).
8. Statut de conservation
49Certaines espèces de Dialium sont répertoriées dans la liste rouge de l’Union Internationale pour la Conservation de la Nature (UICN). La synthèse des statuts de vulnérabilité est dressée au tableau 8. Quatre espèces sont considérées comme menacées. Parmi celles-ci, seule D. hexasepalum est présente dans la région guinéo-congolaise.
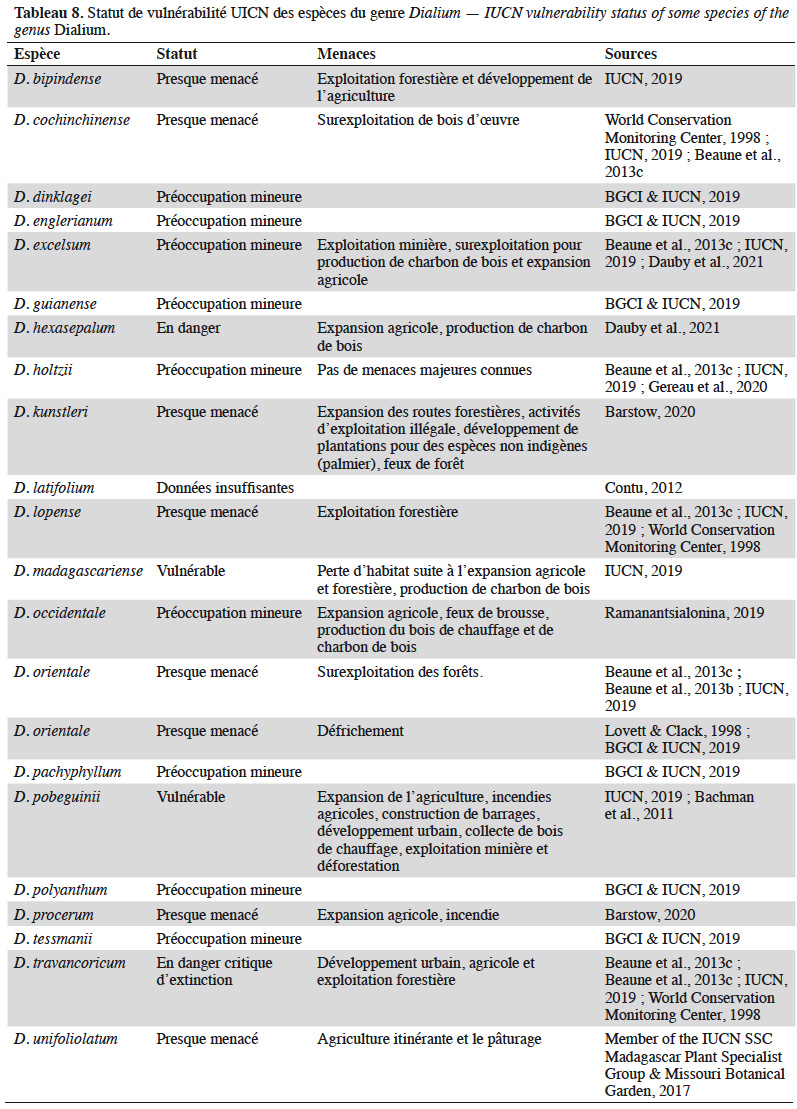
50Selon Beaune et al. (2013c), ces espèces sont aussi menacées à cause de la chasse à but commercial vidant l’écosystème forestier des potentiels disperseurs de graines, dont les primates, ce qui pourrait perturber sur le long terme la dynamique de population de ces espèces (Terborgh et al., 2008 ; Beaune et al., 2013c).
9. Conclusions et perspectives
51De cette synthèse bibliographique, il ressort globalement que le genre Dialium reste très peu étudié. Si le genre est relativement bien documenté au niveau botanique, sa taxonomie est toujours soumise à controverse. De nombreuses espèces n’ont été décrites qu’à partir d’un très faible nombre d’échantillons et divers auteurs proposent de regrouper certaines espèces, mais les mises en synonymie proposées varient selon ces auteurs. Une taxonomie unanimement reconnue serait pourtant l’étape préliminaire à toute étude écologique ou à toute perspective de valorisation. Le recours à des marqueurs moléculaires pourrait permettre de clarifier le statut taxonomique des différents taxons abordés dans cette synthèse.
52Les connaissances en écologie (tempérament, croissance, reproduction, régénération) sont très lacunaires. Les paramètres (mortalité naturelle, croissance) utilisés lors des aménagements forestiers sont en conséquence imprécis.
53Les propriétés physico-mécaniques du bois ont été étudiées pour un nombre limité d’espèces. Par ailleurs, sur les 22 espèces potentielles de la région guinéo-congolaise, à peine trois ont fait l’objet d’un criblage phytochimique et/ou d’études de leurs activités biochimiques.
54Pourtant, dans un contexte de raréfaction des essences commerciales principales, il est indispensable de mieux valoriser les ressources en limitant la pression sur les espèces principales et en valorisant les coproduits issus de la transformation du bois. À l’inverse d’espèces dont les propriétés technologiques semblent proches (par exemple l’azobé, Lophira alata), les populations de Dialium affichent des structures de population particulièrement favorables à une reconstitution de la ressource sur le long terme (Biwolé et al., 2019).
55La transformation du bois devrait idéalement s’accompagner d’une valorisation des molécules issues des coproduits du sciage, d’autant que les quelques données biochimiques disponibles laissent entrevoir des perspectives particulièrement intéressantes. Ce secteur d’activité, qui est déjà très développé en Europe (par exemple, la fabrication des premiers aérogels par condensation des tanins, Szczurek et al., 2019), en est encore à ses balbutiements en Afrique. Les principes actifs issus du métabolisme secondaire des plantes sont pourtant utilisés depuis des époques très anciennes, par exemple pour leur potentiel antiparasitaire (Bakkali et al., 2008)
56En outre, la forte présomption de présence de polyphénols au sein des espèces du genre Dialium laisse entrevoir des perspectives potentiellement très intéressantes dans les domaines pharmaceutique, cosmétique et/ou agro-alimentaire.
Remerciements
57Nous remercions l’ensemble des sociétés dont les données d’aménagement forestier ont été valorisées (Pallisco, CEB-Precious Woods, GRUMCAM, SBL, Wijma). Nous remercions le projet PPECF EHPVAL (Essences à Haut Potentiel de Valorisation), les fonds ERASMUS et l’asbl Nature + pour le financement de nos travaux.
Bibliographie
Abernethy K., 1996. Génétique des arbres de la forêt tropicale humide (étude pilote). Bruxelles : AGRECO-CTFT.
Afolabi O.B., et al., 2018. In vitro antioxidant potential and inhibitory effect of hydro-ethanolic extract from African black velvet tamarind (Dialium indium) pulp on type 2 diabetes linked enzymes. Potravinarstvo Slovak J. Food Sci., 12(1), 413-421, doi.org/10.5219/911
African Plant Database (version 3.4.0.), 2021. http://africanplantdatabase.ch. Genève, Suisse : Conservatoire et Jardin botaniques de la Ville de Genève ; Pretoria : South African National Biodiversity Institute.
Ahoua A.R.C., Konan A.G., Bonfoh B. & Koné M.W., 2015. Antimicrobial potential of 27 plants consumed by chimpanzees (Pan troglodytes verus Blumenbach) in Ivory Coast. BMC Complementary Altern. Med., 15(1), 1-12, doi.org/10.1186/s12906-015-0918-7
Ajiboye A.E., Ameen M.T. & Adedayo M.R., 2015. Antimicrobial activity and phytochemical screening of the fruit pulp of Dialium guineense (velvet tamarind) on some microbial isolates. J. Microbiol. Antimicrob., 7(4), 33-41, doi.org/10.5897/jma2014.0332
Ajiboye A.E. et al., 2018. Antibacterial activity of the seed of Dialium guineense against selected enteric bacteria. Covenant J. Phys. Life Sci., 6(2), 1-10.
Akindele S.O., 2005. Volume functions for common timber species of Nigeria’s forests - a technical document. Phd thesis: University of British Columbia, Vancouver (Canada); Federal University of Technology, Akure (Nigeria).
Akinpelu A.D. et al., 2011. Anti-vibrio and preliminary phytochemical characteristics of crude methanolic extracts of the leaves of Dialium guineense (Wild). J. Med. Plants Res., 5(11), 2398-2404, doi.org/10.5897/JMPR.9000116
ATIBT (Association Technique Internationale des Bois Tropicaux, 2017. Rapport d’activité 2017. Paris : ATIBT.
Aubréville A., 1968. Flore du Gabon. Légumineuse-Caesalpinioïdées. Paris : Museum National d’Histoire Naturelle.
Aubréville, 1970. Flore du Cameroun. T. 9. Paris : Museum National d’Histoire Naturelle.
Awantu A.F. et al., 2011. Dialiumoside, an olean-18-ene triterpenoid from Dialium excelsum. Z. Naturforsch., 66, 624-628, doi.org/10.1515/znb-2011-0610
Ayessou N.C. et al., 2014. Nutrient composition and nutritional potential of wild fruit Dialium guineense. J. Food Compos. Anal., 34(2), 186-191, doi.org/10.1016/j.jfca.2014.01.002
Bachman S. et al., 2011. Supporting red list threat assessments with GeoCAT: geospatial conservation assessment tool. ZooKeys, 150, 117-126, doi.org/10.3897/zookeys.150.2109
Bakkali F., Averbeck S., Averbeck D. & Idaomar M., 2008. Biological effects of essential oils – A review. Food Chem. Toxicol., 46, 446-475, doi.org/10.1016/j.fct.2007.09.106
Barstow M., 2020. Dialium kunstleri. The IUCN Red List of Threatened Species 2020: e.T62023205A62023207, https://dx.doi.org/10.2305/IUCN.UK.2020-3.RLTS.T62023205A62023207.en, (15/06/2021).
Beaune D. et al., 2013a. The Bonobo – Dialium positive interactions: seed dispersal mutualism. Am. J. Primatol., 403, 394-403, doi.org/10.1002/ajp.22121
Beaune D. et al., 2013b. Artificial germination activation of Dialium corbisieri by imitation of ecological process. J. Sustainable For., 32(6), 565-575, doi.org/10.1080/10549811.2013.780199
Beaune D. et al., 2013c. Seed dispersal strategies and the threat of defaunation in a Congo forest. Biodivers. Conserv., 22, 225-238, doi.org/10.1007/s10531-012-0416-x
Bero J. et al., 2009. In vitro antiplasmodial activity of plants used in Benin in traditional medicine to treat malaria. J. Ethnopharmacol., 122(3), 439-444, doi.org/10.1016/j.jep.2009.02.004
Bero J. et al., 2011. In vitro antitrypanosomal and antileishmanial activity of plants used in Benin in traditional medicine and bio-guided fractionation of the most active extract. J. Ethnopharmacol., 137(2), 998-1002, doi.org/10.1016/j.jep.2011.07.022
Besong E.E. et al., 2016. Medicinal and economic value of Dialium guineense. Afr. J. Biomed. Res., 19(3), 163-170.
BGCI (Botanic Gardens Conservation International) & IUCN SSC Global Tree Specialist Group, 2019. Dialium guianense. The IUCN Red List of Threatened Species 2019: e.T62023187A146782202, https://dx.doi.org/10.2305/IUCN.UK.2019-2.RLTS.T62023187A146782202.en, (21/06/2021).
Bile Allogho J., 1999. Étude sur les ressources forestières du Gabon. Rome : FAO.
Biwolé A.B., 2015. Origine et dynamique des populations d’arbres des forêts denses humides d’Afrique Centrale, le cas de Lophira alata Banks ex Gaertn C.F. (Ochnaceae). Thèse de doctorat : Gembloux Agro-Bio Tech - Université de Liège (Belgique).
Biwolé A.B. et al., 2019. Dynamique des populations d'azobé, Lophira alata Banks ex C.F. Gaertn., et implications pour sa gestion durable au Cameroun. Bois For. Trop., 342, 55-68, doi.org/10.19182/bft2019.342.a31670
Breteler F.J., 1994. Novitates gabonenses (14). Dialium lopense, a new leguminosae-Caesalpinioidae from central Gabon. Bull. Jardin Bot. National Belg., 63, 201-204
Bui L.T.K. et al., 2019. Evaluation of antimicrobial, antioxidant and cytotoxic activities of Dialium cochinchinensis seed extract. Indian J. Pharm. Sci., 81(5), 975-980, doi.org/10.36468/pharmaceutical-sciences.594
Catarino S. et al., 2019. Conservation and sustainable use of the medicinal Leguminosae plants from Angola. PeerJ, 7, e6736, doi.org/10.7717/peerj.6736
Chhouk K., Wahyudiono, Kanda H. & Goto M., 2018. Efficacy of supercritical carbon dioxide integrated hydrothermal extraction of Khmer medicinal plants with potential pharmaceutical activity. J. Environ. Chem. Eng., 6(2), 2944-2956, doi.org/10.1016/j.jece.2018.04.036
Chinsembu K.C., 2015. Plants as antimalarial agents in Sub-Saharan Africa. Acta Trop., 152, 32-48, doi.org/10.1016/j.actatropica.2015.08.009
CJBG, 2020. http://africanplantdatabase.ch, (21/06/2021).
CNIAF/MEFE, 2005. Normes nationales d’inventaire d’aménagement forestier. Brazzaville : CNIAF/MEFE.
Contu S., 2012. Dialium latifolium. The IUCN Red List of Threatened Species 2012: e.T19892460A20066610, https://dx.doi.org/10.2305/IUCN.UK.2012.RLTS.T19892460A20066610.en, (21/06/2021).
Dauby G., Simo-Droissart M. & Tack W., 2021. Dialium excelsum. The IUCN Red List of Threatened Species (2021): e.T33466A137509491, https://dx.doi.org/10.2305/IUCN.UK.2021-1.RLTS.T33466A137509491.en, (21/06/2021).
De La Mensbruge G., 1966. La germination et les plantules des essences arborées de la forêt dense humide de la Côte d'Ivoire. Nogent-sur-Marne, France : CTFT.
Doucet J.-L., 2003. L’alliance délicate de la gestion forestière et de la biodiversité dans les forêts du centre du Gabon. Gembloux, Belgique : Faculté universitaire des Sciences agronomiques de Gembloux.
Durrieu De Madron L. & Forni E., 1997. Aménagement forestier dans l'Est du Cameroun. Bois For. Trop., 254, 39-50.
Ezeja M., Omeh Y., Ezeigbo L. & Ekechukwu A., 2011. Evaluation of the analgesic activity of the methanolic stem bark extract of Dialium guineense (Wild). Ann. Med. Health Sci. Res., 1(1), 55-62.
Fayolle A. et al., 2013. Réviser les tarifs de cubage pour mieux gérer les forêts du Cameroun. Bois For. Trop., 317(3), 35-49, doi.org/10.19182/bft2013.317.a20521
FRM (Forêt Ressource Management), 2018. Vision stratégique et industrialisation de la filière bois dans les 6 pays du bassin du Congo, horizon 2030. Rapport stratégique régional. Montpellier, France : FRM.
Fusée Aublet J.B.C., 1775. Histoire des plantes de la Guiane Françoise. Vol. 3 T. 5. Paris : Pierre-François Didot.
Gérard J. et al., 2011. Tropix 7: the main technological characteristics of 245 tropical wood species. Montpellier, France : CIRAD, dx.doi.org/10.5281/zenodo.44995
Gérard J., Guibal D., Paradis S. & Cerre J.-C., 2016. Atlas des bois tropicaux : caractéristiques technologiques et utilisations. Versailles, France : Éditions Quæ.
Gereau R.E. et al., 2020. Dialium holtzii. The IUCN Red List of Threatened Species 2020: e.T34633A2853590, https://dx.doi.org/10.2305/IUCN.UK.2020-3.RLTS.T34633A2853590.en, (21/06/2021)
GBIF, 2020. Dialium L., https://www.gbif.org/fr/species/2970932, (22/06/2021).
Gnansounou S.M. et al., 2018. Dialium guineense Willd. Parkia biglobosa (Jacq.) R. Br. Ex Benth. and Tamarindus indica L.: review of known and synergetic bioactive compounds. J. Med. Plants Stud., 6(3), 103-111.
Gorel A.P., Fayolle A. & Doucet J.L., 2015. Écologie et gestion des espèces multi-usages du genre Erythrophleum (Fabaceae-Caesalpinioideae) en Afrique (synthèse bibliographique). Biotechnol. Agron. Soc. Environ., 19(4), 415-429.
Harms H.A.T., 1915. Leguminosae africanae. VIII. Bot. Jahrb. Systematik Pflanzengeschichte
Pflanzengeographie, 53, 467.
Harris D.J., 2002. The vascular plants of the Dzanga-Sangha reserve, Central African Republic. Scr. Bot. Belgica, 23, 274.
Haurez B., 2015. Rôle du gorille des plaines de l'ouest (Gorilla gorilla gorilla) dans la régénération des forêts denses humides et interaction avec l'exploitation sélective de bois d'œuvre. Thèse de doctorat : Gembloux Agro-Bio Tech - Université de Liège (Belgique).
Hutchinson J., 1964. The genera of flowering plants. Dicotyledones, vol. 1. Oxford: Clarendon Press.
Hutchinson J. & Dalziel J.M., 1958. Flora of west tropical Africa: vol. 1 part 2. London: Crown Agents for Oversea Governments, 444-478.
Idani G., 1986. Seed dispersal by pygmy chimpanzees (Pan paniscus). A preliminary report. Primates, 27, 441-447.
Ijowa K.I. & Ajiwe V., 2017. Phytochemical screening of Dialium indum leaf extract (velvet tamarind). Int. J. Phytopharmacy, 7(1), 6-13.
IUCN, 2019. The IUCN Red List of Threatened Species. Version 2019-2, www.iucnredlist.org, (15/06/2021).
Kajita T. et al., 2001. rbcL and legume phylogeny, with particular reference to Phaseoleae, Millettieae, and allies. Syst. Bot., 26(3), 515-536, doi.org/10.1043/0363-6445-26.3.515
Karsenty A. & Gourlet-Fleury S., 2006. Assessing sustainability of logging practices in the Congo Basin’s managed forests: the issue of commercial species recovery. Ecol. Soc., 11(1), 26, doi.org/10.5751/ES-01668-110126
Kottek M. et al., 2006. World map of the Köppen-Geiger climate classification updated. Meteorol. Z., 15(3), 259-263, doi.org/10.1127/0941-2948/2006/0130
Koyo J.P., 1982. Les forêts congolaises d'aujourd'hui et celles de demain. Bois For. Trop., 196, 17-23.
Lasekan O. & See N.S., 2015. Key volatile aroma compounds of three black velvet tamarind (Dialium) fruit species. Food Chem., 168, 561-565, doi.org/10.1016/j.foodchem.2014.07.112
Lemmens R.H.M.J., Louppe D. & Oteng-Amoako A.A., eds, 2012. Bois d’œuvre 2. Wageningen, Pays-Bas : PROTA.
Ligot G. et al., 2018. Réviser les tarifs de cubage pour prendre en compte l'évolution de la ressource au Cameroun. Bois For. Trop., 338, 57-71, doi.org/10.19182/bft2018.338.a31677
Linnaeus C., 1767. Systema naturae. 12th ed. Holmiæ (Stockholm): Laurentius Salvius.
Lokonon B.E. et al., 2013. Structural and ethnobotanical characterization of velvet tamarind (Dialium guineense Willd), a multipurpose tree species. Agron. Afr., 25(2), 121-131.
Lovett J. & Clarke G.P., 1998. Dialium orientale. The IUCN Red List of Threatened Species 1998:e.T33467A9780615, https://dx.doi.org/10.2305/IUCN.UK.1998.RLTS.T33467A9780615.en, (08/04/2021).
LPWG, 2017. A new subfamily classification of the Leguminosae based on a taxonomically comprehensive phylogeny: the Legume Phylogeny Working Group (LPWG). Taxon, 66, 44-77, doi.org/10.12705/661.3
Macdonald I. & Omoruyi O., 2003. Effect of seed pre-treatment on germination of two surface types of Dialium guineense. Seed Technol., 25(1), 41-44.
Makemba R.N. et al., 2019. Cylicodiscus gabunensis Harms : une espèce prisée dans le commerce international (synthèse bibliographique). Biotechnol. Agron. Soc. Environ., 23(3), 188-202, doi.org/10.25518/1780-4507.18006
Manya M.H. et al., 2020. Antimalarial herbal remedies of Bukavu and Uvira areas in DR Congo: an ethnobotanical survey. J. Ethnopharmacol., 249, 112422, doi.org/10.1016/j.jep.2019.112422
Martin P. & Vernay M., 2016. Guide d'utilisation des bois africains éco-certifiés en Europe. Atibt.
Members of the IUCN SSC Madagascar Plant Specialist Group & Missouri Botanical Garden, 2017. Dialium unifoliolatum. The IUCN Red List of Threatened Species 2017: e.T65523583A66159480, https://dx.doi.org/10.2305/IUCN.UK.2017-3.RLTS.T65523583A66159480.en, (16/06/2021).
Mensah J.K., 2012. Dialium pachyphyllum Harms. Wageningen, Pays-Bas : PROTA4U, http://www.prota4u.org/search.asp, (15/06/2021).
Meunier Q., Doucet J.-L. & Moumbogou C., 2015. Arbres utiles du Gabon. Gembloux, Belgique : Les Presses agronomiques de Gembloux.
Ministère des Eaux et Forêts/République du Cameroun, 2001. Arrêté nº0222/A/MINEF, 2001 fixant les procédures d'élaboration, d'approbation, de suivi et de contrôle de la mise en œuvre des plans d’aménagement des forêts de production du domaine forestier permanent. Yaoundé : Ministère des Eaux et Forêts.
Ministère des Forêts et de la Faune, 2005. Le cadre juridique des forêts et de l'environnement au Cameroun - Recueil de texte. RIDACC.
Ministère des Eaux, Forêts, Chasse et Pêche, Chargé de l’Environnement, 2009. Normes nationales d’élaboration des plans d’aménagement. Bangui : Ministère des Eaux, Forêts, Chasse et Pêche, Chargé de l’Environnement.
Ministère des Eaux et Forêts, 2006. Arrêté ministériel n°034/CAB/Min/ECN-EF/2006 du 05 octobre 2006 révisé le 03/03/2015 portant composition, organisation et fonctionnement des conseils consultatifs provinciaux des forêts. Kinshasa : Ministère des Eaux et Forêts.
Moronkola D., Kunle O., Olaoluwa O. & Ogukwe C., 2017. Chemical compositions of Dialium guineense Willd. Leaf, stem-bark and fruit essential oils. J. Complementary Altern. Med. Res., 3(4), 1-8, doi.org/10.9734/jocamr/2017/35129
Nature + asbl & Alpicam-Grumcam, 2020a. Plan d'aménagement. Unité forestière d'aménagement n°10.026. Région de l'Est. Douala, Cameroun.
Nature + asbl & Alpicam-Grumcam, 2020b. Plan d'aménagement. Unité forestière d'aménagement n°10.051. Région de l'Est. Douala, Cameroun.
Nature + asbl & Alpicam-Grumcam, 2020c. Plan d'aménagement. Unité forestière d'aménagement n°10.053. Région de l'Est. Douala, Cameroun.
Nature + asbl & Olam Gabon, 2014a. Plan d'aménagement. Concession forestière Mouniandji. Walhain Saint-Paul, Belgique.
Nature + asbl & Olam Gabon, 2014b. Plan d'aménagement. Concession forestière Ngouadi. Walhain Saint-Paul, Belgique.
Nature + asbl & Pallisco, 2015. Plan d'aménagement. Unité forestière d'aménagement n°10.047b. Région de l'Est. Douala, Cameroun.
Normand D. & Paquis J., 1976. Manuel d’identification des bois commerciaux – tome 2 : Afrique guinéo-congolaise. Nogent-sur-Marne, France : CTFT, http://agritrop.cirad.fr/322997/, (15/06/2021).
Odukoya O.A. et al., 1996. Molluscicidal triterpenoid glycosides of Dialium guineense. J. Nat. Prod., 3864(96), 632-634, doi.org/10.1021/np9604137
Ogu G.I., Ezeadila J. & Ehiobu J.M., 2013. Antioxidant and antimicrobial activities of Dialium guineense (Willd) leaf extract. Pharmacy Pharmacol. Res., 1(1), 1-7.
Oliver D., 1871. Flora of tropical Africa. Vol. II. Leguminosae to Ficoideae. Ashford, UK: L. Reeve & Co.
ONADEF (Office National de Développement des Forêts), 1992. Norme d'études d'arbres. Yaoundé : Ministère de l'Environnement et des Forêts.
Osman M.F., Hassan N.M., Khatib A. & Tolos S.M., 2018. Antioxidant activities of Dialium indum L. fruit and gas chromatography-mass spectrometry (GC-MS) of the active fractions. Antioxidants, 7(11), doi.org/10.3390/antiox7110154
Osuagwu G.G.E. & Eme C.F., 2013. The phytochemical composition and antimicrobial activity of Dialium guineense, Vitex doniana and Dennettia tripetala leaves. Asian J. Nat. Appl. Sci., 2(3), 69-81.
Pendje G., 1994. Stratégies de régénération de neuf essences commerciales de forêt tropicale (Mayombe, Zaïre). Thèse de doctorat : Université Pierre et Marie Curie, Paris (France).
Picard N. & Gourlet-Fleury S., 2011. Optimisation des hypothèses et paramètres d’aménagement. Projet d’aménagement des petits permis forestiers gabonais (PAPPFG). Rapport technique de mission, avril-juin 2011, RT 1106 NP&SGF, CIRAD, Libreville, Gabon.
Présidence de la République/Gabon, 2004. Décret n°689/PR/MEFEPEPN du 24 août 2004 définissant les normes techniques d’aménagement et de gestion durable des forêts domaniales productives enregistrées. Libreville : Présidence de la République.
Precious Woods & Terea, 2015a. Plan d’aménagement 2000 – 2024. Version révisée 2015. UFA 1 Bambidie. Libreville, Gabon.
Precious Woods & Terea, 2015b. Plan d’aménagement 2000 – 2024 Version révisée 2015. UFA 2Okondja. Libreville, Gabon.
Precious Woods & Terea, 2015c. Plan d’aménagement 2000 – 2024 Version révisée 2015. UFA 3 Léléama. Libreville, Gabon.
Ramanantsialonina R.N., 2019. Dialium occidentale. The IUCN Red List of Threatened Species 2019: e.T128114017A128115062, https://dx.doi.org/10.2305/IUCN.UK.2019-2.RLTS.T128114017A128115062.en, (16/06/2021).
Raponda-Walker & Sillans R., 1961. Les plantes utiles du Gabon. Paris : Éditions Paul Lechevalier.
Réjou-Méchain M. et al., 2011. Detecting large-scale diversity patterns in tropical trees: can we trust commercial forest inventories? For. Ecol. Manage., 261(2), 187-194, doi.org/10.1016/j.foreco.2010.10.003
Reborredo F., 2013. Socio-economic, environmental, and governance impacts of illegal logging. Environ. Syst. Decis., 33(2), 295-304, doi.org/10.1007/s10669-013-9444-7
Rojo J.P., 1982. Studies in the genus Dialium (Cassieae-Caesalpinioideae). Phd thesis: University of Oxford Linacre (United Kingdom).
Saidi I., 2019. Caractérisation et valorisation d’une plante de la famille des Fabaceae : Gleditsia triacanthos de la région de Sidi Bel Abbès : Extraction des substances bioactives. Thèse de doctorat : Université El Djillali Sidi Bel Abbès (Algérie).
SBL (Société des Bois de Lastoursville), 2003. Plan d’aménagement forestier de la concession forestière sous aménagement durable SBL/TRB. Lastoursville, Gabon : SBL.
Steyaert R.L., 1951. Contribution à l’étude du genre Dialium. Bull. Soc. R. Bot. Belg./ Bull. Koninklijke Belg. Bot. Vereniging, 1, 29-45, https://www.jstor.org/stable/20792116, (16/06/2021).
Steyaert R., 1952. Caesalpiniaceae V. - Cassieae. In : Boutique R., éd. Flore du Congo Belge et du Ruanda-Urundi, Spermatophytes. Vol. 3. Bruxelles : INEAC, 495-545.
Steyaert R.L., 1953. Étude sur les rapports entre les genres Uittienia, Dansera et Dialium (Legum.-Caesalp.). Vol. 2. Part 2. Bogor, Indonesia: Herbarium Bogoriense, Kebun Raya Bogor, 351-355.
Szczurek A., Fierro V., Medjahdi G. & Celzard A., 2019. Carbon aerogels prepared by autocondensation of flavonoid tannin. Carbon Resour. Convers., 2(1), 72-84, doi.org/10.1016/j.crcon.2019.02.001
Takasaki H., 1983. Seed dispersal by chimpanzees: a preliminary note. Afr. Study Monogr., 3, 105-108.
Taubert P., 1892. Leguminosae. In: Engler A. & Prantl K., eds. Die natürlichen Pflanzenfamilien. III. 3. Leipzig, Deutschland: W. Engelmann, 70-388.
Terborgh J. et al., 2008. Tree recruitment in an empty forest. Ecology, 89(6), 1757-1768, doi.org/10.1890/07-0479.1
Todd-Bockarie A.H. & Duryea M.L., 1993. Seed pretreatment methods to improve germination of the multipurpose West African forest species Dialium guineense. For. Ecol. Manage., 57(1-4), 257-273.
Trease G.E. & Evans W.C., 2002. Pharmacognosy. 15th ed. London: Saunders.
Vantomme P., 1991. The timber export potential from the Brazilian amazon. Bois For. Trop., 22, 69-74.
WIJMA S.A., 2011. Plan d’aménagement durable UFA 09 021. Douala, Cameroun : FORM Ecology Consultants SARL.
WIJMA Cameroun S.A. & Nature + asbl, 2016. Plan d'aménagement. Unité forestière d'aménagement n°00.003. Région : Centre, Sud et Littoral. Douala, Cameroun : FORM Ecology Consultants SARL.
White F., 1979. The Guineo-Congolian region and its relationship to other phytochoria. Bull. Jard. Bot. Nat. Belg., 49, 11-55.
White F., 1986. La végétation de l’Afrique. Mémoire accompagnant la carte de végétation de l’Afrique Unesco/AETFAT/UNSO. Paris : ORSTOM & UNESCO.
White F., 1993. The AETFAT chorological classification of Africa: history, methods and applications. Bull. Nat. Jard. Bot. Nat. Belg., 62, 225-281.
White L. & Abernethy K.A., 1996. Guide de la végétation de la réserve de la Lopé, Gabon. Libreville : Multipress-Gabon.
Wild H. & Exell A.W., 2007. Flora Zambesiaca – Mozambique, Federation of Rhodesia and Nyasaland, Bechuanaland Protectorate. London: Kew, 117-118.
Willdenow C.L., 1796. Archiv für die Botanik. Leipzig, Deutschland: Schäferischen Buchhandlung.
World Conservation Monitoring Centre, 1998. Dialium lopense. The IUCN Red List of Threatened Species 1998: e.T37495A10053709, https://dx.doi.org/10.2305/IUCN.UK.1998.RLTS.T37495A10053709.en, (21/06/2021).
Yetein M.H. et al., 2013. Ethnobotanical study of medicinal plants used for the treatment of malaria in plateau of Allada, Benin (West Africa). J. Ethnopharmacol., 146(1), 154-163, doi.org/10.1016/j.jep.2012.12.022.
Zimmerman E., Herendeen P.S., Lewis G.P. & Bruneau A., 2017. Floral evolution and phylogeny of the Dialioideae, a diverse subfamily of tropical legumes 1. Am. J. Bot., 104(7), 1019-1041, doi.org/10.3732/ajb.1600436.






