- Home
- Volume 25 (2021)
- numéro 4
- Diversité de la régénération des ligneux dans les plantations forestières au centre de la Côte d’Ivoire
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Diversité de la régénération des ligneux dans les plantations forestières au centre de la Côte d’Ivoire

Attached document(s)
original pdf fileRésumé
Description du sujet. La Côte d’Ivoire a une longue histoire d'utilisation d’espèces exotiques dans les activités de reboisement. Sa stratégie de reboisement a été basée à plus de 70 % sur Tectona grandis L.f., Cedrela odorata L. et Gmelina arborea Roxb. Très peu d’études ont permis de juger ces activités de reboisement sur la base de leur capacité à maintenir une diversité floristique ligneuse issue de la végétation initiale.
Objectifs. La présente étude a pour objectif d’analyser l’incidence des plantations forestières à base d’espèces exotiques sur la régénération naturelle des arbres et arbustes dans une des forêts de reboisement.
Méthode. La méthodologie d’échantillonnage stratifiée a permis de réaliser des inventaires dans quatre types d’habitat : les monocultures de tecks jeunes et âgées, les plantations plurispécifiques et les reliques forestières. Les individus adultes, les jeunes arbres et jeunes plants ont été dénombrés et leurs diamètres à hauteur de poitrine ont été mesurés.
Résultats. Les reliques de forêt sont plus riches et plus diversifiées que les espaces de reboisements aussi bien chez les individus adultes que les jeunes arbres. Pour les jeunes plants, la diversité est similaire entre les différents habitats. Dans les différents habitats, les espèces les plus abondantes et les plus importantes sont exotiques. L’une d’entre elles, Cedrela odorata, a une abondance relativement remarquable dans les reliques forestières.
Conclusions. Les tendances constatées dans la recolonisation des surfaces reboisées suggèrent que les nouvelles plantations devraient utiliser, sur les mêmes parcelles, plusieurs espèces exotiques et/ou indigènes pour améliorer la diversité végétale.
Abstract
Diversity of woody regeneration in forest plantations at the Center of Côte d'Ivoire
Description of the subject. Côte d'Ivoire has a long history of using exotic species in reforestation activities. Its reforestation strategy has been more than 70% based on Tectona grandis L.f., Cedrela odorata L. and Gmelina arborea Roxb. Few studies have made it possible to assess these reforestation activities with regard to their ability to maintain native plant diversity.
Objectives. This study analyzed the impacts of these forest plantations on the natural regeneration of trees in one of the reforestation sites.
Method. Stratified sampling was used as the basis of inventories in four types of habitat: young and old teak forests, multi-species plantations and neighboring forests. Mature, sapling and seedling trees were counted and their diameters at breast height were measured.
Results. Neighboring residual forests were more diversified than reforestation areas for both mature and sapling trees. For seedling trees, the diversity profiles were similar between the habitats. In all habitats, exotic species were the most abundant. Cedrela odorata, an exotic species, showed a remarkable abundance in neighboring forests.
Conclusions. The trends observed in the regeneration of reforested areas suggest that new plantations should be based on several exotic and / or native species to improve plant diversity.
Table of content
Reçu le 14 novembre 2020, accepté le 14 décembre 2021, mis en ligne le 16 décembre 2021
Cet article est distribué suivant les termes et les conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr)
1. Introduction
1Les forêts tropicales fournissent une variété de services écosystémiques en raison de nombreux facteurs liés à la structure et au fonctionnement de l'écosystème, la disponibilité des ressources, les perturbations, les communautés biotiques et les activités humaines (Chapin et al., 2011 ; Angelsen et al., 2014 ; Sheil, 2014). Malgré les nombreux biens et services fournis par ces forêts tropicales, on a constaté que celles-ci sont en baisse de qualité et de quantité (Hansen et al., 2013).
2En Côte d’Ivoire, pays tropical, la couverture forestière a diminué drastiquement ces dernières années, passant de 5,09 millions d’hectares en 2000 à 3,6 millions d’hectares en 2015 (FAO & SEP-REDD, 2017). Les causes sont entre autres l’agriculture, l’exploitation forestière incontrôlée des ressources vivantes, les exploitations minières ainsi que la croissance démographique (BNETD, 2015).
3Dans l’objectif de préserver son couvert forestier, l’État de Côte d’Ivoire s’est engagé dans une politique d’afforestation qui devrait servir au maintien et à la réhabilitation de certains fragments de forêt ainsi qu’à la restauration des terres à partir du reboisement dans les espaces dégradés par l’agriculture. Cette option de reboisement a été confiée à la Société de Développement des Forêts (SODEFOR), créée en 1966.
4Au début, la SODEFOR a procédé à la création de plantations en milieu forestier « éclairci » consistant à mettre en place les plants après abattage des arbres jusqu'à 30 cm de diamètre et à l'empoisonnement des arbres les plus gros (N’Guessan & Kouassi, 2005). Ainsi sur plusieurs années, les plantations à dominance d’espèces forestières natives ont été créées (Maitre, 1983). Cependant, les résultats de ces plantations donnaient une densité d’arbres qui ne couvrait pas la demande en bois d’œuvre (Souvannavong, 1983).
5La SODEFOR va donc opter à partir de 1976 pour une déforestation totale des surfaces avant la mise en place des plantations forestières. Ainsi en l’espace de 30 ans, ce sont 145 686 ha qui ont été plantés (BNETD, 2015). Les espèces prisées sont essentiellement exotiques avec une domination de teck (Tectona grandis L.f) et de Cedrela (Cedrela odorata L.) dont les densités de plants atteignent de 950 à 2 000 plants·ha-1 (Maitre, 1983).
6Bien que ces plantations soient créées par une structure spécialisée, des travaux axés sur leur valeur de conservation de la biodiversité sont rares. De tels travaux méritent d’être abordés car, en milieu tropical, il est démontré que généralement, la régénération des espèces indigènes est affectée dans les plantations forestières à base d’espèces exotiques (Bremer & Farley, 2010). Certains auteurs dont Makino et al. (2007) considèrent ces plantations comme des « déserts verts » pauvres en espèces de la flore et de la faune indigènes. Pour d’autres auteurs, dont Brockerhoff et al. (2008), la valeur des plantations forestières pour la biodiversité varie considérablement selon la couverture terrestre d'origine et si des espèces d'arbres indigènes ou exotiques sont plantées. Le présent article est une contribution à ce débat au niveau de la Côte d’Ivoire où l’État prévoit des reboisements massifs pour la reconstitution de son couvert forestier.
7La Forêt Classée de la Téné (FCT), depuis sa création en 1973, a fait l’objet de nombreuses opérations de reboisement par la SODEFOR. Ce site couvre une superficie totale de 29 000 ha dont 75,87 % ont été convertis en plantations monospécifiques et plurispécifiques (SODEFOR, 1995). La FCT est aujourd’hui considérée comme la plus grande source de production de plant de reboisement et de bois d’œuvre. Dans cette forêt, les plantations de teck représentent plus de 40 % des plantations forestières totales. Les plantations plurispécifiques d’espèces exotiques telles que Gmelina (Gmelina arborea Roxb.) et Cedrela (C. odorata) associées aux résidus de certaines espèces natives naturelles et/ou plantées, couvrent 30 % de la surface reboisée dans la FCT (Eblin & Amani, 2015).
8Environ 50 ans après les premières opérations de reboisement dans la FCT, l’une des principales questions à laquelle cette étude a tenté de répondre est la suivante : la diversité spécifique et la dynamique de régénération du sous-bois ne sont-elles pas influencées par les espèces exotiques plantées ? En effet, les études permettant de répondre à cette question sont, à notre connaissance, inexistantes pour le cas de la FCT. Le présent article a donc permis d’évaluer la diversité et le potentiel de régénération des espèces végétales natives et exotiques plantées ou spontanées. Les aspects abordés concernent brièvement la diversité des plus gros arbres et en détail, celle des recrus ligneux de la strate inférieure des plantations forestières dans la FCT. L’article a permis de tester l’hypothèse suivante : les activités de reboisement et d’exploitation de bois de la SODEFOR impactent négativement la diversité des ligneux en général et des recrus ligneux en particulier, en tenant compte des types de reboisement mono- et plurispécifiques.
2. Matériel et méthodes
2.1. Site d’étude
9La Forêt Classée de la Téné (FCT), où a eu lieu cette étude, est située au centre de la Côte d’Ivoire, dans le département d’Oumé entre 6°27’ et 6°37’ de latitude Nord et 5°20’ et 5°40’ de longitude Ouest (Figure 1). Les températures de la zone de la FCT varient peu d’un mois à l’autre, avec une moyenne générale de 26,5 °C et une humidité relative de 85 %. Les précipitations moyennes annuelles sont comprises entre 1 200 et 2 000 mm (Koné, 2018).
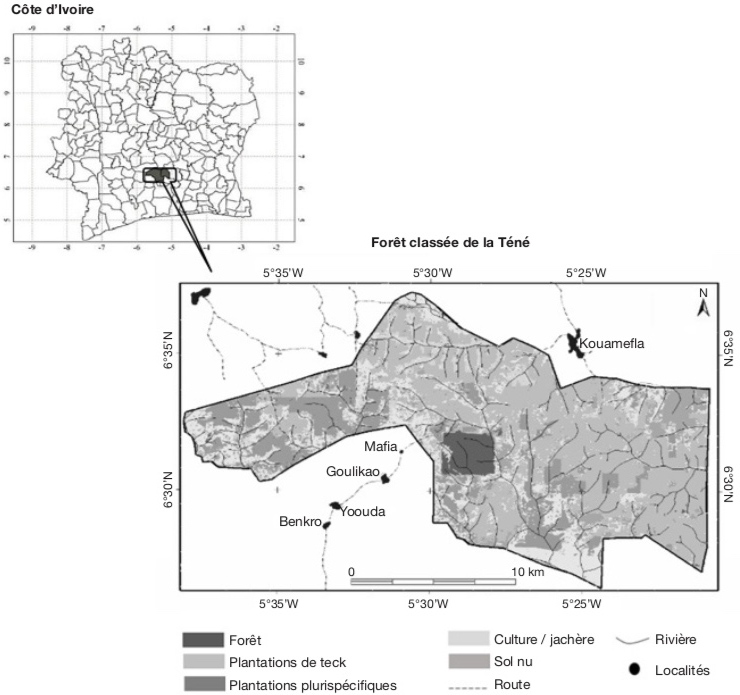 Figure 1. Carte d’utilisation des terres dans la forêt classée de la Téné — Land use map in the Téné protected forest.
Figure 1. Carte d’utilisation des terres dans la forêt classée de la Téné — Land use map in the Téné protected forest.
10Selon Aubréville (1959), la FCT appartient au secteur mésophile du domaine guinéen, caractérisé par une végétation de forêt dense humide de type semi-décidu, à canopée ouverte. C’est une végétation dense à dominance de Celtis spp. et Triplochiton scleroxylon K.Schum., renfermant une flore assez composite dont la physionomie est marquée par les activités humaines (Sangne et al., 2008).
2.2. Choix des plantations forestières et des reliques de forêt inventoriées
11Les plantations forestières de jeunes tecks (âgées de moins de 5 ans) n’ont pas été prises en compte parce qu’elles font l’objet d’entretien régulier consistant à des coupes totales de tiges autres que les tecks. Dans la FCT, les plantations de mélange de C. odorata, G. arborea et/ou T. grandis sont toutes âgées de plus de 20 ans. Ce sont elles qui ont été inventoriées. Il n’y existait pas de jeunes plantations plurispécifiques. Entre les différentes plantations s’observent des fragments de forêts résiduelles. Ainsi, quatre types d’habitat dont les monocultures de tecks jeunes (5 à 20 ans) et vieilles (20 à 40 ans) et les plantations plurispécifiques âgées d’au moins 20 ans, ont été sélectionnés pour des inventaires. Dans ces plantations, différents espacements entre les individus plantés ont été réalisés : 2,5 m x 2,5 m dans les teckeraies et 6 m x 6 m pour les plantations plurispécifiques. Les reliques de forêts sans aucun historique de plantations dont l’âge est estimé à plus de 60 ans ont été sélectionnées, comme témoin.
2.3. Récolte des données
12La répartition des parcelles étudiées est la suivante : 6 dans les reliques de forêts, 6 dans les jeunes plantations de teck, 6 dans les vieilles plantations de teck et 13 en plantations plurispécifiques. Les inventaires des ligneux ont été effectués sur 31 parcelles selon trois catégories d’individus : les individus adultes (dhp ≥ 10 cm), les jeunes arbres (5 ≤ dhp < 10 cm) et les jeunes plants (2,5 ≤ dhp < 5 cm). Selon des auteurs comme Mahamane & Saadou (2008) et Abdourhamane et al. (2013), les jeunes plants sont désignés par ceux ayant un diamètre à hauteur de poitrine (dhp) compris entre 1 et 5 cm. Dans le cas de cette étude, l’intervalle allant de 2,5 à 5 cm a été choisi pour prendre en compte ceux ayant atteint au moins 1,30 m de hauteur du sol. Pour la distinction entre les jeunes arbres et les individus adultes, l’étude s’est appuyée sur les travaux de Gbètoho et al. (2018) et Goba et al. (2019).
13Pour les individus adultes et les jeunes arbres, il s’est agi des parcelles de 2 500 m² (50 m x 50 m), soit une superficie totale de 7,75 ha. Ces ligneux ont été dénombrés et leur dhp mesuré. Pour les jeunes arbres, une sous-parcelle de 100 m² (10 m x 10 m) a été choisie au centre de chaque parcelle de 2 500 m². Ces individus ont été dénombrés et leur diamètre a été mesuré et identifié selon la nomenclature APG IV (2016).
2.4. Analyse des données
14Analyse sur les individus adultes. Premièrement, la densité des ligneux dans les différents habitats a été déterminée par dénombrement des individus. Il s’agit du nombre d’individus par unité de surface.
15Par la suite, la comparaison de la diversité des espèces ligneuses inventoriées dans les différents habitats a consisté à déterminer des indices de diversité de Shannon (1948), de Simpson (1949) et d’équitabilité de Piélou (1966). Les moyennes de ces indices ont été comparées à l’aide des Analyse de Variances (ANOVA).
16Des courbes d’abondance en individus ont été établies. En effet, ces courbes présentent le nombre total d’individus calculé pour chaque espèce et leur classement de la plus abondante à la moins abondante (Kindt & Coe, 2005).
17Analyse sur les jeunes arbres et les jeunes plants. Des courbes d’accumulation des espèces ont été établies pour chaque habitat pour les individus. Ces courbes montrent d’une part la tendance à la rencontre d'espèces supplémentaires lorsque plus de tiges sont échantillonnées et d’autre part, le taux de nouvelles espèces trouvées dans les habitats (Gotelli & Colwell, 2001 ; Ugland et al., 2003).
18Le profil de diversité de Renyi a été dressé pour chaque habitat dans le cas des jeunes arbres et des jeunes plants. Les valeurs du profil de diversité de Renyi (Hα) basées sur 100 randomisations (Legendre & Legendre, 1998) ont été calculées à partir de la formule mathématique suivante :
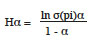
19Dans cette formule, pi est l'abondance des espèces et α, une échelle de paramètres de diversité. Dans cette échelle, les valeurs 0, 1, 2 et ∞ sont liées respectivement à la richesse spécifique S, à l’indice de diversité de Shannon, à l’indice de diversité de Simpson et à l’indice de diversité de Berger-Parker (Legendre & Legendre, 1998). En considérant la comparaison basée sur le profil de diversité de Renyi, une communauté A est plus diversifiée qu’une communauté B si le profil de la communauté A est en tous lieux au-dessus du profil de diversité de la communauté B (Kindt et al., 2006).
20Des diagrammes de Venn ont été établis afin d’illustrer le nombre d’espèces présentes et partagées entre les différents habitats (Vroh et al., 2017). Sur la base de leur abondance, des analyses de Classification Ascendante Hiérarchique (CAH) ont été réalisées.
21Les indices de diversité, les profils de diversité, les courbes d’accumulation et celles d’abondance des espèces ont été tous réalisés à l'aide du package Biodiversity R (Kindt & Coe, 2005).
22Finalement, les recrus ligneux les plus importants ont été identifiés pour chaque type d’habitat, à l’aide de l’Indice de Valeur d’Importance (IVI). Cet indice reflète plus l’importance écologique d’une espèce que les mesures structurales uniques absolues (Bekele & Abebe, 2018). Il prend en compte, pour chaque espèce, les valeurs relatives de la surface terrière, des occurrences et des densités. Selon Fobane et al. (2017), une espèce est écologiquement prépondérante lorsque son IVI est supérieur à 10 %.
3. Résultats
3.1. Bilan floristique des individus adultes dans les différents habitats
23Les biotopes étudiés présentent une densité de 813,75 individus·ha-1 pour les arbres adultes (dhp ≥ 10 cm). Ces arbres sont répartis entre 54 espèces et 26 familles. S’agissant des différents habitats (Tableau 1), les forêts ont une richesse spécifique de 42 espèces (73,6 %) représentées par 758 individus·ha-1 (soit 23,3 % de l’ensemble des tiges). Les plantations plurispécifiques, quant à elles, enregistrent une richesse de 28 espèces qui totalisent 21,4 % des tiges. Les plantations monospécifiques de teck totalisent ensemble 1 799 individus·ha-1 regroupés en 15 espèces.
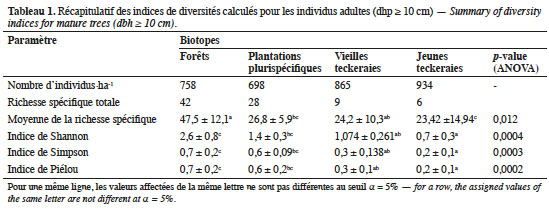
24L’analyse statistique réalisée pour les parcelles de 2 500 m2 donne une richesse moyenne plus grande pour les forêts (47,5 ± 12,1 espèces) par rapport aux autres types d’habitats (Tableau 1). La plus faible valeur moyenne qui est 23,42 ± 14,94 espèces est celle des jeunes teckeraies. Les indices de diversité de Shannon, Simpson et de Piélou diminuent également des forêts aux plantations plurispécifiques et monospécifiques (Tableau 1).
25L’analyse des courbes d’abondance montre que C. odorata est plus abondante dans les forêts et les plantations plurispécifiques avec respectivement 145 (37,08 %) et 578 (44,60 %) tiges. Dans les teckeraires, c’est T. grandis qui est plus abondantes avec 944 (96,92 %) et 829 (87,72 %) tiges respectivement dans les plantations jeunes et âgées (Figure 2).
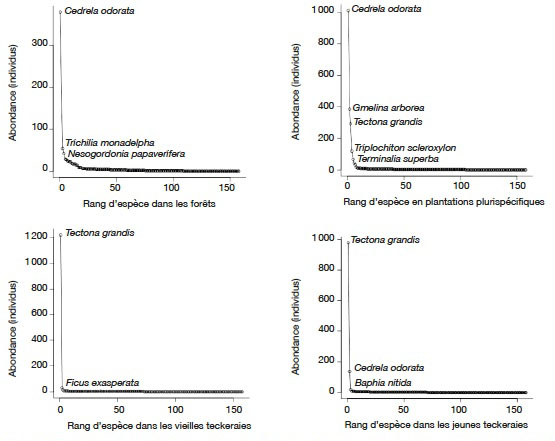 Figure 2. Courbe d’abondance des individus adultes dans les différents habitats — Abondance curve for mature trees in the habitats.
Figure 2. Courbe d’abondance des individus adultes dans les différents habitats — Abondance curve for mature trees in the habitats.
26En forêts, C. odorata est suivie de Trichilia monadelpha (Thonn.) J.J.de Wilde (39 individus, 9,97 %) et Nesogordonia papaverifera (A. Chev.) Capuron ex N. Hallé (29 individus, 7,41 %). Dans les plantations plurispécifiques, C. odorata est suivi de G. arborea (292 individus), T. grandis (183 individus), T. scleroxylon (102 tiges) et T. superba (66 individus, 3,14 %). Au niveau des teckeraies, C. odorata est la deuxième espèce la plus abondante dans les plantations âgées. Elle est suivie de Baphia nitida Lodd. avec 0,63 % des tiges.
3.2. Diversité des recrus ligneux dans les différents habitats
27Au total, 191 individus·ha-1 (87,95 %) pour la catégorie des jeunes arbres et 26 individus·ha-1 (12,05 %) pour celle des jeunes plants, ont été recensés. Dans cette dernière catégorie, ce sont 14 espèces réparties en 13 genres au sein de 9 familles qui ont été dénombrées. Cette richesse est inférieure à celle des jeunes arbres qui totalisent 47 espèces réparties en 42 genres et 24 familles. Dans les deux catégories, ont été dénombrées 4 espèces exotiques et 42 espèces natives.
28Les plantations plurispécifiques ont enregistré la plus forte richesse spécifique (10 espèces) dans la catégorie des jeunes plants. La courbe d’accumulation aire-espèces montre que la valeur maximale du nombre d’espèces représentées par les jeunes plants est loin d’être atteinte dans les plantations plurispécifiques. Dans les autres types d’habitat, le nombre d’espèces observées reste faible et la courbe d’accumulation atteint le plateau très rapidement pour les teckeraies par rapport aux reliques de forêt (Figure 3A). Le nombre d’espèces observées dans cette catégorie est moins élevé dans les teckeraies (Figure 3A).
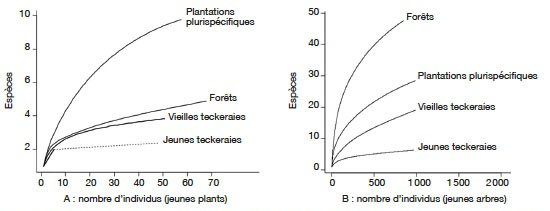 Figure 3. Courbes individus / espèces des recrus ligneux dans les différents habitats — Individuals/species accumulation curves for saplings and seedlings in the habitats.
Figure 3. Courbes individus / espèces des recrus ligneux dans les différents habitats — Individuals/species accumulation curves for saplings and seedlings in the habitats.
29Dans la catégorie des jeunes plants (Figure 3A), les profils de diversité des espèces se recoupent (Figure 4A). À l’inverse, dans la catégorie des jeunes arbres (Figure 4B), les reliques forestières ont constamment un profil de diversité au-dessus de celui des autres habitats pour toutes les valeurs de α. De même, le profil de diversité dans les plantations plurispécifiques, bien que restant en dessous de celui des forêts, est au-dessus de celui des teckeraies. Enfin, les courbes de profil de diversité des vieilles et jeunes teckeraies se recoupent pour des valeurs de α plus grand (Figure 4B).
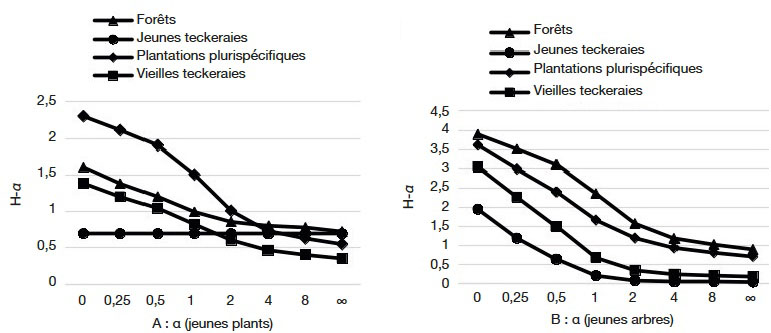 Figure 4. Profils de diversité des recrus ligneux dans les différents habitats — Diversity profiles for saplings and seedlings in the habitats.
Figure 4. Profils de diversité des recrus ligneux dans les différents habitats — Diversity profiles for saplings and seedlings in the habitats.
30Dans la catégorie des jeunes plants, le diagramme de Venn (Figure 5A) montre qu’une seule espèce est présente à la fois dans tous les types d’habitat. Il s’agit de C. odorata. L’espèce Solanum erianthum D. Don est, quant à elle, présente dans plus de deux habitats : les forêts, les plantations plurispécifiques et les vieilles teckeraies.
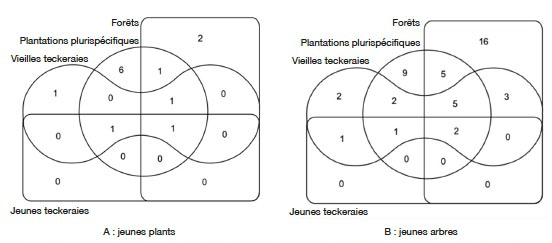 Figure 5. Richesse et ressemblance floristiques des recrus ligneux dans les différents habitats — Richness et floristic similarity between the habitats.
Figure 5. Richesse et ressemblance floristiques des recrus ligneux dans les différents habitats — Richness et floristic similarity between the habitats.
31Dans la catégorie des jeunes arbres, le diagramme de Venn montre que deux espèces sont à la fois présentes dans l’ensemble des habitats inventoriés (Figure 5B). Il s’agit de Antiaris toxicaria Lesch. et C. odorata. Les espèces Blighia sapida K.D.Koenig, Blighia unijugata Baker, Ceiba pentandra (L.) Gaertn., B. nitida et Albizia zygia (DC.) J.F.Macbr. sont à la fois présentes dans les reliques de forêt, les plantations plurispécifiques et les vieilles teckeraies. Les forêts et les plantations plurispécifiques ont plus d’espèces qui leur sont communes et qui ne se rencontrent pas dans les autres habitats. Il s’agit de T. monadelpha, Afzelia bipindensis Harms, S. erianthum, T. scleroxylon et Mansonia altissima (A.Chev.) A.Chev. Parmi les jeunes arbres, 16 espèces (34,8 %) sont signalées uniquement dans les reliques forestières et 9 (19,6 %) dans les plantations plurispécifiques.
32Si on tient compte des abondances des espèces, dans la catégorie des jeunes plants, les plantations plurispécifiques présentent une dissemblance avec les autres habitats. Par ailleurs, les reliques de forêt et les plantations monospécifiques de teck ont une plus forte similarité (Figure 6A). Dans la catégorie des jeunes arbres par contre, les forêts présentent une dissimilarité avec les différents habitats. S’agissant des plantations, les monocultures de teck ressemblent plus aux plantations plurispécifiques (Figure 6B).
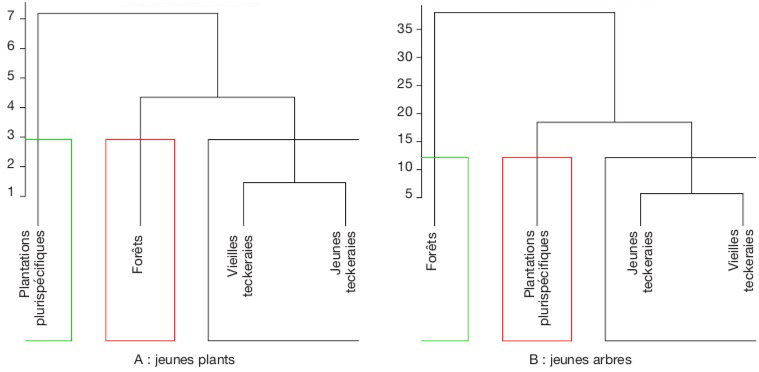 Figure 6. Distance écologique entre les différents habitats basés sur l’abondance des recrus ligneux — Ecological distance between the habitats based on the abundance of seedlings and saplings.
Figure 6. Distance écologique entre les différents habitats basés sur l’abondance des recrus ligneux — Ecological distance between the habitats based on the abundance of seedlings and saplings.
33Pour les parcelles de forêts, cinq espèces ont des IVI supérieurs ou égaux à 10 % dans la catégorie des jeunes plants contre huit espèces dans la catégorie des jeunes arbres (Tableau 2). Dans ces deux catégories, l’espèce C. odorata est la plus importante avec 148 % des valeurs des IVI. Dans la catégorie des jeunes arbres, son importance passe de 148 à 126 % dans les reliques de forêts ; une baisse au profit des espèces comme T. monadelpha, N. papaverifera, Lasiodiscus chevalieri Hutch., B. nitida, S. erianthum, M. altissima et Trema guineensis (Schum. & Thonn.) Ficalho.
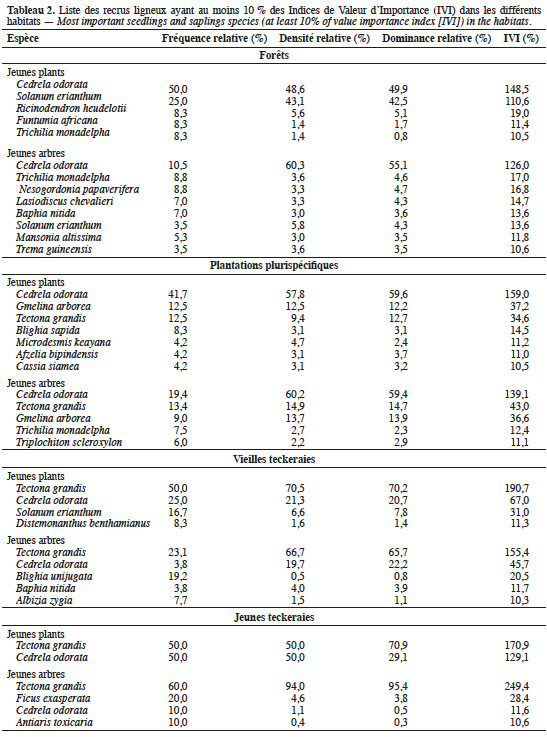
34Dans les plantations plurispécifiques, c’est encore C. odorata qui est la plus importante, pour les deux catégories des jeunes plants (Tableau 2). Elle est accompagnée des recrus d’autres espèces plantées (T. grandis et G. arborea) et d’autres espèces natives dont T. scleroxylon, B. sapida et T. monadelpha (Tableau 2).
4. Discussion
35Avant d’aborder la question de la présence et de la diversité des recrus ligneux dans les plantations forestières, il nous a semblé nécessaire de décrire quelques paramètres floristiques et structuraux dans ces habitats. Pascal (2003) considère qu’en forêts naturelles tropicales, la densité des arbres de diamètre à hauteur de poitrine (dhp) supérieur ou égal 10 cm est comprise entre 450-750 individus·ha-1. La densité des arbres de dhp ≥ 10 cm, obtenue pour les reliques forestières adjacentes (758 tiges·ha-1) des plantations forestières, s’intègre donc dans l’intervalle défini par Pascal (2003). Aussi sur la base de cet intervalle, la densité (698 tiges·ha-1) des plantations plurispécifiques étudiées s’apparente à celle des forêts tropicales. La mixité et le vieillissement de ces plantations accroissent la disponibilité des niches écologiques et favorisent un plus grand nombre et une plus large variété d’organismes. Ainsi, leur biodiversité et densité se rapprochent davantage de celles des forêts environnantes (Hartley, 2002 ; Carnus et al., 2006 ; Paquette & Messier, 2013). Par contre, les plantations jeunes ou âgées monospécifiques de teck ont des densités d’arbres dépassant largement la borne supérieure de cet intervalle. En effet, différents espacements ont été utilisés pour l'établissement de ces plantations. Il s’agit de 2,5 m x 2,5 m pour le teck (T. grandis) en monoculture pour une densité de 1 799 tiges·ha-1 et des écartements de 6 m x 6 m pour les plantations mixtes de T. grandis, C. odorata et G. arborea qui ont donné une densité de 698 individus·ha-1. La différence entre ces espacements est à la base de la densité plus importante dans les plantations de teck par rapport aux autres types d’habitat.
36En termes de paramètres floristiques, les espèces présentes dont les individus ont un dhp ≥ 10 cm sont plus nombreuses et plus diversifiées dans les reliques de forêts que dans les plantations forestières mono- et plurispécifiques. Dans le cas de cette étude, deux principales raisons peuvent expliquer cette baisse de la richesse et de la diversité des espèces d’arbres, des reliques de forêt aux plantations plurispécifiques, puis aux monocultures de teck. La première raison est liée aux pratiques de reboisement pour T. grandis, telles qu’effectuées par la Société de Développement des Forêts (SODEFOR) en Côte d’Ivoire. En effet, lors de la mise en place des plantations de reboisement de teck, les parcelles sont préalablement nettoyées à la main en utilisant des machettes. Tous les arbres grands comme petits sont systématiquement abattus pour favoriser la croissance des jeunes tecks. Après la mise en terre des stumps de teck, la plantation est régulièrement nettoyée jusqu’à l’âge de quatre ans, sauf quelques individus d'arbres d'autres espèces qui sont exceptionnellement laissés dans ces plantations jeunes. Parmi celles-ci, on note par exemple Ficus exasperata Vahl dont les feuilles sont coupées par certains manœuvres de la SODEFOR pour nourrir leur bétail dans les villages voisins de la FCT. Il peut s’agir aussi de B. nitida diversement utilisée par les populations rurales en artisanat pour la confection des pilons et comme bois de chauffage dans les ménages (Vroh et al., 2019). Au-delà de quatre ans, ce sont des coupes sélectives qui sont effectuées. Elles concernent surtout le délianage, le désherbage et quelques arbres jugés trop proches des plants de teck. Des jeunes plants des espèces natives de bois d’œuvre, telles que T. superba, T. ivorensis et T. scleroxylon, peuvent être épargnés. Quelques individus de ces espèces réussissent à grandir et atteindre un dhp de plus de 10 cm, enrichissant ainsi les plantations âgées de teck. À ces espèces indigènes s’ajoute C. odorata dans les plantations âgées de T. grandis.
37Dans les plantations plurispécifiques de T. grandis, G. arborea et/ou C. odorata, la mise en place de la parcelle commence par l’abattage de quelques grands arbres uniquement. Une fois ceux-ci éliminés, les jeunes plants de C. odorata, G. arborea et les stumps de T. grandis sont plantés en veillant à ce que les alentours immédiats soient nettoyés. La croissance des jeunes plants se fait simultanément avec la régénération de certaines espèces natives dont T. superba, T. ivorensis, T. scleroxylon, B. nitida et F. exasperata. Les trois premières sont souvent épargnées lors des travaux de coupes sélectives en raison de leur qualité de bois d’œuvre (SODEFOR, 1995). Ces espèces indigènes étaient, par le passé, plantées dans la FCT (Eblin & Amani, 2015). Les dernières exploitations ont été faites au début des années 2000. En raison de leur croissance lente, ces espèces indigènes ont été abandonnées et ne sont plus plantées. Ainsi donc, la richesse et la diversité des arbres dans les plantations plurispécifiques sont plus grandes que celles des plantations monospécifiques de teck.
38La deuxième raison, quant à elle, explique principalement les plus fortes valeurs de richesse et de diversité des espèces dans les reliques de forêts. En effet, dans les reliques de forêts adjacentes aux plantations forestières, les résultats ont montré une plus grande richesse et diversité des espèces arborescentes ayant un dhp ≥ 10 cm. Ces forêts sont particulièrement dégradées pour plusieurs raisons : usage par les populations riveraines pour la recherche de plantes à diverses vertus, la chasse et les feux de brousse (Sangne et al., 2008). Ces activités anthropiques entrainent des ouvertures favorables à l’installation de nombreuses espèces pionnières héliophiles dont T. monadelpha, N. papaverifera, B. nitida, S. erianthum, M. altissima et T. guineensis (Vroh & Adou Yao, 2017). Par contre, dans les formations végétales fortement anthropisées telles que les plantations forestières d’espèces exotiques, on observe une abondance des individus adultes, mais une faible diversité floristique (Ngueguim, 2013).
39Une autre caractéristique clé de la flore des différents habitats est l’abondance marquée de C. odorata tant dans les plantations forestières que dans les reliques forestières. L’abondance de cette espèce exotique de reboisement dans les forêts résiduelles peut, dans un premier temps, s’expliquer par la proximité de ces espaces avec les plantations forestières. En effet, ces reliques de forêt sont entourées par des plantations plurispécifiques de C. odorata associées à d’autres espèces forestières. Dans un deuxième temps, cette abondance pourrait être due à la biologie et à l’écologie de cette espèce. Les études menées par Renteria & Buddenhagen (2006) ont montré que l’anémochorie est le principal mode de dissémination de C. odorata. De plus, la germination de C. odorata se fait entre 2 à 4 semaines et les individus fructifient seulement au bout de 10 ans (Global Invasive Species Database, 2015). Les plants de cette espèce ont une croissance très rapide pouvant atteindre 1 à 2 m par an dans les premiers stades et tolèrent la sècheresse (Marrero, 1949). Cette espèce se développe mieux dans les forêts naturelles dégradées du fait de son exigence en lumière et se comporte comme une plante pionnière à longue durée de vie (Gerhardt, 1993). D’autre études ont également montré que cette espèce forestière s’adapte et survit à l’ombre comme en plein soleil dans des combinaisons de plantations mixtes (Addo-Danso et al., 2012). Il s’agit donc d’une espèce qui s’adapte bien aux conditions de la zone de transition forêt-savane de la Téné. Les premiers résultats de cette étude montrent de plus fortes valeurs de richesse et diversité des arbres (dhp ≥ 10 cm) des forêts, comparativement à celles des plantations forestières. De tels résultats sont courants lorsqu’on compare une plantation forestière et une forêt naturelle peu ou pas dégradée (Onyekwelu & Olabiwonnu, 2016). Cependant, qu’en est-il de la régénération des recrus ligneux (dhp < 10 cm) dans ces espaces ?
40Selon Ruiz-Jaen & Aide (2005), la colonisation des recrus est l’une des mesures du succès de restauration de la végétation d’origine. Dans la catégorie des jeunes plants (2,5 cm ≤ dhp ≤ 5 cm), cette étude montre qu’il n’y a pas de différence entre les profils de diversité des recrus ligneux issus des différents habitats. Ce résultat révèle que les plantations forestières dans la FCT ont l’avantage d’abriter des espèces qui peuvent être identiques ou différentes des espèces du potentiel floristique originel des forêts denses sèches détruites pour leur création. Leur diversité à ce stade de croissance reste donc comparable entre les différents habitats. En comparant des plantations monospécifiques de G. arborea, Acacia mangium Willd. et T. grandis aux forêts naturelles voisines, des auteurs comme Onyekwelu & Olabiwonnu (2016) ont abouti à des résultats similaires.
41Par contre, dans la catégorie des jeunes arbres de recrus ligneux, le profil de diversité des reliques de forêt est nettement meilleur que celui des plantations plurispécifiques, qui lui-même est mieux que celui des plantations monospécifiques de teck. Ce résultat révèle que, certes, on assiste à un ensemencement spontané important des individus de diamètre inférieur à 5 cm dans les plantations forestières, mais qu’une bonne partie de ces individus n’arrive pas à atteindre le stade des jeunes arbres ; soit parce que ces espèces meurent, soit parce qu’elles restent pendant longtemps au stade de régénération. Leur croissance serait retardée du fait de l’abondance de l’ombrage de la canopée jointive des arbres plantés ou du fait de la variation de diverses autres conditions écologiques telles que la température, le climat, la pluviométrie et le sol (Tulod et al., 2017), principalement dans le cas des plantations de teck. Cette canopée des espèces exotiques, comme C. odorata et T. grandis, ne laissant pas traverser la lumière du soleil, influence donc négativement la croissance des recrus (Petit & Montagnini, 2006). Ainsi donc, même si le recrutement des arbres est actif dans les plantations forestières, après la fermeture de la canopée, lorsque le désherbage n'est plus nécessaire, ces recrus voient leur croissance retardée dans le sous-étage. Par ailleurs, le passage régulier des manœuvres pour les coupes sélectives et le délianage peut également freiner la croissance de la catégorie des jeunes plants (Bekele & Abebe, 2018) ; de telles pressions sont moindres dans les reliques de forêt dense sèche à cime généralement non jointive et où les trouées peuvent naturellement favoriser la croissance de certains arbres (Hubbell et al., 1999).
42D’autres études ont montré que les espèces exotiques, comme c’est le cas pour la FCT, peuvent avoir des impacts négatifs sur les plantes indigènes (Bremer & Farley, 2010).
43En termes de ressemblance des espèces présentes dans les différents habitats, les résultats ont montré une dissimilarité importante entre les reliques de forêts et les plantations forestières lorsqu’on considère la catégorie des jeunes arbres. Les reliques de forêts sont plus diversifiées en recrus ayant atteint le stade jeunes arbres. Aussi, considérant toutes les espèces recensées dans cet habitat, on a constaté que 38 % de celles-ci diffèrent de celles présentes dans les plantations forestières. Les espèces les plus communes aux différents habitats sont B. sapida, B. unijugata, C. pentandra, B. nitida, A. zygia, S. erianthum, F. elastica et A. toxicaria. Il s’agit des espèces typiques de la zone d’étude (Sangne et al., 2008) et elles sont à la fois présentes dans les reliques de forêt, les plantations plurispécifiques et les vieilles teckeraies. Ce sont toutes des espèces pionnières à croissance rapide qui recolonisent les plantations après les entretiens ou les ouvertures dans les reliques de forêts. Leur présence dans les plantations forestières peut être perçue comme une capacité de restauration de la flore initiale dans les espaces reboisés. Parmi elles, C. pentandra, F. elastica et A. toxicaria sont des espèces de bois d’œuvre qui, quoi que n’étant pas plantées par la SODEFOR, seront exploitées plus tard, une fois arrivées à maturité.
44La comparaison des valeurs relatives des abondances, des dominances et des densités des recrus ligneux dans les deux catégories montre la prépondérance de C. odorata dans l’ensemble des habitats. Cette espèce reste la plus importante dans les reliques de forêt où elle n’est pas plantée, elle est également plus importante dans les plantations plurispécifiques et vient en deuxième et troisième position respectivement dans les plantations âgées et jeunes de teck. La régénération rapide, la facilité d’adaptation des recrus et l’abondance des recrus de cette espèce sont confirmées par ces résultats (Gedefaw & Soromessa, 2014). En outre, cette espèce à croissance rapide et ayant peu de prédateurs est classée comme espèce envahissante dans plus 22 pays tropicaux (Holm et al., 1997). Ainsi, en Nouvelle-Calédonie, C. odorata fait partie des 81 espèces végétales envahissantes principales des milieux naturels (Groupe espèces envahissantes, 2012). Aussi, bien que plantée dans les années 1950 et encore actuellement pour son bois dans les Iles Galapagos, C. odorata fait partie des pires espèces envahissantes de ce pays (Global Invasive Species Database, 2015). Introduite en Côte d’Ivoire à partir de 1966, en vue de renforcer l’économie forestière du pays, C. odorata mérite des études approfondies sur sa capacité de régénération et de colonisation rapide des reliques de forêt et des plantations dans et autour des trois forêts classées (Forêts Classées de Téné, Mopri et Irobo) où l’espèce est abondamment exploitée pour son bois.
5. Conclusions et recommandations
45La réhabilitation des forêts par le reboisement devrait répondre aux besoins écologiques et sociaux du pays. Dans le cas de la Côte d’Ivoire, l'implication d'espèces exotiques dans la réhabilitation massive effectuée par la Société de Développement des Forêts (SODEFOR) a été analysée du point de vue de la capacité de régénération de la flore ligneuse initiale au sein de la Forêt Classée de la Téné (FCT). Les résultats de cette étude ont indiqué l’existence d’un potentiel des plantations forestières pour soutenir la régénération de certaines espèces indigènes importantes qui devraient coloniser cette zone. Cependant, après régénération, les conditions écologiques nécessaires au maintien de la majorité des recrus de ces espèces indigènes se dégradent et deviennent moins favorables à leur évolution vers le stade de jeunes arbres. En outre, les tendances constatées suggèrent que les nouvelles plantations devraient utiliser, sur les mêmes parcelles, plusieurs espèces exotiques (plantations plurispécifiques) pour améliorer la diversité végétale à l'intérieur des parcelles.
46Par ailleurs, des recherches supplémentaires sont nécessaires sur les effets du boisement à base de C. odorata dans et autour des différentes forêts classées où cette espèce est plantée et exploitée dans le pays. Il serait, en effet, important de mener des études sur la banque de graines du sol, le mécanisme de dispersion des graines de C. odorata et les impacts de l’abondance des recrus de l’espèce sur la flore dans les zones de son exploitation au niveau national. Aussi, des efforts supplémentaires de la SODEFOR devraient permettre de mettre l’accent sur des entretiens qui sélectionnent, dans le sous-bois, les recrus d’espèces exotiques plantées en vue de créer un pool floristique varié et plus large.
Bibliographie
Abdourhamane H., Morou B., Rabiou H. & Mahamane A., 2013. Caractéristiques floristiques, diversité et structure de la végétation ligneuse dans le Centre-Sud du Niger : cas du complexe des forêts classées de Dan kada Dodo-Dan Gado. Int. J. Biol. Chem. Sci., 7(3), 1048-1068, doi.org/10.4314/ijbcs.v7i3.13
Addo-Danso S.D. et al., 2012. Survival and growth of Nauclea diderrichii and Pericopsis elata in monoculture and mixed-species plots in Ghana. J. Trop. For. Sci., 24(1), 37-45.
Angelsen A. et al., 2014. Environmental income and rural livelihoods: a global-comparative analysis. World Dev., 64, 12-28, doi.org/10.17528/cifor/data.00002
APG IV, 2016. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants. Bot. J. Linn. Soc., 181, 1-20, doi.org/10.1111/boj.12385
Aubréville A., 1959. La flore forestière de Côte d’Ivoire. Nogent-sur-Marne, France : CTFT.
Bekele T. & Abebe W., 2018. Indigenous woody species regeneration under the canopies of exotic tree plantations at Tore Forest, Gelana District, Southern Oromia, Ethiopia. Biodivers. Int. J., 2(1), 1-6, doi.org/10.15406/bij.2018.02.00034
BNETD (Bureau National d’Étude Technique et de Développement), 2015. Rapport pour les états généraux de la forêt, de la faune et des ressources en eau : gestion durable des ressources forestières, Côte d’Ivoire.
Bremer L.L. & Farley K.A., 2010. Does plantation forestry restore biodiversity or create green deserts? A synthesis of the effects of land-use transitions on plant species richness. Biodivers. Conserv., 19, 3893-3915, doi.org/10.1007/s10531-010-9936-4
Brockerhoff E.G. et al., 2008. Plantation forests and biodiversity: oxymoron or opportunity? In: Brockerhoff E.G. et al., eds. Plantation forests and biodiversity: oxymoron or opportunity? Dordrecht, The Netherlands: Springer, Topics in biodiversity and conservation, vol. 9, doi.org/10.1007/978-90-481-2807-5_1
Carnus J.-M. et al., 2006. Planted forests and biodiversity. J. For., 104(2), 65-77.
Chapin F.S., Matson P. & Vitousek P., 2011. Principles of terrestrial ecosystem ecology. 2nd ed. New York: Springer.
Eblin M.O. & Amani Y.C., 2015. Déforestation et politique de reboisement dans les forêts classées : cas de la forêt de la Téné (Centre-ouest de la Côte d’Ivoire). Eur. Sci. J., 11(26), 110-127.
FAO & SEP-REDD+, 2017. Données forestières de base pour la REDD+ en Côte d’Ivoire. Cartographie de la dynamique forestière de 1986 à 2015. Abidjan, Côte d’Ivoire.
Fobane J.L. et al., 2017. Flora diversity and characterization of plant groups in Atlantic forests of Cameroon. J. Biodivers. Environ. Sci., 10(5), 163-176.
Gbètoho A.J. et al., 2018. Impacts of Chromolaena odorata on native trees’ regeneration in the Lama secondary forests in Benin, West Africa. Bois For. Trop., 338(4), 5-14, doi.org/10.19182/bft2018.338.a31675
Gedefaw M. & Soromessa T., 2014. Status and woody plant species diversity in Tara Gedam forest, Northern Ethiopia. Sci. Technol. Arts Res. J., 3(2), 11-18.
Gerhardt K., 1993. Tree seedling development in tropical dry abandoned pasture and secondary forest in Costa Rica. J. Veg. Sci., 4(1), 95-102.
Global Invasive Species Database, 2015. Species profile Cedrela odorata, http://www.iucngisd.org/gisd/species.php?sc=343, (8 January 2019).
Goba A.E. et al., 2019. Structure démographique et régénération naturelle des peuplements naturels de Pterocarpus erinaceus Poir. (Fabaceae) des savanes de Côte d’Ivoire. Bois For. Trop., 341(3), 5-14, doi.org/10.19182/bft2019.341.a31750
Gotelli N.J. & Colwell R.K., 2001. Quantifying biodiversity: procedures and pitfalls in the measurement and comparison of species richness. Ecol. Lett., 4, 379-391, doi.org/10.1046/j.1461-0248.2001.00230.x
Groupe espèces envahissantes, 2012. Plantes envahissantes pour les milieux naturels de Nouvelle-Calédonie. Nouméa : Agence pour la prévention et l’indemnisation des calamités agricoles ou naturelles Éditeur.
Hansen M.C. et al., 2013. High-resolution global maps of 21st-century forest cover change. Science, 342(6160), 850-853, doi.org/10.1126/science.1244693
Hartley M.J., 2002. Rationale and methods for conserving biodiversity in plantation forests. For. Ecol. Manage., 155, 81-95.
Holm L. et al., 1997. World weeds: natural histories and distribution. John Wiley & Sons.
Hubbell S.P. et al., 1999. Light gap disturbance, recruitment, limitation and tree diversity in a neotropical forest. Science, 283(5401), 554-557.
Kindt R. & Coe R., 2005. Tree diversity analysis. A manual and software for common statistical methods for ecological and biodiversity studies. Nairobi: World Agroforestry Centre (ICRAF).
Kindt R., Van Damme P. & Simon A.J., 2006. Tree diversity in western Kenya: using profiles to characterise richness and evenness. Biodivers. Conserv., 15, 1253-1270.
Koné Y., 2018. Caractéristiques floristiques et structurales des systèmes de production de bois de la forêt classée de la Téné (Côte d’Ivoire). Mémoire de master : Université Félix Houphouët-Boigny, Abidjan (Côte d’Ivoire).
Legendre P. & Legendre L., 1998. Numerical ecology. 2nd ed. Amsterdam, The Netherlands: Elsevier Scientific Publishing Company.
Mahamane A. & Saadou M., 2008. Méthode d’étude de la flore et de la végétation tropicale. Projet SUN-EU. In : Actes de l’Atelier de Niamey portant sur l’harmonisation des méthodes d’étude et d’analyse de la flore et de la végétation tropicale, Niamey, Niger.
Maitre H.-F., 1983. Table de production provisoire du teck en Côte d’Ivoire. Nogent-sur-Marne, France : C.T.F.T.
Makino S. et al., 2007. Degradation of longicorn beetle (Coleoptera, Cerambycidae, Disteniidae) fauna caused by conversion from broad-leaved to manmade conifer stands of Cryptomeria japonica (Taxodiaceae) in central Japan. Ecol. Res., 22, 372-381, doi.org/10.1007/s11284-007-0359-y
Marrero J., 1949. Tree seed data from Puerto Rico. Caribb. Forester, 10(l), 11-30.
N’guessan K.E. & Kouassi R.H., 2005. Accroissement en diamètre d’essences forestières au sein de trois périmètres expérimentaux (Mopri, Téné et Irobo) en Côte d’Ivoire. Agron. Afr., 17(2), 91-102, doi.org/10.4314/aga.v17i2.1661
Ngueguim J.R., 2013. Productivité et diversité floristique des ligneux en forêt dense d’Afrique tropicale humide du Cameroun : sites de Mangombe Bidou. Thèse de doctorat : Museum National d’Histoire Naturelle, Paris (France).
Onyekwelu J.C. & Olabiwonnu A.A. 2016. Can forest plantations harbour biodiversity similar to natural forest ecosystems over time? Int. J. Biodivers. Sci. Ecosyst. Serv. Manage., 12(1-2), 108-115, doi.org/10.1080/21513732.2016.1162199
Ouédraogo A., 2006. Diversité et dynamique de la végétation ligneuse de la partie orientale du Burkina Faso. Thèse de doctorat : Université de Ouagadougou (Burkina Faso).
Paquette A. & Messier C., 2013. Managing tree plantations as complex adaptive systems. In: Messier C., Puettmann K.J. & Coates K.D., eds. Managing forests as complex adaptive systems: building resilience to the challenge of global change. New York, NY, USA: EarthScan.
Pascal J.P., 2003. Notions sur les structures et dynamique des forêts tropicales humides. Rev. For. Fr., 55, 118-130, doi.org/10.4267/2042/5765
Petit B. & Montagnini F., 2006. Growth in pure and mixed plantations of tree species used in reforesting rural areas of the humid region of Costa Rica, Central America. For. Ecol. Manage., 233, 338-343.
Piélou E.C., 1966. Species diversity and pattern diversity in the study of ecological succession. J. Theor. Biol., 10, 370-383, doi.org/10.1016/0022-5193(66)90133-0
Renteria J.L. & Buddenhagen C., 2006. Invasive plants in the Scalesia pedunculata forest at Los Gemelos, Santa Cruz, Galapagos. Galapagos Res., 64, 32-35.
Ruiz-Jaen M.C. & Aide T.M., 2005. Vegetation structure, species diversity, and ecosystem processes as measures of restoration success. For. Ecol. Manage., 218, 159-173, doi.org/10.1016/j.foreco.2005.07.008
Sangne Y.C., Adou Yao Y.C. & N’guessan K.E., 2008. Transformation de la flore d’une forêt dense semi décidue : impact des activités humaines (Centre Ouest de la Côte d’Ivoire). Agron. Afr., 20(1), 1-11, doi.org/10.4314/aga.v20i1.1731
Shannon C.E., 1948. The mathematical theory of communications. Bell Syst. Techn. J., 27, 379-423.
Sheil D., 2014. How plants water our planet: advances and imperatives. Trends Plant Sci., 19(4), 209-211.
Simpson E.H., 1949. Measurement of diversity. Nature, 163, 160-163.
SODEFOR, 1995. Plan d’aménagement de la forêt classée de la Téné (29 700 ha) : 1994-2006. Abidjan : SODEFOR.
Souvannavong O., 1983. Appui technique au volet aménagement des teckeraies au Togo. Nogent-sur-Marne, France : AFRI/C.T.F.T.
Tulod A.M., Casas J.V., Marin R.A. & Ejoc J.A.B., 2017. Diversity of native woody regeneration in exotic tree plantations and natural forest in Southern Philippines. For. Sci. Technol., 13(1), 31-40, doi.org/10.1080/21580103.2017.1292958
Ugland K.I., Gray J.S. & Ellingsen K.E., 2003. The species-accumulation curve and estimation of species richness. J. An. Ecol., 72(5), 888-897, doi.org/10.1046/j.1365-2656.2003.00748.x
Vroh B.T.A.& Adou Yao C.Y., 2017. Successional dynamics of tree species during forest recovery in the southeast of Côte d’Ivoire. Sci. Vie Terre Agron. Rev. CAMES, 5(2), 30-38.
Vroh B.T.A., N’Guessan K.E. & Adou Yao C.Y., 2017. Trees species diversity in perennial crops around Yapo protected forest, Côte d’Ivoire. J. Hortic. For., 9(11), 98-108, doi.org/10.5897/jhf2017.0507
Vroh B.T.A., Abrou N.E.J., Goné Bi Z.B. & Adou Yao C.Y., 2019. Systèmes agroforestiers à cacaoyers en Côte d’Ivoire : connaissances existantes et besoins de recherche pour une production durable. Rev. Marocaine Sci. Agron. Vét., 7(1), 99-109.






