- Accueil
- Volume 26 (2022)
- Numéro 2
- Présence des aflatoxines et de l’ochratoxine A dans les denrées alimentaires : évaluation du risque encouru par des consommateurs de poisson fermenté (adjuevan) commercialisé à Abidjan (Côte d’Ivoire)
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Présence des aflatoxines et de l’ochratoxine A dans les denrées alimentaires : évaluation du risque encouru par des consommateurs de poisson fermenté (adjuevan) commercialisé à Abidjan (Côte d’Ivoire)

Document(s) associé(s)
Version PDF originaleRésumé
Description du sujet. Le poisson fermenté « adjuevan » est utilisé comme exhausteur de gout en Afrique de l’Ouest grâce à sa flaveur, mais l’environnement insalubre dans lequel cette denrée est produite porte à croire qu’elle pourrait renfermer des mycotoxines.
Objectifs. Évaluer le niveau de contamination du poisson fermenté par les aflatoxines et l’ochratoxine A (OTA) et le risque encouru par les consommateurs.
Méthode. L’ochratoxine A et les aflatoxines ont été quantifiées par chromatographie en phase liquide à haute performance (CLHP) dans les échantillons de poisson fermenté. Les marges d’exposition ont été déterminées pour l’OTA et les aflatoxines.
Résultats. La teneur en aflatoxine totale était comprise entre 1x10-3 µg·kg-1 et 42,86 µg·kg-1, tandis que celle de l’OTA a oscillé entre 0,09 µg·kg-1 et 0,15 µg·kg-1. Par ailleurs, les marges d’exposition relatives à l’OTA ont oscillé entre144 227 et 1 484 892 pour les effets non néoplasiques et entre 442 134 et 4 551 995 pour les effets néoplasiques. Les marges d’exposition relatives aux aflatoxines B1 et G2 ont respectivement varié entre 423 et 3 683, et entre 431 et 3 754. Pour l’aflatoxine B2, 76,04 % des marges d’exposition ont été inférieures à 10 000, tandis qu’au niveau de l’aflatoxine G1, les marges d’exposition ont été supérieures à 10 000.
Conclusions. L’adjuevan peut engendrer les effets cancérigènes des aflatoxines (AFB1, AFB2 et AFG2) chez le consommateur. Par contre, la consommation de l’adjuevan seul n’est pas suffisante pour l’apparition des effets (non néoplasique et néoplasique) de l’OTA et des effets cancérigènes liés à l’AFG1.
Abstract
Risk associated with the presence of mycotoxins (aflatoxins and ochratoxin A) in foodstuffs: the case of fermented fish (adjuevan) marketed in Abidjan (Côte d’Ivoire)
Description of the subject. The fermented fish “adjuevan” is used as a taste enhancer in West Africa because of its flavor. However, the unhealthy environment in which this food is produced suggests that it may contain mycotoxins.
Objectives. To assess the level of aflatoxin and ochratoxin A contamination of fermented fish and the risk to consumers.
Method. Ochratoxin A and aflatoxins were quantified using high performance liquid chromatography (HPLC) in samples of fermented fish. Margins of exposure (MOEs) were determined for OTA and aflatoxins.
Results. Total aflatoxin content ranged from 1x10-3 µg·kg-1 to 42.86 µg·kg-1, while OTA content ranged from 0.09 µg·kg-1 to 0.15 µg·kg-1. On the other hand, the margins of exposure for OTA ranged from144,227 to 1,484,892 for non-neoplastic effects, and from 442,134 to 4,551,995 for neoplastic effects. The MOEs for aflatoxins B1 and G2 ranged from 423 to 3,683 and from 431 to 3,754, respectively. For aflatoxin B2, 76.04% of the MOEs were lower than 10,000 while for aflatoxin G1 the margins of exposure were higher than 10,000.
Conclusions. Adjuevan can induce the carcinogenic effects of aflatoxins (AFB1, AFB2 and AFG2) to the consumer. Nevertheless, the consumption of adjuevan alone is not sufficient for occurrence of the effects (non-neoplastic and neoplastic) of OTA and the carcinogenic effects of AFG1.
Table des matières
Reçu le 19 juillet 2021, accepté le 23 février 2022, mis en ligne le 30 mars 2022
Cet article est distribué suivant les termes et les conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr)
1. Introduction
1En Côte d’Ivoire, comme dans la plupart des pays en voie de développement, le poisson est un aliment très important grâce à sa teneur en protéines et à sa valeur nutritionnelle (Jain & Pathare, 2007). Malheureusement, dans ces pays, les conditions climatiques et environnementales associées au manque d’infrastructures adéquates de conservation font du poisson une denrée très périssable après sa capture. Des procédés traditionnels tels que le séchage, le salage, le fumage et la fermentation sont utilisés pour augmenter la durée de vie du poisson, limiter les pertes en éléments nutritionnels et améliorer sa qualité organoleptique (Kouakou et al., 2013).
2En Afrique de l’Ouest, la fermentation des produits de pêche est une pratique courante très ancienne et le poisson fermenté est appelé « momoni » au Ghana, « lahouin » au Bénin et « adjuevan » en Côte d’Ivoire. L’adjuevan améliore la flaveur des préparations culinaires, il est donc utilisé comme assaisonnement par la plupart des ménages ivoiriens. Malheureusement, la méthode de production, les conditions d’hygiène relatives à la manutention, à la conservation et au stockage de cette denrée sont artisanales et souffrent de beaucoup d’imperfections (Kouakou et al., 2013). L’insalubrité et l’humidité élevée auxquelles l’adjuevan est soumis sont propices à la prolifération des moisissures sécrétrices de mycotoxines, notamment les aflatoxines et l’ochratoxine A (OTA), qui peuvent contaminer cette denrée. L’OTA est néphrotoxique et potentiellement cancérogène. Classée dans le groupe 2B « cancérigène possible pour l’homme » par le Centre International de Recherche sur le Cancer, l’activité cancérogénique de l’OTA est due aux adduits à l’ADN formés par les quinones (Pfohl-Leszkowicz et al., 2002 ; Tozlovanu et al., 2006 ; Pfohl-Leszkowicz & Manderville, 2007). Les aflatoxines sont classées dans le groupe 1, donc cancérigènes avérées pour l’homme (IARC, 2021). Les aflatoxines sont aussi connues pour leurs effets mutagène, hépatotoxique, génotoxique et immunosuppresseur (AFSSA, 2009).
3L’OTA et les aflatoxines peuvent alors constituer un problème de santé publique à l’image de la néphropathie endémique des Balkans (ANSES, 2011). Les mycotoxines donc sont devenues très préoccupantes pour la politique mondiale de la sécurité sanitaire des aliments, et particulièrement en Afrique subsaharienne où les conditions climatiques associées à la non-maitrise des systèmes d'analyse des risques et de maitrise des points critiques (HACCP) conduisent fréquemment à la présence des mycotoxines dans les denrées alimentaires (Dembele et al., 2009 ; Kpan Kpan et al., 2019). De nos jours, les consommateurs s’orientent de plus en plus vers les produits alimentaires biologiques, et le poisson fermenté peut être proposé comme exhausteur naturel de gout car sa préparation fait appel à un seul agent chimique, qui est le chlorure de sodium ou sel de cuisine. Cette étude a pour objectif de déterminer l’occurrence de l’OTA et des aflatoxines dans des échantillons de poisson fermenté et d’en évaluer le risque encouru par les consommateurs.
2. Matériel et méthodes
2.1. Matrice biologique
4Le matériel biologique était constitué de poisson fermenté obtenu à partir de l’espèce Thunnus thynnus (thon). Ce choix tient compte de la prépondérance de cette catégorie de poisson fermenté sur les marchés locaux d’Abidjan (Côte d’Ivoire).
2.2. Solvants et réactifs
5L’acide acétique (100 %) Normaphur (Leuven, Belgique), l’hydrogénocarbonate de sodium (99,7 %) Merck (Darmstadt, Allemagne), l’acétonitrile grade HPLC CHEM-LAB (Zedelgem, Belgique) ont été utilisés. L’eau ultra pure a été obtenue à l’aide d’un purificateur ELGA (High Wycombe, Angleterre). Les étalons d’OTA (10 µg·ml-1 dans l’acétonitrile) et les aflatoxines (B1 ; B2 ; G1 ; G2 : 2 µg·ml-1 dans l’acétonitrile) ont été fournis par Superlco INC (Bellefonte, États-Unis).
2.3. Appareillage
6Une chaine de CLHP SHIMADZU (Tokyo, Japon) munie d’un dégazeur DGU-20A5, d’une pompe LC-20AT, d’un échantillonneur automatique SIL-20A, d’un réservoir TRAY, d’un four CTO-20A et d’un détecteur à fluorescence RF10 AX a été utilisée pour la détection des aflatoxines et de l’OTA. Une balance électronique SHIMADZU (Tokyo, Japon) avec une précision de ± 0,01 g a permis de déterminer la masse des échantillons. Pour homogénéiser les extraits, un mixeur (Ultra Turax, OMNI INTERNATIONAL, Kennesaw GA, États-Unis) a été utilisé. La détermination du poids corporel (pc) des consommateurs a nécessité une balance pèse-personne (KINLEE). L’extraction et la purification des extraits ont été possibles grâce à l’usage de puits de purification, de pompe à vide VACUUBRAND (Vertheim, Allemagne), de colonnes d’immuno-affinité Aflaprep, Ochraprep provenant de R-BIOPHARM (Darmstadt, Allemagne), de centrifugeuse HETTICH (ZAC de Montévrain, France) et de papier filtre, Whatman, Fisher Scientific (Paris, France).
2.4. Échantillonnage
7Quinze échantillons d’adjuevan ont été collectés dans trois marchés (grand marché, marché de Bocabo et marché d’Avocatier) appartenant à la commune d’Abobo incluse dans le district d’Abidjan (Côte d’Ivoire). Cinq vendeuses ont été choisies de façon aléatoire dans chaque marché à raison d’un échantillon par vendeuse et la masse de chaque échantillon de poisson fermenté était de 200 g. Ces échantillons étiquetés ont été soigneusement acheminés au Laboratoire Central d’Agrochimie et d’Écotoxicologie pour la détermination de leurs teneurs en OTA et aflatoxines.
2.5. Détermination de la teneur en aflatoxines et en ochratoxine A
8Les aflatoxines ont été dosées selon la méthode ISO 16050 : 2003 (ISO, 2003) et l’OTA a été dosée selon la méthode NF EN 14132 : 2009 (AFNOR, 2009). Les étapes clés de ces méthodes sont l’extraction, la purification et la quantification.
9Extraction et purification des aflatoxines. Les échantillons d’adjuevan ont été finement broyés à l’aide d’un mortier en porcelaine. Une quantité de 20 g du broyat d’adjuevan a été prélevée dans un ballon de 200 ml, puis 100 ml de mélange méthanol/eau bidistillée (80/20 : v/v) y ont été ajoutés. La solution obtenue a été ensuite homogénéisée à l’abri de la lumière pendant 30 m. Après centrifugation de l’homogénat à 5 000 tr·min-1 pendant 5 min, le surnageant obtenu a été filtré sous vide sur du papier filtre Whatman N⁰4 dans un erlenmeyer. Dix millilitres de ce filtrat ont été prélevés puis dilués à l’aide de 40 ml d’une solution tampon phosphate saline (PBS). Dix millilitres de la solution diluée ont été déposés dans la colonne d’Immun-Affinité (IA) (Aflaprep) préalablement conditionnée à l’aide de 10 ml de tampon PBS à un débit de 3 ml·min-1. Après rinçage avec 10 ml du tampon PBS, les aflatoxines ont été éluées avec 1,5 ml de méthanol puis diluées en utilisant 1,5 ml d’eau bidistillée pour obtenir la solution prête à l’injection dans le système chromatographique.
10Extraction et purification de l’OTA. Pour extraire l’OTA, 15 g de broyat d’adjuevan ont été prélevés puis 150 ml de mélange méthanol/hydrogénocarbonate de sodium (1 %) dans de l’eau (50/50 : v/v) y ont été ajoutés. Ce mélange a été homogénéisé au mixeur (Ultra Turax) pendant 2 min. La solution obtenue a été centrifugée à 4 000 tr·min-1 pendant 5 min, puis filtrée sur du papier Whatman n°4 dans une éprouvette de 25 ml. Une fraction de 11 ml du filtrat a été diluée en y ajoutant un volume équivalent de solution tampon phosphate saline (PBS) et la purification a été faite sur colonne d’Immuno-Affinité (Ochraprep). Cette colonne a été conditionnée à l’aide de 10 ml de solution PBS à un débit de 10 ml·min-1 en utilisant une pompe à vide (Gilson). Un volume de 20 ml de l’extrait dilué a été déposé goutte à goutte dans la colonne puis le solvant a été évacué à la vitesse de 2 ml·min-1. La colonne a été lavée avec 10 ml de PBS et l’OTA a été décrochée par deux lavages successifs dont le premier a nécessité 1,5 ml d’un mélange de méthanol/acide acétique (96/4 ; v/v) et le second a été réalisé en utilisant 1,5 ml de PBS à un débit de 5 ml·min-1. L’extrait ainsi purifié a été transféré dans un vial pour être injecté dans le système chromatographique.
11Détermination des taux de récupération. Les taux de récupération (Tr) ont été déterminés par la méthode des ajouts dosés. En effet, 15 g de poisson fermenté ont été dopés à l’aide de 1 ml d’étalon dosé à 10 µg·l-1 (aflatoxines ou OTA). Après un temps de latence de 30 min, la mycotoxine concernée a été extraite puis quantifiée. Le taux de récupération a été calculé selon l’expression (Kpan Kpan et al., 2019) :
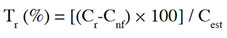
12avec Tr : taux de récupération (%) ; Cr : teneur réelle en mycotoxine de la portion d’échantillon fortifiée (µg·kg-1) ; Cnf : teneur en mycotoxine de la portion d’échantillon non fortifiée (µg·kg-1) ; Cest : teneur estimée de la mycotoxine de la portion d’échantillon fortifiée (µg·kg-1).
13Quantification des aflatoxines et OTA. La détermination des mycotoxines a été réalisée à l’aide de la chaine de CLHP (SHIMADZU) dont la phase stationnaire était constituée d’une colonne en phase inverse (RP) Shim pack VP-ODS 5 µm-C18-100 (250 L x 4,6 mm ID). Le système chromatographique a été préalablement étalonné à l’aide de solutions étalons distinctes d’aflatoxines et d’OTA dosées à 10 µg·l-1. Pour les aflatoxines, la phase mobile était constituée à 40 % d’un mélange d’acétonitrile/méthanol (50 :50 ; v/v) et à 60 % d’eau bidistillée. L’élution a été réalisée en mode isocratique à un débit de 1,5 ml·min-1, la température du four étant maintenue à 40 °C. Le volume d’injection était de 20 µl et la détection a été réalisée en fluorescence aux longueurs d’onde d’excitation de 350 nm et d’émission de 450 nm. Concernant l’OTA, la phase mobile était composée de 45 % de mélange acide acétique/eau bidistillée (2 : 98 ; v/v) et de 55 % d’acétonitrile. L’élution a été effectuée en mode isocratique avec un débit d’élution de 1 ml·min-1, la température du four étant fixée à 40 °C. Les longueurs d’onde d’excitation et d’émission ont été respectivement 330 mn et 460 nm.
14Les teneurs en mycotoxines ont été déterminées à travers l’expression :
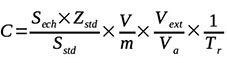
15avec C : concentration de l’échantillon (µg·kg-1) ; Zstd : concentration du standard (µg·l-1) ; Sech : surface du pic de l’échantillon ; Sstd : surface du pic du standard ; V : volume final obtenu par la récupération (l) ; Va : volume après filtration (l) ; m : masse de l’échantillon (kg) ; Vext : volume après extraction (l) et Tr : taux de récupération.
2.6. Consommation de l’adjuevan au sein des ménages (diète journalière)
16Pour évaluer la diète journalière de la population cible, une fiche d’enquête a été mise au point. Cette fiche rend compte de plusieurs points, en l’occurrence le nom du site, le sexe, l’âge, le poids, le prix d’adjuevan consommé quotidiennement par chaque ménage et le nombre de personnes que renferme chaque ménage. Pour déterminer la masse d’adjuevan consommée par les ménages, un calibrage a été réalisé. Lors de ce calibrage, plusieurs échantillons d’adjuevan de 600 F CFA ont été achetés chez différentes vendeuses afin de déterminer la masse moyenne de ces échantillons (W). Ensuite, la quantité d’adjuevan consommée quotidiennement par chaque ménage a été établie comme suit :
17600 F CF1A => W (g) ;
18X F CFA => Y(g) ;
19Y = (X×W) ⁄ 600
20avec Y : quantité d’adjuevan consommée quotidiennement par chaque ménage (g) ; X : le prix d’adjuevan consommé quotidiennement par chaque ménage (FCFA).
21La quantité de poisson fermenté consommée quotidiennement par chaque individu a été estimée selon la formule suivante :
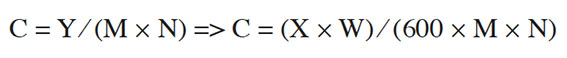
22C : quantité d’adjuevan quotidiennement consommée par chaque individu (kg pc·jour-1) ; M : poids du consommateur (kg) et N : nombre de personnes par ménage.
2.7. Étude de l’exposition et caractérisation du risque
23L’exposition journalière à l’OTA et aux aflatoxines a été déterminée selon l’expression (ANSES, 2016) :
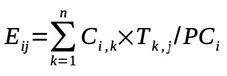
24avec Ei,j : exposition à la substance j de l’individu i (µg·kg pc-1·j-1) ; n : nombre d’aliments dans le régime de l’individu ; Ci,k : consommation de l’aliment k par l’individu i (kg) ; Tk,j : teneur médiane ou moyenne en substance j de l’aliment k (µg·kg-1) et PCi : poids corporel de l’individu i (kg).
25Dans le dernier avis de l’autorité européenne de la sécurité des aliments (EFSA) sur l'OTA et les aflatoxines, l’EFSA a préconisé que la caractérisation du risque concernant ces mycotoxines soit effectuée par l’approche de la marge d’exposition (ME) (ChemSafety Pro, 2018). Cette grandeur a été déterminée selon l’expression :
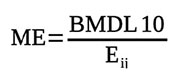
26avec ME : marge d’exposition ; BMDL10 : Benchmark Dose ; Ei,j : exposition journalière à la substance j de l’individu i (µg·kg pc-1·j-1).
27La ME ≥ 10 000 traduit que le risque encouru par le consommateur n’est pas significatif, tandis qu’une ME < 10 000 indique que le risque encouru par le consommateur est significatif.
28Lors de la détermination de la ME relative à chaque aflatoxine (AFB1, AFB2, AFG1 et AFG2), la BMDL10 de 0,4 µg·kg-1 de poids corporel, associée à l’incidence des carcinomes hépatocellulaires (CHC) chez les rats mâles, a été utilisée (EFSA, 2020a).
29Au niveau de l’OTA, la BMDL10 de 4,73 µg·kg-1 de poids corporel par jour calculée à partir des lésions rénales observées chez le porc, a été utilisée lors de la caractérisation du risque relatif aux effets non néoplasiques. Concernant les effets néoplasiques, la BMDL10 de 14,5 µg·kg-1 de poids corporel par jour déterminée à partir des tumeurs rénales observées chez les rats, a été utilisée.
30Pour cette mycotoxine, la ME ≥ 200 indique que le risque de survenue des effets non néoplasiques chez le consommateur n’est pas significatif, alors qu’une ME < 200 indique que le risque de survenue des effets non néoplasiques est significatif chez le consommateur (EFSA, 2020b). Pour les effets néoplasiques de l’OTA, le seuil de la ME est 10 000, comme dans le cas des aflatoxines.
3. Résultats
3.1. Teneurs en aflatoxines et en ochratoxine A
31Les taux de récupération des extractions ont été 89,10 ± 0,76 % pour l’OTA et 89,52 ± 1,04 % pour l’aflatoxine B1 sur un nombre d’essais (n = 5) (Tableau 1).
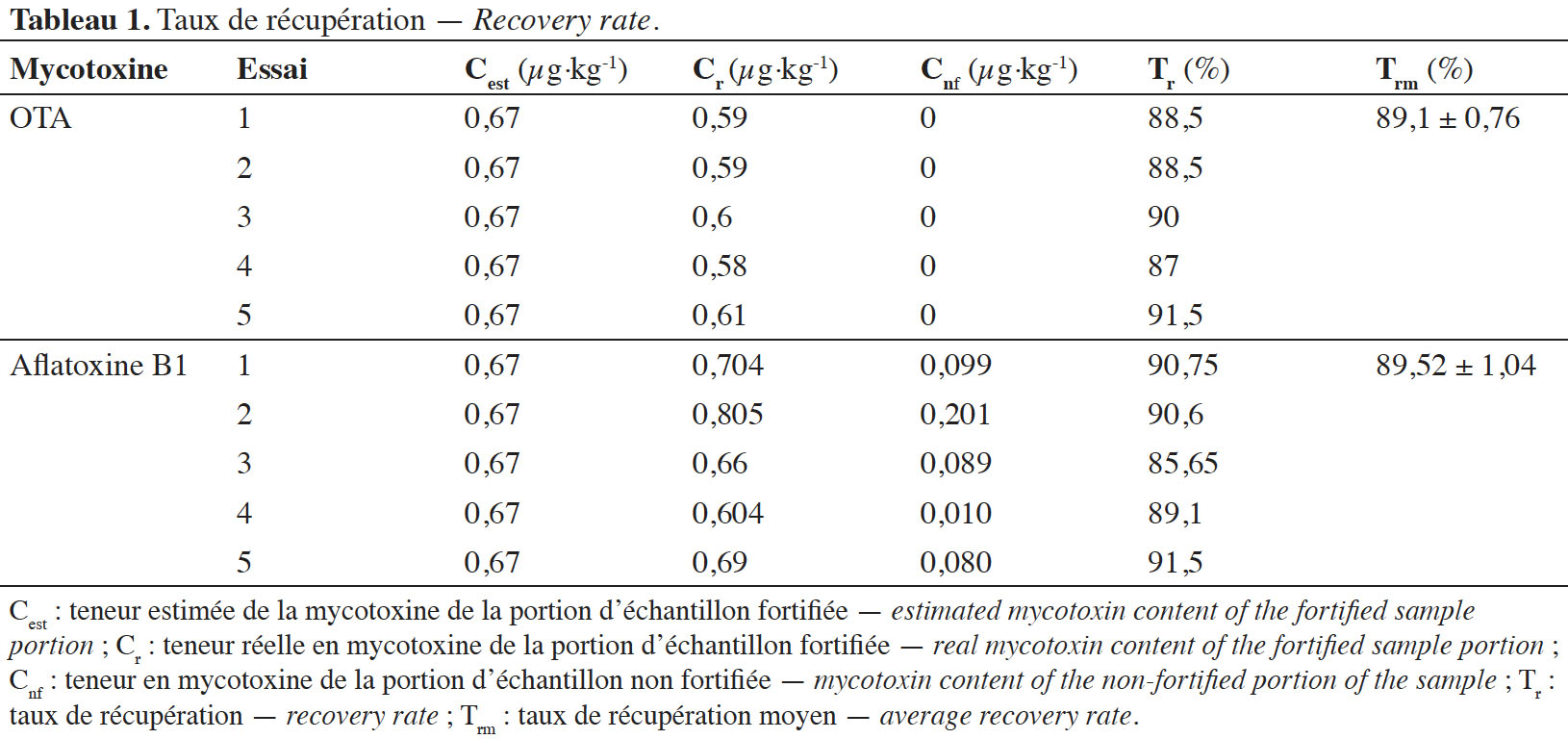
32L’OTA a été détectée dans 80 % des échantillons analysés avec les teneurs supérieures à la limite de quantification (LQ). Les teneurs en OTA étaient comprises entre 0,09 et 0,15 µg·kg-1 (Tableau 2).
33La distribution des teneurs en OTA des marchés prospectés est mise en évidence par la figure 1.
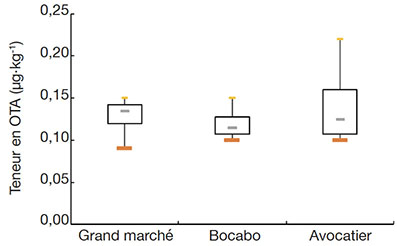
Figure 1. Boîte à moustache des teneurs en OTA des échantillons — Box plots of OTA content of samples.
34Les aflatoxines ont été détectées dans 100 % des échantillons analysés. L’aflatoxine B1 a été retrouvée dans 20 % des échantillons, l’aflatoxine B2 a été observée dans 33,33 % des échantillons. Les aflatoxines G1 et G2 ont été respectivement retrouvées dans 80 % et 26,67 % des échantillons. La teneur en aflatoxine totale était comprise entre 1x10-3 µg·kg-1 et 42,86 µg·kg-1 ; la teneur moyenne en aflatoxine totale étant égale à 7,54 µg·kg-1 (Tableau 3).
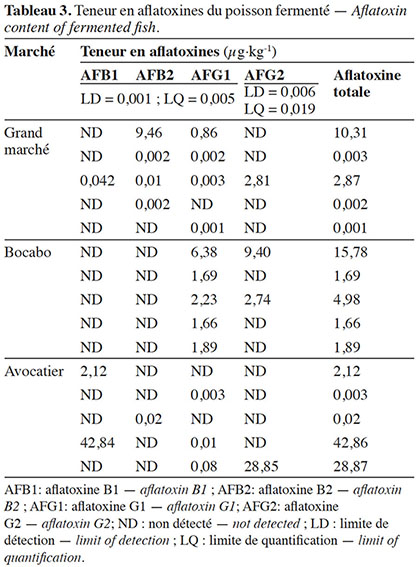 La distribution des teneurs en aflatoxines totales des échantillons de poisson fermenté en fonction des marchés est présentée dans la figure 2.
La distribution des teneurs en aflatoxines totales des échantillons de poisson fermenté en fonction des marchés est présentée dans la figure 2.
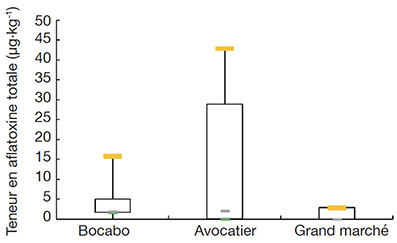
Figure 2. Boîte à moustache des teneurs en aflatoxine totale des échantillons — Box plots of total aflatoxin content of samples.
3.2. Étude de l’exposition et de la caractérisation du risque
35Consommation du poisson fermenté. Au total, 61 ménages ont été visités à raison de 20 à Bocabo, 20 à Avocatier et 21 à Habitat, avec un effectif total de 196 personnes. La majeure partie des individus enquêtés était de sexe féminin (57,5 %) contre 42,6 % de sexe masculin. L’âge des individus a oscillé entre 4 et 65 ans. Les enfants représentaient 17,9 % de l’effectif contre 82,1 % d’adultes. Les données de consommation ont pu être déterminées chez 47,44 % des enquêtés. Le poids de cette frange de population a fluctué entre 21 et 98 kg. Le nombre d’individus des ménages a varié entre 1 et 6 avec une moyenne de 3,21 individus par ménage. La quantité d’adjuevan consommée par jour au niveau de chaque ménage était comprise entre 0 et 16,67 g avec une moyenne de 12,79 g par ménage. La quantité d’adjuevan consommée quotidiennement par tous les ménages a été de 780,76 g. La consommation journalière individuelle d’adjuevan a fluctué entre 2,78 et 8,34 g, avec une moyenne de 3,98 g.
36Caractérisation du risque lié à l’OTA. Les valeurs de la marge d’exposition (ME) relative aux effets non néoplasiques de l’OTA ont varié entre 144 227 et 1 484 892. Concernant les effets néoplasiques, les valeurs de la marge d’exposition étaient comprises entre 442 134 et 4 551 995 (Tableau 4). Dans les deux cas, les valeurs de la marge d’exposition sont supérieures aux valeurs de référence qui sont de 200 pour les effets non néoplasiques et de 10 000 pour les effets néoplasiques.

37Caractérisation du risque lié aux aflatoxines. Les marges d’exposition relatives aux AFB1 et AFB2 sont toutes supérieures à 10 000. Les ME de l’AFB1 sont comprises 423 et 3 683 et celles relatives à l’AFG2 oscillent entre 431 et 3 754. Concernant l’AFB2, les ME se situent entre 2 007 et 17 485 (Tableau 5).

4. Discussion
38Les échantillons d’adjuevan sont faiblement contaminés par l’OTA. En termes d’aflatoxine totale, tous les échantillons sont contaminés par les aflatoxines. Prises individuellement, les aflatoxines AFB1, AFB2, AFG1 et AFG2 ont été retrouvées dans très peu d’échantillons. Cependant, quelques échantillons présentent des teneurs élevées en ces mycotoxines. Les faibles teneurs en OTA et en aflatoxines pourraient s’expliquer par la présence du chlorure de sodium dans le poisson fermenté « adjuevan ». En effet, le sel de cuisine est utilisé comme agent de déshydratation lors de la confection du poisson fermenté (Kouakou et al., 2013). Or, le sel possède un pouvoir inhibiteur des moisissures du genre Aspergillus (Samapundo et al., 2010), alors que les aflatoxines et l’OTA sont des toxines produites par des moisissures du genre Aspergillus, plus particulièrement A. flavus et A. parasiticus pour les aflatoxines (ANSES, 2012 ; OMS, 2018) et A. ochraceus pour l’OTA (Brochard & Le Bâcle, 2009 ; ANSES, 2011). La présence des mycotoxines dans l’adjuevan et surtout les fortes teneurs en aflatoxines de certains échantillons pourraient donc s’expliquer par le salage insuffisant du thon lors de la confection de l’adjuevan, vu le pouvoir inhibiteur du sel sur les moisissures.
39Les marges d’exposition relatives à l’OTA montrent que le risque d’apparition des effets néfastes (non néoplasique et néoplasique) de l’ochratoxine A au sein de la population soumise à cette étude n’est pas significatif. En effet, pour cette mycotoxine, les marges d’exposition relatives aux effets non néoplasiques ont été 721 à 7 424 fois supérieures au seuil de référence (SR = 200) et les ME relatives aux effets néoplasiques ont été 44 à 455 fois plus élevées que le seuil de référence (SR =10 000). Cet état des faits pourrait s’expliquer par les faibles teneurs en OTA du poisson fermenté.
40Les ME relatives à l’AFB1 sont 3 à 24 fois inférieures au seuil de référence (SR = 10 000). Cela suggère que le risque d’apparition des effets cancérigènes liés à cette mycotoxine est significatif pour toute la population soumise à l’étude. Cette situation est la même pour l’AFG2 car pour cette mycotoxine, les ME sont 3 à 23 fois inférieures au seuil de référence (SR =10 000). Concernant l’AFB2, 76,04 % des individus soumis à l’étude présentent un risque significatif de développer les effets cancérigènes liés à cette mycotoxine (ME < SR = 10 000). Pour l’AFG1, les ME sont 15 à 138 fois supérieures à 10 000, ce qui indique que le risque de survenue du cancer lié à l’AFG1 n’est pas significatif chez les consommateurs d’adjuevan. Le risque significatif de survenue du cancer lié aux aflatoxines (AFB1, AFB2 et AFG2) pourrait s’expliquer par les teneurs élevées de ces mycotoxines dans certains échantillons d’adjuevan (AFB1 = 42,84 µg·kg-1, AFB2 = 9,46 µg·kg-1, AFG2 = 28,85 µg·kg-1). Ces teneurs élevées ont amplifié les teneurs moyennes (utilisées dans la détermination de la ME), malgré la présence de chacune de ces mycotoxines dans très peu d’échantillons.
41Par ailleurs, dans un contexte d’évaluation holistique de risque lié aux aflatoxines et à l’OTA, la présence de l’OTA et des aflatoxines dans l’adjuevan peut contribuer à l’augmentation des quantités d’aflatoxines et d’OTA ingérées, et amplifier le risque chez le consommateur.
42En effet, l’adjuevan est utilisé pour la préparation des sauces où il joue le rôle d’exhausteur de gout. Ces sauces sont des mélanges de plusieurs ingrédients (arachide, gombo, piment, etc.) susceptibles eux-mêmes de contenir des mycotoxines. Plusieurs études l’attestent bien. Les études de Diakité et al. (2017) réalisées sur des échantillons de pâte d’arachide prélevés sur trois marchés populaires d’Abidjan (Abobo, Adjamé et Yopougon) ont révélé des teneurs d’aflatoxine B1 (AFB1) de l’ordre de 2 µg·kg-1 dans cette denrée. Ces niveaux de contamination étaient significatifs car ils correspondent à la limite maximale tolérable (LMT) autorisée par l’Union européenne. Selon les études de Sangaré et al. (2006b), le niveau moyen de contamination des arachides des marchés abidjanais par l’AFB1 était de 4,8 µg·kg-1 (1,5 à 10 µg·kg-1, N = 10).
43En outre, les sauces se consomment avec les céréales (riz, maïs) ou les féculents (manioc, igname, banane, taro, etc.) qui sont eux aussi sujets à des contaminations par les mycotoxines (OTA et aflatoxines). En effet, des teneurs très élevées en OTA ont été observées dans des échantillons de maïs, de mil et de riz collectés sur les marchés de Treichville, Abobo et Adjamé, trois communes d’Abidjan. Ces teneurs en OTA ont oscillé entre 3 µg·kg-1 et 1 738 µg·kg-1 pour le maïs dans la totalité des 41 échantillons analysés, entre 17 µg·kg-1 et 204 µg·kg-1 pour le mil et entre 9 µg·kg-1 et 92 µg·kg-1 pour le riz (Sangaré et al., 2006a).
44Enfin, la présence des mycotoxines (OTA et aflatoxines) dans le thon fermenté augmente le risque global encouru par les consommateurs de thon fermenté (adjuevan) car cette question vient s’ajouter à la problématique de l’histamine à laquelle le thon est sujet (FAO, 2012).
5. Conclusions
45Cette étude a révélé la présence de l’OTA et des aflatoxines dans la plupart des échantillons d’adjuevan analysés. La marge d’exposition a montré que l’adjuevan peut engendrer les effets cancérigènes des aflatoxines (AFB1, AFB2 et AFG2) chez le consommateur au regard des marges d’exposition qui ont été largement inférieures à 10 000. Par contre, la consommation de l’adjuevan seul n’est pas suffisante pour l’apparition des effets non néoplasique et néoplasique de l’OTA, eu égard aux marges d’exposition qui ont été largement supérieures aux seuils respectifs de 200 et 10 000. Le risque de cancérogenèse lié à la présence de l’AFG1 dans l’adjuevan n’est pas significatif vu les ME largement supérieures à 10 000.
46En outre, l’adjuevan pourrait contribuer à l’élévation du taux de l’OTA et des aflatoxines chez le consommateur dans la mesure où l’adjuevan est une composante des mets qui renferment des denrées de base telles que le riz, le maïs, l’igname, le manioc, susceptibles d’être contaminées par ces mycotoxines. Il est opportun de mettre en œuvre des mesures de lutte préventive contre la contamination de l’adjuevan par ces mycotoxines car le poisson fermenté est un ingrédient rencontré dans plusieurs mets d’Afrique de l’Ouest. Pour cela, la confection du poisson fermenté doit obéir à des procédures soigneusement élaborées, testées et fiables pour empêcher le développement des moisissures sécrétrices de mycotoxines.
Bibliographie
AFNOR, 2009. NF EN 14132- V03-126. Produits alimentaires - Dosage de l'ochratoxine A dans l'orge et le café torréfié - Méthode par purification sur colonne d'immuno-affinité suivie d'une analyse par chromatographie liquide haute performance (CLHP). La Plaine Saint-Denis, France : AFNOR.
AFSSA, 2009. Évaluation des risques liés à la présence de mycotoxines dans les chaînes alimentaires humaine et animale. Rapport final. Maisons-Alfort, France : AFSSA.
ANSES, 2011. Aspergilli et Penicillia producteurs d’ochratoxine A (OTA). Fiche de description de danger biologique transmissible par les aliments. Maisons-Alfort, France : ANSES.
ANSES, 2012. Aspergillus flavus et autres moisissures productrices d’aflatoxines. Fiche de description de danger biologique transmissible par les aliments. Maisons-Alfort, France : ANSES.
ANSES, 2016. Étude de l’alimentation totale infantile. Tome 2 - Partie 3 : composés organiques. Rapport d’expertise collective. Maisons-Alfort, France : ANSES.
Brochard G. & Le Bâcle C., 2009. Mycotoxines en milieu de travail. Dossier médico-technique. Paris : INRS.
ChemSafety Pro, 2018. What are margin of exposure (MOE) and margin of safety (MOS) and how to calculate, https://www.chemsafetypro.com/Topics/CRA/margin_of_safety_MOS_margin_of_exposure_MOE_difference_chemical_risk_assessment.html, (14 janvier 2022).
Dembélé A. et al., 2009. Détermination du niveau de contamination de l’ochratoxine A (OTA) dans les fèves de cacao à l’exportation. Tropicultura, 27(1), 26-30.
Diakité A., Gouli Bi I.M., N’dri D.K. & Yapo J.A., 2017. Détermination de la contamination par l’Aflatoxine B1 de la pâte d’arachide consommée par la population en Côte d’Ivoire : intérêt de la Chromatographie sur Couche Mince. Int. J. Biol. Chem. Sci, 11(4), 1646-1654, doi.org/10.4314/ijbcs.v11i4.19
EFSA, 2020a. Risk assessment of aflatoxins in food. EFSA J., 18(3), 6040.
EFSA, 2020b. Risk assessment of ochratoxin A in food. EFSA J., 18(5), 6113.
FAO, 2012. Report of the Joint FAO/WHO expert meeting on public health risks of histamine and other biogenic amines from fish and fishery products, 23-27 July 2012, Roma, Italy. Roma: FAO.
IARC, 2021. Agents Classified by the IARC Monographs, volumes 1-128. Lyon, France : IARC.
ISO, 2003. ISO 16050:2003. Produits alimentaires- Dosage de l'aflatoxine B1 et détermination de la teneur totale en aflatoxines B1, B2, G1 et G2 dans les céréales, les fruits à coque et les produits dérivés - Méthode par chromatographie liquide à haute performance. Genève, Suisse : ISO.
Jain D. & Pathare P., 2007. Determination of thermal diffusivity of freshwater fish during ice storage by using a one-dimensional fourier cylindrical equation. Biosyst. Eng., 96, 407-412, doi.org/10.1016/j.biosystemseng.2006.12.004
Kouakou A.C. et al., 2013. Production et commercialisation de l'adjuevan, poisson fermenté de Côte d'Ivoire. Cah. Agric., 22, 559-567.
Kpan Kpan K.G. et al., 2019. Validation of HPLC-UV patulin determination method in traditional juices from Côte d’Ivoire. Eur. Sci. J., 15(36), 253-266, doi.org/10.19044/esj.2019.v15n36p253
OMS, 2018. Les aflatoxines. Note de sécurité sanitaire des aliments. Genève, Suisse : OMS.
Pfohl-Leszkowicz A., Petkova-Bocharova T., Chernozemsky I.N. & Castegnaro M., 2002. Balkan endemic nephropathy and the associated urinary tract tumors: review on etiological causes, potential role of mycotoxins. Food Addit. Contam., 19(3), 282-302, doi.org/10.1080/02652030110079815
Pfohl-Leszkowicz A. & Manderville R.A., 2007. Ochratoxin A: an overview on toxicity and carcinogenicity in animals and humans. Mol. Nutr. Food Res., 51(1), 61-99, doi.org/10.1002/mnfr.200790020
Samapundo S. et al., 2010. Effect of NaCl reduction and replacement on the growth of fungi important to the spoilage of bread. Food Microbiol., 27(6), 749-756, doi.org/10.1016/j.fm.2010.03.009
Sangare-Tigori B. et al., 2006a. Preliminary survey ofochratoxin A in millet, maize, rice and peanuts in Côte d'Ivoire from1998 to 2002. Hum. Exp. Toxicol., 25, 211-216, doi.org/10.1191/0960327106ht605oa
Sangare-Tigori B. et al., 2006b. Co-occurrence of aflatoxin B1, fumonisin B1, ochratoxin A and zearalenone in cereals and peanuts in Côte d’Ivoire. Food Addit. Contam., 23(10), 1000-1007, doi.org/10.1080/02652030500415686
Tozlovanu M., Faucet-Marquis V., Pfohl-Leszkowicz A. & Manderville R.A., 2006. Genotoxicity of the hydroquinone metabolite of ochratoxin A: structure-activity relationships for covalent DNA adduction. Chem. Res. Toxicol., 19(9),1241-1247, doi.org/10.1021/tx060138g
Notes
1 600 F CFA = 0,91 €.






