Impact de l’exploitation du sable fluvio-lagunaire sur la qualité physico-chimique de l’eau des écosystèmes aquatiques du sud-Bénin
Résumé
Description du sujet. L’étude de la qualité physico-chimique de l’eau vise une connaissance des risques écologiques que l’activité d’extraction du sable peut engendrer sur l’environnement et ses ressources.
Objectifs. Évaluer l’impact de l’extraction du sable fluvio-lagunaire sur la qualité physico-chimique de l’eau des écosystèmes aquatiques du sud-Bénin.
Méthode. Les données ont été collectées mensuellement de décembre 2018 à novembre 2019 au niveau de 16 stations dont huit stations draguées et huit stations non draguées (stations de références). Treize paramètres physico-chimiques dont neuf paramètres (température, pH, transparence, profondeur, salinité, oxygène dissous, conductivité électrique, Solides Totaux Dissous, vitesse du courant) sont analysés in situ et quatre autres (NO2-, NO3-, NH4+, PO43-) au laboratoire. Le test de Kruskal-Wallis, la Matrice de Corrélation, la Classification Hiérarchique Ascendante et l’Analyse en Composantes Principales (ACP) ont été utilisés pour l’analyse des données collectées.
Résultats. Les résultats ont permis d’identifier les effets de l’activité d’extraction du sable sur la physico-chimie de l’eau des écosystèmes aquatiques à travers l’analyse des stations draguées et des stations non draguées. Les stations non draguées présentent des eaux fortement minéralisées associées également à une pollution azotée et phosphorée, ce qui pourrait créer un déséquilibre au niveau de la faune aquatique. Par contre, les stations soumises à l’activité d’extraction du sable présentent les caractéristiques d’eaux bien oxygénées, des pH qui tendent vers la basicité, des eaux bien transparentes et profondes. Les résultats de cette étude montrent que les eaux des milieux dragués sont bien oxygénées et pourraient être bien favorables avec le temps au bon développement des espèces aquatiques, lorsque ceux-ci retrouveront peu à peu leur stabilité et redeviendront riches en matières minérales et nutritives.
Conclusions. Cette étude permettra aux chercheurs et aux services techniques en charge de l'environnement de mieux appréhender les effets de l'activité d'extraction du sable sur la qualité physico-chimique des eaux des hydrosystèmes pour une meilleure gestion de ces milieux.
Abstract
Impact of fluvio-lagoon sand exploitation on the physico-chemical quality of water in aquatic ecosystems in south-Benin
Description of the subject. The study of the physico-chemical quality of water aims to understand the ecological risks that sand extraction activity can generate on the environment and its resources.
Objectives. To assess the impact of river-lagoon sand extraction on the physico-chemical quality of aquatic ecosystems in southern Benin.
Method. Data were collected monthly from December 2018 to November 2019 at 16 stations, comprising eight dredged stations and eight undredged stations (reference stations). Thirteen physico-chemical parameters were analyzed: nine (temperature, pH, transparency, depth, salinity, dissolved oxygen, electrical conductivity, Total Dissolved Solids, current velocity) in situ and four others (NO2-, NO3-, NH4+, PO43-) in the laboratory. The Kruskal-Wallis test, Correlation Matrix, Ascending Hierarchical Classification and Principal Component Analysis (PCA) were used for the analysis of the collected data.
Results. The results made it possible firstly, to identify the effects of sand extraction activity on the physico-chemistry of water in aquatic ecosystems through the analysis of the stations and secondly, to separate these stations into two groups. The first group consists of undredged stations and the second group consists of dredged stations. Undredged stations have highly mineralized waters, also associated with nitrogen and phosphorus pollution, which could create an imbalance in aquatic fauna. On the other hand, the stations subject to the sand extraction activity have the characteristics of well-oxygenated water, a pH that tends towards basicity, and highly transparent and deep waters. The results of this study show that the waters of dredged environments are well oxygenated. This means that these environments could become very favorable over time for the appropriate development of aquatic species, as the waters gradually regain their stability and become rich in minerals and nutrients again.
Conclusions. This study will allow researchers and technical services responsible for monitoring the environment to better understand the effects of sand extraction activity on the physico-chemical quality of water in hydrosystems, leading to better management of these environments.
Reçu le 23 juillet 2021, accepté le 27 avril 2022, mis en ligne le 19 mai 2022
Cet article est distribué suivant les termes et les conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr)
1. Introduction
1L’exploitation des plans d’eau est d’une très grande importance socio-économique au Bénin (Houssou, 2012). En effet, plusieurs activités sont réalisées par les populations dans les écosystèmes aquatiques au sud du Bénin et ces activités sont : la pêche, l’agriculture, le transport sur l’eau, l’exploitation du sable lagunaire, etc. La pêche, qui constitue la première activité, est un moyen de subsistance pour de nombreuses communautés. Les Tofinou, les Wémènou et les Xuéda en font leur activité principale (Tossou, 2000). Cette activité constitue une importante source de revenus pour les pêcheurs et présente toutefois de nombreux inconvénients au nombre desquels nous pouvons citer : le déboisement des forêts, la destruction des mangroves, un accroissement des charges sédimentaires, la turbidité et, par conséquent, la diminution du potentiel ichtyologique des plans d’eau. Vient ensuite l’agriculture qui consomme peu d’intrants mais dont la quantité de pesticides et d’engrais utilisée ne cesse de croître d’année en année, surtout avec l’augmentation des superficies emblavées en ce qui concerne les cultures de rente. L’utilisation de ces produits fait courir de graves menaces sur les écosystèmes aquatiques (Gnohossou, 2006). L’agriculture est très diversifiée autour du complexe lagunaire et occupe près de 80 % de la population active. Les principales cultures vivrières pratiquées sont le maïs, l’igname, le manioc et surtout le niébé (Gnohossou, 2006). Comme troisième activité, il y a le transport des personnes, des biens et des produits de première nécessité sur l’eau qui joue un rôle déterminant dans le quotidien des communautés lacustres. Parmi tous les biens transportés, les produits pétroliers sont les plus dangereux pour la faune aquatique (Dovonou et al., 2011) et il est souvent noté un important trafic de produits pétroliers avec de nombreux débarcadères le long des berges et des points de vente sur l’eau. Enfin, l’exploitation du sable lagunaire, qui fait l’objet de cette étude, est une activité très répandue dans les écosystèmes aquatiques du sud-Bénin. Lalèyè et al. (2019) ont répertorié un nombre important de carrières dans l’ensemble des écosystèmes aquatiques du sud-Bénin. En effet, l’extraction du sable lagunaire s’inscrit alors dans une logique d’exploitation des gisements de sable continental en substitution au sable marin, pour réduire la pression sur la côte béninoise qui est confrontée aux problèmes environnementaux (Kombieni, 2016). Cette activité constitue, aujourd’hui, une nouvelle activité qui occupe plusieurs acteurs autour de la lagune de Porto-Novo, du delta de l’Ouémé, dans les bas-fonds dragués de Togbin, du lac Ahémé et de la lagune de Grand-Popo. Elle constitue une source de revenus pour de nombreuses populations, mais elle occasionne également des dommages au niveau de la faune aquatique (Yacoubou, 2005). Selon Kombieni (2016), les impacts de cette activité sur l’environnement sont multiples. Ceux-ci peuvent être physiques, chimiques et biologiques. En effet, les opérations de dragage et le dépôt des produits prélevés sont susceptibles d'altérer l’environnement. L’immersion de déblais de dragage peut provoquer l'apparition de zones déficitaires en oxygène dissous. De même, l’augmentation de la turbidité des eaux par l'immersion de sédiments fins peut avoir des effets négatifs sur la qualité des eaux (Lalèyè et al., 2020). On peut également assister au relargage de substances stimulant la production végétale comme les sels nutritifs et, en particulier, l’ammonium (ONEMA-INERIS, 2009). Dans certains cas particuliers (rejets dans des zones confinées), cela peut conduire à l’eutrophisation du milieu (ONEMA-INERIS, 2009). Pour Vinawamon (2010), l’extraction du sable dans les hydrosystèmes entraine la destruction des habitats des poissons pondeurs sur substrats et augmente la turbidité de l’eau. Cette augmentation de la turbidité de l’eau entraine une diminution de la saturation en oxygène. Quant à la destruction des habitats des poissons, elle entrave le repeuplement des eaux. Ceci est dommageable pour la faune aquatique et, par conséquent, pour l’écosystème aquatique (Achoh et al., 2018). Ainsi, les différents facteurs, ci-dessus cités, ont motivé au choix de la présente étude. L’objectif général est d’évaluer l’impact de l’exploitation du sable fluvio-lagunaire sur la qualité physico-chimique de l’eau dans les écosystèmes aquatiques du sud-Bénin. De façon spécifique, il s’agit d’apprécier l’impact de l’activité d’extraction du sable à travers une comparaison des paramètres physico-chimiques des stations draguées et des stations non draguées.
2. Matériel et méthodes
2.1. Milieu d’étude
2Bassin de l’Ouémé. Le bassin de l’Ouémé traverse plusieurs zones agroécologiques et alimente en aval, par une zone deltaïque, le système lagunaire lac Nokoué-lagune de Porto-Novo. La superficie du bassin versant dépasse 50 000 km2. Deux grandes parties se distinguent dans le bassin : l’Ouémé supérieur et l’Ouémé inférieur (Colombani et al., 1972). Le fleuve Ouémé, en pénétrant dans le bassin sédimentaire côtier par le nord-est du plateau de Zangnanado, reçoit son principal affluent Zou à la latitude de Pobè puis longe le plateau de Pobè-Porto-Novo avant de se jeter dans la lagune de Porto-Novo (Dissou, 1986). La zone ainsi traversée constitue le delta de l’Ouémé. Le delta de l’Ouémé a la forme d’un triangle allongé et mesure 90 km du nord au sud. La lagune de Porto-Novo constitue sa façade méridionale. À l’ouest, la vaste plaine deltaïque est limitée par les marais de la rivière Sô et à l’est par le plateau de Pobè-Porto-Novo. Le delta de l’Ouémé est subdivisé en trois grandes parties : le haut-delta, le moyen delta et le bas delta. Le bassin du fleuve Ouémé est très diversifié. En effet, il abrite différentes espèces de poissons, de crustacés, d’amphibiens, de grenouilles, d’insectes et de macrophytes. Les activités économiques des populations dans le milieu sont essentiellement la pêche, l’extraction du sable, l’exploitation forestière et la production agricole. Mais la pêche constitue une source importante de revenus. Au total, six stations ont été choisies pour l’étude. Sur les six stations, nous avons trois stations draguées choisies parmi les stations draguées inventoriées dans le bassin de l’Ouémé (Lalèyè et al., 2019) : Agbakon (2°28'25,9"E et 6°42'12,3''N), Djassin (2°35'34,9"E et 6°28'06,5''N) et Louho (2°34'57,3"E et 6°29'07,0''N) et trois stations non draguées : Toché (2°33'21,8''E et 6°26'11,0''N), Akodji (2°33'25,5''E et 6°29'46,5''N) et Aguégué (2°32'42,3''E et 6°28'55,3''N).
3La lagune côtière de Ouidah. La lagune côtière de Ouidah est située dans la commune de Ouidah au Sud du Bénin. Elle est alimentée par les eaux continentales en amont et en aval par les eaux marines et s’étend sur une superficie de 4 000 ha. Elle abrite différentes espèces de poissons, de crevettes, de tortues, d’huîtres et de mangroves.
4La lagune de Ouidah communique également avec des bas-fonds, surtout en période de hautes eaux. Ces bas-fonds sont pour la plupart dragués en vue de l’exploitation du sable pour les travaux de construction des bâtiments, ce qui a conduit à la formation de lacs artificiels dans ces bas-fonds. Les activités économiques des populations dans le milieu sont essentiellement la pêche, l’agriculture, la fabrication du sel et l’extraction du sable. Deux stations ont été choisies pour l’étude : la station draguée d’Akogbato (2°20'18,9''E et 6°21'59,8''N) dans la zone lagunaire de Ouidah (Lalèyè et al., 2019) et la station non draguée d’Avlékété (2°12'31,1''E et 6°20'40,8''N).
5Bassin du Mono. La partie du bassin concernée par la présente étude couvre les zones du lac Ahémé et de la lagune de Grand-Popo. Le Lac Ahémé est compris entre les parallèles 6°20 et 6°40 latitudes Nord et les méridiens entre 1°55 et 2° longitude Est et s’étend suivant une direction Nord Est- Sud-Ouest entre Tokpa Domè et Guézin, puis une direction Nord-Sud entre Bopa et Tokpa Domè (Roche International, 2000). Ce lac est installé dans une vallée encaissée, ennoyée et dont la communication avec la mer a été obstruée par l’apparition du cordon littoral (Pliya, 1980). Son effluent est le chenal Aho long de 10 km entre Guézin et Djondji, qui le relie à la lagune de Grand-Popo et par lequel lui parviennent les eaux de mélange du fleuve Mono et de la mer (Guilcher, 1959 ; Pliya, 1980 ; Oyédé et al., 1983). La lagune de Gand-Popo est logée entre l’Océan atlantique et le fleuve Mono et est créée par le bas Mono à la hauteur de passage de Grand-Popo (Agbannankin) jusqu’à Dondji (Agadjihouèdé, 2006). Le bassin du fleuve Mono abrite plusieurs espèces de poissons, d’oiseaux, de reptiles et de mangroves. L’agriculture (culture du maïs, de l’igname et du manioc) et la pêche sont les principales activités économiques du milieu. Mais l’exploitation du sable était pratiquée jusqu’à la fin de l’année 2018 avant de connaitre un arrêt suite à la décision prise par l’État béninois à travers le projet PIRA (Projet Intercommunal de Réhabilitation du lac Ahémé) de procéder au dragage du complexe Lac Ahémé-Lagune côtière et de ses chenaux. Cette décision prise par le gouvernement a amené les acteurs du secteur sablier à fermer des carrières de sable le long du fleuve.
6Plusieurs sites d’exploitation du sable ont été inventoriés dans ce bassin (Lalèyè et al., 2019). Parmi ceux-ci, quatre stations ont été choisies. Il s’agit de Yémè (1°59'41,1''E et 6°35'44,6''N), Dékanmey (1°59'38,1''E et 6°33'26,5''N), Hèvè (1°50'24,2''E et 6°17'04,9''N) et Ounkihoué (1°17'04,9''E et 6°17'06,9''N). Quatre stations non draguées ont été également choisies. Il s’agit de Agonsa (1°58'44,4''E et 6°36'03,4''N), Ahouango (1°59'26,3''E et 6°34'27,0''N), Dohi (1°56'30,6''E et 6°23'01,3''N) et Hounkloto (1°47'22,6''E et 6°16'45,7''N).
7Les stations draguées ont été choisies en fonction du niveau d’intensité des activités de dragage, de l’accessibilité des lieux et de l’importance de la superficie des stations d’extraction du sable. Les stations non draguées (en fonction du nombre de stations draguées au niveau de chaque écosystème) ont été choisies comme stations de référence afin d’apprécier l’impact de l’activité d’exploitation du sable au niveau de chaque écosystème. La localisation géographique des différents bassins et des stations d’études est donnée par la figure 1.
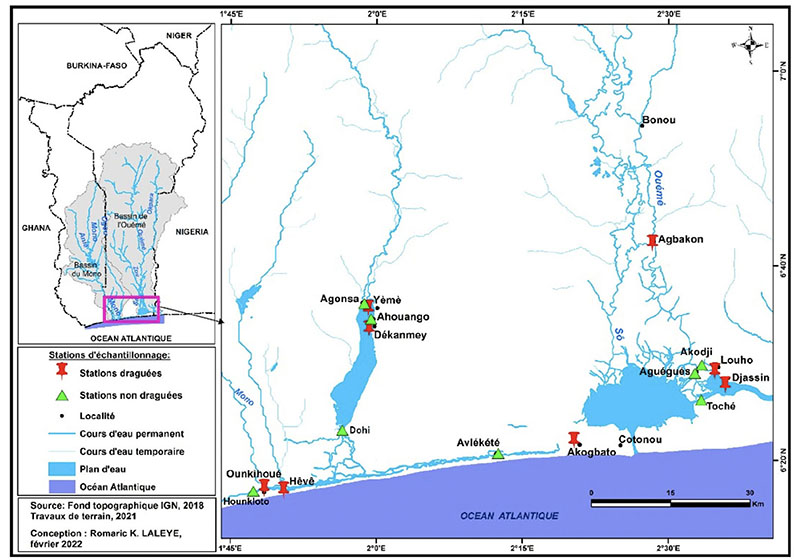 Figure 1. Localisation des stations d’échantillonnages — Location of sampling stations.
Figure 1. Localisation des stations d’échantillonnages — Location of sampling stations.
2.2. Échantillonnage
8Les données ont été prises mensuellement de décembre 2018 à novembre 2019, au niveau des stations draguées et des stations non draguées. Les mesures et prélèvements des eaux ont eu lieu entre 6 h 30 et 11 h 00 dans les stations draguées (Yémè, Dékanmey, Hèvè et Ounkihoué) et le lendemain à la même période au niveau des stations non draguées (Agonsa, Ahouango, Dohi et Hounkloto). Par mois et à chacune des stations (draguées et non draguées), la transparence et la profondeur ont été mesurées à l’aide d’un disque de Secchi. Le pH, la conductivité électrique et le TDS (Solides Totaux Dissous) ont été mesurés avec un multimètre, Model HI 991300 pH/EC/TDS meter. L’oxygène dissous et la température des eaux ont été mesurés avec un oxy-thermomètre, Model HI 9146. La salinité des eaux a été mesurée à l’aide d’un salinomètre, Model LYT-610. Enfin, la vitesse du courant des eaux a été mesurée en utilisant un flotteur. Pour cela, nous avons chronométré le temps que met un flotteur pour parcourir une distance de 1 m mesurée au décamètre. Cet exercice a été répété trois fois. La vitesse est alors égale à la distance parcourue (1 m) rapportée au temps moyen en seconde (Adandédjan, 2012). Après ces mesures, les prélèvements d’eau ont été faits (une fois par mois, dans chaque station) dans des bouteilles en polyéthylène à double bouchage de contenance 1 000 ml, conservés dans une glacière à 4 °C puis ramenés au laboratoire. Au laboratoire, les paramètres chimiques tels que les nitrites, les nitrates, l’ammonium et l’ortho-phosphate ont fait l’objet de dosage à l’aide du spectrophotomètre Hach Lange DR 2800. Les méthodes utilisées sont celles de Rodier (2009).
2.3. Analyses statistiques
9La base de données qui a servi aux analyses et traitements statistiques est constituée de 13 paramètres physico-chimiques, de 16 stations (huit stations draguées et huit stations non draguées) sur une période de 12 mois. La matrice de corrélation a été établie pour montrer les coefficients de corrélation entre les différents paramètres mesurés. Le coefficient de corrélation est la mesure spécifique qui quantifie la force de la relation linéaire entre deux variables d'une analyse de corrélation. Il est compris entre -1 et 1. Plus le coefficient est proche de 1, plus la relation linéaire positive entre les variables est forte. Plus le coefficient est proche de -1, plus la relation linéaire négative entre les variables est forte. Le calcul du coefficient de corrélation a permis d’avoir une idée sur les éventuelles relations entre paramètres : origine commune, distribution homogène, comportement identique vis-à-vis des processus physico-chimiques, fractionnement similaire, influence de l’un sur l’autre. Le test de Shapiro-Wilk a été appliqué pour vérifier si les paramètres physico-chimiques des différentes stations suivent une distribution normale. Le test de Kruskal-Wallis a été utilisé pour comparer les valeurs moyennes de paramètres mesurés entre les mois et les stations définies.
10Ensuite, la typologie abiotique a été réalisée grâce à une Classification Hiérarchique Ascendante (ACH) sur les valeurs moyennes des différents paramètres afin de faire ressortir les différents groupes de stations. Afin d’obtenir une meilleure affectation des paramètres à leur groupe, une Analyse en Composantes Principales a été réalisée sur les valeurs moyennes des différents groupes obtenus après la classification. Toutes les analyses statistiques ont été réalisées avec le logiciel R version 2019-12-12 du package FactoMineR.
3. Résultats
3.1. Variations moyennes mensuelles des paramètres physico-chimiques de l’eau des stations draguées et des stations non draguées
11La température moyenne de l’eau est élevée dans toutes les stations draguées et non draguées (Tableau 1). Elle varie de 28,58 ± 0,96 à 30,45 ± 0,30 °C pour les stations draguées et de 28,29 ± 0,65 à 31,27 ± 0,70 °C pour les stations non draguées. Le pH des eaux a un caractère acide (5,18 ± 0,16 - 6,97 ± 0,17) dans la plupart des stations, à l’exception des stations draguées de Akogbato, Dékanmey et Yémè qui ont un pH proche de la neutralité. Les eaux de toutes les stations draguées sont oxygénées (5,60 ± 0,53 -7,91 ± 0,08 mg·l-1), profondes (2,05 ± 0,09 - 10,97 ± 1,70 m) et transparentes (27,58 ± 0,26 - 51,61 ± 1,51 cm), tandis que celles des stations non draguées sont faiblement oxygénées (3,33 ± 0,12 - 5,34 ± 0,92), peu profondes (0,55 ± 0,02 - 2,29 ± 0,51) avec une faible transparence (0,36 ± 0,001 - 60,00 ± 0,65). Les valeurs moyennes du TDS obtenues pour les stations draguées et les stations non draguées sont respectivement de 158 ± 7,17 mg·l-1 et 73,60 ± 2,66 mg·l-1. De façon générale, on observe que l’évolution du TDS suit celle de la conductivité de l’eau dont les valeurs moyennes sont respectivement de 313,2 ± 4,56 pour les stations draguées et 86,69 ± 1,03 pour les stations non draguées. Les valeurs les plus faibles sont obtenues au niveau des stations non draguées, tandis que les plus élevées sont enregistrées dans les stations draguées. Les valeurs moyennes de salinité sont élevées dans les stations non draguées (2,71 ± 0,1) et faibles dans les stations draguées (0,40 ± 0,26). Enfin, les valeurs moyennes de la vitesse du courant des eaux sont élevées au niveau des stations draguées (0,96 ± 0,31 m·s-1) et faibles au niveau des stations non draguées (0,38 ± 0,05 m·s-1).
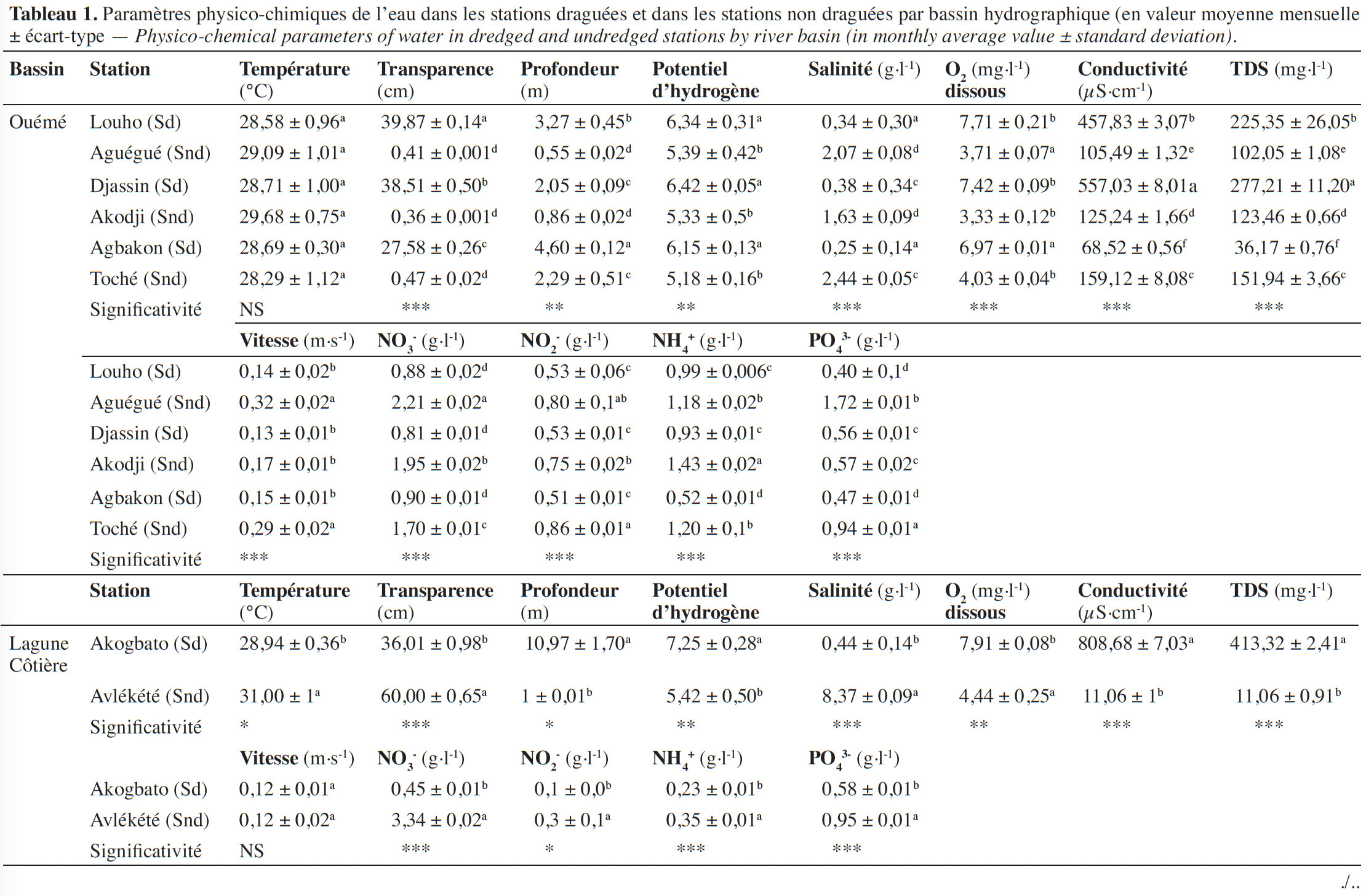
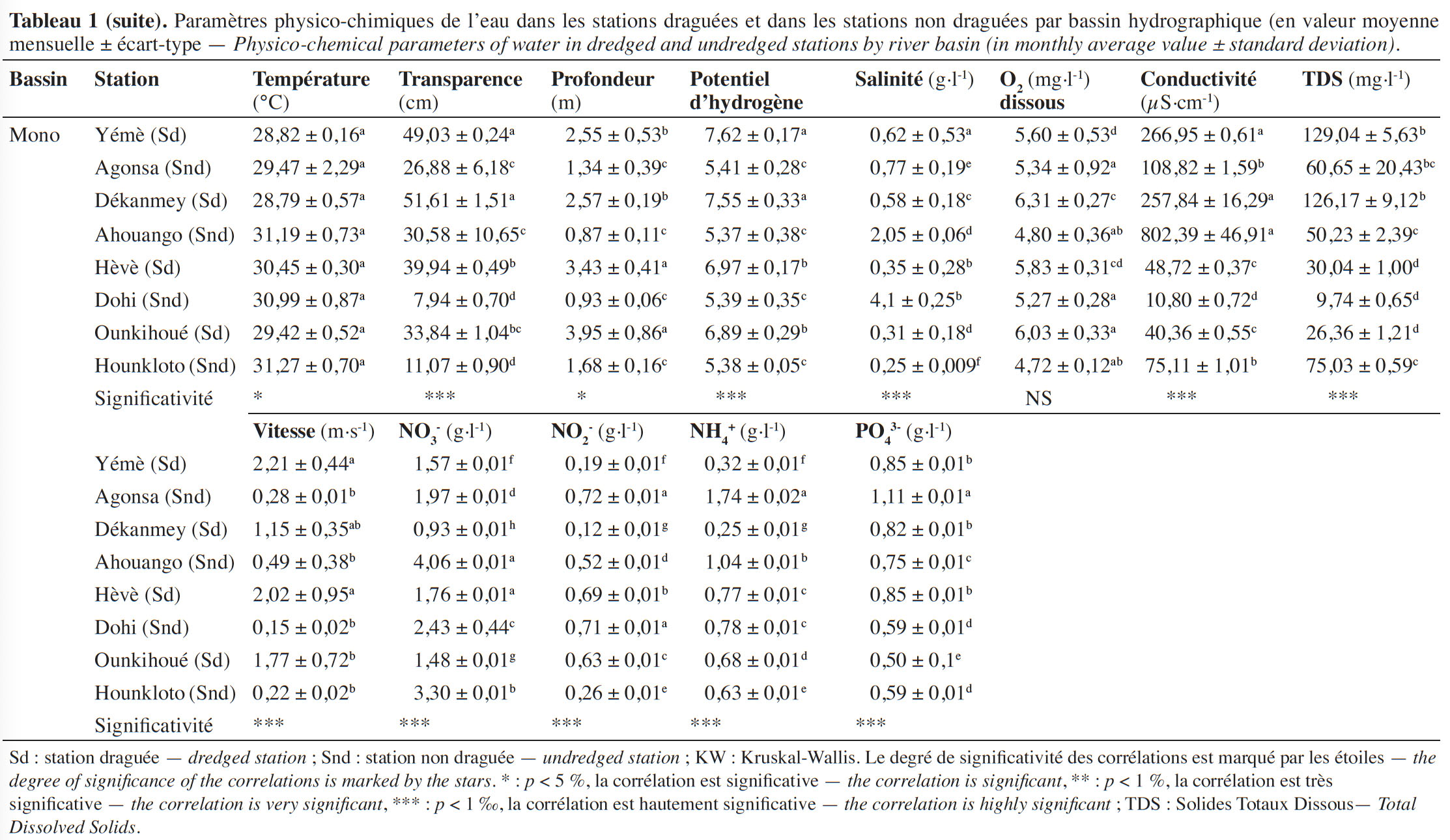
12Le test de Kruskal-Wallis réalisé sur les treize paramètres étudiés (Tableau 1) montre que, seuls, la profondeur et le pH des eaux varient très significativement (p < 0,01) au niveau des stations draguées et non draguées du bassin de l’Ouémé. Dans la lagune côtière de Ouidah, le test de Kruskal-Wallis réalisé a montré que la température des eaux, la profondeur des eaux et les nitrites ont varié significativement (p < 0,05). Enfin, dans le bassin du Mono, seules la température et la profondeur des eaux ont varié significativement au niveau des stations draguées et des stations non draguées.
3.2. Variation moyenne mensuelle des sels dissous des stations draguées et des stations non draguées
13Dans l’ensemble, les sels dissous varient en fonction d’une station draguée à une autre et d’une station non draguée à une autre (Figure 2). En effet, de faibles valeurs en nitrates (1,44 ± 0,01 g·l-1) et (0,86 ± 0,01 g·l-1) sont notées respectivement au niveau des stations draguées du Mono et de l’Ouémé et des valeurs élevées (4,06 ± 0,01et 2,21 ± 0,02) respectivement dans les stations non draguées à Ahouango (Mono) et aux Aguégués (Ouémé). Des valeurs élevées (3,34 ± 0,02) ont été également observées au niveau de la station non draguée de la lagune côtière, contrairement à de faibles valeurs (0,45 ± 0,01) observées au niveau de la station draguée du même plan d’eau. Ensuite, des valeurs faibles en nitrites ont été enregistrées dans les stations draguées de l’Ouémé, alors que des valeurs élevées ont été notées dans les stations non draguées du même plan d’eau. Des valeurs élevées en nitrites ont été également observées dans certaines stations draguées du Mono (Hèvè et Ounkihoué). Des valeurs faibles en nitrites ont été enregistrées dans la station draguée de la lagune côtière. Les valeurs en ammonium sont faibles dans la station draguée de la lagune côtière. Enfin, les valeurs en orthophosphates sont élevées dans les stations non draguées de l’Ouémé et du Mono, comparativement aux valeurs faibles observées dans les stations draguées des mêmes plans d’eau.
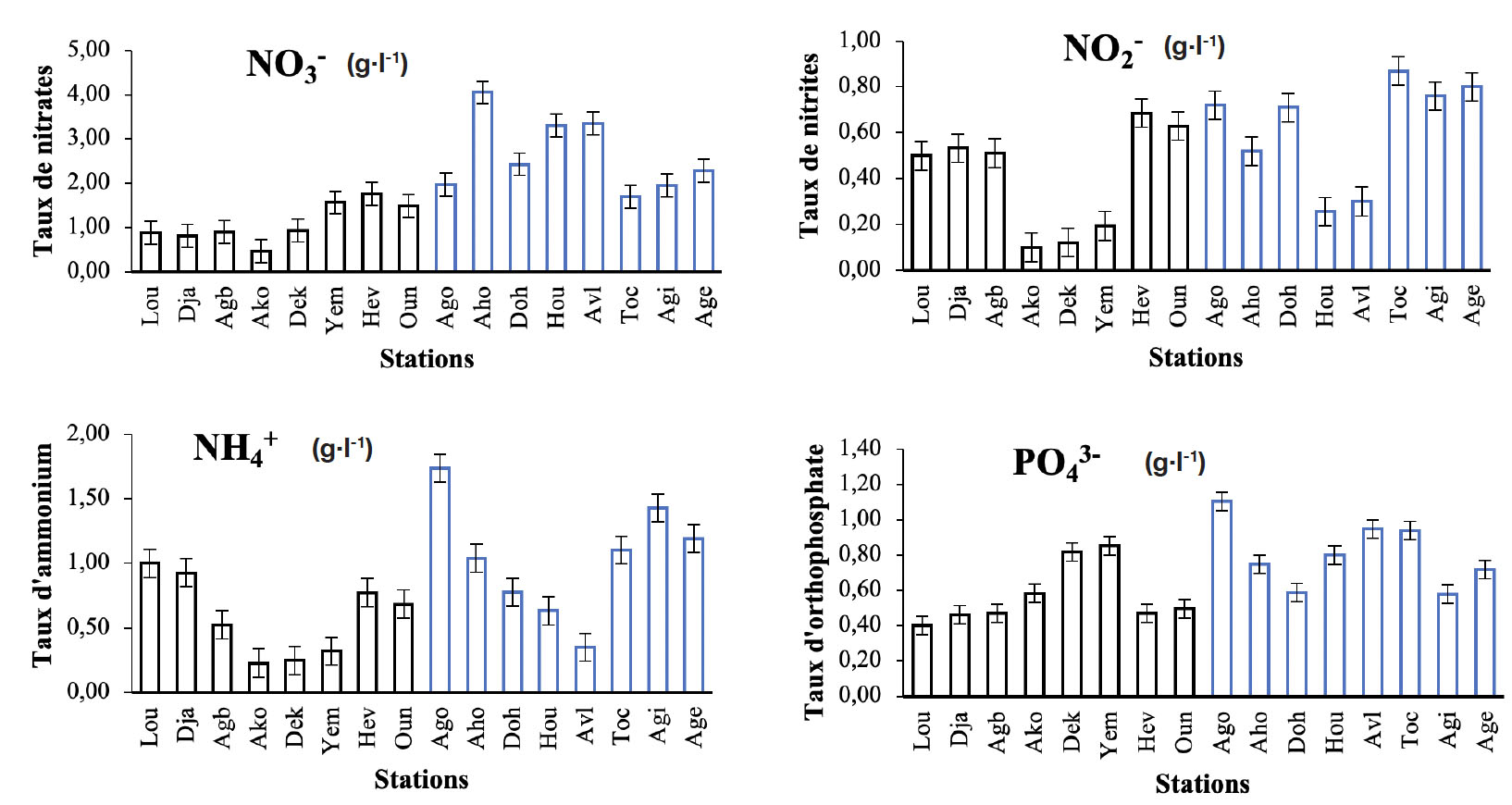 Figure 2. Variation moyenne mensuelle des sels dissous des stations draguées (en noir) et non draguées (en bleu) — Average monthly variation in dissolved salts from dredged (in black) and undredged (in blue) stations.
Figure 2. Variation moyenne mensuelle des sels dissous des stations draguées (en noir) et non draguées (en bleu) — Average monthly variation in dissolved salts from dredged (in black) and undredged (in blue) stations.
Lou : Louho ; Dja : Djassin ; Agb : Agbakon ; Ako : Akogbato ; Dek : Dékanmey ; Yem : Yémè ; Hev : Hèvè ; Oun : Ounkihoué ; Ago : Agonsa ; Aho : Ahouango ; Doh : Dohi ; Hou : Hounkloto ; Avl : Avlékété ; Toc : Toché ; Agi : Akodji ; Age : Aguégué.
14Les valeurs de la profondeur des eaux sont élevées dans les stations draguées, comparativement aux stations non draguées. Par ailleurs, on note une valeur qui est largement élevée au niveau de la station draguée de Akogbato, contrairement aux autres stations du même milieu. Ensuite, les valeurs de la transparence des eaux sont également élevées dans les stations draguées comparativement aux stations non draguées.
3.3. Corrélations entre les différents paramètres mesurés au niveau des stations draguées et des stations non draguées
15Une corrélation négative et significative est notée entre la température des eaux et la conductivité d’une part et entre la transparence et l’ammonium d’autre part. Par ailleurs, une corrélation positive et hautement significative est enregistrée entre les nitrates et la température des eaux d’une part et entre les nitrites et l’ammonium d’autre part. Une corrélation négative et très significative entre la transparence des eaux et les nitrites d’une part, entre l’oxygène dissous et les nitrates et entre la conductivité des eaux et les nitrates d’autre part est également notée. Par contre, une corrélation négative significative entre la profondeur des eaux et les nitrates, une corrélation significative entre le pH et les orthophosphates, entre la salinité et les nitrates et entre l’oxygène dissous et la conductivité est enregistrée (Tableau 2).
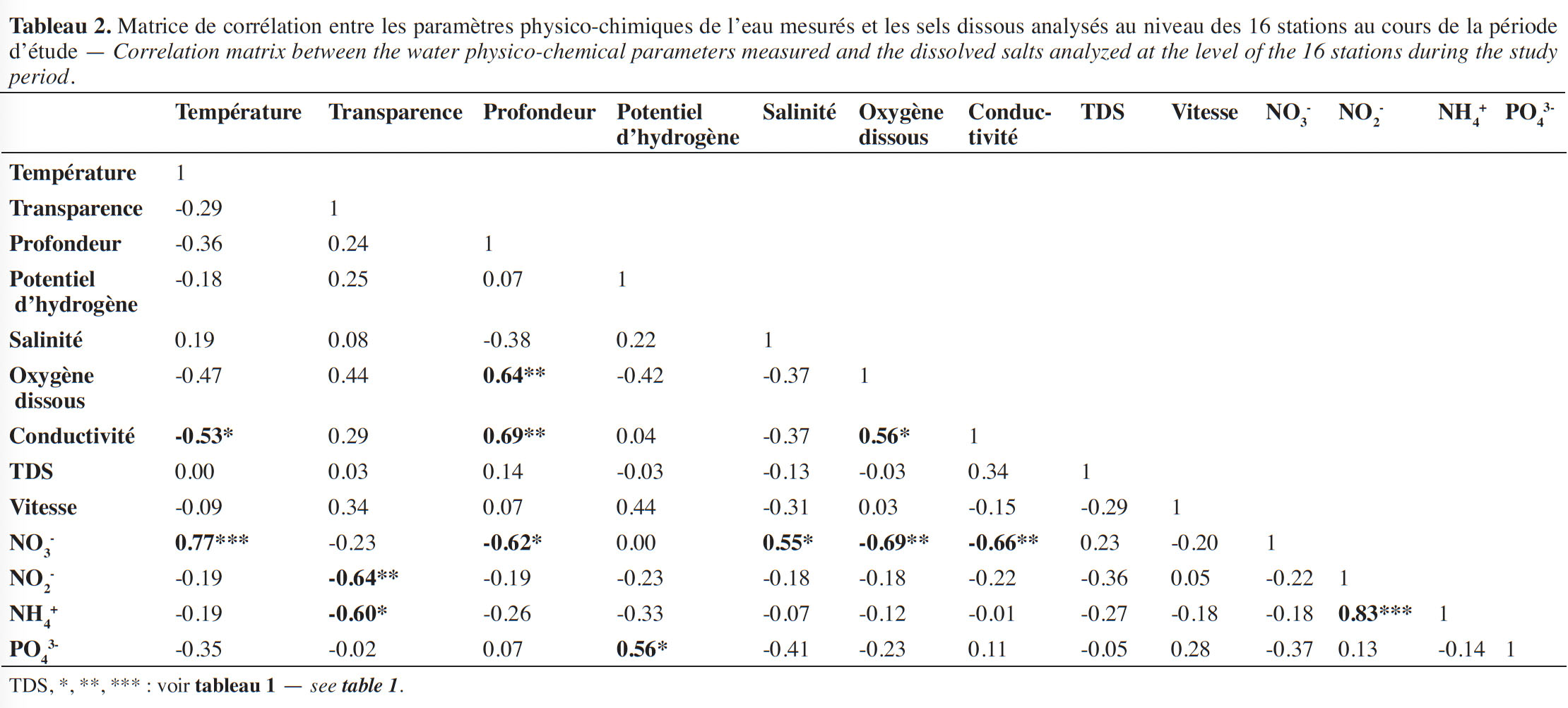
16De l’analyse de la figure 3, sept groupes de stations se distinguent :
17– groupe 1 : stations non draguées de Hounkloto et de Dohi ;
18– groupe 2 : stations non draguées de Avlékété et de Ahouango ;
19– groupe 3 : stations non draguées de Aguégué, Akodji et Toché ;
20– groupe 4 : une seule station non draguée (Agonsa) et deux stations draguées (Hèvè et Ounkihoué) ;
21– groupe 5 : stations draguées de Agbakon, Djassin et Louho ;
22– groupe 6 : stations draguées de Yémè et Dékanmey ;
23– groupe 7 : station draguée de Akogbato.
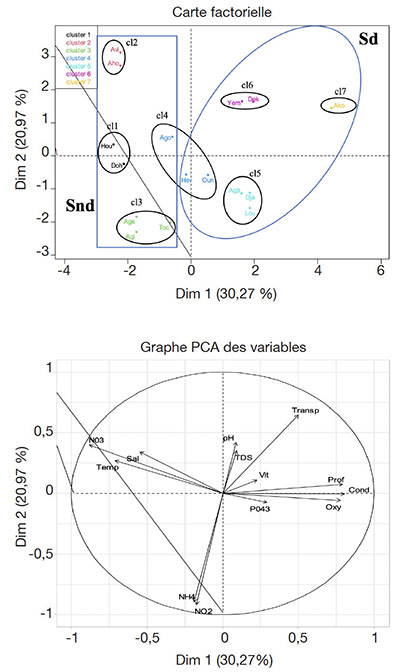
Figure 3. Analyse en Composantes Principales réalisée à partir des paramètres physico-chimiques de l’eau des stations draguées et des stations non draguées — Principal Component Analysis carried out from the physico-chemical parameters of the dredged stations and non-dredged stations.
24Ainsi, on note deux regroupements de stations qui sont plus ou moins distantes l’une de l’autre. Le premier regroupement constitué des stations non draguées et un second regroupement constitué des stations draguées ; ceci met clairement en évidence la différenciation entre les stations des milieux non dragués et celles des milieux dragués. Il est toutefois noté un chevauchement dans le groupe 4 où les caractéristiques physico-chimiques de l’eau d’une station non draguée chevauchent celles de deux stations draguées d’un même écosystème.
25Caractéristiques des groupes. Cette typologie abiotique montre que le groupe 1 est constitué des stations non draguées de la lagune de Grand-Popo ; le groupe 2, des stations non draguées de la lagune de Ouidah et du lac Ahémé ; le groupe 3, des stations draguées du bassin de l’Ouémé ; le groupe 4, d’une station non draguée du lac Ahémé et de deux stations draguées de la lagune de Grand-Popo ; le groupe 5, des stations draguées du bassin de l’Ouémé ; le groupe 6, des stations non draguées du lac Ahémé et le groupe 7, uniquement de la station draguée de Akogbato qui est un bas-fond.
26L’analyse en composante principale, réalisée à partir des valeurs moyennes des paramètres physico-chimiques de ces groupes obtenus, révèle que les deux premiers axes concentrent 51,24 % des informations de départ (Figure 3), ce qui est suffisant pour garantir une interprétation. Le cercle de corrélation montre que l’axe 1 est corrélé positivement à la transparence, au pH, au TDS, à la vitesse, à la profondeur, à la conductivité, à l’oxygène dissous et aux orthophosphates. En revanche, cet axe est corrélé négativement aux nitrates, à la salinité, à la température, à l’ammonium et aux nitrites. L’axe 2 est positivement corrélé à la salinité, à la température, aux nitrates, au pH, au TDS, à la transparence, à la vitesse, à la profondeur et à la conductivité. Il est par contre corrélé négativement à l’oxygène dissous, aux orthophosphates, à l’ammonium et aux nitrites. La projection des paramètres physico-chimiques et des groupes de stations dans le système d’axe 1 et 2 définis par l’ACP indique que :
27– les stations de Hounkloto et de Dohi (stations non draguées représentées par le groupe 1) sont caractérisées par des valeurs élevées en nitrates, en température, en salinité, en ammonium et en nitrites ;
28– les stations de Avlékété et de Ahouango (stations non draguées représentées par le groupe 2) sont caractérisées par des valeurs élevées en nitrates, en température et en salinité. Les stations de Aguégués, Akodji et Toché (également des stations non draguées représentées par le groupe 3) sont caractérisées par des valeurs élevées en ammonium et en nitrites ;
29– les stations de Agonsa (non draguée), de Hèvè et de Ounkihoué (draguées) représentées par le groupe 4, sont caractérisées par des valeurs élevées en nitrates, en température, en salinité, en ammonium, en nitrites, en orthophosphates, en oxygène dissous et en conductivité ;
30– les stations de Agbakon, Djassin et Louho (stations draguées représentées par le groupe 5) sont caractérisées par des valeurs élevées en oxygène dissous et en conductivité ;
31– les stations de Yémè et Dékanmey (stations draguées représentées par le groupe 6) sont caractérisées par des valeurs élevées en pH, en TDS, en vitesse du courant, en profondeur, en transparence et en conductivité ;
32– la station de Akogbato (station draguée représentée par le groupe 7) est caractérisée par des valeurs élevées en pH, TDS, vitesse, profondeur, transparence et conductivité.
33La projection des paramètres physico-chimiques des stations dans le système d’axe 1 et 2 définis par l’ACP indique également que :
34– les stations draguées symbolisées par Sd sont caractérisées par des valeurs élevées en conductivité, transparence, profondeur et en oxygène dissous.
35– les stations non draguées symbolisées par Snd sont caractérisées par des valeurs élevées en nitrates, salinité, température de l’eau, ammonium et nitrites.
4. Discussion
36La présente étude a permis de caractériser l’impact de l’exploitation du sable fluvio-lagunaire sur la qualité physico-chimique des eaux dans les différents groupes écosystémiques regroupant les stations soumises à l’activité d’extraction du sable à travers une comparaison faite sur des stations de références et où l’activité n’est pas pratiquée. Cela a permis de façon générale d’apprécier l’impact de cette activité sur la qualité physico-chimique des eaux des différents plans d’eau faisant l’objet de cette étude. Globalement, les valeurs de la température de l’eau (comprises entre 23 °C et 31 °C) enregistrées au niveau des stations draguées et des stations non draguées durant toute la période de l’étude sont tolérables pour la plupart des espèces tropicales (Lalèyè et al., 2005). Les températures relativement élevées enregistrées au niveau des stations non draguées pourraient être liées aux faibles profondeurs de ces milieux qui ne favorisent pas la diffusion du rayonnement solaire une fois en contact avec l’eau. Aussi, les valeurs de température obtenues au niveau des stations draguées sont différentes de celles obtenues par Chikou (2006) qui était de 28,8 °C à Agonli Lowé, une station de référence n’abritant pas de site d’extraction du sable. Ces mêmes valeurs sont également différentes de celles obtenues par Adandédjan (2012) qui était de 30,9 °C dans les stations non draguées (stations de références) de la lagune de Porto-Novo. Les valeurs élevées de profondeurs de l’eau (2,05 à 10,97 m) obtenues au niveau des stations draguées comparativement à celles obtenues dans les stations non draguées (0,55 à 2,29 m) se justifient par les opérations d’extraction du sable dans ces milieux. Ce même constat a été fait par Barletta et al. (2016) au Brésil qui ont également enregistré des valeurs élevées de profondeur (≥ 10 m) six mois après les opérations de dragage et Saviour (2012) en Inde qui a enregistré des valeurs élevées de profondeur (≥ 14 m). Les maxima de profondeur de l’eau sont obtenues au niveau du bas-fond dragué d’Akogbato sur la lagune côtière et au niveau de la station draguée de Louho dans le bassin de l’Ouémé. Ceci s’explique par l’implantation d’une drague pompeuse au niveau de ces stations pour extraire du sable. Les faibles valeurs de profondeur observées dans certaines stations draguées comme à Djassin, malgré l’extraction du sable, pourraient se justifier par le fait que la lagune est située en aval du fleuve Ouémé dont les forts courants d’eau drainent du sable vers cette dernière. Dans ce milieu, le dragage se fait manuellement avec une intensité qui n’arrive pas à décaper tout le sable drainé. Aussi, les valeurs de profondeur enregistrées au niveau de l’ensemble des stations non draguées se justifieraient pleinement par le comblement des milieux dû aux activités anthropiques (acadjas, pollution des berges, etc.) entrainant une diminution de la profondeur de l’eau (Dèdjiho et al., 2013). Les valeurs moyennes de transparence mesurées varient en fonction des stations draguées et des stations non draguées. Les faibles valeurs de transparence observées au niveau des stations non draguées pourraient s’expliquer par le transfert de sédiments vers les cours d’eau (Gayraud et al., 2002). Ces sédiments fins, principalement transportés en suspension, ont de nombreuses conséquences sur les cours d’eau. Ceci peut également être lié à l’eutrophisation élevée de ces milieux avec un fort développement des algues qui limiterait la visibilité dans l’eau. Les valeurs élevées de transparence ou de turbidité sont principalement obtenues au niveau des stations draguées. Ces observations sont contraires à celles de Dankers (2002) aux Pays-Bas qui a trouvé des niveaux élevés de turbidité causés par les sédiments en suspension libérés par le dragage et qui estime dans le même temps que ces niveaux élevés de turbidité peuvent être nocifs pour le benthique, la végétation et la faune aquatique en raison de l’ombrage (blocage de la lumière du soleil). Barletta et al. (2016) ont également montré au cours de leurs travaux de recherche que les opérations de dragage entrainent la remise en suspension des sédiments de fond et une turbidité accrue, une pénétration limitée de la lumière, une consommation d’oxygène dissous et une diminution de la productivité primaire. Les observations faites au cours de cette étude pourraient se justifier par le fait que l’activité d’exploitation du sable a été arrêtée dans les carrières ou fermée définitivement pour raison de profondeur atteinte pour la zone. Le constat a été fait dans les stations draguées du bassin du Mono où ces dernières ont été fermées définitivement par décision des autorités. En effet, les données physico-chimiques ont été collectées huit mois après la fermeture des carrières dans les stations du Mono, comparativement aux autres stations draguées des autres plans d’eau qui n’ont pas été fermées mais dont les données ont été collectées au moment de l’activité et lors de la fermeture à cause du nombre de mètres de profondeur atteint. La conductivité électrique permet d’évaluer le degré de minéralisation d’une eau, soit la quantité de substances dissoutes ionisées qui y sont présentes. La valeur moyenne de la conductivité électrique obtenue pour l’ensemble des stations draguées montre que la majorité des stations sont moyennement minéralisées suivant la grille de Nisbet & Verneaux (1970). Ces valeurs obtenues dans ces milieux soumis à l’activité d’extraction du sable sont supérieures aux valeurs obtenues dans les stations non draguées et diffèrent également des résultats obtenus dans la littérature par Bonou & Adisso (2002), Chikou (2006) dans le bassin de l’Ouémé, soit une conductivité variant de 47,8 à 129,3 µS·cm-1. Ces valeurs sont également différentes de celles obtenues par Guenda (1996) qui a obtenu une conductivité de 101 µS·cm-1 dans le Mouhoun au Burkina Faso et à la valeur limite de 500 µS·cm-1 rapportée par Belaud (1987) dans les milieux non perturbés par l’extraction du sable. En effet, Bénech & Ouattara (1990) relèvent qu’en Afrique tropicale, dans les bassins versants non pollués, la conductivité électrique spécifique varie de 35 à 1 200 µS·cm-1 pour les fleuves. Les valeurs obtenues au niveau des stations draguées varient entre 40,36 µS·cm-1 à 808,68 µS·cm-1 et sont caractéristiques des stations non polluées. Ceci pourrait se justifier par l’utilisation des dragues qui non seulement permettent d’extraire du sable, mais participent également au curage profond des plans d’eau. Les valeurs obtenues au niveau des stations non draguées sont faibles et varient entre 10,80 µS·cm-1 et 151,94 µS·cm-1 avec une valeur minimale de 10,80 µS·cm-1 qui est largement inférieure à la norme recommandée. Ces valeurs sont caractéristiques des stations polluées et pourraient se justifier par le comblement des plans d’eau dû au dépôt de sédiments et à la forte eutrophisation des eaux. Le pH présente des valeurs se situant dans la gamme de 6,15 à 7,62 dans les stations draguées et de 5,09 à 5,99 au niveau des stations non draguées. Ces valeurs sont plus élevées dans les stations draguées que dans les stations non draguées. Ceci pourrait se justifier par le fait que les milieux non dragués sont sujets à la pollution organique avec une tendance à l’acidification de l’eau (Rodier, 2009). Les valeurs de pH obtenues dans les stations draguées sont proches de la neutralité et sont caractéristiques de la majorité des eaux de surface et, par conséquent, n’indiquent ni pollution acide ni pollution basique des eaux. Elles traduisent, selon la grille de Beaux (1998), des eaux de bonne qualité pour la plupart des poissons. Ces observations sont différentes de celles de Saviour (2012), en Inde, qui a obtenu une faible valeur pour le pH. Les valeurs obtenues dans le cadre de cette étude peuvent également se justifier par le fait que l’activité d’exploitation du sable a été arrêtée dans certaines carrières ou fermée définitivement dans d’autres pour raison de profondeur atteinte pour la zone. En effet, la longue période de fermeture observée, qui est de huit mois, aurait certainement permis aux matières organiques en suspension de se déposer au fond de l’eau. Des études ont montré que la plupart des sites de dragage se rétablissent en quelques mois ou en quelques années, en termes d’écologie et de biodiversité (van Dalfsen & Essink, 1997; Boyd & Rees, 2000) et que cela dépendait d’un certain nombre de facteurs, notamment : la méthode de l’extraction, le type de sédiments, le taux et la quantité de sédiments déversés et l’hydrodynamique locale (Wijsman & Anderson, 2004, données non publiées). Les valeurs obtenues pour l’oxygène dissous dans les différents groupes constitués par les stations draguées sont supérieures aux valeurs des groupes de stations non draguées. Les valeurs de l’oxygène dissous comprises dans cette gamme sont acceptables pour le stade initial et les autres stades de vie des espèces aquatiques dans les écosystèmes tropicaux (CCME, 2011). Ces résultats montrent que les stations draguées sont bien oxygénées et sont en bon état physico-chimique, contrairement aux stations non draguées qui sont moins oxygénées parce que sujettes à l’effet d’une pollution organique. Les observations faites au cours de cette étude sont contraires à celles de Kennish (1998) et Gubbay (2003) qui ont trouvé des taux d’oxygène très faibles causés par la perturbation des couches de sédiments anaérobies et en sont arrivés à la conclusion selon laquelle la matière organique en suspension ou dissoute peut consommer tout l’oxygène dissous disponible dans la colonne d’eau et stresser temporairement les organismes aquatiques. Selon Wijsman & Anderson (2004, données non publiées), la libération de nutriments et d’autres composés consommant de l’oxygène à partir de l’eau interstitielle lors de l’extraction des agrégats sera insignifiante, car la teneur en matière organique et en nutriments est très faible dans les zones dynamiques de sables oxygénés. Les résultats obtenus dans la présente étude pourraient donc s’expliquer dans un premier temps par le fait qu’en période d’intense activité d’exploitation du sable, les plans d’eau sont généralement débarrassés en partie de leurs déchets par le biais des dragues, ce qui permet à l’eau d’être bien aérée et, dans un second temps, par les explications mentionnées plus haut. On pourrait donc avancer que les écosystèmes aquatiques dragués sont en bon état physico-chimique. Ces résultats sont semblables aux observations ponctuelles faites dans le delta de l’Ouémé par Roche international en octobre 1999, avec une teneur en oxygène dissous de 7,43 mg·l-1 mais diffèrent de ceux obtenus par Chikou (2006) dans les milieux non dragués du bassin de l’Ouémé avec une teneur en oxygène dissous de 5,6 mg·l-1. Ces auteurs indiquent que la teneur en oxygène dissous donne des indications sur la santé des cours d’eau et permet, entre autres, d’évaluer la qualité des habitats de poissons. Ce paramètre fait partie intégrante du métabolisme de l’écosystème. Les poissons et autres animaux aquatiques en consomment pour le maintien de leur métabolisme (phénomène de respiration cellulaire).
37De façon générale, les sels dissous d’ammonium et de nitrates-nitrites sont relativement plus faibles dans les milieux dragués que dans ceux non dragués. Ceci peut aisément se justifier par le fait de l’instabilité existante encore dans les milieux dragués. La présence des substances dissoutes principalement organiques dans les milieux non dragués engendre une forte activité de décomposition à la base de la formation des sels dissous dans l’eau. Les milieux dragués et perturbés ne peuvent pas permettre de telles activités.
38Pour le cas de l’ammonium (NH4+), sa diminution dans un milieu aquatique varie selon le niveau de la productivité de l’écosystème et de son degré de pollution par la présence de matières organiques. Sa présence peut également résulter de la dégradation aérobie de l’azote organique (protéines, acides aminés, urées), lequel provient en grande partie des rejets des eaux non épurées. En réalité, le NH4+ en lui-même n’est pas nuisible mais peut se transformer sous certaines conditions en ammoniac (NH3-), un gaz soluble dans l’eau et toxique pour la vie aquatique (MDDELECC, 2017). Hébert & Légaré (2000) démontrent que dans un milieu bien oxygéné, l’ammonium est rapidement utilisé et sa concentration est faible. Les teneurs retrouvées pour l’ensemble des stations draguées présentent des valeurs moins élevées que les teneurs retrouvées dans les stations non draguées. Ainsi, les faibles valeurs obtenues au niveau des stations draguées pourraient se justifier par un arrêt des activités depuis plusieurs mois, lié à la profondeur de dragage déjà atteinte (Achoh et al., 2018). C’est le cas par exemple des stations draguées du bassin du Mono où l’activité de dragage du sable fut arrêtée huit mois avant le début de notre campagne de collecte de données. En effet, les sédiments et les matières organiques ont eu certainement le temps de se déposer au fond de l’eau pendant cette longue période. Les concentrations en nitrates des stations draguées sont comprises entre 0,46 et 1,76 mg·l-1 avec une moyenne de 1,10 mg·l-1 et celles des stations non draguées entre 1,70 et 4,06 mg·l-1 avec une moyenne de 2,63 mg·l-1. Ces concentrations sont élevées par rapport à celles des stations draguées. Ces valeurs élevées observées au niveau des stations non draguées s’expliqueraient par la présence des déchets ménagers et commerciaux de toutes sortes produits par les riverains (Koudenoukpo et al., 2017). Quant aux nitrites, ils présentent des valeurs élevées dans les stations non draguées et moins élevées au niveau des stations draguées. Des taux élevés peuvent également s’expliquer par des conditions d’anaérobiose existantes par endroit avec l’abondance des macrophytes qui favorisent une nitrification assez poussée des matières organiques (Koudenoukpo et al., 2017). S’agissant des teneurs en orthophosphates, elles sont entre 0,40 et 0,85 mg·l-1 au niveau des stations draguées et entre 0,20 et 1,11 mg·l-1 dans les stations non draguées.
39Les valeurs trouvées dans les stations non draguées pourraient traduire un apport excessif du lessivage et du ruissellement des terres agricoles fertilisées. En effet, durant la grande saison pluvieuse et la petite saison sèche, les teneurs en sels nutritifs deviennent importantes. Ces sels nutritifs sont drainés par les eaux de ruissellement chargées de produits de lessivage des bassins versants et par l’arrivée des eaux continentales, riches en matières organiques, ce qui crée une pollution organique (Zinsou et al., 2016 ; Koudenoukpo et al., 2017). Le même constat a été fait au cours de cette étude au niveau de certaines stations non draguées des groupes 1, 2, 3 et 4, tel que démontré par la typologie abiotique réalisée. Elle pourrait être également liée à l’usage des engrais chimiques lors des activités agricoles ainsi qu’à l’élevage des animaux (bœufs et porcs) qui sont laissés en divagation, laissant d’importantes quantités de déjections au niveau des berges (Koudenoukpo et al., 2017). Par contre, ces différents facteurs de pollution sont, voire absents au niveau des stations draguées des groupes 4, 5, 6 et 7. Le rôle de ces différents sels nutritifs dans le contrôle de la production a été souligné dans plusieurs études (Trinquier, 2009 ; Mama et al., 2011 ; Noumon et al., 2015 ; Tchakonté et al., 2015 ; Zinsou et al., 2016). Il est donc nécessaire de les surveiller car ils représentent de grands facteurs d’eutrophisation des plans d’eau.
5. Conclusions
40L’étude de l’impact de l’exploitation du sable fluvio-lagunaire sur la qualité physico-chimique des écosystèmes aquatiques du Sud-Bénin a permis de faire une comparaison entre les milieux qui sont soumis à l’activité d’extraction du sable et ceux non soumis à cette activité à travers une caractérisation physico-chimique de l’eau. Il en ressort que les principaux paramètres physiques (transparence, pH, profondeur et oxygène dissous) observés au niveau des stations draguées présentent des valeurs relativement bonnes, contrairement aux stations non draguées. Aussi, le suivi des concentrations en nutriments dans les stations non draguées révèle des teneurs élevées en composés azotés et phosphorés, responsables de l’eutrophisation dans ces différentes stations. La typologie abiotique montre que toutes les stations non draguées présentent des eaux fortement minéralisées, associées également à une pollution azotée. Par contre, au niveau des stations draguées, la typologie abiotique montre que les stations draguées représentées par les groupes 4, 5, 6 et 7 présentent des eaux bien oxygénées, transparentes et sans pollution azotée. Ces résultats montrent que les milieux dragués présentent les caractéristiques des eaux bien oxygénées qui pourraient être favorables avec le temps, lorsque ces milieux retrouveront peu à peu leur stabilité et redeviendront riches en matières minérales et nutritives, gage d’un bon développement des espèces aquatiques. On peut déjà considérer ces résultats comme des bases solides pour la mise en place d’un plan de gestion durable des écosystèmes aquatiques dragués du sud-Bénin. Beaucoup d’aspects restent toutefois encore à étudier, comme l’étude de la diversité ichtyologique qui a été déjà réalisée et dont les résultats seront publiés ultérieurement ; l’aquaculture dans les milieux dragués à travers l’élevage des espèces de tilapia et de clarias dans des cages flottantes sur l’eau ; les différents impacts socio-économiques de cette activité qui prend de plus en plus d’ampleur dans le sud-Bénin. Ces aspects pourront faire l’objet d’études ultérieures.
Remerciements
41Les auteurs remercient l’Université d’Abomey-Calavi (UAC) à travers le Projet BioSEL « Biodiversité et pressions anthropiques sur les ressources vivantes aquatiques des Systèmes Estuariens et Lagunaires du Sud Bénin » de la 3e Phase du Programme des Fonds Compétitifs de Recherche de l'UAC pour son appui financier quant à la réalisation de ce travail.
Bibliographie
Achoh M.E. et al., 2018. Impact of dredging on the ichtyofauna of the lowlands: comparison of the reproduction parameters of Sarotherodon melanotheron populations (Rüppell, 1852) of dredged lowlands and the coastal lagoon at Togbin in Southern Benin. Int. Fish. Aquat. Stud., 6, 344-350.
Adandédjan D., 2012. Diversité et déterminisme des peuplements de macro-invertébrés benthiques de deux lagunes du Sud-Bénin : la Lagune de Porto-Novo et la Lagune Côtière. Thèse de doctorat : Université d’Abomey-Calavi, Faculté des Sciences Agronomiques (Bénin).
Agadjihouèdé H., 2006. Diversité et exploitation des crevettes d’eau douce dans la Lagune de Grand-Popo (Bas-Mono). Thèse d’ingénieur agronome : Université d’Abomey-Calavi, Faculté des Sciences Agronomiques (Bénin).
Barletta M., Cysneiros F.J.A. & Lima A.R.A., 2016. Effects of dredging operations on the demersal fish fauna of a South American tropical–subtropical transition estuary. J. Fish Biol., 89(1), 890-920, doi:10.1111/jfb.12999
Beaux J.F., 1998. L’environnement. Paris : Nathan.
Belaud A., 1987. Inland water quantity and quality. Toulouse, France: ENSA.
Bénech V. & Ouattara S., 1990. Rôle des variations de conductivité de l’eau et d’autres facteurs externes dans la croissance ovarienne d’un poisson tropical, Brycinus leuciscus (Characidae). Aquat. Living Resour., 3, 153-162, doi.org/10.1051/alr:1990017
Bonou C.& Adisso P., 2002. Evaluation of organic and bacteriological pollution excreta, wastewater and solid waste in the lagoon of Cotonou. CPU/UAC.
Boyd S.E., Rees H.L. & Richardson C.A., 2000. Nematodes as sensitive indicators of change at dredged material disposal sites. Estuarine Coastal Shelf Sci., 51, 805-819, doi.org/10.1006/ecss.2000.0722
CCME, 2011. Values to protect environmental and human health. In: Canadian environmental quality guidelines. Winnipeg, Canada: Canadian Council of Ministers of the Environment..
Chikou A., 2006. Étude de la démographie et de l’exploitation halieutique de six espèces de poissons-chats (Teleostei, Siluriformes) dans le delta de l’Ouémé au Bénin. Thèse de doctorat : Université de Liège (Belgique).
Colombani J., Sircoulon J., Moniod F. & Rodier J., 1972. Monographie du Delta de l’Ouémé (Tome 1). Paris : ORSTOM.
Dankers P.J.T., 2002. Literature study on sediment plumes that arise due to dredging. Delft, The Netherlands: TU Delft.
Dèdjiho C.A. et al., 2013. Évaluation de la qualité physico-chimique de certains tributaires d’eaux usées du lac Ahémé au Bénin. J. Appl. Biosci., 70, 5608-5616, doi.org/10.4314/jab.v70i1.98763
Dissou M., 1986. La république populaire du Bénin : milieux naturels, régions, économie agricole régionale. Abomey-Calavi, Bénin : Université Nationale du Bénin.
Dovonou F., Aina M., Boukari M & Alassane A., 2011. Pollution physico-chimique et bactériologique d’un écosystème aquatique et ses risques écotoxicologiques : cas du Lac Nokoué au Sud Bénin. Int. J. Biol. Chem. Sci., 5(4), 1590-1602, doi.org/10.4314/ijbcs.v5i4.23
Gayraud S., Hérouin E. & Philippe M., 2002. Le colmatage minéral du lit des cours d’eau : revue bibliographique des mécanismes et des conséquences sur les habitats et les peuplements de macroinvertébrés. Bull. Fr. Pêche Piscic., 365-366, 339-355.
Gnohossou P.M., 2006. La faune benthique d’une lagune ouest africaine (le Lac Nokoué au Bénin), diversité, abondance, variations temporelles et spatiales, place dans la chaîne trophique. Thèse de doctorat : Institut National Polytechnique de Toulouse (France).
Gubbay S., 2003. Marine aggregate extraction and biodiversity. Information, issues and gaps in understanding. Report to the Joint Marine Programme of The Wildlife Trusts and WWF-UK. Newark, UK: The Wildlife Trusts; Godalming, UK: WWF-UK.
Guenda W., 1996. Étude faunistique, écologique et de la distribution des insectes d’un réseau hydrographique de l’Ouest africain : le Mouhoun (Burkina Faso) ; rapport avec Simulium damnosum Theobald, vecteur de l’onchocercose. Thèse d’État : Université de droit, d’économie et des sciences d’Aix Marseille III (France).
Guilcher, 1959. Contribution à l’étude des sols des régions tropicales. Les sols rouges sur sable et sur grès d’Afrique occidentale. Mémoires ORSTOM. Paris : ORSTOM.
Hébert S. & Légaré S., 2000. Suivi de la qualité des rivières et petits cours d’eau. Québec, Canada : Ministère de l’Environnement.
Houssou M., 2012. Variabilité saisonnière des communautés planctoniques (phyto et zooplancton) des lacs Azili, Hlan et Toho. Mémoire de master : Université d’Abomey-Calavi, École Polytechnique d’Abomey-Calavi (Bénin).
Kennish M.J., 1998. Pollution impacts on marine biotic communities. Boca Raton, FL, USA: CRC Press.
Kombieni H.A., 2016. Les impacts environnementaux et socio-économiques de l’exploitation du sable lagunaire dans la commune de Grand-Popo (Bénin). Rev. Géogr. Univ. Ouaga I Pr Joseph KI-ZERBO, 5(2).
Koudenoukpo Z.C. et al., 2017. Caractérisation physico-chimique d’un système lotique en région tropicale : la rivière Sô au Sud-Bénin, Afrique de l’Ouest. J. Appl. Biosci., 113, 11111-11122, doi.org/10.4314/jab.v113i1.1
Lalèyè P., Akélé D. & Philippart J.C., 2005. La pêche traditionnelle dans les plaines inondables du fleuve Ouémé au Bénin. Cah. Éthologie, 22(2), 25-38.
Lalèyè K.R. et al., 2019. Inventory of estuarine and lagoonal ecosystems subjected to sand-mining activities in Southern Benin (West Africa). J. Environ. Prot., 10, 473-487, doi.org/10.4236/jep.2019.104027
Lalèyè K.R. et al., 2020. Impacts related to sand dredging activity: literature review. J. Biodivers. Environ. Sci., 16, 19-32.
Mama D. et al., 2011. Étude dynamique des apports en éléments majeurs et nutritifs des eaux de la lagune de Porto-Novo (Sud-Bénin). Int. J. Biol. Chem. Sci., 5(3), 1278-1293, doi.org/10.4314/ijbcs.v5i3.72279
Ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatiques (MDDELCC), 2017. Guide de caractérisation physicochimique de l’état initial du milieu aquatique avant l’implantation d’un projet industriel. Québec, Canada : Direction générale du suivi de l’état de l’environnement.
Nisbet M. & Verneaux J., 1970. Composantes chimiques des eaux courantes. Ann. Limnol., 6, 161-190.
Noumon C.J. et al., 2015. Évaluation de la qualité physico-chimique et du risque d’eutrophisation de la retenue d’eau de Kogbétohouè (Sud-Bénin). J. Appl. Biosci., 85, 7848-7861, doi.org/10.4314/jab.v85i1.9
ONEMA-INERIS, 2009. Impacts sur les milieux aquatiques des sédiments de dragage gérés à terre : problématique, contexte réglementaire, modélisation du transfert de contaminants organiques. Rapport d’étude N°DRC-08-95306-16457A. Aix-en-Provence, France : INERIS.
Oyédé L.M., Kaki C. & Agbani K.M.A., 1983. Le domaine margino-littoral sud-ouest béninois : évolution récente du milieu sédimentaire. Communication présentée aux premières journées scientifiques internationales. Abomey-Calavi, Bénin : Université Nationale du Bénin.
Pliya J., 1980. La pêche dans le sud-ouest du Bénin : étude de géographie appliquée sur la pêche continentale et maritime. Paris : Agence de Coopération Culturelle et Technique.
Roche International, 2000. Étude du projet d’aménagement des plans d’eau du Sud-Bénin. Cotonou : Roche International.
Rodier J., 2009. L’analyse de l’eau. 9e éd. Poitiers, France : Dunod.
Saviour N., 2012. Environmental impact of soil and sand mining: a review. Int. J. Sci. Environ. Technol., 1(3), 125-134.
Tchakonté S. et al., 2015. Impact of anthropogenic activities on water quality and freshwater shrimps diversity and distribution in five rivers in Douala, Cameroun. J. Biodivers. Environ. Sci., 4, 183-194.
Tossou Y.Y.J., 2000. Évaluation des nuisances causées par la prolifération de la jacinthe d’eau (Echornia crassipes)(Mart) Solms-Lawbech sur le lac Nokoué et la lagune de Porto-Novo et la pollution par le dépôt de déchets urbains sur le chenal de Cotonou (République du Bénin). Mémoire de licence : Université d’Abomey-Calavi, École Polytechnique d’Abomey-Calavi (Bénin).
Trinquier C., 2009. Le risque d’eutrophisation des lagunes méditerranéennes : le cas de la lagune de Thau (Hérault). Mémoire de master 1 . Université Montpellier III (France).
van Dalfsen J.A. & Essink K., 1997. Risk analysis of coastal nourishment techniques in The Netherlands (RIACON). Haren, The Netherlands: National Institute for Coastal and Marine Management/RIKZ.
Vinawamon G.C., 2010. Impact du chenal de Cotonou sur les ressources halieutiques du Lac Nokoué. Quelles solutions pour un bon fonctionnement de l’équilibre de l’écosystème ? Diplôme d’Études Supérieures Spécialisées (DESS) : Université d’Abomey-Calavi (Bénin).
Yacoubou R.H., 2005. Contribution à l’élévation écologique des zones humides du site RAMSAR 1018 au sud-Bénin : cas de la Lagune de Porto Novo. Thèse de doctorat : Université d’Abomey Calavi, Cotonou (Bénin).
Zinsou H.L. et al., 2016. Caractéristiques physicochimiques et pollution de l’eau du Delta de l’Ouémé au Bénin. J. Appl. Biosci., 97, 9163-9173.

