- Startpagina tijdschrift
- Volume 27 (2023)
- Numéro 1
- Stocks de carbone des systèmes agroforestiers de la zone soudano-sahélienne du Cameroun, Afrique centrale
Weergave(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Stocks de carbone des systèmes agroforestiers de la zone soudano-sahélienne du Cameroun, Afrique centrale

Documenten bij dit artikel
Version PDF originaleRésumé
Description du sujet. Les systèmes agroforestiers (SAF) en périphérie des aires protégées fortement anthropisées apparaissent comme les systèmes de production les plus adaptés pour fournir une multitude de services écosystémiques tout en réduisant la pression sur les ressources naturelles. Ils constituent en effet d’importants puits de carbone dont le rôle compensatoire dans le processus d'atténuation au changement climatique reste peu connu.
Objectifs. Évaluer le potentiel de stockage de carbone des SAF de la zone périphérique du Parc National de Bouba Ndjidda ainsi que la valeur financière de ces stocks de carbone.
Méthode. Les données ont été collectées dans quatre types de SAF, à savoir les plantations éparses (PE), les haies vives (HV), les jardins de case (JC) et les jachères (JA). Un inventaire total des espèces ligneuses a été effectué et les données dendrométriques collectées dans 37 parcelles de 50 m x 50 m (8,5 ha). Les pools considérés pour l’évaluation des stocks de carbone sont la partie aérienne, la partie souterraine, la biomasse des herbacées et juvéniles, la litière et le sol. La biomasse ligneuse a été évaluée par des équations allométriques. Les analyses statistiques ont consisté en des tests de comparaisons multiples entre les stocks de carbone des différents pools des SAF d’une part et ceux des SAF entre eux d’autre part.
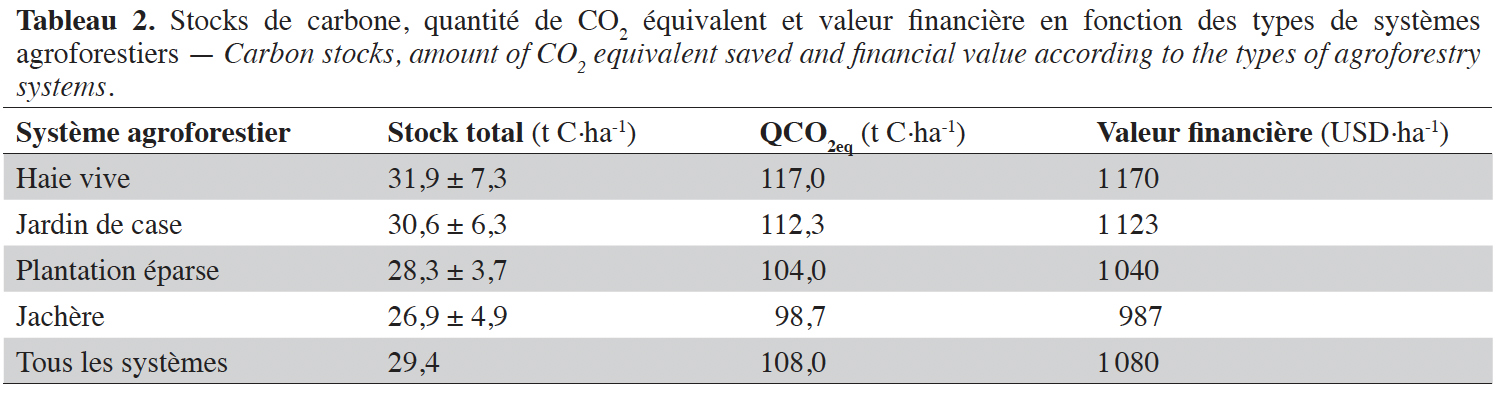
Résultats. Les stocks de carbone totaux variaient de 26,9 t C·ha-1 pour les jachères (JA) à 31,9 t C·ha-1 pour les haies vives (HV). Les stocks de carbone moyen du sol représentaient 31 à 59 % du carbone total et diminuaient significativement avec la profondeur du sol. En termes de paiements pour services écosystémiques, les prix des stocks de carbone des SAF étaient estimés entre 986 et 1 170 USD·ha-1.
Conclusions. Les SAF de la région soudano-sahélienne jouent un rôle écologique et économique important en contribuant significativement à la lutte contre les changements climatiques à travers le stockage du carbone.
Abstract
Carbon stocks of agroforestry systems in the Sudano-Sahelian zone of Cameroon, Central Africa
Description of the subject. Agroforestry systems (AFS) on the periphery of highly anthropized protected areas appear to be the most suitable production systems for providing a multitude of ecosystem services while reducing pressure on natural resources. They are indeed important carbon sinks whose compensatory role in the climate change mitigation process remains little known.
Objectives. To assess the carbon storage potential of AFS in the peripheral zone of Bouba Ndjidda National Park as well as the financial value of these carbon stocks.
Method. Data were collected in four types of AFS, namely sparse plantations (PE), hedgerows (HV), home gardens (JC), and fallows (JA). A total inventory of woody species was conducted and dendrometric data collected in 37 plots of 50 m x 50 m (8.5ha). The pools considered for carbon stock assessment were woody aboveground biomass, belowground biomass, herbaceous biomass, litter and soil. Woody biomass was evaluated by allometric equations. Statistical analyses consisted of multiple comparison tests between the carbon stocks of the different AFS pools on the one hand and those of the AFS among themselves on the other hand.
Results. Total carbon stocks ranged from 26.9 t C·ha-1 for fallows (JA) to 31.9 t C·ha-1 for hedgerows (HV). Average soil carbon stocks represented 31-59% of total carbon and decreased significantly with soil depth. In terms of payments for ecosystem services, prices for AFS carbon stocks were estimated to be between USD 986 and USD 1,170·ha-1.
Conclusions. Agroforestry systems in the Sudano-Sahelian region play an important ecological and financial role by contributing significantly to the fight against climate change through carbon storage.
Inhoudstafel
Reçu le 20 janvier 2022, accepté le 9 Novembre 2022, mis en ligne le 8 février 2023
Cet article est distribué suivant les termes et les conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr)
1. Introduction
1La zone soudano-sahélienne du Cameroun est parmi les plus sèches du pays avec une riche diversité biologique constituée de plus de 30 espèces de grands mammifères, 379 espèces d’avifaunes et 35 espèces de reptiles (Omondi et al., 2008). Cette biodiversité est principalement conservée dans un réseau d’aires protégées (AP) de plus en plus soumis aux pressions anthropiques. Ces espaces, déjà fragiles et vulnérables du fait de l’aridité climatique, font face à de nombreuses menaces dues essentiellement au changement d’utilisation des terres, à l’exploitation non durable des ressources naturelles, au pâturage extensif, aux feux de brousse non contrôlés et à l’avancée du front agricole (Scholte et al., 2018 ; Djiongo et al., 2019).
2Pour réduire ces menaces, la mise en place des systèmes agroforestiers (SAF) dans les zones tampons est souvent recommandée. Cependant, le potentiel de stockage de carbone de ces SAF reste peu connu. Selon Nguekeng et al. (2018), dans les pays du bassin du Congo, la recherche de méthodes peu onéreuses pour piéger le carbone constitue un nouveau défi. Parmi les méthodes envisagées, l’agroforesterie occupe une place de choix et est perçue comme une composante essentielle d’une agriculture intelligente face au climat (Williams et al., 2015). Les SAF représenteraient un moyen intéressant pour atteindre les objectifs de réduction des émissions de gaz à effet de serre (GES). Ils sont bien représentés parmi les activités éligibles pour les mécanismes d’atténuation des changements climatiques parmi lesquels le Mécanisme de Développement Propre (MDP) et la Réduction des Émissions liées à la Déforestation et à la Dégradation des Forêts y compris la conservation et l’augmentation des puits de carbone (REDD+). Ces deux mécanismes offrent des mesures incitatives pour récompenser les actions de réduction des émissions des GES dans l’atmosphère. Les expériences de paiements pour services environnementaux dans le cadre de ces initiatives se sont multipliées depuis la fin des années 1980 (Karsenty et al., 2010) et ont permis à de nombreux pays (Costa Rica, Madagascar, Ouganda, Papouasie) de percevoir des compensations.
3Malgré leur variabilité selon les contextes, ces compensations contribuent directement et indirectement aux politiques d’adaptation et d’atténuation du changement climatique (Karsenty, 2019) et pourraient également permettre aux agriculteurs des SAF de la zone soudano-sahélienne du Cameroun de bénéficier des avantages liés aux crédits carbone. La dynamique du carbone dans les SAF est de plus en plus étudiée sous les tropiques (Kumar & Nair, 2011). Une méta-analyse menée par Feliciano et al. (2018) sur les options agroforestières qui stockent le plus de carbone dans différentes régions du monde révèle qu’en moyenne les stocks de carbone sont plus importants dans les systèmes agroforestiers sous climats tropicaux, aussi bien au-dessus du sol (4,85 t C·ha-1·an-1) qu’en dessous (2,23 t C·ha-1·an-1). En termes de changement d’utilisation des terres, le piégeage du carbone au-dessus du sol le plus important (12,8 t C·ha-1·an-1) se produit lorsque les terres dégradées sont remplacées par des jachères améliorées (Feliciano et al., 2018). Le carbone est directement prélevé dans l’atmosphère sous forme de CO2 et se retrouve dans la biomasse vivante aérienne, souterraine et dans la matière organique morte des sols (litière). Une estimation des stocks de carbone dans tous ces pools évitera des sous-estimations des stocks de l’écosystème, compte tenu du fait que dans le marché carbone par exemple, la prise en compte des différents pools de carbone permet de mieux valoriser leur potentiel en termes de carbone.
4Au Cameroun par exemple, les études de dynamique de carbone dans les systèmes agroforestiers se sont concentrées majoritairement dans la zone forestière, notamment sur les SAF à base de cacaoyer (Nguekeng et al., 2018 ; Temgoua et al., 2018 ). Les SAF de la zone soudano-sahélienne du Cameroun ont fait l’objet de très peu d’études d’évaluation de leur potentiel de stockage de carbone total. Quelques auteurs y ont estimé les stocks de carbone dans les parcs agroforestiers (Noiha et al., 2017 ; Djongmo et al., 2019). Leurs travaux se sont limités à la biomasse épigée ligneuse au détriment d’autres pools de carbone (Noiha et al., 2018). Pourtant, le carbone présent dans le sol à lui seul peut représenter jusqu’à 20 % du carbone total présent dans les SAF en milieu soudano-sahélien (Saidou et al., 2012). Au cours des deux dernières décennies, malgré le fait que de nombreux travaux ont été entrepris pour estimer les stocks de carbone des SAF en Afrique, très peu présentent une étude comparative du potentiel de séquestration de ces systèmes entre eux. À l'heure où les écosystèmes naturels disparaissent à un rythme alarmant, il est nécessaire aujourd'hui de souligner le potentiel de séquestration du carbone des SAF afin que leur rôle compensatoire dans le processus d'atténuation du changement climatique soit connu. Dans un contexte de promotion des SAF, et considérant que dans le cas du Parc National de Bouba Ndjidda (PNBN), les SAF représentent les différentes formes de conversion des écosystèmes naturels (Djiongo et al., 2019), l’évaluation de leurs stocks de carbone permet de déterminer le SAF qui contribuerait le mieux dans la lutte contre les changements climatiques, mais surtout en adéquation avec les besoins de la population. De plus, dans le souci de faire une estimation plus précise des stocks de carbone du sol, une évaluation de la variation des stocks de carbone en fonction de la profondeur permettrait de savoir quel système agroforestier permet de stocker le plus de carbone en surface ou en profondeur et pourquoi, dans l'optique de voir dans quel système prévoir une séquestration à long terme (Nair et al., 2009). Cette étude a pour objectifs d’évaluer :
5– le potentiel de stockage de carbone dans tous les pools des quatre SAF autour du PNBN ;
6– la distribution verticale du carbone organique dans les sols ;
7– la valeur financière des stocks de carbone des SAF en vue de l’implémentation des paiements pour services écosystémiques.
2. Matériel et méthodes
2.1. Zone d’étude
8Cette étude a été réalisée dans les SAF de la périphérie du Parc National de Bouba Ndjidda situé dans le département du Mayo Rey de la région du Nord Cameroun, entre 8°21’ et 9°00’ de latitude Nord et 14°25’ et 14°55’ de longitude Est (Ministère des Forêts et de la Faune, 2010). Le PNBN et ses zones d’intérêt cynégétique périphériques s’étendent sur une superficie d’environ 700 000 ha (Djiongo et al., 2019). Le relief y est relativement peu diversifié et l’altitude moyenne se situe entre 280 et 400 m. Cependant, vers la limite sud du parc, l’altitude maximale est de 900 m. Le climat qui y règne est de type soudano-sahélien caractérisé par l’alternance d’une saison sèche (novembre-avril) et une saison des pluies (avril-octobre). La température moyenne annuelle est de 28 °C avec un maximum de 35 °C et un minimum de 21 °C. Les précipitations totales varient entre 800-1 250 mm·an-1. Les sols sont essentiellement ferrugineux, mais parfois ferrallitiques ou hydromorphes (Aoudou et al., 2018). Le réseau hydrographique du PNBN est assez important et constitué principalement du Mayo Vaimba et de ses nombreux affluents (Ministère des Forêts et de la Faune, 2010). La population autour de ce parc était estimée à 76 204 habitants en 2007 (World Wide Fund for Nature, 2007) et, selon les projections démographiques, serait de 260 149 habitants (Bureau Central des Recensements et des Études de Population, 2015). L’agriculture représente le principal facteur de dégradation des écosystèmes naturels dans la zone périphérique du PNBN. Elle constitue la principale activité socio-économique dans la zone suivie de l’élevage et de la chasse. La principale culture de rente est le coton, l’espèce la plus répandue étant Gossypium hirsutum L. (Ministère des Forêts et de la Faune, 2010).
2.2. Collecte des données
9Les données ont été collectées dans quatre types de SAF identifiés par Djiongo (2015) autour du PNBN, à savoir les jardins de cases (JC), les haies vives (HV), les plantations éparses (PE) et les jachères (JA). Ces quatre SAF sont les principaux systèmes retrouvés autour des aires protégées. Ces SAF présentent des différences en termes de structure, de composition spécifique, d’importance écologique, culturelle et ethnobotanique qui pourraient justifier leurs différences de stock de carbone. Ils sont pluristrates et à arrangement spatial interstitiel (arbres dispersés dans les parcelles de cultures), à l’exception des haies vives qui sont monostrates et à arrangement spatial mixte (arbres alignés à la périphérie de l’espace alloué aux cultures agricoles et quelques-uns dispersés dans le champ). Dans les SAF en général, la composante ligneuse est toujours présente et on lui associe de temps en temps les autres composantes, sauf dans le cas des jachères où les cultures et la jachère forestière alternent. La famille des Fabaceae est dominante dans les quatre SAF où la strate supérieure est dominée par des espèces ligneuses à usages multiples telles qu’Acacia polyancatha Willd. La densité d’arbres est de 180, 37, 31 et 29 tiges·ha-1 respectivement pour les haies vives, les jachères, les jardins de case et les plantations éparses. Ces SAF ont été choisis sur la base de la proximité avec les villages de la zone périphérique du PNBN (≤ 5 km), de la volonté du paysan de nous y conduire et de son accord pour la collecte des données. Des 28 villages adjacents au parc, 13 ont été sélectionnés en fonction de leur accessibilité. L’estimation des stocks de carbone a été faite à partir :
10– de la partie aérienne constituée de la biomasse aérienne (AGB) et de la biomasse des herbacées et juvéniles issus de la régénération,
11– de la partie souterraine constituée de la biomasse racinaire (BGB) et des radicelles,
12– de la biomasse morte (la litière),
13– du sol tel que recommandé par le Groupe Intergouvernemental d’Experts sur l’Évolution du Climat (GIEC) (Intergovernmental Panel on Climate Change, 2003) pour les parcs agroforestiers.
14D’après les lignes directrices du GIEC, la matière organique morte regroupe la litière et les bois morts. En raison de la très faible proportion des bois morts durant la période de collecte des données, soit en fin de saison de pluies, nous les avons assimilés à la litière. Au total, 37 parcelles carrées de 50 m x 50 m (Takimoto et al., 2008), soit une superficie totale échantillonnée de 8,5 ha, ont été échantillonnées. Ceci correspond à 17 parcelles dans les PE, 10 dans les JA, 6 dans les JC et 4 dans les HV. Aux quatre extrémités de chacune de ces parcelles, des sous-parcelles de 1 m x 1 m ; 0,5 m x 0,5 m et 0,2 m x 0,2 m ont été installées respectivement pour la collecte des données des juvéniles et herbacées (espèces ligneuses de diamètre < 5 cm et herbacées non ligneuses), de la litière et des radicelles (diamètre ≥ 2 mm). L’inventaire de toutes les espèces ligneuses de diamètre ≥ 5 cm a été effectué dans ces parcelles de 50 m x 50 m et pour chaque individu identifié, outre le nom scientifique, commun ou vernaculaire relevé, le diamètre a été mesuré à 1,30 cm au-dessus du sol.
15La biomasse des espèces ligneuses inventoriées a été estimée par la méthode non destructive en utilisant des équations allométriques pour convertir les variables collectées sur chaque arbre en biomasse (Picard et al., 2012). En revanche, la méthode destructive a été utilisée pour l’estimation de la biomasse des juvéniles et herbacées, de la litière et des radicelles. Les échantillons de radicelles ont été prélevés dans un volume de terre de 20 cm x 20 cm x 20 cm par la méthode de flottaison successive dans les bassins de lavage (Zapfack, 2005). Ils ont ensuite été tamisés à l’aide d’un tamis suffisamment fin pour ne pas perdre le matériel végétal. Les échantillons de végétation herbacée, de litière, des radicelles et du sol collectés ont été empaquetés puis séchés dans l’étuve à 80 °C au laboratoire de la Station Polyvalente de l’Institut de Recherche Agricole pour le Développement (SP-IRAD) de Garoua jusqu’à l’obtention d’une masse constante.
16Pour déterminer les stocks de carbone du sol, nous avons utilisé des échantillons composites à partir d’échantillons de sol prélevés à l’aide d’une tarière dans une sous-parcelle de 20 cm x 20 cm et à des profondeurs variables soit 0-20 cm, 20-60 cm et 60-100 cm (Das & Chaturvedi, 2008). Ainsi, 15 échantillons ont été collectés par parcelle, soit 5 échantillons pour une même profondeur. Au total, 464 échantillons de sol ont été collectés et acheminés au laboratoire de la SP-IRAD de Yaoundé où nous avons déterminé leur teneur en carbone en suivant le procédé de « dosage du carbone organique par oxydation sulfochromique » (Walkey & Black, 1934). Pour la densité apparente, le sol non remanié a été prélevé à l’intérieur d’un cylindre de densité (Heuscher et al., 2005).
2.3. Analyse des données
17La méthode non destructive a été utilisée pour l’évaluation de la biomasse ligneuse et cela a nécessité l’usage de l’équation allométrique pantropicale de Chave et al. (2014) pour l’évaluation de la biomasse aérienne ligneuse. Cette équation établie à partir des données des arbres de diamètre ≥ 5 cm permet de prédire la biomasse aérienne à partir du diamètre d'un arbre, la densité du bois de l’espèce et surtout l’indice environnemental. L’équation de Chave et al. (2014) se définit comme suit :
18AGB = e (-1,803-0,976 × E + 0,976ln(ρ) + 2,673 × ln(D) - 0,0299 × (ln(D))2)) [1]
19avec AGB, biomasse aérienne ligneuse (kg) ; E, indice environnemental ; ρ, densité du bois de l’espèce considérée et D, diamètre de l’arbre (cm).
20Les valeurs de densité de bois utilisées sont celles du Global Wood Density Data Base (Zanne et al., 2009). Pour les espèces dont la densité du bois est absente de la littérature, la moyenne des densités de bois disponibles pour les espèces inventoriées dans la zone d’étude a été utilisée par défaut (Chimi et al., 2018). Cette densité du bois était en moyenne de 0,63 g·cm-3 dans les SAF de la zone d’étude.
21L’indice environnemental était défini par :
22E = (0,178 × TS - 0,938 × CWD - 6,61 × PS) × 10−3. [2]
23Cette équation est fonction de certaines variables climatiques d’un point géographique donné, à savoir :
24– le TS qui renvoie à la saisonnalité de la température (= écart-type sur un an de la température moyenne mensuelle, en °C) ;
25– le CWD qui est le déficit climatique en eau (= somme sur un an de la différence entre les précipitations mensuelles et l’évapotranspiration mensuelle, en ne comptant que les mois où cette différence est négative) ;
26– le PS qui est la saisonnalité des précipitations (= coefficient de variation des précipitations mensuelles, en %).
27Afin de faciliter la détermination de cet indice, Chave et al. (2014) ont cartographié les valeurs de cet indice à l’échelle mondiale et il est possible de la déterminer pour un point donné à partir des coordonnées géographiques de ce point avec l’aide du package « raster » du logiciel R. Dans le cas de cette étude, l’indice environnemental déterminé variait de 0,53 à 0,64 pour une moyenne de 0,57.
28Pour déterminer la biomasse des racines, l’équation de Cairns et al. (1997) a été utilisée comme dans les études de Takimoto et al. (2008) au Mali et de Diatta (2015) au Sénégal. Elle est recommandée par la FAO (1997) pour les zones sèches (pluviométrie < 1 500 mm). Cette équation est basée sur le principe que la biomasse hypogée est étroitement liée à la biomasse épigée. Elle est définie par :
29BGB = e(-1,0587 + 0,8836 × ln(AGB)) [3]
30avec BGB, biomasse racinaire et AGB, biomasse aérienne ligneuse.
31Les stocks de carbone des différents pools considérés ont été déterminés à partir de leur biomasse calculée en multipliant la biomasse obtenue par le coefficient 0,47 (Zapfack et al., 2016). Ce coefficient correspond en outre à la fraction carbone (FC) contenue dans la biomasse sèche.
32Pour la détermination des stocks de carbone du sol, la formule de Poeplau et al. (2017) a été utilisée :
33Carbone du sol (t C·ha-1) = teneur en carbone × densité apparente × profondeur [4]
34Avec la teneur en carbone en pourcentage, la densité apparente correspond à l’équation [5] et la profondeur correspond à l’épaisseur de la couche considérée (en m) :
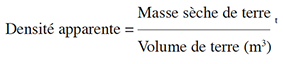
35[5]
36Les stocks de carbone totaux estimés de tous les pools (espèces ligneuses + litière + juvéniles et herbacées + racines + radicelles + sol) pour chaque SAF ont été convertis en quantité équivalente de CO2 (CO2eq) en utilisant le ratio 44/12 (soit 3,67) qui correspond au rapport CO2/C.
37Cette valeur a été ensuite utilisée pour évaluer la valeur monétaire de ces systèmes en utilisant la valeur du service écologique estimée à 10 USD·t CO2eq (Ecosystem Marketplace, 2017 ; Ramstein et al., 2019). Les données collectées sur le terrain ont été analysées à l’aide du logiciel R version 3.4.1 (R Core Team, 2018). Après Analyse de Variance (ANOVA) à deux facteurs de type III (les données étant déséquilibrées), les tests de comparaisons multiples (LSD) ont été réalisés dans un premier temps entre les stocks de carbone moyen des systèmes, puis entre les stocks de carbone moyen au sein des systèmes et enfin entre les stocks de carbone total épigé et hypogé. Le stock de carbone total épigé représente la somme des stocks de carbone moyen de la biomasse aérienne ligneuse, de la litière et des herbacées et juvéniles. Celui du carbone total hypogé représente la somme des stocks de carbone moyen de la biomasse racinaire, des radicelles et du sol. Les tests de Kruskal-Wallis ont été utilisés pour comparer les différences entre les moyennes des stocks de carbone du sol en fonction de la profondeur.
3. Résultats
3.1. Stocks de carbone des systèmes agroforestiers de la zone périphérique du Parc National Bouba Ndjidda
38La comparaison des stocks de carbone des différents pools de chacun des systèmes étudiés fait ressortir une différence significative (p < 0,02 ) (Figure 1), excepté entre les stocks de carbone de la biomasse racinaire et ceux des radicelles, d’une part, et entre les stocks de carbone de la litière et ceux des herbacées et juvéniles, d’autre part. Globalement au sein des SAF, les stocks de carbone suivent le gradient décroissant : sol > biomasse aérienne ligneuse > biomasse racinaire > radicelles > litière > juvéniles et herbacées, sauf dans les HV où les stocks de carbone dans la biomasse aérienne ligneuse étaient plus élevés.
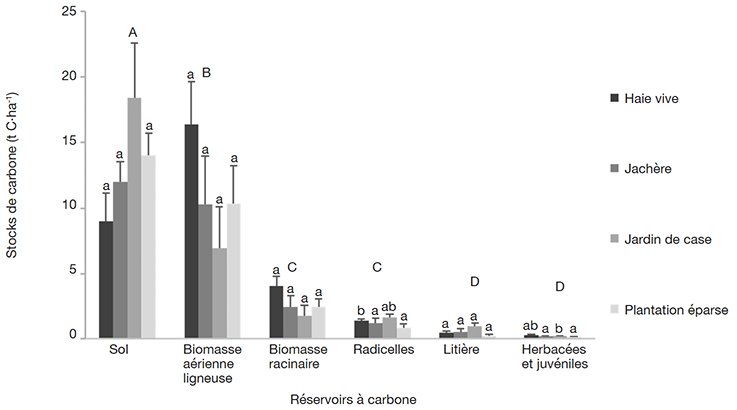 Figure 1. Stocks de carbone moyen des systèmes agroforestiers de la périphérie du Parc National de Bouba Ndjidda — Average carbon stocks of agroforestry systems in the periphery of Bouba Ndjidda National Park.
Figure 1. Stocks de carbone moyen des systèmes agroforestiers de la périphérie du Parc National de Bouba Ndjidda — Average carbon stocks of agroforestry systems in the periphery of Bouba Ndjidda National Park.
Les valeurs partageant une même lettre minuscule (entre les systèmes au sein de chaque pool) et ceux partageant une même lettre majuscule (entre les pools au sein de chaque système) ne sont pas significativement différentes (p < 0,05) ; moyenne ± erreur standard, test LSD, n = 37 — Values sharing the same lowercase letter (between systems within each pool) and those sharing the same uppercase letter (between pools within each system) were not significantly different (p < 0.05); mean ± standard error, LSD test, n = 37.
39Lorsqu’on compare les stocks de carbone des différents pools entre les systèmes, aucune différence significative n’est observée pour la biomasse aérienne ligneuse (AGB). Le même constat est fait pour ce qui est de la biomasse racinaire (BGB) et la litière. Les stocks de carbone contenus dans les radicelles étaient par ailleurs significativement différents entre les systèmes (p < 0,001). Ils sont plus élevés dans les JC (1,7 ± 0,2 t C·ha-1) que dans les trois autres systèmes. Au niveau des herbacées et juvéniles, les stocks de carbone étaient également significativement différents (p < 0,05) et plus élevés dans les JC (0,3 ± 0,02 t C·ha-1) comparativement à ceux des PE et des JA qui étaient respectivement de 0,2 ± 0,06 t C·ha-1 et 0,2 ± 0,02 t C·ha-1.
40Lorsqu’on considère le carbone total épigé et hypogé de chaque SAF, des différences significatives sont observées entre ces deux compartiments au sein des JA et des JC (Figure 2). Globalement, les stocks de carbone hypogé sont plus élevés que ceux du carbone épigé, à l’exception des HV où ils sont plus élevés dans la partie épigée. La tendance des stocks de carbone épigé des SAF autour du PNBN a été la suivante en ordre décroissant : HV > JA > PE > JC et ceux du carbone hypogé : JC > PE > JA > HV. Dans l’ensemble, entre les systèmes il n’y avait pas de différence significative entre les stocks de carbone épigé et hypogé.
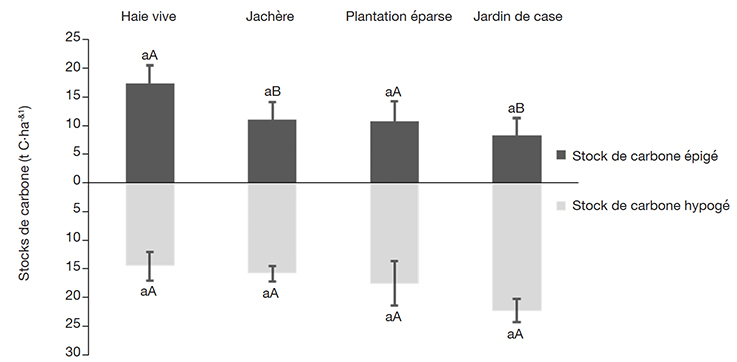 Figure 2. Stocks de carbone épigé et hypogé des systèmes agroforestiers de la périphérie du Parc National de Bouba Ndjidda — Epigeous and hypogeous carbon stocks of agroforestry systems in the periphery of Bouba Ndjidda National Park.
Figure 2. Stocks de carbone épigé et hypogé des systèmes agroforestiers de la périphérie du Parc National de Bouba Ndjidda — Epigeous and hypogeous carbon stocks of agroforestry systems in the periphery of Bouba Ndjidda National Park.
Lowercase and uppercase letters: see figure 1 — lettres minuscules et majuscules : voir figure 1; moyenne ± erreur standard — mean ± standard error; test LSD — LSD test; n = 37.
41Les résultats du tableau 1 montrent que la grande majorité du carbone de la partie aérienne est concentrée dans la biomasse ligneuse, soit plus de 80 fois la teneur du carbone contenu dans les herbacées et juvéniles. Ceci pourrait s’expliquer par la très faible régénération dans les SAF. En additionnant les valeurs moyennes des stocks de carbone de chaque pool et pour chacun des systèmes, les SAF de notre étude contiennent des stocks de carbone totaux de 31,9 ± 7,3 t C·ha-1 ; 30,6 ± 6,3 t C·ha-1 ; 28,3 ± 3,7 t C·ha-1 et 26,8 ± 4,9 t C·ha-1 respectivement pour les HV, les JC, les PE et les JA (Tableau 1). Cependant dans l’ensemble, il n’y avait pas de différence entre les stocks de carbone totaux des SAF étudiés. Les stocks de carbone du sol représentaient 31 à 59 % du carbone total dans les SAF. Pour les autres pools, les stocks de carbone variaient de 24-49 %, 13-18 %, 2-4 % et 1,0-1,5 % respectivement pour la biomasse aérienne ligneuse, les racines, la litière, les juvéniles et herbacées en fonction des types de SAF.
3.2. Contribution des espèces ligneuses des systèmes agroforestiers au stockage du carbone
42Les espèces A. polyacantha (42 %) et Ficus glumosa Delile (13 %) ont été identifiées comme étant celles qui stockent le plus de carbone dans les SAF de la zone d’étude. La figure 3 montre les espèces qui contribuent le plus au stock de carbone dans chaque type de SAF. Dans les HV, des huit espèces identifiées, A. polyacantha et Cassia siamea (Lam.) étaient les seules qui contribuaient le plus au stock de carbone avec respectivement 80 % (16,8 t C·ha-1) et 15 % (3,1 t C·ha-1). Ces deux espèces à elles seules représentaient plus de 95 % du stock de carbone des espèces ligneuses des HV. Dans les JA, 10 espèces sur les 32 identifiées contribuaient pour 93 % (12,5 t C·ha-1) au stock de carbone des espèces ligneuses du système. Les espèces F. glumosa et A. polyacantha sont celles qui contribuaient le plus au stock de carbone, soit respectivement 52 % (7,1 t C·ha-1) et 1,6 t C·ha-1 (12 %). Dans les JC, seules neuf espèces ont été identifiées et l’espèce A. polyacantha était celle qui contribuait le plus au stock de carbone (55 %, 5,0 t C·ha-1). Dans les PE, sur les 31 espèces identifiées, 10 espèces contribuaient à plus de 87 % au stock de carbone avec comme espèces dominantes Prosopis africana (Guill. & Perr.) Taub. et Daniella oliveri (Rolfe) Hutch. & Dalziel fournissant des stocks respectifs de 4,01 et 4,00 t C·ha-1 (Figure 3).
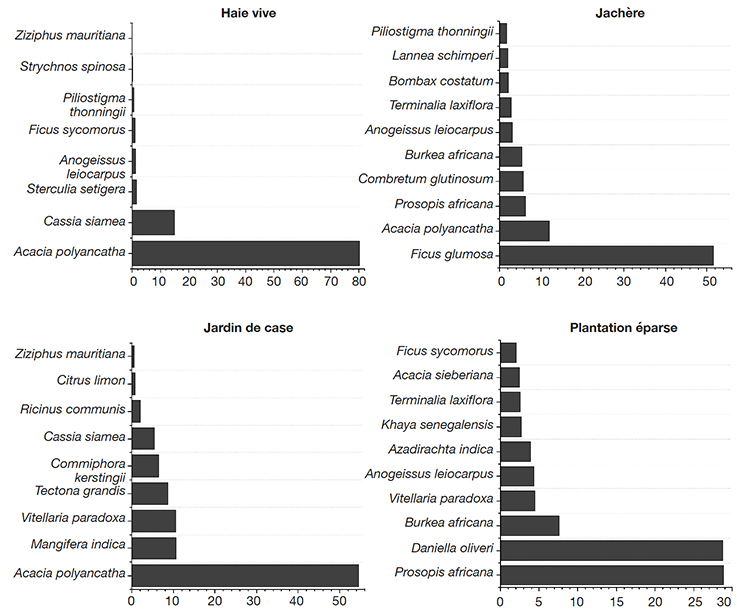 Figure 3. Stocks de carbone des espèces dominantes (pourcentage de contribution) des systèmes agroforestiers de la zone d’étude — Carbon stocks of dominant species (contribution percentage) in agroforestry systems of the study area.
Figure 3. Stocks de carbone des espèces dominantes (pourcentage de contribution) des systèmes agroforestiers de la zone d’étude — Carbon stocks of dominant species (contribution percentage) in agroforestry systems of the study area.
3.3. Variation des stocks de carbone en fonction des horizons du sol et des types de systèmes agroforestiers
43Dans les SAF de la zone d’étude, les stocks de carbone totaux du sol diminuaient significativement avec la profondeur du sol (Kruskal-Wallis, p = 0,009) de 17,9 ± 9 t C·ha-1 (0-20 cm) à 12,4 ± 6,6 t C·ha-1 (20-60 cm) et enfin à 11,7 ± 8,1 t C·ha-1 (60-100 cm) (Figure 4). La même tendance a été observée pour les différents types de SAF considérés individuellement, excepté pour les HV. En ordre décroissant, la tendance des stocks de carbone du sol des SAF a été la suivante : PE > JA > JC > HV.
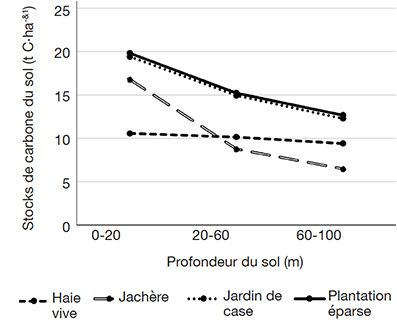
Figure 4. Variation des stocks de carbone du sol avec la profondeur dans les systèmes agroforestiers — Variation of soil carbon stocks with depth in agroforestry systems.
3.4. Paiements pour services environnementaux des systèmes agroforestiers
44Les stocks de carbone totaux estimés variaient de 31,9 ± 7,3 t C·ha-1 dans les HV à 26,9 ± 4,9 t C·ha-1 dans les JA. Ces stocks de carbone correspondent en termes de quantité équivalente de CO2 (CO2eq) à 117,0 t·ha-1 pour les HV et 98,7 t·ha-1 pour les JA. La valeur financière des stocks de carbone des SAF va décroissante des HV (1 170 USD·ha-1), JC (1 123 USD·ha-1), PE (1 040 USD·ha-1) et enfin les JA (987 USD·ha-1) (Tableau 2).
4. Discussion
4.1. Bilan carbone des SAF et contribution des espèces ligneuses
45Les quantités de carbone (27-32 t C·ha-1) stockées par les SAF en périphérie du PNBN sont supérieures aux 13,6 t C·ha-1 estimées par Noiha et al. (2018) dans les savanes de la même zone phytogéographique. La différence observée peut être due au fait que ces auteurs ont considéré uniquement la biomasse aérienne ligneuse et racinaire alors que dans le cadre de notre étude, en plus de ces pools de carbone, nous avons considéré aussi les stocks de carbone de la litière, des juvéniles et herbacées et du sol. Considérant uniquement la biomasse aérienne des espèces ligneuses, les stocks (6,9-16,4 t C·ha-1) trouvés dans cette étude sont proches des valeurs rapportées par Noiha et al. (2018) dans les savanes soudano-sahéliennes du Cameroun ; ils restent cependant faibles par rapport à celles estimées par Kemeuze et al. (2015) dans les forêts sacrées soudano-sahéliennes des monts Mandara où ils ont trouvé 31,2 t C·ha-1 dans la biomasse aérienne ligneuse. Pour Liu et al. (2004)1 cité par Kumar & Nair (2011), les plantations éparses, les parcs arborés et la jachère arborée au Sénégal stockent entre 31,8 et 52,1 t C·ha-1. Ce stock, légèrement supérieur à celui trouvé dans le cadre de cette étude, serait dû, en plus de la forte densité des espèces ligneuses dans les SAF étudiés, à la variabilité des protocoles d’échantillonnage. Toutefois, nos résultats permettent de soutenir les propos de Markum et al. (2013) pour qui les SAF, grâce à la conservation in situ des espèces ligneuses, constituent un moyen de stockage de carbone important tout en assurant une agriculture durable et le bien-être des populations.
46Les écarts statistiques observés entre les composantes ou au sein d’un même SAF peuvent s’expliquer par le niveau d’intervention de l’homme dans chacun d’eux. En effet, sur la base des entretiens effectués avec les paysans, les pratiques culturales variaient d’un système à l’autre et pour un même type de SAF, suivant le paysan. Ainsi, la densité des espèces ligneuses qui influence les stocks de carbone varie d’un système à l’autre (Noiha et al., 2018). Il est donc évident de constater que les JC, HV et les PE sont continuellement entretenus par les agriculteurs et la densité des espèces ligneuses qui y sont présentes est fonction des besoins des agriculteurs. En raison des services fournis par ces espèces ligneuses, certains sont introduits et d’autres conservés durant la mise en place du SAF au détriment d’autres jugés moins importants. Plusieurs auteurs avaient déjà fait ce constat ethnoécologique des SAF au Cameroun, essentiellement dans les cacaoyères (Sonwa et al., 2010). Ainsi, plus il y aura de gros arbres conservés, plus les quantités de carbone stockées seront élevées. La surface terrière étant directement liée au diamètre à hauteur de poitrine, elle permet de justifier les stocks de carbone élevés dans les PE et donc une probable corrélation significative et positive entre la surface terrière et les stocks de carbone des espèces ligneuses.
47Dans le cadre de la présente étude, l’espèce A. polyacantha était la plus dominante des SAF et contribuait pour près de la moitié des stocks de carbone (42 %). En effet, Peltier et al. (2007) ont montré que dans la zone d’étude, A. polyacantha est l’espèce la plus importante du point de vue écologique, socioéconomique et ethnobotanique retrouvée dans tous les SAF. Le potentiel de cette espèce a été longtemps vulgarisé et valorisé dans la zone soudano-sahélienne du Nord Cameroun comme une plante d’avenir dans les plantations paysannes. Outre ses fonctions de production de bois énergie, d’ombrage et de protection des cultures dans les haies vives, cette espèce, comme plusieurs autres légumineuses, a la capacité de rendre disponible dans le sol et sous forme assimilable pour les plantes l’azote fixé biologiquement de l’atmosphère.
4.2. Stocks de carbone du sol
48Tout en protégeant les sols contre l’érosion et en contribuant aux rechargements d’eau dans ces derniers, les SAF contribuent au maintien du carbone du sol (Jose, 2012). Des recherches bibliographiques effectuées, aucune étude n’a évalué le potentiel de stockage de carbone dans les sols dans la zone phytogéographique soudano-sahélienne du Cameroun. Dans le cadre de cette étude, nous avons montré que les stocks de carbone du sol représentent 31 à 59 % du carbone total dans les SAF étudiés. Ceci se rapproche des travaux de Saidou et al. (2012) en zone soudanienne du Bénin qui ont montré que les quantités de carbone dans le sol représentent plus de 20 % du carbone total. Les sols regorgent donc de quantités de carbone importantes dont la capitalisation dans la régulation du climat devrait davantage être prise en compte. Les stocks de carbone du sol sont constitués des micro-organismes vivants dans ces milieux, des racines décomposées, exsudats racinaires et de la décomposition de la matière organique (Montagnini & Nair, 2004). Ces activités se déroulent essentiellement dans la partie supérieure du sol où se font principalement les restitutions de matière organique. Ceci explique la diminution de façon significative des stocks de carbone du sol avec la profondeur (Razafimbelo et al., 2018) telle qu’observée dans le cadre de cette étude. Une méta-analyse effectuée par Nair et al. (2009) a montré que les stocks de carbone sont importants dans les horizons supérieurs du sol (< 50 cm). Plusieurs auteurs ont également montré le rôle significatif des racines d’arbres dans la séquestration du carbone dans les couches profondes du sol sous différentes conditions agro-écologiques telles que les parcs agroforestiers et les banques fourragères au Mali (Takimoto et al., 2008 ; Takimoto et al., 2009), les systèmes sylvopastoraux en Floride et les jardins de case au Sri Lanka (Mattsson et al., 2015). Ces résultats corroborent les nôtres ainsi que ceux de l’abondante littérature pour les stocks de carbone à cette profondeur. Cependant, la très grande variabilité des valeurs sujettes à des conditions spécifiques de chaque site suggère de rester prudent quant à l’utilisation des données.
4.3. Contribution financière des stocks de carbone des SAF
49Les stocks de carbone totaux étaient en moyenne de 30 t C·ha-1 pour l’ensemble des SAF étudiés. Cette valeur correspond à une séquestration équivalente de dioxyde de carbone de 108 t CO2·ha-1. Dans un contexte de promotion des SAF, si cette quantité de carbone augmentait dans l’écosystème, cela contribuerait à atténuer les changements climatiques. Sur le plan financier, s’appuyant sur l’hypothèse qu’avant la mise en place de ces SAF, l'espace était notamment occupé par des sols nus sans végétation et donc avec une teneur en carbone très faible, l’estimation de la valeur monétaire du carbone actuellement présent dans ces SAF correspond au prix carbone de 1 080 USD·ha-1. Cette valeur est inférieure aux 1 479 USD·ha-1 trouvés par Noiha et al. (2017) dans les SAF à base d’anacarde âgés de plus de 20 ans au Nord Cameroun, mais reste supérieur aux 483 USD·ha-1 trouvés par ces mêmes auteurs dans les savanes perturbées de la même région. Cette différence pourrait se justifier par le niveau de maturité des plantations d’anacarde et la variabilité de la densité d’arbres dans les différents systèmes qui dépend elle-même du niveau d’intervention anthropique. La variabilité des prix de CO2 équivalent pourrait également justifier ces écarts. En effet, en dehors de Noiha et al. (2017) qui ont utilisé un taux de 10 USD·CO2eq-1, les autres auteurs ont utilisé des prix tous différents les uns des autres. Les prix de CO2 équivalent ne sont pas pour le moment standard, ils varient d’un pays à l’autre, en fonction des projets, des écosystèmes, des zones agroécologiques, selon qu’il s’agit d’un projet REDD+, MDP ou d’un marché volontaire (Ramstein et al., 2019). Il est donc recommandé de rester prudent pour les comparaisons entre les différents protocoles de récolte des données sur le carbone et d’évaluation financière. Même si l’objectif premier de l’agriculteur n’est pas la vente du carbone, les bénéfices écologiques générés par les SAF à travers la commercialisation du CO2 constituent un incitatif financier pour l’introduction ou l’intensification des arbres dans les pratiques agraires ou les SAF existants.
5. Conclusions
50Cette étude menée dans la zone périphérique du PNBN a permis de déterminer le potentiel de stockage de carbone des SAF estimé en moyenne entre 27 et 32 t C·ha-1. Ces pratiques culturales jouent un rôle écologique important en contribuant significativement à la lutte contre les changements climatiques et peuvent générer une valeur financière moyenne de 1 000 USD·ha-1 indépendamment du système, ce qui constitue une valeur ajoutée pour les paysans en plus des autres biens et services fournis par les SAF. La combinaison du rôle écologique et économique de ces SAF permettrait non seulement de protéger l’environnement, mais aussi d’améliorer les conditions de vie des populations. Les résultats de cette étude pourraient ainsi constituer une bonne base dans les stratégies de promotion des SAF autour des AP de la région soudano-sahélienne à travers le Mécanisme pour un Développement Propre (MDP) et dans la mise en œuvre du processus REDD+ au niveau national et même régional, compte tenu du fait que les présentes données du carbone pourront servir de niveau de référence pour établir des scenarii relatifs à la certification du carbone et donc au développement d’un marché volontaire de carbone.
Remerciements
51Nous remercions le programme de Bourses canadiennes du jubilé de diamant de la reine Elizabeth II et le programme de bourses féminines de la fondation Spark of Hope pour leur soutien financier et logistique.
Bibliographie
Aoudou D.S., Narke C.J. & Mayen B.N., 2018. Evaluation of the advanced minning front craft in and around National Parks of the Benue and Bouba-Ndjidda in North Cameroon. J. Geogr. Inf. Syst., 10, 461, doi.org/10.4236/jgis.2018.104024
Bureau Central des Recensements et des Études de Population, 2015. Troisième recensement général de la population et de l’habitat. Yaoundé : BUCREP.
Cairns M.A., Brown S., Helmer E.H. & Baumgardner G.A., 1997. Root biomass allocation in the world's upland forests. Oecologia, 111, 1-11, doi.org/10.1007/s004420050201
Chave J. et al., 2014. Improved allometric models to estimate the aboveground biomass of tropical trees. Global Change Biol., 20, 3177-3190, doi.org/10.1111/gcb.12629
Chimi D., Zapfack L. & Djomo N., 2018. Diversity, structure and biomass (above and below) in a semi-deciduous moist forest of East Region of Cameroon. J. Biodivers. Environ. Sci., 12, 60-72.
Das D. & Chaturvedi O., 2008. Root biomass and distribution of five agroforestry tree species. Agrofor. Syst., 74, 223-230, doi.org/10.1007/s10457-008-9159-9
Diatta M., 2015. Étude du potentiel de stock de carbone d’espèces agroforestières et de leurs traits fonctionnels en lien avec les systèmes d’utilisation des terres au Sénégal. Thèse de doctorat : Université Laval (Canada).
Djiongo B.J.E., 2015. Contribution de l’agroforesterie à la réduction des conflits dans la zone d’intérêt cynégétique 19 de Tchéboa, Cameroun. Mémoire de fin d’étude : Université Laval (Canada).
Djiongo B.J.E. et al., 2019. Analysis of spatio-temporal dynamics of land use in the Bouba Ndjidda National Park and its adjacent zone (North Cameroun). Open J. For., 10, 39, doi.org/10.4236/ojf.2020.101004
Djongmo V.A. et al., 2019. Carbon sequestration potential and economic value in agroforestry parkland to Tectona grandis L. f. (Verbenaceae) in Central Africa: A case study to department of Poli (Northern Region in Cameroon). Adv. Res., 18(5), 1-16, doi.org/10.9734/air/2019/v18i530100
Ecosystem Marketplace, 2017. State of the voluntary carbon markets 2017. Washington, DC: Forest Trends.
Fao, 1997. State of the world’s forest. Oxford, UK: FAO.
Feliciano D., Ledo A., Hillier J. & Nayak D.R., 2018. Which agroforestry options give the greatest soil and above ground carbon benefits in different world regions? Agric. Ecosyst. Environ., 254, 117-129., doi.org/10.1016/j.agee.2017.11.032
Heuscher S.A., Brandt C.C. & Jardine P.M., 2005. Using soil physical and chemical properties to estimate bulk density. Soil Sci. Soc. Am. J., 69, 51-56, doi.org/10.2136/sssaj2005.0051a
Intergovernmental Panel on Climate Change, 2003. Good Practice Guidance for Land Use, Land-use Change and Forestry (LULUCF). Hayama, Japan: Institute for Global Environmental Strategies.
Jose S., 2012. Agroforestry for conserving and enhancing biodiversity. Agrofor. Syst., 85, 1-8, doi.org/10.1007/s10457-012-9517-5
Karsenty A., 2019. Les PSE dans les pays en développement : compenser ou récompenser ? In : Langlais A., dir. L’agriculture et les paiements pour services environnementaux. Quels questionnements juridiques ? Rennes, France : Presses Universitaires de Rennes, 2019hal-02080034
Karsenty A., Sembres T. & Randrianarison M., 2010. Paiements pour services environnementaux et biodiversité dans les pays du sud. Rev. Tiers Monde, 202, 57-74, doi.org/10.3917/rtm.202.0057
Kemeuze V. et al., 2015. Plant diversity and carbon stock in sacred groves of semi-arid areas of Cameroon: case study of Mandara mountains. Int. J. Environ., 4, 308-318, doi.org/10.3126/ije.v4i2.12659
Kumar B.M. & Nair P.R., 2011. Carbon sequestration potential of agroforestry systems: opportunities and challenges. Springer Science & Business Media.
Markum M., Ariesoesiloningsih E., Suprayogo D. & Hairiah K., 2013. Contribution of agroforestry system in maintaining carbon stocks and reducing emission rate at Jangkok Watershed, Lombok Island. AGRIVITA J. Agric. Sci., 35, 54-63, doi.org/10.17503/Agrivita-2013-35-1-p054-063
Mattsson E., Ostwald M., Nissanka S. & Pushpakumara D., 2015. Quantification of carbon stock and tree diversity of homegardens in a dry zone area of Moneragala district, Sri Lanka. Agrofor. Syst., 89, 435-445, doi.org/10.1007/s10457-014-9780-8
Ministère des Forêts et de la Faune, 2010. Plan d'aménagement du parc national de Bouba Ndjida et sa zone périphérique (2010-2014). Yaoundé : Ministère des Forêts et de la Faune.
Montagnini F. & Nair P., 2004. Carbon sequestration: an underexploited environmental benefit of agroforestry systems. Agrofor. Syst., 61, 281-295, doi.org/10.1007/978-94-017-2424-1_20
Nair P.R., Nair V.D., Kumar B.M. & Haile S.G., 2009. Soil carbon sequestration in tropical agroforestry systems: a feasibility appraisal. Environ. Sci. Policy, 12, 1099-1111, doi.org/10.1016/j.envsci.2009.01.010
Nguekeng P.B.C. et al., 2018. Plant diversity, ecological services, and carbon stock assessment in cocoa agroforestry plantations of forest and savannah transitions in Cameroon. In: Shukla G. & Chakravarty S., eds. Forest biomass and carbon. London: IntechOpen Ltd., doi.org/10.5772/intechopen.77093
Noiha N.V. et al., 2017. Floristic structure and sequestration potential of cashew agroecosystems in Africa: a case study from Cameroon. J. Sustainable For., 36, 277-288, doi.org/10.1080/10549811.2017.1296776
Noiha N.V. et al., 2018. Vegetation structure, carbon sequestration potential and species conservation in four agroforestry systems in Cameroon (Tropical Africa). Acta Bot. Brasilica, 11, doi.org/10.1590/0102-33062017abb0279
Omondi P. et al., 2008. Total aerial count of elephants and other wildlife species in Faro, Benoue and Bouba Ndjidda national parks and adjacent hunting blocks in northern. Yaoundé: WWF-Ministry of Forestry and Wildlife.
Peltier R. et al., 2007. évaluation du stock de carbone et de la productivité en bois d’un parc à karité du Nord-Cameroun. Bois For. Trop., 294(4), 40-50.
Picard N., Saint André L. & Henry M., 2012. Manuel de construction d'équations allométriques pour l'estimation du volume et la biomasse des arbres : de la mesure de terrain à la prédiction. Rome : FAO ; Montpellier, France : Cirad.
Poeplau C., Vos C. & Don A., 2017. Soil organic carbon stocks are systematically overestimated by misuse of the parameters bulk density and rock fragment content. Soil, 3, 61-66, doi.org/10.5194/soil-3-61-2017
R Core Team, 2018. R: A language and environment for statistical computing. Vienna: R Foundation for Statistical Computing, https://www.R-project.org/
Ramstein C. et al., 2019. State and trends of carbon pricing 2019. Washington, DC: The World Bank.
Razafimbelo T.M. et al., 2018. Impact de l’agriculture climato-intelligente sur les stocks de carbone organique du sol à Madagascar. Cah. Agric., 27, 35001, doi.org/10.1051/cagri/2018017
Saïdou A. et al., 2012. Évaluation du stock de carbone dans les systèmes agroforestiers à karité (Vitellaria paradoxa CF Gaertn.) et à néré (Parkia biglobosa Jacq. G. Don) en zone soudanienne du Bénin. Bull. Rech. Agron. Bénin, N.S. Agric. For., 11, 1025-2325.
Scholte P. et al., 2018. A central African perspective on delegated protected area management. Trop. Conserv. Sci., 11, 1940082918796621, doi.org/10.1177/1940082918796621
Sonwa D.J., Eyohob N.S. & Nkongmeneckc B.A., 2010. Carbon and agroforestry in Cameroon/Stockage de carbone dans les agroforêts cacao au Cameroun et perspectives pour l’Afrique Centrale. In: Proceeding of the conference Monitoring forest carbon stocks and fluxes in the Congo Basin, 2-4 February 2010, Conference Centre, Brazzaville, Republic of Congo, 72-75.
Takimoto A., Nair P.R. & Nair V.D., 2008. Carbon stock and sequestration potential of traditional and improved agroforestry systems in the West African Sahel. Agric. Ecosyst. Environ., 125, 159-166, doi.org/10.1016/j.agee.2007.12.010
Takimoto A., Nair V.D. & Nair P.R., 2009. Contribution of trees to soil carbon sequestration under agroforestry systems in the West African Sahel. Agrofor. Syst., 76, 11-25, doi.org/10.1007/s10457-008-9179-5
Temgoua L.F., Dongmo W., Nguimdo V. & Nguena C., 2018. Diversité ligneuse et stock de carbone des systèmes agroforestiers à base de cacaoyers à l’Est Cameroun : cas de la forêt d’enseignement et de recherche de l’Université de Dschang. J. Appl.Biosci., 122, 12269-12281, doi.org/10.4314/jab.v122i1.7
Walkey A. & Black T., 1934. An examination of the Dugtijaraff method for determining soil organic matter and proposed modification of the chronic and titration method. Soil Sci., 37, 23-38, doi.org/10.1097/00010694-193401000-00003
Williams T.O. et al., 2015. L’agriculture intelligente face au climat dans le contexte africain. Abidjan : Banque Africaine de Développement.
World Wide Fund for Nature, 2007. Étude socio-économique de l’UTO de Bouba Ndjida. Réa Banque Africaine de Développement lisée par le Groupe d'Initiave Economique (GIE) Territoire et Développement (TERDEL). Garoua: WWF.
Zanne A.E. et al., 2009. Global wood density database. Dryad, http://hdl.handle.net/10255/dryad.235
Zapfack L., 2005. Impact de l’agriculture itinérante sur brûlis sur la biodiversité végétale et la séquestration du carbone. Thèse d’État : Universite de Yaounde I (Cameroun).
Zapfack L. et al., 2016. Correlation between associated trees, cocoa trees and carbon stocks potential in cocoa agroforests of Southern Cameroon. Sustainability Environ., 1, 71-84, doi.org/10.22158/se.v1n2p71
Voetnoten
1 Liu S. et al., 2004. Impacts of land use and climate change on carbon dynamics in south-central Senegal. J. Arid Environ., 59, 583-604, doi.org/10.1016/j.jaridenv.2004.03.023.






