- Portada
- Volume 27 (2023)
- Numéro 3 : Colloque Agroforesterie en Afrique de l...
- Fluctuation des populations et évaluation des dégâts des mouches de fruits (Diptera : Tephritidae) dans les parcs à karité de l’Ouest du Burkina Faso : cas du transect Koumbia-Dano
Vista(s): 0 (0 ULiège)
Descargar(s): 0 (0 ULiège)
Fluctuation des populations et évaluation des dégâts des mouches de fruits (Diptera : Tephritidae) dans les parcs à karité de l’Ouest du Burkina Faso : cas du transect Koumbia-Dano

Documento adjunto(s)
Version PDF originaleRésumé
Description du sujet. La pulpe des fruits du karité est consommée par les communautés rurales, surtout en période de soudure. Cependant, les fruits du karité sont sujets aux attaques des mouches de fruits qui compromettent l’utilisation de la pulpe.
Objectifs. Suivre la fluctuation des populations de mouches de fruits, établir la diversité spécifique des mouches de fruits et évaluer l’importance des dégâts occasionnés sur les fruits du karité.
Méthode. Un système de piégeage constitué de pièges de type Tephri trap ayant fonctionné avec des attractifs sexuels a été installé dans les parcs à karité. Un échantillonnage des fruits de karité à maturité physiologique et/ou commerciale a été effectué toutes les deux semaines et incubé au laboratoire.
Résultats. Six espèces de mouches de fruits ont été capturées avec une prédominance de Bactrocera dorsalis Hendel (42,21 % des captures) et de Ceratitis silvestrii Bezzi (40,55 % des captures). Deux espèces de mouches de fruits, Ceratitis silvestrii et Ceratitis quinaria Bezzi et deux espèces de parasitoïdes, Psytallia concolor Szépligeti et Fopius caudatus Szépligeti, ont émergé des fruits incubés. Les indices de dégâts (50 à 57,77 % en fonction des sites) et les taux d’infestation (83,70 à 953,84 adultes·kg-1 de fruits) les plus élevés ont été enregistrés en pleine saison de production fruitière du karité au mois de juin.
Conclusions. Les parasitoïdes identifiés pourront être utilisés dans l’élaboration de méthodes de gestion agro-écologique de ces ravageurs dans les parcs agroforestiers.
Abstract
Population fluctuations and evaluation of fruit fly damage on shea fruits in parklands in Western Burkina Faso: Case of the Koumbia-Dano transect
Description of the subject. Shea fruit pulp is consumed by rural communities, especially during times of food shortage. However, shea fruits are infested with fruit flies that affect the pulp quality.
Objectives. This study was conducted during the shea fruiting period in shea parklands to establish fruit fly species diversity and assess the extent of their damage on shea fruits in the study area.
Method. A trapping system consisting of Tephri trap types and sexual attractants was installed in shea parklands. In addition, shea fruits were sampled on a 2-week basis and incubated for insect emergence.
Results. Among the six fruit fly species identified, Bactrocera dorsalis Hendel and Ceratitis silvestrii Bezzi were the most abundant, with 42.21 and 40.55% of adults captured, respectively. Ceratitis silvestrii and C. quinaria Bezzi were associated with the damage observed on shea fruits. Two wasp parasitoid species emerged, including Psytallia concolor Szépligeti and Fopius caudatus Szépligeti. Damage indices and infestation rates varied depending on the sampling period. The highest were recorded in the middle of the shea fruit production season in mid to late June, where damage indices ranged from 50 to 57.77% and infestation rates from 83.70 to 953.84 adults·kg-1 fruit according to the study sites.
Conclusions. The management of parasitoids and their habitats would provide opportunities for the development of sustainable agroecological control methods against these insect pests.
Tabla de contenidos
Reçu le 9 mai 2022, accepté le 16 janvier 2023, mis en ligne le 14 mars 2023.
Cet article est distribué suivant les termes et les conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr)
1. Introduction
1Les produits forestiers non ligneux jouent un rôle prépondérant dans le développement socio-économique des communautés rurales. Parmi les fruits issus des formations naturelles, les fruits du karité contribuent à la formation de 16 à 27 % du revenu des femmes rurales (Lamien & Vognan, 1999). Le karité (Vitellaria paradoxa C.F. Gaertn.) est l’espèce ligneuse la plus importante des systèmes agroforestiers dans la zone soudano-sahélienne de savane (Allal, 2010). Au Burkina Faso, les peuplements de karité sont estimés à environ 190 millions d’arbres, avec une densité moyenne nationale de 30 pieds par hectare (Bonkoungou, 1987). Le fruit du karité est formé d’un épicarpe fin et d’un mésocarpe mou qui constituent la pulpe, très sucrée et nutritive à maturité (Maranz et al., 2004). La pulpe entoure une graine brune ovale riche en huile relativement grande, appelée noix de karité, à partir de laquelle le beurre de karité est extrait (Moore, 2008 ; Mohammed et al., 2013). Le beurre issu de l’amande constitue l’une des principales sources de matière grasse d’origine végétale dans les zones de distribution du karité. La commercialisation des amandes et du beurre est la première source de revenu des femmes en milieu rural dans la zone soudano-sahélienne (Badini et al., 2011). En plus de l’amande et du beurre, la pulpe des fruits du karité constitue un apport nutritif stratégique pour les communautés locales en période de soudure (Sallé et al., 1991). Des études ont montré que sa pulpe contient une quantité importante d’éléments nutritifs tels que les glucides, les protéines, les fibres, les sels minéraux et les vitamines (Maranz et al., 2004 ; Mbaiguinam et al., 2007 ; Ugese et al., 2008 ; Kougblenou et al., 2012). En 2011, la contribution de la filière karité a été évaluée à 30 milliards de FCFA (~ 46 millions €), soit de l’ordre de 0,60 % de la valeur du PIB courant du Burkina Faso (Ouedraogo, 2015). En plus de son rôle alimentaire, la pulpe des fruits du karité présente un énorme potentiel pour la production de bioéthanol (Iddrisu et al., 2020). Au vu de son intérêt socio-économique, plusieurs projets et programmes de développement s’intéressent aux potentialités de la filière karité. C’est dans ce cadre que le projet RAMSES II dont l’objectif principal est « d’évaluer où et comment l’intensification écologique des productions agroforestières, vivrières, ligneuses et forestières non ligneuses peuvent contribuer à travers la domestication et la densification des arbres, à réduire la vulnérabilité des petits producteurs face au changement climatique », intervient au Sénégal et au Burkina Faso. Au Burkina Faso, le Workpackage 2 du projet s’intéresse aux services écosystémiques fournis par les parcs à karité sur le transect Koumbia-Dano et leur impact sur le rendement des cultures. Afin d’apprécier la contribution du karité à la sécurité alimentaire, au bien-être et à l’économie des communautés, des ménages et des individus, plusieurs investigations ont été réalisées sur le transect Koumbia-Dano sur :
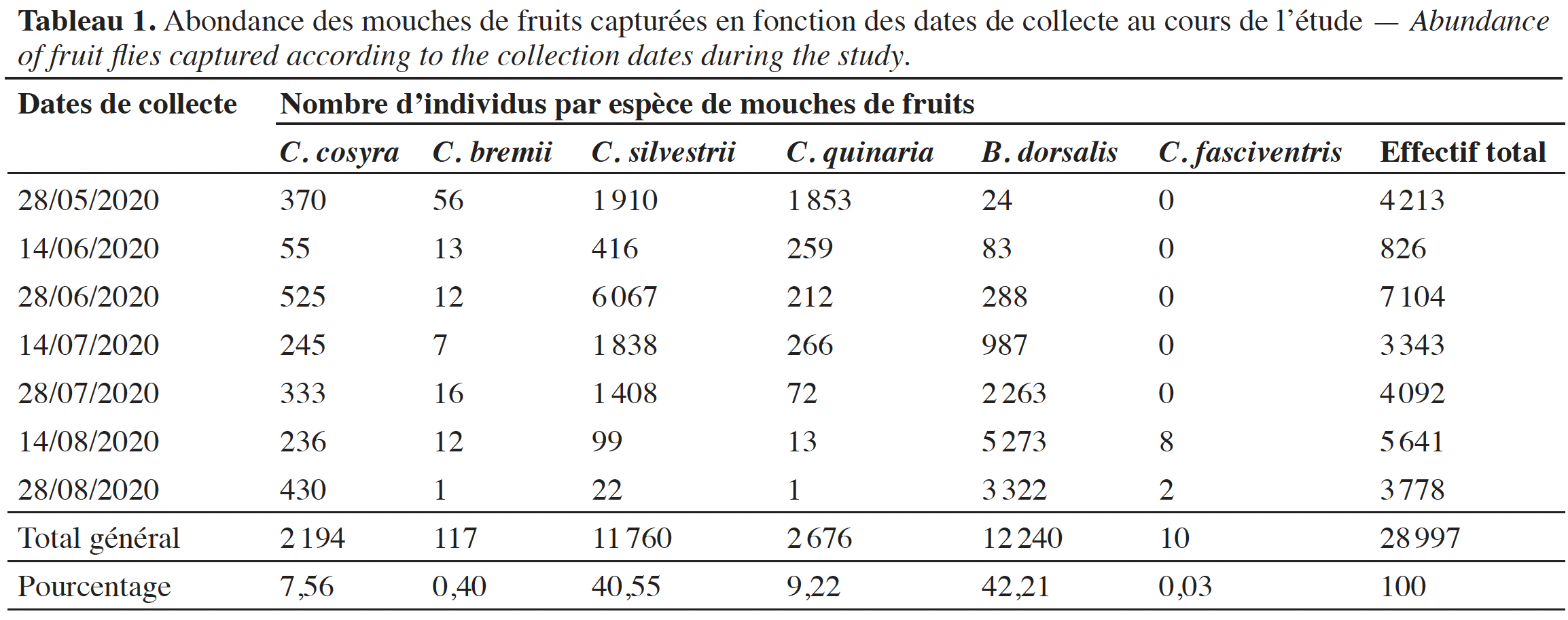
2– l’impact des arbres de karité sur le rendement des cultures annuelles dans les parcs ;
3– les insectes comestibles associés au karité, notamment les chenilles (Cirina butyrospermi) ;
4– l’évaluation de la production fruitière des arbres de karité.
5La présente étude intervient à ce niveau pour évaluer l’impact des insectes phytophages sur la quantité et la qualité des fruits produits par les arbres de karité. En effet, plusieurs types d’insectes s’attaquent au karité tant au niveau de son appareil végétatif que reproducteur et sont susceptibles d’affaiblir l’arbre et/ou de réduire sa production fruitière (Sallé et al., 1991). Parmi les ravageurs associés aux fruits du karité, les mouches de fruits de la famille des Tephritidae sont les plus importantes (Zida et al., 2020a). Les dégâts occasionnés par ces ravageurs sur les fruits du karité se sont aggravés suite à l’introduction accidentelle au Burkina Faso en 2005 de la mouche orientale des fruits Bactrocera dorsalis (Ouédraogo et al., 2010). En effet, à la récolte, beaucoup de fruits renferment des larves de mouches les rendant impropres à la consommation humaine (Zida et al., 2020a). Au Burkina Faso, les études sur les mouches de fruits ont été réalisées principalement dans les zones de forte production fruitière. Ainsi, Zida et al. (2020b) ont montré la présence de 24 espèces de mouches de fruits dans les parcs à karité dans la principale zone de production de la mangue. Dans cette même zone, Zida et al. (2020a) ont montré que sept espèces de mouches ont émergé des fruits du karité dont les plus dominantes étaient Bactrocera dorsalis et Ceratitis silvestrii. Cette étude est la première dans une zone où la production fruitière n’est pas développée. Elle a pour but de :
6– établir la diversité spécifique des mouches de fruits présentes sur les sites d’étude ;
7– évaluer les dégâts occasionnés par les mouches de fruits sur les fruits du karité ;
8– identifier les espèces de mouches de fruits responsables des dégâts observés.
9Ces informations constituent un préalable à l’élaboration de stratégies de lutte contre ces ravageurs d’importance économique.
2. Matériel et méthodes
2.1. Site de l'étude
10Cette étude a été conduite sur le transect Koumbia-Dano. Ce transect prend en compte deux régions administratives, à savoir celles des Hauts Bassins et du Sud-Ouest. Quatre villages situés sur ce transect ont constitué les sites d’étude. Dans chaque village, quatre parcs à karité ont été retenus pour la collecte des données. Ce sont les villages de Djuié et de Gombélédougou localisés dans la commune rurale de Koumbia dans la province du Tuy (Région des Hauts-Bassins) et les villages de Loffing et de Guéguéré localisés respectivement dans les communes de Dano et de Guéguéré dans la province du Ioba (Région du Sud-Ouest) (Figure 1).
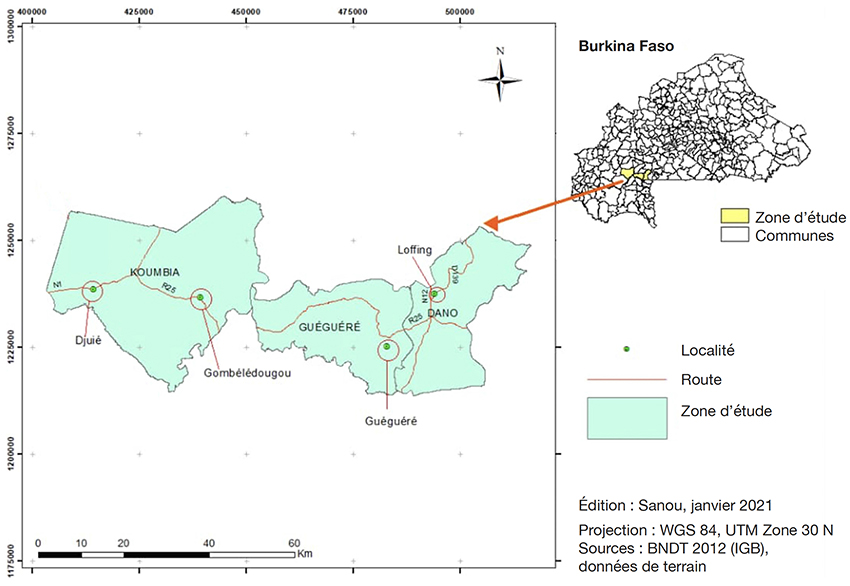 Figure 1. Localisation des sites d’étude sur le transect Koumbia-Dano — Localization of the study sites on the Koumbia-Dano transect.
Figure 1. Localisation des sites d’étude sur le transect Koumbia-Dano — Localization of the study sites on the Koumbia-Dano transect.
11La commune de Koumbia est située dans le domaine climatique soudanien. On y rencontre deux grandes saisons : une saison humide allant de 5 à 6 mois (mai à octobre/novembre) et une saison sèche qui s’étend sur 6 à 7 mois (octobre/novembre à avril). Quant aux communes de Dano et de Guéguéré, elles sont situées dans la zone sud-soudanienne avec une saison sèche qui dure 6 à 7 mois (octobre/novembre à avril). La figure 2 présente les pluviométries moyennes mensuelles enregistrées sur chaque site au cours de l’année 2020.
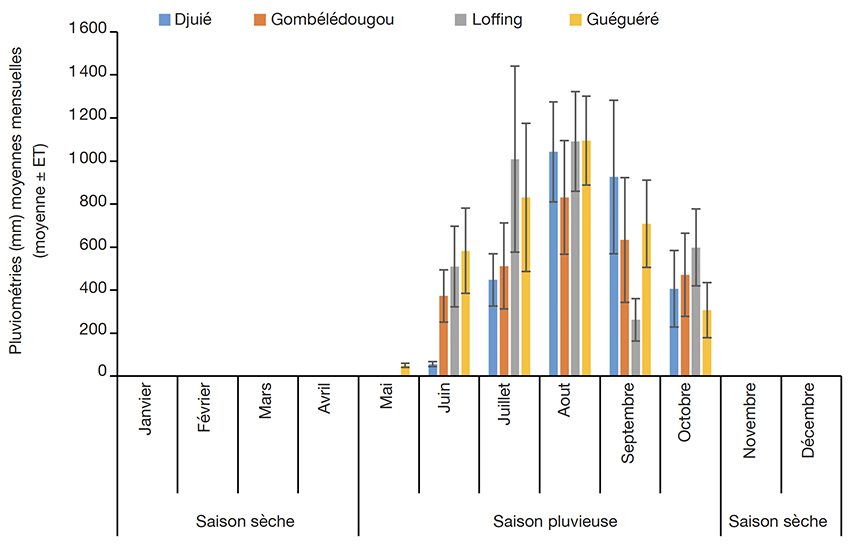 Figure 2. Pluviométries moyennes mensuelles enregistrées sur chaque site au cours de l’année 2020 — Average monthly rainfall in each study site during the year 2020.
Figure 2. Pluviométries moyennes mensuelles enregistrées sur chaque site au cours de l’année 2020 — Average monthly rainfall in each study site during the year 2020.
Source: Agence Nationale de la Météorologie, 2020.
2.2. Étude de la fluctuation des populations de mouches de fruits
12Pièges et attractifs utilisés. Les pièges de type Tephri trap (SORYGAR S.L., Madrid, España) ont été utilisés au cours de cette étude. C’est un récipient cylindrique de couleur jaune avec un couvercle opaque de couleur blanche ayant une capacité de 450 cm3. La partie supérieure et la base peuvent être séparées, permettant d’entretenir et d’appâter le piège. Il a cinq trous d’entrée des insectes dont un en bas et quatre latéralement en haut. La partie supérieure transparente avec une nacelle contraste avec le fond jaune. Cette couleur améliore la capacité du piège à attirer les mouches de fruits (Ekesi & Billah, 2006).
13Les attractifs utilisés sont des attractifs sexuels appelés paraphéromones. La composition chimique, la forme et la couleur de l’attractif sont variables. Les constituants des attractifs sont souvent en rapport avec l’espèce de mouche de fruits cible et son niveau de maturation sexuelle. Deux types de paraphéromones ont été utilisés dans la conduite de cette étude :
14– le méthyl eugénol ou 4-allylvératrole inclus dans un diffuseur de couleur verte. Il peut être décrit chimiquement comme le benzène (1,2 diméthoxy-4-(2-propényl) avec comme formule C11H14O2. C’est une substance naturelle qui se trouve dans 10 familles de plantes différentes (Ekesi & Billah, 2006). Il attire principalement les mâles de certaines espèces du genre Bactrocera (Bactrocera dorsalis, Bactrocera zonata) et des Cératites du sous-genre Pardalaspis (Ceratitis bremii, Ceratitis ditissima et Ceratitis punctata).
15– le terpinyl acétate ou 2-(4-Methyl-3-cyclohexenyl)-2-propyl acetate ou encore p-Menth-1-en-8-yl acetate (un ester retrouvé dans certaines huiles renfermant des esters aisément saponifiables) pour capturer les espèces de Tephritidae du genre Ceratitis. Le diffuseur est de couleur verte et de forme variable. Il est spécifique aux adultes mâles de C. cosyra et alliés.
16En plus des attractifs, un insecticide organophosphoré DDVP ou Dichlorvos (0,0-diméthyl-0-(2,2-dichloro) phosphate) a été utilisé pour tuer les insectes attirés dans les pièges. La concentration de sa matière active est de 30 % Dichlorvos.
17Dispositif de piégeage des mouches de fruits. Dans chaque parc agroforestier, huit pièges ont été accrochés aux arbres pendant la période de production fruitière du karité de fin mai à fin aout 2020. Chaque piège placé sur un pied des arbres échantillonnés est suspendu au tiers inférieur de la frondaison, à une distance moyenne de 2 m du centre de l’arbre. Le piège suspendu est relié à une branche perpendiculaire au tronc de l’arbre, par un fil métallique enduit de graisse solide au niveau du tiers supérieur afin de limiter l’activité prédatrice d’autres insectes sur le contenu du piège. Les pièges suspendus ont été placés dans une aire dégagée d’accès facile et à l’abri des rayons directs du soleil. Une distance de 30 m a été observée entre deux pièges contenant des paraphéromones différentes et 60 m entre deux pièges contenant la même paraphéromone.
18Méthodes de capture, de suivi et relevé des insectes capturés. Chaque piège contenait un attractif plus l’insecticide (DDVP). Le premier est déposé dans la nacelle en haut du piège de façon à optimiser la diffusion de l’attractif et le second est placé au fond du piège. Tout insecte pénétrant par les trous est tué par les gaz toxiques de l’insecticide. Dans chaque parc à karité, quatre pièges ont fonctionné au méthyl eugénol pour suivre les fluctuations des populations mâles de l’espèce invasive B. dorsalis et quatre au terpinyl acétate pour suivre les populations mâles des espèces du genre Ceratitis. Ce dispositif a été suivi avec un relevé des pièges toutes les deux semaines pour collecter les insectes capturés. Les paraphéromones et l’insecticide ont été renouvelés chaque mois. Les insectes capturés ont été récupérés dans des piluliers étiquetés. De l’éthanol dilué à 70 % a été ensuite ajouté dans chaque pilulier contenant les insectes et ceux-ci ont été amenés au laboratoire pour identification et dénombrement.
2.3. Étude des dégâts des mouches sur les fruits du karité
19Échantillonnage et collecte des fruits de karité. Dans chaque parc, les fruits de karité à maturité physiologique et/ou commerciale ont été collectés de façon aléatoire selon une fréquence de deux semaines pendant la période de fructification du karité. Dix pieds de karité ont été retenus et marqués dans chaque parc pour l’échantillonnage des fruits. Sur chaque pied de karité, 10 fruits ont été prélevés de façon aléatoire à chaque date de collecte formant ainsi un échantillon de 100 fruits. Les échantillons ont été étiquetés puis conditionnés dans des sacs adaptés et transportés au laboratoire pour les procédures d’incubation.
20Incubation des fruits, collecte et mise en éclosion des pupes
21Les incubations des fruits ont été réalisées sous une serre ombragée à température ambiante à l’Institut de l’Environnement et de Recherches Agricoles (INERA), station de Farako-bâ. Chaque échantillon de 100 fruits a été réparti en trois lots égaux qui ont constitué les répétitions pour chaque date de collecte sur un même parc. Chaque lot a été pesé puis placé dans un pot en plastique (diamètre : 16 cm, hauteur : 15 cm) contenant du sable stérilisé. Chaque pot a été ensuite recouvert d’un tissu à maille fine permettant la circulation de l’air tout en empêchant les larves de 3è stade de s’échapper et l’entrée de prédateurs. Les procédures d’incubation, de collecte et de mise en émergence des pupes ont suivi le protocole de Zida et al. (2020a). Les insectes émergés ont été récupérés et maintenus en vie dans des cages d’élevage pour permettre le développement complet de leurs caractéristiques morphologiques. Ils ont ensuite été conservés dans des piluliers étiquetés contenant de l’alcool à 70 % pour identification.
2.4. Identification des insectes
22Les insectes capturés et émergés des fruits incubés ont été identifiés au Laboratoire d’Entomologie de l’INERA Farako-Bâ. L’identification a été réalisée au moyen d’une loupe binoculaire à l’aide des clés d’identification physique (White, 2006 ; De Meyer et al., 2016) et électronique (Virgilio et al., 2014).
2.5. Traitement et analyse des données
23Le nombre d’adultes de mouches de fruits a été compté par piège et par date de relevé sur chaque site d’étude. Cela a permis de calculer l’indice journalier de capture (IJC) ou flies per trap per day (FTD) et d’établir la diversité des mouches présentes dans les parcs à karité. L’indice de capture correspond au nombre d’adultes de mouches de fruits capturés par chaque piège en un jour.
24Pour l’étude des dégâts des mouches de fruits sur le karité, un comptage exhaustif du nombre de fruits attaqués, de pupes et d’adultes d’insectes émergés a été effectué sur chaque site et par date de collecte. Les paramètres mesurés étaient le taux d’attaques et le taux d’infestation des fruits du karité par les mouches. Le taux d’attaques (incidence des dégâts) désigne le nombre de fruits attaqués sur le nombre total de fruits incubés par date de collecte, tandis que le taux d’infestation des fruits correspond au nombre d’adultes de mouches de fruits émergés par unité de poids de fruits.
25Le traitement statistique des données a été réalisé avec le logiciel R version 3.6.2. Le test de Bartlett a été utilisé pour vérifier l’homogénéité des variances. Les variances n’étant pas homogènes, le test non paramétrique de Kruskal-Wallis a été utilisé. Les Generalized linear models (GLM) ont été utilisés pour tester l’effet des dates et des sites de collecte, ainsi que leur interaction sur les variables, indices de capture de B. dorsalis et C. silvestrii, les taux d’attaque et d’infestation des fruits du karité par les mouches.
3. Résultats
3.1. Fluctuation des populations des mouches de fruits
26Abondance et diversité spécifique des mouches de fruits. Au total, 28 997 adultes de Tephritidae ont été capturés durant toute la période de l’expérimentation. Six espèces de mouches de fruits appartenant à deux genres ont été identifiées. Ce sont respectivement Bactrocera dorsalis Hendel avec 42,21 % des adultes capturés, Ceratitis silvestrii Bezzi (40,55 %), C. quinaria Bezzi (9,22 %), C. cosyra Walker (7,56 %), C. bremii Guérin-Méneville et C. fasciventris Bezzi.
27Le tableau 1 présente l’abondance de chaque espèce au cours de la saison de production fruitière du karité. La période de fin juin a enregistré le nombre d’adultes de mouches de fruits le plus élevé (24,50 % des captures).
28Fluctuations des populations des mouches de fruits dans les différents sites d’étude. La densité des espèces de mouches de fruits capturées a connu des variations au cours de la période de production du karité (Figure 3). Les indices de capture (nombres moyens ± ET) des espèces du genre Ceratitis étaient plus importants au début de la campagne. C’est le cas de C. silvestrii qui a présenté un pic fin juin (242,33 ± 60,58). La population des espèces du genre Ceratitis va ensuite diminuer progressivement jusqu’au mois d’aout où ces espèces étaient quasi absentes dans les parcs à karité, à l’exception de l’espèce C. cosyra. Quant à l’espèce B. dorsalis, sa population était relativement faible durant les premières semaines de l’étude, soit de mai jusqu’à fin juin, avant de présenter un pic à la mi-aout. À la fin de l’étude, sa population est restée importante dans les parcs à karité.
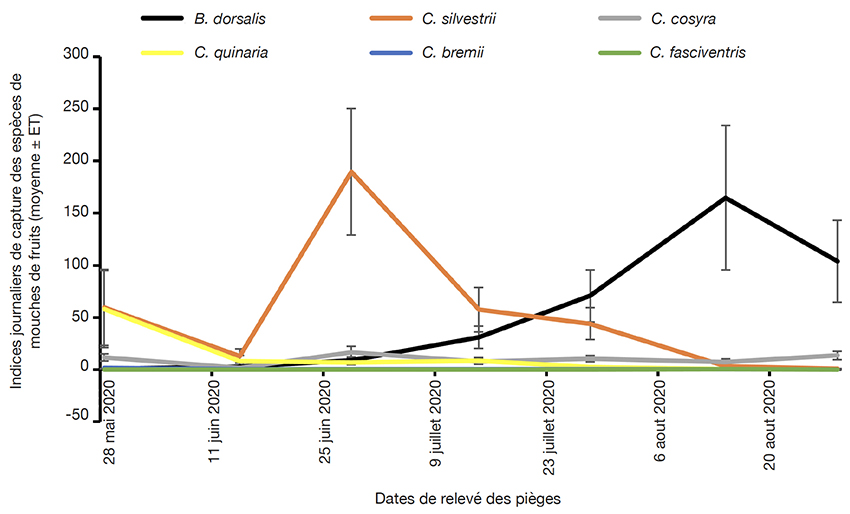 Figure 3. Fluctuation des populations des mouches des fruits au cours de la saison fruitière du karité 2020 — Fruit fly population fluctuations during the 2020 shea fruiting season.
Figure 3. Fluctuation des populations des mouches des fruits au cours de la saison fruitière du karité 2020 — Fruit fly population fluctuations during the 2020 shea fruiting season.
29Effets des différents facteurs sur les indices de capture des deux principales espèces. Les dates et sites de collecte ont influencé significativement la capture de B. dorsalis et de C. silvestrii (Tableau 2). En revanche, l’interaction de ces deux facteurs n’a pas eu un effet significatif sur les indices journaliers de capture de C. silvestrii.
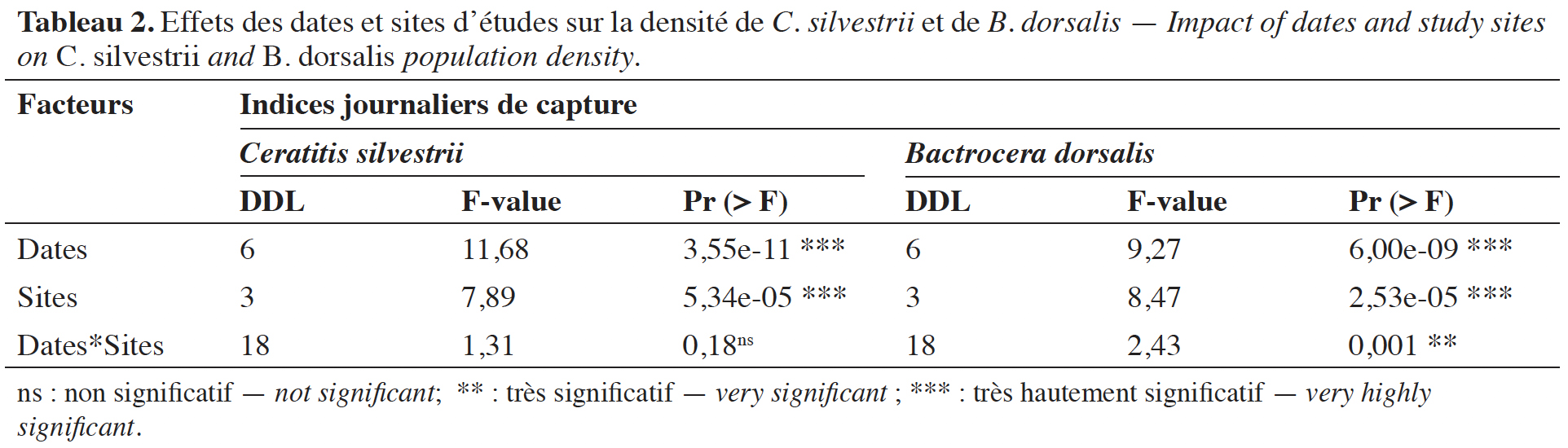
3.2. Importance des dégâts des mouches sur les fruits de karité
30Insectes émergés des incubations des fruits du karité. Un total de 1 260 fruits de karité correspondant à un poids de 29,19 kg a été collecté sur l’ensemble des quatre sites d’études et amené au laboratoire pour incubation. À l’issue des incubations, 3 828 adultes de mouches de fruits et 29 individus adultes d’hyménoptères parasitoïdes ont émergé des 5 642 pupes collectées. Les 3 828 adultes de mouches de fruits émergées appartenaient aux espèces C. silvestrii (94,90 %) et C. quinaria (5,10 %). Les individus adultes d’hyménoptères parasitoïdes appartenaient aux espèces Psytallia concolor Szépligeti (Braconidae, Opiinae) et Fopius caudatus Szépligeti (Braconidae, Opiinae). L’espèce P. concolor représentait 79,31 % des adultes parasitoïdes contre 20,67 % pour l’espèce F. caudatus.
31Taux d’attaque moyens des fruits de karité en fonction des sites et des dates de collecte. Les taux d’attaque moyens (moyennes ± ET) des fruits de karité par les mouches ont varié en fonction des dates de collecte et des sites d’étude (Tableau 3). Les GLM ont montré que les dates de collecte (DDL = 9 ; F = 26,50 ; P = 2,06e-11) ainsi que leur interaction avec les sites (DDL = 2 ; F = 3,75 ; P = 0,03) ont influencé significativement les taux d’attaque des fruits par les mouches. Par contre, les sites n’ont pas eu d’impact significatif (DDL = 2 ; F = 0,98 ; P = 0,38) sur les attaques des fruits par les mouches au cours de l’étude. Les taux d’attaque moyens les plus élevés ont été enregistrés à la mi-juin sur tous les sites. En général, sur tous les sites, les taux d’attaque étaient faibles au début et à la fin de la saison fruitière du karité (Tableau 3).
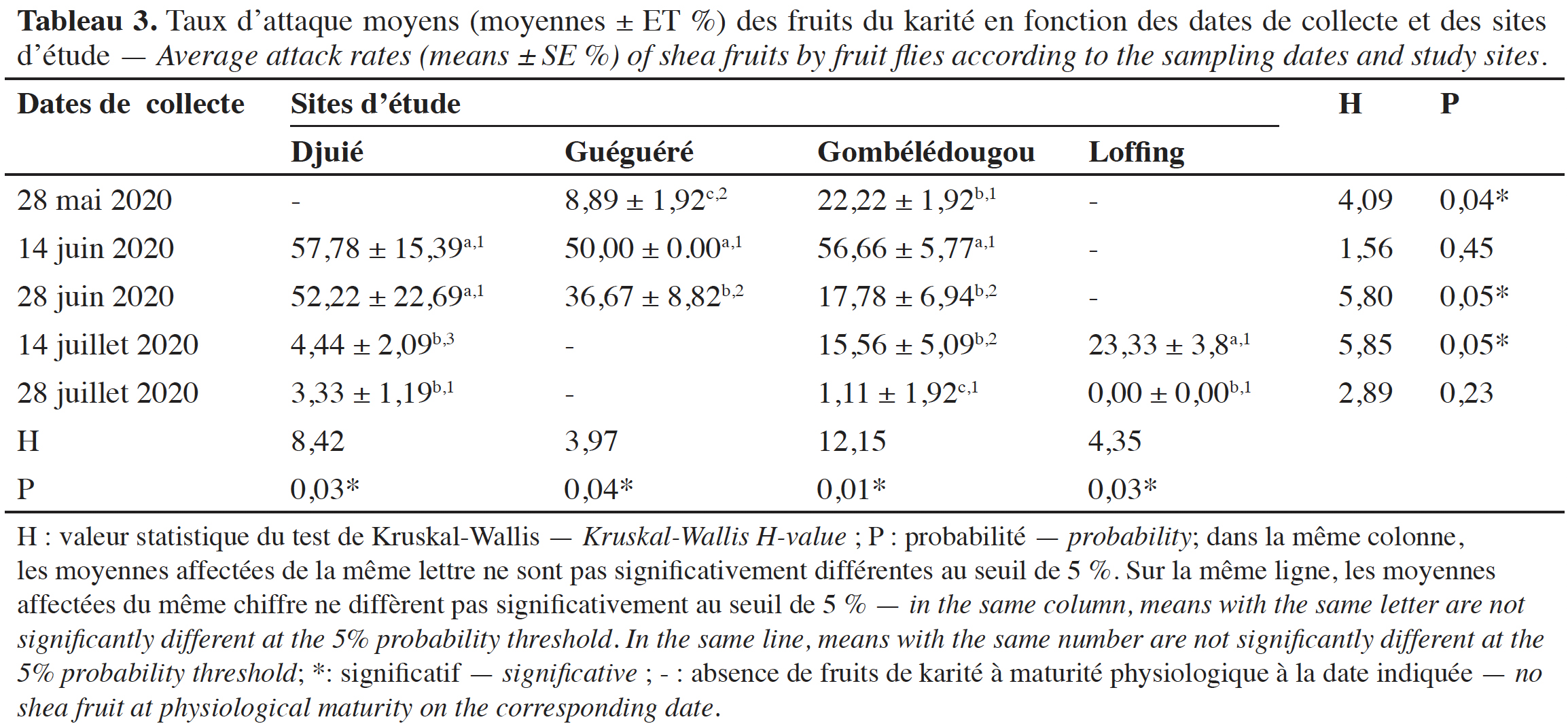
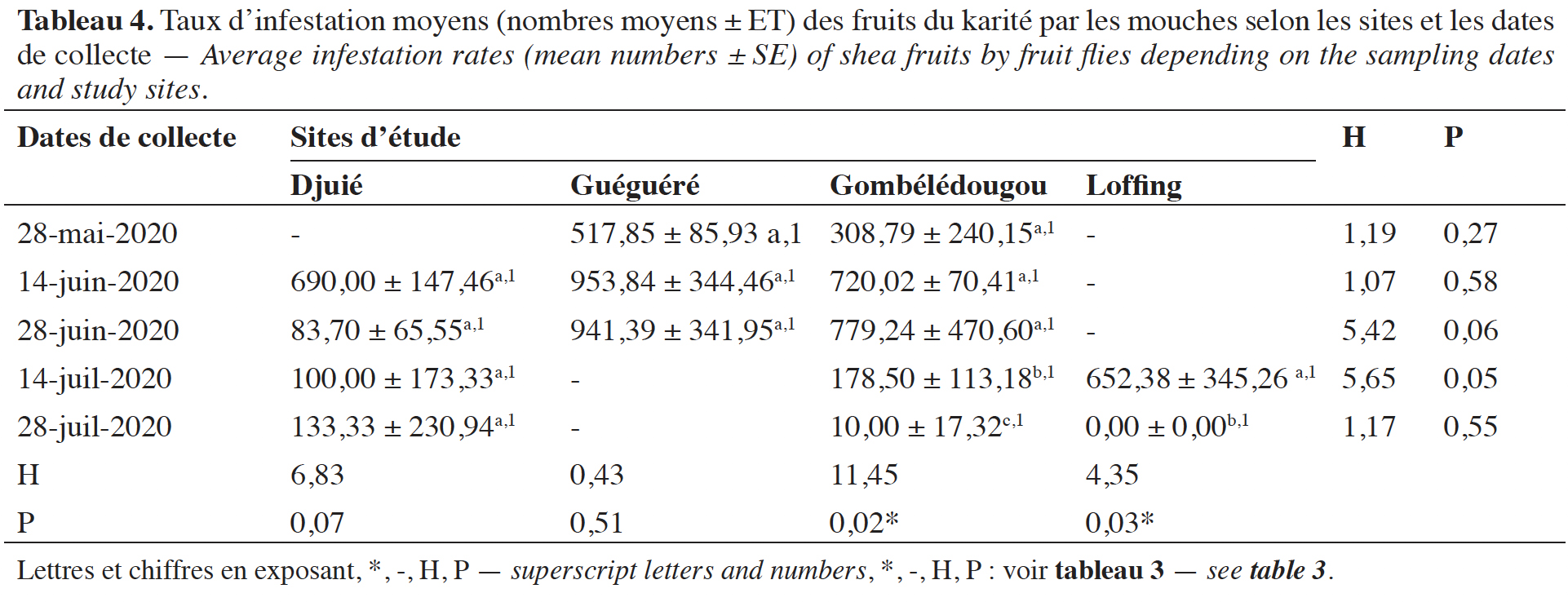
32Taux d’infestation des fruits de karité par les mouches. Les taux d’infestation moyens (nombre d’adultes de mouches par kilo de fruits) ont varié sur chaque site en fonction des dates de collecte (Tableau 4). Ainsi, les infestations des fruits du karité par les mouches étaient plus importantes au mois de juin. Les taux d’infestation des fruits ont été significativement influencés par les dates de collecte (DDL = 9 ; F = 8,90 ; P = 3,43e-06). Cependant, les sites (DDL = 2 ; F = 2,54 ; P = 0,09) ainsi que leur interaction avec les dates de collecte (DDL = 2 ; F = 1,63 ; P = 0,21) n’ont pas eu d’impact significatif sur le taux d’infestation des fruits par les mouches.
4. Discussion
33Six espèces de mouches de fruits ont été inventoriées lors de cette étude : une espèce exotique envahissante Bactrocera dorsalis et cinq espèces indigènes du genre Ceratitis (C. silvestrii, C. quinaria, C. cosyra, C. bremii et C. fasciventris). Toutes ont été déjà rencontrées dans les parcs à karité dans les principales provinces de production fruitière de l’Ouest du Burkina Faso par Zida et al. (2020b). En effet, ces auteurs ont identifié 24 espèces de mouches de fruits dans les parcs à karité des provinces du Houet, du Kénédougou et de la Comoé. L’abondance des espèces fruitières cultivées comme la mangue, la goyave et les Citrus qui constituent les plantes hôtes privilégiées des mouches de fruits dans ces provinces justifie la diversité des mouches de fruits.
34Bactrocera dorsalis était l’espèce dominante dans les captures. La prédominance de cette espèce de mouches de fruits dans les agrosystèmes a été mise en exergue au Bénin, au Togo, en Côte d’Ivoire, dans l’archipel des Comores, en Tanzanie et au Burkina Faso (Mwatawala et al., 2006, 2009 ; N’dépo et al., 2010 ; Gomina, 2015 ; Vayssières et al., 2015 ; Mze Hassani et al., 2016 ; Gnanvossou et al., 2017 ; Zida et al., 2020b). Ses populations étaient abondantes sur tous les sites d’étude pendant la saison des pluies avec un pic observé à la mi-aout. En effet, des études ont montré qu’il existe une corrélation positive et significative entre la pluviométrie, l’humidité relative et l’abondance des populations de cette espèce invasive de mouches de fruits (Mwatawala et al., 2009 ; Gnanvossou et al., 2017 ; Bota et al., 2018 ; Zida et al., 2020b). Selon Bateman (1972), les précipitations stimulent l’émergence de larves de mouches de fruits et entrainent une augmentation du taux d’émergence d’adultes chez les Tephritidae. Malgré sa prédominance dans les pièges, B. dorsalis n’était pas associée aux dégâts des mouches observés sur les fruits du karité. Cependant, Zida et al. (2020a) ont montré que cette espèce était responsable de plus de 54 % des dégâts observés sur les fruits du karité. En effet, leur zone d’étude couvre le bassin fruitier du pays. Or, les fruitiers cultivés, notamment le manguier (Mangifera indica L.), constituent les hôtes de prédilection de cette espèce exotique et invasive (Ekesi & Billah, 2006 ; Vayssières et al., 2009 ; Badii et al., 2014 ; Gomina, 2015 ; Zida et al., 2020c). Donc en période hors mangues ou de forte pullulation, les femelles de cette espèce pourraient avoir recours à d’autres fruitiers, notamment natifs, comme le karité, présents aux alentours des vergers pour l’oviposition. Aussi, Aluja & Mangan (2008) soutiennent que la présence d’une espèce de mouche dans un écosystème ne signifie pas forcément qu’elle attaque ses fruits. Par exemple, Manrakhan et al. (2020) ont montré que malgré la pullulation des populations de C. quinaria dans les vergers de Citrus en Afrique du Sud, cette espèce n’était pas associée aux dégâts observés sur les fruits des Citrus spp.
35Ceratitis silvestrii était l’espèce indigène la plus abondante dans les parcs agroforestiers du transect Koumbia-Dano et était associée à plus de 90 % des dégâts observés au cours de l’étude. Zida et al. (2019) ont montré que cette espèce était la principale mouche de fruits émergée des fruits de karité collectés dans les parcs à karité de Diabo et de Arbolé. Dans les parcs des provinces du Houet, du Kénédougou et de la Comoé, C. silvestrii était la principale espèce indigène de mouche associée aux dégâts observés sur les fruits du karité avec 54,71 % des émergences (Zida et al., 2020a). Pour ce qui est de sa prédominance dans les captures, Zida et al. (2020b) ont montré que la mouche de la mangue, Ceratitis cosyra, était plus abondante que C. silvestrii dans les parcs à karité des provinces du Houet, de la Comoé et du Kénédougou. Ce résultat pourrait s’expliquer par l’abondance des vergers de manguiers dans cette zone comparativement au transect Koumbia-Dano où on ne rencontre que des pieds de variétés locales de manguiers qui sont faiblement attaquées par les mouches des fruits. Ceci souligne le rôle primordial des plantes hôtes dans la distribution des mouches de fruits.
36Les populations des espèces du genre Ceratitis étaient plus abondantes dès le début de l’étude. En effet, Vayssières et al. (2005) ont souligné que les populations des espèces du genre Ceratitis sont très abondantes pendant la saison sèche et diminuent avec les premières pluies. Le pic des populations de C. silvestrii observé fin juin pourrait s’expliquer par la disponibilité de fruits matures du karité sur les sites d’étude. En effet, Zida et al. (2020b) ont montré que C. silvestrii, principale espèce indigène rencontrée au cours de cette étude, présentait un pic mi-juillet avant de disparaitre dans les formations végétales, y compris les parcs à karité à partir du mois d’aout.
37Les deux espèces de mouches émergées des fruits du karité, à savoir C. silvestrii et C. quinaria, dans nos sites d’étude, ont déjà été rencontrées dans les fruits de karité au cours des études antérieures menées à l’Ouest et au Centre du Burkina Faso (Ouédraogo et al., 2010 ; Zida et al., 2019 ; Zida et al., 2020a). Cependant, en plus de ces espèces, ces auteurs avaient montré la présence de plusieurs autres espèces de mouches de fruits, notamment l’espèce exotique et invasive B. dorsalis et d’autres espèces indigènes comme C. cosyra, C. ditissima, C. capitata et C. fasciventris associées aux fruits du karité dans leurs sites d’étude. Ceci pourrait s’expliquer par le fait que nos sites d’étude ne sont pas des sites de forte production fruitière à l’image des provinces de la Comoé, du Kénédougou et du Houet où il y aurait plus de plantes hôtes abritant ainsi plus d’espèces de mouches de fruits.
38Les taux moyens d’attaque et d’infestation ont varié significativement en fonction des dates, et les plus élevés ont été enregistrés en juin. D’autres études ont déjà montré des variations temporelles des taux d’attaques et du degré d’infestation des fruits. En effet, Sarwar et al. (2014) ont rapporté que le pourcentage de fruits piqués de l’olive par Bactrocera olae était significativement différent d’un mois à l’autre au cours de l’année. Aussi, Yokoyama (2015) a indiqué que la date d’infestation maximale des fruits peut varier chaque année en raison des différences de nouaison, de taille des fruits et des conditions météorologiques. Au cours de cette étude, c’est au mois de juin que la majorité des pieds de karité portaient plus de fruits murs qui constituent une ressource nutritive pour les larves des mouches de fruits. L’abondance de la ressource nutritive étant un critère de choix de ponte, ceci expliquerait la forte pullulation des mouches et l’incidence de dégâts plus élevés en cette période. Nos résultats corroborent aussi ceux de Zida et al. (2020a) qui ont rapporté que le taux d’infestation des fruits du karité par les mouches a atteint un pic mi-juin ou fin juin, selon l’année.
39Les deux espèces de parasitoïdes, Psytallia concolor et Fopius caudatus, identifiées au cours de la présente étude ont déjà été rencontrées dans les fruits du karité par Zida et al. (2021) à l’Ouest du Burkina Faso. En Afrique de l’Ouest, Vayssières et al. (2011) et Badii et al. (2016) avaient aussi rencontré des parasitoïdes des mouches de fruits dans les fruits du karité, respectivement au Bénin et au Ghana. En plus de P. concolor et F. caudatus, Zida et al. (2021) avaient identifié quatre autres espèces de parasitoïdes de mouches de fruits associées aux fruits du karité. En effet, Zida et al. (2020a) ont montré que les fruits du karité sont attaqués par sept espèces de mouches de fruits à l’Ouest du Burkina Faso. La diversité de parasitoïdes observée dans leur étude est donc liée à la diversité de mouches de fruits associée aux fruits du karité sur leurs sites d’étude.
5. Conclusions
40Cette étude a permis d’établir la diversité spécifique des mouches de fruits dans les parcs à karité du transect Koumbia-Dano. Les dégâts occasionnés par les mouches varient en fonction de la période de production fruitière et sont causés par deux espèces de mouches de fruits. Des ennemis naturels des mouches de fruits, en l’occurrence des parasitoïdes, ont été identifiés dans la zone de l’étude. L’élevage de ces ennemis naturels au laboratoire suivi de lâchers augmentatifs en milieu naturel pourrait contribuer à promouvoir la lutte biologique par augmentation. Aussi, la formation des jeunes et des femmes impliqués dans le ramassage et la commercialisation des fruits frais au champ sur la gestion des fruits infestés par l’utilisation des augmentoria pourrait contribuer à augmenter les populations de parasitoïdes tout en limitant les foyers de réinfestation. Cette technique constitue une méthode agro-écologique de gestion de ces ravageurs.
Remerciements
41Ce travail a bénéficié du support financier de UE Eranet LEAP Agri-215 project Roles of Agroforestry in sustainable intensification of small farMs and food SEcurity for SocIetIes in West Africa (RAMSES II), https://www.ramsesiiagroforesterie.com/
Bibliographie
Allal F., 2010. Patrons de variabilité chez Vitellaria paradoxa (karité) : étude phylogéographique et analyse combinée de la variation des acides gras, des tocophérols et de gènes candidats. Thèse de doctorat : Université de Montpellier 2 (France).
Aluja M. & Mangan R.L., 2008. Fruit fly (Diptera: Tephritidae) host status determination: critical conceptual, methodological, and regulatory considerations. Annu. Rev. Entomol., 53, 473-502, doi.org/10.1146/annurev.ento.53.103106.093350
Badii K.B., Billah M.K., Afreh-Nuamah K. & Obeng-Ofori D., 2014. Seasonal phenology of Bactrocera invadens (Drew, Tsuruta and White) and Ceratitis cosyra (Walker) (Diptera: Tephritidae) in Northern Ghana. Biosci. Methods, 5(3), 1-11, doi.org/10.5376/bm.2014.05.0003
Badii K.B. et al., 2016. Preliminary inventory of hymenopteran parasitoids associated with fruit-infesting flies (Diptera: Tephritidae) in Northern Ghana. Int. J. Pest Manage., 62, 267-275, doi.org/10.1080/09670874.2016.1174318
Badini Z., Kaboré M., Van Der Mheen-Sluijer J. & Vellema S., 2011. Le marché du karité et ses évolutions : quel positionnement pour le REKAF. Wageningen, The Netherlands : WUR.
Bateman M.A., 1972. The ecology of fruit flies. Annu. Rev. Entomol., 17, 493-518, doi.org/10.1146/annurev.en.17.010172.002425
BNDT, 2012. Base Nationale de Données Topographiques. Ouagadougou : Institut Géographique du Burkina.
Bonkoungou E.G., 1987. Monographie du karité, Butyrospermum paradoxum (Gaertn. F.) Hepper, espèce agroforestière à usages multiples. Ouagadougou : IRBET/CNRST.
Bota L.D. et al., 2018. Seasonal abundance of fruit flies (Diptera: Tephritidae) on mango orchard and its relation with biotic and abiotic factors in Manica Province, Mozambique. Fruits, 73, 218-227, doi.org/10.17660/th2018/73.4.3
De Meyer M., Mwatawala M., Copeland R.S. & Virgilio M., 2016. Description of new Ceratitis species (Diptera: Tephritidae) from Africa, or how morphological and DNA data are complementary in discovering unknown species and matching sexes. Eur. J. Taxon., 233, 1-23, doi.org/10.5852/ejt.2016.233
Ekesi S. & Billah M.K., 2006. A field guide to the management of economically important tephritid fruit flies in Africa. 2nd ed. Nairobi: ICIPE Science Press.
Gnanvossou D. et al., 2017. Diversity and seasonal abundance of tephritid fruit flies in three agro-ecosystems in Benin, West Africa. J. Appl. Entomol., 141, 798-809, doi.org/10.1111/jen.12429
Gomina M., 2015. Contribution à la connaissance des mouches des fruits (Diptera : Tephritidae) et de leurs parasitoïdes au sud du Togo. Thèse de doctorat : Université de Lomé (Togo).
Iddrisu A., Zakpaa H.D., Mills-Robertson F.C. & Lowor S.T., 2020. Vitellaria paradoxa fruit pulp bioethanol production potential: a review. Afr. J. Biochem. Res., 14(2), 33-45, doi.org/10.5897/AJBR2019.1070
Kougblenou N. et al., 2012. Caractérisation physique du fruit et valeur nutritionnelle de la pulpe de karité (Vitellaria paradoxa) collecté dans différents parcs au Bénin. Bull. Rech. Agron. Bénin, Numéro spécial Agriculture et Forêt, 42-49.
Lamien N. & Vognan G., 1999. Importance of Non-Wood Forest Products as source of rural women’s income in Western Burkina Faso. In: Pasternak D. & Shlissel A., eds. Combating desertification with plants. New York, NY, USA: Academic/Plenium Publishers, 69-79.
Manrakhan A. et al., 2020. A survey of Ceratitis quinaria (Bezzi) (Diptera: Tephritidae) in citrus production areas in South Africa. Afr. Entomol., 28(1), 35-43, doi.org/10.4001/003.028.0035
Maranz S., Wiesman Z., Bisgaard J. & Bianchi G., 2004. Nutritionnal values and indigenous preferences for shea fruits (Vitellaria paradoxa C.F. Gaertn.) in African agroforestry parklands. Econ. Bot., 58(4), 588-600, doi.org/10.1663/0013-0001(2004)058[0588:nvaipf]2.0.co;2
Mbaiguinam K., Mbayhoukdel K. & Djekota C., 2007. Physical and chemical characteristics of fruits, pulps, kernels and butter of shea, Butyrospermum parkii (Sapotaceae) from Mandoul, Southern Chad. Asian J. Biochem., 2, 101-110, doi.org/10.3923/ajb.2007.101.110
Mohammed S., Heijndermans E., Butter S. & Group P., 2013. Behind the butter: an energy analysis of shea butter processing. SNV Ghana.
Moore S., 2008. The role of Vitellaria paradoxa in poverty reduction and food security in the Upper East region of Ghana. Earth Environ., 3, 209-245.
Mwatawala M.W., De Meyer M., Makundi R.H. & Maerere A.P., 2006. Seasonality and host utilization of the invasive fruit fly, Bactrocera invadens (Diptera, Tephritidae) in Central Tanzania. J. Appl. Entomol., 130(9-10), 530-537, doi.org/10.1111/j.1439-0418.2006.01099.x
Mwatawala M.W., De Meyer M., Makundi R.H. & Maerere A.P., 2009. An overview of Bactrocera (Diptera: Tephritidae) invasions and their speculated dominancy over native fruit fly species in Tanzania. Bull. Entomol. Res., 99, 629-641, doi.org/10.1017/S0007485309006695
Mze Hassani I. et al., 2016. Invasion by Bactrocera dorsalis and niche partitioning among tephritid species in Comoros. Bull. Entomol. Res., 106, 749-758, doi.org/10.1017/S0007485316000456
N’dépo O.R. et al., 2010. Inventaire des mouches des fruits de trois régions agro-écologiques et des plantes hôtes associées à l’espèce nouvelle, Bactrocera invadens (Diptera : Tephritidae) en Côte d’Ivoire. Eur. J. Sci. Res., 46, 62-72.
Ouedraogo B., 2015. Étude sur la contribution des PFNL à l’économie nationale : cas de la filière fruit de l’arbre à karité. Ouagadougou : ACN Études et Conseils, doi10.13140/RG.2.1.3497.0969
Ouédraogo S.N., Vayssières J.-F., Dabiré R.A. & Rouland-Lefèvre C., 2010. Fruitiers locaux hôtes des mouches des fruits (Diptera: Tephritidae) inféodées au manguier dans l’Ouest du Burkina Faso : identification et taux d’infestation. Fruit Veg. Cereal Sci. Biotechnol., 4, 36-41.
R Development Core Team, 2019. R: A Language and Environment for Statistical Computing. Vienna: R Foundation for Statistical Computing.
Sallé G., Boussim I.J., Raynal-Roques A. & Brunck F., 1991. Le karité : une richesse potentielle. Perspectives de recherches pour améliorer sa production. Bois For. Tropiques, 228, 1-23.
Sarwar M., Hamed M., Yousaf M. & Hussain M., 2014. Monitoring of population density and fruit infestation intensity of tephritid fruit flies (Diptera: Tephritidae) in Citrus reticulata Blanco orchard. J. Zool. Sci., 2, 1-5.
Ugese F.D., Baiyeri K.P. & Mbah B.N., 2008. Nutritional composition of shea (Vitellaria paradoxa) fruit pulp across its major distribution zones in Nigeria. Fruits, 63, 163-169, doi.org/10.1051/fruits:2008006
Vayssières J.-F. et al., 2005. A new Bactrocera species in Benin among mango fruit fly (Diptera: Tephritidae) species. Fruits, 6, 371-377, doi.org/10.1051/fruits:2005042
Vayssières J.-F. et al., 2009. The mango tree in central and northern Benin: damage caused by fruit flies (Diptera:Tephritidae) and computation of economic injury level. Fruits, 64, 207-220, doi.org/10.1051/FRUITS/2009016
Vayssières J.-F., Wharton R., Adandonon A. & Sinzogan A., 2011. Preliminary inventory of parasitoids associated with fruit flies in mangoes, guavas, cashew pepper and wild fruit crops in Benin. BioControl, 56, 35-43, doi.org/10.1007/s10526-010-9313-y
Vayssières J.-F. et al., 2015. Seasonal abundance of mango fruit flies (Diptera: Tephritidae) and ecological implications for their management in mango and cashew orchards in Benin (Centre and North). J. Econ. Entomol., 108, 2213-2230, doi.org/10.1093/jee/tov143
Virgilio M., White I.M. & De Meyer M., 2014. A set of multi-entry identification keys to African frugivorous flies (Diptera: Tephritidae). ZooKeys, 428, 97-108, doi.org/10.3897/zookeys.428.7366
White I.M., 2006. Taxonomy of the Dacina (Diptera: Tephritidae) of Africa and the Middle East. Pretoria: Entomological Society of Southern Africa.
Yokoyama V.Y., 2015. Olive fruit fly (Diptera: Tephritidae) in California table olives. USA: invasion, distribution, and management implications. J. Integr. Pest Manage., 6(1), 14, doi.org/10.1093/jipm/pmv014
Zida I., Diallo B.O., Ouédraogo S.N. & Sanon A., 2019. Infestations de six ethno-variétés du karité par les mouches des fruits au Burkina Faso. Sci. Techn. Sci. Nat. Agron., 2, juillet-décembre 2019.
Zida I. et al., 2020a. Shea fruit-infesting fruit flies (Diptera: Tephritidae) and evaluation of infestation level according to the ethno-varieties in Western Burkina Faso. Int. J. Trop. Insect Sci., 40(3), 493-501, doi.org/10.1007/s42690-020-00097-9
Zida I., Nacro S., Dabiré R. & Somda I., 2020b. Seasonal abundance and diversity of fruit flies (Diptera: Tephritidae) in three types of plant formations in Western Burkina Faso, West Africa. Ann. Entomol. Soc. Am., 113(5), 343-354, doi.org/10.1093/aesa/saaa004
Zida I. et al., 2020c. Host range and species diversity of Tephritidae of three plant formations in Western Burkina Faso. Bull. Entomol. Res., 110(6), 732-742, doi.org/10.1017/S0007485320000243
Zida I. et al., 2021. Native hymenopteran parasitoids associated with fruit-infesting flies in three plant formations and prospects for biological control in Western Burkina Faso, West Africa. Agric. For. Entomol., 24(1), 114-123, doi.org/10.1111/afe.12476






