- Accueil
- Volume 28 (2024)
- Numéro 3
- Caractérisation morpho-physiologique in vitro d’accessions de manioc selon leur tolérance à la salinité
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Caractérisation morpho-physiologique in vitro d’accessions de manioc selon leur tolérance à la salinité

Document(s) associé(s)
Version PDF originaleRésumé
Description du sujet. Au Sénégal, les objectifs de production de tubercule de manioc sont d’année en année plus importants. Toutefois, la salinisation constitue une contrainte majeure à sa culture en raison des terres et des eaux d’irrigation affectées par le sel.
Objectifs. Cette étude se propose de contribuer à déterminer in vitro les effets du chlorure de sodium (NaCl) sur les paramètres morpho-physiologiques d’accessions de manioc afin d’identifier les plus tolérantes ainsi que leur seuil de sensibilité.
Méthode. Des explants de quinze accessions de manioc ont été cultivés in vitro en présence de différentes concentrations de NaCl (0 ; 1 ; 1,5 ; 2 ; 2,5 et 3 g·l-1). La taille des vitroplants régénérés, les poids frais et sec des parties aériennes et racinaires, l’aptitude à l’enracinement des explants et les teneurs des feuilles en chlorophylle a, b et totale ont été déterminés.
Résultats. Les résultats montrent que le NaCl réduit significativement la croissance des vitroplants et la biosynthèse des chlorophylles a, b et totale dans les feuilles des vitroplants. La partie aérienne des vitroplants s’est révélée être plus sensible aux effets dépressifs de la salinité que la partie racinaire. Deux seuils de sensibilité critique aux effets néfastes de la salinité ont été identifiés à 1,5 et 2 g·l-1 de NaCl respectivement pour les paramètres physiologiques et morphologiques. L’indice de salinité (IS) constitue un critère morphologique pertinent pour évaluer la tolérance à la salinité des vitroplants de manioc. Ces résultats ont permis de classer les différentes accessions en groupes tolérant, moyennement tolérant et sensible au NaCl.
Conclusions. Le microbouturage in vitro est une technique qui peut être adoptée pour un criblage rapide et à grande échelle de la tolérance à la salinité d’accessions de manioc. Les teneurs en chlorophylles biosynthétisées par les vitroplants peuvent être considérées comme des indicateurs biochimiques pertinents pour déterminer la sensibilité des vitroplants au sel (NaCl).
Abstract
In vitro morpho-physiological characterization of cassava accessions according to salinity tolerance
Description of the subject. In Senegal, manioc tuber production targets are increasing every year. However, salinization is a major constraint to its cultivation due to salt-affected land and irrigation water.
Objectives. The objective of this study was to evaluate in vitro the physiological and morphological response to salinity stress (NaCl) of cassava accessions in order to identify the most tolerant and their tolerance threshold.
Method. In vitro cultured explants were exposed to different concentrations of NaCl (0, 1, 1.5, 2, 2.5, and 3 g·l-1) to determine the most tolerant accessions and their tolerance threshold. The stress impact was measured by the height of vitroplants, the rooting ability of vitroplants, the fresh and dry biomass, and the leaves' chlorophyll content.
Results. The results showed that NaCl significantly reduced in vitro plant growth and biosynthesis of chlorophylls a, b and total in in vitro plant leaves. The leaves of the vitroplants were more sensitive to the depressive effects of salinity than the roots. Two critical sensitivity thresholds to the adverse effects of salinity were identified at 1.5 and 2 g·l-1 NaCl for physiological and morphological parameters, respectively. The salinity index (SI) is a relevant morphological criterion for assessing the salinity tolerance of cassava vitroplants. The method used can be adopted for rapid, large-scale screening of cassava varieties and/or accessions for salinity tolerance.
Conclusions. In vitro micropropagation is a technique that can be adopted for rapid, large-scale screening of cassava accessions for salinity tolerance. The levels of chlorophylls biosynthesized by in vitro plants can be considered as relevant biochemical indicators for determining the sensitivity of in vitro plants to salt (NaCl).
Table des matières
Reçu le 19 juillet 2023, accepté le 27 juin 2024, mis en ligne le 27 juin 2024.
Cet article est distribué suivant les termes et les conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr)
1. Introduction
1À l’échelle mondiale, 833 millions d’hectares sont affectés par la salinité, ce qui représente 8,7 % des terres à l’échelle de la planète (FAO, 2021). Cette dégradation des terres augmente chaque année, à raison de deux millions d’hectare par an, réduisant ainsi les superficies cultivables (Singh, 2018 ; Escudier et al., 2019). Dans les zones arides et semi-arides, la salinisation des terres réduit les productions agricoles de 18 à 43 % (Chang et al., 2019). Au Sénégal, selon l’Institut National de Pédologie (INP), plus d’un million d’hectares sont affectés par ce phénomène (CSE, 2010). La salinisation des sols touche pratiquement toute la zone côtière, particulièrement les bassins des fleuves Casamance, Gambie, Sine Saloum et le Delta du fleuve Sénégal. Elle serait due, en partie, à l’intrusion de l’eau de mer dans les terres (Tamba & Faye, 2015 ; Fall, 2017), engendrant une baisse de la productivité, la pauvreté et l’abandon des terres cultivables par les populations (PROMASC, 2012 ; Sylla et al., 2023).
2La salinité provoque des changements néfastes dans les processus physiologiques, biochimiques et moléculaires des plantes, entrainant la suppression de la germination des graines, une perturbation de la croissance et du développement, une sénescence prématurée, une inhibition de la photosynthèse et de la respiration, un déséquilibre hydrique, un stress oxydatif, des dommages au niveau de l'ADN, des anomalies dans les structures cellulaires, etc. (Machado & Serralheiro, 2017). Au Sénégal, les pertes économiques liées à la salinité des terres sont estimées à environ 22 millions de dollars américains par an (Sow et al., 2016).
3Dans ce pays, la culture du manioc connait un engouement réel de la part des producteurs depuis le programme spécial manioc initié en 2004 avec l’utilisation des cultivars locaux mais également l’introduction en milieu paysan de variétés exotiques. Depuis lors, les surfaces emblavées pour la culture de l’espèce ne cessent d’augmenter dans toutes les régions du pays afin d’atteindre l’objectif de production de 1 000 000 tonnes par an (SCA, 2013). Selon DAPSA (2017), la superficie de manioc est passée de 20 800 ha à 30 800 ha de 2013 à 2015, avec une production moyenne d’environ 8 t·ha-1. Cependant, la production de manioc est encore caractérisée par de faibles rendements (7,5 t·ha-1) dus à un certain nombre de contraintes abiotiques telles que la salinisation des terres. L’expansion de cette culture à travers le pays et le maintien de hauts rendements de production exigent la sélection de matériel végétal tolérant au sel pour les zones de culture affectées par la salinité de l’eau et/ou du sol (Carretero et al., 2007 ; Shabala, 2013 ; Gleadow et al., 2016). Toutefois, l’évaluation de la tolérance à la salinité d’un grand nombre de génotypes dans des essais conventionnels au champ prend du temps et reste difficile et couteux. Ainsi, l’utilisation des techniques de culture en conditions in vitro constitue un outil de diagnostic rapide pour la tolérance au stress salin.
4De nombreuses études in vitro sur la salinisation ont été menées au Sénégal. La plupart d’entre elles ont accordé plus d’attention aux effets de la salinisation sur le développement de la tomate, du niébé et du riz (Thiam et al., 2013 ; Maïga et al., 2020 ; Sané et al., 2021). Les études sur la tolérance du manioc à la salinité restent très limitées. Ainsi, le but de cette étude est de développer une série de tests in vitro, en présence de NaCl, afin de déterminer le comportement de différentes accessions de manioc cultivées au Sénégal.
2. Matériel et méthodes
2.1. Matériel végétal
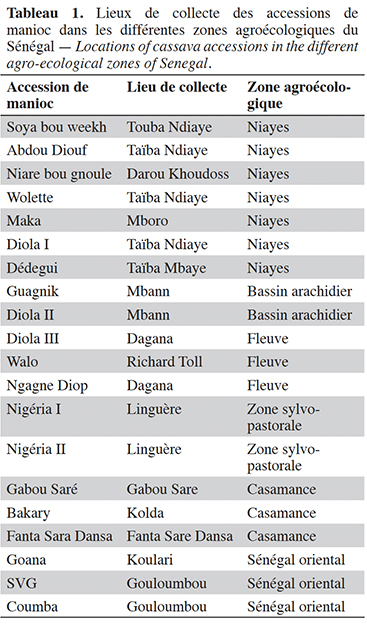
5Le matériel végétal étudié est constitué des accessions de manioc collectées dans les six zones agroécologiques du Sénégal où elles sont cultivées pour leurs adaptations et performances agronomiques (Tableau 1). Les différentes accessions de manioc ont été prélevées dans les champs de producteurs à partir d’individus vigoureux ne présentant aucun symptôme de maladie apparent.
2.2. Méthodes d’étude
6Multiplication in vitro. Pour éviter toute interaction des phytohormones sur le développement des explants élevés sous contrainte saline, les capacités intrinsèques des explants à régénérer des plants vigoureux ont été évaluées sur des milieux de culture dépourvus de régulateur de croissance (MS complet [Murashige et Skoog], MS/2 ; MS/4 et B5). Pour ce faire, des explants uni nodaux de 1 cm ont été placés en incubation dans des tubes à essais contenant 15 ml de solution nutritive supplémentée de 30 g·l-1 de saccharose et de 7 g·l-1 d’agar. Les cultures ont été placées sous une photopériode de 16 h jour et 8 h nuit, une température de 29 °C/27 °C ± 0,25 °C, une intensité lumineuse de 50 μE·s-1·m-2 et une hygrométrie relative de 70 ± 5 %. Un total de 24 explants ont été testés pour chaque traitement.
7Application de la contrainte saline. Afin de pouvoir définir un paramètre pertinent pour discriminer les différentes accessions de manioc, la réponse à la salinité des organes aériens et racinaires des vitroplants a été évaluée. Pour ce faire, les vitroplants néoformés au bout de 45 jours ont été découpés en fragments uni nodaux de 1 cm pour les tests de criblage dans des tubes à essais contenant 15 ml de milieu MS additionné de différentes concentrations de NaCl (0 ; 1,5 ; 2 ; 2,5 ; et 3 g·l-1). Pour chaque traitement, 24 explants ont été soumis ou non à la contrainte saline puis placés en culture sous les conditions contrôlées décrites ci-dessus. Le dispositif expérimental est un bloc complètement aléatoire ou en randomisation totale. Pour chaque traitement, un total de 24 tubes à essais, répartis dans deux portoirs (12 tubes par portoir), ont été utilisés par accession.
2.3. Paramètres mesurés
8Les paramètres morphologiques. Les paramètres mesurés ont porté sur le nombre de nœuds néoformés, la longueur de la tige, la biomasse des parties aériennes, la production de racines (nombre de racines formées). Le poids de matière sèche a été déterminé après séchage jusqu’à un poids constant dans une étuve à 80 °C pendant 4 h. Les observations ont porté sur 24 explants par accession et par traitement après six semaines de culture.
9L’indice de sensibilité (IS) a été utilisé pour évaluer les accessions selon leur aptitude à tolérer le NaCl. Pour un paramètre donné (P), l’indice de sensibilité correspond à l’écart entre les vitroplants traités et les témoins. Il est calculé selon la formule ci-après :
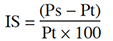
10avec Ps la valeur du paramètre obtenue avec les vitroplants cultivés en présence de sel et Pt celle obtenue avec les témoins non traités.
11Ainsi, plus l’IS est négatif, plus l’accession est sensible au NaCl. Dans ce cas, les tests ont porté sur l’allongement des vitroplants des différentes accessions de manioc.
12Dosage des chlorophylles. L’extraction de la chlorophylle a été effectuée selon la méthode de Makeen et al. (2007). La teneur en chlorophylle totale a été déterminée par la mesure de l’absorbance des chlorophylles a et b au spectrophotomètre contre un blanc préparé avec de l’acétone 80 %. Les quantités de chlorophylle a, b et totale ont été déterminées en milligramme par gramme de matière fraiche (Arnon, 1949). Les analyses ont porté sur 10 échantillons de feuille pour chaque groupe classé comme tolérant, moyennement tolérant et sensible à la salinité.
2.4. Analyse statistique des données
13Les données ont été traitées et analysées à l’aide des logiciels d’extension d’Excel et XlStat (version 2011). Les moyennes des valeurs des différents paramètres mesurés ont été représentées plus ou moins avec leur déviation standard pour un niveau de confiance de 95 %.
14Afin de mettre en évidence l’effet des différentes doses de sel sur les paramètres physiologiques du manioc, une analyse de la variance (ANOVA) à un critère suivi du test de Newman-Keuls au seuil de 5 % été réalisée.
15Une analyse en composantes principales des paramètres relatifs à la croissance et au développement des vitroplants été réalisée afin d’évaluer la diversité au sein des accessions de manioc et de les regrouper selon leur tolérance à la salinité.
3. Résultats
3.1. Effet de la nature du milieu de culture sur l’organogenèse des explants en l’absence de phytohormones
16L’expression morphogénétique des explants de manioc a été déterminée en fonction de la nature du milieu de culture. Le milieu MS a aussi permis la régénération de vitroplants microbouturables (avec un minimum de 4 nœuds et 3 racines) chez 94 % des explants des accessions de manioc testées (Figure 1a). Le milieu de culture MS a donné un meilleur pourcentage d’allongement des explants par rapport aux autres milieux de culture. Par contre, le milieu MS/4 permet d’obtenir un pourcentage plus élevé (98 %) d’explant de manioc enraciné (Figure 1b). Le milieu MS sera choisi pour la suite des essais sous contrainte saline.
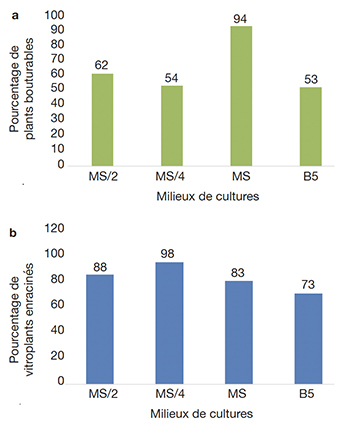
Figure 1. Effet de la nature du milieu de culture sur l’allongement et le développement de la partie aérienne (a) et sur la rhizogenèse des vitroplants de manioc (b) — Effect of growing medium on the elongation and development (a) and on the rhizogenesis of cassava vitroplants (b).
3.2. Évaluation de la sensibilité des organes aériens et souterrains
17L’effet du sel sur le développement des parties aériennes se traduit par des différences de croissance des vitroplants en fonction des concentrations de sel mais aussi selon les accessions (Figure 2, Tableau 2). L’analyse des données à partir des équations de corrélation (1) et (2) a révélé une forte corrélation entre le développement des parties aériennes (R2 = 0,91) et racinaires (R2 = 0,82) des explants et la concentration de chlorure de sodium incorporé dans les milieux de culture (Figure 3). Les équations et coefficients de corrélation obtenus sont les suivants :
18y = -3,15x + 10,56 (R2 = 0,91) (1)
19y = 1,141x + 5,66 (R2 = 0,82) (2)

Figure 2. Les effets du NaCl (1 ; 1,5 ; 2 ; 2,5 ; 3 g.l-1) sur la caulogenèse (a) et la rhizogenèse (b) des explants de manioc — Effects of NaCl (1 ; 1,5 ; 2 ; 2,5 ; 3 g.l-1) on caulogenesis (a) and rhizogenesis (b) of cassava explants.
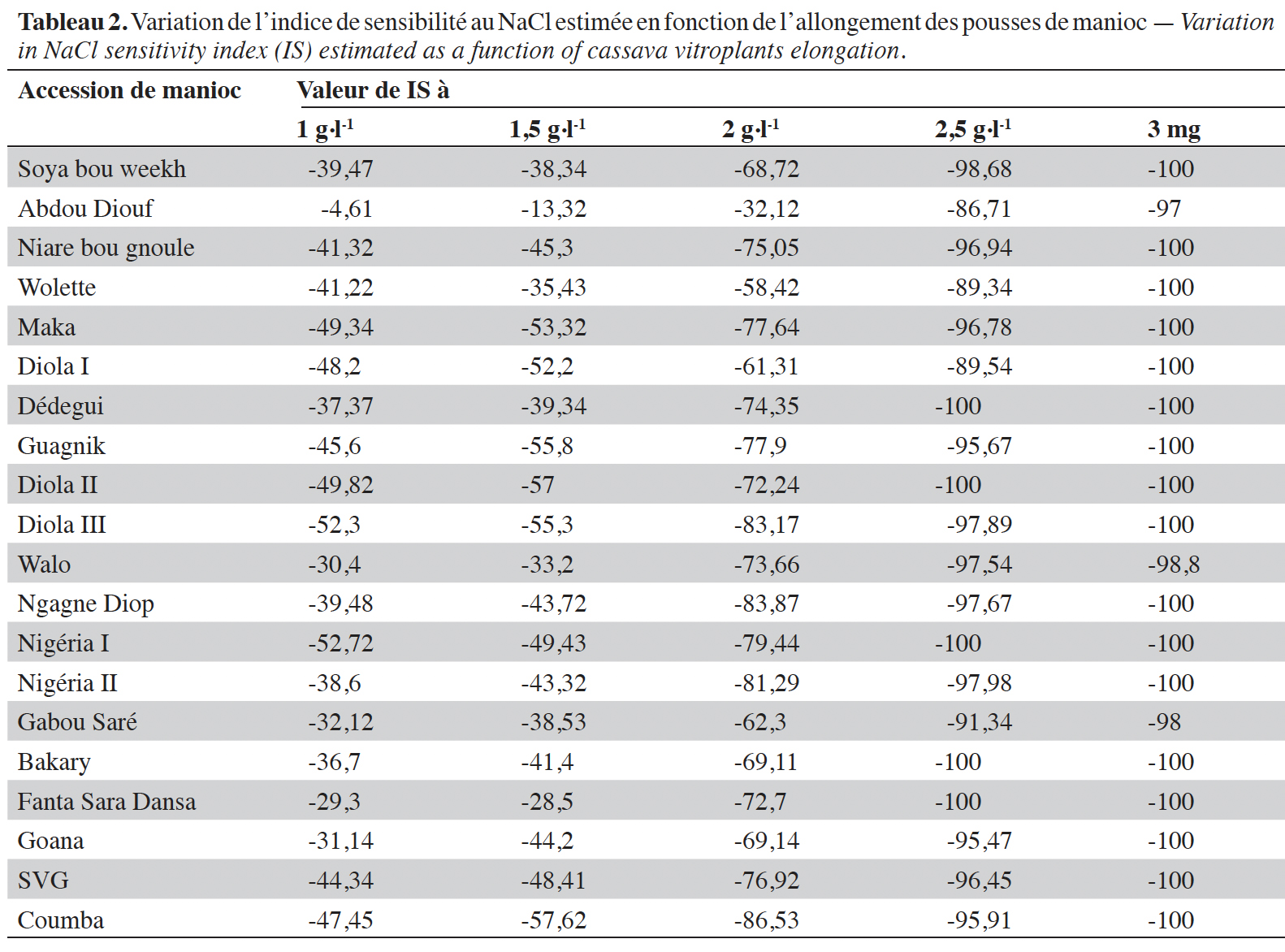
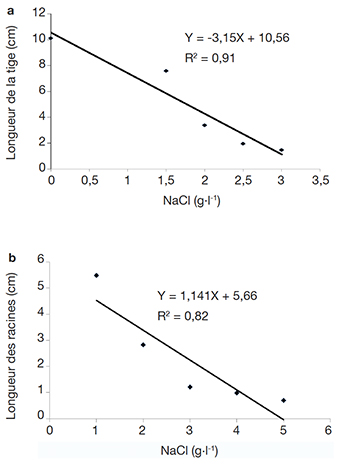
Figure 3. Effet de la concentration de NaCl sur la croissance en hauteur (a) et la longueur des racines (b) des vitroplants de manioc — Effect of NaCl concentration on height growth (a) and root length (b) of cassava vitroplants.
20La concentration en sel affecte négativement le développement des parties aussi bien aériennes que racinaires des explants et la résolution des équations (1) = 0 et (2) = 0 permet de définir respectivement les concentrations de NaCl pour lesquelles les formations de tige et de racine sont totalement inhibées. En effet, la concentration de NaCl inhibitrice de la formation de tige est de 3,36 g·l-1 et est moins élevée que celle inhibitrice des racines qui est évaluée à 5,1 g·l-1. La partie aérienne qui est la plus sensible à la salinité sera par conséquent utilisée comme paramètre pour évaluer l’effet du NaCl sur les accessions de manioc étudiées.
3.3. Calcul des Indices de Salinités (IS)
21Les effets dépressifs du chlorure de sodium sur la croissance végétative (allongement ou caulogenèse) des vitroplants des accessions de manioc sont consignés dans le tableau 2.
22Le NaCl incorporé dans les milieux de culture réduit la croissance des vitroplants chez l’ensemble des accessions. Cependant, l’importance de celle-ci dépend des accessions et des concentrations de NaCl. La dose de 2 g·l-1 réduit fortement l’allongement des vitroplants de manioc qui, à l’exception de ceux de la variété Abdou Diouf, perdent plus de 50 % de leur capacité morphogénétique. En effet, cette accession exprime près de 72 % de ses potentialités de croissance avec un indice de salinité (IS) de -32,12 alors que toutes les autres présentent une large gamme de IS (comprise entre -58,32 et -86,53) bien supérieurs à -50. Toutefois, les fortes concentrations de NaCl à 2,5 et 3 g·l-1 annulent ou réduisent très fortement la croissance des vitroplants chez toutes les accessions cultivées avec des IS compris entre -86,71 et -100.
3.4. Classement des accessions selon leur sensibilité à partir de paramètres morphologiques
23Les valeurs de l’indice de sensibilité (IS) obtenues montrent clairement que la sensibilité au NaCl dépend étroitement de la concentration de NaCl et des accessions testées (Tableau 2). Toutefois, ce paramètre ne discrimine pas les accessions aux faibles concentrations de NaCl à 1 et 1,5 g·l-1. Il les discrimine mieux à 2 g·l-1, avec l’apparition de l’accession tolérante Abdou Diouf. Cette concentration dépassée, l’IS ne permet plus de discriminer les accessions puisque l’allongement des tiges reste insignifiant, voire nul.
24En considérant uniquement les tailles moyennes (avec leur déviation standard pour un niveau de confiance de 95 %) des vitroplants cultivés à la concentration de 2 g·l-1 de NaCl, nous pourrons classer les accessions en trois groupes :
25– le groupe tolérant au sel constitué seulement de l’accession dénommée Abdou Diouf ;
26– le groupe moyennement tolérant avec les accessions Wolette, Gabou Saré, Diola I, Goana, Niare bou gnoule, Walo, Bakary, Guagnik, Nigéria II, Fanta Sara Dansa, SVG, Dedegui ;
27– le groupe sensible à la salinité avec les accessions Maka, Soya bou Weekh, Diola II, Diola III, Nigéria I, Coumba, Ngagne Diop (Figure 4).
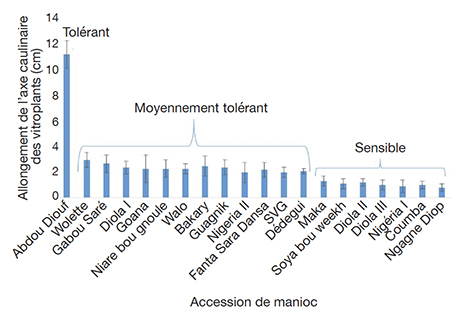
Figure 4. Classement des accessions de manioc en fonction de la taille des vitroplants à la concentration de NaCl à
2 g.l-1 — Classification of cassava accessions according to vitroplant height at 2 g.l-1 NaCl concentration.
28L’analyse en composantes principales des paramètres relatifs à la croissance et au développement des vitroplants (à savoir les biomasses sèches et fraiches des tiges, la longueur des tiges et le nombre de nœuds axillaires) a permis aussi de classer les accessions de manioc selon leur tolérance à la salinité.
29L’axe 1 caractérisé par le nombre de nœuds et le poids sec aérien explique plus de 81 % de la variance totale, contrairement à l’axe 2 constitué par la longueur de la tige et le nombre de racines des vitroplants (Figure 5). Les résultats de cette classification restent similaires à ceux obtenus à partir de la croissance aérienne des tiges des vitroplants placés sous contrainte saline (Figure 4).
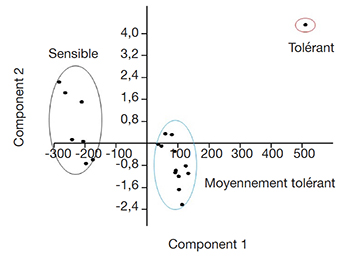
Figure 5. Analyse en composantes principales des paramètres de croissance des accessions de manioc (Axe 1 : 81,46 % ; Axe 2 : 10,88 % de la variance totale) — Principal component analysis of growth parameters of cassava accessions (Axis 1: 81.46%; Axis 2: 10.88% of total variance).
3.5. Biosynthèse de chlorophylles a, b et totale des vitroplants sous contrainte saline
30L’analyse des résultats relatifs aux dosages des chlorophylles ont montré que la salinité induit un effet dépressif qui se traduit par la réduction significative des teneurs en chlorophylles a, b et totale dans les feuilles des vitroplants régénérés (Figure 6). À la concentration de 1,5 g·l-1 mg de NaCl, l’analyse des résultats suivant le test de Newman-Keuls au seuil de 5 % a montré des différences significatives entre les différents groupes. Pour tous les types de chlorophylle biosynthétisée par les vitroplants, le groupe des tolérants présente une teneur en chlorophylle significativement plus élevée, suivi du groupe des moyennement tolérants et enfin du groupe des sensibles (Figure 6a). Par contre, à la concentration de 2 g·l-1 de NaCl, il n’y a pas de différence significative entre les différents groupes pour tous les types de chlorophylle biosynthétisée par les vitroplants (Figure 6b).
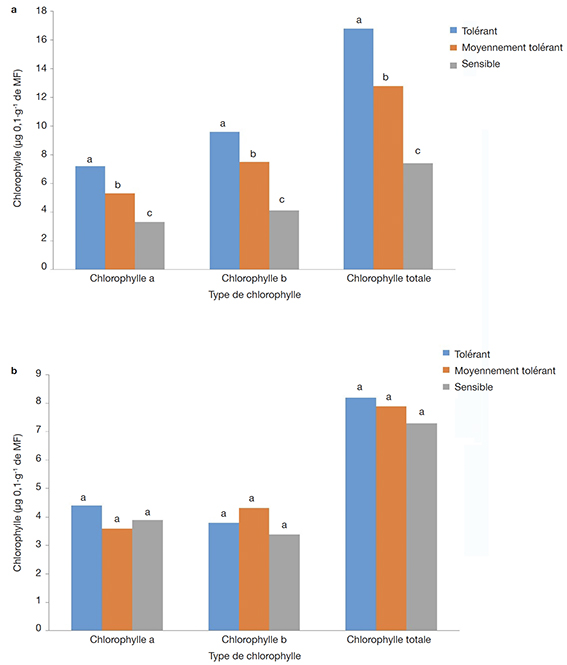
Figure 6. Les teneurs en chlorophylle des groupes d’accessions de manioc en fonction des concentrations de NaCl 1,5 g.l-1 (a) et 2 g.l-1 (b) — Chlorophyll content of groups of cassava accessions at NaCl concentrations 1.5 g.l-1 (a) and 2 g.l-1 (b).
Pour chaque type de chlorophylle, les lettres a, b, et c désignent des groupes homogènes pour la comparaison des moyennes selon le test de Newman-Keuls au seuil de 5 % — For each type of chlorophyll, the letters a, b and c denote homogeneous groups for comparison of means using the Newman-Keuls test with a significance level of 5%.
4. Discussion
31La salinité du sol constitue un stress majeur qui limite la production des cultures vivrières (Gupta & Huang, 2014). Communément dominée par le NaCl, la tolérance au sel a été étudiée sur un large éventail de plantes (Gupta & Huang, 2014 ; Shabala et al., 2015 ; Ibrahim, 2016). Chez plusieurs espèces végétales, les effets produits par le stress salin se manifestent souvent par des changements morphologiques et physiologiques (Kovda, 1983). Les fortes concentrations salines peuvent affecter les différents stades de développement de la plante (Sadio, 1991). Dans cette étude, la sensibilité au chlorure de sodium de plusieurs accessions de vitroplants de manioc a été testée.
32Un test sur le milieu de culture propice à la régénération des explants a permis de choisir le milieu de culture Musrashige et Skoog complet (MS) car il s’est révélé être le plus favorable au développement et à la croissance des vitroplants de manioc en l’absence de régulateurs de croissance. Cependant, Mapayi et al. (2013) ont obtenu de meilleurs résultats en additionnant une auxine et une cytokinine à ce milieu de culture MS. La réponse des explants de manioc par rapport à la nature du milieu de culture pourrait s’expliquer par leur aptitude à reprendre une activité morphogénétique pour une régénération de tige feuillée et enracinée.
33La tolérance au sel s’exprime habituellement en termes de croissance, de rendement ou de survie. Nos résultats sur la croissance des vitroplants de manioc indiquent que la salinité affecte négativement la croissance aussi bien aérienne que racinaire. Ces résultats sont en concordance avec ceux de Daroui et al. (2012) sur le palmier et de Benmahioul et al. (2009) sur le pistachier. Cette diminution de la croissance est le résultat au niveau cellulaire d’une baisse du nombre de divisions cellulaires lors des stress abiotiques (stress salin et hydrique) selon Daroui et al. (2012). La réduction de la croissance aérienne observée au niveau des vitroplants peut s’expliquer par des perturbations des taux de certains régulateurs de croissance, notamment l’acide abscissique et les cytokinines induites par le sel (Benmahioul et al., 2009). D’après Bouhabila (2016), les effets du stress salin peuvent également limiter la croissance des racines, réduisant ainsi les possibilités d’absorption des éléments nutritifs du sol.
34Les résultats montrent aussi que la partie aérienne est plus sensible au stress salin que la partie racinaire. Cette différence de sensibilité entre les organes d’absorption et les organes photosynthétiques est décrite comme caractéristique des glycophytes (Andaloussi, 1999). En effet, selon Greenway & Munns (1980), l’inhibition de la croissance des racines est généralement moins marquée que celle des parties aériennes au niveau desquelles une accumulation des ions Na+ et Cl- peut inhiber la croissance et devenir toxique pour la plante. Des effets similaires sur la croissance ont aussi été obtenus chez d’autres plantes telles que le ricin (Diallo et al., 2015). Ce comportement de la plante correspondrait à une stratégie adaptative car celle-ci retarde le développement des parties aériennes pour accumuler des ressources et de l’énergie lui permettant de lutter contre le stress salin (Zhu, 2001). En effet, Bouraoui et al. (1998) ont montré que la demande énergétique de la croissance des racines chez le triticale est augmentée en milieu salé et que le passage des cellules du stade de division au stade d’élongation serait dû à une modification du métabolisme respiratoire. Ainsi, le maintien de l’élongation racinaire et la stimulation de la respiration sur milieu salé correspondent à l’un des facteurs de tolérance à la salinité.
35Par ailleurs, les résultats obtenus montrent une variabilité dans la réponse des accessions de manioc selon la concentration de NaCl additionnée au milieu de culture. Celle-ci s’explique d’après El-Sharkawy (2004) par son potentiel génétique qui fait que le manioc montre une tolérance aux stress environnementaux considérable mais qui est variable suivant l’espèce, la variété et l’écotype (Zid, 1991). Les effets négatifs du NaCl seraient liés selon Downton (1985) à la concentration élevée de sel dans le milieu qui conduit à l’épuisement progressif des réserves carbonées et azotées du système racinaire sans qu’il n’y ait suffisamment de réapprovisionnement de celles-ci.
36Les paramètres morphologiques suivis sur la tige ont permis de classer les accessions en trois groupes selon leur sensibilité au NaCl au seuil de 2 g·l-1. Une telle classification en conditions in vitro a été réalisée chez des espèces comme le manioc (Potluri & Prassad, 2001 ; Carretero et al., 2007) et le ricin (Diallo et al., 2015).
37Les résultats concernant l’effet limitant du NaCl sur la biosynthèse de la chlorophylle confirment ceux obtenus chez le limonier (Nieves et al., 1991), le blé (Tahri et al., 1998), l’orge (M’Hamed et al., 2008) et le dattier (Diatta, 2013). D’après Nieves et al. (1991), la réduction de la teneur foliaire en chlorophylle sous contrainte saline serait liée à une forte concentration du chlore et/ou du sodium au niveau des feuilles. Levingneron et al. (1995) rapportent que l’effet néfaste de la salinité sur les teneurs en pigments chlorophylliens est partiellement à l’origine de la diminution de la synthèse des hydrates de carbone.
38Toutefois, la biosynthèse de chlorophylles n’a pas permis de confirmer la classification précédemment effectuée sur la base de caractères morphologiques au seuil de 2 g de chlorure de sodium. En effet, la comparaison des teneurs en chlorophylles des groupes classés comme tolérant, moyennement tolérant et sensible a révélé que les effets dépressifs du chlorure de sodium ont été significatifs entre les groupes pour la concentration de 1,5 g·l-1. Aucune différence significative n’a été décelée entre les différents groupes à la concentration de 2 g·l-1 de NaCl. La biosynthèse de chlorophylle apparait ainsi comme un critère physiologique de classification des accessions de manioc pour un seuil de sensibilité à 1,5 g·l-1 de chlorure de sodium. En effet, les teneurs en chlorophylles a, b et total sont des paramètres très sensibles qui représentent des indicateurs du degré de tolérance des accessions de manioc.
5. Conclusions
39Le stress salin induit un effet dépressif sur tous les paramètres morphologiques et physiologiques des accessions de manioc avec une réduction de son expansion foliaire, sa croissance aérienne, le développement de son système racinaire et la biosynthèse des chlorophylles. Les caractères morphologiques caulinaires mesurés sous contrainte saline en conditions in vitro ont permis de classer les accessions de manioc en groupes tolérant, moyennement tolérant et sensible pour un seuil de sensibilité à 2 g·l-1 de NaCl. Cette classification morphologique est confirmée par celle basée sur des paramètres biochimiques (biosynthèse de chlorophylle) mais pour un seuil de sensibilité plus faible (1,5 g·l-1 de NaCl). La sélection de vitroplants tolérants à la salinité par le biais de la culture in vitro peut contribuer à obtenir des clones homogènes et tolérants à la salinité. L’identification et la compréhension des mécanismes de tolérance des plantes à la salinité présentent donc un intérêt évident pour l’amélioration variétale.
Bibliographie
Andaloussi A.M., 1999. Comportement physiologique et biochimique du sorgho fourrager sous contrainte saline : effets d’alternance et acclimatation. Thèse de doctorat : Université de Tunis (Tunisie).
Arnon D.I., 1949. Copper enzymes in isolated chloroplasts. Polyphenoloxidase in Beta vulgaris. Plant Physiol., 24(1), 1-15.
Benmahioul B., Daguin F. & Kaid-Harche M., 2009. Effet du stress salin sur la germination et la croissance in vitro du pistachier (Pistacia vera L.). C.R. Biol., 332(8), 752-758, doi.org/10.1016/j.crvi.2009.03.008
Bouhabila I.E., 2016. Effet du stress salin sur l’expression de deux facteurs de transcription chez la luzerne annuelle Medicago truncatula : cas du NAC969 et du BHLH32. TFE : Université des Frères Mentouri Constantine 1 (Algérie).
Bouraoui N., Grignon C. & Zid E., 1998. Effet de NaCl sur la croissance et la respiration racinaire du triticale (X-TriticosecaleWittmack). Cah. Agric., 7, 372-376.
Carretero C.L., Cantos M., García J.L. & Troncoso A., 2007. In vitro - ex vitro salt (NaCl) tolerance of cassava (Manihot esculenta Crantz) plants. In Vitro Cell. Dev. Biol. Plant, 43, 364-369, doi.org/10.1007/s11627-006-9022-5
Chang X., Gao Z., Wang S. & Chen H., 2019. Modelling long-term soil salinity dynamics using SaltMod in Hetao Irrigation District, China. Comput. Electron. Agric., 156, 447-458, doi.org/10.1016/j.compag.2018.12.005
CSE (Centre de Suivi Écologique), 2010. Rapport sur l’état de l’environnement au Sénégal. Dakar : CSE.
DAPSA (Direction de l’Analyse, de la Prévision et des Statistiques Agricoles), 2017. Résultats définitifs de la campagne agricole 2014-2015. Dakar : DAPSA, https://www.dapsa.gouv.sn/sites/default/files/publications/Note%20production%20definitive_dapsa_2014-2015.pdf, (19/06/2024).
Daroui E.A., Boukroute A., Kouddane N.E. & Berrichi A., 2013. Effet de la salinité sur la germination et la croissance in vitro de Washingtonia filifera L. Nat. Technol. B. Sci. Agron. Biol., 8, 32-38, https://www.univchlef. dz/revuenatec/Art_8_B_05.pdf, (19/06/2024).
Diallo B. et al., 2015. Criblage in vitro des graines d’accessions locales de ricin (Ricinus communis L.) en conditions de stress salin. Agron. Afr., 27(3), 175-187.
Diatta I.L.D., 2013. Influence de l’inoculation avec des champignons mycorhiziens à arbuscules sur la croissance et le développement des plants de cultivars de palmier dattier (Phoenix dactylifera L.) sahéliens en conditions de stress salin. Thèse de doctorat : Université Cheikh Anta Diop de Dakar (Sénégal).
Downton W.J.S., 1985. Growth and mineral composition of the Sultana grapevines as influenced by salinity and rootstock. Aust. J. Agric. Res., 36, 425-434, doi.org/10.1071/AR9850425
El-Sharkawy M.A., 2004. Cassava biology and physiology. Plant Mol. Biol., 56, 481-501, doi.org/10.1007/s11103-005-2270-7
Escudier J.L., Gillery B., Ojeda H. & Etchebarne H., 2019. Maitrise de la salinité des eaux d'irrigation pour la viticulture. BIO Web Conf., 12, article 01010, doi.org/10.1051/bioconf/20191201010
Fall A.C.L., 2017. Sustainable management of coastal saline soils in the Saloum river Basin, Senegal. Int. J. Biol. Chem. Sci., 11(4), 1903-1919, doi.org/10.4314/ijbcs.v11i4.39
FAO, 2021. Global map of salt affected soils version 1.0 (2021). Roma: FAO.
Gleadow R., Pegg A. & Blomstedt C.K., 2016. Resilience of cassava (Manihot esculenta Crantz) to salinity: implications for food security in low-lying regions. J. Exp. Bot., 67, 5403-5413, doi.org/10.1093%2Fjxb%2Ferw302
Greenway H. & Munns R., 1980. Mechanism of salt tolerance in nonhalophytes. Annu. Rev. Plant Physiol., 3, 149-190, doi.org/10.1146/annurev.pp.31.060180.001053
Gupta B. & Huang B., 2014. Mechanism of salinity tolerance in plants: physiological, biochemical, and molecular characterization. Int. J. Genomics, 701596, doi.org/10.1155/2014/701596
Ibrahim E.A., 2016. Seed priming to alleviate salinity stress in germinating seeds. J. Plant Physiol., 192, 38-46, doi.org/10.1016/j.jplph.2015.12.011
Kovda V.A., 1983. Loss of productive land due to salinization. Ambio, 12, 91-93.
Levingneron A. et al., 1995. Les plantes face au stress salin. Cah. Agric., 4, 263-273.
M’Hamed C.H. et al., 2008. Évaluation de la tolérance au stress salin de quelques accessions d’orge (Hordium vulgare L.) cultivées en Tunisie : approche physiologique. Sci. Technol. C, 28, 30-37.
Machado R.M.A. & Serralheiro R.P., 2017. Soil salinity: effect on vegetable crop growth. Management practices to prevent and mitigate soil salinization. Horticulturae, 3(2), 30, doi.org/10.3390/horticulturae3020030
Maïga Y., Mawussi G., Faye O.N. & Fall A., 2020. Screening of rice lines (Oryza spp. L. 1753) for salinity tolerance at vegetative stage under Senegal river valley conditions. J. Exp. Agric. Int., 42(4), 71-81, doi.org/10.9734/JEAI/2020/v42i430501l
Makeen K., Babu G.S., Lavanya G.R. & Abraham G., 2007. Studies of chlorophyll content by different methods in black gram (Vigna mungo L.). Int. J. Agric. Res., 2, 651-654, doi.org/10.3923/ijar.2007.651.654
Mapayi E.F., Ojo D.K., Oduwaye O.A. & Porbeni J.B.O., 2013. Optimization of in vitro propagation of cassava (Manihot esculenta Crantz) genotypes. J. Agric. Sci., 5(3), doi.org/10.5539/jas.v5n3p261
Nieves M., Riuz D. & Cedra A., 1991. Influence of rootstock-scion combination in Lemon trees salt tolerance. In: Proceedings of the International Society of Citriculture, Acireale, Italy, 387-390.
Potluri S.D.P. & Prasad P.V.D., 2001. In-vitro studies on the effects of varying levels of sea-salt on two cassava cultivars. Trop. Agric., 78(1), 62-65.
PROMASC (Projet Partenariat Multi-acteurs pour l’Adaptation des Populations Vulnérables à la Salinisation des sols induite par les Changements Climatiques au Sénégal), 2012. Rapport final, 18 mars 2009-31 mars 2012. Dakar : PROMASC.
Sadio S., 1991. Pédogenèse et potentialités forestières des sols sulfatés acides salés des tannes du Sine-Saloum, Sénégal. Thèse de doctorat : Landbouwuniversiteit, Wageningen (The Netherlands). Ed. ORSTOM.
Sané A.K. et al., 2021. In vitro germination and early vegetative growth of five tomato (Solanum lycopersicum L.) varieties under salt stress conditions. Am. J. Plant Sci., 12(5), 796-817, doi.org/10.4236/ajps.2021.125055
SCA (Stratégie de Croissance Accélérée), 2013. Étude sur l’organisation et la structuration de filières agricoles au Sénégal en des chaînes de valeur performantes dans le cadre de la Grappe Agriculture et Agro-industrie. Dakar : SCA.
Shabala S., 2013. Learning from halophytes: physiological basis and strategies to improve abiotic stress tolerance in crops. Ann. Bot., 112, 1209-1221, doi.org/10.1093%2Faob%2Fmct205
Shabala S., Wu H. & Bose J., 2015. Salt stress sensing and early signalling events in plant roots: current knowledge and hypothesis. Plant Sci., 241, 109-119, doi.org/10.1016/j.plantsci.2015.10.003
Singh A., 2018. Alternative management options for irrigation-induced salinization and waterlogging under different climatic conditions. Ecol. Indic., 90, 184-192, doi.org/10.1016/j.ecolind.2018.03.014
Sow S., Nkonya E., Meyer S. & Kato E., 2016. Cost, drivers and action against land degradation in Senegal. In: Nkonya E., Mirzabaev A. & von Braun J., eds. Economics of land degradation and improvement – a global assessment for sustainable development. Springer, 577-608, doi.org/10.1007/978-3-319-19168-3
Sylla E.H.M. et al., 2023. Le partenariat public-privé appliqué aux investissements dans la grande irrigation en Afrique : le projet de promotion du partenariat rizicole dans le Delta du fleuve Sénégal. Cah. Agric., 32, article 9, doi.org/10.1051/cagri/2023002
Tahri E.H., Belabed A. & Sadki K., 1998. Effet d’un stress osmotique sur l’accumulation de proline, de chlorophylle et des ARNm codant pour la glutamine synthétase chez trois variétés de blé dur (Triticum durum). Bull. Institut Sci. Rabat, 21, 81-87.
Tamba A. & Faye E., 2015. Actes du séminaire national “Lutte contre la salinisation et valorisation des terres salées au Sénégal : état des connaissances et perspectives”, Dakar, Sénégal.
Thiam M., Champion A., Diouf D. & Sy M.O., 2013. NaCl effects on in vitro germination and growth of some Senegalese cowpea (Vigna unguiculata [L.] Walp.) cultivars. ISRN Biotechnol., doi.org/10.5402/2013/382417
Zhu J.K., 2001. Plant salt tolerance. Trends Plant Sci., 6, 66-71, doi.org/10.1016/S1360-1385(00)01838-0
Zid E., 1991. Les tests de sélection précoce pour la résistance des plantes au stress : cas des stress salin et hydrique. In : Chalbi N. & Demarly Y., eds. Amélioration des plantes par l’adaptation aux milieux arides. Ed. AAPELF-UREF, 91-108.






