- Portada
- volume 12 (2008)
- numéro 2
- Comparaison des premières étapes de l’embryogenèse somatique chez Baillonella toxisperma et Vitellaria paradoxa (Sapotacées)
Vista(s): 0 (0 ULiège)
Descargar(s): 0 (0 ULiège)
Comparaison des premières étapes de l’embryogenèse somatique chez Baillonella toxisperma et Vitellaria paradoxa (Sapotacées)

Notes de la rédaction
Reçu le 21 juin 2006, accepté le 11 septembre 2007
Résumé
En vue d’initier la propagation in vitro de Baillonella toxisperma et Vitellaria paradoxa, l’embryogenèse somatique a été étudiée de façon comparative chez ces deux Sapotacées à partir des fragments de feuille prélevés sur des plantes en production. Le milieu de Murashige et Skoog, dilué de moitié (MS/2) et additionné de 0,6 % d’agar et de 4,5 % de saccharose, a été utilisé comme milieu de base. La 6-benzylaminopurine (BAP) (0,5 mg.l-1) et l’acide 2,4-dichlorophénoxyacétique (2,4-D) (0,5 à 5 mg.l-1) ont été ajoutés à ce milieu de base pour étudier la callogenèse et la formation des embryons somatiques sur les cals. Chez les deux espèces, les combinaisons BAP/2,4-D ont significativement affecté la callogenèse. En 28 jours de culture, les combinaisons les plus réactives sont 0,5/0,5 chez B. toxisperma qui a permis à 75,2 % d’explants de former les cals et 0,5/3 chez V. paradoxa qui a permis d’obtenir jusqu’à 87,3 % de callogenèse. Le 2,4-D à 3 mg.l-1 a permis la différenciation des embryons somatiques sur 92,7 % de cals chez B. toxisperma avec en moyenne 38 embryons par cal. Par contre, chez V. paradoxa, c’est la combinaison BAP/2,4-D de 0,5/2 qui est la plus réactive et a permis d’obtenir en 97 jours de culture 62,1 % de cals embryogènes avec en moyenne 27 embryons par cal. L’étude histologique des cals embryogènes a montré que chez les deux espèces, le développement des embryons somatiques différenciés passe par les mêmes stades, notamment le stade nodulaire, le stade de division des cellules nodulaires et enfin le stade embryons bipolaires dont les pourcentages obtenus sont respectivement de 77,2 % et 66,8 % chez B. toxisperma et V. paradoxa. Bien que ce travail ouvre une nouvelle voie probable de la propagation de ces deux espèces, la transformation des embryons bipolaires en plantules viables reste une phase importante à étudier.
Abstract
Comparison of first stages of somatic embryogenesis in Baillonella toxisperma and Vitellaria paradoxa. In order to initiate the in vitro propagation of Baillonella toxisperma and Vitellaria paradoxa, a comparative study of somatic embryogenesis was studied on these two Sapotaceae using leaf fragment from plants under production. A culture medium of Murashige and Skoog half strength (MS/2) supplemented with 0.6% agar and 4.5% sucrose was used as the basic medium. 0.5 mg.l-1 of 6-benzylaminopurine (BAP) and 0.5 to 5 mg.l-1 of 2.4-dichlorophenoxyacetic acid (2.4-D) were added to the basic medium to study the process of callogenesis and the formation of the somatic embryo on the callus. The BAP/2.4-D combination significantly affected callogenesis in both species. During 28 days of culture, the most reactive combinations are 0.5/0.5 in B. toxisperma which allowed 75.2% of the explants to form callus, and 0.5/3 in V. paradoxa which permitted to obtain up to 87.3% callogenesis. At 3 mg.l-1, 2.4-D permitted the differentiation of somatic embryos in 92.7% of callus in B. toxisperma with an average of 38 embryos per callus. On the contrary in V. paradoxa, the most reaction is observed with the combination of 0.5/2 BAP/2.4-D which permitted to obtain 62.1% of embryonic callus in 97 days of culture with an average of 27 embryos per callus. The histological study of embryonic callus showed that the development of the differentiated somatic embryos occurs through the same stages in both species; notably the nodular stage, the division of nodular cells stage and the bipolar embryos stage, thus the respective percentages obtained are 77.2% and 66.8% in B. toxisperma and V. paradoxa. Though this work opens probably new way of propagation of these two species, the transformation of the bipolar embryos into viable plants remains important phase to study.
Tabla de contenidos
1. Introduction
1Baillonella toxisperma et Vitellaria paradoxa sont deux Sapotacées que l’on rencontre à l’état sauvage dans les forêts d’Afrique intertropicale. Leurs noms commerciaux sont respectivement le Moabi et le Karité. Les deux espèces sont monotypiques et se rencontrent en particulier dans les forêts guinéo-congolaises et les savanes soudano-sahéliennes (White, 1983). Ce sont des arbres à usages multiples. Les fruits, à mésocarpe comestible, sont systématiquement récoltés et utilisés par les populations riveraines et dans les industries agro-alimentaires et pharmaceutiques (Gaméné et al., 2003). Des huiles à usages culinaires et cosmétiques sont extraites des graines de ces deux espèces (Vivien et al., 1985). Le beurre de Karité est utilisé dans les industries agro-alimentaires comme substituant du beurre de cacao dans la fabrication du chocolat (Gaméné et al., 2004). En Afrique intertropicale, l’exportation du bois de Moabi est estimée à plus de 35 000 m3 par an (OIBT, 1995 ; Schneeman, 1995). Ce bois est utilisé dans plusieurs pays pour fabriquer des objets d’art et pour construire des chemins de fer (Vivien et al., 1985). Ces multiples usages entraînent une exploitation anarchique de ces deux espèces. Le cycle de reproduction de ces deux Sapotacées est assez long. La première floraison est notée entre 50 et 70 ans chez le Moabi et entre 20 à 30 ans chez le Karité (Schneeman, 1995 ; Debroux, 1998). Les deux espèces sont allogames et la régénération par semis est très limitée à cause des attaques parasitaires (Debroux, 1998). De plus, les quelques arbres issus de cette régénération présentent une hétérogénéité au sein des descendants (Abbiw, 1990), ce qui limite la régénération identique et l’obtention de clones des génotypes élites. Les techniques de multiplication végétative classique (bouturage, marcottage) ne réussissent pas le plus souvent avec les espèces ligneuses à cause surtout de l’enracinement difficile des explants utilisés (Duhoux, 1988 ; Dos Santos et al., 1994). Chez les végétaux, ces techniques favorisent surtout la formation d’un système racinaire non pivotant (Leakey et al., 1989 ; Shiembo et al., 1996 ; 1997), ce qui ne permet pas le plus souvent aux arbres régénérés de résister aux intempéries climatiques. La culture in vitro des tissus en général et l’embryogenèse somatique en particulier apparaît comme un moyen efficace de la production rapide et en masse de plants ayant un système racinaire pivotant chez les espèces végétales. Certains arbres tropicaux sont reproduits in vitro par cette technique ; c’est le cas de Theobroma cacao (Zhijian et al., 1998 ; Alemano et al., 2001), Hevea brasiliensis (Blanc, 1999 ; Blanc et al., 2002), Dacryodes edulis (Youmbi, 2000), Coffea spp. (Ansaldi, 2002). L’embryogenèse somatique chez B. toxisperma et V. paradoxa n’a pas encore été décrite. Ce travail présente une toute première approche comparative de l’embryogenèse somatique chez ces deux espèces. La mise au point de régénération par cette technique pourra permettre la production rapide des plants de qualité en vue de la propagation et de la domestication de B. toxisperma et V. paradoxa. Cette mise au point est basée sur l’emploi de deux substances de croissance : l’acide 2,4-dichlorophénoxyacétique (2,4-D) et la 6-benzylaminopurine (BAP).
2. Matériel et méthodes
2.1. Matériel végétal utilisé et méthode de désinfection
2Les explants utilisés sont prélevés sur une plante (un génotype) de B. toxisperma dans la région de Nsimalen (banlieue de Yaoundé, Cameroun) et une plante (un génotype) de V. paradoxa dans la région de Ndang (banlieue de Ngaoundéré, Cameroun). Les jeunes feuilles ont été prélevées sur un arbre portant des fruits et sont lavées sous un courant d’eau de robinet pendant 30 min avant la désinfection. Celle-ci consiste en une immersion dans une solution de tween 40 à 2 % pendant 2 min, immersion dans une solution de mercryl laurylé 10 % pendant 10 min puis dans une solution d’hypochlorite de sodium 3 % pendant 15 min. Cette dernière immersion est suivie de trois rinçages à l’eau distillée stérile pendant 10 min chacun. Ces opérations ont lieu en conditions d’asepsie. Les feuilles désinfectées sont sectionnées en fragments de 1,5 cm2 et ensemencées de telle sorte que la face abaxiale soit en contact avec les milieux de culture.
2.2. Milieux et conditions de culture
3Les travaux de Fotso (2005) ont montré que le milieu de Murashige et al. (1962) dilué de moitié (MS/2) est favorable à l’organogenèse in vitro chez plusieurs espèces ligneuses tropicales. Le milieu de base utilisé est MS/2 additionné de 0,6 % d’agar (Difco), 4,5 % de saccharose (Fluka) et les vitamines de Morel et al. (1951). Les cals embryogènes sont initiés par culture des explants sur milieu de base enrichi de 0,5 mg.l-1 de BAP associée avec 0; 0,5; 1; 2; 3; 4 ou 5 mg.l-1 de 2,4-D chez les deux espèces après 7 jours de culture.
4Chez B. toxisperma, les cals embryogènes de 28 jours sont repiqués pendant 97 jours sur le milieu de base additionné de 0; 0,5; 1; 2; 3 ou 4 mg.l-1 de 2,4 D en vue de la différenciation des embryons somatiques bipolaires. Chez V. paradoxa, cette différenciation s’obtient lorsque ces cals sont repiqués pendant le même temps sur les mêmes milieux d’initiation. L’autoclavage des milieux a lieu à 115 °C pendant 30 min sous une pression de 1,6 kg.cm-2 après ajustement du pH à 5,7. Les milieux de culture ont été ensuite répartis dans des tubes à essai (2,5 x 15 cm) à raison de 10 ml par tube. Toutes les cultures ont été placées dans une salle à une température de 26 ± 1 °C, une photopériode de 16 h d’éclairement, avec une intensité lumineuse de 80 µmol.m-2.s-1. Après 120 jours de culture, les coupes histologiques ont été réalisées au niveau des cals ayant différencié les embryons somatiques afin de mieux apprécier la structure de ces derniers.
2.3. Etude histologique des cals embryogènes
5Les cals ayant différencié les embryons ont été fixés dans l’AFA (90 ml d’alcool 70° ; 5 ml de formaldéhyde et 5 ml d’acide acétique). Ils sont ensuite lavés sous un courant d’eau de robinet pendant 24 h et déshydratés par trois bains successifs dans l’éthanol 90° pendant 30 min chacun. Après trois traitements de 30 min chacun dans des mélanges éthanol 95° - toluène dans les proportions respectives de 3/4 - 1/4 ; 1/2 - 1/2 ; 1/4 - 3/4, les cals ont subi une inclusion dans la paraffine liquéfiée pendant 32 h. Des coupes de 10 µm d’épaisseur sont réalisées à l’aide d’un microtome (Shibuya Optical CO., LTD). Après déparaffinage par trempage successif dans le toluène (1 h), l'alcool 95° (1 h) et l'alcool 70° (10 min), les coupes sont rincées trois fois à l’eau distillée pendant 30 min et colorées à l’hématoxyline de Regaud-Safranine O. Les observations sont faites au microscope photonique (Nicon).
2.4. Analyses statistiques
6Chez les deux espèces étudiées, chaque expérience a été répétée trois fois et a porté à chaque fois sur la mise en culture de 50 explants. Les résultats des différentes expériences ont été traités par analyse de variances et les moyennes significativement différentes ont été séparées par le test de Duncan au seuil de probabilité de 5 %.
3. Résultats
3.1. Effet des différentes combinaisons BAP/2,4-D sur la callogenèse
7Chez les deux espèces, la callogenèse est initiée après 7 jours et au bout de 28 jours, des cals friables et jaunâtres sont obtenus chez B. toxisperma (Figure 1A), friables et blanchâtres chez V. paradoxa (Figure 1B). Les différentes combinaisons BAP/2,4-D ont significativement (p ≤ 0,05) affecté le pourcentage de la callogenèse chez les deux espèces. Les combinaisons 0,5/0,5 et 0,5/3 sont les plus réactives respectivement chez B. toxisperma et V. paradoxa. En effet, 75,2 % et 87,3 % des explants forment les cals respectivement chez les deux espèces (Tableau 1). Les autres combinaisons BAP/2,4-D testées ont donné des pourcentages significativement inférieurs et, avec la combinaison de 0,5/5, on obtient 0 % d’explant qui forme les cals chez B. toxisperma contre 3,2 % chez V. paradoxa (Tableau 1). En absence de 2,4-D (0 mg.l-1), il ne se forme pas de cal (0 %). Cette auxine est indispensable à cette organogenèse.
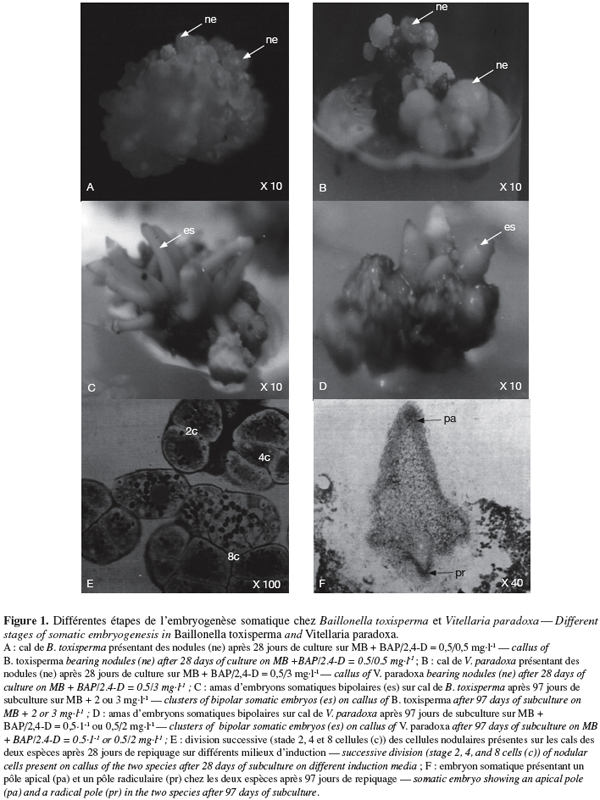
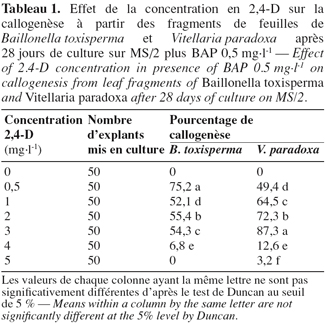
3.2. Effet de 2,4-D et des combinaisons BAP/2,4-D sur la formation des embryons somatiques au niveau des cals et étude histologique
8Chez les deux espèces, l’évolution des cals après repiquage sur milieu de base additionné de 0 à 5 mg.l-1 de 2,4-D aboutit à la différenciation des embryons somatiques bipolaires après 97 jours. Chez B. toxisperma, le pourcentage de cals qui différencie ces embryons et le nombre moyen de ces embryons par cal sont significativement (p ≤ 0,05) influencés par les différentes concentrations de 2,4-D tandis que chez V. paradoxa, ces deux paramètres sont significativement (p ≤ 0,05) influencés par les différentes combinaisons BAP/2,4-D. Chez B. toxisperma, le 2,4-D à 3 mg.l-1 est plus réactif, à cette concentration on obtient 92,7 % de cals qui différencient les embryons somatiques à différents stades de développement, et on compte en moyenne 38 embryons par cal à 2 ou 3 mg.l-1 de 2,4-D parmi lesquels 30 se développent en embryons somatiques bipolaires (Tableau 2). Chez V. paradoxa, la combinaison BAP/2,4-D de 0,5/2 est la plus réactive, elle permet d’obtenir 62,1 % de cals qui différencient les embryons. Un nombre moyen maximal de 27 embryons somatiques par cal est obtenu avec cette combinaison parmi lesquels 18,1 embryons se développent en embryons somatiques bipolaires (Tableau 3). Toute autre concentration de 2,4-D ou autre combinaison de BAP/2,4-D testée sur les cals chez les deux espèces n’a donné que des résultats significativement inférieurs à ces valeurs.
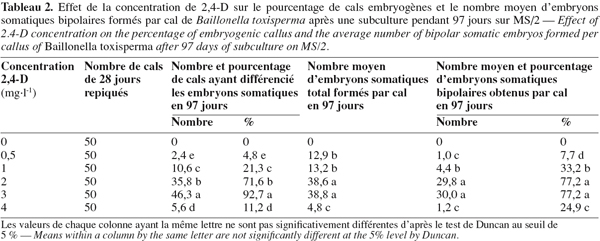
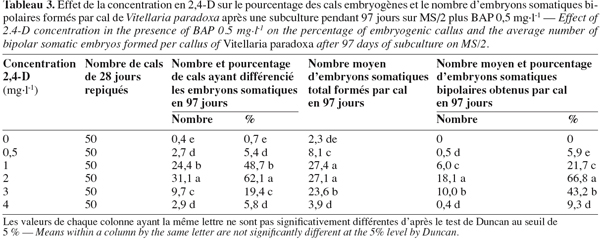
9Nonante-sept jours après repiquage des cals, les nodules (ne) présents sur les cals embryogènes des deux espèces (Figure 1A, 1B) se sont développés en embryons somatiques bipolaires (es). Ces embryons se présentent en amas de sept à dix chez B. toxisperma et sont allongés (Figure 1C) et en amas de trois à cinq chez V. paradoxa et sont globoïdes (Figure 1D). L’étude histologique des cals embryogènes montre que la formation des embryons somatiques bipolaires commence par la mise en place des amas de cellules organisées en nodules (ne). Les cellules nodulaires se divisent activement chez les deux espèces (Figure 1E), puis s’épidermisent et augmentent de dimension pour devenir des embryons dont chacun présente un pôle apical (pa) et un pôle radiculaire (pr) (Figure 1F). Les pourcentages maxima des embryons bipolaires ainsi différenciés à partir des nodules présents sur les cals sont respectivement de 77,2 % en présence de 2 ou 3 mg.l-1 de 2,4-D chez B. toxisperma (Tableau 2) et de 66,8 % en présence de la combinaison BAP/2,4-D de 0,5/2 chez V. paradoxa (Tableau 3).
4. Discussion
10La callogenèse et la différenciation des embryons somatiques sur les cals chez B. toxisperma et V. paradoxa varient en fonction de la nature et/ou de la concentration des phytohormones utilisées. Chez ces deux espèces les cals se forment surtout lorsque le 2,4-D est associé à la BAP dans les milieux de culture. Cette association fait penser à un effet synergique et/ou complémentaire des auxines et des cytokinines sur l’organogenèse en général et la callogenèse en particulier chez ces deux espèces. En effet, cet effet complémentaire sur la callogenèse a déjà été démontré chez d’autres espèces ligneuses telles que Quercus suber (Noronha et al., 1992), Mangifera indica (Litz et al., 1998), Citrus grandis (Huang et al., 2002). Les meilleurs pourcentages de callogenèse (75,2 % et 87,3 %) sont obtenus avec les combinaisons BAP/2,4-D de 0,5/0,5 et 0,5/3 respectivement chez B. toxisperma et V. paradoxa. Ces résultats sont similaires à ceux obtenus par Oumar et al. (2001) chez Irvingia gabonensis et Irvingia wombulu, à partir des fragments de feuille cultivés sur MS contenant respectivement 1/2 et 1/3 mg.l-1 BAP/2,4-D. Par contre, Herman et al. (1975) et Hatanaka et al. (1999) ont obtenu des pourcentages de callogenèse de 91,3 % et 97,1 % respectivement avec les fragments de feuille de Coffea arabica et Coffea caneffora cultivés sur MS/2 enrichi presque avec les mêmes combinaisons BAP/2,4-D. Fotso et al. (2002) ont obtenu avec les explants de Cola anomala et Cola acuminata cultivés dans les mêmes conditions, des pourcentages de callogenèse (21,4 % et 32,7 % respectivement) significativement inférieurs à ceux obtenus chez les deux Sapotacées. Ainsi, en culture in vitro, en plus de la nature et de la concentration des phytohormones utilisées, l’espèce végétale est l’un des facteurs à prendre en considération. Elle serait liée au facteur génétique pouvant déterminer le comportement des explants mis en culture (Zrÿd, 1988). La différenciation et le développement des embryons somatiques sur les cals sont observés après 97 jours chez les deux espèces. Chez B. toxisperma, ces processus sont obtenus en présence de 2,4-D uniquement. L’importance de 2,4-D dans la formation des embryons somatiques est déjà démontrée chez plusieurs espèces ligneuses telles que Hevea brasiliensis (Cailou et al., 1996), Ricinodendron heudelotii (Donfagsiteli, 2002). Cette auxine à 3 mg.l-1 a permis d’obtenir un maximum de 92,7 % de cals qui forment les embryons somatiques avec en moyenne 38 embryons par cal dont 30 bipolaires. Des résultats semblables ont été obtenus par De Wald et al. (1993) chez Mangifera spp., Cailou et al. (1996) chez Hevea brasiliensis et par Niemenak (1998) chez Theobroma cacao. En revanche, Jayanthi et al. (2001) ont montré que chez Tylophora indica, le 2,4-D utilisé seul inhibe la formation des embryons somatiques sur cals, mais lorsqu’il est associé à la BAP ou à la kinétine (0,5 à 3 mg.l-1), on obtient jusqu’à 70 % de cals qui forment les embryons avec en moyenne 61 ± 3 embryons par cal. De même, dans les résultats de ce travail, ce sont les combinaisons BAP/2,4-D qui favorisent la formation des embryons somatiques sur les cals de V. paradoxa. Les meilleurs résultats sont obtenus avec la combinaison 0,5/2 qui a permis à 62,1 % de cals de former les embryons somatiques avec un nombre moyen maximum de 27 embryons par cal dont 18,1 bipolaires. Des résultats similaires ont été obtenus par Von Arnold et al. (1996) chez Picea abies, mais plutôt avec des combinaisons kinétine/2,4-D de 0,5/1 et 0,5/2 et après ajout de 1 mg.l-1 de charbon actif dans les milieux de culture. En revanche, Sanonne (2003) a obtenu dans les mêmes conditions des résultats relativement inférieurs (57,8 % de cals embryogènes et 22 embryons par cal dont 4,3 bipolaires) avec les cals de B. toxisperma subcultivés sur les milieux identiques. Chez les deux Sapotacées, bien que la formation des embryons somatiques soit favorisée différemment (2,4-D chez B. toxisperma et par les combinaisons BAP/2,4-D chez V. paradoxa), leur développement commence par la mise en place des nodules embryonnaires, suivi de la division active des cellules nodulaires qui finissent par s’épidermiser afin de mettre en place des embryons à structure bipolaire. Ainsi, chez ces deux espèces, la nature et la concentration des phytohormones utilisées influenceraient beaucoup plus l’induction des embryons sans effet significatif sur leur développement. De telles observations ont été notées chez d’autres espèces végétales telles que Elaeis guineensis (Rival et al., 1998), Dactylis glomerata (Somleva et al., 2000). Ces auteurs ont d’ailleurs obtenu un bon développement des embryons somatiques après leur induction et une subculture sur un milieu de base (MS) sans phytohormone. Alexandro et al. (2002) et Ansaldi (2002) ont montré que ce développement serait étroitement lié aux facteurs génétiques propres à ces embryons.
5. Conclusion
11Chez B. toxisperma et V. paradoxa, la callogenèse n’est pas influencée par la nature des phytohormones utilisées, mais plutôt par leur concentration dans les milieux de culture. Par contre, l’induction et la prolifération des embryons somatiques sur les cals sont fortement influencées par la nature et la concentration des phytohormones utilisées. Le 2,4-D étant favorable sur ces processus chez B. toxisperma alors que ce sont les combinaisons BAP/2,4-D qui sont favorables sur ces derniers chez V. paradoxa. En revanche, chez les deux espèces, les différentes étapes de développement des embryons somatiques induits semblent ne pas être influencées par les phytohormones. Au vu du nombre moyen maximal d’embryons somatiques induits par cal chez B. toxisperma et V. paradoxa (38 avec 2 ou 3 mg.l-1 de 2,4-D et 27 avec 0,5/1 et 0,5/2 de BAP/2,4-D respectivement) et au vu des pourcentages respectifs des embryons somatiques bipolaires obtenus (77,2 % et 66,8 %), la méthode de différenciation des embryons somatiques et le développement de plus de 60 % de ces embryons en embryons bipolaires ouvre une nouvelle voie probable pour la propagation de ces deux espèces de Sapotacées. Mais une étude approfondie reste à faire, notamment en ce qui concerne le développement des embryons bipolaires en plantules viables.
Bibliographie
Abbiw D.K., 1990. Useful plants of Ghana: West African uses of wild and cultivate plants. London: Intermitate Technology Publication; Kew, UK: The Royal Botanic Gardens.
Alemano L., Berthouly M. & Michaux-Ferrière N., 2001. Histology of somatic embryogenesis from floral tissues Cacao. Plant Cell Tissue Org. Cult., 46, 187-194.
Alexandro K.S. & Conger B.V., 2002. Isolation of two somatic embryogenesis related genes from Dactylis glomerata. Plant Sci., 162, 301-307.
Ansaldi C., 2002. Recherche de descripteurs des phases précoces de l’embryogenèse somatique chez le café. Mémoire : Université Paul Sabatier de Toulouse (France).
Blanc G., 1999. Rôles de l’apport glucidique sur les étapes précoces de l’embryogenèse somatique des cals d’Hevea brasiliensis (Müll Arg.). Thèse de doctorat : Université des Sciences et Techniques du Languedoc, Montpellier II (France).
Blanc G., Mati A., Jacob J. & Carron M.P., 2002. Differential carbohydrate metabolism conducts morphogenesis in embryogenic callus of Hevea brasiliensis (Müll Arg.). J. Exp. Bot., 53, 1453-1462.
Cailou F., Julien-Guerrier J., Linossier L. & Coudret A., 1996. Long-term somatic embryogenesis and maturation of somatic embryo in Hevea brasiliensis. Plant Sci., 120, 185-196.
De Wald S.G., Lithz R.E. & Moore G.A, 1993. Optimizing somatic embryo production in Mango. J. Amer. Soc. Hort. Sci., 114, 712-716.
Debroux L., 1998. L’aménagement des forêts tropicales fondées sur la gestion des populations d’arbres : l’exemple du Moabi (Baillonella toxisperma) dans la forêt du Dja, Cameroun. Thèse de doctorat : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Donfagsiteli T.N., 2002. Potentialité de régénération in vitro chez Ricinodendron heudelotii à partir des fragments d’organe. Mémoire : Université de Yaoundé I (Cameroun).
Dos Santos & Silviera C.E., 1994. Bouturage et microbouturage de Fraxinus excelsior L., aspects morphogénétique et cytophysiologique. Thèse de doctorat : Université de Paris IV (France).
Duhoux E., 1988. Organogenèse et multiplication végétative chez les arbres. In : Zrÿd J.P. Culture des cellules, tissus et organes végétaux. Fondements théoriques et utilisations pratiques. Lausanne, Suisse : Presses Polytechniques Romandes.
Fotso, 2005. Organogenèse in vitro de quelques espèces forestières à usages multiples. Thèse de doctorat : Université de Yaoundé I (Cameroun).
Fotso, Omokolo N.D. & Mbouna D., 2002. Comparaison de l’aptitude à la régénération in vitro de deux kolatiers Cola anomala et Cola acuminata. Cah. Agric., 11, 355-360.
Gaméné C.S., Pritchard H.W. & Daws M., 2003. Effects of desiccation and storage on Vitellaria paradoxa seed viability. In: Sacand M., Joeker D., Dulloo M.E. & Thomsen K.A., eds. Comparative biology of tropical trees seeds. Roma: IPGRI, 36-89.
Gaméné C.S., Druart P.H. & du Jardin P., 2004. Résultats préliminaires d’essais de mise en culture in vitro de Vitellaria paradoxa (le karité). In : Actes des IXe journées scientifiques-AUF-Lomé, Togo, 4-7 octobre 2004. Lomé (Togo) : Agence Universitaire de la Francophonie (AUF), 65-70.
Hatanaka T., Choi Y.E., Kusano T. & Sano H., 1999. Transgenic plants of Coffea canephora from embryogenic callus via Agrobacterium Tumefaciens mediated transformation. Plant Cell Rep., 19, 106-110.
Herman E.B. & Haas G.J., 1975. Clonal propagation of Coffea Arabica L. from callus culture. J. Hortic. Sci., 10, 588-589.
Huang T. et al., 2002. Plant regeneration from leaf-derived callus in Citrus grandis (Pummelo): effects of auxins in callus induction medium. Plant Cell Tissue Organ Cult., 69, 141-146.
Jayanthi M. & Mandal P.K., 2001. Plant regeneration through somatic embryogenesis and RAPD analysis of regenerated plants in Tylophora indica. In vitro Cell. Dev. Biol., 37, 576-580.
Leakey R.R.B. & Coutts M.P., 1989. The dynamics of rooting in Triplochiton scleroxylon cuttings: their relation to leaf area, node position, dry weight accumulation, leaf water potential and carbohydrate composition. Tree Physiol., 5, 135-146.
Litz R.E., Hendrix R.C., Moon P.A. & Chavez V.M., 1998. Induction of embryogenic Mango cultures as affected by genotype explanting, 2,4-D and embryogenic nurse culture. Plant Cell Tissue Organ Cult., 53, 13-18.
Morel G. & Wetmore R.H., 1951. Fern callus tissues culture. Amer. J. Bot., 38, 141-143.
Murashige T. & Skoog F., 1962. A revised medium for rapid growth and bioassay with tobacco tissue culture. Physiol. Plant, 15, 473-492.
Niemenak N., 1998. Etude histologique et biochimique de la callogenèse et de l’embryogenèse somatique in vitro chez Théobroma cacao L. Thèse de doctorat : Université de Yaoundé I (Cameroun).
Noronha C., Romano & Martin-Lauçâo M.A., 1992. Influence of growth regulators on shoot proliferation in Quercus suber L. Ann. Bot., 70, 513-536.
OIBT, 1995. Elements for the annual review and assessment of the world tropical timber situation. Draft Document.
Oumar, Fotso & Omokolo N.D., 2001. Données préliminaires sur la morphogenèse in vitro chez Irvingia gabonensis et Irvingia wombulu. In : Actes du VIIIe séminaire internationnal sur les biosciences et amélioration de la production végétale, 17- 19 décembre 2001, Yaoundé, Cameroun. Yaoundé : Presse universitaire UYI, 173-177.
Rival A. et al., 1998. Multiplication clonale du palmier à huile par embryogenèse somatique (Elaeis guineensis Jacq.). Cah. Agric., 7, 492-498.
Sanonne, 2003. Effet du saccharose, des auxines et des cytokinines sur l’embryogenèse somatique chez Baillonella toxisperma (Sapotacée). Mémoire : Université de Yaoundé I (Cameroun).
Schneeman J., 1995. Exploitation of moabi in the humid dense forests of Cameroon. Harmonization and improvement of two conflicting ways of exploitation of the same forest resource. Bos Newsl., 14(2), 20-32.
Shiembo P.N., Newton A.C. & Leakey R.R.B., 1996. Vegetative propagation of Irvingia gabonensis, a West Africa fruit tree. Forest Ecol. Manage., 87, 185-192.
Shiembo P.N., Newton A.C. & Leakey R.R.B., 1997. Vegetative propagation of Ricinodendron heudelotii, a West Africa fruit tree. J. Trop. Forest Sci., 9(4), 514-525.
Somleva M.N., Schmidts E.D.L. & De Vries S.C., 2000. Embryogenic cells in Dactylis glomerata L. explants identified by cell tracking and SERK expression. Plant Cell Rep., 19, 718-726.
Vivien J. & Faure J.J., 1985. Arbres des forêts denses d’Afrique Centrale. Paris : Agence de Coopération Culturelle et Technique (ACCT).
Von Arnold S., Chapham D., Egrestsdotter U. & Mo L.H., 1996. Somatic embryogenesis in conifers, a case study of induction and development of somatic embryos in Picea abies. Rev. Plant Growth Regul., 20, 3-9.
White F., 1983. The vegetation of Africa. A descriptive memoir to accompany the UNESCO/AETFAT/UNSO vegetation map of Africa. Paris: UNESCO.
Youmbi E., 2000. Potentialité de régénération in vitro du noeud cotylédonaire chez Dacryodes edulis. Fruits, 55(6), 409-419.
Zhijian L.I., Aboulaye J., Siela M. & Guiltiman M.J., 1998. Somatic embryogenesis and plant regeneration from floral explants of cacao (Theobroma cacao L.). In Vitro Cell. Dev. Biol. Plant, 34, 239-249.
Zrÿd J.P., 1988. Culture de cellules, tissus et organes végétaux. Fondements théoriques et utilisations pratiques. Lausanne, Suisse : Presses Polytechniques Romandes.
Para citar este artículo
Acerca de: Fotso
Ecole normale supérieure. Laboratoire de Physiologie végétale. BP 47. CAM-Yaoundé (Cameroun). E-mail : fotsober@yahoo.fr
Acerca de: Sanonne
Ecole normale supérieure. Laboratoire de Physiologie végétale. BP 47. CAM-Yaoundé (Cameroun).
Acerca de: Denis Omokolo Ndoumou
Ecole normale supérieure. Laboratoire de Physiologie végétale. BP 47. CAM-Yaoundé (Cameroun).
Acerca de: Néhémie Donfagsiteli Tchinda
Institut de Recherches médicales et d’Etudes des Plantes médicinales (IMPM). BP 6113. CAM-Yaoundé (Cameroun).






