- Startpagina tijdschrift
- volume 12 (2008)
- numéro 3
- Effet du sucre sur l'embryogenèse somatique de l'olivier (Olea europaea L.) cv. ' Picholine marocaine '
Weergave(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Effet du sucre sur l'embryogenèse somatique de l'olivier (Olea europaea L.) cv. ' Picholine marocaine '

Nota's van de redactie
Reçu le 22 mai 2006, accepté le 15 janvier 2008.
Résumé
L'embryogenèse somatique de l'olivier (Olea europaea L.) variété ' Picholine marocaine ' est peu étudiée malgré son importance pour le Maroc. Nos travaux ont cherché à comprendre et à étudier les effets du type et de la concentration de sucre sur l'induction et le développement des embryons somatiques chez ce cultivar. La régénération de plants d'olivier par embryogenèse somatique a été réalisée à partir de fragments de cotylédons. L'initiation des cals embryogènes qui sont nodulaires et compacts a lieu dans un milieu de culture contenant 0,5 mg.l-1 de zéatine et 2 mg.l-1 d'ANA. Le saccharose a été testé aux concentrations de 20, 30, 60 et 90 g.l-1. Le saccharose a été aussi comparé au mannitol et au sorbitol. L'induction des cals a été influencée significativement (P < 0,001) par le type de sucre utilisé. Les meilleurs résultats ont été obtenus en présence du mannitol (90,6 %). Par ailleurs, le saccharose s'est distingué (P < 0,001) en phase de développement et le niveau de régénération de plantules par embryogenèse somatique a atteint 37 %. La concentration de 30 g.l-1 du saccharose a significativement amélioré l'induction des cals embryogéniques et a favorisé la meilleure régénération des plantules d'olivier. Aucune morphogenèse n'a été obtenue dans le cas du sorbitol. L'embryogenèse somatique semble pouvoir constituer une source intéressante pour la micropropagation de l'olivier au Maroc.
Abstract
Effect of sugar on somatic embryogenesis of olive tree (Olea europaea L.) cv ' Moroccan Picholine '. The somatic embryogenesis of the olive tree cv ' Moroccan Picholine ' has been until now very little studied, in spite of its importance for Morocco.Thus, our work aimed to study the effects of type and concentrations of sugar on the induction and the development of somatic embryos of this variety. Regeneration of olive plants via somatic embryogenesis has been achieved from cotyledon fragments. Embryogenic, nodular and compact calli have been induced on media supplemented with 0.5 mg.l-1 zeatin and 2 mg.l-1 NAA and different types of sugar as mannitol, saccharose and sorbitol and different saccharose concentrations (20, 30, 60 and 90 g.l-1). The highest percentage of callus induction (P < 0.001) was observed with mannitol (90.6%). Up to 37% somatic embryogenesis was obtained in the case of saccharose (P < 0.001). The best callus induction was obtained in presence of 30 g.l-1 saccharose. This concentration was the best for olive plantlets regeneration. No morphogenesis was obtained with sorbitol. Somatic embryogenesis seems to be able to constitute an interesting source of micropropagation of olive tree in Morocco.
Inhoudstafel
1. Introduction
1La synthèse des études faites sur la micropropagation de l'olivier montre clairement que les travaux réalisés restent encore limités et que l'optimisation de l'efficience du système demeure (Cimato, 1999). Le recours à d'autres moyens de production de plants permettant de satisfaire le besoin national s'avère nécessaire.
2L'embryogenèse somatique, avantageuse surtout sur le plan rapidité et coût de production, présente un intérêt certain pour les ligneux. Les résultats obtenus chez l'olivier jusqu'à présent laissent présager un avenir prometteur pour certains cultivars, notamment ' Dolce agogia ', ' Leccino ', ' Frantoio ' et ' Moraiolo ' (Rugini, 1988), ' Canino ' (Lambardi et al., 1995 ; Rugini et al., 1995) et chez l'olivier sauvage var. ' sylvestris ' (Orinos et al., 1991). Cependant, il reste à développer certains aspects, en particulier les besoins nutritifs et hormonaux de l'embryon, de même que les conditions de survie et de développement des plantules issues de ces embryons.
3L'objectif de cette recherche est l'étude des possibilités d'embryogenèse somatique d'olivier cultivar ' Picholine marocaine ', le cultivar le plus important au Maroc et qui n'a bénéficié que de quelques travaux (Brhadda et al., 1999 ; Brhadda et al., 2003a ; 2003b ; Abousalim et al., 2005). Chez ce cultivar, les facteurs contrôlant la germination in vitro des embryons zygotiques ont été étudiés (Brhadda et al., 2000) et une organogenèse indirecte a été induite à partir de fragments de cotylédons (Brhadda et al., 2002). En conséquence, nos travaux ont cherché à étudier l'effet de trois sucres appropriés et leur influence sur l'induction des cals embryogènes. Ont été étudiés aussi les effets de la concentration de saccharose respectivement dans la phase d'induction et de développement des embryons somatiques en plantules.
2. Matériel et méthodes
2.1. Source d'explants et désinfection
4Les graines du cv. ' Picholine marocaine ' ont été désinfectées pendant 2 minutes avec l'éthanol à 70 % puis trempées, durant 15 minutes, dans une solution d'hypochlorite de sodium (concencentré à 12 %) additionnée de 2 à 3 gouttes de Tween 20. Enfin, elles ont été rincées 3 à 4 fois avec de l'eau distillée stérile et imbibées sur du papier filtre stérile en boîtes de Pétri pendant 24 heures à une température de 25 ± 2 °C à l'obscurité. L'imbibition des graines permet une séparation aisée de l'embryon et des cotylédons. Seuls les cotylédons entiers sont mis en culture.
2.2. Milieux et conditions de culture.
5Phase d'induction des cals. Le milieu de culture utilisé pour la phase d'induction des cals est le milieu MS (Murashige & Skoog, 1962) additionné d'ANA à la concentration 2 mg.l-1, concentration choisie sur base d'essais préliminaires. Dans un premier essai, le saccharose, le sorbitol et le mannitol, utilisés comme source d'hydrate de carbone à 30 g.l-1, sont comparés. Dans un second essai, 4 concentrations de saccharose ont été éprouvées, à savoir 20, 30, 60 et 90 g.l-1. Après ajustement du pH à 5,8, tous les milieux de culture sont solidifiés par 8 g.l-1 d'agar (Bactériologique, Difco) et l'autoclavage a lieu pendant 20 minutes à 121 °C. Pour cette phase, les milieux de culture sont répartis dans des boîtes de Pétri contenant 20 ml de milieu par boîte. Les cultures sont maintenues à l'obscurité à 25 ± 2 °C pendant 6 semaines.
6Phases de développement et de régénération. Après 6 semaines dans le milieu d'induction, les cals obtenus sont transférés dans le milieu de développement, soit le milieu MS contenant uniquement 0,5 mg.l-1 de zéatine (Sigma). Ceci afin de favoriser le développement des embryons somatiques à partir de cals et par la suite leur régénération en plantules. Au stade régénération, les explants sont transférés dans des tubes à essai contenant 15 ml des milieux de culture avec soit les trois types de sucre (essai 1), soit les différentes concentrations de saccharose (essai 2). Les phases de développement et de régénération des plantules ont lieu à la lumière sous une photopériode de 16 heures et une intensité lumineuse de 3 000 lux. La température est maintenue à 25 ± 2 °C.
7Un total de 20 explants par traitement est considéré et chaque expérience est répétée 5 fois, le nombre total d'explants par traitement est donc de 100. Lorsque les plantules somatiques obtenues présentent des racines bien développées et un minimum de deux feuilles, elles sont repiquées dans des pots contenant un substrat composé de tourbe, de sable et de vermiculite (1/0, 5/1 ; V/V/V), préalablement autoclavé pendant 60 min. L'acclimatation a lieu sous serre vitrée en conditions environnementales contrôlées.
2.3. Analyses statistiques
8Les données obtenues ont subi une analyse de la variance à deux critères. Un dispositif complètement aléatoire a été adopté et 100 explants ont été utilisés par traitement. Les pourcentages zéro ont subi la transformation (1/4 n), n étant le nombre d'explants mis en culture. Le test de Newman & Keuls (Dagnelie, 1980) au seuil de 5 % a été adopté pour classer les valeurs moyennes des facteurs étudiés.
3. Résultats
3.1. Effet du type de sucre
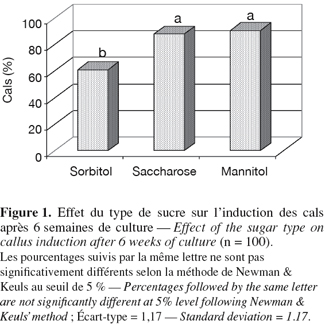
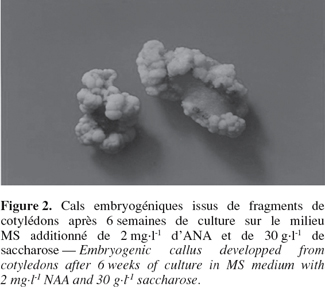
9Induction des cals. L'induction des cals a été affectée significativement (P ≤ 0,001) par le type de sucre. Le mannitol et le saccharose ont permis d'obtenir la meilleure induction (90,6 % et 88 %, respectivement), ils sont suivis par le sorbitol (61 %) (Figure 1). Au cours de la phase d'induction qui s'est prolongée durant 6 semaines, on a obtenu deux types de cals. Le premier type qui apparaît après 4 semaines de culture est friable, translucide, beige ou brun. Ce type de cal est non embryogénique. Le deuxième type de cal apparaît après 4 à 6 semaines ; il est compact à structure irrégulière, vert ou blanchâtre, à surface nodulaire (Figure 2). Ce type de cal est embryogénique. Le saccharose et le mannitol ont permis d'obtenir les cals les plus développés (environ 2 à 3,5 cm de surface) ; ces cals sont nodulaires et compacts. Le sorbitol a, par contre, produit des cals de petite taille (1 à 1,5 cm) dont certains sont friables et d'autres compacts, présentant des globules isolés.
10Développement des embryons somatiques et régénération de plantules. La régénération de plantules par embryogenèse somatique est de 37 % dans le cas du saccharose, suivi par le mannitol (29 %). Aucune régénération n'a été notée dans le cas du sorbitol. Dans ce dernier cas, au niveau des quelques globules formés, les cals compacts n'ont pas évolué. La différence observée entre les types de sucre est significative (P ≤ 0,001) (Figure 3). Il est à signaler qu'une induction de racines a aussi été notée dans le cas du saccharose (50 %) et du mannitol (41 %). Le saccharose a permis la meilleure régénération de plantules, donc on a pensé utile d'étudier l'effet de la concentration de ce sucre dans un deuxième essai.

3.2. Effet de la concentration de saccharose
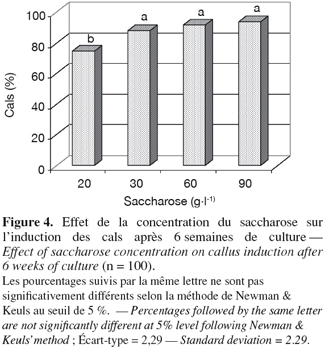
11Induction de cals. L'induction des cals est améliorée significativement (P ≤ 0,001) par l'utilisation du saccharose à des concentrations dépassant 20 g.l-1. Aucune différence significative n'est notée entre les concentrations 30, 60 et 90 g.l-1 (Figure 4).
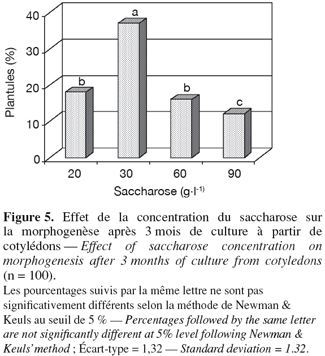
12Développement des embryons somatiques et régénération de plantules. La concentration de saccharose a affecté significativement (P ≤ 0,001) le développement des embryons somatiques et par la suite leur régénération en plantules. L'addition de 30 g.l-1 est le niveau optimal de régénération, soit 37 %. Dans les autres cas, les résultats ont varié entre 12 et 18 % (Figure 5). Il est à noter que des racines ont également été obtenues, surtout dans les milieux contenant 30 et 60 g.l-1 de sucre (50 % et 45 %, respectivement). En général, on observe 2 à 3 racines très minces par plantule et ayant une longueur moyenne variant de 0,2 à 2 cm.
4. Discussion
13Parmi les différentes sources de carbone intervenant dans la différenciation et dans l'ajustement osmotique, le saccharose reste la source la plus communément utilisée en culture in vitro. En effet, à travers son interaction avec les régulateurs de croissance, le contenu en saccharose du milieu de culture affecte la croissance du cal et par la suite, l'embryogenèse somatique (Button, 1978 ; Ozias et al., 1983 ; Rugini, 1995).
14Compte-tenu des résultats acquis, les explants initiaux cultivés in vitro peuvent produire des embryons somatiques. Un tel protocole peut être utile dans la recherche de la variation somaclonale et dans les études de la transformation génétique. L'étude histologique a confirmé l'obtention d'embryons somatiques à partir de cals chez la ' Picholine marocaine ' (Brhadda et al., 2007).
15La production d'embryons somatiques d'olivier cv. ' Picholine marocaine ' a été obtenue sur les milieux de culture contenant du saccharose ou du mannitol en phase d'induction et de développement. La meilleure régénération de plantules est obtenue en présence de saccharose. Aucune régénération de plantules n'est notée dans le cas du sorbitol. Rugini (1995) a trouvé que l'augmentation de l'osmolarité par le sorbitol inhibe la germination des embryons somatiques chez certains cultivars d'olivier tels que ' Dolce agogia '. Chez d'autres espèces comme le pêcher, le glucose ou le sorbitol ont donné de meilleurs résultats que le fructose et le saccharose (Declerck et al., 1986). Chez le céleri aussi, le mannitol améliore la différenciation normale des embryons somatiques et favorise la formation d'embryons secondaires (Unnikrishnan et al., 1990). Ceci traduirait des affinités spécifiques pour un type donné de sucre.
16Chez le riz, le mannitol a inhibé la régénération des plantules à partir des suspensions cellulaires, alors que le sorbitol a été nécessaire lors de cette phase de culture. Cet effet opposé des deux osmoticums sur la régénération suggère que le sorbitol est plutôt physiologiquement qu'osmotiquement actif (Tsukahara et al., 1996).
17L'augmentation de la concentration de saccharose dans le milieu jusqu'a 90 g.l-1 a été accompagnée d'une amélioration de l'induction des cals. Cependant, la concentration de 30 g.l-1 reste optimale pour le développement ultérieur d'embryons somatiques et la régénération de plantules.
18La concentration de sucre généralement utilisée pour l'induction et le développement des embryons somatiques chez plusieurs espèces telles que la laitue (Han et al., 1989) et le rosier (Rout et al., 1991) est de 20 à 30 g.l-1. D'autres auteurs ont rapporté que des concentrations élevées de saccharose peuvent avoir des effets négatifs sur la formation des embryons comme dans le cas du géranium où les concentrations 6, 9 ou 12 % empêchent la formation d'embryons somatiques (Gill et al., 1993). Par ailleurs, chez d'autres espèces, l'induction et le développement des embryons somatiques nécessitent un taux élevé de saccharose tels que chez l'asperge (5 %) (Komura et al., 1990) et le chrysanthème (12-18 %) (May et al., 1991).
19L'augmentation de la fréquence de l'induction des cals embryogènes comme chez le maïs (Miao, 1980) ainsi que de la fréquence et de la longévité de la régénération des plantules à partir de cals comme chez le riz (Kavi-Kishor, 1987), a été attribuée au potentiel osmotique élevé du milieu de culture.
20Li et al. (1998) affirment que la combinaison du maltose et de polyéthylène glycol est plus efficace dans la maturation de l'embryon somatique que celle du saccharose et du polyéthylène glycol chez Pinus teada.
21Sur les milieux sans régulateur de croissance, on note une absence totale d'embryons somatiques. Chez d'autres cultivars d'olivier comme ' Dolce agogia ', ' Leccino ', ' Moraiolo ' et ' Frantoio ', Rugini (1988) a obtenu 10 % d'embryons somatiques à partir d'embryons zygotiques immatures cultivés sur le milieu ½ MS sans régulateurs de croissance. L'inconvénient de ce protocole réside dans le fait que les embryons immatures ne sont disponibles que pendant une courte période de l'année. L'utilisation des cotylédons permet de travailler tout au long de l'année.
22Les plantules obtenues sont morphologiquement identiques aux plantes mères et à croissance normale dans la serre. Par ailleurs, le transfert des plantules régénérées de la culture in vitro au sol présente souvent un échec et une difficulté due à la fragilité des vitroplants (Brhadda et al., 2007).
Bibliographie
Abousalim A., Brhadda N. & Walali L.D.M., 2005. Essais de prolifération et d'enracinement de matériel issu de rajeunissement par bouturage d'oliviers adultes (Olea europaea L.) et de germination in vitro : effets de cytokinines et d'auxines. Biotechnol. Agron. Soc. Environ., 9(4), 237-240.
Brhadda N., Walali L.D.M. & Abousalim A., 1999. Rhizogenèse et régénération in vitro de plantules d'olivier (Olea europaea L.) variété ' Picholine marocaine '. In: Actes du séminaire international sur les innovations scientifiques et leur application en oléiculture et oléotechnie, 10-12 mars 1999, Conseil Oléicole International, Florence, Italie, 1-10.
Brhadda N., Walali L.D.M., Abousalim A. & Benali D., 2000. Effet de la température et de l'endosperme sur la dormance et la germination des embryons d'olivier (Olea europaea L.) variété ' Picholine marocaine '. Agronomie, 20, 643-653.
Brhadda N., Walali L.D.M. & Abousalim A., 2002. Etude de l'effet du type et de la concentration de cytokinines sur la prolifération de l'olivier (Olea europaea L.) cv. ' Picholine marocaine '. In : Actes des 8è Journées scientifiques, 7-9 Octobre 2002, AUF, Marrakech, 118-120.
Brhadda N., Abousalim A. & Walali L.D.M., 2003a. Effets du milieu de culture et de la lumière sur l'embryogenèse somatique de l'olivier (Olea europaea L.) cv. ' Picholine marocaine '. Fruits, 85(3), 1-14.
Brhadda N., Walali L.D.M., Abousalim A. & Benali D., 2003b. Effet du milieu de culture sur le microbouturage de l'olivier (Olea europaea L.) variété ' Picholine marocaine '. Biotechnol. Agron. Soc. Environ., 7(3-4), 177-182.
Brhadda N., Walali L.D.M. & Abousalim A., 2007. Etude histologique de l'embryogenèse somatique de l'olivier (Olea europaea L.) cv. ' Picholine marocaine '. Fruits, 62(2), 115-124.
Button J., 1978. The effects of some carbohydrates on the growth and organization of Citrus ovular callus. Z. Pflanzenphysiol., 88, 61-68.
Cimato A., 1999. Propagation et certification des plants. L'élevage des plants d'olivier en pépinière. In : Actes du séminaire international sur les innovations scientifiques et leur application en oléiculture et oléotechnie, 10-12 mars 1999, Conseil Oléicole International, Florence, Italie, 1-30.
Dagnelie P., 1980. Théorie et méthodes statistiques, application agronomique. Vol. 2. Gembloux, Belgique : Presses agronomiques de Gembloux.
Declerck V. & Korban S.S., 1986. Influence of growth regulators and carbon sources on callus induction growth and morphogenesis from leaf tissues of peach (Prunus persica L. Batsch). J. Hortic. Sci., 71(1), 49-50.
Gill G., Gerrath J.M. & Saxena P.K., 1993. High frequency direct somatic embryogenesis in thin layer cultures of hybrid seed geranium (Pelargonium x hortorum). Can. J. Bot., 71, 408-413.
Han H. & Xi T., 1989. Rapid propagation of lettuce by embryos. Plant Physiol. Commun., 2, 17-20.
Kavi-Kishor P.B., 1987. Energy and osmotic requirement for high frequency regeneration of rice plants from long-term cultures. Plant Sci., 48, 189-194.
Komura H., Chokyu S. & Ikeda Y., 1990. Micropropagation of Asparagus through somatic embryogenesis. 1. Somatic embryogenesis and plant regeneration from seedlings. Bull. Hiroshima Prefect. Agric. Exp. Stn, 53, 43-50.
Lambardi M., Capuana M., Sozzi L. & Giannini R., 1995. Factors affecting in vitro adventitious bud induction from excised embryos of Swiss stone pine (Pinus ombra L.). Forest Genet., 2, 49-58.
Li X.Y. & Huang F.H., 1998. Maltose enhances somatic embryogenesis. In vitro cellular and developmental biology. Plant, 34, 22-26.
May R.A. & Trigiano R.N., 1991. Somatic embryogenesis and plant regeneration from leaves of Dendranthema grandiflora. J. Am. Soc. Hortic. Sci., 116(2), 366-371.
Miao S.H., 1980. Effects of NH+4 on embryoid generation from pollens of maize. Acta Bot. Sin., 22(4), 356-359.
Murashige T. & Skoog F., 1962. A revised medium for rapid growth and bioassay with tobacco tissue culture. Physiol. Plant, 15, 473-492.
Orinos T. & Mitrakos K.,1991. Rhizogenesis and somatic embryogenesis in calli from wild olive (Olea europaea L.) var. ' sylvestris ' (Miller) mature zygotic embryos. Plant Cell Tissue Organ Cult., 27, 183-187.
Ozias Akins P. & Vasil I.K., 1983. Improved efficiency and normalisation of somatic embryogenesis in Triticum aestivum L. Protoplasma, 117, 40-44.
Rout G.R., Debata B.K. & Das P., 1991. Somatic embryogenesis in callus cultures of Rosa hybrida L. cv. ' Landora '. Plant Cell Tissue Organ Cult., 27(1), 65-69.
Rugini E., 1988. Somatic embryogenesis and plant regeneration in olive (Olea europaea L.). Plant Cell Tissue Organ Cult., 14, 207-214.
Rugini E., 1995. Somatic embryogenesis in olive (Olea europaea L.) In: Jain S., Gupta P. & Newton R., eds. Somatic embryogenesis in woody plants. 2. Dordrecht, The Netherlands: Kluwer Academic Publishers, 171-189.
Rugini E. & Cariccato G., 1995. Somatic embryogenesis and recevery from mature tissues of olive cultivars (Olea europaea L.) ' Canino ' and ' Maraiolo '. Plant Cell Rep., 14, 257-260.
Tsukahara M., Hirosawa T. & Kiskine S., 1996. Efficient plant regeneration from cell suspension cultures of rice (Oryza sativa L.). J. Plant Physiol., 149(1-2), 157-162.
Unnikrishnan S.K., Mehta A.R. & Bhatt P.N., 1990. Abscissic acid induced high frequency embryogenesis from Sapindus trifoliatus leaves. Acta Hortic., 280, 89-94.
Om dit artikel te citeren:
Over : Najiba Brhadda
Université Ibn Tofail. Faculté des Sciences. Laboratoire de Biodiversité et Ressources naturelles. Unité Agrophysiologie et Biotechnologie végétale. MA-Kenitra (Maroc). E-mail : brhadda@hotmail.com
Over : Dou Elmacane Walali Loudyi
Institut agronomique et vétérinaire Hassan II. Département d'Horticulture. Madinat Al Irfane. MA-Rabat (Maroc).
Over : Abdelhadi Abousalim
Institut agronomique et vétérinaire Hassan II. Département d'Horticulture. Madinat Al Irfane. MA-Rabat (Maroc).






