- Accueil
- volume 12 (2008)
- numéro 3
- Structure du bourgeon végétatif et relation avec le résultat de la croissance chez l'olivier (Olea europaea L.) : mise en évidence d'une préformation hivernale et estivale
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Structure du bourgeon végétatif et relation avec le résultat de la croissance chez l'olivier (Olea europaea L.) : mise en évidence d'une préformation hivernale et estivale

Notes de la rédaction
Reçu le 21 mai 2007, accepté le 13 novembre 2007
Résumé
Des bourgeons végétatifs d'olivier (Olea europaea L.) issus de la variété ' Chemlali ' prélevés à deux périodes du cycle de végétation de l'olivier (en arrêt de croissance hivernal et estival) chez trois types de rameaux (courts, moyens et longs) ont été observés et mesurés. Le présent travail a pour but de caractériser la structure des bourgeons en période d'arrêt de croissance et de comparer le contenu du bourgeon en primordiums foliaires durant l'arrêt de croissance et la structure du rameau futur à la fin des deux cycles de croissance. L'étude anatomique des bourgeons a permis de faire ressortir la zonation classique des bourgeons : le méristème apical ou axial, l'anneau initial ou zone latérale et le méristème médullaire. Toutes les coupes longitudinales des bourgeons terminaux, prélevés aussi bien avant le débourrement printanier qu'avant le départ automnal, montrent entre 3 à 4 paires d'ébauches foliaires distinctes soit une moyenne de 3,25 paires pour la première période et 3,80 pour la deuxième période. Le rameau est donc constitué de 6 à 7 paires de feuilles préformées. En comparant le contenu à l'intérieur des bourgeons en organes foliaires et la structure de la future pousse printanière et automnale, il apparaît que certaines pousses sont d'origine préformée constituées à l'intérieur du bourgeon quiescent en période hivernale ou estivale (préformation hivernale ou estivale) et d'autres rameaux montrant une préformation hivernale et estivale suivie d'une portion néoformée se développant après la reprise de la croissance au niveau des deux vagues de croissance printanière et automnale (néoformation printanière et automnale).
Abstract
Structure of the vegetative bud of olive tree and relation with the growth result (Olea europaea L.). Olive tree buds (Olea europaea L.) issued of the cultivar ' Chemlali ', were sampled and described on two periods of olive growth season (on winter rest and summer stop) and on different types of shoots (short, medium and long shoot). The aim of this study was to characterize the structural and anatomical aspects of olive buds during the stop of growth and to analyze the relationship between the bud content during the rest and the structure of the produced shoot on olive tree on the end of the two growth flushes. The anatomical study of buds showed the classic zonation of buds: central zone, lateral zone and medullar zone. The bud section showed a number of nodes exactly half of that were present due to the decussate phyllotaxis of the olive tree. All buds for all forms deducted before the spring bud break or before the autumnal flush, showed between 3 to 4 pairs of leaf primordia with an average of 3.25 pairs for winter bud and 3.80 for summer bud. In fact, they developed between 6 to 7 pairs of preformed leaves on the resulting shoot. To analyze the relationship between the bud content during the rest and the structure of the subsequently produced shoot, it appears that some shoots may be entirely preformed and another may consist of a preformed portion followed by a neoformed portion. These types of shoots contained preformed metameres before spring and autumnal growth (winter or summer preformation) and neoformed metameres formed and simultaneously expanded without bud formation after the preformed part (spring and autumnal neoformation).
Table des matières
1. Introduction
1L'olivier présente en conditions pluviales une croissance cyclique bi-modale à deux pics. Le premier pic débute en mars pour continuer jusqu'à début juin. La deuxième période de croissance intervient en septembre pour s'arrêter vers la fin du mois de novembre et est tributaire des réserves hydriques du sol, de la période thermique optimale et de l'abaissement de la température (Lavee, 1977 ; Poli, 1986 ; Bandino et al., 2001).
2La croissance primaire d'un rameau comprend deux processus fondamentaux : l'organogenèse et l'allongement (Champagnat et al., 1986). Ces deux processus peuvent avoir lieu en même temps, constituant ainsi la partie préformée où les ébauches foliaires se développent à l'intérieur du bourgeon avant son débourrement, ou décalés dans le temps correspondant à une portion de tige non présente à l'état d'ébauches dans le bourgeon qualifié de partie néoformée (Rivals, 1966 ; Caraglio et al., 1997). Le rameau peut être entièrement préformé (Sabatier et al., 2001 ; Sabatier et al., 2003), ou entièrement néoformé, phénomène décrit chez différentes espèces tropicales (Borchert, 1969) ou encore constitué d'une portion préformée suivie d'une partie néoformée, phénomène cité par différents auteurs chez différentes espèces (Costes, 1993 ; Souza et al., 2002 ; Gordon et al., 2006 ; Guédon et al., 2006). Le nombre de pièces foliaires préformées ou néoformées dépend de l'espèce, du stade de développement de la plante et de la position du rameau étudié (Davidson et al., 1984 ; Remphrey et al., 1984 ; Costes, 2003 ; Sabatier et al., 2003 ; Costes et al., 2006). Les bourgeons terminaux de l'olivier contiennent 4 à 7 paires de feuilles préformées (Rivals, 1966 ; Jankiewicz et al., 1973 ; Moundi, 1973 ; Villemur et al., 1978 ; Pinney et al., 1990).
3Le présent travail a pour objectif de décrire l'organogenèse du méristème terminal du rameau d'olivier à chaque arrêt de croissance végétative, de mesurer le bourgeon ainsi que les ébauches foliaires existantes à l'intérieur de ce dernier et enfin de préciser la nature préformée ou néoformée du résultat de la croissance printanière et automnale observée chez l'olivier en tenant compte du nombre d'ébauches foliaires formées dans le bourgeon avant chaque départ végétatif.
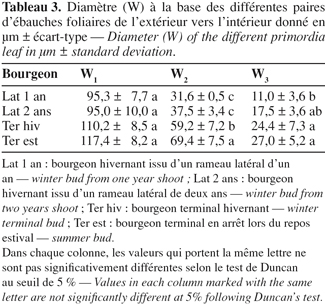
2. Matériel et méthodes
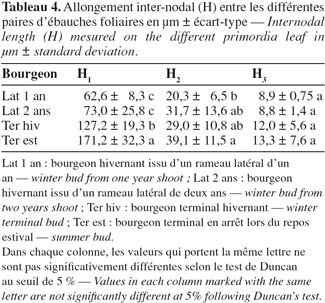
2.1. Matériel végétal
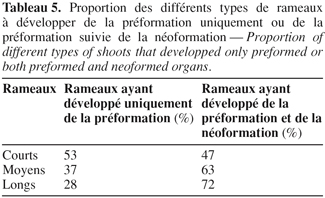
4Des échantillons de bourgeons sont prélevés sur des rameaux d'un an de la variété ' Chemlali '. Ce sont des rameaux développés durant la croissance végétative précédente c'est-à-dire âgés d'un an. Ces rameaux sont de trois types : des rameaux courts dont la longueur est inférieure à 20 cm, des rameaux moyens dont la longueur est comprise entre 20 et 50 cm et des rameaux longs dont la longueur est supérieure à 50 cm. Ces rameaux sont échantillonnés au hasard à raison de 20 rameaux pour chacun des types : rameaux courts (RC), moyens (RM) et longs (RL).
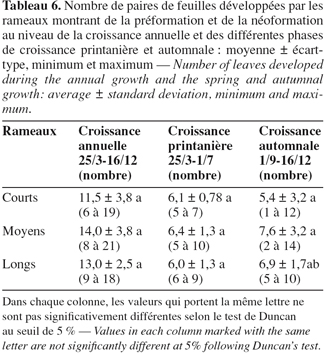
5Des bourgeons sont prélevés soit durant l'hiver vers le début du mois de mars (lors du repos inter-annuel) ou encore durant le repos estival soit vers la fin du mois d'août juste avant le départ en végétation ayant lieu en septembre (lors de l'arrêt de croissance intra-annuel). Pour être certains que ces bourgeons puissent donner une pousse, les bourgeons récoltés doivent montrer une apparence gonflée. Des bourgeons latéraux ont été aussi récoltés lors de l'arrêt de croissance hivernal. Une quinzaine de bourgeons sont récoltés pour chaque traitement (bourgeons hivernants, bourgeons estivaux, bourgeons hivernants latéraux d'un an et de deux ans). Des coupes histologiques ont été réalisées car la dissection sous loupe binoculaire s'est avérée difficile pour discerner les différentes pièces foliaires.
2.2. Préparation des bourgeons
6Des coupes histologiques longitudinales sont réalisées selon le protocole suivi par différents auteurs (De La Rosa, 2000 ; Msallem, 2002). Tous les bourgeons sont fixés dans le F.A.A. (Formol Acétique Alcool) selon la formule de Johansen (1940) [6,5 % (v/v) formol ; 2,5 % (v/v) acide acétique ; 91 % (v/v) éthanol dilué à 50 %]. Les échantillons sont ensuite déshydratés dans des solutions à titre croissant d’alcool (50 %, 70 % et 95 %) et puis dans trois bains d’alcool absolu pendant 12 heures chacun. Ils sont ensuite imprégnés dans des bains de paraffine fondue à volume croissant dont la durée de chacun est égale à 12 heures, jusqu’à un bain de paraffine pure d’une durée de 24 heures réalisé dans une étuve à paraffine. La mise en bloc est réalisée à l’aide des moules de barre de Leuckart. Après refroidissement, on obtient un bloc de paraffine renfermant un échantillon. Les coupes sont réalisées selon un plan passant par l’axe du bourgeon. Des coupes sériées de 10 à 12 µm d’épaisseur sont réalisées à l’aide d’un microtome rotatif. Les lames obtenues sont colorées par l’hémalun éosine et montées au microscope pour observation.
2.3. Mesures réalisées
7Une dizaine d'échantillons de chaque type de bourgeons (terminal hivernal, terminal estival, latéral d'un et de deux ans) ont été retenus. Les sections longitudinales de bourgeons sont observées et les nœuds sont comptés. Le nombre de nœuds est égal à la moitié du nombre réel de nœuds existant dans le bourgeon en raison de la phyllotaxie opposée décussée de l'olivier. Des mesures sont réalisées à l'aide d'un microscope relié à un système d'analyse par image (Win Dias-Li COOR) et ont porté sur la longueur des différentes paires d'ébauches foliaires (Figure 1), le diamètre basal des différentes paires d'ébauches (W1, W2 et W3) et enfin la longueur inter-nodale qui indique la distance séparant deux nœuds successifs (H1, H2 et H3).
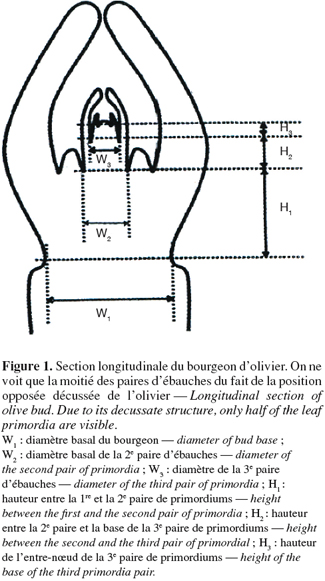
2.4. Analyse statistique
8Les différentes mesures réalisées au niveau des bourgeons sont comparées avec le test de Duncan à l'aide du logiciel SPSS (Version 10.0).
3. Résultats
3.1. Description morpho-histologique du bourgeon
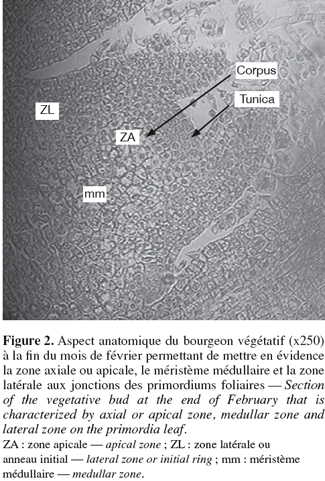
9L'apex du bourgeon végétatif apparaît large en forme de dôme montrant différentes parties (Figure 2) :
10– une zone apicale axiale constituée d'une tunica à 2 ou 3 couches de cellules alignées horizontalement et colorées avec un cytoplasme assez dense et des noyaux peu visibles et d'un corpus à cellules de formes diverses,
11– une zone latérale encore appelée anneau initial située sur les flancs du dôme, zone de division de manière à faire apparaître de façon séquencée et régulière des protubérances qui s'organiseront en ébauches ou primordiums foliaires, donc des centres générateurs multiples de feuilles. C'est une zone très active et très colorable. La fréquence des mitoses est plus élevée dans la zone latérale que dans la zone apicale,
12– un méristème médullaire ou zone sub-apicale, situé sous le dôme et plus précisément sous le corpus et entre les insertions des divers primordiums. Il est constitué de cellules plus ou moins aplaties alignées en files. Cette région est responsable de l'activité intercalaire responsable de l'allongement des entre-nœuds du rameau. Une importante activité cellulaire est observée (mérèse) suivie d'un grossissement des cellules (auxèse). Ces deux phénomènes sont responsables de l'élongation des pousses observées (Figure 2).
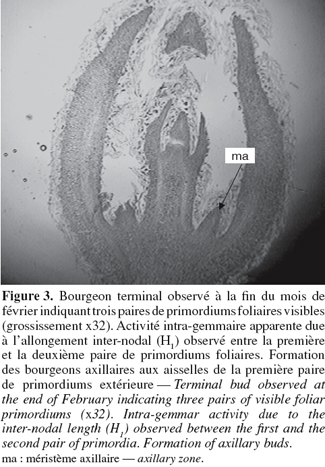
13A partir du mois de septembre, les primordiums foliaires se transforment en ébauches foliaires qui se différencieront progressivement en feuilles adultes par croissance et différenciation histologique (Figure 3). Des changements sont observés au niveau des zones méristématiques axillaires de la première paire d'ébauches foliaires extérieure indiquant la formation de bourgeons axillaires. A partir de fin février, le stade des trois nœuds est visible dans la totalité des bourgeons latéraux (Figure 3). Les bourgeons terminaux peuvent montrer entre 3 à 4 paires de primordiums et un début d'allongement inter-nodal central intra-gemmaire est observé. A partir de mi-mars, les feuilles externes s'ouvrent et la croissance inter-nodale extra-gemmaire commence.
3.2. Structure des bourgeons
14Les bourgeons de l'olivier ne possédant pas d'écailles, toutes les ébauches des feuilles se transformeront en feuilles normales. Les paires d'ébauches foliaires sont disposées par paires dans le bourgeon et sont disposées avec un angle de 90° entre elles afin que la deuxième se développe exactement au-dessus de la première. Cette disposition alternée des feuilles caractérise tous les types d'Olea europaea. Dans nos résultats, nous nous référons au nombre de nœuds et de paires d'ébauches différenciées sur les lames.
15Tous les bourgeons terminaux, prélevés aussi bien avant le débourrement printanier qu'avant le départ automnal, montrent entre 3 à 4 paires d'ébauches foliaires distinctes, soit une moyenne de 3,25 paires pour la première période et 3,80 pour la deuxième période. Les bourgeons latéraux portés par le rameau d'un an (formé avant l'hiver) et le rameau plus âgé de deux ans, développent exactement trois paires (Tableau 1).

16Le tableau 2 rapporte les dimensions des différentes paires de feuilles de l'extérieur vers l'intérieur. La première paire d'ébauches située vers l'extérieur est la plus importante et varie selon le type de bourgeon observé. Ainsi, les bourgeons terminaux montrent des ébauches extérieures plus importantes ; les deux ébauches de la première paire du bourgeon hivernal sont respectivement de l'ordre de 416,6 µm et 357,2 µm et celles du bourgeon estival égales à 565,0 et 491,1 µm. Les deux paires situées vers l'intérieur sont moins importantes au niveau de la longueur pour les différents types de bourgeons observés.
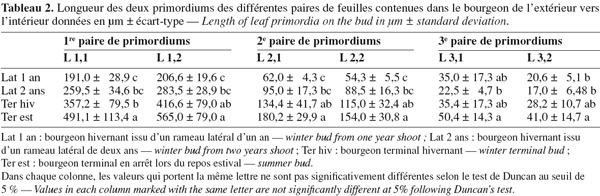
17Les bourgeons terminaux à débourrement printanier ou automnal présentent des dimensions plus importantes des différentes paires de feuilles ébauchées dans le bourgeon par rapport aux bourgeons latéraux (Tableau 2).
18L'épaississement basal varie entre 95,3 et 117,4 µm pour les différents types de bourgeons mais ne montre pas de différence significative entre les différents types de bourgeons (Tableau 3).
19Des mesures détaillées au niveau de la longueur inter-nodale entre la première et la deuxième paire d'ébauches les plus extérieures (H1) indiquent un allongement de l'entre-nœud intra-gemmaire chez le bourgeon terminal qui permet de faire ressortir une certaine avance de l'activité endogène des bourgeons terminaux ayant déjà entamé leur activité, par rapport aux bourgeons latéraux qui ne montrent encore aucune activité apparente (Tableau 4). H1 est alors égal à 171,2 µm pour les bourgeons en période de repos estival et 127,2 µm pour les bourgeons en repos hivernal.
3.3. Comparaison entre le contenu des bourgeons en pièces foliaires et le nombre de feuilles déployées des unités de croissance printanière et automnale
20En fin de chaque croissance printanière et automnale ainsi qu'en fin de cycle de croissance annuel, le nombre de paires de feuilles développées au niveau de la pousse est observé au niveau des différents types de rameaux issus de la variété ' Chemlali '. Les rameaux se regroupent autour de deux types : des rameaux ayant développé uniquement des feuilles préformées et d'autres se composant d'une partie préformée et d'une partie néoformée. Ceci est noté quand le nombre moyen de paires de feuilles développées est supérieur au nombre de paires de feuilles préformées ébauchées durant le repos. La tendance vers la préformation uniquement ou de la préformation suivie par la néoformation est variable selon les différents types de rameaux. Le pourcentage des rameaux ayant développé seulement de la préformation est de l'ordre de 53 % pour les rameaux courts, 37 % pour les rameaux moyens et 28 % pour les rameaux longs. Par contre, la formation des pièces préformées et néoformées est la plus importante chez les rameaux longs. La proportion est de l'ordre de 72 % chez les rameaux longs, 63 % chez les rameaux moyens et 47 % chez les rameaux courts (Tableau 5).
21Le tableau 6 indique le nombre de feuilles déployées par les rameaux ayant développé de la préformation et de la néoformation au niveau des deux vagues de croissance printanière et automnale et au niveau de la croissance annuelle. Le nombre de paires de feuilles déployées par le bourgeon terminal pendant la vague de croissance printanière varie entre 5 et 7 pour les rameaux courts (moyenne = 6,1 ± 0,78), 5 et 10 pour les rameaux moyens (moyenne = 6,4 ± 1,3) et 6 et 9 pour les rameaux longs (moyenne = 6,0 ± 1,3). A la fin de la vague de croissance automnale, le nombre maximum de paires de feuilles développées peut atteindre 12, 14 et 10 paires de feuilles pour ces mêmes types de rameaux. Le nombre moyen de paires de feuilles développées est égal à 5,4 pour les rameaux courts, 7,6 pour les moyens et enfin 6,9 pour les longs. Ainsi après le départ en végétation, le méristème forme de nouvelles feuilles qui seront de nature néoformée non-présente à l'état d'ébauches dans le bourgeon durant l'arrêt de croissance aussi bien hivernal qu'estival.
4. Discussion
22Cette étude a permis de réaliser une description morpho-histologique du bourgeon d'olivier à deux stades du cycle qui sont l'arrêt de croissance hivernal et estival et de préciser la nature préformée ou néoformée de la pousse résultant de la croissance aussi bien printanière qu'automnale chez l'olivier.
23L'analyse morpho-histologique du bourgeon végétatif en arrêt apparent de toute croissance montre un apex en forme de dôme et la zonation classiquement connue : zone axiale, zone médullaire et zone latérale (Plantefol, 1946 ; Crabbé, 1987). Des observations similaires de structures ont été observées sur des bourgeons d'olivier de la variété ' Nocellara ' Etnea (Fabri et al., 1999), de la variété ' Manzanille ' (De La Rosa et al., 2000) et des variétés ' Meski ', ' Chétoui ' et ' Picholine ' (Mehri et al., 2005).
24A partir de fin février, le stade des trois nœuds est visible et existe dans la majorité des bourgeons latéraux. Les bourgeons terminaux peuvent montrer entre 3 à 4 entre-nœuds et un début d'allongement inter-nodal central intra-gemmaire. Des changements sont observés au niveau des zones méristématiques axillaires de la première paire d'ébauches foliaires extérieure indiquant la formation de bourgeons axillaires. Aucun signe d'élongation inter-nodale n'est encore apparent chez les bourgeons issus de la ' Nocellara Etnea ' au 21 janvier et un allongement des entre-nœuds est observé à partir de la mi-mars (Fabri et al., 1999).
25Le nombre de métamères préformés est de l'ordre de 6 dans le bourgeon latéral et entre 6 et 7 pour le terminal prélevé aussi bien au mois de mars qu'en août. Les bourgeons contiennent 4 à 5 nœuds à partir de la fin août à mi-octobre. Ces mêmes bourgeons augmentent de 1 à 2 nœuds entre mi-octobre et mi-novembre. Ce nombre de nœuds reste constant jusqu'à la reprise de la croissance printanière (De la Rosa et al., 2000).
26Il apparaît dans notre étude que les bourgeons terminaux en repos estival notent un nombre plus important en ébauches préformées (3,8 paires de feuilles) que le bourgeon en repos hivernal (3,25 paires de feuilles) ainsi que des dimensions plus importantes en longueur et en largeur. Ces résultats confirment ceux obtenus sur Juglans regia L. (Sabatier et al., 2003) et sur Quercus rubra L. (Collin et al., 1996) qui ont expliqué cette différence par l'intensité et la durée du repos végétatif.
27En comparant le contenu à l'intérieur des bourgeons en organes foliaires et la structure des pousses en fin d'allongement aussi bien printanier qu'automnal, il apparaît que certains rameaux développent uniquement des feuilles préformées et d'autres rameaux développent d'abord des feuilles préformées puis néoformées. Chez ce dernier type de rameau, il est noté alors que le nombre moyen de paires de feuilles développées est supérieur au nombre d'ébauches de feuilles préformées durant le repos (entre 6 et 7 paires préformées). Ainsi après le départ en végétation, le méristème forme de nouvelles ébauches foliaires qui seront de nature néoformée et qui se déploieront après la partie préformée. Il apparaît ainsi que la croissance du rameau est le résultat d'une croissance préformée et d'une partie néoformée d'intensité variable (Puntieri et al., 2002). Les pousses printanières et automnales sont alors issues d'une préformation hivernale et estivale puis d'une néoformation printanière et automnale. Ces résultats corroborent les résultats obtenus chez le noyer (Juglans regia L.) qui montre une préformation hivernale donnant une partie de la pousse printanière et une préformation printanière, celle de la future pousse estivale (Sabatier et al., 1995 ; Sabatier et al., 2001).
5. Conclusion
28La bonne gestion des vergers fruitiers passe inévitablement par une bonne connaissance des caractéristiques de croissance et de développement de l'espèce. La compréhension des processus responsables du développement de la croissance d'une pousse feuillée (activité organogénétique, croissance, préformation, néoformation, etc.) permettra de mieux comprendre le développement futur de la structure ramifiée et de mieux analyser le développement futur de l'arbre et par conséquent maîtriser les techniques de conduite de l'arbre.
Bibliographie
Bandino G. & Dettori S., 2001. Manuale di olivicultura. Cagliari, Italy: Edition Grafiche Salinas.
Borchert R., 1969. Unusual shoot growth pattern in a tropical tree Oreopanax (Arialiaceae). Amer. J. Bot., 56, 1033-1041.
Caraglio Y. & Barthélémy D., 1997. Revue critique des termes relatifs à la croissance et à la ramification des tiges des végétaux. In: Bouchon J., De Reffye P. & Barthélémy D., eds. Modélisation et stimulation de l'architecture des végétaux. Paris : INRA, 11-87.
Champagnat P., Barnola P. & Lavarenne S., 1986. Quelques modalités de la croissance rythmique endogène des tiges chez les végétaux ligneux. In: Comptes-rendus du colloque international sur l'arbre, 9-14 septembre 1985, Montpellier. Naturalia Monspeliensia, n° hors série, 279-302.
Collin P., Badot P.M. & Millet B., 1996. Croissance rythmique et développement du chêne rouge d'Amérique Quercus rubra L. cultivé en conditions contrôlées. Ann. Sci. For., 83, 1059-1069.
Costes E., 1993. Architecture aérienne de l'abricotier en développement libre. Acta Bot. Gallica, 140, 249-261.
Costes E., 2003. Winter bud content according to position in 3-year-old branching system of '' Granny Smith '' apple. Ann. Bot., 92, 581-588.
Costes E., Lauri P.E. & Regnard J.L., 2006. Analysing fruit tree architecture: implications for tree management and fruit production. Hortic. Rev., 32, 1-61.
Crabbé J., 1987. Aspects particuliers de la morphogenèse caulinaire des végétaux ligneux et introduction à leur étude quantitative. Bruxelles : IRSIA.
Davidson C.G.W. & Remphrey W.R., 1984. Shoot neoformation in clones of Fraxinus pennsylvanica in relation to genotype, site and pruning treatments. Trees, 8, 205-212.
De La Rosa R., Rallo L. & Hava F., 2000. Olive floral bud growth and starch content during winter rest and spring budbreak. HortScience, 35(7), 1227-2000.
Fabbri A. & Alerci L., 1999. Reproductive and vegetative bud differentiation in Olea europaea L. J. Hortic. Sci. Biotechnol., 74(4), 522-527.
Gordon D., Damiano C. & Dejong T.M., 2006. Preformation in vegetative buds of Prunus persica: factors influencing number of leaf primordial in overwintering buds. Tree Physiol., 26, 537-544.
Guédon Y., Puntieri G., Sabatier S. & Barthélémy D., 2006. Relative extents of preformation and neoformation in tree shoots: analysis by a deconvolution method. Ann. Bot., 98, 835-844.
Jankiewicz L.S., Borkouwska B., Plich H. & Horaszky A., 1973. Growth correlation of young shrubs. Acta Hortic., 34, 107-116.
Johansen D.A., 1940. Plant microtechnique. New York, USA: Ed. Mc Graw-Hill.
Lavee S., 1977. Biologie et physiologie de l'olivier. In: Plaza & Janes, eds. Encyclopédie mondiale de l'olivier. Madrid: Conseil oléicole international, 61-110.
Mehri H., Mehri R. & Fendri F., 2005. Processus de croissance en relation avec le développement génératif de trois variétés d'olivier: ' Meski ', ' Chetoui ' et ' Picholine '. Olivae, 85, 33-38.
Moundi E.M., 1973. Etude de la croissance et de la pollinisation chez l'olivier. Thèse de diplôme d'études approfondies : Ecole Nationale Supérieure Agronomique (ENSA), Montpellier (France).
Msallem M., 2002. Etude de la juvénilité chez l'olivier (Olea europaea L.). Aspects morphologiques, anatomiques, physiologiques et biochimiques. Thèse de doctorat : Institut National Agronomique de Tunis (Tunisie).
Pinney K. & Polito V.S., 1990. Flower initiation in " Manzanillo " olive. Acta Hortic., 286, 203-205.
Plantefol L., 1946. Fondements d'une théorie phyllotaxique nouvelle : la théorie des hélices foliaires multiples. Ann. Sci. Nat. Bot., 11(8), 1-71.
Poli P., 1986. L'alternance de la production de l'olivier (étude bibliographique). Olivae, 10, 11-33.
Puntieri J.G., Barthélémy D., Mazzini C. & Brion C., 2002. Periods of organogenesis in shoots of Nothafagus dombeyi (Mirb) Oersted (Nothofagacaea). Can. J. Bot., 78, 1044-1054.
Remphrey W.R. & Powell G.R., 1984. Crown architecture of Larix laricina saplings: shoot preformation and neoformation and their relation to shoot vigour. Can. J. Bot., 62, 2181-2192.
Rivals P., 1966. Essai sur la croissance des arbres et sur leurs systèmes de floraison (application aux espèces fruitières). J. Agric. Trop. Bot. Appl., 12, 91-122.
Sabatier S., Barthélémy D., Ducoussou L. & Germain E., 1995. Nature de la pousse annuelle chez le noyer commun, Juglans regia (Juglandaceae) : préformation hivernale et printanière. In: Bouchon J., ed. Architecture des arbres fruitiers et forestiers. Colloque no74. Paris : INRA, 109-124.
Sabatier S. & Barthélémy D., 2001. Bud structure in relation to shoot morphology and position on the vegetative annual shoots of Junglans regia L. (Juglandaceae). Ann. Bot., 87, 117-123.
Sabatier S., Barthélémy D. & Ducoussou L., 2003. Periods of organogenesis in mono and bicyclic annuals shoots of Juglans regia L. (Juglandaceae). Ann. Bot., 92, 231-238.
Souza M.S., Puntieri J.G. & Barthélémy D., 2002. A bud content and its relation to shoot size and structure in Nothofagus pumilio (Poepp et Endl.) Krasser (Nothofagaceae). Ann. Bot., 85, 545-555.
Villemur P. & Delmas J.M., 1978. Croissance-développement chez l'olivier et alternance de production. In: Dufour A. & Zidani M., eds. Séminaire sur l'olivier et autres plantes oléagineuses cultivées en Tunisie, 3-7 juillet 1978, Mahdia, Tunisie. Tunis : Edition Office National de l'Huile (ONH), 27-41.
Pour citer cet article
A propos de : Mouna Aïachi Mezghani
Institut de l'Olivier. Station de Sousse. BP 14. TN-4061 Ibn Khaldoun (Tunisie). E-mail : ayachimouna@yahoo.fr
A propos de : Salem Ben El Hadj
Institut National Agronomique de Tunis (INAT). Avenue Charles Nicolle, 43. TN-1082 Tunis (Tunisie).
A propos de : Foued Labidi
Institut de l'Olivier. Station de Sousse. BP 14. TN-4061 Ibn Khaldoun (Tunisie).
A propos de : Abderahmen Jebari
Institut National Agronomique de Tunis (INAT). Avenue Charles Nicolle, 43. TN-1082 Tunis (Tunisie).






