- Accueil
- volume 12 (2008)
- numéro 4
- La biosynthèse des isoprénoïdes chez les pucerons : une cible potentielle de nouveaux bio-insecticides ?
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
La biosynthèse des isoprénoïdes chez les pucerons : une cible potentielle de nouveaux bio-insecticides ?

Notes de la rédaction
Reçu le 14 mars 2008, accepté le 3 juin 2008
Résumé
Actuellement, le contrôle des pucerons repose en grande partie sur l'utilisation d'insecticides de synthèse. Toutefois, l'effet néfaste de ceux-ci sur l'environnement, ainsi que le développement croissant de populations résistantes conduit à rechercher de nouvelles méthodes de lutte. Parmi celles-ci, une des voies actuellement envisagée est la formulation de nouveaux bio-insecticides ciblant et perturbant les fonctions biochimiques de l'insecte. En raison de la haute spécificité des agents utilisés, ces méthodes de contrôle des ravageurs ne présentent généralement que peu de risque pour l'environnement, les espèces non ciblées et la santé humaine. Dans le contexte de la lutte contre les pucerons, la voie de biosynthèse des isoprénoïdes, et plus particulièrement les enzymes de la famille des " short-chain " isoprényle diphosphate synthases, s'avère être une cible intéressante pour le développement de ces nouveaux agents de contrôle. En effet, chez les pucerons, cette voie de biosynthèse est associée à la production des mono- et sesquiterpènes, deux classes d'isoprénoïdes jouant des rôles importants au niveau de la physiologie des pucerons.
Abstract
Isoprenoid metabolism in aphids: a new target for bio-insecticides development? Currently, the control of aphids is largely dependent on the use of broad-spectrum chemical insecticides. Their adverse effects on the environment, combined with the ability of insects to quickly develop resistance to them, has prompted a search for alternative control products. One of the approaches currently under consideration involves the design of novel bio-rational insecticides targeting and disrupting specific biochemical processes in the insect. As a result of their high specificity, these pest control products generally present little risk to the environment, non-target organisms and human health. In the context of aphid control, isoprenoid metabolism and, more specifically, enzymes of the short-chain isoprenyl diphosphate synthases family constitute promising targets for the development of new control products. Indeed, in aphids, isoprenoid metabolism is associated with the production of mono- and sesquiterpenes, which are compounds playing important roles in the physiology of these insects.
Table des matières
1. Introduction
1Les isoprénoïdes ou terpénoïdes constituent une vaste famille de substances naturelles dont le squelette carboné est composé d'un élément de base commun à cinq atomes de carbone et dérivé de l'isoprène (C5). Le classement de ces composés se base sur le nombre d'unités isopréniques engagées dans leur formation. On distingue ainsi les hémiterpènes (C5), les monoterpènes (C10), les sesquiterpènes (C15), les diterpènes (C20), les sesterterpènes (C25), les triterpènes (C30), les tétraterpènes (C40) et les polyterpènes (C5n).
2Les isoprénoïdes sont présents chez tous les organismes vivants et possèdent des structures, des propriétés physiques et chimiques, et des activités biologiques très diverses. Plus de 22.000 composés isopréniques ont été répertoriés (Connolly et al., 1992), mais seul un petit pourcentage d'entre eux ont été étudiés dans la perspective d'évaluer leurs rôles fonctionnels.
3Néanmoins, à partir des années 1970, un certain nombre d'isoprénoïdes ont été identifiés comme étant toxiques ou possédant un effet attractif ou répulsif vis-à-vis de certains organismes, ce qui démontra leur implication dans les interactions antagonistes ou mutualistes entre organismes (Langenheim, 1994).
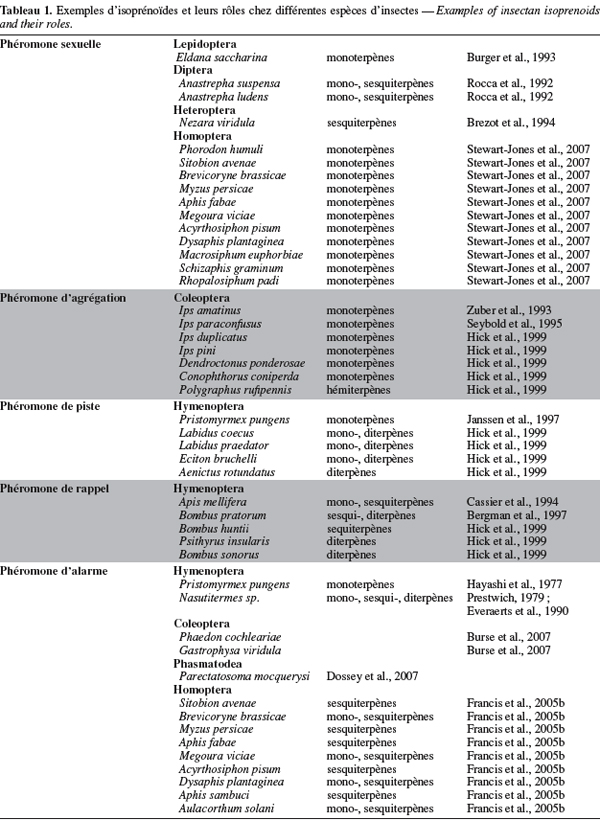
4Chez plusieurs ordres d'insectes, des isoprénoïdes sont impliqués dans le développement, dans les mécanismes de défense et/ou dans la communication chimique (Hick et al., 1999). Ainsi, des mono- sesqui- et diterpènes composent les sécrétions gluantes libérées par les termites du genre Nasutitermes (Termididae) en vue d'immobiliser leurs ennemis. Chez d'autres insectes, les terpénoïdes servent de messagers chimiques afin de signaler la présence de nourriture, de congénères et d'ennemis. Citons, à titre d'exemples, la phéromone de marquage des pistes de la fourmi Pristomyrmex pungens (Myrmicinae), la phéromone de Nasonov ou phéromone de rappel d'Apis mellifera (Apidea), la phéromone d'agrégation des coléoptères du genre Ips (Scotylidae) ou encore la phéromone sexuelle de la punaise Nezara viridula (Pentatomidae) (Hick et al., 1999). Le tableau 1 reprend quelques exemples d'isoprénoïdes et leurs rôles chez différentes espèces d'insectes.
5La compréhension des mécanismes biochimiques régulant la synthèse de ces composés est donc d'un grand intérêt tant d'un point de vue fondamental qu'appliqué. En outre, compte tenu de l'incidence des isoprénoïdes sur la physiologie des insectes, le développement de nouveaux insecticides ayant la capacité d'inhiber leur synthèse semble être une alternative séduisante aux méthodes de contrôle actuellement disponibles.
2. Importance des isoprénoïdes chez les pucerons
6Les pucerons ne font pas exception à la règle et voient les isoprénoïdes entrer dans la composition de leurs phéromones sexuelles et d'alarme. En outre, de la même manière que pour les autres insectes, leur développement est lié à un autre composé isoprénique : l'hormone juvénile.
7L'hormone juvénile est un sesquiterpène ayant pour principale fonction de réguler deux processus physiologiques critiques chez les insectes : la métamorphose et la reproduction (Hartfelder, 2000). A ce jour, six formes chimiques d'hormone juvénile ont été identifiées et toutes correspondent à des dérivés méthyle esters de l'acide époxy-farnésoïque (Cusson et al., 2000). Chez la plupart des insectes, dont les pucerons, l'hormone juvénile III est la seule forme à avoir été identifiée (Hardie et al., 1985 ; Westerlund et al., 2004). Toutefois, chez les Lépidoptères, cinq formes d'hormone juvénile ont été mises en évidence (JH 0, JH I, JH II, JH III, 4-méthyl JH I). De même, chez les Diptères supérieurs, un bis-époxyde de la forme III de l'hormone juvénile (JH B3) coexiste avec cette dernière.
8Les phéromones d'alarme sont sécrétées par les pucerons lors de l'approche ou l'attaque de prédateurs et ont pour effet d'induire un comportement de fuite. En fonction des espèces, la composition chimique de la phéromone d'alarme varie. Il a toutefois pu être établi que de nombreuses espèces libèrent comme signal d'alarme un sesquiterpène, le (E)-β-farnésène, soit exclusivement, soit en combinaison avec d'autres terpènes (Francis et al., 2005b). Outre ce rôle de signal d'alarme, le (E)-β-farnésène a pour effet d'augmenter le nombre d'individus ailés au niveau de la progéniture (Kunert et al., 2005). Il a également été démontré que le (E)-β-farnésène possède un effet attractif sur différents ennemis naturels des pucerons (Du et al., 1998 ; Al Abassi et al., 2000 ; Francis et al., 2004 ; Francis et al., 2005a).
9Les monoterpènes constituent également une classe d'isoprénoïdes importante chez les pucerons. S'ils peuvent entrer dans la composition de la phéromone d'alarme en mélange ou non avec le (E)-β-farnésène (Francis et al., 2005b), ils jouent également un rôle essentiel au niveau du cycle de reproduction sexuée des pucerons. En effet, lors de ce cycle, les femelles vierges émettent une phéromone sexuelle afin d'attirer les mâles. Cette dernière a été caractérisée pour la première fois chez Megoura viciae comme étant un mélange de deux cyclopentanoïdes, la népétalactone et le népétalactol (Dawson et al., 1987). Jusqu'à ce jour, à l'exception de quatre espèces, pour lesquelles seul un des deux monoterpènes compose la phéromone sexuelle, toutes les études menées ont démontré la présence d'un mélange de népétalactone et de népétalactol, en proportion variable (Dawson et al., 1996 ; Stewart-Jones et al., 2007). La question de savoir si les différences spécifiques dans les ratios népétalactone:népétalactol assurent un isolement reproductif est encore actuellement discutée.
3. Voie de biosynthèse des isoprénoïdes chez les insectes
10L'isopentényle diphosphate (IPP) et le diméthylallyle diphosphate (DMAPP) sont les précurseurs communs de tous les isoprénoïdes. La formation de l'IPP et du DMAPP a été considérablement étudiée, ce qui permit, dans les années 1950, la découverte de la voie du mévalonate. Plus récemment, une voie de biosynthèse de l'IPP et du DMAPP totalement différente fut mise en évidence chez Escherichia coli (Rohmer et al., 1993). A la différence de la voie du mévalonate apparentée à la biosynthèse des lipides, cette voie alternative utilise des dérivés de glucides pour aboutir soit à l'IPP, soit au DMAPP. Cette nouvelle voie métabolique a ensuite été mise en évidence chez différentes bactéries, chez des algues vertes, ainsi que dans les chloroplastes de végétaux (Bach, 1995 ; Eisenreich et al., 1996). Cependant, chez les insectes, seule la voie du mévalonate intervient dans la biosynthèse des isoprénoïdes ; en conséquence, seule cette voie est détaillée ici.
11Comme illustrée à la figure 1, la voie du mévalonate débute avec la condensation successive de trois molécules d'acétyl-CoA de manière à former le 3-Hydroxy-3-méthylglutaryl-CoA (HMG-CoA). Les enzymes catalysant ces réactions de condensation sont respectivement l'acétyl-CoA thiolase et la HMG-CoA synthase. La réduction du 3-Hydroxy-3-méthylglutaryl-CoA en mévalonate est ensuite catalysée par la HMG-CoA réductase.
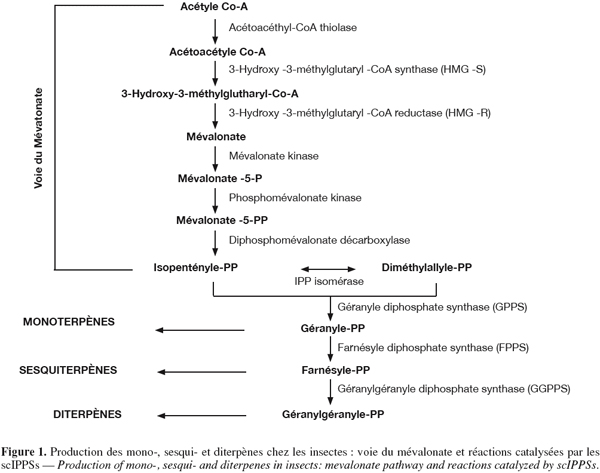
12Le mévalonate subit alors deux phosphorylations successives ainsi qu'une décarboxylation conduisant à la formation de l'IPP. L'isopentényle diphosphate isomérase (IPPI) catalyse l'isomérisation de l'IPP en DMAPP. La liaison covalente de l'IPP à son isomère conduit à la formation du précurseur des monoterpènes, le géranyle diphosphate (GPP). De la même manière, la liaison covalente du GPP à l'IPP conduit à la formation de la farnésyle diphosphate (FPP), le précurseur des sesquiterpènes. La réaction conduisant au GPP peut être catalysée à la fois par la géranyle diphosphate synthase (GPPS) et la farnésyle diphosphate synthase (FPPS). La réaction conduisant au FPP est quant à elle uniquement catalysée par la FPPS. Enfin, la liaison covalente du FPP à l'IPP est catalysée par la géranylgéranyle diphosphate synthase (GGPPS) et conduit à la formation du géranylgéranyle diphosphate (GGPP), le précurseur des diterpènes.
13Chez les vertébrés, la liaison de deux farnésyle diphosphates permet d'obtenir le squalène, le précurseur du cholestérol. Les insectes ne possèdent pas les enzymes (squalène synthase et lanostérol synthase) permettant la catalyse de cette réaction et sont par conséquent incapables de synthétiser de novo des stérols (Castillo-Gracia et al., 1999).
4. La famille des " short-chain " isoprényle diphosphate synthases
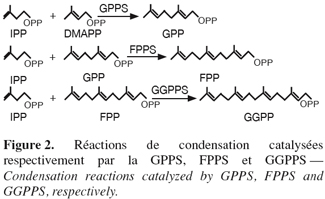
14La famille des " short-chain " isoprényle diphosphate synthases (scIPPS) est impliquée dans la formation des dérivés isopréniques déphosphorylés à 10, 15 ou 20 atomes de carbones. Ces enzymes catalysent la condensation 1'-4 d'une unité isoprénique homoallylique, l'IPP, sur un substrat allylique, le DMAPP, le GPP, ou le FPP (Poulter et al., 1981) (Figure 2).
4.1. La géranyle diphosphate synthase
15La GPPS catalyse la formation de GPP, le précurseur des monoterpènes, par condensation d'une molécule d'IPP sur une molécule de DMAPP (Banthorpe et al., 1983).
16Les GPPS ont surtout été étudiées chez les plantes. La première purification à homogénéité d'une GPPS a été réalisée à partir de cellules de Vitis vinifera (Clastre et al., 1993). La protéine présente une masse moléculaire de 69 kDa. L'activité maximale est obtenue en présence de cations divalents Mg2+ et Mn2+ comme cofacteurs, avec une efficacité plus importante pour le Mn2+. Plus récemment, les ADNc codant les GPPS de Mentha piperita (Burke et al., 1999), Arabidopsis thaliana (Bouvier et al., 2000), Abies grandis (Burke et al., 2002), Anthirrimum majus et Clarkia breweri (Tholl et al., 2004) ont été isolés et les protéines correspondantes caractérisées. Toutes ces enzymes présentent des séquences similaires aux autres enzymes de la famille des scIPPSs, mais elles diffèrent dans leur architecture. En effet, les GPPS de M. piperita (Burke et al., 1999), A. majus et C. breweri (Tholl et al., 2004) se présentent sous la forme d'hétérodimères, tandis que les GPPS isolées chez A. thaliana et A. grandis se présentent sous la forme d'homodimères.
17Gilg et al. (2005) ont été les premiers à cloner l'ADNc codant une GPPS animale, soit celle du coléoptère Ips pini (Scotylidae) ; ils ont démontré son rôle dans la biosynthèse de la phéromone d'agrégation, laquelle est composée des monoterpènes ipsenol et ipsdienol. Cette enzyme possède un poids moléculaire calculé de 48,5 kDa. Comme les autres enzymes de la famille des scIPPSs, elle présente les motifs conservés impliqués dans les mécanismes catalytiques et de liaison des substrats. Plus récemment, une activité GPPS a pu être détectée dans le corps gras de larves de Phaedon cochleariae et Gastrophysa viridula (Chrysomelidae), chez lesquelles la GPPS joue vraisemblablement un rôle dans la biosynthèse des monoterpènes iridoïques (monoterpènes composés d'un noyau iridane) impliqués dans leur système de défense (Burse et al., 2007).
4.2. La farnésyle diphosphate synthase
18La FPPS est considérée comme une enzyme clé de la voie de biosynthèse des isoprénoïdes. Elle catalyse une réaction de condensation séquentielle de deux molécules d'IPP avec une molécule de DMAPP pour former une molécule de FPP par l'intermédiaire d'une molécule de GPP (Poulter et al., 1976). Le FPP est le précurseur des sesquiterpènes ainsi que de nombreux métabolites cellulaires essentiels comme les stérols, l'hème a, le dolichol, l'ubiquinone et les groupements prényl des protéines (Poulter et al., 1981).
19Les premières purifications de la FPPS réalisées à partir de différentes sources eucaryotiques dont Saccharomyces cerevisiae (Eberhardt et al., 1975), le poulet (Reed et al., 1975), le porc (Yeh et al., 1977) et l'homme (Barnard et al., 1981), ont montré que chez tous ces organismes, la FPPS se présente sous forme d'un homodimère de 80 à 84 kDa qui nécessite la présence de cations Mg2+ pour son activité. Le développement de la biologie moléculaire a permis ensuite d'approfondir les connaissances relatives à cette enzyme. Ainsi, Clarke et al. (1987) ont cloné le gène codant la FPPS du rat. Deux ans plus tard, Anderson et al. (1989) ont pu à leur tour l'isoler à partir d'une banque d'ADN génomique de la levure S. cerevisiae. Le gène de la FPPS humaine a quant à lui été cloné en 1990 (Wilkin et al., 1990). A ce jour, de très nombreuses séquences du gène codant cette enzyme sont disponibles.
20Chez les insectes, les purifications partielles de deux FPPS ont été réalisées pour Bombyx mori (Koyama et al., 1985) et Manduca sexta (Sen et al., 2002). En outre, plusieurs études concernant le clonage de cette enzyme ont été rapportées : chez Agrotis ipsilon (Castillo-Gracia et al., 1999), Bombyx mori (Kikuchi et al., 2001), Pseudaletia unipuncta et Choristoneura fumiferana (Cusson et al., 2006), Ips pini (AY953507), Dendroctonus jeffreyi (AY966009), Anthonomus grandis (AY966008), Apis mellifera (XP_396224), Drosophila melanogaster (Sen et al., 2007) et Anopheles gambiae (XP_308653).
4.3. La géranylgéranyle diphosphate synthase
21La GGPPS catalyse la formation de géranylgéranyle diphosphate (GGPP) par condensation successive de trois molécules d'IPP sur un substrat allylique (Ogura et al., 1998). Chez les plantes supérieures, le GGPP est un précurseur essentiel pour la synthèse des caroténoïdes, des gibbérellines et de la chlorophylle (Wang et al., 1999). Les gènes et les ADNc codant la GGPPS de nombreux organismes ont été clonés (Sandmann et al., 1993 ; Kainou et al., 1999 ; Okada et al., 2000). La GGPPS se présente en général sous la forme d'un dimère constitué de deux sous-unités de 40 kDa et in vitro, cette enzyme est capable d'utiliser les différents substrats allyliques DMAPP, GPP, FPP (Kuntz et al., 1992). Très récemment, Hojo et al. (2007) ont cloné une GGPPS chez la termite Nasutitermes takasagoensis. Chez ces insectes, la GGPPS est vraisemblablement impliquée dans la biosynthèse des diterpènes qui composent leurs sécrétions de défense. Il est également intéressant de souligner les études, menées respectivement sur deux archéobactéries Methanobacterium thermoautotrophicum (Chen et al., 1993) et Thermococcus kodakaraensis (Fujiwara et al., 2004) ainsi que sur le parasite Toxoplasma gondii (Ling et al., 2007), ayant permis d'identifier deux enzymes bifonctionnelles de type FPPS/GGPPS, capables de catalyser la synthèse tant du FPP que du GGPP.
4.4. Structure et organisation du site actif des enzymes de la famille des scIPPSs
22Durant les dix dernières années, de nombreuses enzymes de la famille des scIPPSs ont été purifiées et un certain nombre des gènes codant ces enzymes ont été clonés (Ogura et al., 1997 ; Wang et al., 1999). La comparaison des différentes séquences amino-acidiques disponibles révèle l'existence de certaines régions hautement similaires ainsi que la présence de deux motifs caractéristiques riches en aspartate (DDxxD, D pour aspartate et X pour n'importe quel autre acide aminé), respectivement dénommés First et Second Aspartate-Rich Motif (FARM et SARM).
23La première structure cristalline d'une enzyme appartenant à la famille des scIPPSs est celle de la FPPS du poulet, obtenue à une résolution de 2,6 Å par Tarshis et al. (1994). Comme illustrée à la figure 3A, cette enzyme se présente sous forme d'un homodimère ; chaque sous-unité présente 13 hélices α et ne possède qu'un seul site actif permettant l'élongation de C5 en C15. L'assemblage de 10 hélices α forme la cavité catalytique de l'enzyme et les deux motifs riches en aspartate, situés sur des faces opposées de la cavité catalytique, sont séparés d'environ 12 Å.
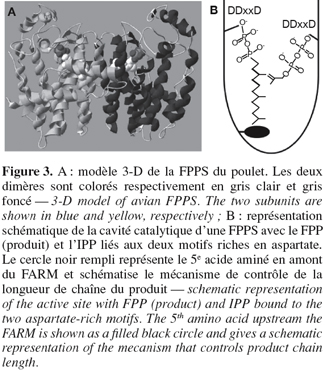
24Des travaux basés sur des analyses cristallographiques et des essais de mutagenèse dirigée ont ensuite montré l'implication des deux motifs riches en aspartate dans les mécanismes de fixation des substrats et de catalyse (Figure 3B). Des essais entrepris sur la FPPS de S. cerevisiae ont montré que la substitution du premier aspartate du FARM par un résidu alanine conduisait à une réduction de la constante catalytique. Un effet similaire a été observé suite aux substitutions réalisées sur les résidus aspartate du SARM (Song et al., 1994). De manière analogue, chez la FPPS du rat, le remplacement des second et troisième aspartate du FARM par un résidu glutamine a conduit à la réduction de la constante catalytique d'un facteur 1.000. Cependant, aucun changement significatif de la constante de Michaelis-Menten pour l'IPP et le GPP n'a été observé. Au niveau du SARM de la FPPS du rat, la substitution du premier aspartate par un résidu glutamine a eu pour conséquence de réduire d'un facteur 90 la constante catalytique et d'augmenter la constante de Michaelis-Menten pour l'IPP (Marrero et al., 1992). Enfin, les mutations réalisées au niveau du troisième aspartate n'ont eu aucun effet sur les paramètres cinétiques. Ces résultats démontrent l'implication des domaines FARM et SARM dans le mécanisme de catalyse ainsi que le rôle du motif SARM dans la fixation de l'IPP et le maintien des substrats allyliques dans la conformation idéale pour la condensation.
25En parallèle aux études de mutagenèse dirigée contre les résidus aspartate des motifs FARM et SARM, plusieurs études se sont intéressées aux acides aminés pouvant être impliqués dans la régulation de la longueur de la chaîne carbonée des produits issus des réactions catalysées par les scIPPSs. Chez la FPPS du poulet, le remplacement par mutation dirigée des deux résidus phénylalanine, situés en position -4 et -5 du premier aspartate du motif FARM, par des acides aminés possédant une chaîne latérale plus courte (par exemple, une alanine ou une sérine) a conduit à la formation de produits possédant un nombre d'atomes de carbone plus élevé (C20-C70) (Tarshis et al., 1996). D'autres essais, menés chez les FPPS de Bacillus stearothermophilus, ont confirmé que le premier acide aminé aromatique situé en amont du FARM forme le " plancher " du site catalytique de l'enzyme et de cette manière empêche toute condensation au-delà de 15 atomes de carbone (Ohnuma et al., 1996). Inversement, le remplacement d'un acide aminé peu encombrant par un acide aminé possédant un encombrement stérique plus important, conduit à limiter la progression du produit au sein de la cavité catalytique et par conséquent limite le nombre d'atomes de carbone constituant sa chaîne carbonée. A titre d'exemple, les mutants A116W et N114W de la FPPS du poulet produisent du GPP (C10) au lieu du FPP (C15) produit par le type sauvage (Fernandez et al., 2000).
5. Lutte contre les pucerons : potentiel d'utilisation des scIPPSs comme cibles de nouveaux bio-insecticides
26A l'heure actuelle, les infestations de pucerons sont généralement contrôlées à l'aide d'insecticides de synthèse tels que les néonicotinoïdes et les pyréthrinoïdes de synthèse. Malgré les progrès réalisés, les insecticides restent responsables de nombreux problèmes tant pour l'environnement (persistance de métabolites à tous les échelons édaphiques) que pour la santé humaine (possibilité de résidus dans les eaux de distribution ainsi que dans les aliments). De plus, l'utilisation massive d'insecticides depuis plus d'une trentaine d'années est à la base de la sélection de populations d'insectes résistants (Nauen et al., 2003).
27Ce constat conduit les scientifiques à rechercher de nouvelles approches de lutte qui, utilisées seules ou en combinaison avec les méthodes existantes, permettraient de contrôler efficacement ces ravageurs tout en limitant les impacts négatifs des produits antiparasitaires sur l'environnement et la santé humaine. Parmi ces approches, des méthodes de lutte biologique utilisant des prédateurs ou des parasitoïdes des pucerons ont été développées. Mais les pucerons, avec leur cycle de reproduction par parthénogenèse, ont la capacité de rapidement diluer les attaques de leurs ennemis. Par conséquent, les solutions biologiques capables d'apporter une alternative à l'utilisation des insecticides, dans un contexte de grandes cultures, ne permettent pas encore d'assurer des rendements de production à un prix compétitif. Une autre voie actuellement envisagée est la formulation de nouveaux insecticides appelés bio-insecticides. Ces insecticides sont conçus pour perturber certaines fonctions biochimiques essentielles à la survie de l'insecte ravageur visé. En ciblant des protéines à structure tridimensionnelle particulière et propres à un groupe d'insectes, ils garantissent un haut niveau de sélectivité et, par conséquent, ne présentent que peu ou pas de risque pour la santé humaine, les espèces non ciblées et l'environnement.
28Si l'idée de perturber, chez les pucerons, au moyen d'un bio-insecticide, les voies biosynthétiques de l'hormone juvénile, des phéromones sexuelle et/ou d'alarme, parait séduisante, le caractère quasi universel des enzymes de la voie du mévalonate dans les règnes animal et végétal constitue un obstacle évident à l'élaboration d'inhibiteurs ciblant une des enzymes de cette voie ; un tel inhibiteur risquerait en effet d'avoir une action sur une multitude d'autres organismes. Néanmoins, les enzymes impliquées dans les dernières étapes de la biosynthèse des mono- et sesquiterpènes sont plus spécifiques à celles-ci. Par conséquent, elles constituent des cibles plus intéressantes.
29Récemment, nous avons cloné, chez plusieurs espèces de pucerons, une enzyme dont la particularité est de présenter une activité bifonctionnelle GPPS/FPPS. Chez ces insectes, la GPPS joue très vraisemblablement un rôle dans la biosynthèse des deux composés monoterpéniques de la phéromone sexuelle, tandis que la FPPS est une enzyme clé de la voie de biosynthèse de l'hormone juvénile et du (E)-β-farnésène. Notre découverte revêt donc un intérêt particulier en matière de lutte contre les pucerons. En effet, une enzyme de ce type pourrait être utilisée comme cible de bio-insecticides spécifiques ; ceux-ci auraient pour effet de perturber les mécanismes de défense, de reproduction ou encore le développement des pucerons. Nos efforts actuels visent la caractérisation approfondie de cette enzyme et l'élaboration de modèles tridimensionnels afin de nous aider ensuite dans la mise au point d'inhibiteurs spécifiques. Si notre quête d'inhibiteurs de cette enzyme s'avère fructueuse, nous serons alors en mesure de proposer une alternative aux méthodes de contrôle actuellement disponibles.
Bibliographie
Al Abassi S. et al., 2000. Response of the seven-spot ladybird to an aphid alarm pheromone and an alarm pheromone inhibitor is mediated by paired olfactory cells. J. Chem. Ecol., 26, 1765-1771.
Anderson M.S., Yarger J.G., Burck C.L. & Poulter C.D., 1989. Farnesyl diphosphate synthase. Molecular cloning, sequence, and expression of an essential gene from Saccharomyces cerevisiae. J. Biol. Chem., 264, 19176-19184.
Bach T.J., 1995. Some new aspects of isoprenoid biosynthesis in plants: a review. Lipids, 30, 191-202.
Banthorpe D.V., Long D.R.S. & Pink C.R., 1983. Biosynthesis of geraniol and related monoterpenes in Pelargonium graveolens. Phytochemistry, 22, 2459-2463.
Barnard G.F. & Popjak G., 1981. Human liver prenyltransferase and its characterization. Biochim. Biophys. Acta, 661, 87-99.
Bergman P. & Bergström G., 1997. Scent marking, scent origin, and species specificity in male premating behavior of two Scandinavian bumble bees. J. Chem. Ecol., 23, 1235-1250.
Bouvier F. et al., 2000. Molecular cloning of geranyl diphosphate synthase and compartmentation of monoterpene synthesis in plant cells. Plant J., 24, 241-252.
Brezot P., Malosse C., Mori K. & Renou M., 1994. Bisabolene epoxides in sex pheromone in Nezara viridula (L.) (Heteroptera: Pentatomidae): Role of cis isomer and relation to specificity of pheromone. J. Chem. Ecol., 20, 3133-3147.
Burger B.V. et al., 1993. Constituents of wing gland and abdominal hair pencil secretions of male African sugarcane borer, Eldana saccharina walker (Lepidoptera: Pyralidae). J. Chem. Ecol., 19, 2255-2277.
Burke C.C., Wildung M.R. & Croteau R., 1999. Geranyl diphosphate synthase: cloning, expression, and characterization of this prenyltransferase as a heterodimer. Proc. Natl Acad. Sci. USA, 96, 13062-13067.
Burke C.C. & Croteau R., 2002. Geranyl diphosphate synthase from Abies grandis: cDNA isolation, functional expression, and characterization. Arch. Biochem. Biophys., 405, 130-136.
Burse A. et al., 2007. Iridoid biosynthesis in Chrysomelina larvae: Fat body produces early terpenoid precursors. Insect Biochem. Mol. Biol., 37, 255-265.
Cassier P. & Lensky Y., 1994. The Nassanov gland of the workers of the honeybee (Apis mellifera L.): Ultrastructure and behavioural function of the terpenoid and protein components. J. Insect Physiol., 40, 577-584.
Castillo-Gracia M. & Couillaud F., 1999. Molecular cloning and tissue expression of an insect farnesyl diphosphate synthase. Eur. J. Biochem., 262, 365-370.
Chen A. & Poulter C.D., 1993. Purification and characterization of farnesyl diphosphate/geranylgeranyl diphosphate synthase. A thermostable bifunctional enzyme from Methanobacterium thermoautotrophicum. J. Biol. Chem., 268, 11002-11007.
Clarke C.F. et al., 1987. Molecular cloning and sequence of a cholesterol-repressible enzyme related to prenyltransferase in the isoprene biosynthetic pathway. Mol. Cell. Biol., 7, 3138-3146.
Clastre M. et al., 1993. Purification and characterization of geranyl diphosphate synthase from Vitis vinifera L. cv. ' Muscat de Frontignan ' cell cultures. Plant Physiol., 102, 205-211.
Connolly J.D. & Hill R.A., 1992. Dictionary of terpenoids. London: Chapmann and Hall.
Cusson M. & Palli S.R., 2000. Can juvenile hormone research help rejuvenate integrated pest management? Can. Entomol., 132, 263-283.
Cusson M. et al., 2006. Characterization and tissue-specific expression of two lepidopteran farnesyl diphosphate synthase homologs: implications for the biosynthesis of ethyl-substituted juvenile hormones. Proteins, 65, 742-758.
Dawson G.W. et al., 1987. Identification of an aphid sex pheromone. Nature, 325, 614-616.
Dawson G.W., Pickett J.A. & Smiley D.W.M., 1996. The aphid sex pheromone cyclopentanoids: Synthesis in the elucidation of structure and biosynthetic pathways. Bioorganic Med. Chem., 4, 351-361.
Dossey A.T., Walse S.S., Conle O.V. & Edison A.S., 2007. Parectadial, a monoterpenoid from the defensive spray of Parectatosoma mocquerysi. J. Nat. Prod., 70, 1335-1338.
Du Y. et al., 1998. Identification of semiochemicals released during aphid feeding that attract parasitoid Aphidius ervi. J. Chem. Ecol., 24, 1355-1368.
Eberhardt N.L. & Rilling H.C., 1975. Prenyltransferase from Saccharomyces cerevisiae. Purification to homogeneity and molecular properties. J. Biol. Chem., 250, 863-866.
Eisenreich W. et al., 1996. Studies on the biosynthesis of taxol: the taxane carbon skeleton is not of mevalonoid origin. Proc. Natl Acad. Sci. USA, 93, 6431-6436.
Everaerts C. et al., 1990. (+)-α-Pinene in the defensive secretion of Nasutitermes princeps (Isoptera, Termitidae). Cell. Mol. Life Sci., 46, 227-230.
Fernandez S.M.S., Kellogg B.A. & Poulter C.D., 2000. Farnesyl diphosphate synthase. Altering the catalytic site to select for geranyl diphosphate activity. Biochemistry, 39, 15316-15321.
Francis F., Lognay G. & Haubruge E., 2004. Olfactory responses to aphid and host plant volatile releases: (E)-ß-farnesene an effective kairomone for the predator Adalia bipunctata. J. Chem. Ecol., 30, 741-755.
Francis F., Martin T., Lognay G. & Haubruge E., 2005a. Role of (E)-ß-farnesene in systematic aphid prey location by Episyrphus balteatus larvae (Diptera: Syrphidae). Eur. J. Entomol., 102, 431-436.
Francis F. et al., 2005b. Is the (E)-ß-farnesene only volatile terpenoid in aphids? J. Appl. Entomol., 129, 6-11.
Fujiwara S. et al., 2004. Temperature-dependent modulation of farnesyl diphosphate/geranylgeranyl diphosphate synthase from hyperthermophilic archaea. Biochem. Biophys. Res. Commun., 325, 1066-1074.
Gilg A.B. et al., 2005. Isolation and functional expression of an animal geranyl diphosphate synthase, and its role in bark beetle pheromone biosynthesis. Proc. Natl Acad. Sci. USA, 102, 9760-9765.
Hardie J. et al., 1985. The identification of an aphid juvenile hormone, and its titre in relation to photoperiod. Physiol. Entomol., 10, 297-302.
Hartfelder K., 2000. Insect juvenile hormone: from " status quo " to high society. Brazilian J. Med. Biol. Res., 33, 157-177.
Hayashi N. & Komae H., 1977. The trail and alarm pheromones of the ant, Pristomyrmex pungens Mayr. Experientia, 33, 424-425.
Hick A.J., Luszniak M.C. & Pickett J.A., 1999. Volatile isoprenoids that control insect behaviour and development. Nat. Prod. Rep., 16, 39-54.
Hojo M., Matsumoto T. & Miura T., 2007. Cloning and expression of a geranylgeranyl diphosphate synthase gene: insights into the synthesis of termite defence secretion. Insect Mol. Biol., 16, 121-131.
Janssen E. et al., 1997. Trail pheromone of myrmicine ant Pristomyrmex pungens. J. Chem. Ecol., 23, 1025-1034.
Kainou T. et al., 1999. Identification of the GGPS1 genes encoding geranylgeranyl diphosphate synthases from mouse and human. Biochim. Biophys. Acta., 1437, 333-340.
Kikuchi K., Hirai M. & Shiotsuki T., 2001. Molecular cloning and tissue distribution of farnesyl pyrophosphate synthase from the silkworm. J. Insect Biotechnol. Sericology, 70, 167-172.
Koyama T., Matsubara M. & Ogura K., 1985. Isoprenoid enzyme systems of silkworm. II. Formation of the juvenile hormone skeletons by farnesyl pyrophosphate synthase II. J. Biochem., 98, 457-463.
Kunert G. et al., 2005. Alarm pheromone mediates production of winged dispersal morphs in aphids. Ecol. Lett., 8, 596-603.
Kuntz R. et al., 1992. Identification of a cDNA for the plastid-located geranylgeranyl pyrophosphate synthase from Capsicum annuum: Correlative increase in enzyme activity and transcript level during fruit ripening. Plant J., 2, 25-34.
Langenheim J.H., 1994. Higher plant terpenoids: a phytocentric overview of their ecological roles. J. Chem. Ecol., 20, 1223-1280.
Ling Y. et al., 2007. The farnesyl diphosphate/geranylgeranyl diphosphate synthase of Toxoplasma gondii is a bifunctional enzyme and a molecular target of bisphosphonates. J. Biol. Chem., 282, 30804-30816.
Marrero P.F., Poulter C.D. & Edwards P.A., 1992. Effects of site-directed mutagenesis of the highly conserved aspartate residues in domain II of farnesyl diphosphate synthase activity. J. Biol. Chem., 267, 21873-21878.
Nauen R. & Elbert A., 2003. European monitoring of resistance to insecticides in Myzus persicae and Aphis gossypii (Hemiptera: Aphididae) with special reference to imidacloprid. Bull. Entomol. Res., 93, 47-54.
Ogura K., Toyama T. & Sagami H., 1997. Polyprenyl diphosphate synthases. In: Bittman R., ed. Subcellular Biochemistry, Vol. 28, 57-88. New York, USA: Plenum.
Ogura K. & Koyama T., 1998. Enzymatic aspects of isoprenoid chain elongation. Chem. Rev., 98, 1263-1276.
Ohnuma S. et al., 1996. A role of the amino acid residue located on the fifth position before the first aspartate-rich motif of farnesyl diphosphate synthase on determination of the final product. J. Biol. Chem., 271, 30748-30754.
Okada K. et al., 2000. Five geranylgeranyl diphosphate synthases expressed in different organs are localized into three subcellular compartments in Arabidopsis. Plant Physiol., 122, 1045-1056.
Poulter C.D. & Rilling H.C., 1976. Prenyltransferase: the mechanism of the reaction. Biochemistry, 15, 1079-1083.
Poulter C.D. & Rilling H.C., 1981. Prenyl transferases and isomerase. In: Porter J.W. & Spurgeon S.L., eds. Biosynthesis of isoprenoid compounds. Vol. 1. New York, USA: Wiley and Sons, 161-224.
Prestwich G.D., 1979. Chemical defense by termite soldiers. J. Chem. Ecol., 5, 459-480.
Reed B.C. & Rilling H.C., 1975. Crystallization and partial characterization of prenyltransferase from avian liver. Biochemistry, 14, 50-54.
Rocca J.R., Nation J.L., Strekowski L. & Battiste M.A., 1992. Comparison of volatiles emitted by male caribbean and mexican fruit flies. J. Chem. Ecol., 18, 223-224.
Rohmer M. et al., 1993. Isoprenoid biosynthesis in bacteria: a novel pathway for the early steps leading to isopentenyl diphosphate. Biochem. J., 295, 517-524.
Sandmann G. et al., 1993. Functional identification of al-3 from Neurospora crassa as the gene for geranylgeranyl pyrophosphate synthase by complementation with crt genes, in vitro characterization of the gene product and mutant analysis. J. Photochem. Photobiol., 18, 245-251.
Sen S.E. & Sperry A.E., 2002. Partial purification of farnesyl diphosphate synthase from whole-body Manduca sexta. Insect Biochem. Mol. Biol., 32, 889-899.
Sen S.E. et al., 2007. Cloning, expression and characterization of a dipteran farnesyl diphosphate synthase. Insect Biochem. Mol. Biol., 37, 1198-1206.
Seybold S.J. et al., 1995. De novo biosynthesis of the aggregation pheromone components ipsenol and ipsdienol by the pine bark beetles Ips paraconfusus Lanier and Ips pini (Say) (Coleoptera: Scolytidae). Proc. Natl Acad. Sci. USA, 92, 8393-8397.
Song L. & Poulter C.D., 1994. Yeast farnesyl diphosphate synthase:site-directed mutagenesis of residues in highly conserved prenyltransferase domain I and II. Proc. Natl Acad. Sci. USA, 91, 3044-3048.
Stewart-Jones A. et al., 2007. Structure, ratios and patterns of release in the sex pheromone of an aphid, Dysaphis plantaginea. J. Exp. Biol., 210, 4335-4344.
Tarshis L.C., Yan M., Poulter C.D. & Sacchettini J.C., 1994. Crystal structure of recombinant farnesyl diphosphate synthase at 2.6-A resolution. Biochemistry, 33, 10871-10877.
Tarshis L.C. et al., 1996. Regulation of product chain length by isoprenyl diphosphate synthases. Proc. Natl Acad. Sci. USA, 93, 15018-15023.
Tholl D. et al., 2004. Formation of monoterpenes in Antirrhinum majus and Clarkia breweri flowers involves heterodimeric geranyl diphosphate synthases. Plant Cell, 16, 977-992.
Wang K. & Ohnuma S., 1999. Chain-length determination mechanism of isoprenyl diphosphate synthases and implications for molecular evolution. Trends Biochem. Sci., 24, 445-451.
Westerlund S.A. & Hoffmann K.H., 2004. Rapid quantification of juvenile hormones and their metabolites in insect haemolymph by liquid chromatography-mass spectrometry (LC-MS). Anal. Bioanal. Chem., 379, 540-543.
Wilkin D.J., Kutsunai S.Y. & Edwards P.A., 1990. Isolation and sequence of the human farnesyl pyrophosphate synthetase cDNA. Coordinate regulation of the mRNAs for farnesyl pyrophosphate synthetase, 3-hydroxy-3-methylglutaryl coenzyme A reductase, and 3-hydroxy-3-methylglutaryl coenzyme A synthase by phorbol ester. J. Biol. Chem., 265, 4607-4614.
Yeh L.S. & Rilling H.C., 1977. Purification and properties of pig liver prenyltransferase: interconvertible forms of the enzyme. Arch. Biochem. Biophys., 183, 718-725.
Zuber M., Meyer H., Kohnle U. & Francke W., 1993. Odour production and pheromone response in the European engraver bark beetles, Ips amitinus (Eichh.) and Ips amitinus var. montana Fuchs (Coleoptera: Scolytidae). J. Appl. Entomol., 115, 462-465.
Pour citer cet article
A propos de : Sophie Vandermoten
Gembloux Agricultural University – FUSAGx. Entomologie fonctionnelle et évolutive. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : vandermoten.s@fsagx.ac.be
A propos de : Michel Cusson
Natural Resources Canada. Canadian Forest Service. Laurentian Forestry Centre. 1055 Rue du PEPS. Québec. CDN-Québec G1V4C7 (Canada).
A propos de : Frédéric Francis
Gembloux Agricultural University – FUSAGx. Entomologie fonctionnelle et évolutive. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
A propos de : Éric Haubruge
Gembloux Agricultural University – FUSAGx. Entomologie fonctionnelle et évolutive. Passage des Déportés, 2. B-5030 Gembloux (Belgique).






