- Home
- Volume 11 (2007)
- Numéro 1
- Variabilité de la composition chimique des huiles essentielles de Mentha rotundifolia du Nord de l’Algérie
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Variabilité de la composition chimique des huiles essentielles de Mentha rotundifolia du Nord de l’Algérie

Editor's Notes
Reçu le 19 août 2005, accepté le 11 octobre 2006.
Résumé
Les huiles essentielles de Mentha rotundifolia (L.) Huds obtenues par entraînement à la vapeur d’eau, à l’échelle semi pilote (rendement : 0,8 %), sont analysées par GC-MS et GC-FID. Les résultats montrent l’existence vraisemblable de deux chémotypes l’un « l’oxyde de pipéritone », le second « pipériténone » qui sont caractérisés par des teneurs différenciées en ces deux constituants. Le premier contient l’oxyde de pipéritone (19,7–31,4 %) et l’oxyde de pipériténone (27,8–29,4 %) comme constituants majoritaires tandis que le second révèle une teneur très élevée en pipériténone (54,9 %) et en oxyde de pipériténone (17,6 %), ces deux espèces moléculaires représentant les 75 % des produits identifiés. Ce chémotype très particulier est rapporté pour la première fois chez l’espèce Mentha rotundifolia (L.) Huds.
Abstract
Variability of the chemical composition of Mentha rotundifolia from Northern Algeria. Algerian oils of Mentha rotundifolia (L.) Huds., obtained by steam distillation (yield : 0,8%), have been analysed by means of GC-FID and GC/MS. The results indicate clearly the occurrence of two chemotypes which are presently described. The former contains high proportions of piperitone oxide (19,7–31,4%) and piperitenone oxide (27,8–29,4%) respectively and the latter revealed piperitenone (54,9%) and piperitenone oxide (17,6%) as the major constituents. Such particular composition is reported for the first time within the M. rotundifolia species.
Table of content
1. Introduction
1Les menthes (Lamiaceae) sont des plantes herbacées, vivaces, très odorantes que l’on trouve particulièrement dans les milieux humides. Il existe de nombreuses espèces de menthe dont certaines, telles M. pulegium et M. rotundifolia, poussent spontanément en Algérie. Ce sont des plantes aromatiques très utilisées en médecine traditionnelle, dans les préparations culinaires, les confiseries, en cosmétique et parfumerie. Mentha rotundifolia, dont le nom vernaculaire est « timarssat » en langue arabe, est un hybride de Mentha longifolia et de Mentha suaveolens (Kokkini, Papageorgiou, 1988 ; Lorenzo et al., 2002) alors que pour d’autres auteurs Mentha rotundifolia et Mentha suaveolens correspondent à la même espèce (Hendriks, Van Os, 1976).
2La composition chimique des huiles essentielles de Mentha rotundifolia poussant dans diverses parties du monde (Kokkini, Papageorgiou, 1988 ; El Arch et al., 2003) a fait l’objet de nombreux travaux et différents chémotypes ont été définis. L’un d’eux est particulièrement riche en oxyde de pipériténone. Ce monoterpène oxygéné possède des effets biologiques très intéressants. Il présente des effets cardiovasculaires (activité hypotensive, vasodilatateur, bradycardie), une activité sur les centres nerveux sympathiques (relaxant, stimulant, dépressant), des propriétés antibactériennes et antifongiques, et agit aussi comme agent retardant la reproduction du vecteur de malaria Anopheles stephensis (Damien et al., 2003 ; Tripathi et al., 2004). L’oxyde de pipériténone est également intéressant pour la synthèse des hétérocycles, de pyrazoles, de pyrazolines et d’alcools allyliques (Ghoulami et al., 2001). L’objectif de cette étude est de déterminer la composition chimique des huiles essentielles de Mentha rotundifolia, poussant à l’état sauvage dans trois régions du nord de l’Algérie et de mettre en évidence une éventuelle variabilité de la composition chimique de ces huiles. Cette étude s’intègre dans le contexte plus global de la mise en valeur de la biodiversité des plantes aromatiques algériennes pour leurs propriétés tant médicinales qu’alimentaires.
2. Matériel et Méthodes
2.1. Matériel végétal et extraction des constituants volatils
3Les parties aériennes de Mentha rotundifolia ont été récoltées durant le mois de novembre 2004 dans trois localités du nord de l’Algérie : Sandjas (W. Chlef), Miliana et Rouina (W. Ain Defla) ayant pour altitude respectivement 500, 780 et 280 m. Les specimens ont été déposés dans l’herbier de la Faculté des Sciences agronomiques et de Biologie de l’Université Hassiba Ben Bouali de Chlef (Algérie). Trois lots d’échantillons préalablement séchés à l’ombre (350 g), à une température maximale de 25 °C, sont soumis à l’entraînement à la vapeur d’eau dans une installation semi pilote. L’extraction est effectuée durant une heure, à la température de 100 °C et sous une pression de 1,2 bar. La vapeur d’eau enrichie de constituants volatils est condensée puis décantée à 20 °C. Les essais ont été répétés trois fois.
4Analyse chromatographique en phase gazeuse avec détection par ionisation de flamme GC-FID. L’analyse chimique des huiles essentielles est effectuée à l’aide d’un chromatographe en phase gazeuse HP GC 6890A, équipé d’un détecteur à ionisation de flamme. La colonne capillaire 5 % Phényl Méthyl Siloxane possède les caractéristiques suivantes (longueur : 30 m ; diamètre interne : 0,25 mm ; épaisseur du film : 0,25 μm). Les conditions opératoires sont
5– la température de l’injecteur splitless : 280 °C ;
6– la température du détecteur FID : 300 °C ;
7– la programmation de température de 40 °C (1 min) à 200 °C à raison de 6 °C/min puis de 200 à 280 °C à 30 °C/min et maintien à 280 °C pendant 2 min ;
8– le gaz vecteur : He à 1 ml/min (vitesse linéaire moyenne = 33 cm/sec).
9Analyse GC/MS. Le spectromètre de masse, Agilent 5973 à quadripole est couplé à un chromatographe en phase gazeuse Agilent 6890. La colonne utilisée est identique à celle mentionnée ci-dessus. Les conditions opératoires sont
10– la température de l’injecteur splitless : 250 °C ;
11– la programmation de température : de 40 °C à 250 °C à raison de 6 °C/min ;
12– le gaz vecteur : He à 1 ml/min (vitesse linéaire moyenne = 36 cm/sec).
13Les températures de la source et du quadripole sont fixées à 230 °C et 150 °C respectivement ; énergie d’ionisation 70 eV, gamme de masse : 35 à 400 amu. L’identification des différents constituants est réalisée à partir de leurs spectres de masse en comparaison avec ceux des composés standard de la banque de données informatisées (Wiley 275.L, Adams, 2001). Pour les hydrocarbures terpéniques diverses confirmations sont obtenues par comparaison des spectres de masse et de leurs indices de rétention selon Kovats donnés par la littérature (Joulain, König, 1998 ; Adams, 2001).
3. Résultats et discussion
14Les extractions fournissent des huiles essentielles de couleur jaunâtre avec une très forte et persistante odeur de menthe. L’extraction a été optimisée par des hydrodistillations successives en utilisant des conditions opératoires strictement identiques. Dans tous les essais réalisés, il est apparu qu’au delà d’une heure de traitement (Figure 1), l’oxyde de pipériténone subit une dégradation qui conduit à l’apparition d’une molécule non identifiée par les bases de données informatisées disponibles [Caractéristiques spectrales (M+ = 166), autres ions caractéristiques : 151(21),137(28),123 (96),105 (38), 91(20) 77(25), 67 (29), 55(20), 41/41/, pic de base].
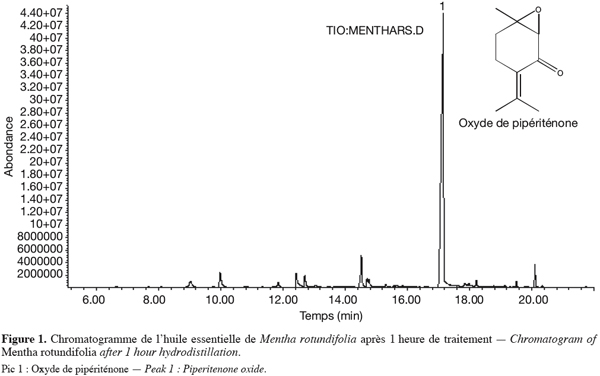
15En effet comme le montre la figure 2, un pic surnémaire apparaît au temps de rétention 17,88 min quelle que soit l’origine de la plante traitée. La levée de l’ambiguïté sur la nature de la molécule passe par son isolement à l’aide de la CPG préparative. Il s’agit d’isoler les quantités suffisantes pour envisager l’étude par spectrométrie RMN.
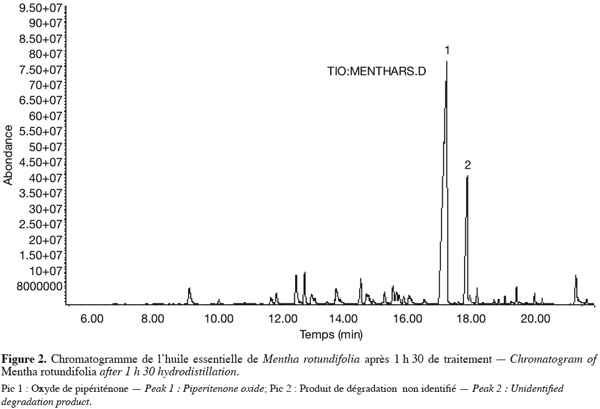
16Ce travail fera partie d’une étude séparée. Compte tenu de la dégradation constatée d’un constituant essentiel, les temps d’extraction ont toujours été limités à 1 heure. Les rendements en huiles essentielles varient de 0,7 % à 0,9 % (g d’huile essentielle/100 g de matériel végétal). Ces faibles valeurs du rendement peuvent être attribuées à la sénescence des feuilles récoltées au mois de novembre correspondant à la période après floraison. On note que les meilleures rendements (1,6–1,8 %) sont obtenus durant la période de floraison (juin - juillet). Les composés identifiés dans les huiles essentielles de Mentha rotundifolia provenant des trois régions mentionnées ci-dessus sont repris au tableau 1.
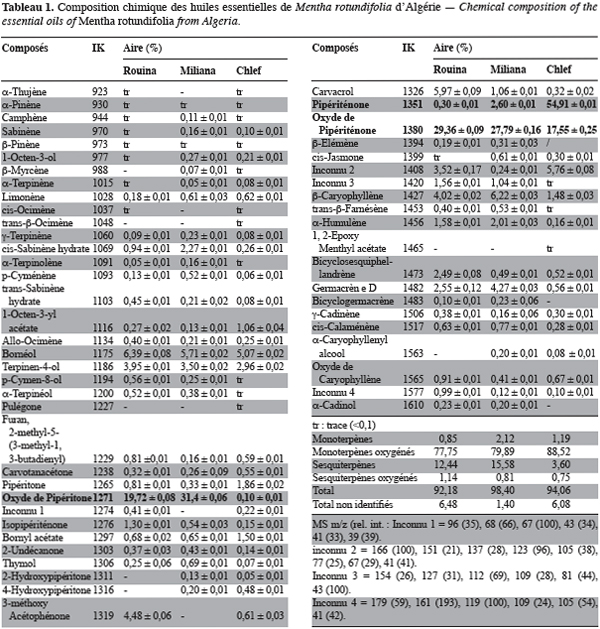
17Quarante quatre composés sont identifiés pour l’échantillon provenant de Rouina et quarante cinq pour celui provenant de Miliana (Tableau 1) ; les composés majoritaires sont l’oxyde de pipéritone (Miliana : 31,4 % ; Rouina : 19,7 %) et l’oxyde de piperiténone (Miliana : 27,8 % ; Rouina : 29,4 %) représentant le chémotype 1. L’oxyde de pipéritone a été rapporté comme constituant majoritaire de l’huile essentielle de M. rotundifolia de Grèce (Kokkini, Papageorgiou, 1988) et d’Allemagne (Van Os, Hendriks, 1975). Quarante huit constituants sont identifiés pour l’échantillon provenant de Chlef. Les molécules majoritaires sont la pipériténone (54,9 %) et l’oxyde de pipériténone (17,6 %) représentant le chémotype 2. L’oxyde de pipériténone a été rapporté comme constituant caractéristique des huiles volatiles de quelques chémotypes de Mentha rotundifolia (Lorenzo et al., 2002 ; Nagell, Hefendehl, 1974), M. spicata (Pino et al., 1998), M. longifolia (Adams, 2001 ; Venskutonis, 1996) et M. villosa (Abreu Matos et al., 1999). Des travaux antérieurs à la présente étude ont porté sur la variation de la composition chimique des huiles essentielles de M. rotundifolia et ont révélé l’existence de chémotypes particuliers avec comme composés majoritaires l’acétate de menthyle (Kokkini, Papageorgiou, 1988), la dihydrocarvone (Hendriks et al., 1976), le 2,4(8), 6-p-menthatrien-2,3 diol (Pino et al., 1999) et la pulégone (Il Idrissi, Bellakhdar, 1989).
18La différence de composition constatée sur les huiles essentielles investiguées est vraisemblablement à mettre en rapport avec des facteurs abiotiques tels que le climat spécifique aux régions de provenance des échantillons, les facteurs géographiques comme l’altitude et la nature du sol. A la meilleure connaissance des auteurs, la pipériténone n'a jamais été rapportée comme constituant majoritaire de Mentha rotundifolia et l'échantillon provenant de Chlef représente, selon toute vraisemblance, un nouveau chémotype typique du Nord de l’Algérie et dont les propriétés fonctionnelles sont en cours d’étude.
Bibliographie
Abreu Matos FJ., Lacerda Machado MI., Craveiro AA., Alencar JW., Barbosa JME., Leitao da Cunha V., Hiruma CA. (1999). Essential oil of Mentha x villosa from northeastern Brazil. J. Essent. Oil Res. 11, p. 41–44.
Abu-Al-Futuh IM., Abdelmageed OH., Jamil RM., Avato P. (2000). A piperitenone oxide chemotype of Mentha longifolia (L.) Huds. Growing in Jordan. J. Essent. Oil Res. 12 (5), p. 530–532.
Adams RP. (2001). Identification of Essential Oil Components by Gaz Chromatography/Quadrupole Mass Spectroscopy. Carol Stream, IL., USA: Allured Publishing Co.
Baser KHC., Kürkçüoglu M., Tarimcilar G., Kaynak G. (1999). Essential Oils of Mentha Species from Northern Turkey. J. Essent. Oil Res. 11, p. 579–588.
Damien Dorman HJ., Kosar M., Kahlos K., Holm Y., Hiltunen R. (2003). Antioxidant properties and Composition of aqueous Extracts from Mentha Species, Hybrids, Varieties and Cultivars. J. Agric. Food Chem. 51, p. 4563–4569.
El Arch M., Satrani B., Farah A., Bennani L., Briky D., Fechtel M., Blaghen M., Talbi M. (2003). Chemical composition and antimicrobial and insecticidal activities of the essential oil in Mentha rotundifolia from Morocco. Acta Bot. Gallica 150 (3), p. 267–274.
Ghoulami S., Il Idrissi A., Fkih Tetouani S. (2001). Synthèse de nouveaux hétérocycles à partir de l’oxyde de piperiténone. Tetrahedron Lett. 42, p. 2107–2109.
Hendriks H.,Van Os FHL. (1976). Essential Oils of two chemotypes of M. suaveolens during ontogenesis. Phytochemistry 15, p. 1127–1130.
Hendriks H., Van Os FHL, Feenstra WJ. (1976). Crossing experiments between some chemotypes of M. longifolia and M. suaveolens. Planta Med. 30, p. 154–162.
Il Idrissi A., Bellakhdar J. (1989). Etude chimiotaxinomique de diverses populations de Mentha suaveolens Ehrh. du Maroc : Nouvelles données. Al Biruniya 5 (2), p. 79–88.
Joulain D., König WA. (1998). The Atlas of Spectral Data of Sesquiterpene Hydrocarbons, Hambourg: E.B.- Verlag.
Kokkini S., Papageorgiou VP. (1988). Constituents of Essential Oils from Mentha X rotundifolia Growing Wild in Greece. Planta Med. 38, p. 166–167.
Lahlou S., Carneiro-Leo RFL., Leal-Cardoso JH., Toscano CF. (2001). Cardiovascular effects of the essential oil of Mentha x villosa and its main constituent, piperitenone oxide, in normotensive anaesthetised rats: Role of the autonomic nervous system. Planta Med. 67 (7), p. 638–643.
Lawrence BM. (1978). A Study of the Monoterpenene Interrelationships in the Genus Mentha with Special Reference to the Origin of Pulegone and Menthofuran. Ph.D. Thesis. Groningen, The Netherlands : Rijksuniversiteit, p. 123–144.
Lorenzo D., Paz D., Dellacassa E., Davies P., Vila R., Canigueral S. (2002). Essential Oils of Mentha pulegium and Mentha rotundifolia from Uruguay. Bras. Arch. Boil. Technol. 45 (4), p. 519–524.
Nagell A., Hefendehl FW. (1974). Composition of the essential oil of Mentha rotundifolia. Planta Med. 26, p. 1–8.
Oumzil H., Ghoulami S., Radjaoui M., Il Idrissi A., Fkih Tetouani S., Faid M., Bendjouad A. (2002). Antibacterial and antifungal activity of essential oils of Mentha suaveolens. Phytother. Res. 16 (8), p. 727–731.
Pino JA., Rosado A., Fuentes V. (1998). Essential Oil of Mentha spicata (L.) from Cuba. J. Essent. Oil Res. 10, p. 657–659.
Pino JA., Rosado A., Fuentes V. (1999). Chemical Composition of the Leaf Oil of Mentha rotundifolia (L.) Hudson from Cuba. J. Essent. Oil Res. 11, p. 241–242.
Raya MDP., Utrilla MP., Navarro MC., Jiminez J. (1990). CNS activity of Mentha rotundifolia and Mentha longifolia essential oil in mice and rats. Phytotherapy 4 (6), p. 232–234.
Sousa PJC., Magalhaes PJC., Lima CC., Oliveira VS., Leal Cardoso JH. (1997). Effects of piperitenone oxide on the intestinal smooth muscle of the guinea pig. Bras. J. Med. Biol. Res. 30 (6), p. 787–791.
Tripathi AK., Prajapati V., Ahmad A., Aggarwal KK., Khanuja SPS. (2004). Piperitenone oxide as Toxic, Reppellent and Reproduction Retardant Toward Malarial Vector Anopheles stephensi (Diptera: Anophelinae). J. Med. Entomol. 41 (4), p. 691–698.
Van Os FHL., Hendriks H. (1975). Investigation of a population of Mentha X niliaca Juss. ex Jacq. found in natural conditions at oudemolen. Acta Bot. Neerl. 24, p. 129–133.
Venskutonis PR. (1996). A chemotype of Mentha longifolia L. from Lithuania rich in piperitenone oxide. J. Essent. Oil Res. 8, p. 91–95.
To cite this article
About: Moussa Brada
Laboratoire d’Analyse Fonctionnelle des Procédés Chimiques. Centre Universitaire de Khemis-Miliana. Route de Thenia. W. Aïn-Defla, 44225 (Algérie). E-mail : bradamoussa@yahoo.fr
About: Mohamed Bezzina
Laboratoire d’Analyse Fonctionnelle des Procédés Chimiques. Université Saad Dahleb. Route de Soumaa. W. Blida, 09000 (Algérie).
About: Michel Marlier
Unité de Chimie générale et Chimie organique. Faculté universitaire des Sciences agronomiques de Gembloux. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
About: Annabelle Carlier
Unité de Chimie générale et Chimie organique. Faculté universitaire des Sciences agronomiques de Gembloux. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
About: Georges Lognay
Unité de Chimie analytique. Faculté universitaire des Sciences agronomiques de Gembloux. Passage des Déportés, 2. B-5030 Gembloux (Belgique).






