- Accueil
- volume 13 (2009)
- numéro 1
- Activité larvicide sur Anopheles gambiae Giles et composition chimique des huiles essentielles extraites de quatre plantes cultivées au Cameroun
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Activité larvicide sur Anopheles gambiae Giles et composition chimique des huiles essentielles extraites de quatre plantes cultivées au Cameroun

Notes de la rédaction
Reçu le 16 juillet 2007, accepté le 8 avril 2008
Résumé
Les huiles essentielles obtenues par hydrodistillation des feuilles sèches de Cymbopogon citratus (DC.) Stapf, Ocimum canum Sims, Ocimum gratissimum L. var 'gratissimum' L. et Thymus vulgaris L. cultivés au Cameroun ont été analysées et leur activité larvicide sur Anopheles gambiae Giles déterminée. Les rendements d'extraction ont montré que T. vulgaris est plus riche en huile essentielle (0,95 %) que C. citratus (0,67 %). O. canum et O. gratissimum ont sensiblement la même teneur en constituants volatils (0,59 % et 0,60 %, respectivement). L'analyse par chromatographie en phase gazeuse (CPG) et couplage chromatographie en phase gazeuse-spectrométrie de masse (CPG/SM) a révélé que ces huiles sont toutes à majorité monoterpénique (86,8-97,4 %). Les monoterpènes oxygénés sont prédominants dans les essences de C. citratus et d'O. canum (81,6 % et 68,9 %, respectivement) alors que les monoterpènes hydrocarbonés sont majoritaires dans l'huile essentielle d'O. gratissimum (61,0 %). Enfin, T. vulgaris se caractérise par une proportion sensiblement identique de monoterpènes hydrocarbonés (45,0 %) et de monoterpènes oxygénés (48,9 %). Les constituants majeurs identifiés dans l'essence de C. citratus sont des monoterpènes acycliques tels que le géraniol (15,6 %), le géranial (39,3 %), le néral (21,9 %) et le myrcène (14,0 %). L'huile essentielle de T. vulgaris se distingue par une prépondérance de structures p-menthaniques dominées par le thymol (40,1 %), le p-cymène (23,4 %) et le γ-terpinène (15,1 %). Le p-cymène (32,1 %) et le thymol (24,3 %) sont également les constituants quantitativement les plus importants de l'huile volatile d'O. gratissimum alors que le linalol (56,3 %) et le limonène (10,9 %) prédominent dans celle d'O. canum. Les tests biologiques effectués selon une méthodologie inspirée du protocole standard de l'OMS ont révélé que ces huiles possèdent de remarquables propriétés larvicides. Elles induisent 100 % de mortalité des larves de stade 4 d'A. gambiae à la concentration de 100 ppm pour C. citratus, 200 ppm pour T. vulgaris, 350 ppm pour O. gratissimum et 400 ppm pour O. canum. Les CL50 et les CL80 mesurées pour les quatre huiles essentielles indiquent le même ordre de réactivité. L'huile essentielle de C. citratus est l'extrait le plus efficace avec des valeurs respectives de : CL50 = 18 ppm et CL80 = 25 ppm.
Abstract
Larvicidal activity against Anopheles gambiae Giles and chemical composition of essential oils from four plants cultivated in Cameroon. The chemical composition of the essential oils obtained by hydrodistillation of dry leaves from Cymbopogon citrates (DC.) Stapf, Ocimum canum Sims, Ocimum gratissimum L. var 'gratissimum' L. and Thymus vulgaris L. cultivated in Cameroon were analyzed and their larvicidal activity against fourth instar larvae of Anopheles gambiae Giles were determined. The yields of extraction indicate that T. vulgaris (0.95%) was richer in essential oil than C. citratus (0.67%). O. canum and O. gratissimum have approximately the same content in volatile constituents (0.59% and 0.60%, respectively). The analyses by GC and GC/MS showed that these oils are monoterpenic (86.8-97.4%). Oxygenated monoterpenes predominate in C. citratus and O. canum (81.6% and 68.9%, respectively) while O. gratissimum oil contains a majority of monoterpene hydrocarbons (61.0%). T. vulgaris is characterized by the same proportion of monoterpene hydrocarbons (45.6%) and oxygenated monoterpenes (48.9%). The main compounds found in the essential oil of C. citratus are acyclic monoterpenes such as geraniol (15.6%), geranial (39.3%), neral (21.9%) and myrcene (14.0%). The essential oil of T. vulgaris is characterized by p-menthane structures given by thymol (40.1%), p-cymene (23.4%) and γ-terpinene (15.1%); p-cymene (32.1%) and thymol (24.3%) were also the constituents quantitatively important in O. gratissimum essential oil while linalool (56.3%) and limonene (10.9%) were predominant in O. canum. Bioassay test done by the World Health Organization standard protocol revealed that these essential oils have remarkable larvicidal properties as they could induce 100% mortality in the larvae of A. gambiae at the concentration of 100 ppm for C. citratus, 200 ppm with T. vulgaris, 350 ppm for O. gratissimum and 400 ppm for O. canum. Their LC50 and LC80 show the same reactivity order. The essential oil of C. citratus was found to be the most efficient, with respective values of: LC50 = 18 ppm and LC80 = 25 ppm.
Table des matières
1. Introduction
1Le paludisme, également connu sous le nom de malaria, demeure de loin la parasitose la plus importante dans le monde intertropical, et particulièrement en Afrique au sud du Sahara. Les données statistiques estiment entre 300 et 500 millions le nombre de personnes atteintes par an avec environ 1,5 à 3 millions de décès, notamment chez les enfants de moins de cinq ans et chez les femmes enceintes (World Health Organization, 2000). Au Cameroun, le paludisme demeure une endémie majeure. Selon le Ministère camerounais de la Santé publique, cette maladie représente 40 à 50 % des consultations médicales, 23 % des cas d'hospitalisation et consomme environ 40 % du budget annuel de santé des ménages (Minsanté, 2000).
2De nombreux obstacles s'opposent aux efforts de la communauté scientifique à contrôler la malaria, à savoir : la recrudescence de la résistance du Plasmodium aux antipaludéens traditionnellement utilisés pour l'action curative des malades ; la résistance des moustiques aux insecticides ; les conditions d'hygiène dans certaines de nos grandes villes qui favorisent le contact homme/moustique et les problèmes économiques (coût élevé des nouveaux antipaludiques, des moustiquaires et des insecticides).
3Face au paludisme ainsi devenu un problème de santé publique, l'Organisation Mondiale de la Santé préconise la mise sur pied de nouvelles stratégies pour venir à bout de ce fléau. L'une des méthodes qui a démontré son efficacité est le contrôle des populations de vecteurs (larves et adultes), notamment les espèces de moustiques du genre Anopheles directement impliquées dans la transmission de cette maladie parasitaire. Ces moyens de lutte antivectorielle utilisent, entre autres, les moustiquaires imprégnées et les pulvérisations intradomiciliaires d'insecticides de synthèse. Malheureusement, la plupart de ces produits chimiques ont des effets néfastes pour l'homme, les animaux et l'environnement du fait de leur accumulation dans le milieu naturel (Chandre et al., 2000 ; Hargreaves et al., 2000). D'où l'urgence de rechercher des insecticides naturels qui, tout en étant aussi actifs, sont biodégradables. C'est dans le but d'apporter notre contribution à ce volet de la recherche que nous avons récolté, extrait et analysé la composition chimique des huiles essentielles de Cymbopogon citratus (DC.) Stapf, Ocimum canum Sims, Ocimum gratissimum L. et Thymus vulgaris L. en vue de déterminer leur activité larvicide sur les souches d'Anopheles gambiae Giles, vecteur principal du paludisme en Afrique subsaharienne. Ces plantes ont été choisies en raison de leurs utilisations traditionnelles comme insectifuges.
4En effet, C. citratus (lemongrass) est une herbe pérenne poussant en touffe dense. La plante qui est originaire de l'Inde est cultivée au Cameroun dans les jardins autour des cases d'habitation (Noumi, 1984). Les extraits de C. citratus sont largement utilisés dans la pharmacopée traditionnelle camerounaise, notamment pour soulager les maux d'estomac (Mapi, 1988).
5O. canum (basilic à petites feuilles) et O. gratissimum (basilic à grandes feuilles) sont deux plantes très parfumées cultivées à proximité des villages et dans les jardins potagers. En dehors de leur utilisation comme aromates, elles entrent dans la liste des plantes utilisées comme insecticides (Mapi, 1988).
6T. vulgaris (thym) est un sous-abrisseau très aromatique, originaire du bassin méditerranéen. Il a été introduit au Cameroun où il se cultive aujourd'hui sur les sols rocailleux de l'Ouest (Hutchinson et al., 1963). Outres ses vertus culinaires comme aromate, le thym possède de multiples autres propriétés. L'infusion de la plante entière est utilisée contre les maux de l'appareil respiratoire (toux, bronchite, asthme) et son huile essentielle possède aussi une forte activité bactéricide mise à profit dans certains produits pharmaceutiques (Debuigne, 1982).
2. Matériel et méthodes
2.1. Récolte des plantes et extraction des huiles essentielles
7Le matériel végétal est constitué des feuilles de C. citratus, O. canum, O. gratissimum et T. vulgaris récoltées en avril 2005 (Tableau 1). Les spécimens ont été identifiés à l'Herbier National de Yaoundé par le Dr. Onana Jean Michel sous les numéros d'herbiers respectifs de 48536/SFR, 15866/SRF/Cam, 5817/SRF/Cam et 25746/SRF.

8Des fractions d'environ 700 g de feuilles séchées pendant 48 h à la température ambiante du laboratoire de chaque échantillon ont été soumises à une hydrodistillation pendant 5 h grâce à un appareillage de type Clevenger. L'huile essentielle recueillie par décantation à la fin de la distillation a été filtrée sur colonne de sulfate de sodium anhydre pour éliminer les traces d'eau résiduelles. L'essence ainsi obtenue est mise dans des flacons sombres et le rendement d'extraction calculé par rapport au poids du matériel végétal séché avant extraction.
2.2. Analyse de la composition chimique par chromatographie en phase gazeuse et couplage chromatographie en phase gazeuse – spectrométrie de masse
9Chromatographie en phase gazeuse. L'analyse chimique des huiles essentielles a été effectuée à l'aide d'un chromatographe de type Varian CP-3380 équipé d'un détecteur à ionisation de flamme et d'une colonne capillaire (longueur 30 m, diamètre interne 0,25 mm) avec une phase stationnaire apolaire de type méthylsilicone (DB-1, épaisseur du film 0,25 μ). L'azote est utilisé comme gaz vecteur avec un débit de 0,8 ml.min-1. La température de l'injecteur est de 220 °C ; le détecteur est réglé à 250 °C. Le four est programmé de 50 °C à 200 °C avec un gradient de température de 5 °C.min-1.
10Les indices de rétention des différents constituants ont été calculés par rapport aux temps de rétention d'une série de n-alcanes et leurs pourcentages relatifs calculés par intégration électronique en considérant que leurs facteurs de réponses sont tous égaux à 1.
11Chromatographie en phase gazeuse – spectrométrie de masse. Le couplage chromatographie en phase gazeuse – spectrométrie de masse a été réalisé à l'aide d'un appareillage de marque Hewlett Packard HP 5970 A, équipé d'une colonne capillaire apolaire (30 m x 0,25 mm) en silice fondue de type HP-1 (épaisseur du film 0,25 μ) et d'un détecteur de type quadripôle (énergie d'ionisation 70 eV). La température de l'injecteur est de 220 °C et celle de la zone d'interface à 210 °C. Injection en mode split (1/100) de 1 µl d'une solution d'huile essentielle à 10 % dans le dichlorométhane. La température du four est programmée de 70 °C à 200 °C avec un gradient de 10 °C.min-1. Le gaz vecteur est l'hélium avec un débit de 0,6 ml.min-1. L'acquisition a été effectuée en mode scan [35-300 amu] à 2,96 scan.sec-1.
12Identification des constituants. L'identification des constituants des huiles essentielles a été faite sur la base de leurs indices de rétention et de leurs spectres de masse par comparaison avec les données de la littérature (Joulain et al., 1998 ; Adams, 2001) et de la librairie personnelle du laboratoire.
2.3. Collecte des larves d'anophèles et tests biologiques
13Les eaux stagnantes ont été systématiquement scrutées dans la localité de Maképè Missokè (Douala-Cameroun). Les larves d'anophèles ont été repérées par leur position horizontale à la surface de l'eau. Le gîte larvaire a été ensuite entièrement vidé et l'eau introduite dans des bassines en plastique (30 × 20 × 10 cm). Les larves flottant à la surface ont été recueillies par tamisage, rincées abondamment à l'eau de puits (exempte de certains composés susceptibles d'être nocifs aux larves, tels que les dérivés chlorés) et introduites dans des bocaux en verre de 500 ml. Au laboratoire, elles ont été identifiées et nourries aux biscuits (2 g de poudre de biscuits par boîte de 500 ml contenant l'eau de puits) pendant 24 h avant leur utilisation pour les tests.
14Ces tests ont consisté à évaluer la mortalité des larves d'anophèles en présence des solutions diluées d'huiles essentielles suivant une méthodologie inspirée du protocole de l'Organisation Mondiale de la Santé (World Health Organization, 1985). En effet, 25 larves de stade 4 ont été prélevées à l'aide d'une pipette pasteur et mises dans des gobelets de 5 cm de diamètre contenant chacun 99 ml d'eau de puits. Des expériences préliminaires ont permis de sélectionner une gamme de concentrations pour les tests proprement dits. Pour ce faire, des solutions-mères d'huiles essentielles de chaque échantillon ont été préparées dans l'éthanol absolu, à partir desquelles des dilutions ont été réalisées dans l'eau de puits pour obtenir des concentrations expérimentales finales de 500 à 15 ppm (par introduction d'un millilitre de chaque solution ainsi diluée dans les gobelets de 5 cm précédemment préparés, ce qui correspond dans tous les cas à une concentration en éthanol de 1 %). Trois répétitions ont été réalisées pour chaque dilution. Deux gobelets témoins ont été également constitués dans les conditions identiques aux gobelets tests. Le témoin négatif ne contenait que de l'éthanol (dans les mêmes proportions que pour les essais, c'est-à-dire à 1 %) sans aucune trace d'huile essentielle tandis que le témoin positif renfermait un larvicide de référence (Bacillus thuringiensis israelensis, Bti) préparé à la concentration de 8 ppm. Le comptage des larves a été réalisé après 24 h d'exposition aux extraits volatils solubilisés dans l'eau. L'analyse statistique des moyennes est réalisée à l'aide du test de l'analyse de variance à deux facteurs (ANOVA 2). Les moyennes de mortalité ont été traitées et comparées par le test de Scheffé (test analytique) au seuil de P = 0,05 (SAS, 1990). Pour évaluer plus précisément l'efficacité de la toxicité de ces huiles, nous avons calculé les CL50 et CL80, définies comme étant les concentrations létales provoquant respectivement 50 % et 80 % de mortalité dans la population de larves traitées. Ces valeurs ont été déterminées à partir d'une courbe expérimentale donnant les variations du pourcentage de mortalité, à 24 h, en fonction des doses croissantes d'huile essentielle.
3. Résultats et discussion
15Des huiles essentielles de couleur jaune clair et brun ont été obtenues par hydrodistillation des échantillons végétaux avec des rendements variant de 0,59 % à 0,95 % (Tableau 1). T. vulgaris est légèrement plus riche en huile essentielle (0,95 %) que C. citratus (0,67 %), O. gratissimum (0,60 %) et O. canum (0,59 %). Ces rendements sont supérieurs, quelle que soit l'espèce considérée, aux valeurs obtenues lors de nos investigations antérieures (Amvam et al., 1988 ; Tchoumbougnang et al., 2005 ; 2006). Ces résultats peuvent s'expliquer par le fait que les valeurs ont été calculées sur la base du poids sec des échantillons.
16Les résultats des analyses chimiques des quatre échantillons d'huiles essentielles sont donnés dans le tableau 2. Son examen indique que l'essence de C. citratus est à majorité monoterpénique (97,4 %), avec une prépondérance de composés oxygénés (81,0 %) dominés par le géraniol (15,6 %), le géranial (39,3 %) et le néral (21,9 %). Dans le groupe des monoterpènes hydrocarbonés, le myrcène représente 14,0 % du mélange.
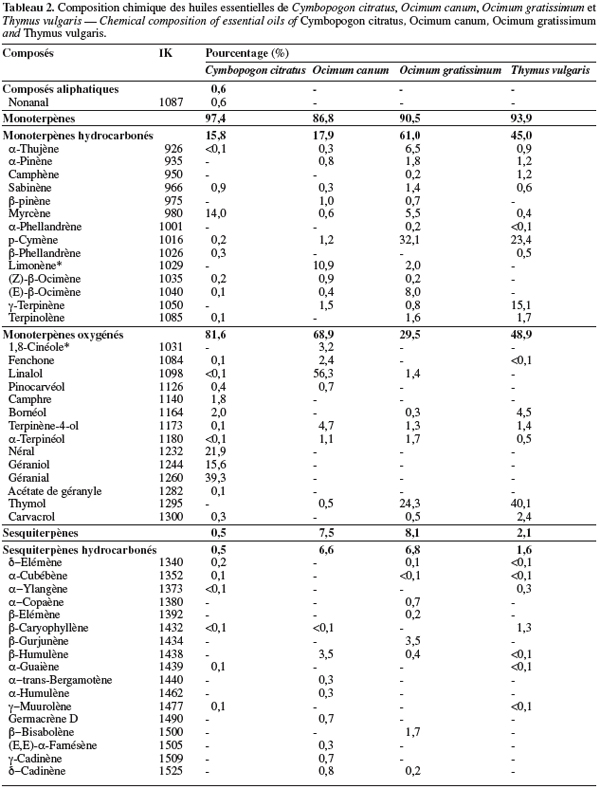
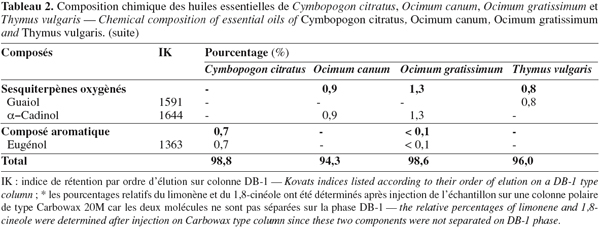
17Le néral et le géranial sont caractéristiques du lemongrass, quelle que soit son origine géographique ; ces composés ont par exemple été signalés en quantité importante (39,7 % et 60,3 %, respectivement) dans l'huile essentielle de l'espèce C. citratus d'origine brésilienne (Barreira et al., 2004). Les sesquiterpènes sont minoritaires dans l'échantillon analysé, puisque aucun n'a été identifié à un taux supérieur à 1,0 %. Par ailleurs, il est intéressant de signaler la présence d'un constituant aliphatique, le nonanal (0,6 %), ainsi que celle d'un composé aromatique, l'eugénol (0,7 %). Ce dernier constituant est signalé très rarement dans le lemongrass ; il a été identifié dans des échantillons d'huiles essentielles de l'espèce C. citratus d'Afrique de l'Ouest à une teneur de 0,3 % (Addae-Mensah et al., 1996).
18L'huile essentielle de T. vulgaris est également de type monoterpénique (93,9 %), avec une proportion sensiblement identique de monoterpènes hydrocarbonés (45,0 %) et de monoterpènes oxygénés (48,9 %). Le principal constituant de la fraction oxygénée est le thymol (40,1 %). Parmi les monoterpènes hydrocarbonés, on peut citer le p-cymène (23,4 %) et le γ-terpinène (15,1 %) qui prédominent. Ces résultats sont en accord avec ceux obtenus par Pino et al. (1997) qui décrivent un échantillon caractérisé par un fort taux de thymol (34,6 %), de γ-terpinène (17,6 %) et de p-cymène (17,6 %). En revanche, ils diffèrent de ceux publiés par Naguib (2002) dont l'essence se caractérise plutôt par une forte teneur en thymol (36,6 %), α-thujone (23,2 %) et 1,8-cinéole (13,4 %).
19L'huile essentielle d'O. gratissimum est riche en monoterpènes dont les plus remarquables sont le p-cymène (32,1 %) et le thymol (24,3 %). Dans l'huile essentielle d'O. canum, les monoterpènes (86,8 %) sont fortement représentés par le linalol (56,3 %) et le limonène (10,9 %). Ces compositions chimiques concordent avec celles obtenues précédemment pour ces deux espèces d'Ocimum (Amvam et al., 1988 ; Markouk et al., 2000 ; Tchoumbougnang et al., 2005 ; 2006).
20Les résultats des tests d'activités larvicides réalisés sur les huiles essentielles (Figure 1 et Tableau 3) indiquent une relation directe des pourcentages de mortalité des larves L4 avec la concentration en huiles essentielles. Les concentrations minimales nécessaires pour obtenir 100 % de mortalité des larves d'A. gambiae ont été évaluées à 100 ppm pour C. citratus, 200 ppm pour T. vulgaris, 350 ppm pour O. gratissimum et 400 ppm pour O. canum. L'effet toxique des extraits analysés est également clairement mis en évidence avec les valeurs des CL50 et des CL80 : l'huile essentielle de C. citratus demeure la plus efficace, avec des valeurs respectives de 18 ± 0,7 ppm et 25 ± 1,1 ppm tandis que des valeurs 5 à 12 fois supérieures sont obtenues pour les trois autres échantillons : 119 ± 1,5 et 147 ± 2,4 pour l'huile essentielle de T. vulgaris, 180 ± 0,8 et 270 ± 1,3 ppm pour O. gratissimum et 201 ± 0,9 et 300 ± 1,5 ppm pour O. canum.
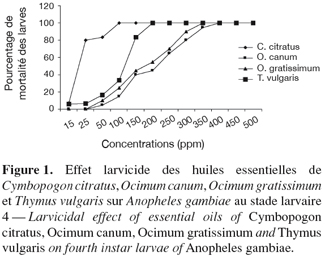

21L'huile essentielle la plus active, obtenue à partir de C. citratus, est caractérisée par une teneur élevée en citral. L'activité intéressante de ces aldéhydes terpéniques avait déjà été mise en évidence lors de l'évaluation antiparasitaire du lemongrass vis-à-vis de Plasmodium berghei (Tchoumbougnang et al., 2005). Les deux autres échantillons les plus actifs, issus de T. vulgaris et de O. gratissimum, sont tous deux riches en thymol, connu pour ses propriétés antiseptiques. L'activité larvicide observée peut être raisonnablement attribuée à la présence de ce constituant phénolique (Laret et al., 1988). D'ailleurs, la différence d'activité observée entre les deux échantillons semble directement liée à la teneur en thymol dans l'huile essentielle : elle est approximativement deux fois plus élevée dans l'essence de T. vulgaris que dans l'essence d'O. gratissimum, pour une efficacité environ 1,7 fois supérieure. L'huile essentielle d'O. canum, riche en linalol, est l'échantillon le moins actif.
22Un potentiel larvicide intéressant pour les échantillons d'huiles essentielles a été observé. Des études similaires réalisées par Traboulsi et al. (2002) ont démontré l'activité insecticide de quatre plantes médicinales récoltées au Liban (Myrtus communis L., Lavandula stoechas L., Origanum syriacum L. et Mentha microphylla K.Koch) sur les larves de Culex pipiens molestus Forskal. Les CL50 obtenues étaient comprises entre 16 à 89 mg.l-1. Des composés phénoliques tels que le carvacrol (61,0 %) et le thymol (21,8 %) étaient quantitativement les plus importants dans l'essence de O. syriacum, un des échantillons les plus actifs (CL50 = 36 mg.l-1). L'évaluation de l'activité larvicide de ces composés dans les mêmes conditions a démontré que le thymol (CL50 = 36,0 mg.l-1) et le carvacrol (CL50 = 37,6 mg.l-1) étaient très certainement à l'origine de cette activité (Traboulsi et al., 2002).
4. Conclusion
23L'utilisation des insecticides de synthèse, de plus en plus réglementée pour la protection de l'environnement, est à l'origine de nombreux cas de résistance chez les insectes. Dans ce contexte, le recours à des molécules naturelles (d'intérêt écologique et économique) aux propriétés insecticides ou insectifuges, de moindre toxicité pour l'homme, se révèle être une démarche alternative à l'emploi des insecticides de synthèse.
24Lors de cette étude, nous avons procédé à l'extraction des huiles essentielles de quatre plantes cultivées au Cameroun, à leur analyse chimique et à l'évaluation de leur potentiel larvicide sur A. gambiae. Tous les échantillons ont montré une activité intéressante sur des larves au stade 4, l'essence de lemongrass étant l'échantillon le plus efficace, avec une CL50 de 18,0 ± 0,7 ppm. Cette espèce aromatique étant très couramment rencontrée et utilisée traditionnellement sur le continent africain, ce résultat ouvre des perspectives intéressantes pour son application dans la production des biocides. Nous envisageons de poursuivre cette étude afin de préciser la nature du (ou des) composé(s) responsable(s) de cette activité par un fractionnement mené en parallèle avec les tests biologiques.
25Remerciements
26Nous remercions M. Djouaka Rousseau (OEAI-Bénin) pour son assistance dans la collecte et l'identification de larves d'A. gambiae ainsi que pour sa contribution dans la finalisation du protocole des tests biologiques.
Bibliographie
Adams R.P., 2001. Identification of essential oils by gas chromatography quadrupole mass spectroscopy. Carol Stream, IL, USA: Allured Publishing Corporation.
Addae-Mensah I., Asomaning W.A. & Oteng-Yeboah A., 1996. Creation of small enterprises Togo-Benin-Ghana. Commercialization of essential oils for small and large-scale soap and cosmetic industries. In: Collin G. & Garneau F.-X., eds. Actes du 3e colloque de produits naturels d'origine végétale de Saint-Jean-sur-Richelieu, 18-24 Octobre 1995, Université Chicoutimi, Quebec, 107-124.
Amvam Zollo P.H. et al., 1988. Aromatic plants of tropical central Africa, Part XXXII: chemical composition and antifungal activity of thirteen essential oils from aromatic plant of Cameroon. Flavour Fragrance J., 13, 107-114.
Barreira C.E.S, Selene M., Lima A.M. & Pinho Santana E.W., 2004. Larvicidal activity of essential oils from Brazilian plants against Aedes aegypti L. Mem. Inst. Oswaldo Cruz, 99(5), 541-544.
Chandre F., Darrier F. & Manga L., 2000. Status of pyrethroid resistance in Anopheles gambiae sensu lato. Bull. World Health Organ., 77, 230-234.
Debuigne G., 1982. Dictionnaire des plantes qui guérissent. Paris : Larousse.
Hargreaves K. et al., 2000. Anopheles funestus resistant to pyrethroid insecticide in South Africa. Med. Vet. Entomol., 14, 181-189.
Hutchinson J. & Dalziel J.M., 1963. Flora of West Tropical Africa, 2nd ed., Vol. 2. London: Crown Agents.
Joulain D. & Köning W.A., 1998. The atlas of spectral data of sesquiterpene hydrocarbons. Hamburg, Germany: EB-Verlag.
Loret H. & Barrandon A., 1886. Flore de Montpellier. Montpellier, France: Edition Calas; Paris : Masson.
Mapi J., 1988. Contribution à l'étude ethnobotanique et analyse chimique de quelques plantes utilisées en médecine traditionnelle dans la région de Nkongsamba (Moungo). Thèse de doctorat : Université de Yaoundé (Cameroun).
Markouk M. et al., 2000. Evaluation of some Moroccan medicinal plants extract for larvicidal activity. J. Ethnopharmacology, 73(12), 293-297.
Minsanté, 2000. Plan stratégique national de lutte contre le paludisme. Yaoundé : Ministère de la Santé publique du Cameroun, 45-49.
Naguib N.Y., 2002. Thyme (Thymus vulgaris L.) growth, oil quality, yield and chemical composition as affected by of chelated iron and two potassium forms. Arab Univ. J. Agric. Sci., 10(3), 893-918.
Noumi E., 1984. Les plantes à épices, à condiments et à arômes du Cameroun. Thèse de doctorat : Université de Yaoundé (Cameroun).
Pino J.A., Estarron M. & Fuentes V., 1997. Essential oil of thyme (Thymus vulgaris L.) grown in Cuba. J. Essent. Oil Res., 9(5), 609-610.
SAS, 1990. SAS Use's guide: Statistics. Cary, NC, USA: SAS Institute.
Tchoumbougnang F., Amvam Zollo P.H., Dagne E. & Mekonnen Y., 2005. In vivo antimalarial activity of essential oils from Cymbopogon citratus and Ocimum gratissimum on mice infected with Plasmodium berghei. Planta medica, 71, 20-23.
Tchoumbougnang F. et al., 2006. Variability in the chemical compositions of the essential oils of five Ocimum species from Tropical African Area. J. Essent. Oil Res., 18, 194-199.
Traboulsi A.F. et al., 2002. Insecticidal properties of essential plant oils against the mosquito Culex pipiens molestus (Diptera: Culicideae). Pest Manage. Sci., 58, 491-495.
World Health Organization (WHO), 1985. Bioassay method for the titration of Bacillus sphaericus: consultation on the developpement of Bacillus sphaericus as a microbial larvicide. World Health Organ., 3, 85-95.
World Health Organization (WHO), 2000. Severe falciparum malaria. Trans. R. Soc. Trop. Med. Hyg., 94, 1-90.
Pour citer cet article
A propos de : François Tchoumbougnang
Université de Douala. Faculté des Sciences. Laboratoire de Biochimie. B.P. 24157. CAM-Douala (Cameroun).
A propos de : Pierre Michel Jazet Dongmo
Université de Ngaoundéré. Ecole Nationale Supérieure des Sciences Agro-Industrielles (ENSAI). BP 455. CAM-Ngaoundéré (Cameroun).
A propos de : Modeste Lambert Sameza
Université de Douala. Faculté des Sciences. Laboratoire de Biochimie. B.P. 24157. CAM-Douala (Cameroun).
A propos de : Edwige Gaby Nkouaya Mbanjo
Université de Douala. Faculté des Sciences. Laboratoire de Biochimie. B.P. 24157. CAM-Douala (Cameroun).
A propos de : Guy Bertrand Tiako Fotso
Université de Douala. Faculté des Sciences. Laboratoire de Biochimie. B.P. 24157. CAM-Douala (Cameroun).
A propos de : Paul Henri Amvam Zollo
Université de Ngaoundéré. Ecole Nationale Supérieure des Sciences Agro-Industrielles (ENSAI). BP 455. CAM-Ngaoundéré (Cameroun).
A propos de : Chantal Menut
Ecole nationale supérieure de Chimie de Montpellier. Equipe Glycochimie. Institut des Biomolécules Max Mousseron (IBMM). Unité Mixte de Recherche (UMR) 5247. CNRS- UM1-UM2. 8 Rue de l'Ecole normale. F-34296 Montpellier Cedex 5 (France). E-mail : chantal.menut@univ-montp2.fr






