- Home
- volume 13 (2009)
- numéro 1
- Elargissement de la base génétique de la principale espèce de cotonnier cultivé Gossypium hirsutum L. par la création et l'exploitation de lignées monosomiques d'addition
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Elargissement de la base génétique de la principale espèce de cotonnier cultivé Gossypium hirsutum L. par la création et l'exploitation de lignées monosomiques d'addition

Editor's Notes
Reçu le 18 septembre 2007, accepté le 9 octobre 2008
Résumé
Le genre Gossypium comprend une quarantaine d'espèces diploïdes qui constituent un important réservoir de gènes d'intérêt pour l'amélioration de Gossypium hirsutum L., la principale espèce de cotonnier cultivé tétraploïde. La création de lignées monosomiques d'addition (LMA), constituées de plantes présentant en plus du jeu chromosomique normal de l'espèce cultivée, un chromosome d'une espèce diploïde, représente une voie intéressante pour exploiter cette variabilité. L'obtention de LMA se heurte cependant à de nombreuses contraintes dont la principale concerne sans aucun doute la production d'une descendance de première génération à partir des pentaploïdes obtenus en rétrocroisant par G. hirsutum les hybrides bispécifiques hexaploïdes composés du génome tétraploïde de l'espèce cultivée et du génome diploïde de l'espèce donneuse des caractères recherchés. La levée de cet obstacle par des schémas de croisements appropriés permet de disposer de LMA offrant la possibilité d'introgresser de manière précise des caractères d'intérêt et de mieux connaitre les relations génomiques entre les espèces du genre Gossypium. L'identification et l'exploitation de ces lignées ont pendant longtemps été basées sur une caractérisation morphologique peu fiable et l'usage des techniques de la cytogénétique classique très lourdes à mettre en œuvre. Elles bénéficient aujourd'hui des grandes avancées enregistrées dans le domaine de la biologie moléculaire à travers le développement des marqueurs de l'ADN et des techniques de la cytogénétique moléculaire. Ces progrès font de l'exploitation des lignées monosomiques d'addition une voie prometteuse pour l'amélioration génétique de la principale espèce de cotonnier cultivé.
Abstract
Genetic broadening of the main cultivated cotton species Gossypium hirsutum L. by creation and exploitation of monosomic alien addition lines. The genus Gossypium is composed of about forty wild diploïd species that constitute an important reservoir of interesting genes for the genetic improvement of Gossypium hirsutum L., the main cultivated cotton species. Creation of monosomic alien addition lines (MAAL), made up of plants having in addition to the chromosome set of the cultivated species one wild species' supernumerary chromosome, is an interesting way to exploit this diversity. Numerous constraints limit the creation of MAAL, among them the most important is doubtless the production of first generation derivatives from pentaploids obtained by backcrossing G. hirsutum with bispecific hexaploid hybrids made of the cultivated species tetraploid genome and the genome of a donor diploid species. Raising this impediment by appropriate techniques allows to develop MAAL offering the possibility to introgress finely traits of interest from diploid species and to better understand genomic relationships between species in the genus Gossypium. Identification and exploitation of these MAAL have been for a long time based on not very reliable morphological characteristics and on the use of classical cytogenetic techniques, very heavy to implement. Nowadays, the exploitation of MAAL benefits from the great advances registered in molecular biology through the development of DNA markers and molecular cytogenetics. These progresses make of MAAL a promising way for the genetic improvement of the main cultivated cotton species.
Table of content
1. Introduction
1Le genre Gossypium comprend une quarantaine d'espèces diploïdes (2n = 2x = 26) réparties dans huit classes génomiques désignées par les lettres A, B, C, D, E, F, G et K ainsi que cinq espèces tétraploïdes (2n = 4x = 52) de formule génomique AD (Stewart, 1995 ; Wendel et al., 2003). De toutes ces espèces, seules deux diploïdes de génome A (Gossypium arboreum L. et Gossypium herbaceum L.) et deux tétraploïdes (Gossypium barbadense L. et Gossypium hirsutum L.) produisent du coton. A elle seule, l'espèce G. hirsutum représente au niveau mondial plus de 85 % des superficies cultivées et près de 90 % de la production, ce qui en fait la principale espèce de cotonnier cultivé (Berti et al., 2006).
2La Chine, les Etats-Unis, l'Inde et le Pakistan représentent près de 80 % de cette production mais c'est dans les pays francophones d'Afrique de l'Ouest, qui ne représentent que 5 % de la production mondiale mais 15 % des échanges mondiaux, que son poids économique est le plus important, notamment comme première pourvoyeuse d'emplois, principale source de devises et facteur essentiel de la modernisation des sociétés rurales (Berti et al., 2006 ; Zagbaï et al., 2006).
3Bien qu'elles ne produisent pas de fibres filables utilisables par l'industrie du textile, les espèces diploïdes des génomes B, C, D, E, F, G et K présentent cependant un ensemble de caractères désirables pour l'amélioration génétique de la principale espèce cultivée tels que la forte ténacité de la fibre, un haut rendement à l'égrenage, une bonne tolérance à des facteurs abiotiques et biotiques défavorables, l'inhibition de la synthèse du gossypol uniquement dans la graine, etc. (Demol et al., 2002).
4Le présent article traite des modalités de production et de caractérisation de lignées monosomiques d'addition chez G. hirsutum et des possibilités d'exploitation de ces aneuploïdes en vue d'élargir la base génétique de la principale espèce de cotonnier cultivé.
2. Amélioration génétique du cotonnier cultivé G. hirsutum L. par hybridation interspécifique
5Le recours à l'hybridation interspécifique permet d'élargir la base génétique de la principale espèce de cotonnier cultivé en augmentant les possibilités de choix dans une gamme de génotypes plus large que celle permise par l'hybridation intraspécifique qui n'exploite que la variabilité existant à l'intérieur de G. hirsutum (Baudoin, 2001).
6Suivant les principes dégagés par Harlan et al. (1971), Stewart (1995) répartit les ressources génétiques de la principale espèce de cotonnier cultivé en pools géniques primaire, secondaire et tertiaire suivant la difficulté croissante à surmonter les barrières d'incompatibilité qui empêchent le transfert de matériel génétique entre espèces. Selon cet auteur, le pool génique primaire est constitué de toutes les formes cultivées, subspontanés et sauvages de G. hirsutum et de G. barbadense ainsi que des trois autres espèces tétraploïdes du genre (Gossypium tomentosum Nutt. ex Seem., Gossypium mustelinum Miers ex G.Watt et Gossypium darwinii G.Watt). Les croisements avec ces espèces sont relativement faciles et les fréquences de recombinaison sont élevées. Le pool génique secondaire comprend les espèces diploïdes de génome A, D, B et F. L'obtention d'un hybride avec ces espèces est plus difficile qu'avec le premier pool, mais une fois l'hybride obtenu, les fréquences de recombinaison observées sont élevées. Cependant, comme ces espèces sont diploïdes, l'hybride est, à quelques rares exceptions, un triploïde stérile dont le stock chromosomique doit être doublé pour la production d'un hexaploïde fertile. Le pool génique tertiaire renferme toutes les autres espèces du genre Gossypium (espèces de génome E, C, G ou K). Ce sont les espèces dont l'utilisation pose le plus de difficultés en raison des obstacles à surmonter pour créer l'hybride et de la faiblesse des taux de recombinaison (Brubaker et al., 1999 ; Mergeai, 2006).
7Les premières tentatives d'amélioration par hybridation interspécifique de la principale espèce de cotonnier cultivé ont d'abord fait appel à l'espèce tétraploïde cultivée G. barbadense afin de cumuler les bonnes qualités technologiques de la fibre de G. barbadense aux qualités agronomiques de G. hirsutum (Schwendiman, 1978a). Ces hybrides n'ont cependant que très rarement donné des résultats intéressants à cause de la production de génotypes très déséquilibrés ou se rapprochant fortement de l'un ou l'autre des parents du croisement.
8La mise au point de techniques permettant de contourner les fortes barrières d'incompatibilité existant entre l'espèce cultivée et les quarante-quatre espèces diploïdes du genre Gossypium a ouvert d'immenses sources potentielles de variabilité pour l'amélioration de la principale espèce cultivée.
9Trois principales voies sont utilisées pour exploiter cette source de variabilité (Mergeai, 2006) :
10– une voie trispécifique (voie paraphylétique) qui procède par l'utilisation d'une espèce-pont, de génome A ou D, qui est croisée avec l'espèce donneuse pour créer par colchiploïdisation un allotétraploïde qui sera rétrocroisé avec l'espèce cultivée,
11– une voie trispécifique (voie pseudo-phylétique) au cours de laquelle l'espèce-pont est d'abord croisée avec l'espèce cultivée pour donner un triploïde dont le nombre chromosomique est ensuite doublé pour fournir un allohexaploïde, ce dernier est ensuite croisé avec l'espèce donneuse pour produire un tétraploïde,
12– une voie bispécifique ou aphylétique d'introgression (Figure 1) qui procède par croisement de G. hirsutum avec l'espèce donneuse. Le triploïde résultant est colchidiploïdisé pour donner un allohexaploïde qui sera croisé avec l'espèce cultivée pour donner un pentaploïde. Le rétrocroisement avec l'espèce tétraploïde ou l'autofécondation de ce pentaploïde et de ses descendants aboutit à la production d'aneuploïdes dont une partie est porteuse d'un seul chromosome surnuméraire de l'espèce diploïde en plus du jeu chromosomique normal de l'espèce cultivée. Pour chaque espèce diploïde de cotonnier, il est donc théoriquement possible d'obtenir treize lignées monosomiques d'addition correspondant au nombre chromosomique de base du genre Gossypium.
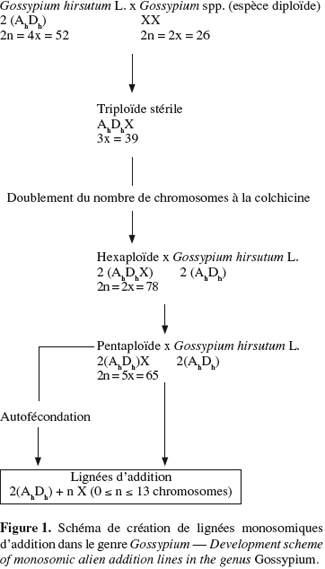
3. Utilisation de la méthode des LMA pour l'amélioration génétique de G. hirsutum
3.1. Génomes diploïdes concernés par la méthode des LMA
13L'utilisation des LMA pour l'amélioration de la principale espèce de cotonnier cultivé a d'abord concerné les espèces des génomes A, D, B et F (Poisson, 1970 ; Baudoin, 1973 ; Louant et al., 1977 ; Koto, 1983) mais elle s'avère également particulièrement appropriée pour l'exploitation des espèces phylogénétiquement plus éloignées (André, 1983 ; Rooney et al., 1991a ; Mergeai, 1992 ; Brubaker et al., 1999 ; Ahoton et al., 2003 ; Mergeai, 2006). Le tableau 1 donne un résumé des travaux qui ont déjà été menés pour étudier les possibilités d'exploitation des LMA dans le genre Gossypium.
3.2. Utilisation des LMA pour l'introgression de caractères agronomiques d'intérêt
14La voie classique d'utilisation de l'hybridation interspécifique consiste à produire par reproduction sexuée ou hybridation somatique un hybride dont la balance génique est fortement déséquilibrée et qui doit par conséquent être rétrocroisé à plusieurs reprises sur l'espèce cultivée. L'objectif d'atteindre la quasi-isogénicité des génotypes introgressés avec les variétés récurrentes de l'espèce cultivée nécessite alors un nombre très élevé de rétrocroisements pour éliminer les fragments de chromosomes indésirables provenant de l'espèce donneuse du caractère d'intérêt recherché. Du fait qu'elles ne portent qu'un seul chromosome de l'espèce donneuse, les LMA limitent les possibilités de recombinaison à ce seul chromosome et peuvent donner des produits équilibrés après un nombre de rétrocroisements limité. La principale utilisation des LMA en amélioration génétique du cotonnier vise ainsi le transfert précis à l'espèce cultivée de gènes d'intérêt portés par un chromosome surnuméraire d'une espèce sauvage donneuse (Hau, 1981a). Il faut cependant reconnaître qu'elle est surtout envisageable pour l'introgression de caractères à déterminisme génétique simple.
3.3. Identification de gènes d'intérêt chez les espèces sauvages et cartographie chromosomique
15Au-delà de son utilisation pour l'introgression de gènes d'intérêt, la production de LMA, comparable à une dissection du génome, permet de soustraire le chromosome de toutes les actions épistatiques des autres chromosomes auxquels il est naturellement confronté et d'analyser l'expression de chacun de ses gènes dans un fonds génétique homogène.
16Par comparaison de LMA avec les espèces parentales, des marqueurs ou des gènes peuvent être attribués au chromosome en addition. Les marqueurs ou gènes simultanément présents chez l'espèce sauvage et chez la LMA mais absents de l'espèce cultivée sont considérés comme étant portés par le chromosome surnuméraire.
3.4. Intérêt phylogénétique
17Selon la théorie de Hutchinson et al. (1947) cité par Hau (1981a) concernant la faible différenciation du contenu génique des chromosomes des espèces diploïdes du genre Gossypium, des lignées d'addition monosomiques porteuses de chromosomes homéologues provenant d'espèces diploïdes différentes doivent montrer des ressemblances morphologiques traduisant l'homéologie existant entre les chromosomes surnuméraires.
18Cette hypothèse a été vérifiée par Poisson et al. (1969) qui a observé une similitude d'action du chromosome surnuméraire entre des LMA de Gossypium longicalyx J.B.Hutch. & B.J.S.Lee, d'une part, et de Gossypium anomalum Wawra et de Gossypium stocksii Mast., d'autre part, aussi bien sur des caractères qualitatifs que quantitatifs. Mergeai (1992) a fait la même observation en comparant les phénotypes de deux LMA de Gossypium areysianum Deflers sur G. hirsutum avec ceux de deux lignées impliquant respectivement un chromosome additionnel de G. longicalyx et un chromosome additionnel de G. anomalum décrites par Hau (1981b) et par Koto (1983).
19L'homéologie de chromosomes provenant d'espèces diploïdes distinctes déduite sur base du phénotype des LMA qui les portent a été confirmée par Poisson (1970) lors de la création de plantes disomiques d'addition complexes obtenues en croisant des LMA de G. anomalum et de G. stocksii sur G. hirsutum présentant des similitudes phénotypiques. Chez les plantes disomiques d'addition produites, le taux d'appariement des deux chromosomes surnuméraires entre eux était particulièrement élevé.
20Les progrès récents réalisés dans le domaine de la biologie moléculaire et particulièrement dans le domaine de la cartographie génétique (Reinisch et al., 1994 ; Nguyen et al., 2004 ; Rong et al., 2004 ; Han et al., 2006) permettent grâce à la transférabilité ou portabilité des marqueurs développés chez l'espèce cultivée tétraploïde vers les espèces diploïdes sauvages, de mesurer le degré de conservation de la colinéarité entre chromosomes des sous-génomes A et D de l'espèce cultivée tétraploïde et leurs homéologues des espèces sauvages isolés sous forme de LMA. En permettant l'étude des relations d'homéologie à l'échelle du chromosome, les LMA représentent un outil efficace pour une meilleure compréhension de l'organisation des génomes et de leurs relations dans le genre Gossypium.
4. Production des LMA
4.1. Production du triploïde
21Presque toutes les espèces diploïdes peuvent être croisées avec l'allotétraploïde pour produire un triploïde. La plus ou moins grande difficulté à créer le triploïde dépend du réservoir génique auquel appartient l'espèce diploïde. Brubaker et al. (1999), travaillant sur plusieurs espèces appartenant aux 3 génomes australiens C, G et K qu'ils croisent avec G. hirsutum dans les deux sens, montrent qu'il est plus facile d'obtenir des hybrides avec les espèces de génome C qu'avec les espèces de génome G. Les espèces de génome K se situent pour leur part dans une situation intermédiaire entre ces deux génomes. Ils montrent, en outre, que l'hybride triploïde est plus difficile à obtenir lorsque l'espèce sauvage est utilisée comme parent femelle. Ce qui confirme la théorie de Beasley (1940) selon laquelle dans le genre Gossypium les chances de réussite des hybridations sont d'autant plus grandes que l'on prend comme parent femelle la plante qui a le plus haut niveau de ploïdie. L'explication de cette observation se trouverait dans le rapport de ploïdie de l'albumen vis-à-vis de celui du zygote qui jouerait un rôle essentiel dans le développement de ce dernier.
4.2. Production de l'hexaploïde et du pentaploïde
22En raison de la forte stérilité du triploïde due aux mésappariements entre chromosomes de génomes différents, le nombre chromosomique de celui-ci doit être doublé à la colchicine pour produire un hexaploïde qui, par rétrocroisement avec l'allotétraploïde, donnera un pentaploïde. Même si elle exige parfois beaucoup de croisements, l'obtention de ce pentaploïde ne pose généralement pas de problèmes insurmontables (Koto, 1983 ; Brubaker et al., 1999 ; Ahoton et al., 2003). Altman et al. (1987), contrairement à d'autres auteurs (Brubaker et al., 1999 ; Ahoton et al., 2003), ont cependant dû recourir au sauvetage d'embryons pour produire le pentaploïde impliquant l'espèce Gossypium sturtianum J.H.Willis. Il serait également possible d'obtenir le pentaploïde avec certaines espèces sans passer par l'hexaploïde. Il semble en effet que les triploïdes impliquant les espèces diploïdes de génome K présentent un fort taux de gamètes non réduits. Partant de ce constat, Stewart (1995) prédit l'obtention de pentaploïdes par rétrocroisement de ces triploïdes sur G. hirsutum. Brubaker et al. (1999) rapportent des travaux non publiés de Stewart dans lesquels ce dernier obtient des pentaploïdes par cette méthode.
4.3. Production de la descendance de première génération du pentaploïde
23La fertilité du pentaploïde qui est autofécondé ou rétrocroisé à plusieurs reprises par G. hirsutum pour produire les lignées d'addition apparaît comme la principale contrainte à l'utilisation de certaines espèces diploïdes. S'il est en effet facile, pour des pentaploïdes impliquant les espèces diploïdes du pool génique secondaire comme G. herbaceum, G. arboreum et G. anomalum (Brown, 1965 ; Poisson, 1970), d'obtenir par autofécondation une assez importante descendance, la fertilité est nulle pour le pentaploïde impliquant G. sturtianum et très faible pour celui concernant Gossypium australe F.Muell., deux espèces appartenant au pool génique tertiaire (Brubaker et al., 1999 ; Ahoton, 2002). Le recours à des croisements avec l'espèce cultivée permet cependant, même pour les pentaploïdes stériles en autofécondation comme celui impliquant l'espèce G. sturtianum, d'obtenir une descendance plus ou moins importante selon l'espèce diploïde concernée. Le succès de ces hybridations dépend en grande partie du sens selon lequel elles sont réalisées. Comme pour l'obtention des triploïdes, il est généralement admis que les croisements qui donnent les meilleurs résultats correspondent à ceux au cours desquels le parent ayant le niveau de ploïdie le plus élevé est pris comme parent femelle. De ce point de vue, le pentaploïde impliquant G. australe constitue une exception dans la mesure où toutes les études concernant cette espèce (Brubaker et al., 1999 ; Ahoton, 2002) ont montré que les meilleurs résultats sont obtenus lorsque le pentaploïde est pris comme parent mâle.
24Koto (1983), pour générer des LMA de G. longicalyx sur G. hirsutum, obtient en partant de plusieurs pentaploïdes des résultats irréguliers : pour certains pentaploïdes, aucune descendance n'est obtenue en autofécondation tandis que pour d'autres, des plantes viables sont recouvrées. Il obtient des plantes viables en croisement dans les deux sens avec presque toujours une descendance plus importante quand le pentaploïde est pris comme parent femelle plutôt que comme parent mâle. Ahoton et al. (2003) donne la description la plus exhaustive du schéma suivi pour la production de LMA impliquant les espèces G. australe et G. sturtianum. Pour le pentaploïde impliquant la première espèce, des graines sont obtenues aussi bien en autofécondation qu'en croisement. Par contre, avec le pentaploïde impliquant G. sturtianum, aucune descendance n'est obtenue par autofécondation, alors que des graines sont produites en rétrocroisant le pentaploïde par G. hirsutum ; le nombre de graines obtenues quand le pentaploïde est pris comme parent mâle étant nettement plus faible que lorsqu'il est pris comme parent femelle. Altman et al. (1987) travaillant sur l'hybride G. hirsutum x G. sturtianum a dû recourir au sauvetage d'embryons pour recouvrer, avec un taux de réussite de 1 %, des plantes issues du rétrocroisement du pentaploïde pris comme parent femelle.
25Les produits issus du pentaploïde sont constitués, en plus des plantes euploïdes caractéristiques de l'espèce cultivée, de " souches introgressées " (Louant et al., 1977) composées des plantes euploïdes présentant un phénotype distinct de celui de la variété de l'espèce cultivée impliquée dans la création de l'hybride interspécifique et d'aneuploïdes (les lignées d'addition).
4.4. Origines des plantes euploïdes introgressées de la descendance du pentaploïde
26Il est établi que pour les espèces diploïdes proches de l'espèce cultivée, particulièrement celles de génome A ou D, on observe à la phase triploïde de nombreux multivalents qui témoignent, malgré l'existence d'un facteur de diploïdisation chez l'espèce cultivée (Kimber, 1961), d'échanges de matériel génétique. Ainsi Baudoin (1973) cite Kammacher qui a observé qu'à la métaphase I de la méiose du triploïde G. hirsutum x Gossypium raimondi Ulbr., la presque totalité des chromosomes de G. raimondii s'apparient avec ceux du génome D de G. hirsutum. Le nombre d'appariements observé en métaphase I tend cependant à diminuer avec l'éloignement génétique de l'espèce diploïde par rapport aux chromosomes des deux sous-génomes constitutifs du principal tétraploïde cultivé (Endrizzi et al., 1985 ; Ndungo et al., 1988).
27Au stade hexaploïde, des appariements hétérogénétiques peuvent être observés particulièrement lorsque l'espèce diploïde appartient aux génomes ancestraux ou dans une moindre mesure aux autres espèces du réservoir génique secondaire (Kammacher, 1956 ; Maréchal, 1972 ; Schwendiman et al., 1980). Louant et al. (1977) montrent en outre que ce stade est particulièrement propice à des échanges intergénomiques lorsqu'on procède à des générations d'autofécondation, schéma qu'ils préconisent d'ailleurs comme méthode d'introgression. La preuve de l'occurrence de ces échanges est donnée par l'évolution vers la stérilité des hexaploïdes impliquant des espèces des génomes A et D maintenus en autofécondation. Cette stérilité serait le résultat de l'accumulation des échanges intergénomiques qui perturbent la méiose (Baudoin, 1973).
28La probabilité d'échanges intergénomiques au stade pentaploïde semble être intermédiaire entre celle observée au stade triploïde et celle notée au stade hexaploïde. Elle est d'autant plus grande que l'affinité génomique de l'espèce sauvage avec l'espèce cultivée est importante.
29Pour celui qui vise à isoler des LMA, ces échanges intergénomiques, quel que soit le moment auquel ils se produisent, constituent un obstacle à l'isolement de LMA stables.
4.5. Composition, fertilité et fréquence d'apparition des différents aneuploïdes dans la descendance de première génération des pentaploïdes
30Très peu de travaux se sont intéressés à décrire de manière systématique la descendance de première génération des pentaploïdes. Quand ces études ont été menées, elles ont souvent porté sur un faible nombre d'individus. L'explication de cette situation est sans doute à trouver dans la lourdeur des études cytogénétiques à mettre en œuvre. Cet obstacle a été souvent contourné en combinant l'observation des caractères morphologiques et l'évaluation de la fertilité pour inférer le génotype des différents individus.
31Chez le cotonnier, la fertilité des aneuploïdes est en étroite corrélation avec le nombre de chromosomes qu'ils portent. La stérilité croît régulièrement avec le nombre de chromosomes surnuméraires. Celle-ci pourrait s'expliquer par la loi de Darlington qui stipule que la stérilité découle plus d'interactions géniques entre chromosomes que de problèmes de comportement méiotique (Baudoin, 1973 ; Louant et al., 1977). La stérilité la plus sévère traduisant un nombre maximal d'interactions serait obtenue lorsque la moitié des gènes est dupliquée. Il faut toutefois noter que la stérilité ne semble pas uniquement liée au nombre de chromosomes additionnels. La spécificité du chromosome semble également jouer un rôle non négligeable (Schwendiman, 1978a). On peut cependant retenir que l'espèce G. hirsutum supporte l'addition d'un assez grand nombre de chromosomes supplémentaires. Schwendiman (1978b) indique des lignées d'addition possédant de 1 à 9 chromosomes surnuméraires de G. stocksii. Altman et al. (1987) signalent des aneuploïdes qui comportent 10 chromosomes de G. sturtianum. Ahoton et al. (2003), analysant 27 plantes de la descendance de première génération du pentaploïde impliquant la même espèce diploïde, notent 25 individus stériles comptant tous plus d'un chromosome surnuméraire. André et al. (1983) observent chez 35 plantes de la descendance de première génération de G. areysianum sur G. hirsutum une proportion variable de plantes présentant de un à six chromosomes surnuméraires. Tous les travaux portant sur la production de LMA dans le genre Gossypium notent aussi des fréquences d'apparition très inégales entre les différentes formules caryologiques. Becerra Lopez-Lavalle et al. (2007) montrent ainsi qu'au niveau de la descendance du pentaploïde G. hirsutum x G. australe, les fréquences de transmission des 13 groupes de liaison supposés représenter les 13 LMA varient entre 11 et 100 % alors que dans la descendance de première génération du pentaploïde G. hirsutum x G. sturtianum, les fréquences de transmission varient entre 0 et 91 %. Des conclusions similaires peuvent être tirées des observations réalisées par Ahoton (2002) concernant le nombre d'individus au sein des différentes classes phénotypiques isolées dans la descendance du pentaploïde G. hirsutum x G. australe. Ces effectifs, reflet du taux de transmission des chromosomes de l'espèce sauvage, varient d'un seul individu à 249 pour la classe phénotypique la plus nombreuse.
32La constitution caryologique de la descendance de première génération du pentaploïde pourrait dépendre du mode d'obtention de cette descendance. Comme chez le cotonnier, le gamète mâle supporte moins de chromosomes supplémentaires que le gamète femelle, on peut supposer que la descendance obtenue en prenant le pentaploïde comme parent mâle donnera des aneuploïdes avec très peu de chromosomes supplémentaires, voire uniquement des LMA alors que lorsque le pentaploïde est pris comme parent femelle, la descendance aneuploïde sera en majorité constituée de plurisomiques. Altman et al. (1987) obtiennent ainsi par un rétrocroisement du pentaploïde G. hirsutum x G. sturtianum, au cours duquel le pentaploïde a été pris comme parent femelle, des plantes portant 6 à 10 chromosomes de G. sturtianum. Par contre, dans la descendance rétrocroisée du pentaploïde G. hirsutum x G. australe utilisé comme parent mâle, Ahoton et al. (2003) trouvent que la descendance aneuploïde du pentaploïde est essentiellement constituée de plantes monosomiques d'addition.
33Dans la plupart des études impliquant des espèces diploïdes du pool génique secondaire au cours desquelles le pentaploïde est pris comme parent femelle, on remarque que la descendance est en majorité stérile ou quasi stérile, indice de la présence de plusieurs chromosomes (Poisson, 1970 ; André, 1983 ; Koto, 1983) et de la grande tolérance des gamètes femelles pour les chromosomes additionnels.
4.6. Intégrité des chromosomes surnuméraires de la population aneuploïde BC1 du pentaploïde
34Jusqu'avant Ahoton et al. (2003), toutes les études concernant les LMA dans le genre Gossypium ont porté sur des analyses morphologiques et/ou cytogénétiques. En utilisant des marqueurs microsatellites cartographiés distribués tout le long du chromosome, les travaux de ces chercheurs intègrent une nouvelle dimension dans l'analyse des aneuploïdes qui, si elle n'avait pas été ignorée ou était même souvent mise en évidence, restait malgré tout difficile à évaluer. Cette nouvelle dimension concerne l'intégrité des chromosomes surnuméraires dans les descendances de première génération du pentaploïde. Partant de 13 plantes possédant un chromosome surnuméraire de G. australe mis en évidence par analyse cytogénétique classique, les travaux d'Ahoton et al. (2003) ont permis d'identifier six LMA différentes dont les chromosomes additionnels sont homéologues des groupes de liaison c6-c25, c12-c26, c9-c23, c10-c20, c7-c16 et c3-c17 de G. hirsutum. Becerra Lopez-Lavalle et al. (2007) ont réalisé une étude plus exhaustive en analysant avec des marqueurs AFLP la totalité de la descendance BC1 et BC2 des pentaploïdes impliquant les espèces G. australe et G. sturtianum. Ils aboutissent à la conclusion que, s'il existe dans la descendance du pentaploïde des plantes monosomiques et plurisomiques avec des chromosomes entiers, la majorité des plantes non-euploïdes portent des chromosomes incomplets et fragmentés.
35Nos résultats (non encore publiés) portant sur une soixantaine de plantes de la descendance de première génération du pentaploïde G. hirsutum x G. australe analysées avec des marqueurs SSR cartographiés vont dans le même sens. Ils mettent en évidence le fait qu'une forte proportion des plantes aneuploïdes est en réalité constituée de plurisomiques segmentés ou fragmentés. Le nouveau défi consiste maintenant à identifier sous quelle forme (libre ou recombinée) se trouvent ces fragments de chromosomes.
4.7. Production de la descendance de deuxième génération du pentaploïde
36Lorsque certaines lignées ne sont pas isolées dans la première génération de la descendance du pentaploïde, des plantes plurisomiques qui contiennent ces chromosomes non encore isolés peuvent être autofécondées ou rétrocroisées. A ce stade, la fertilité s'est généralement bien améliorée et la production d'une importante descendance permet d'obtenir l'isolement de nombreuses souches monosomiques d'addition.
4.8. Caractéristiques des LMA des espèces diploïdes sauvages de Gossypium sur G. hirsutum
37Morphologie des LMA. Les LMA présentent une très grande variabilité morphologique mais elles ressemblent souvent davantage à l'espèce cultivée qu'à l'espèce donneuse du chromosome en addition (Ahoton, 2002). Elles montrent généralement une croissance ralentie comparée à celle de l'espèce cultivée. Chez certaines lignées, la présence de chromosomes surnuméraires différents en addition monosomique se traduit par des phénotypes fort proches. Cette configuration trisomique et/ou la faible différenciation génomique dans le genre Gossypium pourraient expliquer les grandes similitudes morphologiques parfois observées entre LMA issues d'espèces diploïdes distinctes (Hau, 1981b ; Koto, 1983 ; Mergeai et al., 1993).
38Fertilité des LMA. Selon l'espèce diploïde, le chromosome en addition et le gamète considéré, les LMA présentent une grande variabilité quant à leur fertilité (Hau, 1982 ; Mergeai et al., 1993). On peut cependant retenir que la fertilité des LMA est généralement moindre comparée à celle des plantes euploïdes mais nettement supérieure à celle des plantes présentant plusieurs chromosomes en addition et que la fertilité femelle est généralement plus élevée que la fertilité mâle.
39Caractéristiques cytologiques des LMA. Les fréquences d'appariements intergénomiques traduisent la " distance génétique " entre espèces et sont inversement proportionnelles au degré de parenté des espèces intervenant dans la constitution des hybrides interspécifiques. Elles représentent une mesure importante des possibilités d'introgresser par recombinaison un gène d'intérêt de l'espèce diploïde sauvage vers l'espèce cultivée. Les observations de ces appariements sont effectuées à la métaphase I ou à la prophase.
40Les plaques métaphasiques présentent l'avantage d'être plus faciles à obtenir et à observer mais elles ne montrent qu'imparfaitement les appariements qui ont lieu aux stades antérieurs. En effet, le nombre d'appariements homéologues observés a tendance à diminuer au fur et à mesure du déroulement de la première partie de la méiose et plus rapidement lorsque les espèces sont éloignées phylogénétiquement (Endrizzi et al., 1985 ; Mergeai, 1992). D'où, il apparait que les appariements visibles à un stade tardif comme la métaphase I ne traduisent qu'imparfaitement les fréquences totales de recombinaison auxquelles ils sont inférieurs. C'est ainsi qu'analysant des centaines de plaques métaphasiques de LMA de G. areysianum sur G. hirsutum, Mergeai (1992) n'observe aucun trivalent alors qu'il note pourtant dans la descendance de ces lignées des euploïdes manifestement introgressés. L'absence de multivalents en métaphase I ne permet donc pas de conclure à une absence d'échanges intergénomiques pendant les étapes antérieures de la méiose.
41D'une manière générale, à cause des différences d'homologie entre chromosomes du fond génétique et du chromosome additionnel, les taux d'appariements allosyndétiques observés sont souvent très faibles, quel que soit le stade méiotique.
42Du fait des difficultés d'évaluation des appariements méiotiques, on peut, pour estimer les chances de succès de transférer un gène d'intérêt, calculer directement le taux des plantes euploïdes recombinées dans la descendance de la LMA. Quoi qu'assez lourde à mettre en œuvre, cette solution est cependant moins difficile à réaliser que l'analyse cytogénétique lorsqu'on dispose d'une méthode de criblage rapide et fiable pour analyser une population de grande taille. Rooney et al. (1991a) soulignent l'élimination somatique du chromosome surnuméraire chez une LMA de G. sturtianum sur G. hirsutum et proposent l'hypothèse que l'élimination somatique du chromosome surnuméraire doit survenir à un stade précoce. Sarr (2003) note également le même phénomène dans une LMA de G. australe sur G. hirsutum.
43Transmission du chromosome surnuméraire par les LMA. La transmission normale du chromosome additionnel est un phénomène rare. Les facteurs susceptibles d'expliquer ce constat sont les suivants :
44– irrégularités méiotiques qui se traduisent par le rejet du chromosome additionnel suivi de son élimination lors de la formation des gamètes,
45– manque de viabilité des gamètes aneuploïdes,
46– plus grande compétitivité des gamètes à n chromosomes par rapport aux gamètes à n+1 chromosomes,
47– avortement des zygotes à 2n+1 chromosomes,
48– manque de viabilité des plantules monosomiques d'addition (Mergeai, 1992).
49En outre, plusieurs facteurs influencent la transmission du chromosome surnuméraire. Selon le chromosome en addition, les LMA présentent des taux de transmission du chromosome surnuméraire différents. Rooney et al. (1991) trouvent parmi les 4 LMA qu'ils ont étudiées un taux de transmission moyen de 23 % pour 3 LMA et de 90 % pour la quatrième. Sarr (résultats non publiés) trouve également pour une LMA de G. australe sur G. hirsutum un taux de transmission de 91 %. Ces taux très élevés pourraient s'expliquer par la présence sur ces chromosomes d'un gène distorseur de ségrégation qui entraine la transmission préférentielle du chromosome qui le porte en rendant non-fonctionnels les gamètes qui ne le contiennent pas. Ce phénomène est assez bien connu chez les espèces du genre Aegilops qui portent sur certains chromosomes des facteurs Gc (pour gamétocide) qui causent des cassures aléatoires des chromosomes et induisent des aberrations chromosomiques (Jiang et al., 1994 ; Nasuda et al., 1998).
50Chez la plupart des LMA du genre Gossypium, le chromosome surnuméraire est mieux transmis par les ovules que par le pollen. Ce qui découle du fait déjà signalé que le gamète femelle supporte mieux l'addition d'un ou plusieurs chromosomes supplémentaires que le gamète mâle. Mergeai (1992) note que le taux de transmission en autofécondation dans le genre Gossypium est souvent plus élevé que la somme des taux de transmission mâle et femelle. Le taux de transfert du chromosome surnuméraire dépend de son comportement méiotique qui est influencé par l'importance des recombinaisons qu'il a subies. Celles-ci, en augmentant son affinité avec les chromosomes de l'espèce cultivée, tendent à favoriser l'augmentation de son taux de transmission. Hau (1982) montre que le taux de transmission évolue de manière favorable au cours des générations d'autofécondation.
5. Identification des LMA
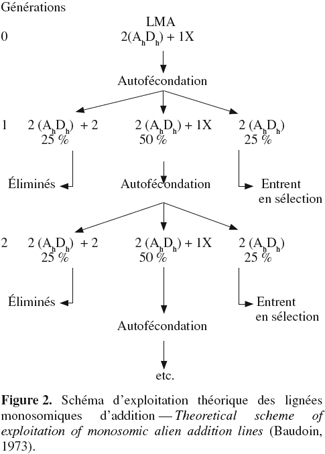
5.1. Approches possibles pour l'identification des LMA
51L'identification des LMA est un des aspects les plus importants pour leur utilisation dans le transfert de gènes des espèces sauvages aux espèces cultivées. Cette identification se situe à deux niveaux :
52– identification des plantes monosomiques d'addition,
53– identification du chromosome en addition.
54Toute différence (morphologique, chromosomique, physiologique, moléculaire, etc.) entre plantes peut être utilisée pour procéder à cette identification. Les techniques employées se distinguent par leur fiabilité, leur rapidité, le niveau de technicité requis et leur coût. D'abord fondées sur l'évaluation de la morphologie des plantes, elles utilisent aujourd'hui les techniques d'hybridation et de marquage moléculaires qui permettent une identification plus rapide et plus précise.
5.2. Caractérisation morphologique
55C'est la méthode la plus anciennement utilisée. Elle part du principe qu'un chromosome en addition, étranger de surcroît, par sa seule présence et/ou par l'expression des gènes qu'il porte entraine une perturbation de l'équilibre génique et/ou de nature épigénétique qui induit des désordres physiologiques se traduisant par des effets phénotypiques visibles à l'œil nu.
56Souvent associée à d'autres techniques, elle a servi à l'identification de plusieurs LMA d'espèces sauvages du genre Gossypium sur G. hirsutum L. (Baudoin, 1973 ; Hau, 1981b ; André, 1983 ; Koto, 1983 ; Ahoton, 2002). Cependant, la plupart de ces auteurs soulignent l'insuffisance de la caractérisation morphologique. En effet, si les LMA sont généralement caractérisées par une croissance ralentie, un manque de vigueur, une fertilité réduite ou parfois par certains caractères particuliers (coloration particulière de la fibre ou des fleurs, forme des capsules, etc.), les caractères morphologiques sont souvent insuffisants pour permettre de distinguer de manière catégorique et fiable toute la série des LMA d'une espèce.
57En effet, les caractères morphologiques analysés sont souvent contrôlés par de nombreux gènes dont l'expression est influencée par le milieu et la pénétrance des gènes que porte le chromosome surnuméraire n'est pas toujours complète. De plus, quand l'espèce receveuse est polyploïde, comme dans le cas de G. hirsutum, la présence de plusieurs allèles pour chaque gène peut réprimer ou jouer un effet tampon qui empêche l'expression des gènes du chromosome en addition. Les changements morphologiques ne sont également pas toujours spécifiques au chromosome surnuméraire et seraient parfois plus liés à la configuration trisomique qu'associés à un chromosome particulier. La ségrégation de caractères peut aussi s'observer au niveau de LMA dont la constitution a impliqué la réalisation de croisements entre plusieurs variétés et/ou accessions différentes de l'espèce cultivée. En outre, les chromosomes surnuméraires peuvent subir au cours de la production des LMA des remaniements (translocations et recombinaisons) susceptibles de modifier l'expression de leurs gènes (Louant et al., 1977). A tous ces inconvénients, il faut ajouter la difficulté de procéder à un criblage précoce dans la mesure où plusieurs caractères descriptifs s'expriment à la fin du cycle de développement de la plante. La caractérisation morphologique n'est finalement vraiment efficace que lorsque le chromosome en addition est stable et porte des gènes qui commandent un caractère qualitatif peu influencé par le milieu.
5.3. Caractérisation par la cytogénétique
58Apports de la cytogénétique à la caractérisation des LMA. La cytogénétique est l'étude morphologique du matériel génétique organisé en chromosomes dont elle permet le dénombrement et l'identification (Jahier, 1992). Utilisée dans l'identification des lignées monosomiques, elle permet de s'assurer de la formule caryologique 2n+1, de distinguer le chromosome en addition des chromosomes du fond génétique et de distinguer des chromosomes en addition entre eux. C'est une technique qui permet, lorsqu'elle s'adresse aux chromosomes mitotiques, un screening très précoce des lignées d'addition. Elle permet également de vérifier l'état recombiné ou en addition d'un fragment de chromosome en addition.
59Caractérisation par la cytogénétique classique. A la métaphase de la mitose et à la métaphase I méiotique, les chromosomes sont sur-enroulés et peuvent être intensément colorés avec des produits comme le réactif de Schiff, le carmin acétique, le Giemsa ou l'orcéine acétique. La coloration simple des chromosomes permet de les compter et de reconnaitre le chromosome surnuméraire lorsque :
60– pour cause de différences d'homologie entre les chromosomes du fond génétique et le chromosome additionnel, celui-ci est rejeté de la plaque métaphasique lors de la méiose,
61– les chromosomes du fond génétique et celui du chromosome surnuméraire présentent une morphologie ou des tailles différentes.
62Par contre, quand les chromosomes sont de petite taille et sont uniformément colorés, la distinction des chromosomes devient délicate et nécessite des observations à des phases méiotiques antérieures à la métaphase (pachytène, diacinèse). Ces phases présentent cependant l'inconvénient d'être plus difficiles à observer (Mergeai, 1992).
63L'appariement entre chromosomes dépend principalement de leur degré de similitude structurale et chimique qu'on appelle homologie. L'étude du comportement méiotique d'une LMA permet de trouver les relations homéologiques entre le chromosome étranger avec un ou plusieurs chromosomes du fond génétique. La métaphase est évidemment le stade où les chromosomes sont le plus faciles à observer parce que très contractés. Elle ne constitue cependant pas le meilleur stade pour une bonne observation de ce que sont réellement les appariements. C'est au pachytène, stade pendant lequel les chromosomes sont appariés sur toute leur longueur, qu'une ressemblance ou une différence précise entre deux chromosomes d'une paire peuvent être observées avec le plus de précision (Jahier, 1992). Les méthodes cytogénétiques classiques constituent dans l'identification des LMA une grande avancée par rapport à la caractérisation morphologique. Cependant, elles présentent le grand inconvénient d'être assez lourdes à mettre en œuvre, surtout lorsqu'il s'agit d'observer des chromosomes aux stades précoces de la méiose (Jahier, 1992 ; Haider Ali et al., 2001).
64Caractérisation par la cytogénétique moléculaire ou hybridation in situ. Les limites constatées au niveau de l'emploi des techniques de la cytogénétique classique soulignent la nécessité de disposer de moyens d'identification plus précis. Les méthodes moléculaires qui s'adressent à la séquence d'ADN et permettent une coloration différentielle des chromosomes offrent cette précision. Le principe est basé sur la possibilité de rendre simple-brin les molécules d'ADN cibles et de les hybrider, suivant la loi de complémentarité des bases, avec une molécule d'ADN marquée (avec un marqueur radioactif ou chimique), également rendue monocaténaire, appelée sonde. L'hybridation in situ s'opère sur une coupe histologique, donnant ainsi des informations précises sur les relations homéologiques entre chromosomes et sur les remaniements d'une certaine taille. Elle permet de repérer ou de rechercher une molécule d'ADN spécifique dans une population hétérogène et de répondre rapidement à la question de la présence ou de l'absence d'un génome particulier dans une lignée d'addition ou une lignée recombinée (Tagu, 1999). On l'utilise sur des chromosomes mitotiques ou méiotiques. Le fait de travailler sur des chromosomes mitotiques en métaphase permet de localiser précisément sur des chromosomes les zones où se situent les séquences homologues de la sonde. Il est également possible de travailler sur des chromosomes au stade pachytène. L'hybridation in situ présente de nombreuses variantes selon le système de détection et le type de sonde utilisée (Durnam et al., 1985 ; Pinkel et al., 1986 ; Schwarzacher et al., 1989 ; Le et al., 1991). Selon le système de détection, on distingue l'hybridation in situ isotopique qui utilise des sondes radioactives et l'hybridation in situ à fluorescence (FISH) qui utilise des sondes marquées avec des haptènes telles que la Biotine ou la digoxygénine. En fonction du type de sonde, on distingue l'hybridation génomique in situ (GISH) où la sonde est constituée de l'ADN total d'un parent de l'hybride et les techniques qui utilisent les séquences d'ADN répété. Le principe de la GISH consiste à prendre comme sonde l'ADN génomique total marqué d'une des espèces (généralement l'espèce en addition) mélangé en excès avec de l'ADN non marqué de l'espèce du fond génétique (ADN compétiteur), à les digérer (taille inférieure à 500 pb) et à les hybrider sur la coupe histologique. L'ADN compétiteur s'hybridera alors sur toutes les séquences complémentaires communes aux deux espèces tandis que l'ADN marqué s'hybridera sur les séquences complémentaires spécifiques à l'ADN du chromosome en addition qui apparaît ainsi coloré (Anamthawat-Jonsson et al., 1990 ; Schwarzacher et al., 1992).
65La GISH présente de multiples avantages (Schwarzacher et al., 1992) :
66– il n'est pas nécessaire d'avoir des cellules en métaphase. Le comptage chromosomique peut se faire à tous les stades du cycle cellulaire,
67– il est possible de visualiser à la métaphase la morphologie du chromosome en addition et d'étudier les relations homéologiques entre le chromosome en addition et la chromatine du fond génétique,
68– de faibles remaniements chromosomiques peuvent être détectés,
69– il n'est pas nécessaire de semer les plantes ni d'extraire l'ADN car le criblage peut se faire sur les cellules de graines pré-germées,
70– si les deux espèces sont très éloignées, il n'est pas nécessaire d'ajouter de l'ADN compétiteur,
71– il n'est pas nécessaire de connaitre l'espèce du chromosome en addition pour la détecter. Il suffit juste de marquer l'ADN de l'espèce du fond génétique (ADN compétiteur). Ainsi, ce sera le chromosome en addition qui prendra la couleur de la contre-coloration.
72Même si elle sert surtout à établir la formule caryologique des plantes, elle peut, combinée à des analyses avec des marqueurs moléculaires, permettre d'identifier le chromosome en addition. Elle a ainsi permis à Ahoton (2002) d'identifier des chromosomes de G. australe sur G. hirsutum. Malgré tous ces avantages, la GISH présente des limites qui sont liées à la parenté entre l'espèce receveuse et l'espèce donneuse : un lien de parenté étroit entre les deux espèces empêche en effet une différenciation des deux types de chromatine.
5.4. Caractérisation par les marqueurs génomiques de l'ADN
73Les marqueurs génomiques, plus communément appelés marqueurs moléculaires, révèlent directement le polymorphisme au niveau des séquences de l'ADN. Deux techniques sont principalement utilisées pour révéler ce polymorphisme. La première est basée sur l'hybridation moléculaire (RFLP), tandis que la seconde est fondée sur la PCR (RAPD, AFLP, SSR, etc.) (De Vienne, 1998). L'une des principales voies d'utilisation de ces marqueurs est la réalisation de cartes génétiques denses. Il existe à l'heure actuelle plusieurs cartes de l'espèce G. hirsutum (Reinisch et al., 1994 ; Lacape et al., 2003 ; Nguyen et al., 2004 ; Han et al., 2006 ; Jiwen et al., 2007) comportant des marqueurs RFLP, AFLP, SSR, etc. Cette profusion de cartes concernant la principale espèce cultivée contraste cependant avec la rareté des études consacrées aux espèces diploïdes sauvages. Des marqueurs spécifiques des espèces diploïdes sauvages constitueraient pourtant un instrument fiable et rapide pour déterminer la fréquence de transmission du chromosome surnuméraire des LMA et déceler les recombinaisons intergénomiques. Brubaker et al. (2003) ont les premiers cartographié à partir de la F2 d'un croisement G. australe x Gossypium nelsonii Fryxell le génome G de Gossypium avec des marqueurs AFLP et utilisé ces marqueurs pour cribler des lignées d'addition.
74Les marqueurs cartographiés sur l'espèce G. hirsutum sont néanmoins utilisables pour l'identification des LMA. Cette utilisation est basée sur leur transférabilité ou portabilité à travers le genre Gossypium, c'est-à-dire sur la possibilité que ces marqueurs, développés pour l'espèce cultivée, puissent amplifier des segments d'ADN d'autres espèces de cotonnier présentant les mêmes séquences flanquantes reconnues par les sondes utilisées comme marqueurs de l'ADN et montrer du polymorphisme (Peakall et al., 1998). Le principal intérêt de cette portabilité est de disposer de marqueurs pour les espèces diploïdes sans passer par le processus long et onéreux du développement de ceux-ci. Les travaux de Altaf-Khan et al. (2006) sont les premiers qui aient porté sur la transférabilité vers les espèces diploïdes des marqueurs SSR développés sur G. hirsutum. Avec un taux d'amplification croisée de 83 % et 85 % de polymorphisme entre espèces diploïdes, ils démontrent que les séquences flanquantes sont bien conservées entre le tétraploïde et les espèces diploïdes. Guo et al. (2006), dans une étude concernant la transférabilité de 207 EST-SSR (séquences SSR dérivées de régions codantes) de l'espèce diploïde G. arboreum vers 23 autres espèces diploïdes appartenant à 7 génomes différents, ont trouvé un taux de transférabilité de 96,5 % des SSR testés.
75L'identification des LMA se fait par criblage des individus avec des marqueurs cartographiés sur les différents groupes de liaison de l'espèce cultivée. L'observation d'allèles spécifiques de l'espèce diploïde correspondant à des loci répartis sur un même chromosome de l'espèce cultivée laisse supposer la présence en addition monosomique du chromosome homéologue de ce dernier. Les marqueurs utilisés n'ayant généralement pas été cartographiés sur l'espèce diploïde en addition, deux facteurs doivent cependant être pris en considération lors de l'interprétation des résultats : d'une part, la synténie des marqueurs peut ne pas être conservée sur un même chromosome entre l'espèce cultivée et l'espèce sauvage et, d'autre part, certains marqueurs peuvent être dupliqués sur plusieurs chromosomes différents. Ahoton et al. (2003) sont parvenus avec des marqueurs SSR cartographiés sur l'espèce tétraploïde à identifier 7 LMA de G. australe sur G. hirsutum. De même, Beccara Lopez-Lavalle et al. (2007) ont identifié des LMA de G. australe et de G. sturtianum sur G. hirsutum en utilisant des marqueurs AFLP.
6. Techniques d'exploitation des LMA pour l'amélioration du cotonnier cultivé
76Les LMA constituent un outil de choix pour l'amélioration génétique mais elles ne peuvent être utilisées telles quelles pour les raisons suivantes :
77– en plus d'éventuels caractères d'intérêt agronomique, le chromosome surnuméraire porte de nombreux gènes dont l'expression induit des modifications défavorables du phénotype de l'espèce cultivée,
78– la présence du chromosome entier signifie une duplication, au niveau de la plante, de tous les gènes situés sur ce chromosome,
79– le taux de transfert du chromosome surnuméraire ne pouvant excéder 50 % par reproduction sexuée (sauf pour les cas de transmission préférentielle), on assiste systématiquement à une ségrégation des caractères intéressants qu'il porte dans la descendance des LMA,
80– le chromosome en addition peut perdre son intégrité suite à des recombinaisons avec un chromosome homéologue ou suite à sa fragmentation.
81L'exploitation des LMA du genre Gossypium passe, après le choix des meilleurs types d'addition, c'est-à-dire ceux présentant des caractères agronomiques intéressants, par la multiplication des générations par autofécondation en suivant le schéma proposé par Baudoin (1973) (Figure 2). Le but visé est de favoriser les échanges intergénomiques car les chromosomes appartenant à des génomes étrangers n'ont que peu tendance à s'apparier et à échanger des fragments. D'une manière générale, la recombinaison intergénomique dépend principalement de la distance phylogénétique entre l'espèce diploïde dont provient le chromosome additionnel et les deux sous-génomes de G. hirsutum. Plus l'espèce diploide est phylogénétiquement proche d'un des sous-génomes de l'espèce tétraploïde, plus les probabilités de recombinaison sont élevées.
82Le cotonnier étant une espèce tétraploïde qui se comporte comme un diploïde, cette diploïdisation limite les appariements allosyndétiques. Le facteur à l'origine de cette diploïdisation est spécifique de l'amphidiploïde mais l'intensité de son influence est déterminée par la spécificité des génomes provenant des espèces diploïdes intervenant dans la constitution de l'hybride (Kimber, 1961 ; Louant et al., 1977). Bien qu'il soit difficile de dissocier les effets de la diploïdisation et ceux de l'appariement préférentiel entre homologues des chromosomes de l'amphidiploïde, on peut supposer que l'intensité du phénomène de diploïdisation est moins importante lorsque le génome auquel appartient ce chromosome n'est pas présent au complet (Louant et al., 1977 ; André, 1983). Cette hypothèse, renforcée par le fait que les LMA sont le siège d'échanges géniques limités et qu'elles présentent, d'après la loi de Darlington, un déséquilibre génique minimal, est à la base de l'intérêt et de leur utilisation pour l'introgression de caractères d'intérêt des espèces diploïdes sauvages chez la principale espèce cultivée. Mergeai (1992) a ainsi obtenu, par utilisation de LMA de G. areysianum sur G. hirsutum, l'introgression de gènes induisant une amélioration simultanée de la résistance et de l'allongement de rupture de la fibre, deux caractères corrélés négativement.
83Dans les lignées de substitution, un chromosome entier de l'espèce receveuse est remplacé par un chromosome de l'espèce donneuse. L'obtention d'une lignée de substitution passe par la réalisation de croisements entre une lignée monosomique d'addition et une lignée monosomique pour le chromosome homéologue du chromosome surnuméraire de la LMA (Koto, 1983). La lignée de substitution présente l'inconvénient de perdre les gènes situés sur le chromosome de l'espèce receveuse substitué. Cette situation entraine généralement un déséquilibre génique qui s'accompagne d'effets délétères. Le chromosome substituant peut également présenter un défaut d'appariement qui se traduit par une certaine stérilité (Jena et al., 1989). Pour obtenir des lignées recombinées, les lignées de substitution présentent cependant l'avantage, par rapport aux LMA, de montrer un taux de recombinaison plus élevé. En effet, dans les LMA, la présence de deux chromosomes homologues favorise une association entre ceux-ci plutôt qu'avec leur homéologue en addition, alors que dans une lignée substituée, le chromosome dont l'homologue a été substitué aura plus tendance à s'apparier avec son homéologue.
7. Conclusion et perspectives
84S'il est sans doute exagéré de dire que la variabilité de la principale espèce de cotonnier cultivé est aujourd'hui trop étroite pour permettre des progrès génétiques significatifs, l'immense réservoir de gènes d'intérêt que constituent les espèces diploïdes du genre Gossypium n'est certainement pas à négliger pour améliorer la production de coton-graine tant au point de vue quantitatif que qualitatif. L'exploitation de cet énorme réservoir de variabilité ne peut que contribuer à permettre au cotonnier de garder son rang de première culture textile à l'échelle mondiale et de continuer à jouer un rôle fondamental dans le développement rural des pays d'Afrique où il occupe une place centrale dans l'économie.
85Le développement de lignées monosomiques d'addition constitue une voie très intéressante pour l'exploitation de la diversité génétique des espèces diploïdes de cotonnier. Comme toute méthode d'amélioration par hybridation interspécifique, la création de LMA se heurte à des contraintes liées à l'existence de barrières qui limitent la réussite des croisements, à la faiblesse des taux de recombinaison chez les hybrides créés et à la production de plantes non équilibrées génétiquement. Le principal obstacle à la production des LMA se situe au niveau de la très forte stérilité que présente généralement le pentaploïde obtenu en rétrocroisant par G. hirsutum l'hexaploïde obtenu en croisant la principale espèce de cotonnier cultivé et une espèce diploïde. La réalisation, avec l'application de régulateurs de croissance qui empêchent la chute des capsules, d'un nombre élevé d'hybridations en prenant le pentaploïde comme parent femelle permet néanmoins fréquemment de surmonter cet obstacle et de générer des populations présentant une proportion plus ou moins importantes de plantes aneuploïdes porteuses d'un nombre variable de chromosomes surnuméraires (dont un certain nombre de plantes monosomiques d'addition) et de plantes euploïdes introgressées. La multiplication des générations d'autofécondation au niveau des LMA obtenues permet, en général, la réalisation d'échanges intergénomiques entre le chromosome en addition et les chromosomes de l'espèce cultivée et la production de cotonniers euploïdes enrichis d'une nouvelle variabilité. Ces plantes introgressées peuvent servir de géniteurs ou de têtes de lignée dans des programmes de sélection.
86L'utilisation des techniques de cytogénétique classique permet un comptage assez précis du nombre et des fréquences d'appariement des chromosomes chez les LMA produites mais est impuissante à donner des informations fines sur l'intégrité des chromosomes en présence et sur le niveau d'introgression dont ils sont le siège. Cette faiblesse, même si elle n'était pas ignorée, était rarement prise en compte avant l'avènement des techniques de sélection assistée par marqueurs moléculaires et d'hybridation in situ. L'arrivée de ces nouvelles techniques ouvre des perspectives très prometteuses pour l'exploitation rationnelle des lignées monosomiques d'addition en vue d'élargir la base génétique de la principale espèce de cotonnier cultivé.
Bibliographie
Ahoton L., 2002. Utilisation des espèces sauvages australiennes Gossypium sturtianum J.H.Willis et G. australe F.Muell. pour l'amélioration du cotonnier cultivé G. hirsutum L. Thèse de doctorat : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Ahoton L., Lacape J.M., Baudoin J.-P. & Mergeai G., 2003. Introduction of Australian diploid cotton genetic variation into upland cotton. Crop Sci., 43, 1999-2005.
Altaf-Khan M. et al., 2006. Usefulness of SSR derived from tetraploid Gossypium spp. for analyses of diploid Gossypium spp. J. Crop Improv., 16, 1-20.
Altman D.W., Stelly D.M. & Kohel R.J., 1987. Introgression of the glanded-plant and glandless-seed trait from Gossypium sturtianum into cultivated upland cotton using ovule culture. Crop Sci., 27, 880-884.
Anamthawat-Jonsson K., Leitch S.T., Bennett A.R. & Heslop-Harrison M.D., 1990. Discrimination between closely related species Triticeae species using genomic DNA as a probe. Theor. Appl. Genet., 79, 721-728.
André B., 1983. Amélioration du cotonnier Gossypium hirsutum L. par hybridation interspécifique : utilisation de l'espèce G. areysianum (Defl.) Hutch. Mémoire : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
André B. & Verschraege L., 1983. Amélioration du cotonnier Gossypium hirsutum L. par hybridation interspécifique : utilisation de l'espèce G. areysianum (Defl.) Hutch. Bull. Rech. Agron. Gembloux, 18, 151-164.
Baudoin J.-P., 1973. L'aneuploïdie chez les végétaux et les possibilités d'application dans l'amélioration du cotonnier par introgression. Mémoire : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Baudoin J.-P., 2001. Contribution des ressources phytogénétiques à la sélection variétale de légumineuses alimentaires tropicales. Biotechnol. Agron. Soc. Environ., 5, 221-231.
Beasley J.O., 1940. The production polyploids in Gossypium. J. Hered., 31, 39-48
Becerra Lopez-Lavalle L.A. & Brubaker C.L., 2007. Frequency and fidelity of alien chromosome transmission in Gossypium hexaploid bridging populations. Genome, 50(5), 479-491.
Berti F., Hofs J.L., Zagbaï H.S. & Lebailly P., 2006. Le coton dans le monde, place du coton africain et principaux enjeux. Biotechnol. Agron. Soc. Environ., 10, 271-280.
Brown M.S., 1965. Chromosome manipulations and plant genetics. Attributes of intra and interspecific aneuploidy in Gossypium. Heredity, 20(suppl.), 98-120.
Brubaker C.L. et al., 1999. Production of fertile hybrid germplasm with diploid Australian Gossypium species for cotton improvement. Euphytica, 108, 199-213.
Brubaker C.L. & Brown A.H.D., 2003. The use of multiple alien chromosome addition aneuploids facilitates genetic linkage mapping of the Gossypium G genome. Genome, 46, 774-791.
Demol J., coord., 2002. L'amélioration des plantes. Application aux principales espèces cultivées en régions tropicales. Gembloux, Belgique : Presses agronomiques de Gembloux.
Deodikar G.B., 1949. Cytogenetic studies on crosses of Gossypium anomalum with cultivated cottons I. Indian J. Agric. Sci., 19, 389-399.
Deodikar G.B., 1950. Cytogenetic studies on crosses of Gossypium anomalum with cultivated cottons II. Indian J. Agric. Sci., 20, 399-414.
De Vienne D., 1998. Les marqueurs moléculaires en génétique et biotechnologies végétales. Paris : INRA.
Durnam D.M., Gelinas R. & Myerson D., 1985. Detection of species specific chromosomes in somatic cell hybrids. Somatic Mol. Genet., 11, 65-71.
Endrizzi J.E., Turcotte E.L. & Kohel R.J., 1985. Genetics, cytology, and evolution of Gossypium. Adv. Agron., 23, 271-275.
Guo W., Wang W., Zhou B. & Zhang T., 2006. Cross-species transferability of G. arboreum-derived EST-SSRs in the diploid species of Gossypium. Theor. Appl. Genet., 112, 1573-1581.
Haider Ali S.N., Ramana M.S., Jacobsen E. & Visser R.G.F., 2001. Establishment of a complete series of a monosomic tomato chromosome addition lines in the cultivated potato using RFLP and GISH analyses. Theor. Appl. Genet., 103, 687-695.
Han Z. et al., 2006. Characteristics, development and mapping of Gossypium hirsutum derived EST-SSRs in allotetraploid cotton. Theor. Appl. Genet., 112, 430-439
Harlan J.R. & De Wet J.M.J., 1971. Towards a rational classification of cultivated plants. Taxon, 20, 509-517.
Hau B., 1981a. Lignées d'addition sur Gossypium hirsutum L. I. Utilisation de l'hybridation interspécifique et de la méthode des lignées d'addition pour l'amélioration du cotonnier. Coton Fibres Trop., 26, 247-258.
Hau B., 1981b. Lignées d'addition sur Gossypium hirsutum L. II. Description phénotypique de quelques lignées d'addition monosomiques de Gossypium anomalum et de Gossypium stocksii. Coton Fibres Trop., 36, 285-295.
Hau B., 1982. Lignées d'addition sur l'espèce G. hirsutum L. III. Evolution d'une collection de lignées d'addition de G. anomalum et de G. stocksii sur G. hirsutum après plusieurs générations d'autofécondation. Coton Fibres Trop., 37, 163-177.
Hutchinson J.B., Silow R.A. & Stephens S.C., 1947. The evolution of Gossypium. Oxford, UK: University Press London.
Jahier J., 1992. Techniques de cytogénétique végétale. Paris : INRA.
Jena K.K. & Khush S.G., 1989. Monosomic alien addition lines of rice: production, morphology, cytology and breeding behavior. Genome, 32, 449-455.
Jiang J., Friebe B. & Gill B.S., 1994. Recent advances in alien gene transfer in wheat. Euphytica, 73, 199-212.
Jiwen Y. et al., 2007. High-density linkage map of cultivated allotetraploid cotton based on SSR, TRAP, SRAP and AFLP markers. J. Integrative Plant Biol., 49, 716-724.
Kammacher P., 1956. Les possibilités actuelles d'application de l'hybridation interspécifique à l'amélioration du cotonnier en milieu africain. Coton Fibres Trop., 11, 101-136.
Kammacher P. & Schwendiman J., 1969. Addition au génome de l'espèce de cotonnier Gossypium hirsutum de deux chromosomes de l'espèce sauvage G. stocksii. Can. J. Genet. Cytol., 11, 169-183.
Kimber G., 1961. Basis of the diploid-like meitotic behaviour of polyploid cotton. Nature, 191, 98-100.
Koto E., 1983. Tentative d'utilisation de l'espèce sauvage diploïde G. longicalyx pour l'amélioration de l'espèce cultivée tétraploïde G. hirsutum L. par la méthode des lignées d'addition et de substitution. Thèse de doctorat : Université d'Orsay (France).
Lacape J.M. et al., 2003. A combined RFLP-SSR-AFLP map of tetraploid cotton based on a Gossypium hirsutum x Gossypium barbadense backcross population. Genome, 46, 612-626.
Le H.T. & Armstrong K.C., 1991. In situ hybridization as a rapid means to assess meiotic pairing and detection of alien DNA transfers in interphase cells of wide crosses involving wheat and rye. Mol. Gen. Genet., 7, 33-37.
Louant B.P., Maréchal R. & Baudoin J.-P., 1977. Les facteurs agissant sur les transferts de matériel génétique chez les hybrides bispécifiques. Principes utiles aux sélectionneurs et perspectives dérivant de l'étude des croisements interspécifiques dans le genre Gossypium. Coton Fibres Trop., 32, 39-57.
Maréchal R., 1972. Comportement méiotique chez l'hybride Gossypium hirsutum L. x Gossypium areysianum (Defl.). Hutch. aux niveaux triploïde, hexaploïde et pentaploïde. Coton Fibres Trop., 27, 205-211.
Mergeai G., 1992. Utilisation du cotonnier sauvage Gossypium areysianum (Defl.) Hutch. Pour l'amélioration de l'espèce cultivée Gossypium hirsutum L. Thèse de doctorat : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Mergeai G., Noel J.M., Louwagie J. & Baudoin J.-P., 1993. Utilisation du cotonnier sauvage Gossypium areysianum (Defl.) Hutch. pour l'amélioration de l'espèce cultivée G. hirsutum L. : description de deux nouvelles lignées d'addition monosomiques. Coton Fibres Trop., 49(4), 231-251.
Mergeai G., 2006. Introgressions interspécifiques chez le cotonnier. Cah. Agric., 15, 135-143.
Nasuda S., Friebe B. & Gill B.S., 1998. Gametocidal genes induce chromosome breakage in the interphase prior to the first mitotic cell division of the male gametophyte in wheat. Genetics, 149, 1115-1124.
Ndungo V., Demol J. & Maréchal R., 1988. L'amélioration du cotonnier Gossypium hirsutum par hybridation interspécifique. Bruxelles : ADGD.
Nguyen T.B. et al., 2004. Wide coverage of the tetraploid cotton genome using newly developed microsatellite markers. Theor. Appl. Genet., 109, 167-175.
Peakall R. et al., 1998. Cross-species amplification of soybean (Glycine max) simple sequence repeats within the genus and other legume genera: implications for the transferability of SSRs in plants. Mol. Biol. Evol., 15, 1275-1287.
Pinkel D., Straume T. & Gray J.W., 1986. Cytogenetic analysis using quantitative, high-sensitivity, fluorescence hybridization. Proc. Natl Acad. Sci. USA., 83, 2934-2938.
Poisson C., Schwendiman J. & Kammacher P., 1969. Mise en évidence d'une homéologie chromosomique entre Gossypium anomalum Wawra & Peyr. et G. stocksii. C. R. Acad. Sci. Paris., 268, 1597-1599.
Poisson C., 1970. Contribution à l'étude de l'hybridation interspécifique dans le genre Gossypium : transfert de matériel génétique de l'espèce diploïde sauvage G. anomalum à l'espèce cultivée G. hirsutum. Thèse de doctorat : Université d'Orsay (France).
Reinisch A.J. et al., 1994. A detailed RFLP map of cotton, Gossypium hirsutum x Gossypium barbadense: chromosome organization and evolution in a disomic polyploid genome. Genetics, 138, 829-847.
Rong J.K. et al., 2004. A 3347-locus genetic recombination map of sequence-tagged sites reveals features of genome organization, transmission and evolution of cotton (Gossypium). Genetics, 166, 389-417.
Rooney W.L., Stelly D.M. & Altman D.W., 1991a. Identification of four Gossypium sturtianum monosomic alien addition derivatives from a backcrossing program with G. hirsutum. Crop Sci., 31, 337-341.
Rooney W.L. & Stelly D.M., 1991b. Preferential transmission and somatic elimination of a Gossypium sturtianum chromosome in G. hirsutum. Crop Sci., 82, 151-155.
Sarr D., 2003. Evaluation des potentialités des lignées monosomiques d'addition des espèces diploïdes australiennes sur Gossypium hirsutum L. pour l'amélioration de la principale espèce cultivée. Mémoire : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Schwarzacher T., Leitch A.R., Bennett M.D. & Helsop-Harisson J.S., 1989. In situ localisation of parental genomes in a wide hybrid. Ann. Bot., 64, 315-324.
Schwarzacher T. et al., 1992. Genomic in situ hybridisation to identify alien chromosomes and chromosome segments in wheat. Theor. Appl. Genet., 84, 778-786.
Schwendiman J., 1978a. L'amélioration du cotonnier Gossypium hirsutum par hybridation interspécifique : utilisation des espèces G. barbadense et G. stocksii. Coton Fibres Trop., 33, 239-255.
Schwendiman J., 1978b. L'amélioration du cotonnier Gossypium hirsutum par hybridation interspécifique : utilisation des espèces G. barbadense et G. stocksii. Thèse de doctorat : Université d'Orsay (France).
Schwendiman J., Koto E. & Hau B., 1980. Considérations sur l'évolution de l'appariement chromosomique chez les allotétraploïdes de cotonnier G. hirsutum x G. stocksii et G. hirsutum x G. longicalyx et sur la position taxonomique de G. longicalyx. Coton Fibres Trop., 35, 269-275.
Stewart J.McD., 1995. Potential for crop improvement with exotic germplasm and genetic engineering. In: Constable G.A. & Forrester N.W., eds. Proceedings of the world cotton research conference. 1: Challenging the future, 14-17 February 1994, Brisbane, Australia. Narrabri, NSW, Australia: CSIRO, 313-337.
Tagu D., 1999. Principes des techniques de biologie moléculaire. Paris : INRA.
Wendel J.F. & Cronn R.C., 2003. Polyploidy and the evolutionary history of cotton. Adv. Agron., 78, 139-186.
Zagbaï H.S., Berti F. & Lebailly P., 2006. Impact de la dynamique cotonnière sur le développement rural. Etude de cas de la region de Korhogo, au Nord et au Centre de la Côte-d'Ivoire. Biotechnol. Agron. Soc. Environ., 10, 325-334.
To cite this article
About: Djibril Sarr
Gembloux Agricultural University – FUSAGx. Unité de Phytotechnie tropicale et Horticulture. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
About: Guy Mergeai
Gembloux Agricultural University – FUSAGx. Unité de Phytotechnie tropicale et Horticulture. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : mergeai.g@fsagx.ac.be






