- Portada
- volume 13 (2009)
- numéro 2
- Aspects microbiologiques de la production par fermentation solide des endo-β-1,4-xylanases de moisissures : le cas de Penicillium canescens
Vista(s): 0 (0 ULiège)
Descargar(s): 0 (0 ULiège)
Aspects microbiologiques de la production par fermentation solide des endo-β-1,4-xylanases de moisissures : le cas de Penicillium canescens

Notes de la rédaction
Reçu le 3 mars 2008, accepté le 4 novembre 2008
Résumé
La production de xylanases par Penicillium canescens 10-10c fait l'objet de recherche au Centre Wallon de Biologie Industrielle. Les travaux antérieurs utilisaient la fermentation submergée ou liquide. Les travaux actuels s'orientent de plus en plus vers la fermentation solide à partir des résidus agricoles ou agroalimentaires. Outre la valorisation de ces résidus, la fermentation solide atteint un intérêt de plus en plus important dans divers autres domaines comme la biodégradation des résidus solides, la bioremédiation des polluants organiques dans les sols et la réduction de la pollution atmosphérique par la biofiltration. La xylanase est une enzyme industrielle utilisée en général dans les procédés d'extraction et de clarification. P. canescens présente la particularité d'en produire une activité, équilibrée dans ses composantes xylanases, beta-xylosidase et arabinosidase et non contaminée par des activités cellulolytiques et amylolytiques. C'est une souche hyper-productrice de xylanases non contaminées par une activité cellulase. Le taux de production est l'un des plus élevés dans la littérature (535 U.ml-1 et 9 632 U.g-1 en fioles, en milieux liquide et solide, respectivement). L'activité de bioblanchiment de la pulpe de cellulose par l'enzyme purifiée est plus élevée que celle d'une préparation commerciale de xylanases de Trichoderma longibrachiatum utilisée traditionnellement en industries de papier. Elle possède un degré d'hydrolyse complète de 40 % (sur glucuronoxylane) et de 35 % (sur arabinoxylane) à 55 °C et à pH de 5,9. Ces caractéristiques ouvrent les portes de nombreuses applications, d'où l'optimisation de sa production en fermentation solide à l'échelle du laboratoire en vue de définir une ligne de conduite pour la transposition industrielle ultérieure. Cet article présente un résumé de la littérature scientifique sur ce sujet.
Abstract
Microbial aspects of endo-β-1,4-xylanase production in solid-state fermentation by Penicillia: the case of Penicillium canescens. Production of xylanases by Penicillium canescens 10-10c is the research object in Walloon Center of Industrial Biology. Previous works used submerged or liquid fermentation. The actual works are oriented more and more towards solid fermentation from agricultural or agro-alimentary residues. In addition to the valorization of these residues, solid-state fermentation reaches an increasingly significant interest in various other fields like the biological breakdown of the solid residues, the bioremediation of the organic pollutants in the grounds and the reduction of the air pollution by the biofiltration. Xylanase is an industrial enzyme used in general in extraction and clarification processes. P. canescens can produce an activity of it, particularly in its balanced forms of xylanases, beta-xylosidase and arabinosidase, and not contaminated by cellulolytic and amylolytic activities. It is a hyper producing strain of xylanase. The production rate is one of the highest in literature (535 U.ml-1 and 9,632 U.g-1 in Erlenmeyer flasks, in submerged and solid state fermentation, respectively). The biobleaching activity of the cellulose pulp by the purified enzyme is higher than a commercial preparation of xylanases from Trichoderma longibrachiatum used industrially. It has a complete hydrolysis degree of 40% (on glucuronoxylan) and 35% (on arabinoxylan) at 55°C and at pH of 5.9. These characteristics lead to many industrial applications of this enzyme. That is why the optimization of its production by the solid-state fermentation at the laboratory scale in order to define a policy for the industrial transposition later is carried out. This article presents a summary of the scientific literature on this subject.
Tabla de contenidos
1. Introduction
1Une grande variété de microorganismes (bactéries, levures, moisissures, algues, protozoaires, gastéropodes et arthropodes) produisent les enzymes xylanolytiques (Collins et al., 2005 ; Yang et al., 2006). Les moisissures constituent le groupe le plus intéressant à cause de leur large spectre d'activités xylanolytiques (Bakri, 2003). De plus en plus, les xylanases commerciales sont produites aussi bien par fermentation liquide que solide (Haltrich et al., 1997).
2La fermentation solide présente un certain nombre d'avantages économiques et technologiques dont la faiblesse des couts et la simplicité des équipements (Durand, 2003). Cet article traite de généralités sur la production des xylanases de moisissures, particulièrement par Penicillium canescens en fermentation solide.
2. Généralités sur les enzymes industrielles
3Les enzymes sont des protéines qui, en raison de leurs propriétés spécifiques, participent à la synthèse de molécules. Elles peuvent accélérer certaines réactions chimiques par des facteurs de cent millions. Dans des conditions particulières, elles rendent possible de nombreux processus. Elles sont utilisées comme produits finaux, mais aussi comme agents de fabrication industrielle. Selon Larreta-Garde (1997), les enzymes sont utilisées dans toutes les industries de la fermentation, que ce soit pour les produits agroalimentaires (distillerie, jus de fruit, sucre, condiments, additifs, viandes, céréales, laits, fromages, plats cuisinés, pain, biscuiterie), dans l'industrie pharmaceutique (antibiotiques, acides divers, vitamines), l'industrie biomédicale (protéines recombinantes, réactifs), les industries biochimiques du nettoyage et de la décontamination (lessives, détergents, traitement de l'eau et des surfaces) (Figure 1).
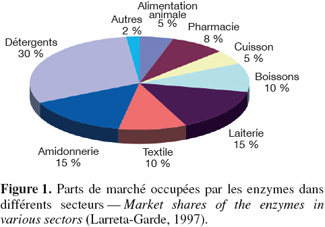
4En 2001, le marché global des enzymes industrielles et de spécialité était estimé à presque deux milliards d'euros (Collins et al., 2005).
5Les enzymes sont divisées en six principales classes, en fonction du type de réaction qu'elles catalysent : les oxydoréductases (EC 1), les transférases (EC 2), les hydrolases (EC 3), les lyases (EC 4), les isomérases (EC 5) et les ligases (EC 6). Elles sont désignées par un nom systématique (indiquant la nature du ou des substrats, le type de réaction catalysée), un numéro d'ordre à quatre chiffres, précédé de E.C. (= Enzyme Commission) et dont le premier chiffre indique la classe, le deuxième la sous-classe, le troisième la sous-sous-classe, le quatrième le numéro d'ordre dans la sous-sous-classe.
6Septante-cinq pourcent des enzymes sont des hydrolases (amylases, cellulases, hémicellulases, pectinases). Au niveau commercial, les protéases sont les plus importantes (environ 40 % du total des ventes), viennent ensuite les hydrolases. Le reste du marché est tenu par les oxydo-réductases et/ou les isomérases. Les plus grands producteurs sont Megazyme, Novozymes, Biocatalysts Ltd, Enzyme Bio Systems Inc., etc. De plus en plus, les producteurs d'enzymes industrielles utilisent la fermentation solide. C'est le cas de Lyven-France qui utilise exclusivement la fermentation solide pour la production des enzymes industrielles.
3. Les enzymes xylanolytiques
3.1. Définition
7Les xylanases sont des glycosidases (O-glycoside hydrolases, EC 3.2.1.x) qui catalysent les hydrolyses des liaisons 1,4-D-xylosidiques dans les régions non substituées des chaines de xylanes pour aboutir au xylose (une source de carbone primaire nécessaire au métabolisme cellulaire). Elles libèrent des oligomères linéaires de haut, puis de faible degré de polymérisation. La nature, la fréquence et la répartition des substituants sur la chaine de xylane conditionnent la capacité d'une endoxylanase à hydrolyser un substrat (Bakri, 2003). Différentes structures de xylanes existent en fonction des espèces de plantes (Collins et al., 2005) ; les chaines homopolymériques des unités 1, 4-β-D-xylopyranosyl pouvant être substituées à différents degrés par des glucuronopyranosil, 4-O-méthyl-D-glucuronopyranosyl, α-L-arabinofuranosyl, acétyl, feruloyl et/ou les chaines de p-coumaroy. La structure de base est un squelette linéaire d'unités D-xylopyranose liées en β-1,4 et le degré de polymérisation se situe entre 100-200 unités de xylose. Le xylane de bois existe sous forme de O-acétyl-4-O-méthylglucuronoxylane (bois dur) et sous forme de arabino-4-O-methylglucuronoxylane (bois tendre), alors que les xylanes des herbes et des plantes annuelles sont typiquement des arabinoxylanes. Compte tenu de leur hétérogénéité et complexité, l'hydrolyse complète des xylanes requiert l'action combinée d'endo- et d'exoenzymes qui, non seulement hydrolysent les liaisons au sein de la chaine principale, mais également libèrent les constituants des chaines latérales (Figure 2). Non seulement les enzymes qui attaquent les liaisons intérieures de type β1,4-xylosidique appelées endo-β-1,4-xylanases (EC 3.2.1.8) sont nécessaires, mais également les exo-1,4-β-xylosidases (EC 3.2.1.37) hydrolysant les petits oligomères libérés par les endoxylanases, en xylose. Les enzymes accessoires ou enzymes de débranchement éliminant les chaines latérales sont aussi nécessaires. Ce sont les α-L-arabinofuranosidases ou xylanes-1,4-β-xylonidases (EC 3.2.1.55), les α-glucuronidases, les acétyl estérases, acétyl-xylan estérases et coumarique et férulique estérases.
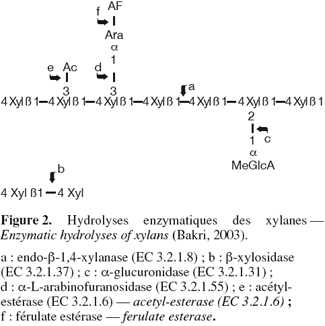
8Les premières publications relatives aux xylanases datent de 1955 et en 1961, il leur avait été attribué le code EC 3.2.1.8. Leur appellation officielle est endo-1,4-β-xylanase, mais elles sont communément appelées par les termes synonymiques tels xylanase, endoxylanase, 1,4-β-D-xylane-xylanohydrolase, endo-1,4-β-D-xylanase, β-1,4-xylanase et β-xylanase.
3.2. Multiplicité des xylanases chez les microorganismes
9De nombreuses xylanases ayant des propriétés variables ont été découvertes chez plusieurs microorganismes. Par exemple, cinq xylanases ont été purifiées chez Aspergillus niger 11. Au moins trois xylanases ont été purifiées respectivement chez Clostridium stercocararium, Streptomyces sp. 3137, Streptomyces exfoliatus MC1, Trichoderma hazianum E58, Trichoderma reesei QM9414, aeromonas sp. 212, Penicillium janthinellum, Talaromyces byssochlamydoides YH-50 (Wong et al., 1988). Le complexe enzymatique de P. canescens comprend principalement l'endo-β-1,4-xylanase (31 kD, pI 8,2-9,3), la β-galactosidase (120 kD, pI 6,7), l'α-L-arabinofuranosidase (60 kD, pI 7,6), l'arabinoxylanarabinofuranohydrolase (70 kD, pI 3,8-4) et l'endo-1,3/1,4-glucanase (40 kD, pI 4,4) (Sinitsyna et al., 2003a).
3.3. Classification des xylanases
10Wong et al. (1988) classaient les xylanases sur la base de leurs propriétés physicochimiques en deux groupes : celles de faible poids moléculaire (< 30 kDa) et de pI basique et celles de grand poids moléculaire (> 30 kDa) et de pI acide. Cependant, Collins et al. (2005) notent que cette classification était incomplète, de nombreuses exceptions avaient été découvertes et approximativement 30 % des endoxylanases (particulièrement issues des moisissures) ne pouvaient pas être classées suivant ce système. Plus tard, un système de classification plus complet a été admis et permettait la classification des xylanases et des glycosidases en général par la comparaison des structures primaires de leurs domaines catalytiques. Ce système regroupait les xylanases en six familles (de A à F). Actuellement, 96 familles de glycosidase ont été identifiées (Collins et al., 2005). De ce système de classification, les xylanases font partie des familles 10 (autrefois F) et 11 (autrefois G). Des enzymes ayant des activités xylanases ont été aussi trouvées dans les familles 5, 7, 8, 16, 26, 43, 52 et 62. Mais seules les séquences appartenant aux familles 5, 7, 8, 10, 11 et 43 possèdent des domaines catalytiques avec une activité endo-1,4-β-xylanase. Certaines séquences reportées dans les familles 16, 52 et 62 apparaissent être en fait des enzymes bifonctionnelles contenant deux domaines catalytiques : le domaine des familles 10 ou 11 aussi bien qu'un deuxième domaine de glycosidases.
3.4. Propriété des xylanases des moisissures
11Selon Bakri (2003), la température optimale des endoxylanases varie entre 40 et 60 °C. Kulkarni et al. (1999) observent que les xylanases de bactéries sont plus thermostables que les xylanases de moisissures. En général, les xylanases de différents microorganismes sont souvent stables sur une gamme de pH 3-10 et montrent un optimum de pH dans la gamme 4-7. Les points isoélectriques varient entre 3 et 10. Elles constituent une unité protéique de poids moléculaire variable entre 8-145 KDa. La composition en acides aminés est dominée par les acides aspartique, glutamique, glycine, sérine et thréonine (Bakri, 2003).
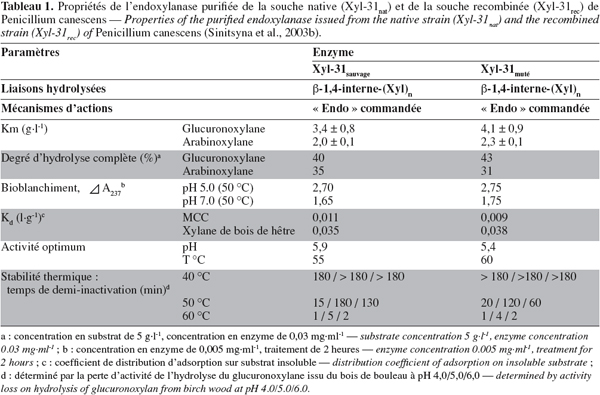
12L'endo-β-1-4-xylanase purifiée de P. canescens présente un PM de 31 kD, un pI compris entre 8,2-9,3, un pH optimal de 5,9 et une température optimale de 55 °C, une activité spécifique plus élevée sur le glucuronoxylane (29,4 U.mg-1) et sur l'arabinoxylane (24,1 U.mg-1) (Tableau 1) (Sinitsyna et al., 2003b).
13Le gène complet xylA codant pour l'endo-β-1,4-xylanase de P. canescens a été cloné et séquencé. La région codante comprend huit introns. La protéine enzymatique elle-même comprend 302 acides aminés issus de la protéine mature et 25 acides aminés du peptide signal (Serebryanyi et al., 2001).
3.5. Intérêts industriels des xylanases
14Les xylanases constituent la proportion commerciale majoritaire des hémicellulases. Elles peuvent être utilisées seules dans une large gamme de procédés industriels, couvrant tous les secteurs du marché des enzymes industrielles. L'office commercial et des brevets des Etats-Unis a dénombré 468 brevets sur les xylanases en 2001. Les xylanases sont fréquemment utilisées dans la formulation d'aliments pour les animaux (amélioration de la digestibilité et de la valeur nutritive), en industries des jus de fruits et brassicoles (amélioration de l'extraction ou la filtration), en amidonnerie (amélioration de l'opération d'extraction), en industrie du papier (amélioration de la pureté de la cellulose, permet une réduction de 50 % de la quantité de chlore nécessaire au blanchiment du papier et de la quantité d'organochlorés rejetés dans l'environnement) (Collins et al., 2005). Des tests ont montré que l'activité de bioblanchiment de la pulpe de cellulose par l'endo-β-1,4-xylanase de P. canescens est supérieure à celle d'Ecopulp X200 (une préparation commerciale de xylanases de Trichoderma longibrachiatum) (Sinitsyna et al., 2003b).
15D'autres applications existent, dans l'extraction du café et dans la préparation des cafés solubles, dans les détergents, dans la production de polysaccharides actifs pharmacologiquement (pour une utilisation comme agents antimicrobiens ou comme antioxydants), dans la production des alkyl glycosides (pour une utilisation comme surfactants), etc. (Collins et al., 2005).
16Les xylanases sont aussi utilisées en combinaison avec d'autres enzymes, et en particulier avec d'autres hydrolases, mais aussi avec des protéases, oxydases, isomérases. L'objectif actuel de nombreux programmes aux U.S.A. et au Brésil est de développer l'exploitation de la biomasse végétale et d'améliorer la rentabilité des procédés de saccharification des polysaccharides. L'hydrolyse de xylane en xylose par voie enzymatique, et la transformation du xylose en xylitol (par hydrogénation catalytique) ou en éthanol (par fermentation) qui suit, constituent des voies de développement dans ce domaine. Il est clair qu'un système xylanolytique complet (endo- et exoenzymes, xylobiase, enzymes débranchantes) est nécessaire pour atteindre l'hydrolyse totale du polymère. La tendance est d'utiliser des mélanges bruts d'hémicellulases de différentes espèces et de tirer profit des synergismes observés entre les multiples xylanases (Collins et al., 2005).
4. Les mécanismes de régulation de la synthèse des xylanases chez les Penicillia
4.1. Les facteurs influençant la synthèse
17La régulation des gènes inducteurs des enzymes xylanolytiques des Penicillia est contrôlée par la composition du milieu de culture (principalement les substrats carbonés et azotés) et les conditions environnementales de culture (pH, température, teneur en eau) (Chavez et al., 2006). Les substrats carbonés servent à la fois comme source de croissance et d'énergie aux moisissures. Plusieurs exemples établissent le xylane et le glucose respectivement comme un excellent inducteur et un puissant répresseur de la synthèse des endo-β-1,4-xylanases chez les moisissures (Tonukari et al., 2002 ; Bakri, 2003 ; Collins et al., 2005 ; Chavez et al., 2006). Cependant, ces substrats purs ne peuvent être utilisés qu'à très petite échelle compte tenu de leur prix d'achat élevé. Les sucres solubles (cellulose, saccharose, arabinose, maltose, lactose, etc.) n'induisent que très faiblement la synthèse, alors que les résidus agricoles insolubles et peu couteux (paille de blé, bagasse de canne à sucre, paille de riz, farine de soja, son de blé, son de l'orge, épi de mais, foins, etc.) induisent fortement la synthèse des xylanases (Bakri, 2003).
18Chez P. canescens, les meilleures sources de carbone sont les résidus agricoles tels la farine de soja, la paille de blé (Gaspar et al., 1997 ; Bakri et al., 2003). Le xylane et l'arabinose ou leurs produits d'hydrolyses (xylose et arabinose respectivement) à des concentrations déterminées constituent les meilleurs sucres solubles (Nikolaev et al., 1998 ; Vavilova et al., 2003).
19Les mêmes remarques sont aussi valables pour les sources d'azote. Généralement, la synthèse xylanasique par les moisissures est améliorée en présence de peptones ou d'extrait de levure (Haltrich et al., 1997). Cette observation a été confirmée chez P. canescens. Les sources d'azote organique (peptone de caséine, extrait de levure, etc.) influencent positivement la synthèse xylanasique par P. canescens, contrairement aux sources d'azote minéral (sulfate de sodium, nitrate de sodium, etc.) (Gaspar, 1999 ; Bakri, 2003).
20Les milieux de production des enzymes en général et des xylanases en particulier contiennent également des sels minéraux (KH2PO4, MgSO4, CaCl2, des sels en NH4+ou NO3-) et des ions métalliques (Fe2+, CO2+, Zn2+) (Gaspar, 1999 ; Bakri, 2003).
21En plus de ces divers éléments ci-dessus énumérés, les surfactants (principalement le tween 80) ou les acides aminés sont parfois utilisés dans la production des xylanases. Cependant, pour Haltrich et al. (1997), le tween 80 n'a aucun effet sur la production de xylanases.
22Deux autres facteurs importants qui affectent considérablement la production de xylanases sont le pH et la température de la culture (Gaspar et al., 1997; Bakri, 2003). Il a été montré pour plusieurs moisissures que la culture de ceux-ci à un pH ou à une température défavorables, limite l'accessibilité au substrat hémicellulosique, baisse le taux de croissance et la production de xylanases. Ainsi, la production de xylanases par P. canescens en culture liquide se caractérise par une production optimale à 30 °C et dans une gamme de pH proche de la neutralité (Gaspar, 1999).
4.2. Modèles explicatifs de la régulation de la synthèse des xylanases au niveau moléculaire (Chavez et al., 2006)
23Induction de la synthèse des xylanases par le xylane chez les Penicillia. Selon Chavez et al. (2006), le nombre de gènes xylanases Xln R (chez les Aspergilli et les Penicillia) et le type de substrat carboné inducteur expliqueraient le niveau de xylanases synthétisées par une moisissure (Figure 3). Deux types de substrats carbonés existent : les substrats solubles simples et les substrats insolubles complexes (les résidus agricoles et agroalimentaires). Cela suggérerait l'existence de deux groupes de Penicillia : ceux ne possédant que des sites de fixation pour les substrats simples et ceux possédant des sites de fixation pour les substrats complexes.
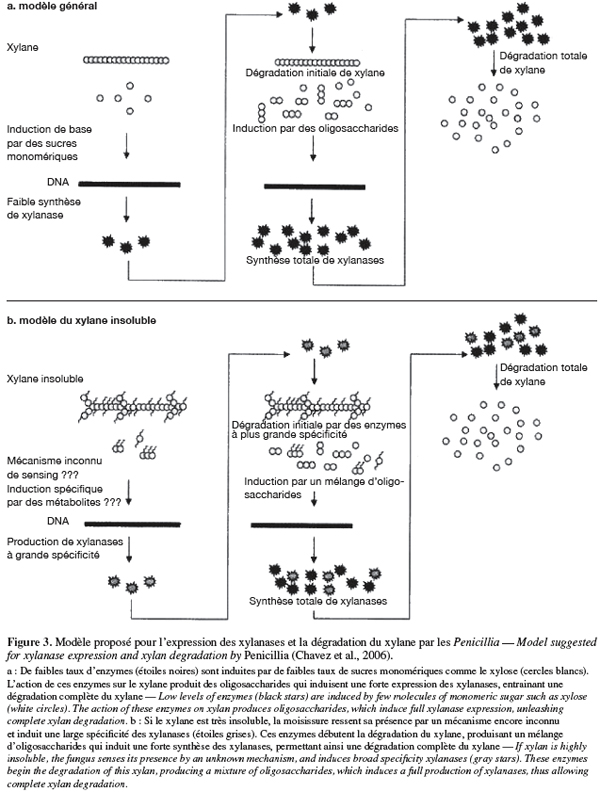
24Chez les Penicillia du premier groupe. Initialement suite à une légère dégradation chimique ou physique du substrat soluble simple (le xylane, par exemple) dans le milieu de culture, cela entraine une libération de quelques molécules de sucres monomériques comme le xylose ou le xylitol. Une légère synthèse xylanasique de base s'établit ensuite et servira de mécanisme déclencheur de la synthèse xylanasique à un niveau plus élevé pour la dégradation complète du substrat principal. L'effet inducteur du xylose, du xylobiose, de l'arabinose a en effet été démontré avec différentes moisissures dont Trichoderma reesei, Aspergillus terreus et P. canescens (Bakri, 2003 ; Vavilova et al., 2003). Cependant, il est possible que la synthèse des xylanases soit réprimée par l'accumulation des produits d'hydrolyse (xylose, xylitol, arabinose, arabitol) lors de culture élevée en xylane ou arabinose (Bakri, 2003 ; Vavilova et al., 2003).
25Chez les Penicillia du deuxième groupe. Suite à une libération chimique ou mécanique d'oligosaccharides spécifiques de xylane provenant de substrats insolubles complexes (xylane d'avoine, par exemple) ou par d'autres mécanismes inconnus de sensing, des enzymes de plus grandes capacités sont induites. Ce qui conduit à une expression entière de la synthèse des xylanases. Ces enzymes, appartenant à la famille 10 des glycosyl hydrolases, possèdent un plus large et profond site actif que les autres endoxylanases. Ce qui expliquerait pourquoi elles sont plus accessibles aux substrats complexes. Les endoxylanases de la famille 10 ont une faible spécificité en substrat soluble simple.
26Répression de la synthèse des xylanases par le glucose chez les Penicillia. Les études de Tonukari et al. (2002) ont confirmé qu'au niveau moléculaire, les endoxylanases des Aspergilli, Trichoderma et Penicillia sont réprimées par le glucose. Cette répression de l'expression des gènes Xln R par le glucose serait associée à une protéine, le CreA. La présence de glucose dans le milieu de culture active la protéine CreA. CreA jouant le rôle de médiateur négatif, se fixerait à la place des gènes inducteurs des xylanases Xln R des Aspergilli, Trichoderma et Penicillia, réprimant la synthèse xylanasique.
5. Production par fermentation solide de xylanases par les moisissures
27Le tableau 2 présente des niveaux de production de l'endo-β-1,4-xylanase de moisissures obtenus par fermentation solide. Chez P. canescens 10-10c, la production en fioles, en fermentation solide selon Bakri (2003) étant de 9 632 U.g-1 est 18 fois plus élevée que le taux de production obtenu en fermentation submergée par Gaspar (1999) qui est de 535 U.ml-1.
6. La fermentation solide
6.1. Définition
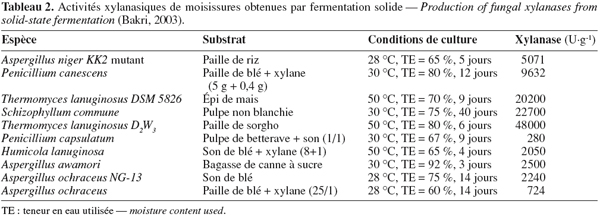
28La fermentation solide (fermentation de substrats solides, fermentation humide, culture solide, etc. et en anglais : solid-state fermentation ou SSF) est généralement définie comme une croissance microbienne sur des particules solides humides en l'absence d'eau libre (Durand, 2003 ; Gervais et al., 2003 ; Rahardjo et al., 2006). De façon simplifiée, les microorganismes se développent dans un système à trois phases : une matrice solide, une phase liquide qui lui est liée et une phase gazeuse prise au piège dans les particules ou entre celles-ci. Rahardjo et al. (2006) expliquent la diffusion des moisissures filamenteuses dans le substrat solide humide (Figure 4).
29Selon les substrats considérés, l'apparition d'eau libre se manifeste pour des teneurs en eau comprises entre 12 et 90 %, soit 0,65 et 0,98 d'activité d'eau (aw) (Mathot, 1996 ; Gervais et al., 2003).
6.2. Avantages de la fermentation solide
30Les avantages des fermentations solides sont nombreux. Ceux-ci incluent la simplicité de cette technologie (applicable en milieu rural) et ne nécessitant pas d'équipement sophistiqué pour les contrôles permanents des paramètres environnementaux (facultatifs). Le cout des équipements et des opérations est donc faible.
31L'absence d'eau libre permet de réduire considérablement le volume des installations de fermentation et les contaminations bactériennes. En effet, la majorité des bactéries réclame des taux d'humidité élevés pour survivre. Le peu d'eau disponible favorise la production de certains métabolites qui n'apparaissent pas ou peu en culture liquide. Par exemple, Monascus produit dix fois plus de pigment rouge en milieu solide qu'en fermentation liquide (Mathot, 1996).
32De plus, les opérations de mélange étant facilement modulables, il n'y a pas de production de mousses lors des fermentations solides, contrairement aux fermentations liquides. Etant donné que la plupart des procédés de fermentation solide mettent en œuvre des moisissures, ils ne nécessitent pas de stérilisation préalable du substrat. Ce qui réduit le cout énergétique nécessaire. En calibrant bien les particules du substrat (hachage, broyage, tamisage, etc.), l'aération peut être assurée passivement et/ou sans agitation ou par agitation discontinue. En cas d'aération active ou forcée, une porosité bien étudiée facilite le passage de l'air qui entre facilement en contact avec les moisissures installées en surface des particules.
33En revanche, les moisissures filamenteuses rendent souvent les milieux liquides fortement visqueux. Ce qui entraine des problèmes à l'agitation et au transfert d'oxygène (Durand, 1983).
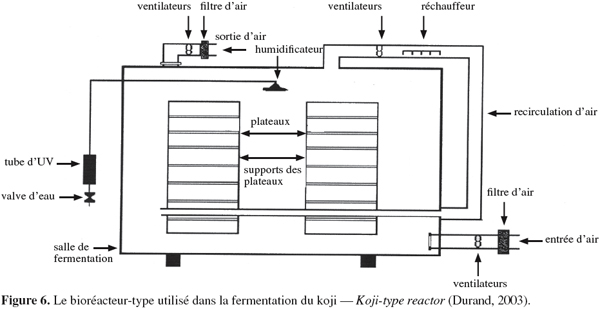
34En cas de production d'aliments pour animaux, tout le produit est utilisé, sans rejet d'eau usée. Les frais de séchage éventuels sont réduits (Mathot, 1996).
35Bref, selon la littérature, la fermentation solide possède une réputation de technique simple à mettre en œuvre, facilement applicable en milieu rural, de moindre cout car peu exigeante en matériel, ne nécessitant pas obligatoirement une stérilisation énergétique du substrat de culture et requiert un faible espace. Elle assure une forte productivité en métabolites. La faible teneur en humidité empêche la contamination bactérienne.
36Cependant, cette renommée est largement surfaite, surtout lors du développement d'applications pilotes ou en vraie grandeur. Dans ces conditions et bien d'autres, la fermentation solide présente de nombreux inconvénients.
6.3. Inconvénients des fermentations solides
37Les microorganismes utilisés sont limités. En effet, seuls les microorganismes se développant bien aux basses humidités peuvent être employés.
38Les connaissances physiologiques et technologiques de la croissance des microorganismes sur milieux solides sont faibles.
39Les problèmes de transfert d'oxygène et de chaleur rendent difficile l'augmentation d'échelle des procédés. En effet, la faible quantité d'eau ralentit les échanges de chaleur, pouvant créer des problèmes de surchauffe lorsque des masses importantes sont mises en fermentation. L'évaporation compense partiellement cet échauffement, mais en réduisant l'eau disponible. L'évacuation des calories métaboliques peut donc poser un problème qu'il s'agit de résoudre lors du passage de petits essais de laboratoire aux applications en vraie grandeur.
40La nature solide et hétérogène des substrats utilisés complique le suivi direct des paramètres de fermentation. Les sondes utilisées en fermentation liquide ne sont pas utilisables, même si Bellon-Maurel et al. (2003) proposent de nouveaux types de sondes adaptées aux cultures solides.
41Il est pratiquement difficile d'assurer une distribution parfaitement homogène de substances ajoutées au substrat et donc du milieu de culture. Ce qui rend le contrôle on line des paramètres de culture tels que le pH, l'humidité et la concentration des nutriments, assez aléatoire.
42Les microorganismes étant inséparables du substrat, l'estimation de la biomasse est délicate.
43Etant donné la forte concentration des métabolites obtenus, des produits inhibiteurs générés par les microorganismes peuvent s'accumuler en concentration élevée dans le milieu de culture.
6.4. Les diverses étapes suivies en fermentations solides
44Les différentes étapes suivies au cours d'une fermentation solide sont : la préparation du substrat ou du milieu de culture, la stérilisation facultative du milieu (généralement à 121 °C pendant 21 minutes) suivie par le refroidissement de celui-ci, l'inoculation du milieu de culture, l'incubation du milieu inoculé en maintenant dans la mesure du possible les conditions environnementales optimales (température, pH, teneur en eau).
45La préparation du substrat carboné. Les substrats carbonés utilisés en fermentation solide proviennent essentiellement des résidus agricoles et agroalimentaires. Ce sont les substrats lignocellulosiques (sous forme de paille, de son, de bagasse, de pulpe, etc.), les féculents (résidus de banane, de soja, les graines, etc.), les supports synthétiques (mousse de polyuréthane, résine polymérique, etc.), etc.
46La préparation du substrat carboné vise à lui faire subir divers traitements physique, chimique ou biologique (enzymes) afin de favoriser une grande accessibilité des constituants aux microorganismes. Le traitement physique peut se faire soit mécaniquement (broyage, concassage, hachage, aplatissage), soit thermiquement (chauffage, autoclavage, traitement à la vapeur), soit par irradiation ou par ultrasonication. Le traitement chimique se fait par la voie des alcalis, acides, oxydants, gaz et solvants.
47L'inoculation du milieu de culture. L'inoculation du milieu de culture se fait le plus souvent à partir d'une suspension de spores (Mathot, 1996). Celles-ci restent viables plus longtemps que du mycélium, sont moins sensibles aux conditions externes et se conservent plus facilement. La quantité optimale de spores à inoculer diffère selon les cas. Un excès de spores peut parfois inhiber la germination. Les spores sont cependant métaboliquement dormantes, impliquant que la dégradation du substrat ne peut s'installer qu'après la germination. Pour minimiser cet inconvénient, une pré-germination des spores est parfois envisagée. Des inoculums spores + mycélium + substrat de production peuvent être utilisés également.
48Optimisation de la température, de la teneur en eau, du pH et de l'aération de la culture. A l'échelle industrielle, les contrôles de la température de culture et de l'humidité du milieu sont très importants pour le scaling up (Bellon-Maurel et al., 2003). La faible conductibilité thermique des substrats utilisés et leur faible teneur en eau réduisent le transfert de chaleur, qui lui-même dépend de la taille des particules de la couche solide. Une élévation de la température dans la masse fermentable due à un dégagement de chaleur métabolique peut aller jusqu'à atteindre 80° C, causant un assèchement de la culture et une baisse de l'aw et de la disponibilité en nutriments. La mesure de la température se fait souvent dans la couche solide et dans la phase gazeuse entrant et sortant du réacteur grâce à des thermosenseurs, thermistances/thermistors ou des sondes métaboliques Pt. La température de la culture à l'échelle industrielle est généralement régulée par l'injection d'air forcé, l'agitation du réacteur ou par le phénomène d'évaporation. Au laboratoire, la température du milieu de culture est généralement régulée par un bain d'eau thermostatisée ou par une simple régulation de la température de la pièce où se trouve le bioréacteur (Bellon-Maurel et al., 2003).
49L'eau est impliquée dans la croissance cellulaire et les réactions métaboliques, les activités enzymatiques, les transports des éléments nutritifs, des métabolites extracellulaires et des gaz au cours de la fermentation solide (Bellon-Maurel et al., 2003 ; Gervais et al., 2003). Les variations de la teneur en eau sont dues à l'évaporation causée par la chaleur métabolique, à l'hydrolyse du substrat et aux productions d'eau métabolique. La teneur en eau est habituellement déterminée off-line par les mesures de la matière sèche, laquelle, cependant, ne différencie pas l'eau disponible pour les activités microbiennes (c'est-à-dire l'activité d'eau aw) de l'eau liée au substrat indisponible aux microorganismes.
50A l'échelle du laboratoire, l'activité d'eau est contrôlée en plaçant le bioréacteur dans une chambre de culture dont l'humidité de l'atmosphère est régulée par des solutions salines saturées. A grande échelle, le bioréacteur est généralement aéré avec de l'air saturé en eau.
51Des variations de valeur du pH résultent d'une consommation en substrat (exemple de l'hydrolyse des protéines) et/ou des synthèse métaboliques (exemple des acides organiques). Les variations de pH sont des indicateurs des changements dans les activités métaboliques (Bellon-Maurel et al., 2003).
52En fermentation solide, il n'existe pas d'électrode pouvant enregistrer le pH des milieux solides à cause de l'absence d'eau libre. Certains auteurs utilisent des électrodes potentiométriques ou une électrode à pH standard, après suspension de l'échantillon dans de l'eau distillée. Il est ainsi difficile de contrôler le pH efficacement en fermentation solide. Lorsque cela est nécessaire, la méthode standard est de tamponner le milieu de culture avec un mélange adéquat de composés azotés (urée, sels ammoniacaux), des sels de Ca2+ ou des solutions alcalines. Pendant la fermentation, le pH peut être régulé par l'addition d'acides ou de bases à l'eau de refroidissement de la masse fermentable.
53L'aération des cultures solides joue quatre fonctions, à savoir le maintien des conditions d'aérobies, l'élimination du dioxyde de carbone, la régulation de la température de culture et la régulation de la teneur en eau (Raimbault, 1998). En fermentation liquide, l'aération est souvent le facteur limitant de la croissance microbienne à cause de la faible solubilité de l'oxygène dans l'eau. L'aération en fermentation solide est plus facile qu'en fermentation liquide à cause d'une part, de la diffusion rapide de l'oxygène dans le film humide entourant les particules de substrat, et d'autre part à cause aussi des grandes surfaces de contact entre la phase gazeuse, le substrat et les mycelia aériens. Généralement, l'oxygène ne constitue pas un facteur limitant en fermentation solide lorsque le substrat est particulaire.
6.5. Applications de la fermentation solide
54De manière générale, les applications de la fermentation solide concernent l'alimentation humaine (fromages, production de champignons comestibles, koji, choucroute et saucissons secs), le compostage et l'ensilage, la bio-filtration de gaz malodorants, la production d'aliments riches en protéines pour l'alimentation animale, la production d'enzymes (amylases, cellulases, xylanases, etc.) et de métabolites spécifiques (éthanol, acides organique, citrique, etc.).
7. Les réacteurs utilisés en fermentation solide
55Bellon-Maurel et al. (2003) notent qu'il existe différents types d'appareillage que l'on peut regrouper dans les catégories suivantes : les plateaux étagés disposés souvent dans une chambre conditionnée avec ou sans aération forcée, les colonnes avec aération forcée et, très souvent, humidification de l'air introduit, les cuves tournantes autour d'un axe, avec ou sans chicanes internes, la vis sans fin placée dans l'axe d'un cylindre permettant une fermentation continue, les cuves ouvertes fixes où le substrat est mélangé par bras d'agitation, pales, hélices ou vis sans fin, les rocking fermentor avec agitation par balancement et les lits fluidisés air solide où un courant d'air calibré maintient les particules en suspension dans l'air.
56Durand (2003) classe les bioréacteurs utilisés en fermentation solide en deux catégories selon l'échelle de fermentation : les bioréacteurs utilisés au stade de laboratoire (utilisant quelques grammes à quelques kilogrammes de substrat solide) et les bioréacteurs utilisés au stade industriel (utilisant des kilogrammes à des tonnes de substrat solide).
7.1. Les bioréacteurs utilisés au stade de laboratoire
57Plusieurs types d'équipements très diversifiés sont utilisés au stade de laboratoire en fermentation solide. Les boites de Petri, fioles, barquettes en aluminium, sacs O2, bouteilles de roux et de rouleau offrent l'avantage de leur simplicité. Généralement sans aération active, ni agitation, seule la température de la salle de fermentation est régulée. Ces bioréacteurs sont utilisés lors des premières études. Certains ont fait l'objet de brevets par des chercheurs.
58Ainsi, le bioréacteur d'ORSTOM des années 1975-1980 composé de petites colonnes (Φ = 4 cm, 20 cm de long), est rempli avec le milieu de culture préalablement inoculé et placé dans un bain d'eau thermostatisé (Figure 5). De l'air saturé en eau traverse chaque colonne. Ce bioréacteur offre la possibilité d'aérer la culture et aussi d'analyser la respiration microbienne en connectant chaque colonne à un analyseur de gaz. Toutefois, ce système ne permet pas d'échantillonner pendant la fermentation et il est nécessaire de sacrifier l'entièreté de la culture lors des analyses.
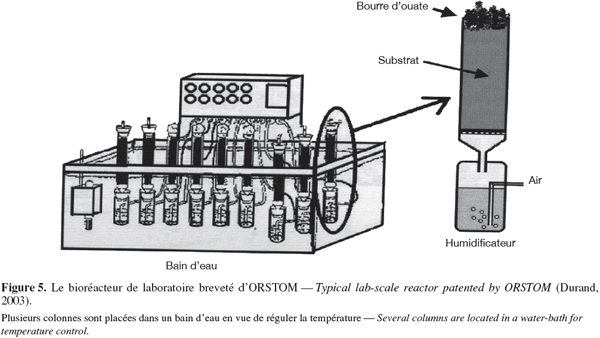
59Un autre bioréacteur de laboratoire d'ORSTOM nommé Zymotis a également été breveté (Durand, 2003). Il contient des plateaux verticaux internes pour le transfert de chaleur dans lesquels de l'eau froide circule. Le milieu solide est préalablement inoculé avant d'être introduit sur chaque plateau.
7.2. Les bioréacteurs utilisés aux stades pilote et industriel
60Le nombre de réacteurs utilisés aux stades pilote et industriel est limité. A grande échelle, les transferts de chaleur et d'oxygène se font très délicatement. Le nombre de microorganismes pouvant être utilisés à grande échelle est très faible. La nature du substrat, la nécessité de la stérilité du produit final, la quantité d'inoculum nécessaire et la méthode d'inoculation, le nettoyage du réacteur, etc. posent d'énormes difficultés à grande échelle.
61Les problèmes de transfert de chaleur et de masse sont attribués à une mauvaise aération dans la masse en fermentation. Les solutions proposées consistent à faire circuler l'air à travers les couches du substrat ou l'air traverse le substrat. Trois stratégies sont utilisées : les lits statiques, mélangés par intermittence ou continuellement mélangés. Pour ce faire, deux principales catégories de réacteurs sont utilisées : les réacteurs non mélangés et les réacteurs mélangés.
62Les réacteurs statiques non mélangés, à plateaux ou à cuve. Les réacteurs statiques à plateaux (Figure 6) sont utilisés dans la fermentation du koji, principalement dans les pays asiatiques. Ces réacteurs constituent la plus ancienne et simple technologie. En bois, métal ou en plastique, perforés ou non, les plateaux contiennent le milieu solide avec une profondeur maximale de 15 cm. Cette technologie peut être utilisée à l'échelle souhaitée, aussi bien en laboratoire qu'en industrie, car il s'agira simplement d'augmenter le nombre de plateaux dans le réacteur. Quant aux réacteurs statiques à cuve, ils peuvent contenir jusqu'à 20 kg de substrat solide (Durand, 2003). Quelques variantes de ce système sont utilisées par la société allemande Prophyta pour la production en conditions stériles de biopesticides. Un réacteur similaire, nommé " PlafractorTM " a été breveté par la société indienne Biocon.
63Les réacteurs mélangés (tambours rotatifs). Ce sont des cuves tournantes autour d'un axe, avec ou sans chicanes internes. Le retournement assure à la fois l'homogénéisation, l'aération et limite la sporulation. Un système simple est la bétonnière (Mathot, 1996). La rotation peut être périodique ou continue. Lorsqu'elle est périodique, la rotation se fait généralement en réponse à l'augmentation de la température mesurée par un thermocouple inséré dans le milieu. Un tel type de bioréacteur a été utilisé pour fermenter 4,7 l de volume d'haricot de soja par Rhizopus (Durand, 2003). La firme Fujiwara au Japon en commercialise.
8. Les méthodes d'estimation de la biomasse en fermentation solide
64L'une des plus grandes difficultés de la fermentation solide, contrairement à la fermentation liquide, réside dans le dosage de la biomasse. La détermination directe de la biomasse en fermentation solide est très difficile à cause des contraintes pour séparer la biomasse microbienne du milieu de culture. La majorité des études utilise les méthodes de séparation de la biomasse, de suppression de la matrice solide et d'estimations indirectes basées sur le dosage de composés spécifiques de la biomasse (protéines, acides nucléiques, glucosamine, ergostérol) et sur l'activité métabolique de la biomasse (respiration : oxygène consommé ou CO2 produit, production d'enzymes extracellulaires, production d'ATP).
65La méthode de séparation de la biomasse n'est possible que pour les organismes unicellulaires où de simples comptages microbiologiques sont possibles. Elle a été utilisée sur du riz fermenté par Candida lipolytica et pour Saccharomyces cerevisiae sur divers substrats amylacés (Mathot, 1996).
66La méthode de suppression de la matrice solide a été appliquée lors de la fermentation de riz par Aspergillus oryzae en vue d'éliminer l'amidon du substrat à l'aide d'amylases, puis à récupérer le mycélium par filtration (Mathot, 1996).
67Le dosage des protéines se fait par les méthodes analytiques (méthode de Kjeldahl, dosage des acides aminés totaux, méthode au biuret, méthode de Lowry).
68Dans tous les cas, l'estimation de la biomasse est altérée par la nécessité de poser des hypothèses pour les calculs (Mathot, 1996). En effet, cette estimation est généralement estimée par des analyses de culture du microorganisme étudié sur milieu liquide dans des conditions aussi étroitement identiques que possible à la culture solide. Ces hypothèses se résument à trois principalement : la constance de la teneur en protéines, alors qu'elle varie en cours de croissance ; la non-utilisation des protéines du substrat, alors que c'est généralement le contraire ; la détermination obligatoire du facteur de conversion en culture liquide, alors que la teneur en protéines est parfois différente sur substrat solide.
69Le dosage des acides nucléiques est parfois inapplicable par suite d'interférences issues du milieu de culture. Cette méthode a été utilisée pour doser la biomasse d'Aspergillus oryzae fermentant le riz. La teneur en ADN du mycélium est déterminée en culture liquide (Mathot, 1996).
70L'ATP d'une culture solide est une mesure de l'activité microbienne, mais ne peut être corrélée à la croissance microbienne ; les résultats sont difficilement répétitifs car toutes les particules du mycélium ne sont pas dans le même état physiologique (Mathot, 1996).
71Le dosage de la glucosamine tire parti de la présence de chitine dans les parois fongiques. L'avantage ici est que la chitine est le plus souvent absente du substrat. Mais la proportion de chitine varie avec l'âge et l'environnement. En plus, le facteur de conversion est tiré d'essais en culture liquide.
72Le dosage d'ergostérol se justifie car c'est le stérol membranaire prédominant chez les levures et champignons (excepté chez certains phycomycètes et les rouilles) (Crépy, 2000). Il est un constituant membranaire des mycélia, des spores et des cellules végétatives. Mais l'ergostérol est relativement instable, sensible à l'air et à la lumière. De plus, la teneur en ergostérol varie en fonction de l'espèce fongique, de l'âge de la culture et du stade de développement (phase de croissance, formation d'hyphe et sporulation), de la composition du milieu sur lequel les moisissures se développent, ainsi que des conditions de croissance (pH, température, agitation) et des paramètres environnementaux. Elle augmente avec le développement de la moisissure, avec une concentration maximale lors de la sporulation. Ensuite, la concentration diminue avec la dégénérescence et la mort du champignon.
73La mesure de la respiration ou respirométrie (O2 consommé, CO2 libéré) n'est applicable in situ qu'avec un fermenteur étanche à aération forcée à partir d'un analyseur de gaz. Mais l'estimation de la biomasse à partir de la respiration suppose que l'évolution de l'O2 ou du CO2 est entièrement associée à celle-ci. De plus, la consommation de l'O2 ou la production du CO2 doit être constante pendant la durée de l'essai. Ce qui n'est pas toujours le cas. De plus, des différences importantes apparaissent en fin de croissance pour cause de respiration endogène (Mathot, 1996).
74La production d'exoenzymes est aussi, en principe, associée à la croissance cellulaire. La production d'alpha-amylase est directement proportionnelle au poids de mycélium d'Aspergillus oryzae cultivé sur du riz. Une corrélation élevée a été calculée entre la teneur en glucosamine et l'activité alpha-amylase (0,91) et de l'amyloglucosidase (0,98) pour Aspergillus oryzae (Mathot, 1996).
75Les mesures de baisse de pression dans le bioréacteur suite à la croissance mycélienne servent aussi à estimer la biomasse en fermentation solide. Cette méthode basée sur le rapport BP/L (où BP est la baisse de pression, L est la longueur de la colonne) est un bon indicateur des changements qualitatifs (germination, croissance, sporulation) et dans certains cas des changements quantitatifs dans la biomasse. Il reflète la perméabilité du microorganisme dans le milieu solide. Cependant, comme la fermentation solide utilise des matières végétales à la fois comme support et substrat, les variations de la perméabilité ne résultent pas seulement de la croissance du microorganisme, mais aussi des changements macroscopiques dans la structure du support, résultant de la consommation et de l'adsorption d'eau (Bellon-Maurel et al., 2003).
76Ainsi, aucune des méthodes d'estimation de la biomasse proposées dans la littérature n'est en mesure de fournir des valeurs réellement fiables. Toutes reposent, en effet, sur des hypothèses difficilement vérifiables. Elles permettent, tout au plus, de fixer un ordre de grandeur. De nouvelles méthodes sont envisagées actuellement pour analyser divers paramètres de la fermentation solide. Ce sont l'analyse de molécules volatiles, la spectrométrie infrarouge, les analyses d'images, les mesures des micro-ondes, les rayons X et gamma, le temps de la résonance magnétique du domaine (TRMD), la résonance magnétique de la formation d'image (RMFI). L'inconvénient majeur de ces techniques est l'impossibilité de la reproductibilité des mesures, leur cout élevé qui rend ces techniques inapplicables en laboratoire.
9. Conclusion
77L'enzymologie industrielle utilise de plus en plus la fermentation solide et les moisissures pour la production des xylanases. Une revue de la littérature sur le cas de l'endo-β-1,4-xylanase produite par les moisissures, particulièrement par P. canescens, a été analysée dans le présent article. La culture solide est adaptée aux substrats complexes agricoles ou agroalimentaires pour la production d'endo-β-1,4-xylanase par P. canescens. Le taux de production est 18 fois plus élevé qu'en fermentation liquide (Gaspar, 1999 ; Bakri, 2003). C'est une technologie simple et de moindre cout. En outre, elle permet d'augmenter la production enzymatique sans créer les problèmes énormes rencontrés en fermentation liquide.
Bibliographie
Bakri Y., 2003. Optimisation de la production de xylanases par Penicillium canescens 10-10c. Thèse de doctorat : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Bakri Y., Jacques Ph. & Thonart Ph., 2003. Xylanase production by Penicillium canescens 10-10c in solid-state fermentation. Appl. Biochem. Biotechnol., 108, 737-748.
Bellon-Maurel V., Orliac O. & Christen P., 2003. Sensors and measurements in solid-state fermentation: a review. Process Biochem., 38, 881-896.
Chavez R., Bull P. & Ey Zaguirre J., 2006. The xylanolytic enzyme system from the genus Penicillium. J. Biotechnol., 1(2), 64-66.
Collins T., Gerday Ch. & Feller G., 2005. Xylanases, xylanase families and extremophilic xylanases. FEMS Microbiol. Rev., 29, 3-23.
Crépy H., 2000. Mise en évidence et dosage de l'ergostérol, biomarqueur de moisissures retrouvées dans les lieux de travail. Mémoire : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Durand A., 2003. Bioreactor designs for solid-state fermentation. Biochem. Eng. J., 13, 113-125.
Gaspar A., Cosson T., Roques C. & Thonart Ph., 1997. Study on the production of a xylanolytic complex from Penicillium canescens 10-10c. Appl. Biochem. Biotechnol., 67, 45-58.
Gaspar A., 1999. Etude des interactions entre les paramètres biologiques et les grandeurs physiques liées à l'agitation et à l'aération lors de la production de xylanases par Penicillium canescens. Thèse de doctorat : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Gervais P. & Molin P., 2003. The role of water in solid-state fermentation. Biochem. Eng. J., 13, 85-101.
Haltrich D. et al., 1997. Production of fungal xylanases. Bioresour. Technol., 58, 137-161.
Kulkarni N., Shendye A. & Rao M., 1999. Molecular and biotechnological aspects of xylanases. FEMS Microbiol. Rev., 23, 411-456.
Larreta-Garde V., coord., 1997. Enzymes en agroalimentaire. Paris : Lavoisier, Tec & Doc.
Mathot P., 1996. Modélisation d'un réacteur simplifié pour la fermentation solide de produits et sous-produits agricoles. Valorisation de l'aliment fermenté par le porc. Thèse de doctorat : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Nikolaev I.V. & Vinetski Y.P., 1998. L-arabinose induces synthesis of secreted ββ-galactosidase in the filamentous fungus Penicillium canescens. Biochemistry, 63(11), 1294-1298.
Rahardjo Y.S.P., Tramper J. & Rinzema A., 2006. Modeling conversion and transport phenomena in solid-state fermentation: a review and perspectives. Biotechnol. Adv., 24(2), 161-179.
Raimbault M., 1998. General and microbiological aspects of solid substrate fermentation. Electron. J. Biotechnol., 1(3), http://www.ejbiotechnology.info/content/vol1/issue3/full/9/, (03.02.08).
Serebryanyi V.A, Vavilova E.A., Chulkin A.M. & Vinetskii Y.P., 2001. Cloning of Penicillium canescens endo-1,4-β-xylanase gene and construction of multicopy strains. Appl. Biochem. Microbiol., 38(5), 420-426.
Sinitsyna O.A. et al., 2003a. Isolation and properties of major components of Penicillium canescens extracellular enzyme complex. Biochemistry, 68(11), 1200-1209.
Sinitsyna O.A. et al., 2003b. Recombinant endo--1,4-xylanase from Penicillium canescens. Biochemistry, 68(12), 1313-1319.
Tonukari N.J., Scott-Craig J.S. & Walton J.D., 2002. Influence of carbon source on the expression of Cochliobolus carbonum xylan-degrading enzyme genes. Afr. J. Biotechnol., 1(2), 64-66.
Vavilova E.A., Antonova S.V., Barsukov E.D. & Vinetskii Y.P., 2003. Mechanism of overproduction of secreted enzymes in the mycelial fungus Penicillium canescens. Appl. Biochem. Microbiol., 39(3), 249-256.
Wong K.K.Y., Tan L.U.L. & Saddler J.N., 1988. Multiplicity of β-1,4-xylanase in microorganisms: functions and applications. Microbiol. Rev., 52(3), 305-317.
Yang S.Q. et al., 2006. High-level of xylanase production by the thermophilic Paecilomyces themophila J18 on wheat straw in solid-state fermentation. Bioresour. Technol., 97(15), 1794-1800.
Para citar este artículo
Acerca de: Allah Antoine Assamoi
Gembloux Agricultural University – FUSAGx. Centre Wallon de Biologie Industrielle (CWBI). Unité de Bio-industries. Passage des Déportés, 2. B-5030 Gembloux (Belgium). E-mail : assamoi.a@fsagx.ac.be
Acerca de: Jacqueline Destain
Gembloux Agricultural University – FUSAGx. Centre Wallon de Biologie Industrielle (CWBI). Unité de Bio-industries. Passage des Déportés, 2. B-5030 Gembloux (Belgium).
Acerca de: Philippe Thonart
Gembloux Agricultural University – FUSAGx. Centre Wallon de Biologie Industrielle (CWBI). Unité de Bio-industries. Passage des Déportés, 2. B-5030 Gembloux (Belgium).






