- Accueil
- volume 13 (2009)
- numéro 2
- L’impact du miellat de puceron au niveau des relations tritrophiques entre les plantes-hôtes, les insectes ravageurs et leurs ennemis naturels
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
L’impact du miellat de puceron au niveau des relations tritrophiques entre les plantes-hôtes, les insectes ravageurs et leurs ennemis naturels

Notes de la rédaction
Reçu le 20 octobre 2008, accepté le 4 décembre 2008
Résumé
Les relations tritrophiques entre plantes, insectes phytophages et auxiliaires reposent essentiellement sur la présence de stimuli chimiques présents dans l’environnement. Dans ce contexte, le miellat (excrément liquide des pucerons), riche en sucres et en acides aminés, constitue une source de nourriture pour de nombreux auxiliaires mais agit également comme une kairomone volatile et de contact. D’une part, les composés volatils issus du miellat guident les auxiliaires vers une source de nourriture, de proies ou d’hôtes mais stimulent aussi certains comportements : recherches, localisations et attaques de proies/hôtes. D’autre part, un contact avec cette substance induit l’oviposition, chez les syrphes notamment (Episyrphus balteatus, etc.). L’utilisation d’un miellat artificiel (solution sucrée, etc.) pourrait permettre de renforcer l’efficacité de la lutte biologique dans des zones infestées de ravageurs en augmentant la présence d’auxiliaires et ainsi les taux de prédation et de parasitisme.
Abstract
Aphid honeydew impact on the tritrophic relationships between host-plants, phytophagous insects and their natural enemies. Tritrophic relations between plants, phytophagous insects and beneficials are based on the presence of chemical cues in the environment. In this context, honeydew (the aphid excretory product), rich in sugars and amino-acids, constitutes a nutritional resource for beneficials but also acts as a volatile and a contact kairomone. On one hand, honeydew volatile chemicals cues guide beneficials to a food source, hosts or preys but also stimulate particular behaviors: searching, preys/hosts locations and attacks. On the other hand, a contact with honeydew induces the oviposition especially for syrphids (Episyrphus balteatus, etc.). The use of an artificial honeydew could be a way for enhancing the biological control efficiency in fields by increasing the number of beneficials but also the predation and parasitic rates.
Table des matières
1. Introduction
1Les interactions entre les plantes et les insectes phytophages reposent sur trois niveaux trophiques et sont régies par un grand nombre de stimuli chimiques impliquant :
2– les plantes-hôtes, premier niveau trophique : métabolites secondaires, terpènes, " composés à note verte " ou green leaf volatiles, etc. (Flint et al., 1979 ; Turlings et al., 1990 ; 1992 ; De Moraes et al., 2001),
3– les ravageurs, second niveau trophique : phéromones d’agrégation, sexuelles et d’alarme, produits secrétés et excrétés, etc. (Kennedy, 1984 ; Nordlund et al., 1985 ; Symondson et al., 2002),
4– les insectes auxiliaires (parasitoïdes et prédateurs), troisième niveau trophique.
5Libérés dans l’environnement, les sémiochimiques (ou molécules naturellement impliquées dans la communication entre individus) relatifs à ces trois niveaux trophiques sont exploités par les ravageurs et les insectes auxiliaires. Parmi les sémiochimiques, on distingue deux groupes : les phéromones et les substances allélochimiques (Nordlund et al., 1976).
6Les substances allélochimiques sont définies comme étant des métabolites secondaires émis par un individu d’une espèce et capables d’affecter la santé, la croissance, le comportement et/ou la biologie d’un individu d’une autre espèce. On y retrouve les kairomones, les allomones et les synomones (Arnaud et al., 2003). Les kairomones sont bénéfiques pour l'espèce qui reçoit le signal ; les allomones, émises lors des relations de compétition entre espèces, sont bénéfiques pour l'individu émetteur et les synomones sont à la fois bénéfiques aux espèces émettrices et réceptrices.
7Les phéromones se définissent comme étant des substances sécrétées par un individu et captées par un autre individu de la même espèce : il en résulte une réaction intraspécifique (Nordlund et al., 1976).
8Les sémiochimiques permettent aux auxiliaires de localiser une source de nourriture, des hôtes ou des proies (Nordlund et al., 1976 ; Tumlinson et al., 1992 ; Vet et al., 1992 ; Ahmad et al., 2004). Au niveau des relations tritrophiques, ces odeurs induisent différentes réponses comme l’attraction, la répulsion, l’arrêt ou la stimulation de certains comportements chez les auxiliaires. Il est d’ailleurs bien connu que les prédateurs et les parasitoïdes réagissent aux sémiochimiques émis par les plantes attaquées mais aussi à ceux libérés par les ravageurs. Par exemple, le puceron noir de la fève, Aphis fabae (Scopoli) (Homoptera : Aphididae), produit une kairomone (le tricosane) qui attire Metasyrphus corollae (Fabricus) (Diptera : Syrphidae), un syrphe aphidiphage (Shonouda et al., 1998a ; 1998b). La coccinelle Hippodamia convergens (Guerin-Meneville) (Coleoptera : Coccinellidae) est, quant à elle, attirée par les molécules chimiques libérées par le végétal lorsque le puceron Myzus persicae (Sulzer) (Homoptera : Aphididae) s’en nourrit (Hamilton et al., 1999).
9Les auxiliaires sont également attirés par des kairomones de faible volatilité et déposées par leurs proies/hôtes sur le végétal. Il s’agit de sécrétions glandulaires et cuticulaires mais aussi de rejets métaboliques (Steidle et al., 2002 ; 2003). Dans ce contexte, les pucerons, causant d’importants dommages culturaux en prélevant la sève phloémienne de leurs plantes-hôtes, rejettent une substance épaisse et collante par le système digestif : le miellat. La quantité de miellat produite peut représenter plus de 100 fois le poids du puceron chaque heure (Hölldobler et al., 1990). Ce composé, riche en sucres et en acides aminés (Wäckers, 2000), joue un rôle crucial dans les relations tritrophiques. En effet, le miellat est considéré :
10– comme un complément nutritionnel essentiel (sucres, acides aminés, etc.) pour les insectes auxiliaires (Hagen, 1962 ; Hagen et al., 1971 ; Hogervorst et al., 2007),
11– comme une kairomone volatile et/ou de contact utilisée spécifiquement par les prédateurs et les parasitoïdes afin de localiser leurs proies/hôtes (Bouchard et al., 1984 ; 1985 ; Budenberg, 1990 ; Budenberg et al., 1992a ; McEwen et al., 1993 ; Du et al., 1997 ; Evans et al., 1997 ; Scholz et al., 2000 ; Petersen et al., 2002 ; Buitenhuis et al., 2004).
2. Le miellat : généralités et composition
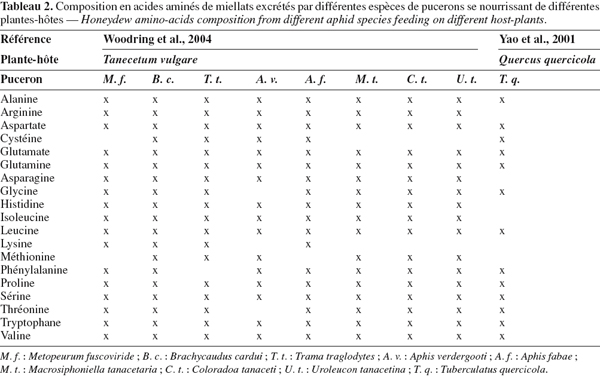
12Le miellat est un terme générique définissant les rejets métaboliques des Homoptères, déposés sur les feuilles et au pied de la plante-hôte. Cette excrétion comprend essentiellement des sucres (Tableau 1), 90 à 95 % de la matière sèche (monosaccharides : fructose, galactose, glucose, mannose, etc. ; disaccharides : maltose, mélibiose, sucrose, tréhalose, turanose, etc. et trisaccharides : fructomaltose (erlose), mélézitose, raffinose, etc.) (Wäckers, 2000 ; Yao et al., 2001), des acides aminés libres (Tableau 2), des minéraux, des vitamines, des lipides et des acides organiques (Way, 1963 ; Buckley, 1987a ; 1987b).
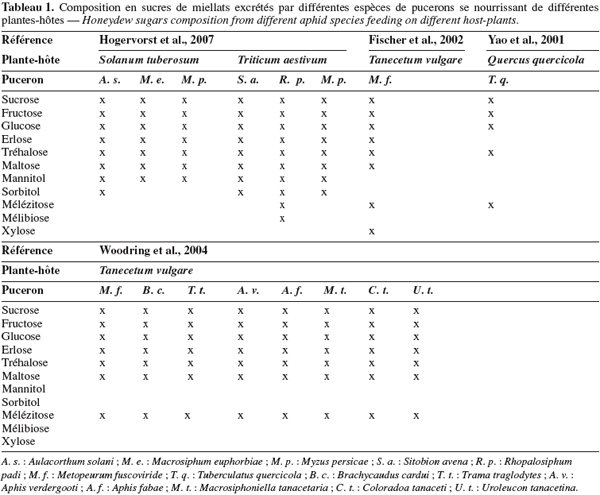
13La composition en sucre du miellat reflète celle de la sève phloémienne que prélève le puceron pour satisfaire ses besoins nutritionnels en hydrates de carbone et en acides aminés (Wäckers, 2000).
14De nombreux pucerons produisent périodiquement des gouttelettes de miellat (de 0,05 à 0,1 µl) (Yao et al., 2001) qu’ils excrètent à l’aide de leurs pattes postérieures, par expulsion via le cauda ou par contraction de l’abdomen. Les quantités de miellat rejetées varient selon les espèces de pucerons. Par exemple, le puceron Metopeurum fuscoviride (Stroyan) excrète quatre fois plus de miellat par unité de temps (880 μg par puceron par heure) que Brachycaudus cardui (L.) (223 μg par puceron par heure), et six fois plus que A. fabae (133 μg par puceron par heure) (Fisher et al., 2001). Notons que ce comportement est modifié en présence de fourmis (relation de mutualisme1) (Way, 1963).
15Parmi les hydrates de carbone, on retrouve communément, quelle que soit l’origine du miellat : le sucrose, le fructose, le glucose et le maltose (quatre sucres issus du phloème), mais aussi des sucres complexes synthétisés par le puceron – le mélézitose, l’erlose (fructomaltose), le raffinose et le tréhalose – (Wäckers, 2000). Ce sont les concentrations de ces divers sucres qui varient selon l’espèce de pucerons, la plante-hôte ou encore d’autres facteurs développés plus loin.
16Ainsi, ce sont les sucres d’origine végétale qui représentent la majeure partie des hydrates de carbone : 67 à 89 % des sucres totaux (Hogervorst et al., 2007).
17La forte concentration en sucres du miellat y favorise le développement de la fumagine ou sooty mold, un complexe de champignons de type Cladosporium, Aureobasidium, Fumago, Antennariella, Limacinula, Scorias et Capnodium (Reynolds, 1976 ; Schoulties, 1980). Cependant, ce complexe de champignons peut également se retrouver sur des végétaux non-infestés de pucerons. Dans ce dernier cas, la fumagine se développe sur des exudats produits par les trichomes glandulaires des feuilles de certains végétaux (Hibiscus, etc.) (Hughes, 1976 ; Schoulties, 1980). La fumagine forme un dépôt noirâtre à la surface des feuilles de la plante-hôte, réduit la photosynthèse et provoque même une asphyxie de la plante attaquée par les pucerons.
18La composition en acides aminés est également variable et dépend des mêmes facteurs que ceux mentionnés pour les sucres. Une étude menée par Woodring et al. (2004) sur huit espèces de pucerons a montré que le miellat contient essentiellement quatre acides aminés non-essentiels (78 % des acides aminés totaux) : l’asparagine, la glutamine, le glutamate et la sérine. Par ailleurs, les deux premiers sont reconnus comme étant les acides aminés principaux retrouvés chez de nombreux pucerons (Sasaki et al., 1990 ; Douglas et al., 1992).
19La composition du miellat est donc variable et dépend de plusieurs facteurs :
20– l’espèce, le stade et l’âge du puceron déterminent la quantité totale de miellat produit, mais aussi sa composition finale (teneurs et proportions en sucres, en acides aminés, etc.) (Hendrix et al., 1992),
21– la présence de bactéries symbiotiques dans le tractus digestif des pucerons influe sur leurs excrétions (Wilkinson et al., 1997),
22– la composition du miellat dépend de la plante-hôte (Völkl et al., 1999), mais n’est pas tout à fait identique à celle de la sève phloémienne (Bristow, 1991),
23– la durée de l’infestation de la plante-hôte est également un paramètre qui va définir les caractéristiques du miellat (Faria et al., 2007),
24– les métabolites secondaires des végétaux et la nutrition minérale de ces derniers modifient aussi les teneurs en acides aminés (Malcolm, 1990),
25– le mutualisme avec les fourmis modifie la composition du miellat (moins de glucose, plus de sucrose, jusqu’à 40 % de mélézitose et 35 % de tréhalose, de plus grandes quantités d’acides aminés), mais aussi sa " présentation " (gouttelettes de plus petite taille) (Yao et al., 2001 ; 2002),
26– les pucerons parasités produisent un miellat moins riche en acides aminés (Cloutier, 1986).
27Li et al. (1997) mentionnent encore que la conservation des composés du miellat est relativement brève puisque les sucres et les acides aminés s’altèrent rapidement (fermentation, oxydation, activités microbiennes, etc.). Ainsi, le miellat, dont la composition varie au cours du temps, ne constitue pas toujours un indicateur fiable de la présence de proies. En effet, les sucres et les acides aminés peuvent perdurer sur le végétal, alors que les colonies de pucerons peuvent l’avoir déjà quitté (Li et al., 1997). Selon Shaltiel et al. (1998), l’activité kairomonale du miellat décroît en fonction de son vieillissement et s’estompe même complètement après 72 h (Choi et al., 2004).
28De plus, la " durée de vie " du miellat dans les cultures peut être limitée à la fois par les consommateurs de cette substance nutritionnelle, mais aussi par les précipitations et les rosées (lessivage du miellat). Enfin, il n’opèrerait comme kairomone que sur des distances de quelques centimètres à peine (Scholz et al., 2000 ; Choi et al., 2004).
3. Les principaux rôles du miellat vis-à-vis des auxiliaires
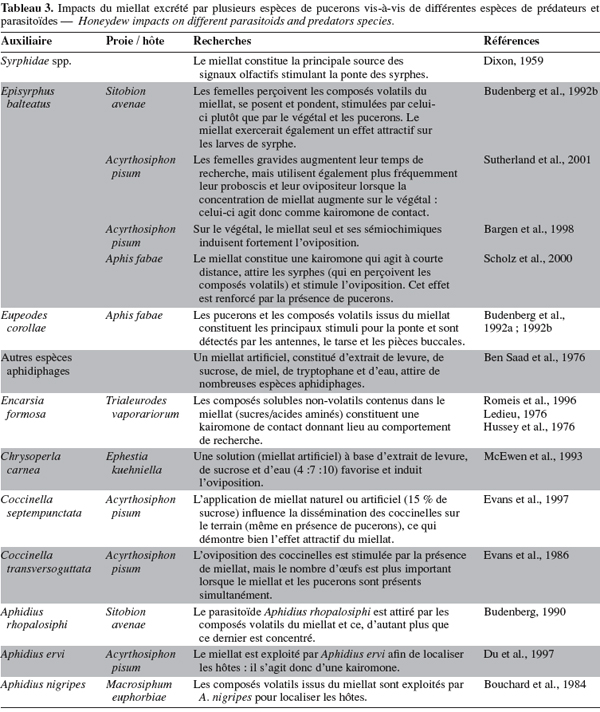
29Zoebelein (1955) a recensé 246 espèces d’insectes qu’attire le miellat des pucerons dont 23 espèces de syrphes, 10 de coccinelles et 59 de parasitoïdes Hyménoptères. Le tableau 3 propose une synthèse bibliographique (non exhaustive) des effets du miellat sur divers prédateurs et parasitoïdes.
30Il est reconnu que le miellat agit à la fois comme une kairomone volatile et comme une kairomone de contact (Figure 1). Les composés volatils associés et émis par le miellat proviendraient de l’altération naturelle (fermentation, oxydation, etc.) des sucres et des acides aminés que contient cette excrétion. La flore (bactéries, champignons, etc.) présente (originaire du tractus digestif des pucerons) ou se développant dans le miellat excrété est également suspectée d’être à la source des composés volatils attractifs pour de nombreux auxiliaires. Une dégradation naturelle due aux facteurs abiotiques (température, lumière, humidité relative) peut de même expliquer l’émission de composés volatils qui sont perçus par les sensilles présentes sur les antennes des auxiliaires (perception olfactive) (Choi et al., 2004).
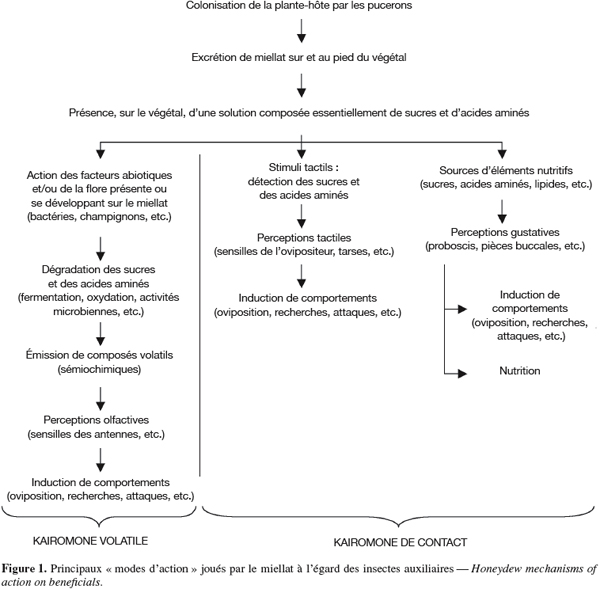
31L’excrétion de miellat, sur et au pied des plantes-hôtes, enduit les végétaux d’une solution riche en sucres et en acides aminés. Les insectes auxiliaires s’en nourrissent directement mais l’associent également à la présence potentielle de proies/hôtes. Ainsi, suite à une perception gustative (proboscis, etc.) et/ou tactile (sensilles présentes sur l’ovipositeur de certains auxiliaires, c’est le cas pour plusieurs espèces de syrphes), certains comportements sont fréquemment observés comme l’oviposition sur le végétal ou dans/sur un hôte (Budenberg et al., 1992a ; Scholz et al., 2000).
32Le miellat peut jouer un rôle kairomonal à la fois pour les larves et pour les adultes de divers auxiliaires. Ainsi, il a été montré que le premier stade larvaire d’Episyrphus balteatus (DeGeer) (Diptera : Syrphidae) s’oriente vers ses proies après avoir étiré ses papilles pour percevoir à la fois les composés volatils issus des pucerons (phéromones d’alarme ou sexuelles), mais aussi ceux libérés par le miellat (Gries, 1986 ; Bargen et al., 1998). La perception du miellat a également été démontrée pour les larves de Coccinella septempunctata (L.) (Coleoptera : Coccinellidae) (Hagen, 1962 ; Carter et al., 1984 ; Ide et al., 2007), de Chrysoperla carnea (Stephens) (Neuroptera : Chrysopidae) (Hogervorst et al., 2007) et d’Aphidoletes aphidimyza (Rondani) (Diptera : Cecidomyiidae) (Wilbert, 1974), lorsque ces ennemis naturels recherchent leurs proies. Les larves de C. carnea exploitent également le miellat comme une source nutritionnelle d’hydrates de carbone (Hogervorst et al., 2007).
33L’exploitation du miellat par les adultes de prédateurs et de parasitoïdes est plus largement reconnue. D’une part, le miellat constitue une source nutritionnelle indispensable pour de nombreux auxiliaires (Hagen, 1962 ; Hogervorst et al., 2007) et, d’autre part, cette substance ainsi que les composés volatils qui y sont associés induisent de nombreux comportements comme la localisation et l’attaque des proies/d’hôtes ou encore l’oviposition chez les insectes prédateurs (Bouchard et al., 1984 ; 1985 ; Budenberg, 1990 ; Budenberg et al., 1992a ; McEwen et al., 1993 ; Evans et al., 1997 ; Du et al., 1997 ; Scholz et al., 2000 ; Petersen et al., 2002).
34De plus, plusieurs études ont montré que le miellat est la source principale des stimuli olfactifs induisant l’oviposition de nombreuses espèces de syrphes (E. balteatus, M. corollae, etc.). Cependant, un contact avec cette substance serait indispensable à l’induction de la ponte (kairomone de contact) (Dixon, 1959 ; Budenberg et al., 1992a ; Scholz et al., 2000). Ainsi, Sutherland et al. (2001) ont montré qu’en présence de miellat, les femelles gravides d’E. balteatus consacrent plus de temps à la recherche de sites d’oviposition.
35Par ailleurs, en présence de miellat, C. carnea (McEwen et al., 1993 ; Petersen et al., 2002) ou C. septempunctata (Evans et al., 1986 ; 1997) déposent beaucoup plus d’œufs tandis que les parasitoïdes Aphidius nigripes (Ashmead) (Hymenoptera : Braconidae) ou Aphidius rhopalosiphi (De Stefani-Perez) (Hymenoptera : Braconidae) recherchent, localisent et attaquent plus fréquemment leurs hôtes (Bouchard et al., 1984 ; 1985 ; Budenberg, 1990 ; Budenberg et al., 1992b ; Du et al., 1997).
36Enfin, les composés volatils émanant du miellat stimulent les adultes de C. carnea à voler vers une source de nourriture. Le tryptophane serait la source présumée de cette kairomone volatile, mais le rôle attractif serait dû à un produit de décomposition de cet acide aminé : l’indole acétaldéhyde.
4. Utilisation du miellat dans le cadre de la lutte biologique
37Il est établi que le miellat naturel agit en tant que kairomone, qu’il stimule l’oviposition de divers prédateurs et parasitoïdes aphidiphages et qu’il en induit certains comportements (recherches actives, attaques fréquentes des proies/hôtes, etc.) propices à une lutte biologique efficace.
38Ainsi, afin de valoriser efficacement les propriétés de cette substance, plusieurs chercheurs ont envisagé l’emploi de miellat artificiel pour attirer les prédateurs et les parasitoïdes tout en induisant des comportements renforçant l’efficacité de la lutte biologique (recherches, localisations, etc.) (McEwen et al., 1993). En général, les miellats artificiels consistent en un mélange de sucrose, de levure (autolysat de levure ou extrait de levure) et d’eau. Il a été montré que le " miellat " ainsi recomposé (7:4:10) assure le maintien des aphidiphages dans les champs et qu’il favorise même la production d’œufs pour C. carnea (Hagen et al., 1971). Par ailleurs, l’attraction de prédateurs et de parasitoïdes dans des champs de Solanum tuberosum a été obtenue avec succès après la pulvérisation des plants de pommes de terre avec une solution à base de miel, de tryptophane et de levure, ces trois composants étant répandus seuls ou en association (Ben Saad et al., 1976). De plus, l’application de miellats artificiels (solution sucrée : 15 % de sucrose) influence la dissémination des coccinelles (C. septempunctata, etc.) sur le terrain (même en présence de pucerons) (Evans et al., 1997).
39Des essais, réalisés en cages, ont par ailleurs démontré que la pulvérisation de miellat artificiel augmente significativement le temps de résidence des parasitoïdes (A. rhopalosiphi, etc.) à proximité des plants traités (Budenberg et al., 1992b).
40C’est pourquoi Mandour et al. (2006) suggèrent, après des études réalisées en conditions de laboratoire, que l'application de miellat artificiel peut contribuer efficacement au maintien des ennemis naturels dans les zones ciblées tout en augmentant les taux de parasitisme et de prédation. Sur le terrain, il est donc possible d’influer considérablement sur la distribution et le comportement des auxiliaires afin de renforcer leur présence là où les infestations de ravageurs sont les plus importantes.
41Pourtant, aucune technique de lutte biologique ne recourt réellement à l’utilisation de miellat artificiel puisque la pulvérisation d’une solution fortement concentrée en sucres et en acides aminés présente plusieurs " inconvénients " considérables :
42– développements accrus de maladies fongiques (fumagine) et/ou bactériennes sur le feuillage et donc diminution du rendement final de la culture,
43– non-persistance du miellat artificiel sur les plants traités (lessivage par les pluies, consommation par les insectes ravageurs et/ou par les auxiliaires, etc.) et donc obligation de répéter son application périodiquement,
44– attraction éventuelle d’insectes ravageurs autres que les pucerons et donc observation de dommages plus importants.
45Cependant, afin de valoriser les propriétés attractives du miellat dans le cadre de la lutte biologique, une perspective intéressante repose sur l’exploitation de ses propriétés kairomonales. Plusieurs études suggérant la perception olfactive du miellat par divers prédateurs et parasitoïdes, l’utilisation des sémiochimiques émis lors de la dégradation du miellat (bactéries, champignons, etc.) semble être une voie prometteuse pour attirer et fixer les auxiliaires dans une zone-cible. La technique de lutte biologique ne reposerait alors plus sur la pulvérisation d’une solution aqueuse sucrée, mais plutôt sur le placement de diffuseurs contenant des sémiochimiques de synthèse identiques à ceux associés au miellat naturel.
5. Conclusion
46Le miellat induit de nombreuses interactions au niveau des relations tritrophiques (plante-hôte, ravageur, auxiliaire). Très fréquente sur les végétaux infestés et essentiellement composée de sucres (d’origine végétale) et d’acides aminés, cette excrétion des pucerons constitue une source de nourriture non négligeable mais agit également en tant que kairomone volatile et de contact pour de nombreux prédateurs et parasitoïdes.
47Détecté et localisé de façon tactile (sensilles de l’ovipositeur, tarse, etc.), gustative (proboscis et pièces buccales) et/ou olfactive (sensilles présentes sur les antennes, etc.), le miellat contribue à l’orientation des insectes auxiliaires et induit également certains comportements renforçant l’activité prédatrice ou parasitaire de ces derniers.
48En effet, les larves et les adultes de prédateurs (E. balteatus, E. corollae, C. carnea, C. septempunctata, etc.) ainsi que les parasitoïdes (A. nigripes, A. rhopalosiphi, etc.) exploitent notamment cette substance afin de s’orienter vers une source de nourriture. Le miellat est également à l’origine de stimuli olfactifs induisant des comportements particuliers tels que des recherches actives et des localisations de proies/d’hôtes, des attaques fréquentes de proies/d’hôtes et l’oviposition. Notons encore que c’est en association avec d’autres composés volatils tels que les green leaf volatiles, les phéromones d’alarme ou encore les phéromones sexuelles que le miellat intervient au sein des relations tritrophiques.
49Afin de renforcer l’efficacité de la lutte biologique dans des zones particulièrement infestées de ravageurs, l’utilisation d’un miellat artificiel et plus particulièrement des sémiochimiques y étant associés, parait toute indiquée pour augmenter la présence d’auxiliaires tout en stimulant leurs activités prédatrices ou parasitaires.
Bibliographie
Ahmad F., Aslam M. & Razaq M., 2004. Chemical ecology of insects and tritrophic interactions. J. Res. (Sci.), 15(2), 181-190.
Arnaud L., Detrain C., Gaspar C. & Haubruge E., 2003. Insectes et communication. J. Ing., 87, 25-28.
Bargen H., Saudhof K. & Poelhing H.M., 1998. Prey finding by larvae and adult females of Episyrphus balteatus. Entomol. Exp. Appl., 87, 245-254.
Ben Saad A.A. & Bishop G.W., 1976. Attraction of insects to patato plants through use of artificial honeydews and aphid juice. Entomophaga, 21(1), 49-57.
Bouchard Y. & Cloutier C., 1984. Honeydew as a source of host-searching kairomones for the aphid parasitoid Aphidius nigripes (Hymenoptera: Aphidiidae). Can. J. Zool., 62(8), 1513-1520.
Bouchard Y. & Cloutier C., 1985. Role of olfaction in host finding by aphid parasitoid Aphidius nigripes (Hymenoptera: Aphidiidae). J. Chem. Ecol., 11, 801-808.
Bristow C.M., 1991. Are ant-aphid association a tritrophic association? Oleander aphids and argentine ants. Oecologia, 87, 514-521.
Budenberg W.J., 1990. Honeydew as a contact kairomone for aphid parasitoids. Entomol. Exp. Appl., 55, 139-148.
Budenberg W.J. & Powell W., 1992a. The role of honeydew as an ovipositional stimulant for two species of syrphids. Entomol. Exp. Appl., 64, 57-61.
Budenberg W.J., Powell W. & Clark S.J., 1992b. The influence of aphids and honeydew on the leaving rate of searching aphid parasitoids from wheat plants. Entomol. Exp. Appl., 63, 259-264.
Buckley R.C., 1987a. Interactions involving plants, homoptera, and ants. Annu. Rev. Entomol., 8, 111-135.
Buckley R.C., 1987b. Ant-plant-homopteran interactions. Adv. Ecol. Res., 16, 53-85.
Buitenhuis R., McNeil J.N., Boivin G. & Brodeur J., 2004. The role of honeydew in host searching of aphid hyperparasitoids. J. Chem. Ecol., 30(2), 273-285.
Carter M. & Dixon A.F.G., 1984. Honeydew: an arrestant stimulus for coccinellids. Ecol. Entomol., 9, 383-387.
Choi M.Y. et al., 2004. Olfactory response by the aphidophagous gall midge Aphidoletes aphidimyza to honeydew from green peach aphid, Myzus persicae. Entomol. Exp. Appl., 111, 37-45.
Cloutier C., 1986. Amino acid utilization in the aphid Acyrthosiphon pisum infected by the parasitoid Aphidius smithi. J. Insect Physiol., 32, 263-267.
De Moraes C.M., Mescher M.C. & Tumlinson J.H., 2001. Caterpillar-induced nocturnal plant volatiles repel conspecific females. Nature, 410, 577-580.
Dixon T.J., 1959. Studies on behaviour of Syrphidae (Diptera). Trans. R. Entomol. Soc. London, 112, 345-379.
Douglas A.E. & Prasser W.A., 1992. Synthesis of the essential amino acid tryptophan in the pea aphid (Acyrthosiphon pisum) symbiosis. J. Insect Physiol., 38, 565-568.
Du Y., Guy M.P., Powell W. & Wadhams L.J., 1997. Chemically mediated associative learning in the host foraging behavior of the aphid parasitoid Aphidius ervi (Hymenoptera: Braconidae). J. Insect Behav., 10, 509-521.
Evans E.W. & Dixon F.G., 1986. Cues for oviposition by ladybird beetles (Coccinellidae): response to aphids. J. Anim. Ecol., 55, 1027-1034.
Evans E.W. & Richards D.R., 1997. Managing the dispersal of ladybird beetles (Col.: Coccinellidae): use of artificial honeydew manipulate spatial distributions. Entomophaga, 42, 93-102.
Faria C.A., Wäckers F.L. & Turlings T.C.J., 2007. The nutritional value of aphid honeydew for non-aphid parasitoids. Basic Appl. Ecol., 9(3), 286-297.
Fisher M.K., Hoffmann K.H. & Völkl W., 2001. Competition for mutualists in an ant-homopteran interactions mediated by hierarchies of ant attendance. Oïkos, 92, 531-541.
Fisher M.K., Völkl W., Schopf R. & Hoffmann K.H., 2002. Age-specific patterns in honeydew production and honeydew composition in the aphid Metopeurum fuscoviride: implications for ant-attendance. J. Insect Physiol., 48, 319-326.
Flint H.M., Salter S.S. & Walters S., 1979. Caryophyllene: an attractant for the green lacewing Chrysopa carnea Stephens. Environ. Entomol., 8, 1123-1125.
Gries G., 1986. Zum Beutefangverhalten der Schwebfliegenlarve Syrphus balteatus Deg. (Diptera, Syrphidae). J. Appl. Entomol., 102, 309-313.
Hagen K.S., 1962. Biology and ecology of predaceous Coccinellidae. Annu. Rev. Entomol., 7, 289-326.
Hagen K.S., Greany P., Sawall E.F. & Tassan R.L., 1971. The use of food sprays to increase effectiveness of entomophagous insects. In: Proceedings of the Tall timbers conference on ecological animal control and habitat management, 1970, n° 2. Tallahassee, FL, USA: Tall Timbers Research Station, 59-81.
Hamilton R.M., Dogan E.B., Schaalje G.B. & Booth G.M., 1999. Olfactory response of the lady beetle Hippodamia convergens (Coleoptera: Coccinellidae) to prey related odors, including a scanning electron microscopy study of the antennal sensilla. Environ. Entomol., 28, 812-822.
Hendrix D.L., Wie Y. & Leggett J.E., 1992. Homopteran honeydew sugar composition is determined by both the insect and plant species. Comp. Biochem. Physiol. A, 101B, 23-72.
Hogervorst P., Wäckers F. & Romeis J., 2007. Effects of honeydew sugar composition on the longevity of Aphidius ervi. Entomol. Exp. Appl., 122, 223-232.
Hölldobler B. & Wilson E., 1990. The ants. Cambridge, MA, USA: The Belknap Press of Harvard University Press.
Hughes S.J., 1976. Sooty moulds. Mycologia, 68, 693-820.
Hussey N.W., Parr W.J. & Stacey D.L., 1976. Studies on the dispersal of the whitefly parasite Encarsia formosa. IOBC/WPRS Bull., 4, 115-120.
Ide T., Suzuki N. & Katayama N., 2007. The use of honeydew in foraging for aphids by larvae of the ladybird beetle, Coccinella septempunctata L. (Coleoptera: Coccinellidae). Ecol. Entomol., 32(5), 455-460.
Kennedy B., 1984. Effect of multilure and its components on parasites of Scolytus mutistriatus (Coleoptera: Scolytidae). J. Chem. Ecol., 10, 373-385.
Ledieu M.S., 1976. Dispersal of the parasite Encarsia formosa as influenced by its host, Trialeurodes vaporariorum. Report of the meeting Progress in integrated control in glasshouses, 5-7 May 1976, Station de Zoologie et de Lutte Biologique, INRA, Antibes, France. Bulletin-SROP, 121-124.
Li C., Roitberg B.D. & Mackauer M., 1997. Effects of contact kairomone and experience on initial giving-up time. Entomol. Exp. Appl., 84, 101-104.
Malcolm S.B., 1990. Chemical defence in chewing and sucking insect herbivores: plant-derived cardenolides in the monarch butterfly and oleander aphid. Chemoecology, 1, 12-21.
Mandour N.S., Ren S.X., Qiu B.L. & Olleka A., 2006. Effect of different kairomonal sources on the performance of Eretmocerus sp. near furuhashii. I: In cages. Agric. Res. J., 6, 207-211.
McEwen P.K., Jervis M.A. & Kidd N.A.C., 1993. Influence of artificial honeydew on larval development and survival in Chrysoperla carnea (Neur., Chrysopidae). Entomophaga, 38(2), 241-244.
Nordlund D.A. & Lewis W.J., 1976. Terminology of chemical releasing stimuli in intraspecific and interspecific interactions. J. Chem. Ecol., 2, 211-220.
Nordlund D.A. & Lewis W.J., 1985. Response of females of braconid parasitoids Microplitis demolitor to frass of larvae of noctuids, Heliothis zea and Trichoplusia ni and to 13-methylhentriacontane. Entomol. Exp. Appl., 38, 109-112.
Petersen M.K. & Hunter M.S., 2002. Ovipositional preference and larval - early adult performance of two generalist lacewing predators of aphids in pecans. Biol. Cont., 25, 101-109.
Reynolds D.R., 1976. Observations on growth forms of sooty mold fungi. Nova Hedwigia, 26, 179-193.
Romeis J. & Zebitz C.P.W., 1996. Searching behavior of Encarsia formosa as mediated by colour and honeydew. Entomol. Exp. Appl., 82, 299-309.
Sasaki T., Aoki T., Hayashi H. & Ishikawa H., 1990. Amino acid composition of the honeydew of symbiotic and aposymbiotic pea aphids Acyrthosiphon pisum. J. Insect Physiol., 36, 35-40.
Scholz D. & Poehling H.M., 2000. Oviposition site selection of Episyrphus balteatus. Entomol. Exp. Appl., 94, 149-158.
Schoulties C.L., 1980. Sooty molds. Plant Pathol. Circ., 208.
Shaltiel L. & Ayal Y., 1998. The use of kairomones for foraging decisions by an aphid parasitoid in small host aggregations. Ecol. Entomol., 23, 319-329.
Shonouda M.L., Bombosch S., Shalaby A.M. & Osman S.I., 1998a. Biological and chemical characterization of a kairomone excreted by the bean aphids Aphis fabae Scop., and its effect on the predator Metasyrphus corollae Fabr. I. Isolation, identification and bioassay of aphid-kairomone. J. Appl. Entomol., 122, 15-23.
Shonouda M.L., Bombosch S., Shalaby A.M. & Osman S.I., 1998b. Biological and chemical characterization of a kairomone excreted by the bean aphids Aphis fabae Scop., and its effect on the predator Metasyrphus corollae Fabr. II. Behavioural response of the predator M. corollae to the aphid kairomone. J. Appl. Entomol., 122, 25-28.
Steidle J.L.M. & van Loon J.J.A., 2002. Chemoecology of parasitoid and predator oviposition behaviour. In: Hilker M. & Meiners T., eds. Chemoecology of insect eggs and egg deposition. Berlin: Blackwell, 291-317.
Steidle J.L.M. & van Loon J.J.A., 2003. Dietary specialization and infochemical use in carnivorous arthropods: testing a concept. Entomol. Exp. Appl., 108, 133-148.
Sutherland J.P., Sullivan M.S. & Poppy G.M., 2001. Oviposition behaviour and host colony size discrimination in Episyrphus balteatus (Diptera: Syrphidae). Bull. Entomol. Res., 91, 411-417.
Symondson W.O.C., Sunderland K.D. & Greenstone M.H., 2002. Can generalist predators be effective biocontrol agents? Annu. Rev. Entomol., 47, 561-594.
Tumlinson J.H., Turlings T.C.J. & Lewis J., 1992. The semiochemical complexes that mediate insect parasitoid foraging. Agric. Zool. Reviews, 5, 221-252.
Turlings T.C.J. & Tumlinson J.H., 1992. Systemic release of chemical signals by herbivore-injured corn. Proc. Natl Acad. Sci., 89, 8399-8402.
Turlings T.C.J., Tumlinson J.H. & Lewis J., 1990. Exploitation of herbivore-induced plant odor by host-seeking parasitic wasps. Science, 250, 1251-1253.
Vet L.E.M. & Dicke M., 1992. Ecology of infochemical use by natural enemies in a tritrophic context. Annu. Rev. Entomol., 37, 141-172.
Völkl W. et al., 1999. Ant-aphid mutualisms: the impact of honeydew production and honeydew sugar composition on ant preferences. Oecologia, 118, 483-491.
Wäckers F.L., 2000. Do oligosaccharides reduce the suitability of honeydew for predators and parasitoids? A further facet to the function of insect-synthesized honeydew sugars. Oikos, 90, 197-201.
Way M.J., 1963. Mutualism between ants and honeydew-producing Homoptera. Annu. Rev. Entomol., 8, 307-344.
Wilbert H., 1974. The perception of its prey by newly hatched larvae of Aphidoletes aphidimyza (Cecidomyiidae). Entomophaga, 19, 173-181.
Wilkinson T.L., Ashford D.A., Pritchard J. & Douglas A.E., 1997. Honeydew sugars and osmoregulation in the pea aphid Acyrthosiphon pisum. J. Exp. Biol., 200, 2137-2143.
Woodring J. et al., 2004. Honeydew amino acids in relation to sugars and their role in the establishment of ant-attendance hierarchy in eight species of aphids feeding on tansy (Tanacetum vulgare). Physiol. Entomol., 29, 311-319.
Yao I. & Akimoto S.I., 2001. Ant attendance changes the sugar composition of the honeydew of the drepanosiphid aphid Tuberculatus quercicola. Oecologia, 128, 36-43.
Yao I. & Akimoto S.I., 2002. Flexibility in the composition and concentration of amino acids in honeydew of the drepanosiphid aphid Tuberculatus quercicola. Ecol. Entomol., 27, 745-752.
Zoebelein G.,1955. Der Honigtau als Nahrung der Insekten. Z. Angew. Entomol., 38, 369-416.
Notes
Pour citer cet article
A propos de : Pascal Leroy
Gembloux Agricultural University – FUSAGx. Unité d’Entomologie fonctionnelle et évolutive. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : entomologie@fsagx.ac.be
A propos de : Quentin Capella
Gembloux Agricultural University – FUSAGx. Unité d’Entomologie fonctionnelle et évolutive. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
A propos de : Éric Haubruge
Gembloux Agricultural University – FUSAGx. Unité d’Entomologie fonctionnelle et évolutive. Passage des Déportés, 2. B-5030 Gembloux (Belgique).






