- Accueil
- Volume 11 (2007)
- Numéro 1
- Organisation du pool génique de Vigna unguiculata (L.) Walp. : croisements entre les formes sauvages et cultivées du niébé
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Organisation du pool génique de Vigna unguiculata (L.) Walp. : croisements entre les formes sauvages et cultivées du niébé

Résumé
L’organisation du pool génique du niébé (Vigna unguiculata (L.) Walp.) est étudiée sur base de croisements intraspécifiques entre les formes cultivées (cv-gr. Unguiculata, cv-gr. Biflora) et les formes sauvages de l’espèce (var. spontanea, subsp. alba, subsp stenophylla, subsp. pawekiae, subsp. baoulensis). Le taux de réussite des croisements, le taux de fécondité des gousses obtenues et la fertilité pollinique des hybrides F1 varient suivant les taxons sauvages utilisés. Le taux de réussite le plus élevé est obtenu pour les croisements entre les formes cultivées et la forme autogame annuelle (40-79,3 %). Ce résultat confirme que var. spontanea est génétiquement plus proche des formes cultivées que les autres formes sauvages. Les croisements entre les formes cultivées et les formes sauvages allo-autogames ont donné des taux de réussite intermédiaires (17,8-57,9 %) et une réduction significative de la fertilité pollinique chez certains hybrides F1. Ces observations suggèrent l’existence d’une divergence génétique entre ces deux groupes, tout en partageant le même pool génique. Les formes sauvages allogames ont donné les plus faibles taux de réussite avec les formes cultivées (3,1-40 %) montrant qu’elles sont génétiquement plus distantes de ces dernières par rapport aux autres groupes sauvages. Les taux de réussite sont particulièrement plus faibles lorsque la forme sauvage allogame subsp. baoulensis est croisée avec les formes cultivées.
Abstract
Organization of the genic pool of Vigna unguiculata (L.) Walp. : crosses between the wild and cultivated forms of cowpea. Cowpea (Vigna unguiculata (L.) Walp.) gene pool organization is studied on the basis of intra-specific crossing between cultivated (cv-gr. Unguiculata, cv-gr. Biflora) and wild forms of the species (var. spontanea, subsp. alba, subsp. stenophylla, subsp. pawekiae, subsp. baoulensis). The rate of crosses success, the rate of the obtained pods fruitfulness and the pollinic fertility of the hybrids F1 varied according to the wild taxa used. The highest rate of success was obtained for the crossings between cultivated and annual inbred form (40-79,3%). This result confirms that var. spontanea is genetically closer to the cultivated forms than the other wild forms. Crosses between cultivated and wild allo-autogamous forms gave intermediate rates of success (17,8-57,9%) and a significant reduction of the pollinic fertility of some hybrids F1. These observations suggest the existence of a genetic divergence between these two groups, however they share the same gene pool. The wild allogamous forms gave the weakest rates of success with the cultivated forms (3,1-40%) showing that they are genetically more distant of these last, compared to the other wild groups. The rates of crosses success are particularly weaker when the wild form subsp. baoulensis is crossed with the cultivated forms.
Table des matières
1. Introduction
1Le niébé (V. unguiculata) est une légumineuse alimentaire cultivée sur tout le continent africain, en Amérique latine et dans quelques régions du sud-est asiatique. Avec son taux en protéines de 25 %, le niébé est l’une des sources de protéines les moins chères pour les populations démunies. En Afrique de l’Ouest, où plus de 70 % de la totalité du niébé est produite, il est devenu progressivement une partie intégrante des systèmes de culture (Ogbuinya, 1997). Dans cette région, l’accroissement des rendements est difficile à obtenir en raison des contraintes liées aux attaques d’insectes pendant et après la floraison. Il s’agit notamment de thrips, comme Megalurothrips sjostedti Trybom, qui s’attaquent aux fleurs, des foreuses de gousses, comme Maruca vitrata Fabricius et Clavigralla tomentosicollis Stål., et des bruches qui s’attaquent aux graines stockées (Bottenberg, Tamò, 1998 ; Karungi et al., 2000).
2Ces insectes causent des dégâts considérables et des pertes de production variant de 50 à 95 %. étant donné que la majorité des fermiers africains n’ont pas les moyens financiers pour mener une lutte chimique efficace, la nécessité de mettre en place une stratégie de lutte plus adaptée s’impose (Singh et al., 1990 ; Ogbuinya, 1997 ; Kawukia et al., 2005 ; Sales et al., 2005). La sélection de variétés résistantes s’avère la solution la plus prometteuse pour la survie de la culture du niébé en zone tropicale.
3Dans le cadre des travaux d’amélioration génétique des espèces cultivées, les formes sauvages et les espèces apparentées ont très souvent constitué une source abondante de gènes intéressants et exploitables pour l’amélioration des formes cultivées (Feldman, Sears, 1981). Chez V. unguiculata, étant donné que l’espèce est biologiquement isolée par rapport aux autres espèces du genre Vigna, les formes sauvages apparentées au niébé constituent un réservoir génétique très utile pour l’amélioration variétale de la légumineuse. Elles ont cependant été longtemps négligées dans les travaux de sélection, qui privilégiaient les croisements entre les formes cultivées (Fatokun, 1991 ; Pasquet, Baudoin, 1997).
4Les dernières révisions taxonomiques divisent le niébé en 10 sous-espèces pérennes et une sous-espèce annuelle, subsp. unguiculata. Cette dernière comprend les formes cultivées du niébé (var. unguiculata) et la forme sauvage annuelle, var. spontanea (Schweinf.) Pasquet (Pasquet, 1993a, 1993b, 1997). La sous-espèce cultivée unguiculata a été divisée en cinq cultigroupes (cv-gr.) nommés : Unguiculata, Biflora, Melanophthalmus, Sesquipedalis et Textilis (Pasquet, 1998). Les 10 sous-espèces pérennes sauvages sont constituées de 5 sous-espèces contenant uniquement des accessions allogames (subsp. baoulensis (A. Chev.) Pasquet, subsp. burundiensis Pasquet, subsp. letouzeyi Pasquet, subsp. aduensis Pasquet et subsp. pawekiae Pasquet) et 5 sous-espèces contenant aussi bien des accessions allogames et autogames (subsp. dekindtiana (Harms) Verdc. sensu stricto, subsp. stenophylla (E. Mey.) Verdc., subsp. tenuis (E. Mey.) Maréchal, Mascherpa et Stainier, subsp. alba (G. Don) Pasquet, et subsp. pubescens (R. Wilczeck) Pasquet (Pasquet, 1994 ; 1999).
5Depuis ces dernières classifications, très peu de croisements ont été réalisées entre les formes cultivées et les formes sauvages (Echikh, 2000).
6Actuellement, deux hypothèses sont émises concernant l’organisation du pool génique du niébé. La première hypothèse soutenue par Rawal et al. (1976), Baudoin et Maréchal (1985), Sakupwanya et al. (1990) et Padulosi (1993) suggère l’absence ou la faiblesse de barrières d’incompatibilité entre les formes cultivées et les formes sauvages. Ces conclusions reposent, cependant, sur un nombre limité de génotypes cultivés et sauvages utilisés lors des hybridations.
7La seconde hypothèse, soutenue par Fatokun (1991), Pasquet et Baudoin (1997) et Echikh (2000) suggère, sur la base des résultats d’hybridations et des analyses enzymatiques, la présence de barrières reproductives non négligeables entre les formes cultivées et les formes sauvages, et la possibilité de l’existence d’un pool génique secondaire chez l’espèce V. unguiculata.
8Pasquet et Baudoin (1997) et Echikh (2000) ont ainsi proposé une structuration du pool génique de V. unguiculata en un pool génique primaire comportant les formes cultivées, la forme spontanée autogame et les formes sauvages allo-autogames, et un pool génique secondaire composé uniquement des formes allogames. Notons cependant, que les travaux d’hybridations entre formes cultivées et formes sauvages réalisés par Echikh (2000) ne sont pas représentatifs de la diversité génétique des cultigroupes parentaux et reposent sur un nombre réduit de croisements pour certaines combinaisons.
9Compte tenu des diverses hypothèses contradictoires sur les relations phylétiques au sein du taxon V. unguiculata, nos travaux ont pour objet d’étudier les barrières d’incompatibilité entre les formes cultivées et les formes sauvages sur la base de la plus récente classification taxonomique proposée par Pasquet (1994, 1999). Ce travail est également justifié par les récents résultats des travaux de Kouadio et al. (2006) mettant en évidence l’existence de barrières d’incompatibilité pré et post-zygotiques chez les formes sauvages de V. unguiculata.
10L’objectif à long terme de ce travail est de définir les relations phylétiques entre les formes cultivées du niébé et leurs formes sauvages apparentées et de mieux comprendre l’organisation du pool génique de l’espèce.
2. Matériels et méthodes
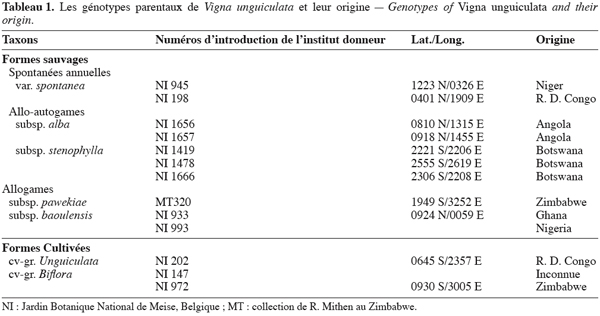
11Le tableau 1 reprend la liste des introductions utilisées pour la réalisation des croisements intraspécifiques entre les formes cultivées et sauvages de V. unguiculata.
12Pour chaque génotype, deux à trois graines sont scarifiées pour faciliter la germination puis placées dans des boîtes de Pétri et mises à l’étuve à 25 °C. Deux à trois jours après la germination, elles sont placées dans des « Jiffy pots » et mises au germoir à 27 °C et 100 % d’humidité relative. Après le développement des feuilles primaires, les plantules sont transplantées dans des serres tropicalisées de la Faculté universitaire des Sciences agronomiques de Gembloux. La température des serres est réglée à 21 °C le jour et 16,5 °C la nuit, avec une humidité relative de 80 %. Les travaux se sont déroulés durant les années 2003 et 2004. Les croisements réciproques entre les accessions sont réalisées les matins entre 7 h et 10 h suivant le même protocole qu’Echikh (2000). Les génotypes parentaux ont été autofécondés et les résultats de ces autofécondations servent de comparaison avec les résultats des croisements entre formes cultivées et sauvages du niébé. Les observations portent sur le nombre de fleurs pollinisées, le nombre de gousses matures et le nombre de graines obtenues par gousse.
13L’analyse des barrières pré-zygotiques entre les accessions croisées est réalisée à partir de 3 fleurs avortées par combinaison et de 3 fleurs autofécondées des parents, toutes collectées 24 heures après pollinisation. La méthode utilisée pour suivre la germination du pollen sur le stigmate et la croissance du tube pollinique dans le style et dans l’ovaire est la méthode de fluorescence du bleu d’aniline (Dumas, Knox, 1983). Pour les différents échantillons à traiter, le gynécée complet est fixé pendant 24 h à 4 °C dans une solution 1:1 glutaraldéhyde et acide formique (v/v). Après la fixation, le matériel est mis à macérer dans de la soude caustique concentrée (8 N) pendant au moins 12 h. Le style est par la suite rincé plusieurs fois à l’eau courante avant l’observation. Cette opération est très importante car elle a pour but de ramener le pH au niveau optimal (pH 9) pour accentuer l’action du bleu d’aniline.
14Les styles et les ovaires sont ensuite séparés et traités différemment à cause de leur différence de structure et de consistance. Les styles sont disséqués longitudinalement et la face sectionnée est disposée vers le haut pour recevoir la lumière incidente. Les ovaires sont ouverts délicatement sur toute la ligne de suture du carpelle, de manière à maintenir les ovules sur les deux demi-carpelles selon l’alternance de leur implantation sur le placenta. Les échantillons sont déposés sur des lames et reçoivent une goutte de fluorochrome de bleu d’aniline qui forme un complexe avec la callose dont l’ensemble émet une fluorescence jaune-vert (Eschrich, Currier, 1964).
15L’ensemble est recouvert d’une lamelle pour observation en lumière réfléchie grâce à un microscope Nikon (Elipse E 800) fluorescent. Les images sont prises à l’aide d’une camera JVC (3-CCD) et gérée par le programme Image Archive Plus de Sony.
16Pour vérifier l’obtention des hybrides, des observations morphologiques et de fertilité pollinique sont réalisées sur chaque parent et les combinaisons supposées hybrides. La fertilité pollinique est estimée sur une moyenne de trois fleurs grâce à un test de coloration des grains de pollen à l’acétocarmin. Les grains de pollen colorés et bien ronds sont considérés comme viables (Alexander, 1980). Les observations morphologiques concernent la taille des fleurs, la forme de la tâche jaune et l’intensité de la tâche violette sur l’étendard, la torsion de la carène, la longueur des pédoncules floraux, la forme de la foliole terminale, la base de la foliole terminale, l’intensité de la tâche foliaire basale, l’intensité de la tâche en « V » renversé à travers la foliole, la pigmentation anthocyanique à l’aisselle de la tige, la taille et la couleur des graines, ainsi que le poids de 100 graines. Le taux de fécondité des gousses (le pourcentage du nombre de graines bien formées sur le nombre d’ovules par gousse) a également été calculé sur un effectif de 15 gousses.
17Lorsque la fertilité du pollen et le taux de fécondité des gousses des individus F1 sont moindres que ceux des parents, le test-t de Student est réalisé pour vérifier si la différence observée est significative.
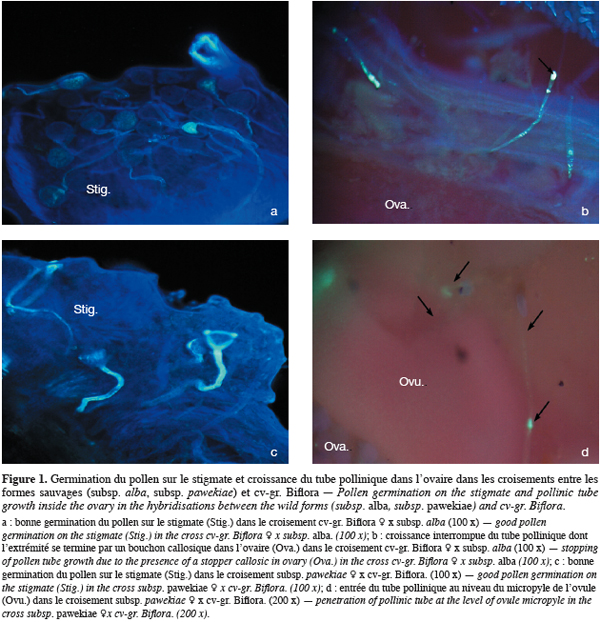
3. Résultats
3.1. Croisements et fertilité des gousses
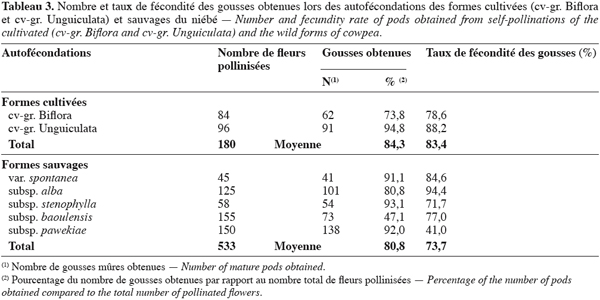
18Les résultats des hybridations et le taux de fécondité des gousses obtenues sont repris dans les
19tableaux 2 et 3.
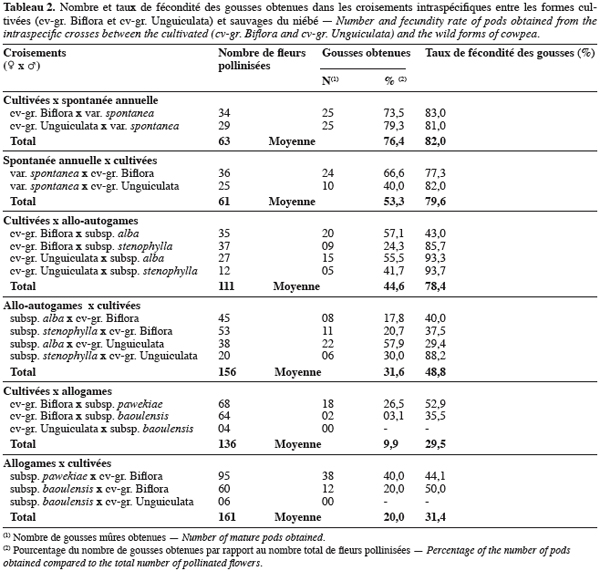
20Croisements entre les formes cultivées et la forme spontanée annuelle. Les hybridations intraspécifiques entre les formes cultivées et la forme spontanée annuelle ont été réalisées avec succès dans les deux sens du croisement. Le taux d’obtention des gousses varie entre 40 % et 79,3 %. Le meilleur taux d’obtention de gousses mûres est observé lorsque les formes cultivées sont utilisées comme parent femelle. Dans les deux sens du croisement, tous les avortements des gousses présumées hybrides sont survenus entre un et trois jours après la pollinisation. Aucune différence significative entre taux d’obtention de gousses par autofécondation et par hybridation n’a été observée (P = 0,272) surtout lorsque les formes cultivées sont utilisées comme parent femelle. Le taux de fécondité des gousses obtenues est élevé dans les deux sens du croisement et varie entre 77,3 et 83 %.
21Croisements entre les formes cultivées et les formes pérennes allo-autogames. Les croisements entre les formes cultivées du niébé et les formes sauvages allo-autogames ont également été réalisés avec succès dans les deux sens du croisement. Le taux d’obtention de gousses varie entre 17,8 et 57,9 %. Aucune influence du sens de croisement n’a été observée chez les différentes combinaisons, à l’exception du croisement entre subsp. alba et cv-gr. Biflora. En effet, pour ce dernier, lorsque la subsp. alba est utilisée comme parent femelle, le taux de réussite est faible, soit 17,8 %, tandis que la combinaison réciproque donne un taux de réussite de 57,1 %. La plupart des avortements de gousses présumées hybrides intervienne entre un et trois jours après la pollinisation ; seules 11 gousses ont avorté au delà de 3 jours. Une différence significative entre les taux d’obtention de gousses par autofécondation des parents et par hybridation dans les deux sens du croisement a été observée (P = 0,009). Le taux de fécondité des gousses hybrides est élevé et proche de ceux des parents, lorsque la forme cultivée est utilisée comme parent femelle. Par contre dans le croisement réciproque, le taux de fécondité des gousses présumées hybrides est significativement faible par rapport à ceux des deux parents (P = 0,023).
22Croisements entre les formes cultivées et les formes pérennes allogames. à cause du faible nombre de fleurs pollinisées entre la subsp. baoulensis et cv-gr. Unguiculata, les résultats des hybridations entre ces deux groupes n’ont pas été pris en compte dans nos analyses. Cependant, chez les autres combinaisons, le pourcentage de gousses obtenues varie entre 3,1 et 40 %. Le taux d’obtention de gousses est meilleur pour les croisements entre cv-gr. Biflora et subsp. pawekiae. Une différence significative du taux d’obtention de gousses est observée selon le sens du croisement dans les croisements entre subsp. baoulensis et cv-gr. Biflora (P < 0,05). En effet, lorsque subsp. baoulensis est utilisée comme parent femelle, le taux de réussite est de 20 %, tandis que le croisement réciproque donne un taux de réussite de 3,1 %. Excepté la combinaison cv-gr. Biflora ♀ x subsp. baoulensis, les autres combinaisons ont donné un taux d’obtention de gousses supérieur ou égal à 20 %. Toutes les combinaisons ont donné un taux de fécondité de gousses supérieur à 30 %.
3.2. Morphologie et fertilité des hybrides
23Les graines potentiellement hybrides semées sont toutes viables et donnent des plantes qui ont une croissance végétative comparable à celle des génotypes parentaux.
24Morphologie et fertilité des hybrides entre les formes cultivées et la forme spontanée annuelle du niébé. Chez les plantes F1 provenant du croisement var. spontanea ♀ x cv-gr. Unguiculata, la forme de la tache jaune sur l’étendard et la longueur des pédoncules floraux des individus F1 sont similaires à celles du parent paternel. La fertilité de leur pollen est élevée soit 90 %. Pour le croisement réciproque, cv-gr. Unguiculata ♀ x var. spontanea, les caractères suivants sont identiques à ceux du parent paternel : la longueur des pédoncules, l’intensité de la tache violette, la forme de la tache jaune sur l’étendard et l’intensité des taches foliaires en « V » renversé. Le taux de fécondité des gousses et la fertilité des grains de pollen sont proches de ceux des deux parents.
25Morphologie et fertilité des hybrides entre les formes cultivées et les formes sauvages allo-autogames du niébé. Les individus F1 obtenus entre cv-gr. Biflora et subsp. alba se sont développés normalement et ont montré une bonne vigueur. Chez la combinaison cv-gr. Biflora ♀ x subsp. alba, les folioles terminales sont lobées comme celles du parent mâle (Tableau 4). Nous avons observé chez ces individus F1 une réduction significative du taux de fécondité des gousses et de la fertilité du pollen par rapport aux deux parents (P < 0,05 et P = 0,012 respectivement).
26Dans le croisement réciproque, subsp. alba ♀ x cv-gr. Biflora, les folioles terminales ne sont pas lobées et ne présentent pas de taches foliaires contrairement au parent femelle. Aucune différence significative n’a été observée entre la moyenne de la fertilité pollinique observée chez l’hybride et celle des deux parents (P = 0,153). Le taux de fécondité des gousses hybrides est significativement réduit par rapport à ceux des parents (P < 0,05).

27Morphologie et fertilité des hybrides entre les formes cultivées et les formes pérennes allogames. Les plantes F1 obtenues pour la combinaison cv-gr. Biflora ♀ x subsp. pawekiae, la forme de la tache jaune chez l’hybride est similaire à celle du parent paternel. Les plantes hybrides ont montré une faible viabilité pollinique (60-70 %) et une réduction significative du taux de fécondité des gousses hybrides par rapport à ceux des parents (P < 0,05). Dans les croisements réciproques, les plantes F1 sont similaires au parent paternel cultivé sur base de la forme lancéolée de la foliole terminale, tandis que celle-ci est cordiforme chez le parent maternel. On observe également chez l’hybride F1 une absence de taches foliaires comme chez le parent mâle cv-gr. Biflora, et une fertilité pollinique élevée soit 98 %.
28Chez la combinaison cv-gr. Biflora ♀ x subsp. baoulensis, les plantes sont identiques au parent mâle par la forme des lobes des folioles, la pigmentation anthocyanique à l’aisselle de la tige et la torsion de la carène. Ces hybrides ont une fertilité pollinique élevée et proche de celle des parents. Cependant, le taux de fécondité des gousses hybrides est significativement réduit par rapport aux deux parents (P = 0,004).
29Les hybrides réciproques F1 sont identiques au parent paternel par la torsion de la carène, la base non lobée des folioles terminales, la coloration des graines F1 (Tableau 5). Ces hybrides se comportent comme des formes autogames sur base de la fréquence élevée des autofécondations sans intervention manuelle (résultats non montrés). La fertilité pollinique de ces hybrides est également élevée et proche de celle des parents. Cependant, la fécondité de leurs gousses est significativement réduite par rapport à celle des parents (P = 0,001).

3.3. Relation de compatibilité pollen-pistil
30La germination du pollen et la fécondation des ovules ont été observées dans les croisements cv-gr. Biflora ♀ x subsp. alba et cv-gr. Biflora ♀ x subsp. pawekiae et leurs combinaisons réciproques. Les résultats sont repris dans le tableau 6. Ces combinaisons ont été sélectionnées car elles se caractérisent par l’avortement massif des fleurs pollinisées 24 heures après pollinisation.
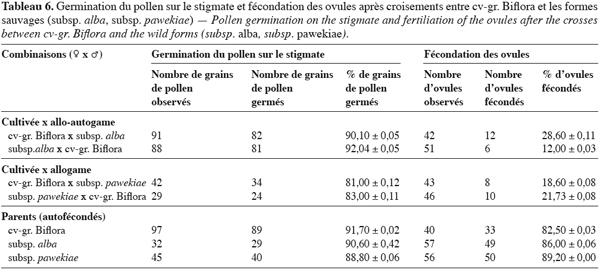
31Chez toutes les combinaisons étudiées, on a observé une germination élevée du pollen sur le stigmate. Ainsi, dans les croisements entre la forme cultivée cv-gr. Biflora et la forme allo-autogame subsp. alba, le taux de germination du pollen sur le stigmate varie entre 90 % lorsque la forme cultivée est utilisée comme parent femelle et 92 % pour le croisement réciproque (Figure 1a). Les tubes polliniques après une croissance régulière parviennent à l’ovaire où la croissance de certains reste bloquée par la présence d’un bouchon callosique très fluorescent (Figure 1b). Cependant, 12 à 28,6 % des ovules ont été pénétrés par un tube pollinique, 24 heures après la pollinisation. Les taux d’ovules fécondés au cours des hybridations sont néanmoins très réduits par rapport à ceux de l’autofécondation des deux parents.
32Au niveau des croisements entre la forme cultivée cv-gr. Biflora et la forme allogame subsp. pawekiae, on observe également une bonne germination du pollen sur le stigmate (Figure 1c).
33Après la germination des grains de pollen, nous observons la pénétration des ovules par des tubes polliniques (Figure 1d). Cependant, 24 heures après la pollinisation, seuls 18,6 à 21,73 % des ovules ont pu être fécondés au cours des hybridations ; ces taux sont faibles par rapport à ceux observés lors des autofécondations des génotypes parentaux (82,5 et 89,20 %).
4. Discussion
34Intensité des barrières d’incompatibilité entre les formes cultivées et la forme spontanée autogame. Les hybridations entre les formes cultivées (cv-gr. Biflora, et cv-gr. Unguiculata) et la forme spontanée autogame (var. spontanea) ont été réalisées avec succès. En effet, au cours de ces croisements, nous avons observé des valeurs élevées pour les taux d’obtention de gousses et de fécondité de gousses, ainsi que pour la fertilité pollinique des hybrides F1. Ces différentes observations suggèrent la présence de faibles barrières d’incompatibilité et une forte affinité génétique entre les deux groupes. Vaillancourt et al. (1993), Panella et Gepts, (1992) ; Pasquet, (1994, 1999, 2000) ; Coulibaly et al. (2002) et Ba et al. (2004) ont aussi observé une grande affinité génétique entre les formes cultivées de V. unguiculata et var. spontanea.
35Intensité des barrières d’incompatibilité entre les formes cultivées et les formes sauvages allo-autogames. Les croisements entre les formes cultivées et les formes sauvages pérennes allo-autogames ont également été réalisés avec succès. Dans les croisements entre subsp. alba et la forme cultivée cv-gr. Biflora, le taux de réussite des croisements et le taux de fécondité des gousses obtenues sont moindres que ceux observés dans les croisements entre var. spontanea et les formes cultivées.
36La réduction significative observée au niveau de la fertilité pollinique et le taux de fécondité des gousses des hybrides F1 suggère l’existence d’une divergence génétique relativement importante entre les taxons. Cette hypothèse est confirmée par la présence de barrières pré-zygotiques mises en évidence par le faible taux d’ovules fécondés (12 à 28 %) des hybrides par rapport à l’autofécondation des parents. En effet, malgré la bonne germination des grains de pollen sur le stigmate très peu de grains arrivent à féconder les ovules. Fatokun et Singh (1987) avaient aussi observé des difficultés au cours de leurs travaux d’hybridations entre les formes cultivées de V. unguiculata et la forme sauvage pérenne V. pubescens (forme allo-autogame connue actuellement sous l’appellation de subsp. pubescens). En effet, les plantes hybrides F1 obtenues en culture in vitro par ces auteurs avaient montré une faible fertilité pollinique. Des analyses cytologiques réalisées par ces mêmes auteurs ont révélé la présence de nombreux quadrivalents, indiquant une différence structurelle entre les deux génomes.
37Dans les croisements entre les formes cultivées (cv-gr. Biflora, cv-gr. Unguiculata) et la forme sauvage subsp. stenophylla, les taux de réussite sont également moindres que ceux observés dans les croisements entre var. spontanea et les formes cultivées. Cependant, les hybrides F1 obtenus entre subsp. stenophylla et les formes cultivées (cv-gr. Biflora et cv-gr. Unguiculata) ont montré une bonne croissance végétative et une bonne fertilité pollinique (résultats non présentés). Aucune anomalie n’a été observée dans ces hybrides. Sakupwanya et al. (1990) avaient aussi obtenu des hybrides normaux ayant une bonne fertilité pollinique entre cv-gr. Unguiculata et var. stenophylla (forme allo-autogame connue actuellement sous le nom de subsp. stenophylla). Ces différentes observations suggèrent que la divergence génétique entre les formes cultivées et les formes allo-autogames n’est pas très grande. Ceci pourrait expliquer pourquoi ces formes pérennes allo-autogames ont été maintenues au rang de sous-espèce par Pasquet (1993a, 1994).
38Au regard de toutes ces observations et selon la théorie définie par Harlan et DeWet (1971) sur l’organisation du pool génique d’une espèce, nos résultats permettent de confirmer que les formes pérennes allo-autogames partagent le même pool génique que les formes cultivées (Ng, Apeji, 1986 ; Sakupwanya et al. 1990 ; Pasquet, Baudoin, 1997 ; Echikh, 2000).
39Intensité des barrières d’incompatibilité entre les formes cultivées et les formes sauvages allogames. Les hybridations entre les formes cultivées et les formes pérennes allogames ont donné des taux de réussite satisfaisants, en dehors de la combinaison cv-gr. Biflora ♀ x subsp. baoulensis. En effet, cette combinaison a donné les plus faibles taux d’obtention et de fécondité de gousses hybrides. Chez les combinaisons cv-gr. Biflora ♀ x subsp. pawekiae, les hybrides F1 ont également montré une réduction de la fertilité pollinique et du taux de fécondité des gousses par rapport aux parents. Ces différentes observations montrent l’existence d’une grande divergence génétique entre les deux taxons. Ce constat est renforcé par l’observation d’un faible nombre d’ovules fécondés (18 à 21 %) chez les gousses hybrides avortés 24 heures après pollinisation. Kouadio et al. (2006) ont également observé un faible pourcentage d’ovules fécondés lors des hybridations entre les formes allogames de V. unguiculata et la forme spontanée autogame var. spontanea (proches des formes cultivées) montrant ainsi la présence de barrières d’incompatibilité pré-zygotiques entre les deux groupes.
40Ces résultats sont conformes aux données obtenues à partir d’analyses morphologiques et enzymatiques par Pasquet (1999). Cependant, le taux de réussite des croisements entre subsp. pawekiae ♀ x cv-gr. Biflora (40 %) est aussi élevé que celui obtenu par Evans (1976) en croisant différentes variétés cultivées du niébé. Ces observations montrent que les barrières génétiques entre les formes cultivées et les formes allogames peuvent être surmontées.
5. Conclusions et perspectives
41Cette étude nous a permis de montrer que les croisements entre les formes cultivées (cv-gr. Biflora, cv-gr. Unguiculata) et les formes sauvages de V. unguiculata sont possibles. Cependant, les différences constatées dans le taux de réussite, le taux de fécondité des gousses et la fertilité pollinique confirment la classification des groupes sauvages en trois grands ensembles. Les formes spontanées autogames ont montré une plus grande proximité génétique avec les formes cultivées, ensuite viennent les formes allo-autogames et enfin les formes allogames. Nos résultats sur la structuration du pool génique de V. unguiculata confirment les résultats des analyses morphologiques et enzymatiques émises par Pasquet (1994, 1998 et 2000).
42Nos travaux montrent également que malgré la présence de barrières pré- ou postzygotiques, celles-ci ne devraient pas empêcher l’exploitation des formes sauvages de V. unguiculata pour l’amélioration des formes cultivées. Cependant, l’utilisation des formes allogames nécessitera, chez certains taxons tels que subsp. baoulensis, un plus grand nombre d’hybridations pour obtenir des hybrides intraspécifiques. Dans l’optique d’une exploitation efficiente des formes sauvages, les futurs travaux devraient mettre l’accent sur l’évaluation des potentialités de ces dernières pour l’amélioration des formes cultivées. D’autres travaux pourraient également s’intéresser à l’analyse des barrières d’incompatibilité entre les formes sauvages africaines et les formes cultivées du niébé sélectionnées sur d’autres continents notamment les continents asiatique, australien et américain. Il serait en effet intéressant de vérifier l’existence éventuelle de barrières d’incompatibilité qui pourraient naître de l’isolement géographique qui sépare ces différents groupes.
Bibliographie
Alexander MP. (1980). A versatile stain for pollen, fungi yeast and bacteria. Stain techn. 55, p. 13–18.
Ba SF., Remy S. Pasquet, Paul G. (2004). Genetic diversity in cowpea (V. unguiculata (L.) Walp.) as revealed by RAPD markers. Gen. Ressour. Crop Evol. 51, p. 539–550.
Baudoin JP., Maréchal R. (1985). Cowpea taxonomy, origin and germplasm. In Singh SR., Rachie KO. (eds). Cowpea research, production and utilization. Chichester, UK: John Wiley Sons, p. 3–9.
Bottenberg H., Tamò M. (1998). Occurrence of phytophagous insects on wild Vigna sp. and cultivated cowpea: comparing the relative importance of host-plant resistance and millet intercropping. Agric. Ecosyst. Environ. 70, p. 217–229.
Coulibaly S., Pasquet RS., Papa R., Gepts P. (2002). AFLP analysis of the phonetic organization and genetic diversity of Vigna unguiculata (L.) Walp. reveals extensive gene flow between wild and domesticated types. Theor. Appl. Genet. 104, p. 358–366.
Dumas C., Knox RB. (1983). Callose and determination of pistil viability and incompatibility. Theor. Appl. Genet. 67, p. 1–10.
Echikh N. (2000). Organisation du pool génique de formes sauvages et cultivées d’une légumineuse alimentaire, Vigna unguiculata (L.) Walp. Thèse de doctorat. Gembloux, Belgique : Faculté universitaire des Sciences agronomiques, 307 p.
Eschrich W., Currier HB. (1964). Identification of callose by its diachrome and fluorochrome reaction. Stain Techn. 39 (5), p. 303–308.
Evans A. (1976). Species hybridization in the genus Vigna. In Luse RA., Rachie KO. (eds). Proceeding of IITA collaborators meeting on grain Legume Improvement, 11-13 June 1975. Ibadan, Nigeria: International Institute of Tropical Agriculture, p. 31–34.
Fatokun CA. (1991). Wide hybridization in cowpea: problems and prospects. Euphytica 54, p. 137–140.
Fatokun CA., Singh BB. (1987). Interspecific hybridization between Vigna pubescens and V. unguiculata (L.) Walp. Through embryo rescue. Plant Cell Tissue Organ Cult. 9 (3), p. 229–233.
Feldman M., Sears ER. (1981). The wild gene resources of wheat. Sci. Am. 244, p. 98–109.
Harlan JR., DeWet JMJ. (1971). Toward a rational classification of cultivated plants. Taxon 20, p. 509–517.
Karungi J., Adipala E., Nampala P., Ogenga-Latigo M., Kyamanywa S. (2000). Pest management in cowpea. Part 3. Quantifying the effect of cowpea field pests on grain yields in eastern Uganda. Crop Prot. 19, p. 343–347.
Kawukia RS., Agonab A., Nampala P., Adipala E. (2005). A comparison of effectiveness of plant-based and synthetic insecticides in the field management of pod and storage pests of cowpea. Crop Prot. 24, p. 473–478.
Kouadio D., Toussaint A., Pasquet RS., Baudoin JP. (2006). Barrières d’incompatibilité pré-zygotiques chez les hybrides entre formes sauvages du niébé, Vigna unguiculata (L.) Walp. Biotechnol. Agron. Soc. Environ. 10 (1), p. 1–9.
Ng QN., Apeji J. (1986). Interspecific crosses cowpea and wild Vigna. Genetic Resources Annual report. International Institute of Tropical Agriculture.
Ogbuinya PO. (1997). Advances in Cowpea Research. Biotech. Develop. Monitor. 33, p. 1012.
Padulosi S. (1993). Genetic diversity, taxonomy and ecogeographic survey of the wild relatives of cowpea (Vigna unguiculata (L.) Walp.). Thèse de doctorat. Louvain-La-Neuve, Belgique : Université Catholique de Louvain, 228 p.
Panella L., Gepts P. (1992). Genetic relationship within Vigna unguiculata (L.) Walp. based on isozyme analyses. Genet. Resour. Crop Evol. 39, p. 71–88.
Pasquet RS. (1993a). Classification infraspécifique des formes spontanées de V. unguiculata (L.) Walp. à partir de données morphologiques. Bull. Jard. Bot. Natl. Belg. 62, p. 127–173.
Pasquet RS. (1993b). Two new subspecies of V. unguiculata (L.) Walp. (Leguminosae : Papilionoideae). Kew Bull. 48, p. 805–806.
Pasquet RS. (1994). Organisation génétique et évolutive des formes spontanées et cultivées du niébé, Vigna unguiculata (L.) Walp. Biosystématique et processus de domestication. Thèse de doctorat. Paris Grignon, Institut National Agronomique Paris-Grignon-ORSTOM, 284 p.
Pasquet RS. (1997). A new subspecies of Vigna unguiculata (Leguminosae: Papillionoideae). Kew Bull. 52, p. 840.
Pasquet RS. (1998). Morphological study of cultivated cowpea Vigna unguiculata (L.) Walp.: importance of ovule number and definition of cv. gr Melanophthalmus. Agronomie 18, p. 61–70.
Pasquet RS. (1999). Genetic relationships among subspecies of Vigna unguiculata (L.) Walp. Based on allozyme variation. Theor. Appl. Genet. 101, p. 211–219.
Pasquet RS. (2000). Allozyme diversity of cultivated cowpea Vigna unguiculata (L.) Walp. Theor. Appl. Genet. 101, p. 211–219.
Pasquet RS., Baudoin JP. (1997). Le niébé, Vigna unguiculata. In Charrier A., Jacquot M., Hammon S., Nicolas D. (eds). L’amélioration des plantes tropicales. Montpellier, France : CIRAD-ORSTOM, p. 483–505.
Rawal KM., Rachie KO., Franckowiak JD. (1976). Reduction in seed size in crosses between wild and cultivated cowpeas. J. Hered. 67, p. 253–254.
Sakupwanya S., Mithen R., Mutangaundura-Mhlanga (1990). Studies on the African Vigna genepool II. Hybridization studies with Vigna unguiculata var tenuis and var. stenophylla. IBPGR Plant Genet. Res. Newsl. 78/79, p. 5–10.
Sales MP., Andrade LBS., Ary MB., Miranda MRA., Teixeira FM., Oliveira AS., Fernandes KVS., Xavier-Filho J. (2005). Performance of bean bruchids Callosobruchus maculatus and Zabrotes subfasciatus (Coleoptera: Bruchidae) reared on resistant (IT81D-1045) and susceptible (Epace 10) Vigna unguiculata seeds: Relationship with trypsin inhibitor and vicilin excretion. Comp. Biochem. Physiol., Part A 142, p. 422–426.
Singh SR., Jackai LEN., Dos Santos JHR., Adalla CB. (1990). Insect pests of cowpea. In Singh SR. (ed.). Insect Pests of Tropical Food Legumes. Chichester, UK : John Wiley Sons, Ltd. p. 43–89.
Vaillancourt RE., Weeden NF., Barnard J. (1993). Isozyme diversity in the cowpea species complex. Crop Sci. 33, p. 606–613.
Pour citer cet article
A propos de : Daouda Kouadio
Unité de Phytotechnie tropicale et Horticulture. Faculté universitaire des Sciences agronomiques de Gembloux. Passage des Déportés, 2. B-5030 Gembloux (Belgique). daoudak70@hotmail.com
A propos de : Nadejda Echikh
Société botanique de Liège, c/o Maison de l’Environnement, 3 rue Fusch, 4000 Liège, Belgium.
A propos de : André Toussaint
Unité de Phytotechnie tropicale et Horticulture. Faculté Universitaire des Sciences Agronomiques de Gembloux. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
A propos de : Rémy S. Pasquet
International Center of Insect Physiology and Ecology, P.O. Box 30772, Nairobi Kenya.
A propos de : Jean-Pierre Baudoin
Unité de Phytotechnie tropicale et Horticulture. Faculté Universitaire des Sciences Agronomiques de Gembloux. Passage des Déportés, 2. B-5030 Gembloux (Belgique).






