- Startpagina tijdschrift
- Volume 14 (2010)
- numéro 1
- Étude comparative des composés phénoliques, du pouvoir antioxydant de différentes variétés de sorgho sénégalais et des enzymes amylolytiques de leur malt
Weergave(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Étude comparative des composés phénoliques, du pouvoir antioxydant de différentes variétés de sorgho sénégalais et des enzymes amylolytiques de leur malt

Nota's van de redactie
Reçu le 26 novembre 2008, accepté le 10 juillet 2009
Résumé
L'étude a concerné sept variétés de sorgho blanc sélectionnées à l'ISRA de Bambey et consommées dans de nombreuses régions du Sénégal. Certains caractères et composés biochimiques des grains (présence de testa pigmenté, phénols totaux, tanins condensés et activité antioxydante) ont été déterminés dans toutes les variétés. Un maltage de trois jours a été effectué. Les enzymes amylolytiques, les α-amylases, les β-amylases et les dextrinases limites essentielles, pour un malt de bonne qualité, ont été dosées. Ces enzymes ont été mesurées spécifiquement avec des kits Megazyme : Amylazyme (α-amylases), Betamyl (β-amylases) et Limit-Dextrizyme (dextrinases limites). Deux variétés, CE 180-33 et CE 145-66, se sont révélées être des sorghos à tanins. Elles ont les teneurs les plus élevées en phénols totaux et les activités antioxydantes les plus importantes (ABTS et DPPH). Les résultats des analyses enzymatiques et l'indice de Kolbach montrent que la variété F-2-20 présente les meilleures potentialités de maltage.
Abstract
Comparative study of phenolic compounds, antioxidant power of various Senegalese sorghum cultivars and amylolytic enzymes of their malt. The study involved seven cultivars of white sorghum selected to ISRA Bambey and consumed in many regions of Senegal. Several characters and biochemical compounds of the grains (presence of pigmented testa, total phenols, condensed tannins and antioxidant activity) were determined in all cultivars. A three days malting was also carried out and amylolytic enzymes such as α-amylase, β-amylase and limit-dextrinase which are essential for a malt of good quality were proportioned. These enzymes are measured specifically with kits of Megazyme: Amylazyme (α-amylase), Betamyl (β-amylase) and Limit-Dextrizyme (limit-dextrinase). Two cultivars, CE 180-33 and CE 145-66 proved to be tannin sorghums, have the highest levels in total phenols and the most important antioxidant activities (ABTS and DPPH). The results of enzymatic analysis and the index of Kolbach indicated the F-2-20 like cultivar presenting the best potentialities for malt production.
Inhoudstafel
1. Introduction
1Le sorgho (Sorghum bicolor (L.) Moench), connu aussi sous le nom de grand mil, herbe de Guinée, est une poacée dont la culture est une des plus anciennes dans le monde. Il pousse dans des terrains secs, des sols détrempés ou à forte salinité et tolère bien la chaleur ; ces qualités lui confèrent un avantage considérable par rapport à d'autres cultures céréalières dans les régions de la zone tropicale et semi-aride (Asiedu, 1991). Il est cultivé sur 42 millions d'hectares dans le monde. En 2005, la production mondiale totale de sorgho était estimée à près de 57 millions de tonnes, le plaçant ainsi au 5e rang des productions céréalières après le riz, le maïs, le blé et l'orge (FAOSTAT, 2006). C'est une culture africaine par excellence, car on y consacre la plus grande part de la superficie cultivée. Mais les plus gros producteurs sont les États-Unis d'Amérique (près de 17 % de la production mondiale), grâce à des rendements évidemment bien plus élevés, suivis par l'Inde, le Nigeria, la Chine, le Mexique, le Soudan et l'Argentine (ICRISAT, 2006). Les grains de sorgho jouent un rôle important, voire primordial, dans l'alimentation des habitants des régions semi-arides d'Afrique et d'Asie car ils constituent leur principale source d'énergie, de protéines, de vitamines et de minéraux, surtout pour les plus pauvres. Par contre dans les pays industrialisés, il est utilisé sous forme de grains ou de fourrage dans l'alimentation des animaux et pour la production de bioéthanol. La demande en sorgho augmente de plus en plus dans de nombreux pays en développement et particulièrement en Afrique de l'Ouest (surtout au Nigeria, Ghana et Burkina Faso). Cela est lié d'une part à la croissance démographique et d'autre part, à la politique de ces pays qui visent à développer l'exploitation industrielle du sorgho (brasserie) en remplacement au malt d'orge. Dufour et al. (1992) ont démontré la possibilité de produire du malt de sorgho d'une qualité similaire au malt d'orge si les variétés sont sélectionnées. D'ailleurs, ils furent les premiers chercheurs à tenter et à réussir la production de bière 100 % sorgho.
2L'Afrique détient plus de la moitié (55 %) de la production mondiale de sorgho (Taylor et al., 2002 ; Taylor, 2003). Actuellement avec l'amélioration en sélection, le nombre de variétés de sorgho identifiées se chiffre à plus de 7 000 (Dicko et al., 2006). Ces variétés diffèrent par les caractéristiques des grains comme le poids, la présence ou l'absence de testa, la couleur de l'endosperme, la teneur en composés phénoliques. La présence d'un testa, enveloppe de la graine, de couleur brune, est un indice de dépréciation. Dans certains génotypes de sorgho, le testa est parfois partiel, pas bien visible ou même absent tandis que dans d'autres, il est fortement pigmenté (Evers et al., 2002). Les composés phénoliques (acides phénoliques, flavonoïdes et tanins) sont les métabolites secondaires les plus largement représentés et omniprésents dans le règne végétal mais parmi les céréales, le sorgho en est le plus riche et peut en contenir jusqu'à 6 % (Beta et al., 2000 ; Awika et al., 2004 ; Dicko et al., 2005), quoiqu'il ait été démontré que seules les variétés présentant un testa pigmenté contenaient des tanins (Rooney, 2003 ; Dykes et al., 2006).
3Ces derniers, présents sous la forme de tanins hydrolysables et de tanins condensés (parmi lesquels des proanthocyanidines), présentent des intérêts considérables en agronomie. Ils jouent un rôle important dans les mécanismes de défense de la plante vis-à-vis des champignons et des prédateurs, comme les insectes et les oiseaux. Il est maintenant reconnu que les composés phénoliques interviennent aussi dans la santé humaine : lutte contre l'athérosclérose, action anticancérigène, source majeure d'antioxydants naturels permettant de lutter contre le vieillissement cellulaire (Hagerman et al., 1998 ; Kumar et al., 2006). Les tanins condensés du sorgho peuvent être utilisés comme additifs antioxydants dans les aliments gras (Sikwese et al., 2007). Cependant, les tanins présentent l'inconvénient de se lier aux protéines, aux hydrates de carbone et aux éléments minéraux du grain, réduisant ainsi leur valeur nutritionnelle (Nguz, 1997). Ils peuvent également inhiber les enzymes digestives comme l'α-amylase ou la trypsine. Selon Uvere et al. (2000) et Taylor (2003), ils sont également inhibiteurs des amylases du malt. Beta et al. (2000) ont constaté une réduction des tanins dans les grains par un trempage dans une solution alcaline avant leur maltage.
4La crise mondiale actuelle des denrées alimentaires oblige certains pays en développement à valoriser leurs produits agricoles. Dans ce cadre, le sorgho présente différentes potentialités :
5– une substitution au blé pour les personnes allergiques au gluten,
6– sa transformation en malt peut également trouver application dans les industries de la bière en remplacement du malt d'orge si les activités amylasiques (en particulier α-amylases, β-amylases et dextrinases limites) sont suffisantes et dans la préparation des aliments de sevrage (bouillies) à faible viscosité (Dillon, 1989 ; Larreta-Garde, 1997 ; Traoré et al., 2004).
2. Matériel et méthodes
2.1. Variétés de sorgho
7Les sept variétés de sorgho blanc : F-2-20, CE 180-33, CE 145-66, CE 151-262, CE 196-7-2-1, 93B1057 et 93B1062 (dont les principales caractéristiques botaniques sont présentées dans le tableau 1), sont issues de la récolte 2007 à l'Institut Sénégalais de Recherches Agricoles (ISRA) du Centre National de Recherches Agricoles de Bambey.

2.2. Test de blanchiment (Chlorox)
8La présence ou l'absence de testa pigmenté dans les variétés de sorgho est déterminée par le Bleach test de Waniska et al. (1992). Il est effectué de la manière suivante : 15 g de grains sont versés dans une solution d'hypochlorite de sodium NaOCl (70 ml) contenant 7,5 g de KOH. Le tout est mis dans un bain à 60 °C, sous agitation pendant 7 min et ensuite rincé à l'eau. Les grains de couleur jaune clair ou blanche ne présentent pas de testa pigmenté par opposition à ceux de couleur noire.
2.3. Détermination des phénols totaux
9La méthode de Folin-Ciocalteu (Singleton et al., 1999), simple et sensible, est utilisée pour doser les phénols totaux. L'extraction est faite avec du méthanol acidifié (1 % v/v) d'HCl à 37 % dans du méthanol. Les graines sont moulues et tamisées avec un tamis de 0,5 mm de diamètre. La farine obtenue (0,5 g) est traitée avec 7,5 ml de méthanol acide à 25 °C pendant 20 min (Dicko et al., 2002) dans des tubes de centrifugation, homogénéisés toutes les 5 min. Le mélange est ensuite centrifugé à 1 700 g durant 10 min à 25 °C pour recueillir le surnageant. L'opération est répétée une deuxième fois et les deux surnageants sont additionnés pour le dosage. Dans 100 µl d'extrait, on ajoute 250 µl de réactif de Folin (Sigma-Aldrich, Germany) dilué (50 % v/v). Après 5 min d'incubation à 25 °C, 250 µl de carbonate de sodium à 20 % (p/v) sont ajoutés dans les tubes et le tout est porté à 2 000 µl avec de l'eau distillée. L'absorbance est lue à 760 nm après 60 min. Les blancos sont préparés pour chaque variété en remplaçant le réactif de Folin par de l'eau distillée. L'acide gallique (Sigma-Aldrich, Germany) est utilisé comme standard et les résultats sont exprimés en mg d'équivalent acide gallique par 100 mg de matière sèche. Malgré la sensibilité et la simplicité de la méthode Folin, elle n'est cependant pas spécifique des polyphénols. En effet, le réactif peut réagir avec des protéines, des sucres réducteurs, l'acide ascorbique et des composés soufrés (Singleton et al., 1999).
2.4. Détermination des tanins condensés
10Les tanins condensés sont déterminés par la méthode à la vanilline en milieu acide (Price et al., 1978). Cette méthode est basée sur la capacité de la vanilline à réagir avec les unités des tanins condensés en présence d'acide pour produire un complexe coloré mesuré à 500 nm. La réactivité de la vanilline avec les tanins n'implique que la première unité du polymère. L'extraction est faite de la manière suivante : 5 ml de méthanol (Price et al., 1978) sont ajoutés dans chaque tube contenant 0,5 g de farine de sorgho, le mélange est homogénéisé toutes les 5 min pendant 20 min, puis centrifugé (1 700 g, 10 min à 25 °C) pour recueillir le surnageant. L'opération est effectuée deux fois et les deux surnageants sont additionnés pour le dosage. Les extraits et les réactifs de vanilline [mélange à volume égal de 8 % d'HCl à 37 % dans du méthanol et 4 % de vanilline (Sigma-Aldrich, Germany) dans du méthanol] sont maintenus à 30 °C avant le dosage. Deux cents µl d'extrait sont ajoutés à 1 000 µl de réactif de vanilline pour le dosage des tanins condensés. Les blancos sont préparés en remplaçant le réactif par le mélange méthanol-acide, les tubes sont maintenus à 30 °C pendant 20 min, l'absorbance est lue à 500 nm. La catéchine est utilisée comme standard et les résultats sont exprimés en mg d'équivalent catéchine par 100 mg de matière sèche de farine.
2.5. Détermination de l'activité antioxydante
11L'activité antioxydante est mesurée par deux méthodes : DPPH = 1,1-diphényle-2-picrylhydrazyle (Sigma-Aldrich, Germany) et ABTS = acide 2,2'-azino-bis 3-éthylbenzothiazoline-6-sulfonique (Sigma-Aldrich, Germany). Pour ce faire, 10 ml d'une solution hydroacétonique (80 % : 80 ml d'acétone et 20 ml d'eau) sont versés dans des tubes contenant 0,5 g de farine de chaque variété. Le mélange est homogénéisé au vortex toutes les 10 min pendant 2 h et centrifugé à 1 700 g durant 10 min. Le surnageant est récupéré pour les dosages. Le Trolox ou acide 6-hydroxy-2,5,7,8-tétramethylchromane-2-carboxylique (Sigma-Aldrich, Germany) est utilisé comme standard.
12Activité antioxydante mesurée par le radical DPPH. Cette activité est déterminée selon la méthode d'Awika et al. (2003). Le radical DPPH est dissous dans du méthanol à une concentration de 6.10-5 mol.l-1 et gardé à -20 °C à l'abri de la lumière avant utilisation. À chaque extrait (0,1 ml) sont ajoutés 2,9 ml de solution de DPPH et l'absorbance est mesurée après 8 h à 517 nm. Le résultat est exprimé en micromoles d'équivalent Trolox par gramme de matière sèche.
13Activité antioxydante mesurée par le radical cation ABTS. Le radical cation ABTS est généré en mélangeant à volume égal une solution de 3 mM de persulfate de potassium K2S2O8 et une solution stock d'ABTS à 8 mM, le tout est conservé à l'abri de la lumière et à la température ambiante durant 16 h avant utilisation (Awika et al., 2003). La solution obtenue est diluée avec du tampon phosphate (0,2 M, pH 7,4) contenant 150 mM de NaCl pour obtenir une absorbance de 1,5 à 734 nm. 2,9 ml de cette solution fraichement préparée sont ajoutés à 0,1 ml d'extrait et la lecture est faite à 734 nm après 30 min pour chaque série d'analyses. Le Trolox est utilisé comme standard et le résultat final est exprimé en micromoles d'équivalent Trolox par gramme de matière sèche.
2.6. Maltage des différentes variétés
14Les grains de sorgho sont désinfectés d'abord avec une solution d'hypochlorite de sodium (eau de Javel) à 2 % (v/v) pendant 10 min avant et après trempage pour éviter le développement de moisissures au cours de la germination. Ils sont ensuite trempés dans de l'eau distillée (200 ml d'eau pour 100 g de grains). Le trempage dure 16 h et s'effectue en milieu alcalin Ca(OH)2 à 0,1 % (p/v). La germination se déroule dans une chambre à 30 °C ± 2 °C pendant 72 h et est suivie d'un sèchage de 48 h à 40 °C. Le malt ainsi obtenu est dégermé, transformé en farine pour analyse. Les activités amylasiques sont mesurées à l'aide de kits spécifiques : AMYLAZYME (Azurine-crosslinked amylose = AZCL-Amylose, Megazyme International Ireland Ltd, Irlande) pour les α-amylases, BETAMYL (Megazyme International Ireland Ltd, Irlande) pour les ß- amylases et LIMIT-DEXTRIZYME (Megazyme International Ireland Ltd, Irlande) pour les dextrinases limites. Les résultats sont exprimés en Unité Ceralpha correspondant à la quantité d'enzymes nécessaire pour libérer une micromole de p-nitrophénol par minute et par gramme de matière sèche à 40 °C pour les α- et β-amylases. Pour les dextrinases limites, une unité d'activité est définie comme la quantité d'enzymes nécessaire pour libérer une micromole de glucose à partir de pullulane par minute et par kilogramme de matière sèche à 40 °C.
2.7. Analyses statistiques
15Chaque expérience a été répétée trois fois. Les données obtenues ont été traitées par analyse de la variance et les moyennes significativement différentes ont été séparées en utilisant le système SAS (version 9.1.3. pour Windows) au seuil de probabilité de 5 %.
3. Résultats et discussion
3.1. Caractéristiques des variétés de sorgho étudiées
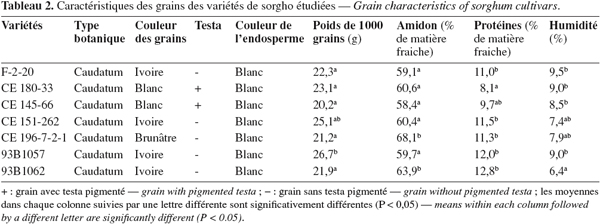
16Les caractéristiques botaniques des différentes variétés étudiées sont présentées dans le tableau 1. La teneur en protéines (N x 6,25), en amidon et le poids de 1 000 grains (Tableau 2) se situent dans des valeurs normales par rapport à celles publiées par la FAO en 1995 (protéines : 7 à 15 % ; amidon : 60 à 75 % ; poids de 1 000 grains : 25 à 30 g).
3.2. Test de blanchiment
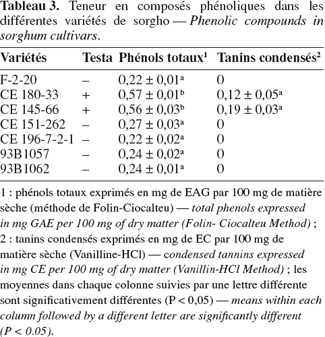
17Le test de blanchiment, permettant de visualiser le testa des grains après dissolution du péricarpe, montre que seuls les grains des variétés CE 180-33 et CE 145-66 (Tableau 3) contiennent un testa pigmenté. Rappelons que selon Rooney (2003) et Dykes et al. (2006), un testa pigmenté indique la présence de tanins condensés.
3.3. Phénols totaux
18Les composés phénoliques sont constitués de trois grandes catégories : les acides phénoliques, les flavonoïdes et les tanins (Beta, 2003 ; Dicko et al., 2006 ; Dykes et al., 2006). Les teneurs en phénols totaux mesurés à l'aide du réactif de Folin-Ciocalteu varient de 0,22 à 0,57 mg EAG par 100 mg (Tableau 3), les variétés CE 180-33 et CE 145-66 étant les plus riches. Une différence significative (P < 0,05) est notée entre les moyennes des sept variétés et la comparaison multiple des moyennes montre que ces deux variétés sont les mêmes et diffèrent des cinq autres variétés. Certaines variétés de sorgho blanc parmi les 50 étudiées par Dicko et al. (2002) ont des teneurs en polyphénols semblables à celles obtenues dans notre étude. Nos résultats sont aussi comparables à ceux de Zhao et al. (2008) avec 14 variétés d'orge.
3.4. Tanins condensés
19Le dosage par la vanilline HCl n'a révélé la présence de tanins condensés que dans les deux variétés présentant un testa pigmenté (Tableau 3). Ces résultats confirment bien les hypothèses d'Earp et al. (2004) et Dykes et al. (2006). Les valeurs obtenues sont respectivement 0,12 % et 0,19 % pour CE 180-33 et CE 145-66. Ces deux variétés peuvent être classées dans la catégorie des sorghos de type II (Dykes et al., 2006). Trois types de sorgho existent : les sorghos de type I dont la teneur en tanins est inférieure à 0,02 %, le type II compris entre 0,02-0,19 % et le type III situé entre 0,4-3,5 %. Les sorghos riches en tanins sont une source d'antioxydants, substances intéressantes pour la santé humaine. Leur désavantage se situe au niveau des interactions tanins-protéines, particulièrement pour les sorghos des groupes II et III. Ces interactions affectent la digestibilité des protéines et des hydrates de carbone, mais inhibent aussi les enzymes comme les amylases du malt. Il faut reconnaitre qu'actuellement beaucoup d'aliments traditionnels comme les porridges et les boissons alcoolisées sont faits à partir de sorgho à tanins (Awika et al., 2004).
3.5. Activité antioxydante
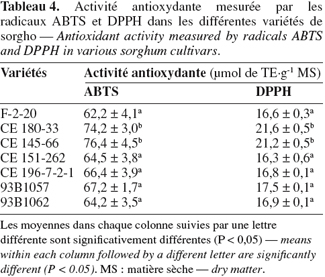
20L'activité antioxydante est mesurée par deux méthodes, la première utilisant le radical DPPH généralement utilisé pour déterminer l'activité antioxydante dans les céréales, la seconde utilisant le radical ABTS souvent utilisé pour les composés simples et d'autres mélanges complexes (Yu et al., 2004 ; Zhou et al., 2004). L'activité varie entre 16,3 et 21,7 µmol ET.g-1 pour la méthode DPPH et 62,2 et 76,4 µmol ET.g-1 pour la méthode ABTS (Tableau 4). Les variétés CE 180-33 et CE 145-66 ont l'activité antioxydante la plus élevée par les deux méthodes de dosage (seules variétés à posséder des tanins condensés et présentant les valeurs les plus élevées en phénols totaux). Les valeurs trouvées par le radical ABTS sont plus importantes que celles trouvées par le radical DPPH. Zhao et al. (2008) ont obtenu des résultats similaires en mesurant l'activité antioxydante des extraits de malt de 14 variétés d'orge par ces deux radicaux, de même que Dlamini et al. (2007) avec cinq variétés de sorgho étudiées. Cette différence de valeurs s'explique partiellement par l'interférence probable exercée par les anthocyanes des pellicules du sorgho qui présentent un pic d'absorption dans le visible au niveau de 475-485 nm, alors que l'absorbance pour la méthode au DPPH se mesure à 515 nm, ce qui justifierait la faible activité mise en évidence par cette méthode. Notons enfin que le radical ABTS est également moins sensible aux pH acides que le radical DPPH.
3.6. Analyse des malts de sorgho
21Les malts résultent d'une étape de germination de 96 h suivie d'un sèchage de 48 h à 40 °C pour abaisser l'humidité de manière suffisante afin d'assurer une bonne conservation. Les activités des amylases, α-amylase, β-amylase et dextrinase limite, ainsi que les pertes de matières ou freintes et l'indice de Kolbach ont été déterminés pour chaque variété de sorgho maltée (Tableau 5).
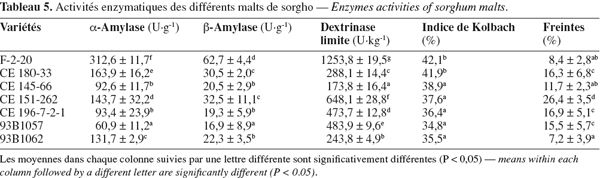
22Les pertes de matières observées pendant la germination varient selon les variétés, elles se situent entre 7,2 et 26,4 %. Ces pertes (freintes) sont élevées par rapport au malt d'orge (12 % en 8 jours). Cependant, il faut noter que les conditions du maltage sont différentes chez l'orge et le sorgho. En effet, la température de germination adéquate pour un malt de sorgho de bonne qualité se situe entre 25 et 30 °C contre 15 à 17 °C pour l'orge (Agu et al., 1997). Cette température de germination induit un développement rapide des radicelles et des germes.
23Les mesures de l'activité α-amylase réalisées avec le kit AMYLAZYME montrent des valeurs d'activité comprises entre 61 et 312 U.g-1. L'activité la plus importante est notée avec la variété F-2-20 (312,6 U.g-1) et la plus faible avec 93B1057 (60,9 U.g-1). Au regard des valeurs trouvées dans la littérature pour le malt de sorgho (Agu et al., 1997 ; Letsididi et al., 2008), quatre parmi les sept variétés étudiées (F-2-20, CE 180-33, CE 151-262 et 93B1062) présentent une très bonne activité α-amylase. Leurs activités sont comparables et même supérieures à celles de certaines variétés d'orge étudiées par Kraemer et al. (2001). Les valeurs importantes des activités α-amylase sont probablement dues au développement plus long des radicelles, connu pour augmenter les niveaux de gibbérellines qui stimulent la production des amylases.
24Les activités β-amylase ou enzymes « saccharifiantes » dans les sept variétés de sorgho malté mesurées par la méthode BETAMYL varient entre 17 et 62 U.g-1. La variété F-2-20 avec 62,7 U.g-1 présente, parmi les variétés étudiées, l'activité la plus élevée suivie par CE 151-262 et CE 180-33 qui ont des activités presque semblables (32,5 à 30,5 U.g-1). Ensuite viennent dans l'ordre décroissant les variétés 93B1062, CE 145-66, CE 196-7-2-1 et 93B1057. Les activités β-amylase obtenues sont semblables à celles trouvées par Taylor et al. (1993) en utilisant la même méthode (BETAMYL). Par contre, certaines variétés de sorgho étudiées par Agu et al. (1997 ; 1998) et Letsididi et al. (2008) ont des activités β-amylase plus importantes que celles obtenues dans notre étude (valeurs comprises entre 80 et 168 U.g-1). Ces variations peuvent être dues aux différences dans les méthodes de maltage et aux variétés étudiées.
25Cependant, plusieurs hypothèses sont émises sur la faible activité β-amylase dans le malt de sorgho. Uriyo et al. (1999) l'ont attribué à une interaction avec les polyphénols lors de l'extraction, alors que Dufour et al. (1992) ont montré que l'activité β-amylase reste faible, même dans les variétés à faible teneur en polyphénols. D'autres prétendent qu'il y aurait des inhibiteurs autres que les polyphénols, une solubilisation partielle de l'enzyme ou un rendement faible pendant le maltage.
26Comparativement au malt d'orge dont la valeur standard de l'activité β-amylase est de 550 U.g-1, celle du malt de sorgho est de loin inférieure. Cette faible activité β-amylase (enzyme essentielle à la réussite du processus de brassage) est l'une des raisons qui pose problème pour l'adoption du sorgho dans les brasseries européennes.
27La dextrinase limite est déterminée par la méthode de McCleary (1992) en utilisant du pullulane contenu dans les comprimés du LIMIT-DEXTRIZYME comme substrat. L'analyse des sept variétés maltées a montré une activité dextrinase limite non négligeable. Avec 1253,8 U.kg-1, la F-2-20 produit plus de dextrinases limites, suivie par CE 151-262, 93B1057 et CE 196-7-2-1. CE 145-66 affiche la plus faible activité dextrinase limite. Hormis la variété CE 145-66, l'activité dextrinase limite mesurée dans les autres variétés de cette étude est de loin supérieure à celle mesurée dans 11 variétés de sorgho du Botswana par Letsididi et al. (2008) ainsi qu'à celle de certaines variétés d'orge étudiées par Wang et al. (2006).
28L'indice de Kolbach (ratio entre protéines solubles et protéines totales d'un malt) est déterminé dans les différents malts. En général, il est compris entre 35 et 45 %. Les valeurs obtenues avec les variétés F-2-20 et CE 180-33, respectivement 42,1 et 41,9 %, montrent une très bonne désagrégation.
4. Conclusion
29L'étude avait comme objectif de déterminer la teneur en composés phénoliques et le pouvoir antioxydant de différentes variétés de sorgho blanc sénégalais et d'étudier leurs potentialités de maltage en dosant l'activité de trois importantes enzymes, α-amylase, β-amylase et dextrinase limite, ainsi que l'indice de Kolbach. Parmi les sept variétés utilisées, seules deux, CE 180-33 et CE 145-66, sont des sorghos à tanins (proanthocyanidines) et présentent les teneurs les plus élevées en composés phénoliques. Par ailleurs, l'activité antioxydante a montré des valeurs significatives par rapport à l'orge dans toutes les variétés étudiées. Ce qui est intéressant pour leur utilisation en brasserie, en effet leur bonne activité antioxydante permettrait de stabiliser la bière.
30L'étude comparative des activités amylolytiques dans les différents malts nous a conduits à faire des observations intéressantes. La F-2-20 présente une bonne activité α-amylase, dextrinase limite et une bonne désagrégation. Avec son équipement enzymatique, elle pourrait être employée comme adjuvant ou comme matière première en brasserie. Mais des améliorations sont nécessaires pour élever la teneur en β-amylase dans le malt de sorgho. En effet, ceci devrait être possible soit par l'optimisation des conditions de maltage, soit par le biais de la génétique afin de sélectionner des variétés ayant une proportion suffisante de β-amylase, supérieure à 400 U.g-1.
31Remerciements
32Nous remercions Wallonie-Bruxelles International (WBI), ex Commissariat Général aux Relations Internationales de la Communauté Française de Belgique (CGRI), pour son soutien financier et le Centre National de Recherches Agricoles de Bambey (Sénégal) pour avoir mis à notre disposition les différentes variétés de sorgho étudiées. Nous remercions également le Dr Guy Derdelinckx, du Centre for Food and Microbial Technology-Department M2S de l'Université catholique de Louvain, d'avoir accepté de juger ce travail.
Bibliographie
Agu R.C. & Palmer G.H., 1997. The effect of temperature on the modification of sorghum and barley during malting. Process Biochem., 32(6), 501-507.
Agu R.C. & Palmer G.H., 1998. A reassessment of sorghum for lager-beer brewing. Bioresour. Technol., 66, 253-261.
Asiedu J.J., 1991. La transformation des produits agricoles en zone tropicale : approche technologique. Paris : Karthala.
Awika J.M. et al., 2003. Screening method to measure antioxidant activity of sorghum (Sorghum bicolor) and sorghum products. J. Agric. Food Chem., 51, 6657-6662.
Awika J.M. & Rooney L.W., 2004. Sorghum phytochemicals and their potential impact on human health. Phytochemistry, 65, 1199-1221.
Beta T., 2003. Anti-nutrients or anti-oxidants in cereal grains: an evaluation of the composition and functionality of phenolic compounds with special reference to sorghum and barley. In: Belton P.S. & Taylor J.R.N., eds. Conference proceedings of the AFRIPRO Workshop on the proteins of sorghum and millets: enhancing nutritional and functional properties for Africa, 2-4 April, Pretoria, South Africa, paper 11, 1-9, http://www.afripro.org.uk/papers/Paper11Beta.pdf., (11/05/2007).
Beta T., Rooney L.W., Marovatsanga L.T. & Taylor J.R.N., 1999. Phenolic compounds and kernel characteristics of Zimbabwean sorghum. J. Sci. Food Agric., 79, 1003-1010.
Beta T., Rooney L.W., Marovatsanga L.T. & Taylor J.R.N., 2000. Effect of chemical treatments on polyphenols and malt quality in sorghum. J. Cereal Sci., 31, 295-302.
Dicko M.H. et al., 2002. Comparison of content in phenolic compounds, polyphenol oxidase and peroxidase in grains of fifty sorghum varieties from Burkina Faso. J. Agric. Food Chem., 50, 3780-3788.
Dicko M.H. et al., 2005. Evaluation of the effect of germination on phenolic compounds and antioxidant activities in sorghum varieties. J. Agric. Food Chem., 53, 2581-2588.
Dicko M.H., Gruppen H., Voragen A.G.J. & van Berkel W.J.H., 2006. Biochemical characterization of major sorghum grain peroxidase. FEBS J., 273, 2293-2307.
Dillon J.C., 1989. Les produits céréaliers dans l'alimentation de sevrage du jeune enfant en Afrique. Céréales en régions chaudes. Paris : AUPELF-UREF, Éditions John Libbey Eurotext, 299-307.
Dlamini N.R., Taylor J.R.N. & Rooney L.W., 2007. The effect of sorghum type and processing on the antioxidant properties of African sorghum-based food. Food Chem., 105, 1412-1419.
Dufour J.P. & Mélotte L., 1992. Sorghum malt for the production of a lager beer. J. Am. Soc. Brew. Chem., 50(3), 110-119.
Dykes L. & Rooney L.W., 2006. Sorghum and millet phenols and antioxidants. J. Cereal Sci., 44, 236-251.
Earp C.F., McDonough C.A. & Rooney L.W., 2004. Microscopy of pericarp development in the caryopsis of Sorghum bicolor (L.) Moench. J. Cereal Sci., 39, 21-27.
Evers T. & Millar S., 2002. Cereal grain structure and development: some implications for quality. J. Cereal Sci., 36, 261-284.
FAO (Food and Agriculture Organisation of the United Nations), 1995. Le sorgho et les mils dans la nutrition humaine. Rome : FAO.
FAOSTAT, 2006. http://www.fao.org/, (11/02/2008).
Hagerman A.E. et al., 1998. High molecular weight plant phenolics (tanins) as biological antioxidants. J. Agric. Food Chem., 46, 1887-1892.
ICRISAT (International Crops Research Institute for the Semi Arid Tropics), 2006. Crops: Sorghum, http//test1.icrisat.org/sorghum/sorghum.htm#5, (29/01/2007).
Kraemer J.E.G., Mundstock E.C. & Molina S.C., 2001. Development expression of amylases during Barley malting. J. Cereal Sci., 33, 279-288.
Kumar G.S., Nayaka H., Dharmesh S.M. & Salimath P.V., 2006. Free and bound phenolic antioxidant in amla (Emblic offinalis) and turmeric (Curcuma longa). J. Food Compos. Anal., 19, 446-452.
Larreta-Garde V., 1997. Enzymes en agroalimentaire. Paris : Lavoisier Tec & Doc.
Letsididi R., Bulawayo B., Kebakile M. & Ezeogu L.I., 2008. Evaluation of indigenous Botswana sorghum cultivars with respect to their diastatic power, α-amylase, β-amylase, and limit dextrinase potentials for malting. J. Am. Soc. Brew. Chem., 66, 29-36.
McCleary B.V., 1992. Measurement of the content of limit dextrinase in cereal flours. Carbohydr. Res., 227, 257-268.
Nguz K., 1997. Étude nutritionnelle et biochimique sur les tanins condensés du sorgho (Sorghum bicolor (L.) Moench). Thèse de doctorat : Université de Gand (Belgique).
Price M.L., Van Scoyoc S. & Butler L.G., 1978. A critical evaluation of the vanillin reaction as an assay for tannin in sorghum grain. J. Agric. Food Chem., 26, 1214-1218.
Rooney L.W., 2003. Overview: sorghum and millet food research failures and successes. In: Belton P.S. & Taylor J.R.N., eds. In: Belton P.S. & Taylor J.R.N., eds. Conference proceedings of the AFRIPRO Workshop on the proteins of sorghum and millets: enhancing nutritional and functional properties for Africa, 2-4 April, Pretoria, South Africa,
http://www.afripro.org.uk/papers/Paper09Rooney.pdf. (26/10/2006).
Sikwese F.E. & Duodu K.G., 2007. Antioxidant effect of crude phenolic extract from sorghum bran in sunflower oil in the presence of ferric ions. Food Chem., 104, 324-331.
Singleton V.L., Orthofer R. & Lamuela-Raventos R.M., 1999. Analysis of total phenols and other oxidant substrates and antioxidants by means of Folin-Ciocalteu reagent. Methods Enzymol., 299, 152-178.
Taylor J.R.N., 2003. Overview: importance of sorghum production in Africa. In: Belton P.S. & Taylor J.R.N., eds. Conference proceedings of the AFRIPRO Workshop on the proteins of sorghum and millets: enhancing nutritional and functional properties for Africa, 2-4 April, Pretoria, South Africa, http://www.afripro.org.uk/papers/Paper09Rooney.pdf., (26/10/2006).
Taylor J.R.N. & Robbins D.J., 1993. Factors influencing ß-amylase activity in sorghum malt. J. Inst. Brew., 99, 413-416.
Taylor J.R.N. & Belton P.S., 2002. Sorghum. In: Belton P.S. & Taylor J.R.N., eds. Pseudocereals and less common cereals: grain properties and utilisation potential. Berlin, Germany: Springer, 25-79.
Traoré T. et al., 2004. Changes in nutrient composition, phytate and cyanide contents and α-amylase activity during cereal malting in small production units in Ouagadougou (Burkina Faso). Food Chem., 88, 105-114.
Uriyo M. & Eigel W.E., 1999. Duration of kilning treatment on α-amylase, β-amylase and endo-(1, 3) (1, 4)-β-D- glucanase activity of malted Sorghum (Sorghum bicolor). Process Biochem., 35, 433-436.
Uvere P.O., Adenuga O.D. & Mordi C., 2000. The effect of germination and kilning on the cyanogenic potential, amylase and alcohol levels of sorghum malts used for burukutu production. J. Sci. Food Agric., 80(3), 352-358.
Wang X., Yang J. & Zhang G., 2006. Genotypic and environmental variation in barley limit dextrinase activity and its relation to malt quality. J. Zhejiang Univ. Sci. B, 7(5), 386-392.
Waniska R.D., Hugo L.F. & Rooney L.W., 1992. Practical methods to determine presence of tannins in sorghum. J. Appl. Poult. Res., 1, 122-128.
Yu L. & Zhou K., 2004. Antioxidant properties of bran extracts from 'Platte' wheat grown at different location. Food Chem., 90, 311-316.
Zhao H. et al., 2008. Evaluation of antioxidant activities and total phenolic content of typical malting barley varieties. Food Chem., 107, 296-304.
Zhou K., Laux J.J. & Yu L., 2004. Comparison of Swiss red wheat grain and fractions of their antioxidant properties. J. Agric. Food Chem., 52, 1118-1123.
Om dit artikel te citeren:
Over : Khady Ba
Univ. Liège - Gembloux Agro-Bio Tech. Centre Wallon de Biologie Industrielle (CWBI). Unité des Bio-Industries. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : K.Ba@student.ulg.ac.be – Université Cheikh Anta Diop de Dakar (UCAD). École Supérieure Polytechnique de Dakar (ESP). Laboratoire de Microbiologie Appliquée et de Génie Industriel (LMAGI). BP 5085. Dakar Fann (Sénégal).
Over : Emmanuel Tine
Université Cheikh Anta Diop de Dakar (UCAD). École Supérieure Polytechnique de Dakar (ESP). Laboratoire de Microbiologie Appliquée et de Génie Industriel (LMAGI). BP 5085. Dakar Fann (Sénégal).
Over : Jacqueline Destain
Univ. Liège - Gembloux Agro-Bio Tech. Centre Wallon de Biologie Industrielle (CWBI). Unité des Bio-Industries. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Over : Ndiaga Cissé
Centre National de Recherches Agricoles. BP 53. Bambey (Sénégal).
Over : Philippe Thonart
Univ. Liège - Gembloux Agro-Bio Tech. Centre Wallon de Biologie Industrielle (CWBI). Unité des Bio-Industries. Passage des Déportés, 2. B-5030 Gembloux (Belgique).






