- Portada
- Volume 14 (2010)
- numéro 1
- Composition chimique et activité antimicrobienne des huiles essentielles de Thymus algeriensis Boiss. & Reut. et Thymus ciliatus (Desf.) Benth. du Maroc
Vista(s): 0 (0 ULiège)
Descargar(s): 0 (0 ULiège)
Composition chimique et activité antimicrobienne des huiles essentielles de Thymus algeriensis Boiss. & Reut. et Thymus ciliatus (Desf.) Benth. du Maroc

Notes de la rédaction
Reçu le 28 avril 2009, accepté le 23 septembre 2009
Résumé
Ce travail vise l’étude de la composition chimique et de l’activité antibactérienne et antifongique des huiles essentielles de Thymus algeriensis Boiss. & Reut. et Thymus ciliatus (Desf.) Benth. du Maroc vis-à-vis de sept micro-organismes. Les huiles essentielles de T. ciliatus sont caractérisées par la présence de thymol (44,2 %), β-E-ocimène (25,8 %) et α–terpinène (12,3 %) comme principaux constituants chimiques. Les huiles essentielles de T. algeriensis sont formées en majorité par le camphre (27,7 %) et l’α-pinène (20,5 %). L’huile essentielle de T. ciliatus a montré une forte activité antibactérienne et antifongique. Cette bioactivité est due principalement à la richesse de cette essence en thymol connu pour son efficacité contre les agents microbiens.
Abstract
Chemical composition and antimicrobial activity of the Thymus algeriensis Boiss. & Reut. and Thymus ciliatus (Desf.) Benth. essential oils of Morocco. The aim of this work is to study the chemical composition and antibacterial and antifungal activity of essential oils of Thymus algeriensis Boiss. & Reut. and Thymus ciliatus (Desf.) Benth. of Morocco against seven microorganisms. The essential oils of T. ciliatus are characterized by the presence of thymol (44.2%), β-E-ocimene (25.8%) and α-terpinene (12.3%) as principal chemical components. The essential oils of T. algeriensis are formed mainly by camphor (27.7%) and α-pinene (20.5%). The oil of T. ciliatus showed a strong antibacterial and antifungal activity against all tested bacteria and fungi. This bioactivity is due mainly to the richness of this essential oil in thymol known for its effectiveness against the microbial agents.
Tabla de contenidos
1. Introduction
1Les huiles essentielles des plantes ont trouvé leur place en aromathérapie, en pharmacie, en parfumerie, en cosmétique et dans la conservation des aliments. Leur utilisation est liée à leurs larges spectres d’activités biologiques reconnues (Paster et al., 1990 ; Caccioni et al., 1994 ; Cowan, 1999 ; Nielsen et al., 2000 ; Lamiri et al., 2001 ; Cimanga et al., 2002).
2Les huiles essentielles de thym sont largement utilisées comme agents antiseptiques dans plusieurs domaines pharmaceutiques et comme aromatisants pour de nombreux types de produits alimentaires (Papageorgio, 1980). Le genre Thymus englobe de nombreuses espèces et variétés et la composition chimique de leurs huiles essentielles a été étudiée depuis longtemps (Papageorgio, 1980 ; Baser et al., 1992 ; 1998 ; Vila et al., 1995 ; Guillen et al., 1998 ; Lozeine et al., 1998 ; Saez, 1998 ; Tumen et al., 1998). Les huiles essentielles de plusieurs espèces de thym ont déjà prouvé leurs propriétés antibactériennes et antifongiques (Pellecuer et al., 1980 ; Benjilali et al., 1987a ; 1987b ; Agnihotri et al., 1996). Au Maroc, le genre Thymus (Lamiaceae) est représenté par 21 espèces dont 12 sont endémiques (Benabid, 2000), la région méditerranéenne étant le centre de ce genre (Stahl-Biskup et al., 2002).
3Thymus ciliatus (Desf.) Benth. est un arbrisseau de petite taille, mais pouvant former des touffes bien étalées sur le sol ; les feuilles florales sont différentes des feuilles caulinaires, en général fortement dilatées à leur portion inférieure. Rencontrée dans les broussailles, matorrals, sur substrats calcaires et siliceux et sur sols rocailleux et bien drainés, la plante se répartit sur tout le Maroc non saharien (Benabid, 2000). Thymus algeriensis Boiss. & Reut. est une espèce endémique de l’Afrique du Nord. Au Maroc, elle est rencontrée dans le Moyen Atlas, le Haut Atlas, l'Anti Atlas occidental, le Rif et l’Oriental (Forêt de Béni Snassen). C’est une plante vivace à entre-nœuds longs de 4 à 7 mm naissant en touffe de la souche courte et ligneuse (Benabid, 2000).
4Au Maroc, peu de travaux ont été consacrés à l’étude du profil chimique des huiles essentielles de ces deux thyms. En plus, à notre connaissance, l’activité antibactérienne et antifongique des huiles essentielles de T. ciliatus et T. algeriensis du Maroc n’a fait l’objet d’aucune étude auparavant.
5L’objectif de ce travail est la caractérisation de la composition chimique des huiles essentielles de T. algeriensis et T. ciliatus et l’étude de l’activité antimicrobienne des huiles essentielles de ces deux espèces vis-à-vis de quatre souches bactériennes et trois espèces fongiques.
2. Matériel et méthodes
2.1. Matériel végétal
6Les échantillons de la partie aérienne (tiges, feuilles et fleurs) de T. algeriensis ont été récoltés au mois d’avril (2008) à Rchida, région de l'Oriental (Est du Maroc). Ceux de T. ciliatus ont été collectés au mois de mai (2008) dans la région d’Azrou, Moyen Atlas du Maroc.
2.2. Micro-organismes étudiés
7Quatre bactéries (Bacillus subtilis, Escherichia coli, Micrococcus luteus et Staphylococcus aureus) et trois champignons (Aspergillus niger, Penicillium expansum et Penicillium digitatum) ont été choisis pour leur fréquence élevée à contaminer les denrées alimentaires et pour leur pathogénicité.
8Les souches bactériennes sont des lots de l’ATCC (American Type Culture Collection). Elles sont entretenues par repiquage sur gélose nutritive favorable à leur croissance pendant 24 h à l’obscurité à 37 °C. Les trois moisissures appartiennent à la collection de la mycothèque du Laboratoire de Mycologie du Centre de Recherche forestière. Elles sont cultivées sur le milieu nutritif PDA (Potato Dextrose Agar) pendant 7 j à 25 °C dans l’obscurité.
2.3. Extraction des huiles essentielles
9L’extraction des huiles essentielles a été effectuée par hydrodistillation dans un appareil de type Clevenger (Clevenger, 1928). Trois distillations ont été réalisées par ébullition, pendant 1h30, de 200 g de matériel végétal frais avec 1 l d’eau dans un ballon de 2 l surmonté d’une colonne de 60 cm de longueur reliée à un réfrigérant. Le rendement en huile essentielle a été déterminé par rapport à la matière sèche, évaluée à partir de trois échantillons de 30 g sèchés pendant 48 h à l’étuve à 60 °C. L’huile essentielle a été stockée à 4 °C dans l’obscurité en présence de sulfate de sodium anhydre. Elle est diluée dans du méthanol (1 %, v/v) avant de procéder aux analyses CG (chromatographie en phase gazeuse) et CG/SM (chromatographie en phase gazeuse couplée à la spectrométrie de masse).
2.4. Analyse chromatographique
10Les analyses chromatographiques ont été effectuées sur un chromatographe en phase gazeuse à régulation électronique de pression de type Hewlett Packard (série HP 6890), équipé d’une colonne capillaire HP-5 (30 m x 0,25 mm) avec une épaisseur du film de 0,25 μm, d’un détecteur FID règlé à 250 °C et alimenté par un mélange de gaz H2/Air et un injecteur split-splitless règlé à 250 °C. Le mode d’injection est split (rapport de fuite : 1/50, débit : 66 ml.min-1). Le gaz utilisé est l’azote avec un débit de 1,7 ml.min-1. La température de la colonne est programmée de 50 à 200 °C pendant 10 min à raison d’une montée de 4 °C.min-1. L’appareil est piloté par un système informatique de type « HP ChemStation », gérant le fonctionnement de l’appareil et permettant de suivre l’évolution des analyses chromatographiques. Le volume injecté est 1 μl.
11L’identification des constituants a été réalisée en se basant sur leurs indices de Kováts (IK) et sur la chromatographie en phase gazeuse couplée à la spectrométrie de masse. Cette dernière est réalisée sur un chromatographe en phase gazeuse de type Hewlett-Packard (série HP 6890) couplé avec un spectromètre de masse (série HP 5973). La fragmentation est effectuée par impact électronique à 70eV. La colonne utilisée est une colonne capillaire HP-5MS (30 m x 0,25 mm), l’épaisseur du film est de 0,25 μm. La température de la colonne est programmée de 50 à 200 °C pendant 10 min à raison d’une montée de 4 °C.min-1. Le gaz vecteur est l’hélium dont le débit est fixé à 1,5 ml.min-1. La gamme de masse scannée m/z : 50-650 et la température d’interface est de 280 °C. Le mode d’injection est split (rapport de fuite : 1/70 débit 112 ml.min-1). L’appareil est relié à un système informatique gérant une bibliothèque de spectre de masse NIST 98.
2.5. Procédure microbiologique
12Du fait de la non-miscibilité des huiles essentielles à l’eau et donc au milieu de culture, une mise en émulsion a été réalisée grâce à une solution d’agar à 0,2 % (Remmal et al., 1993 ; Satrani et al., 2001). Elle permet d’obtenir dans le milieu une répartition homogène des huiles essentielles et d’augmenter au maximum le contact germe/composé. Des dilutions sont préparées au 1/10e, 1/25e, 1/50e, 1/100e, 1/200e, 1/300e et 1/500e dans cette solution d’agar. Dans des tubes à essai contenant chacun 13,5 ml du milieu solide TSA (Tryptic Soja Agar) pour les bactéries et le PDA (Potato Dextrose Agar) pour les moisissures, stérilisés à l’autoclave pendant 20 min à 121 °C et refroidis à 45 °C, on ajoute aseptiquement 1,5 ml de chacune des dilutions de façon à obtenir les concentrations finales de 1/100, 1/250, 1/500, 1/1 000, 1/2 000, 1/3 000 et 1/5 000 (v/v). On agite convenablement les tubes afin de bien disperser l’HE dans le milieu de culture avant de les verser dans les boites de Petri. Des témoins, contenant le milieu de culture et la solution d’agar à 0,2 % seule, sont également préparés.
13L’ensemencement se fait par stries à l’aide d’une anse de platine calibrée afin de prélever le même volume d’inoculum. Ce dernier se présente sous forme de bouillon de culture de 24 h pour les bactéries et sous forme d’une suspension dans l’eau physiologique de spores provenant d’une culture de 7 j dans le PDA pour les moisissures. L’incubation se fait à 37 °C pendant 24 h pour les bactéries et à 25 °C pendant 7 j pour les champignons. Chaque essai est répété trois fois afin de minimiser l’erreur expérimentale.
3. Résultats et discussion
3.1. Rendement et composition chimique
14Les rendements moyens en huiles essentielles ont été calculés en fonction de la matière végétale sèche de la partie aérienne de la plante. Les échantillons de T. ciliatus ont fourni un taux d’environ 1,2 % ± 0,05 plus élevé que celui obtenu à partir de T. algeriensis, qui est de 0,3 % ± 0,07. Ce dernier taux est plus faible par rapport à celui obtenu à partir de T. algeriensis de l’Algérie et qui est de 1,13 % (Dob et al., 2006).
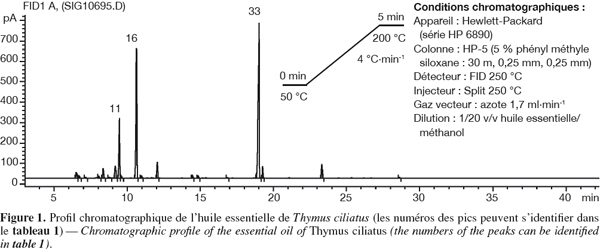
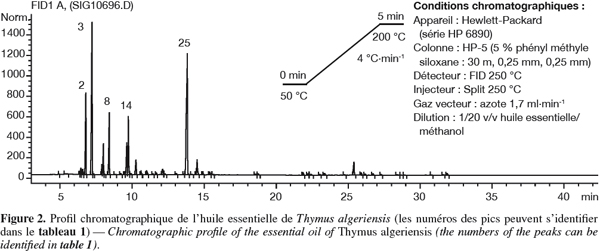
15Les analyses chromatographiques des huiles essentielles ont permis d’identifier 15 composés qui représentent environ 97,41 % pour T. ciliatus, contre 48 composés (98,87 %) pour T. algeriensis (Tableau 1, Figures 1 et 2).
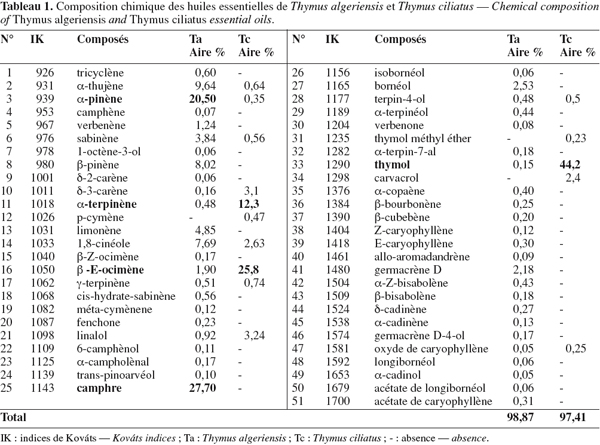
16L’huile essentielle de T. ciliatus du Maroc est composée principalement de thymol (44,2 %), de β-E-ocimène (25,8 %) et d’α–terpinène (12,3 %) accompagnés d’autres constituants à des teneurs relativement faibles : linalol (3,24 %), δ-3-carène (3,1 %), 1,8-cinéole (2,63 %) et carvacrol (2,4 %), totalisant 93,67 %.
17L’huile essentielle de T. ciliatus présente un polymorphisme chimique très important. En effet, Benjilali et al. (1987a ; 1987b) ont montré que le profil chimique de 14 échantillons de T. ciliatus de différentes régions du Maroc est très variable. La teneur et la nature des composés majoritaires varient considérablement d’un échantillon à l’autre en fonction de l’origine des plantes : thymol (0,3-29,3 %), carvacrol (0,4-21,7 %), acétate d’α-terpényle (0-42,9 %), acétate de géranyle (0-21,7 %), butyrate de géranyle (0-26,7 %), camphre (0,4-28,4 %) et bornéol (0,1-31,6 %). C’est le cas aussi pour T. ciliatus de l’Algérie, pour lequel Giordani et al. (2008) ont montré que l’huile essentielle de cette espèce originaire de Djebel Ansel est dominée par le thymol (60,52 %). Alors que le carvacrol (72,4-80,3 %) est le constituant principal de huit provenances de T. ciliatus ssp. eu-ciliatus de la région de Tlemsen (Bousmaha et al., 2007).
18Deux constituants chimiques dominent l’huile essentielle de T. algeriensis : le camphre (27,7 %) et l’α-pinène (20,5 %). D’autres composés sont également présents, mais à des teneurs moins importantes : α-thujène (9,64 %), β-pinène (8,02 %), 1,8-cinéole (7,69 %), limonène (4,85 %), sabinène (3,84 %) et bornéol (2,53 %). L’ensemble de ces constituants contribue au mélange à concurrence de 84,77 %. Cette composition chimique est différente de celle de l’huile essentielle étudiée par Dob et al. (2006) qui contient comme principaux constituants le linalol (43,3 %), le thymol (29,2 %) et le ρ-cymène (6,8 %). Les essences de T. algeriensis originaires de Khedara et Fatoum Souda (Algérie) présentent les mêmes composés majoritaires, mais elles sont plus riches en α-pinène (27,14-25,52 %) qu’en camphre (8,77-8,45 %), en plus du 1,8-cinéole (7,69-7,68 %), du sabinène (5,25 -5,61 %) et du β-pinène (2,66-3,12 %) (Giordani et al., 2008).
19La composition chimique de l’huile essentielle de T. algeriensis est complètement distincte de celle de T. ciliatus. En effet, le thymol composé principal de l’essence de T. ciliatus est présent en faible quantité dans l’huile de T. algeriensis. D’un autre côté, le camphre, composé dominant de T. algeriensis est absent dans l’essence de T. ciliatus. Aussi, l’α-pinène, constituant majoritaire de T. algeriensis, est sans importance dans l’huile de T. ciliatus.
20Les variations rencontrées dans la composition chimique des huiles essentielles, du point de vue qualitatif et quantitatif, peuvent être dues à certains facteurs écologiques, à la partie de la plante utilisée, à l’âge de la plante et à la période du cycle végétatif, ou même à des facteurs génétiques (Senatore, 1996 ; Kokkini et al., 1997 ; Russo et al., 1998 ; Thompson et al., 2003 ; Karousou et al., 2005).
3.2. Activité antimicrobienne des huiles essentielles
21Le tableau 2 montre les résultats de l’activité antibactérienne et antifongique des huiles essentielles de T. algeriensis et de T. ciliatus. On note que l’huile de T. ciliatus a exercé une forte activité antibactérienne. La concentration de 1/2 000 v/v était suffisante pour inhiber la croissance d’E. coli et de M. luteus. Alors que B. subtilis et S. aureus étaient plus sensibles avec une concentration d’inhibition de 1/3 000 v/v. Les mêmes résultats ont été obtenus pour l’huile essentielle de Thymus capitatus (L.) Hoffm. & Link du Maroc [carvacrol (70,92 %), ρ-cymène (6,34 %), γ-terpinène (4,92 %)], sauf pour S. aureus qui a été inhibée à partir de 1/2 000 v/v (Amarti et al., 2008). Dorman et al. (2000) ont testé l’huile essentielle de Thymus vulgaris L. contre ces quatre bactéries et ils ont trouvé une sensibilité plus importante de B. subtilis et d’E. coli. Loziene et al. (2007) ont montré que S. aureus et M. luteus étaient plus sensibles qu’E. coli à l’huile essentielle de T. pulegioides L. Également, l’huile essentielle de Thymus revolutus Celak. étudiée par Karaman et al. en 2001 [carvacrol (43,13 %), γ-terpinène (20,86 %), ρ-cymène (13,94 %)] s’est montrée très active contre ces souches bactériennes.
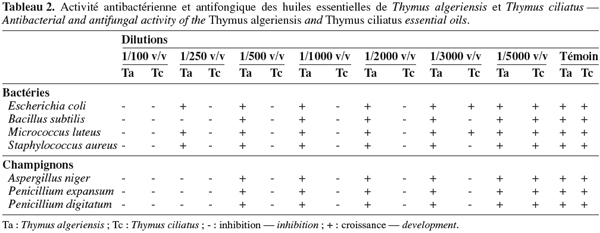
22À l’égard de l’essence de T. algeriensis : B. subtilis s’est montrée plus résistante avec une concentration d’inhibition de 1/250 v/v, alors que les autres bactéries ont été inhibées à partir de 1/500 v/v.
23Toutes les moisissures testées ont été inhibées à partir de la faible concentration de 1/3 000 v/v de l’essence de T. ciliatus, alors qu’elles ont résisté jusqu’à 1/250 v/v de l’huile de T. algeriensis.
24L’huile essentielle de T. algeriensis est moins active comparée à l’essence de T. ciliatus. Cette faible activité peut être due à la présence dans l’huile de T. algeriensis de l’α-pinène (20,5 %), du β-pinène (8,02 %) et du limonène (4,85 %) reconnus par leur faible activité antibactérienne (Knobloch et al., 1989 ; Chalchat et al., 2000). La même constatation a été rapportée par Giordani et al. (2008) qui ont montré que parmi les huiles de sept plantes aromatiques et médicinales différentes de l’Algérie, l’essence de T. algeriensis a présenté la plus faible activité antifongique contre Candida albicans.
25L’importante bioactivité de l’huile essentielle de T. ciliatus est en relation avec sa teneur élevée en thymol (44,2 %). En effet, plusieurs auteurs (Pellecuer et al., 1980 ; Gergis et al., 1990 ; Panizzi et al., 1993 ; Sivropoulou et al., 1996 ; Trombetta et al., 2002 ; Satrani et al., 2008) ont montré que les huiles essentielles riches en dérivés phénoliques (carvacrol et thymol) possèdent une forte activité antimicrobienne. Dorman et al. (2000) ont démontré que le thymol est le composé qui possède le plus large spectre d’activité antibactérienne contre 25 genres de bactéries testées. Des études réalisées par l’Organisation Mondiale de la Santé (OMS, 1999) ont également montré que ce constituant possède une forte activité antifongique et antibactérienne contre de nombreuses espèces y compris Aspergillus sp., S. aureus et E. coli. Lambert et al. (2001) et Juven et al. (1994) ont expliqué ce phénomène par le fait que le thymol se lie aux protéines membranaires et fait augmenter la perméabilité de la membrane cellulaire bactérienne. D’autres travaux ont suggéré aussi que ce composé volatil est responsable de l’inactivation d’enzymes, y compris ceux impliqués dans la production d’énergie et la synthèse des constituants de structure (Trombetta et al., 2005).
26Contre les champignons, les phénols terpéniques des huiles essentielles provoquent plusieurs dégâts tels que des perturbations morphologiques des hyphes mycéliens, la rupture de la membrane plasmique et l’altération de la structure des mitochondries (Arras et al., 2001 ; De Billerbeck et al., 2001).
4. Conclusion
27Dans ce travail, nous avons étudié la composition chimique et l’activité antibactérienne et antifongique des huiles essentielles de deux thyms marocains. L’analyse qualitative et quantitative des huiles essentielles de T. ciliatus et T. algeriensis a permis d’identifier respectivement 15 et 48 constituants. L’huile de T. ciliatus est composée principalement par le thymol (44,2 %), le β-E-ocimène (25,8 %) et l’α–terpinène (12,3 %), alors que l’essence de T. algeriensis a montré une dominance du camphre (27,7 %) et de l’α-pinène (20,5 %).
28Les deux huiles essentielles se sont montrées actives contre les champignons et les bactéries testés, mais c’est l’essence de T. ciliatus qui a manifesté le plus grand pouvoir antimicrobien grâce à sa richesse en thymol.
29Une récente étude nous a permis aussi de prouver l’efficacité des essences de deux thyms, T. capitatus et Thymus bleicherianus Pomel contre les mêmes bactéries et champignons (Amarti et al., 2008). Ceci montre que la flore marocaine peut constituer une réserve importante d’espèces végétales intéressantes, dont les principes actifs peuvent être employés dans plusieurs domaines tels que les industries agroalimentaire et pharmaceutique.
Bibliographie
Agnihotri S. & Vaidy A.D.B., 1996. A novel approach to study antibacterial properties of volatile components of selected Indian medicinal herbs. Indian J. Exp. Biol., 34(7), 712-715.
Amarti F. et al., 2008. Composition chimique et activité antimicrobienne des huiles essentielles de Thymus capitatus et de Thymus bleicherianus du Maroc. Phytothérapie, 6, 342-347.
Arras G. & Usai M., 2001. Fungitoxic activity of 12 essential oils against four postharvest Citrus pathogens: chemical analysis of Thymus capitatus oil and its effect in subatmospheric pressure conditions. J. Food Prot., 64, 1025-1029.
Baser K.H.C., Ozek T. & Tumen G., 1992. Essential oils of Thymus cariensis and Thymus haussknechtii, two endemic species in Turkey. J. Essent. Oil Res., 4, 659-661.
Baser K.H.C., Kirimer N., Tumen G. & Duman H., 1998. Composition of the essential oils of Thymus canaoviridis Jalas. J. Essent. Oil Res., 10, 199-200.
Benabid A., 2000. Flore et écosystèmes du Maroc. Évaluation et préservation de la biodiversité. Paris : Édition Ibis Press, 159-161.
Benjilali B., Hammouni M., M'Hamedi A. & Richard H., 1987a. Essential oil composition of different Moroccan thyme varieties: principal component analysis. Sci. Aliments, 7, 275-299.
Benjilali B., Hammouni M. & Richard H., 1987b. Chemical polymorphism of Moroccan thyme essential oils: compounds characterization. Sci. Aliments, 7, 77-91.
Bousmaha L., Atik Bekkara F., Tomi F. & Casanova J., 2007. Chemical composition and antibacterial activity of the essential oil of Thymus ciliatus (Desf.) Benth. ssp. eu-ciliatus Maire from Algeria. J. Essent. Oil Res., 19(5), 490-493.
Caccioni D.R.L. & Guizardi M., 1994. Inhibition of germination of fruit and postharvest pathogenic fungi by essential oil components. J. Essent. Oil Res., 6, 173-179.
Chalchat J.C. et al., 2000. Photochemical hydroperoxidation of terpenes. Antimicrobial activity of α-pinene and limonene hydroperoxides. J. Essent. Oil Res., 12, 125-134.
Cimanga K. et al., 2002. Correlation between chemical composition and antibacterial activity of essential oils of some aromatic medicinal plants growing in the Democratic Republic of Congo. J. Ethnopharmacology, 79, 213-220.
Clevenger J.F., 1928. Apparatus for the determination of volatile oil. J. Am. Pharm. Assoc., 17, 336-341.
Cowan M.M., 1999. Plant products as antimicrobial agents. Clin. Microbiol. Rev., 12, 564-582.
De Billerbeck V.G. et al., 2001. Effects of Cymbopognon nardus (L.) W. Watson essential oil on the growth and morphogenesis of Aspergillus niger. Can. J. Microbiol., 47, 9-17.
Dob T., Darhmane D., Benabdelkader T. & Chelghoum T.C., 2006. Studies on the essential oils and antimicrobial activity of Thymus algeriensis Boiss. & Reut. Int. J. Aromatherapy, 16(2), 95-100.
Dorman H.J.D. & Deans S.G., 2000. Antimicrobial agents from plants: antimicrobial activity of plant volatile oils. J. Appl. Microbiol., 88, 308-316.
Gergis V., Spiliotis V. & Poulos C., 1990. Antimicrobial activity of essential oils from Greek Sideritis species. Pharmazie, 45, 70.
Giordani R., Hadef Y. & Kaloustian J., 2008. Compositions and antifungal activities of essential oils of some Algerian aromatic plants. Fitoterapia, 79, 199-203.
Guillen M.D. & Manzanos M.J., 1998. Study of composition of different parts of a Spanish Thymus vulgaris L. Plant Food Chem., 3, 373-383.
Juven B.J., Kanner J., Schved F. & Weisslowiez H., 1994. Factors that interact with the antibacterial action of thyme essential oil and its active constituents. J. Appl. Bacteriol., 76, 626-631.
Karaman S., Digrak M., Ravid U.A. & Ilcim A., 2001. Antibacterial and antifungal activity of the essential oils of Thymus revolutus Celak. from Turkey. J. Ethnopharmacology, 76, 183-186.
Karousou R., Koureas D.N. & Kokkini S., 2005. Essential oil composition is related to the natural habitats: Coridothymus capitatus and Satureja thymbra in NATURA 2000 sites of Crete. Photochemistry, 66, 2668-2673.
Knobloch K. et al., 1989. Antibacterial and antifungal properties of essential oil components. J. Essent. Oil Res., 1, 119-128.
Kokkini S. et al., 1997. Autumn essential oils of Greek oregano. Phytochemistry, 44(5), 883-886.
Lambert R.J.W., Skandamis P.N., Coote P. & Nychas G.J.E., 2001. A study of the minimum inhibitory concentration and mode of action of oregano essential oil, thymol and carvacrol. J. Appl. Microbiol., 91, 453-462.
Lamiri A., Lhaloui S., Benjilali B. & Berrada M., 2001. Insecticidal effects of essential oils against Hessian fly, Mayetiola Destructor (Say). Field Crops Res., 71, 9-15.
Loziene K., Vauciunine J. & Venskutonis P., 1998. Chemical composition of the essential oil of creeping thyme (Thymus serpyllum I.) growing wild in Lithuania. Planta Medica, 64, 772-773.
Loziene K., Venskutonus P.R., Sipailiene A. & Labokas J., 2007. Radical scavenging and antibacterial properties of the extracts from different Thymus pulegioides L. chemotypes. Food Chem., 103, 546-559.
Nielsen P.V. & Rios R., 2000. Inhibition of fungal growth on bread by volatile components from spices and herbs, and the possible application in active packaging, with special emphasis on mustard essential oil. Int. J. Food Microbiol., 60, 219-229.
Organisation Mondiale de la Santé (OMS), 1999. Monographs on selected medicinal plants. Geneva, Switzerland: OMS.
Panizzi L., Flamini G., Gioni P.L. & Morelli I., 1993. Composition and antimicrobial properties of essential oils of four Mediterranean lamiaceases. J. Ethnopharmacology, 39, 169-170.
Papageorgio V., 1980. GLC-MS computer analysis of the essential oil of Thymus capitatus. Planta Medica Suppl., 29-33.
Paster N. et al., 1990. Inhibitory effect of oregano and thyme essential oils on molds and foodborne bacteria. Lett. Appl. Microbiol., 11, 33-37.
Pellecuer J., Jacob M., Simeon de Buechberg M. & Allegrini J., 1980. Therapeutic value of the cultivated mountain savory (Satureia Montana L.). Acta Hortic., 96, 35-39.
Remmal A. et al., 1993. Improved method for determination of antimicrobial activity of essential oils in agar medium. J. Essent. Oil Res., 5(2), 179-184.
Russo M., Galletti G.C., Bocchini P. & Carnacini A., 1998. Essential oil chemical composition of wild populations of Italian oregano spice (Origanum vulgare ssp. hirtum (Link)): a preliminary evaluation of their use in chemotaxonomy by cluster analysis. J. Agric. Food Chem., 46, 3741-3746.
Saez F., 1998. Variability in essential oils from populations of Thymus hyemalis Lange in southeastern Spain. J. Herbs Spices Med. Plants, 5, 65-76.
Satrani B. et al., 2001. Composition chimique et activité antimicrobienne des huiles essentielles de Satureja calamintha et Satureja alpina du Maroc. Ann. Falsif. Expert. Chim. Toxicol., 94(956), 241-250.
Satrani B. et al., 2008. Composition chimique et activité antimicrobienne de l’huile essentielle de Cladanthus mixtus. Bull. Soc. Pharm. Bordeaux, 146, 85-96.
Senatore F., 1996. Influence of harvesting time on yield and composition of the essential oil of a thyme (Thymus pulegioides L.) growing wild in Campania (Southern Italy). J. Agric. Food Chem., 44, 1327-1332.
Sivropoulou A. et al., 1996. Antimicrobial and cytotoxic activities of origanum essential oils. J. Agric. Food Chem., 44, 1202-1205.
Stahl-Biskup E. & Saez F., 2002. Thyme. The genus Thymus. London; New York, USA: Taylor & Francis.
Thompson J.D. et al., 2003. Qualitative and quantitative variation in monoterpene co-occurrence and composition in the essential oil of Thymus vulgaris chemotype. J. Chem. Ecol., 29(4), 859-880.
Trombetta D. et al., 2002. Study on the mechanisms of the antibacterial action of some plant, ß-unsaturated aldehydes. Lett. Appl. Microbiol., 35, 285-290.
Trombetta D. et al., 2005. Mechanisms of antibacterial action of three monoterpenes. Antimicrob. Agents Chemother., 49(6), 2474-2478.
Tumen G., Baser K.H.C., Demirci B. & Ermin N., 1998. The essential oils of Satureja coerulea Janka and Thymus aznavouriii Velen. Flavour Fragrance J., 13(1), 65-67.
Vila R. et al., 1995. Composition and study of the variability of the essential oil of Thymus funkii Cosson. Flavour Flagrance J., 10, 379-383.
Para citar este artículo
Acerca de: Fatiha Amarti
Centre de Recherche forestière. BP 763. Agdal. MA-10050 Rabat (Maroc) – Université Ibn Tofail. Faculté des Sciences. Département de Chimie. Laboratoire de Chimie appliquée et de Contrôle de la Qualité. BP 133. MA-Kénitra (Maroc).
Acerca de: Badr Satrani
Centre de Recherche forestière. BP 763. Agdal. MA-10050 Rabat (Maroc). E-mail : badrsat@yahoo.fr
Acerca de: Mohamed Ghanmi
Centre de Recherche forestière. BP 763. Agdal. MA-10050 Rabat (Maroc).
Acerca de: Abdellah Farah
Institut national des Plantes médicinales et aromatiques. BP 7048. MA-30007 Fès-Ezohour (Maroc).
Acerca de: Abderrahman Aafi
Centre de Recherche forestière. BP 763. Agdal. MA-10050 Rabat (Maroc).
Acerca de: Lotfi Aarab
Université Sidi Mohamed Ben Abdellah. Faculté des Sciences et Techniques. Laboratoire des Molécules bioactives. BP 2202. MA-Fès (Maroc).
Acerca de: Mustapha El Ajjouri
Centre de Recherche forestière. BP 763. Agdal. MA-10050 Rabat (Maroc) – Université Ibn Tofail. Faculté des Sciences. Département de Chimie. Laboratoire de Chimie appliquée et de Contrôle de la Qualité. BP 133. MA-Kénitra (Maroc).
Acerca de: Abdelaziz Chaouch
Centre de Recherche forestière. BP 763. Agdal. MA-10050 Rabat (Maroc).






