Les produits de la mer au Sénégal et le potentiel des bactéries lactiques et des bactériocines pour la conservation
Univ. Liège - Gembloux Agro-Bio Tech. Centre Wallon de Biologie Industrielle (CWBI). Passage des Déportés, 2. B-5030 Gembloux (Belgique). – Université Cheikh Anta Diop. École supérieure polytechnique. 5085 Dakar (Sénégal). E-mail : bioindus.gembloux@ulg.ac.be - diopmb@yahoo.fr
Univ. Liège - Gembloux Agro-Bio Tech. Centre Wallon de Biologie Industrielle (CWBI). Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Université Cheikh Anta Diop. École supérieure polytechnique. 5085 Dakar (Sénégal).
Univ. Liège - Gembloux Agro-Bio Tech. Centre Wallon de Biologie Industrielle (CWBI). Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Reçu le 28 mai 2008, accepté le 10 novembre 2009
Résumé
Au Sénégal, le poisson constitue la première source de protéines animales des populations. Les contraintes socio-économiques entravent le développement des techniques industrielles de conservation. La nature artisanale de la production pose des problèmes liés à la sécurité, ainsi que des substances toxiques affectant la qualité organoleptique et sanitaire des produits. Certaines techniques de conservation des produits halieutiques utilisant les bactéries lactiques productrices de bactériocines (peptides antibactériens) sont peu couteuses et peu consommatrices d’énergie. Elles peuvent être adaptées dans la conservation du poisson au Sénégal particulièrement dans la fermentation dans laquelle les captures, généralement stockées pendant plusieurs heures aux températures ambiantes, sont seulement additionnées de sel (NaCl) et sèchées au soleil. Les bactéries lactiques productrices de bactériocines pourraient être utilisées comme ferment (avec ajout d’hydrates de carbone) au cours de la préparation des poissons pour rendre ces derniers plus résistants à la prolifération des bactéries indésirables par la production in situ d’acides organiques et de bactériocines. Une seconde alternative d’application de ces bactéries est l’utilisation des solutions bactéricides issues de leurs cultures, comme barrière additionnelle au chlorure de sodium pour inhiber la croissance de la flore au cours du stockage de maturation des poissons. Ces nouvelles techniques de préparations combinées à un sèchage pourraient améliorer la qualité microbiologique et diététique des produits halieutiques locaux.
Abstract
Fish preservation in Senegal: potential use of lactic acid bacteria and their antibacterial metabolites. In Senegal, fish are first as staple animal protein foods for populations. Socioeconomic constraints hamper the development of industrial preservations. Traditional fish production has some inherent food safety concerns considering the high susceptibility of seafood to bacterial spoilage. Some strategies of seafood products preservation using lactic acid bacteria producing bacteriocin are not very expensive and do not consume energy very much. They can be adapted in the preservation of fish in Senegal particularly in the fermentation in which the catches, generally handled for many hours at ambient temperature, are only added salt (NaCl) and sun dried. Lactic acid bacteria producing bacteriocins could be used as starters (with addition of carbohydrates) during the preparation of fish for rendering them more resistant to the growth of spoilage and pathogenic bacteria by in situ production of organic acids and bacteriocins. A second alternative of application of these bacteria is to use bactericidal solutions obtained from their cultures as additional barrier to sodium chloride to prevent growth of the flora during fish storage for maturation. These new strategies of preparation combined with drying can be used to enhance microbiological and dietetic qualities of local seafood commodities.
1. Introduction
1Dans de nombreuses parties du globe, les produits de la pêche constituent la première source de protéines animales pour les populations. Ces produits renferment des animaux appartenant à différents groupes zoologiques. Il s’agit principalement de poissons [poissons cartilagineux (Élasmobranches) et poissons osseux (Ostéichyens)], de mollusques [gastéropodes, céphalopodes et bivalves (huitres)] et de crustacés. Tous ces produits sont connus pour leur grande susceptibilité à la dégradation. Ils posent des problèmes tant hygiéniques que toxicologiques et économiques, particulièrement dans les pays tropicaux.
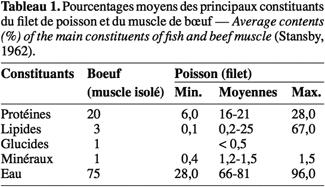
2Différentes technologies basées sur le froid, la chaleur ou utilisant des agents chimiques de conservation ont été développées afin d’étendre la durée de conservation des produits de la pêche. De nouvelles stratégies de biopréservation utilisent les propriétés antimicrobiennes des bactéries lactiques, particulièrement celles productrices de bactériocines (Glatman et al., 2000 ; Gelman et al., 2001 ; O’Sullivan et al., 2002 ; Dortu et al., 2009). Cette technologie permet d’obtenir des produits de bonne qualité microbiologique, contenant moins de conservateurs chimiques.
3Les bactériocines sont des composés peptidiques (ou des protéines) produits par certaines souches bactériennes qui ont un effet antagoniste sur d’autres bactéries généralement phylogénétiquement proches. Certaines bactériocines de bactéries lactiques ont un spectre d’inhibition assez large incluant des bactéries pathogènes (Listeria monocytogenes, Staphylococcus aureus, Bacillus sp.) d’origine alimentaire.
4Trois stratégies sont utilisées pour l’exploitation des bactéries lactiques et leurs métabolites dans la conservation des denrées alimentaires (Schillinger et al., 1996) :
5– inoculation de l’aliment avec des bactéries lactiques qui produisent une bactériocine in situ,
6– addition de la bactériocine purifiée ou partiellement purifiée,
7– utilisation de solutions brutes d’acide lactique et de bactériocine issues de la culture d’une souche bactérienne lactique productrice de bactériocine comme ingrédient dans la transformation des produits alimentaires.
8Le Sénégal est connu pour son niveau élevé de production de produits de la mer. Mais les contraintes socio-économiques entravent le développement de la conservation industrielle des captures (Diei-Ouadi, 2005). La nature artisanale de la production pose des problèmes liés à la sécurité, ainsi que des substances toxiques affectant la qualité organoleptique et sanitaire des produits.
9Cette synthèse bibliographique présente les différentes techniques de conservation de produits halieutiques les plus couramment utilisées dans la filière artisanale sénégalaise. Les stratégies utilisant les bactéries lactiques ou leurs métabolites antibactériens comme bio-conservateurs de produits halieutiques sont également détaillées dans le but d’identifier des possibilités d’exploitation dans la transformation du poisson au Sénégal.
2. Principaux facteurs de dégradation des produits marins
10Aussitôt après sa mort, le poisson subit un processus naturel de décomposition qui est le résultat de la succession de réactions enzymatiques, chimiques et microbiologiques.
11Les cathepsines seraient les premiers acteurs de la dégradation du tissu musculaire des produits marins. Ces enzymes proviennent des lysosomes fragilisés par l’abaissement du pH à la mort du poisson (Kolodziejska et al., 1995). Elles ont une action ramollissante sur la chair du poisson. Cette action survient dans les prises après 5 à 30 h de stockage à 0 °C (Cheftel et al., 1992). Elle favorise la diffusion de liquides biologiques et la progression des bactéries dans le muscle du poisson, normalement stérile.
12La très faible teneur en hydrates de carbone du muscle du poisson (Tableau 1) constitue une limite à la baisse post mortem du pH liée essentiellement à la production d’acide lactique à partir du glycogène (Huss, 1986). La baisse de pH dans les poissons est plus faible (7,0 à 6,2-6,5 en moyenne, à 0 °C) que dans les viandes d’animaux à sang chaud (Cheftel et al., 1992). Dans ces conditions de pH relativement élevé, les entérobactéries, Shewanella spp., Pseudomonas spp., Vibrio spp. et d’autres bactéries pathogènes incluant Staphylococcus aureus, Bacillus cereus et Listeria monocytogenes peuvent proliférer dans le poisson.
13En se développant dans le poisson, ces bactéries peuvent libérer une large gamme de composés responsables d'odeurs ou de saveurs désagréables incluant l’ammoniac, le sulfure d’hydrogène, le diméthylsulfure et le méthyl mercaptan, ainsi que des substances toxiques susceptibles d’affecter la qualité organoleptique et sanitaire des produits (Gram et al., 2002).
14L’exposition des captures à des températures abusives est l’une des principales causes de la détérioration des produits halieutiques. Sous les températures ambiantes des tropiques, le poisson se détériore très rapidement, en moins de 12 h (Cheftel et al., 1992). Le tableau 2 présente les principales bactéries et métabolites d’origine bactérienne pathogènes dans les produits de la mer.

15La formation d’histamine est fréquente chez certaines familles de poissons incluant les thonidés, scrombidés et les clupéidés, relativement riches en histidine. Cette amine biogénique provient de l’histidine sous l’action d’enzymes (décarboxylases) produites essentiellement par des entérobactéries mésophiles. La plupart des bactéries décarboxylase-positives ne sont normalement pas attendues dans la flore naturelle des poissons. Leur présence est probablement liée à une contamination au cours des premières manipulations post-captures. Une flore mésophile totale de 106 à 107 ufc.g-1 aboutit à une production potentielle d’histamine atteignant le seuil de toxicité (Bulushi et al., 2009).
3. Critères de qualité microbiologique des produits marins
16Pour empêcher ou limiter la dégradation bactérienne, les produits de la pêche sont soumis à l’action du froid le plus rapidement possible après leur capture. La gamme de températures choisie pour l’action du froid est généralement comprise entre -2 °C et 0 °C (Boyd et al., 1992).
17La réfrigération sous glace est une pratique obligatoire pour les prises. Pendant et après le débarquement des produits, les opérateurs dans la filière de la pêche doivent éviter toute contamination qui serait liée aux équipements, matériaux, méthodes, contaminations croisées ou au non respect de la température optimale de stockage (Reg. /CE1/853/2004 ; Arrêté n°36142 du 15 avril 1991).
18Les valeurs indicatives de la contamination bactérienne des produits de la pêche (produits décortiqués et décoquillés de crustacés et de mollusques) destinés à la consommation humaine sont définies par rapport à Escherichia coli (indicateur de contamination fécale) et Staphylococcus aureus. Les limites d’acceptabilité (valeurs moyennes) ont été établies à 10 ufc.g-1 (Escherichia coli) et 102 ufc.g-1 (Staphylococcus aureus) (Reg. /CE/2073/2005). Pour les produits de la pêche fabriqués à partir d’espèces de poissons associées à une grande quantité d’histidine, la limite en histamine (teneur moyenne) acceptable est définie à 100 mg.kg-1 ; les produits qui ont subi un traitement de maturation aux enzymes dans la saumure peuvent avoir des teneurs plus élevées mais ne dépassant pas 200 mg.kg-1 (Reg. /CE/2073/2005 ; Arrêté n°0049611 du 11 février 2005).
19L’application des règles d’hygiène pose des problèmes dans la filière de la pêche au Sénégal, au regard du nombre croissant d’alertes enregistrées au niveau de l’Union européenne depuis 1997. Ces alertes, déclenchées à la suite de contrôles défavorables à l’importation, sont secondaires à un taux important d’histamine et à l’isolement de Salmonella, de Vibrio cholerae et de Vibrio parahaemolyticus (Commission européenne, 1999). Ces bactéries pathogènes mésophiles font l’objet de surveillance dans les produits de la mer (Guiraud, 1998), notamment dans le cadre des accords de pêche entre le Sénégal et l’Union européenne (Décision 96/355/CE3).
4. La filière de la pêche au Sénégal
4.1. Production, consommation et exportation de produits marins
20Au Sénégal, la pêche maritime fournit environ 90 % du total des captures. La pêche est la première source de devises devant le tourisme et constitue de ce fait un secteur vital pour le pays. La pêche industrielle ne représente que 15 % des captures et est essentiellement tournée vers l’exportation (Figure 1).
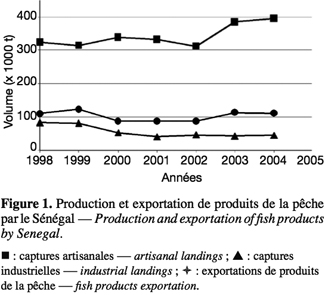
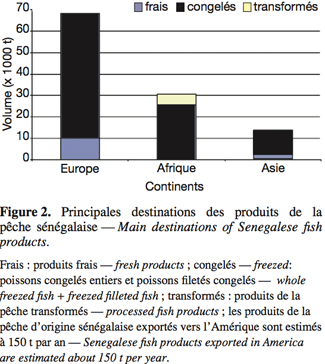
21L’Europe est la principale destination des produits de la pêche sénégalaise. Elle absorbe à elle seule environ 52 % des exportations (DOPM, 2004). En 2003, la production totale de poissons maritimes est estimée à 444 111 tonnes, tandis que les exportations s’élèvent à 95 675 tonnes, soit 21,5 % de la production totale. Les produits frais représentent environ 8 % des exportations contre 75 % pour les produits congelés, 11 % pour les produits en boites (conserves et farines de poissons) et 6 % pour les produits transformés artisanalement (Figure 2). La valeur totale des exportations de produits de pêche a été estimée à 164 milliards de F CFA (environ 250.380.000 €) en 2003 (DOPM, 2004). En ce qui concerne les exportations de produits transformés, pour l’Europe, les produits sont essentiellement issus de la transformation industrielle (97 %), tandis que pour l’Afrique, les produits issus de la transformation artisanale sont dominants (75 %).
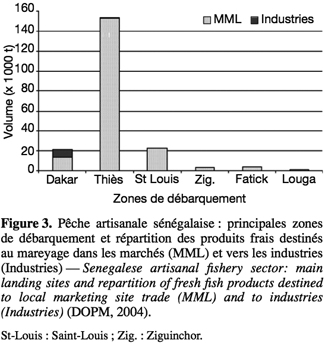
22Au Sénégal, la pêche artisanale draine 85 % de la production de poissons maritimes (DOPM, 2004). Elle permet le ravitaillement des marchés locaux et ceux de pays limitrophes (Mauritanie, Mali, Guinée-Bissau), d’Afrique Centrale (Cameroun, République Démocratique du Congo) et d’Afrique de l’Ouest (Burkina Faso) (DOPM, 2004).
23Le poisson constitue également la première source de protéines animales pour les populations au Sénégal. La moyenne nationale de la consommation de poisson par habitant est estimée à 28,1 kg par an, loin devant la viande (17,1 kg par an) (FAO, 2004).
4.2. Pêche artisanale au Sénégal
24Principaux sites de débarquement et de commercialisation. Les principaux centres de pêche se trouvent dans les régions de Thiès (M’Bour), de Dakar et de Saint-Louis (Figure 3). Le marché du poisson frais est très important. Parmi les sites de commercialisation du pays, le marché central de Dakar est le plus important. Il reçoit des produits en provenance de toutes les régions maritimes du Sénégal, ainsi que de pays limitrophes (Mauritanie, Gambie et Guinée). Il constitue également un lieu d’éclatement de ces produits vers les marchés de l’intérieur du pays.
25Conditionnement du poisson et transformations artisanales. Selon Gram (1992), le niveau de la microflore des poissons pêchés sur les côtes de Dakar atteint 106 à 107 ufc.g-1. La flore dans les poissons est très sensible au traitement par le froid : la conservation des poissons dans de la glace (100 g de poisson par 100 g de glace) entraine une réduction immédiate du nombre de bactéries viables à 103-104 ufc.g-1 et sa stabilisation à cette valeur pendant 7 jours ; le niveau des bactéries psychrotrophes est estimé à 109 ufc.g-1 au bout de 3 à 4 semaines. Toutefois, dans la majorité des sites de débarquement et de commercialisation, le poisson est conditionné à température ambiante ou dans de faibles quantités de glace (GRET et al., 1993). De plus, la préparation du poisson est réalisée dans des environnements généralement mal adaptés du point de vue sanitaire (Figure 4) (Diei-Ouadi, 2005).

26La transformation artisanale est une filière essentiellement occupée par les femmes ; elle absorbe 30 à 40 % des débarquements de la pêche artisanale, auxquels s’ajoutent les invendus de la pêche industrielle (GRET et al., 1993), ce qui permet de valoriser et d’atténuer les pertes. Elle contribue également à l’approvisionnement régulier en protéines animales des populations de l’intérieur du pays. Les sites de transformation du poisson sont localisés le long des côtes sénégalaises (Dakar : Yoff, Thiaroye ; M'Bour : Mballing, Joal ; Ziguinchor, etc.). Elles sont pour la plupart faiblement aménagées, ce qui favorise la présence de mouches et d’insectes.
27Différents procédés conduisent à l’élaboration des produits traditionnels : Kéthiakh (sardinelle braisée, salée et sèchée), Sali (poisson salé et sèché), Tambadiang (petit poisson salé sèché entier, faisandé ou non), Guedj (poisson fermenté, salé et sèché), Yeet (gastéropode fermenté sèché), Yokhoss (huitre sèchée), Touffa (gastéropode fermenté sèché), Métorah (poisson fumé à chaud puis sèché), Yoss (poisson juvénile sèché) (Figure 5). Les quantités de sels incorporés peuvent atteindre 30-40 % du poids du poisson (GRET et al., 1993).
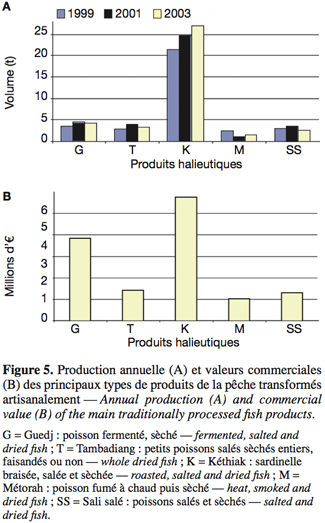
28Du fait des saveurs exceptionnelles qu’ils présentent, ces produits sont très appréciés par une bonne partie des populations en Afrique de l’Ouest et Centrale, où ils constituent une part non négligeable des besoins en protéines alimentaires (Fellows, 1997). Ils sont également une source importante de devises pour les populations des zones côtières au Sénégal (GRET et al., 1993).
29Fermentation traditionnelle des produits marins au Sénégal. La fermentation des produits de la pêche est une pratique très ancienne et largement répandue dans le monde, mais particulièrement diffusée en Europe et en Asie (Bourgeois et al., 1996). En Asie, les produits de la fermentation se présentent sous forme de pâtes ou de liquide « nuocnam ». Certains procédés font intervenir un ensemencement en ferments et/ou l'addition d'une source de carbone fermentescible tel que du glucose ou du riz cuit (Bourgeois et al., 1996).
30En Afrique, peu de données existent sur les caractéristiques de la fermentation. Il s’agit généralement de fermentations spontanées, réalisées par simple incubation des poissons crus (parfois additionnés de sel ou d’eau de mer) aux températures ambiantes pouvant atteindre ou même dépasser 30 °C (Anihouvi et al., 2005). La figure 6 présente le procédé traditionnel de transformation du poisson par fermentation suivie de salage et sèchage au Sénégal. Le produit obtenu appelé « Guedj » est typique par le fait qu’il garde sa texture comme dans le cas du Colombo en Inde (Bourgeois et al., 1996).
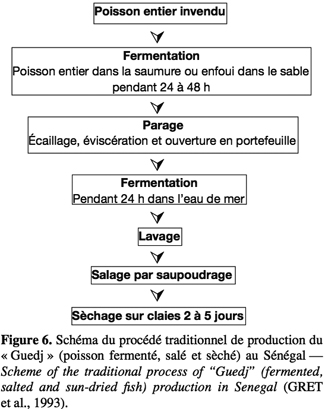
31La connaissance scientifique sur les changements biochimiques et microbiologiques au cours de la fermentation traditionnelle du poisson demeure limitée et les résultats publiés sont parfois contradictoires (GRET et al., 1993). La nature spontanée de la fermentation laisse présager des niveaux de pH élevés dans les produits. Selon Gram (1992), le stockage du poisson aux températures ambiantes entraine une augmentation relativement importante de bactéries Gram- telles que les entérobactéries et Shewanella putrefaciens dans les produits. De plus, l’eau de mer utilisée comme ingrédient dans certains procédés traditionnels de fermentation peut être une source potentielle de bactéries pathogènes incluant Clostridium sp. et Vibrio sp.
4.3. Problématique de la salubrité des produits de la mer locaux
32La pêche constitue un secteur vital pour le Sénégal. Cependant, les contraintes socio-économiques entravent la modernisation du secteur. La nature artisanale de la production pose des problèmes tant hygiéniques qu’économiques et toxicologiques qui entravent le développement de la filière. Les acteurs de la filière artisanale, à majorité constitués de femmes, utilisent différentes techniques traditionnelles de préparation du poisson incluant la fermentation pour étendre la durée de conservation des captures et limiter les pertes qui sont estimées à près de 25 % (GRET et al., 1993).
33La tendance dans les procédés traditionnels de transformation consiste à incorporer du chlorure de sodium en grandes quantités (30-40 %) afin de réduire la prolifération des microorganismes.
34De nos jours, il y a une forte tendance à réduire la quantité de sel dans les produits carnés pour des considérations tant technologiques que sanitaires (Kanner et al., 1991). Les bactéries lactiques sont largement utilisées pour la conservation du lait, de la viande, des céréales et des légumes. L’applicabilité des bactéries lactiques acidifiantes et/ou bactériocinogènes dans la production de produits de la mer élaborés pour des durées de conservation plus ou moins longues et moins salés, a été largement démontrée au cours de ces dernières décennies. Certaines des stratégies développées ne nécessitent pas d’équipements lourds ni de dépense énergétique élevée et pourraient être adaptées dans la conservation du poisson au Sénégal, en particulier dans la préparation du poisson fermenté et/ou salé et sèché.
5. Utilisation des bactéries lactiques et/ou bactériocines dans les produits de la mer
5.1. Caractéristiques taxonomiques des bactéries lactiques
35A quelques exceptions près, les bactéries lactiques ont pour principales caractéristiques d’être des microorganismes Gram+, généralement immobiles, asporulés, anaérobies mais aérotolérants. Elles ne possèdent ni catalase (certaines possèdent une pseudocatalase), ni nitrate réductase, ni cytochrome oxydase et ont besoin de glucides fermentescibles pour leur croissance. Le produit du catabolisme du glucose est principalement de l’acide lactique (bactéries homofermentaires) ou de l’acide lactique, du CO2 et de l’éthanol ou de l’acide acétique ou les deux (bactéries hétérofermentaires). La teneur en guanine et cytosine (G+C) de leur ADN est inférieure à 50 %.
36Le développement des techniques moléculaires de taxonomie a profondément modifié la classification des bactéries par l’introduction d’un critère lié à leur phylogénie. L’analyse des séquences des ARNr 16S et 23S, respectivement d’environ 1 500 et 2 900 nucléotides chez les procaryotes (Guiraud, 1993), révèle que ces molécules présentent des régions hautement conservées qui déterminent la fonctionnalité du ribosome. Les régions variables témoignent de mutations randomisées qui ont eu lieu au cours du temps. Elles permettent, par comparaison, d’établir un degré de parenté entre deux organismes (Woese, 1987).
37L’utilisation couplée de critères phylogénétiques et phénotypiques ou taxonomie polyphasique permet de différencier au sein du groupe des bactéries lactiques les genres Streptococcus, Lactoccoccus, Vagococcus, Enterococcus, Pediococcus, Oenococcus, Tetragenococcus, Leuconostoc, Weissella, Lactobacillus et Carnobacterium (Vandamme et al., 1996).
5.2. Propriétés technologiques des bactéries lactiques
38Les bactéries lactiques ont été traditionnellement utilisées dans la conservation de nombreux aliments et jouent un rôle important dans la fabrication des fromages et des produits fermentés. Ces bactéries présentent des propriétés inhibitrices envers la flore d’altération et la flore pathogène, grâce à la production de métabolites (acides organiques, peroxyde d’hydrogène) et à la production de bactériocines ou à leur compétition écologique vis-à-vis des nutriments (O’Sullivan et al., 2002 ; Dortu et al., 2009).
5.3. Utilisation des souches bactériennes acidifiantes comme ferment
39Les produits à base de poisson fermentés par utilisation des bactéries lactiques incluent les sauces fermentées à base de poisson en Asie du Sud-Est, les ensilages de poisson et les produits d'humidité intermédiaire du type surimi (Bourgeois et al., 1996). La conservation repose principalement sur l’abaissement du pH du poisson de 6,5 à 4,9-5,3, gamme de pH susceptible d’assurer la stabilité des produits carnés.
40L'addition d'une source de carbone fermentescible dans le poisson s'impose généralement, les quantités d'acide lactique nécessaires à l’abaissement du pH sont plus importantes que dans le cas de la fermentation des végétaux, en raison du pouvoir tampon du milieu. Les souches bactériennes acidifiantes les plus couramment utilisées incluent Lc. plantarum, Lactobacillus acidophilus, Pediococcus halophilus et Pediococcus acidilactici (Bourgeois et al., 1996).
41Sur base des modèles scandinaves de préparation de filets de saumon crus fermentés (gravlax) et de canapés de poissons crus fermentés (i-suchis), on envisage actuellement la fermentation lactique dans un but exclusif de conservation prolongée des produits de la mer en rayons frais.
42L’inoculation de hachis de thon avec des cultures individuelles de Lactobacillus plantarum, Pediococcus pentosaseus et Leuconostoc mesenteroides, à la concentration de 107 ufc.g-1, permet de contrôler la croissance des bactéries d’altération et pathogènes, entrainant une extension de la durée de conservation sur 4 semaines à 8 °C (Glatman et al., 2000).
43Le fumage à froid est une méthode traditionnelle de préparation de produits à base de poisson élaborés pour de courtes durées de conservation. Ces produits sont généralement emballés sous vide. Les facteurs qui empêchent la prolifération microbienne sont le sel, la réduction de l’activité de l’eau, le stockage à froid et la concentration limitée en oxygène.
44Les principaux dangers bactériologiques associés aux poissons fumés à froid sont des bactéries pathogènes capables de croître sous les températures de réfrigération, à l’instar de Listeria monocytogenes et Clostridium botulinum (Huss et al., 1995).
45L’inoculation de ces produits avec des cultures individuelles de Lactobacillus sake, Pediococcus acidilactici à la concentration de 107 ufc.g-1 combinée à un ajout de glucose à 1 % permet de mieux contrôler les bactéries d’altération et pathogènes, entrainant ainsi une meilleure conservation sur 42 jours à 3 °C (Pejätä et al., 2000).
5.4. Utilisation des bactéries bactériocinogènes comme cultures protectrices
46Comme dans le cas de la fermentation lactique, cette stratégie consiste à inoculer les préparations de produits halieutiques élaborées pour de courtes durées de conservation avec des cultures vivantes de bactéries lactiques. La concentration de l’inoculum est généralement inférieure à 106 ufc.g-1, niveau admis pour les produits non fermentés. La souche bactérienne appliquée doit être capable de produire sa bactériocine sans modifier les propriétés organoleptiques des produits (Rodgers, 2001).
47Plusieurs travaux ont montré une amélioration du contrôle de Listeria monocytogenes dans des filets de saumon fumés à froid, en y inoculant des cultures individuelles à base de souches de Lactococcus sp., Lactobacillus sp. et Carnobacterium sp. bactériocinogènes. Ceci entraine comme résultat l’extension de la durée de conservation des produits à la gamme de températures de 3-8 °C (Wessels et al., 1996 ; Brillet et al., 2004 ; 2005 ; Ghalfi et al., 2006a ; 2006b). Cette stratégie a des effets bactériostatiques sur la souche pathogène précitée. Mais les effets bactériostatiques sont limités voire inexistants lorsque le niveau de la flore totale contaminante atteint ou dépasse 104 à 105 ufc.g-1 (Brillet et al., 2005).
5.5. Utilisation de l’acide lactique et/ou des bactériocines comme additifs
48L’utilisation de l’acide lactique et/ou des bactériocines des bactéries lactiques comme additifs est l’une des principales réponses de l’industrie de production de produits de la mer élaborés pour de courtes durées de conservation, à la forte demande de produits « naturels » (légèrement salés) et salubres. La bactériocine la plus utilisée à cet effet est sans doute la nisine qui est produite par certaines souches de Lactococcus lactis. Cette bactériocine est acceptée comme additif alimentaire dans plusieurs pays (Delves-Broughton, 1990 ; De Vuyst et al., 1994).
49L’addition combinée d’acide lactique dérivant de cultures de Lactobacillus sp. et de filtrat de petit lait dérivant d’une culture de Lc. lactis productrice de nisine, dans du hachis de poisson ou dans du poisson fumé à froid, permet de retarder la croissance de la flore. Cela entraine comme résultat l’extension de la durée de conservation d’une dizaine de jours à 3 °C (Nykänen et al., 1998 ; 1999).
50La nisine n’inhibe pas la croissance des bactéries Gram- mais a une activité bactéricide sur les bactéries Gram+ (Delves-Broughton, 1990), alors que l’acide lactique inhibe ces deux types de bactéries. L’addition de ces deux substances dans le poisson permet d’augmenter l’effet antibactérien dirigé envers toute la flore.
51Einarsson et al. (1995) ont rapporté des extensions plus ou moins significatives de la durée de conservation de crevettes (Pandalus borealis) à 4,5 °C en ajoutant dans la saumure (10 %, v/v) du surnageant de culture sans cellule de Lc. lactis (21 jours) ou de Lb. bavaricus (6 jours), une solution bactéricide de nisine commerciale (21 jours) ou une solution de carnocine (3 jours). Ces auteurs ont aussi observé une augmentation de 49 jours de la durée de conservation des crevettes en combinant le sel avec du sorbate de sodium et du benzoate de potassium en concentration finale de 1 000 ppm chacun. Toutefois, la tendance chez les consommateurs est une préférence de produits préservés en utilisant des conservateurs d’origine biologique.
52Des résultats similaires relatifs à l’inhibition de L. monocytogenes sur chair de crabes ont été publiés par Degnan et al. (1994) : l’imprégnation de la chair de crabes préalablement déshydratée (par pression) pendant 30 à 60 sec avec une solution de pédiocine (Alta 2341, Quest International, Sydney Australia) et de nisine (Alpin and Barett, Trowbridge, UK) ou de surnageant de culture bactéricide d’Enterococcus faecium, permet d’inhiber la croissance de L. monocytogenes pendant 6 jours à 4 °C.
53Ghalfi et al. (2006a) ont montré que l’ajout d’une suspension bactéricide à base de bactériocines adsorbées aux débris de la membrane des cellules productrices (Yang et al., 1992 ; Benkerroum et al., 2002) dans des filets de saumon fumés à froid permet de contrôler la croissance de L. monocytogenes dans le produit pendant 22 jours de conservation à 4 °C.
54Par ailleurs, Al-Holy et al. (2004) ont montré que le traitement par imprégnation pendant 40 sec des œufs de saumon (Oncorhynchus keta) et d’esturgeon (Acipenser transmontanus) avec une solution de nisine (500 UI.ml-1) salée (NaCl, 3 %), permet de réduire de moitié la durée de réduction décimale à 65 °C (D65 °C) de Listeria innocua ATCC5142 de même que le contrôle de la flore mésophile totale contaminante.
55Toutefois, certains auteurs ont montré que l’activité antibactérienne des bactériocines dans les aliments dépend de plusieurs facteurs physico-chimiques et biologiques tels que le pH, les forces intra et intermoléculaires, la température et les microorganismes cibles. Les bactériocines sont généralement moins efficaces dans les aliments, comparées à leur activité bactéricide sur milieux de cultures synthétiques.
56Une des principales limites de l’application des bactériocines dans les produits carnés et sans doute de la mer est leur susceptibilité à être dégradée par les enzymes protéolytiques (Kouakou et al., 2008). Elles peuvent aussi s’oxyder ou interagir avec les constituants (molécules lipidiques et protéiques) des aliments (Aasen et al., 2003), les rendant non disponibles pour tuer les microorganismes cibles. D’autre part, leur efficacité dépend aussi de la bactériocine utilisée ou de la méthode de conservation (Shelef et al., 1993). Certaines combinaisons de diverses bactériocines avec d’autres conservateurs chimiques peuvent être synergiques ou antagonistes (Gänzle et al., 1999). Par conséquent, des tests sont nécessaires pour évaluer l’efficacité d’une bactériocine donnée dans un système alimentaire donné.
6. Conclusion
57Au Sénégal, le poisson est la principale source de protéines animales des populations. La production artisanale du poisson pose des problèmes tant hygiéniques qu’économiques et toxicologiques. En réponse aux contraintes socio-économiques entravant la conservation industrielle des captures, l’utilisation des bactéries lactiques et/ou de leurs métabolites antibactériens comme barrières additionnelles au chlorure de sodium peut constituer un moyen de donner une valeur ajoutée aux produits locaux des populations sénégalaises et d’Afrique subsaharienne.
58Les bactéries lactiques productrices de bactériocines pourraient être utilisées comme ferment (avec ajout d’hydrates de carbone) pour améliorer le contrôle de la flore d’altération et pathogène des poissons (entérobactéries, Staphylococcus sp. et Bacillus sp.) par la production in situ d’acides organiques et de bactériocines. Une seconde alternative d’application est l’utilisation de solutions bactéricides plus ou moins purifiées issues des cultures de ces souches lactiques. Ces deux types de traitements combinés à un sèchage peuvent être utilisés pour améliorer la qualité microbiologique et diététique des produits halieutiques fermentés locaux.
Bibliographie
Aasen I.M. et al., 2003. Interactions of the bacteriocins sakacin P and nisin with food constituents. Int. J. Food Microbiol., 87, 35-43.
Al-Holy M. et al., 2004. Inactivation of Listeria innocua in nisin-treated salmon (Oncorhynchus keta) and sturgeon (Acipenser transmontanus) caviar heated by radiofrequency. J. Food Prot., 67(9), 1848-1854.
Anihouvi V.B., Hounhouigan J.D. & Ayernor G.S., 2005. Production et commercialisation du « lanhouin », un condiment à base de poisson fermenté du golfe du Bénin. Cah. Agric., 14(3), 323-330.
Benkerroum N., Oubel H. & Lben M., 2002. Behavior of Listeria monocytogenes and Staphylococcus aureus in yogurt fermented with a bacteriocin-producing thermophilic starter. J. Food Prot., 65(5), 799-805.
Bourgeois C.M. & Larpent J.P., 1996. Microbiologie alimentaire, aliments fermentés et fermentations alimentaires. 2e éd. Paris : Lavoisier Technique & Documentation.
Boyd L.C., Green D.P. & Lepors L.A., 1992. Quality changes of pond raised hybrid striped bass during chillpack and refrigerated storage. J. Food Sci., 57, 59-62.
Brillet A. et al., 2004. Biodiversity of Listeria monocytogenes sensivity to bacteriocin-producing Carnobacterium strains and application in sterile cold-smoked salmon. J. Appl. Bacteriol., 97, 1029-1037.
Brillet A. et al., 2005. Effect of inoculation of Carnobacterium divergens V41, a biopreservative strain against Listeria monocytogenes risk, on the microbiological, chemical and sensory quality of cold-smoked salmon. Int. J. Food Microbiol., 104(3), 309-324.
Bulushi I.A., Poole S., Deeth H. & Dykes G., 2009. Biogenic amines in fish: roles in intoxication, spoilage, and nitrosamine formation. Review. Crit. Rev. Food Sci. Nutr., 49(4), 369-377.
Cheftel J.C. & Cheftel H., 1992. Introduction à la biochimie et à la technologie des aliments. 7e éd. Paris : Lavoisier Technique & Documentation.
Commission européenne, SANCO, 1999. Rapport final concernant une mission sur le Sénégal, n°1123/99, http://ec.europa.eu/food/fs/inspections/vi/reports/senegal/index_en.html, (18/01/2009).
De Vuyst L. & Vandamme E.J., 1994. Antimicrobial potential of lactic acid bacteria. In: De Vuyst L. & Vandamme E.J., eds. Bacteriocins of lactic acid bacteria: microbiology, genetics and applications. London: Blackie Academic and Professional, 91-142.
Degnan A.J. et al., 1994. Evaluation of lactic acid bacterium fermentation products and food grade chemicals to control Listeria monocytogenes in blue crab (Callinectes sapidus) meat. Appl. Environ. Microbiol., 60, 3198-3203.
Delves-Broughton J., 1990. Nisin and its uses as a preservative. Food Technol., 11, 100-112.
Diei-Ouadi Y., 2005. Minced sardinella fillets in fish-landing and marketing sites in Senegal. In: FAO fisheries Circular no 999:FIIU/C999(EN). Roma: FAO.
DOPM (Direction des pêches maritimes), 2004. Résultats généraux des pêches maritimes. Rapport 2004. Dakar : Ministère de l’Économie maritime & des Transports maritimes internationaux.
Dortu C. & Thonart P., 2009. Les bactériocines des bactéries lactiques : caractéristiques et intérêts pour la bioconservation des produits alimentaires. Biotechnol. Agron. Soc. Environ., 13(1), 143-154.
Einarsson H. & Lauzon H.L., 1995. Biopreservation of brined shrimp (Pandalus borealis) by bacteriocins from lactic acid bacteria. Appl. Environ. Microbiol., 61, 669-676.
FAO (Organisation des Nations unies pour l’Agriculture et l’Alimentation), 2004. Pêche de capture et production de l’aquaculture, http://faostat.fao.org/site/339default.aspx, (10/05/08).
Fellows P., 1997. Traditional foods processing for profits. In: Fellow P., ed. Meat, fish and dairy products. London: Intermediate Technology Publication, 163-191.
Gänzle M.G., Hertel C. & Hammes W.P., 1999. Antimicrobial activity of bacteriocin-producing cultures in meat products: modelling of the effect of pH, NaCl, and nitrite concentrations on the antimicrobial activity of sakacin P against Listeria ivanovii DSM20750. Fleischwirstchaft, 76, 409-412.
Gelman A., Drabkin V. & Glatman L., 2001. Evaluation of lactic acid bacteria, isolated from lightly preserved fish products, as starter cultures for new fish-based food products. Innovative Food Sci. Emerging Technol., 1, 219-226.
Ghalfi H. et al., 2006a. Bacteriocin activity by Lactobacillus curvatus CWBI-B28 to inactivate Listeria monocytogenes in cold-smoked salmon during 4°C storage. J. Food Prot., 59(5), 1066-1071.
Ghalfi H. et al., 2006b. Antilisteria bacteriocin-producing strain of Lactobacillus curvatus CWBI-B28 as a preservative culture in bacon meat and influence of fat and nitrite on bacteriocins production and activity. Food Sci. Technol. Int., 12(4), 325-333.
Glatman L., Drabkin V. & Gelman A., 2000. Using lactic acid bacteria for developing novel fish food products. J. Sci. Food Agric., 80, 375-380.
Gram L., 1992. Spoilage of three Senegalese fish species stored in ice at ambient temperature. In: Bligh E.H., ed. Seafood science and technology. Oxford, UK: Fishing News Books Blackwell, 225-233.
Gram L. & Dalgaard P., 2002. Fish spoilage bacteria-problems and solutions. Curr. Opin. Biotechnol., 13, 262-266.
GRET (Groupe de Recherche et d’Échanges Technologiques) & CTA (Centre Technique de Coopération Agricole et Rurale), 1993. Conserver et transformer le poisson. Paris : le Point Sur.
Guiraud J.P., 1993. Génétique microbienne. Bases théoriques et introduction aux applications pratiques. Paris : Lavoisier Technique & Documentation.
Guiraud J.P., 1998. Microbiologie alimentaire. Paris : Dunod.
Huss H.H., 1986. Fresh fish: quality and quality changes. A training programme on fish technology and quality control. Roma: FAO/DANOA.
Huss H.H., Embarek P.K.B. & Jeppesen V.F., 1995. Control of biological hazards in cold smoked salmon production. Food Control, 6(6), 335-340.
Huss H.H., Reilly A. & Ben Embarek P.K., 2000. Prevention and control of hazards in seafood. Food Control, 11(2), 149-156.
Kanner J., Harel S. & Joffe R., 1991. Lipid peroxidation of muscle food as affected by NaCl. J. Agric. Food Chem., 39, 1017-1024.
Kolodziejska I. & Sikorski Z.E., 1995. Muscle cathepsins of marine fish and invertebrates. Pol. J. Food Nutr. Sci., 45, 3-10.
Kouakou P. et al., 2008. Enhancing the antilisterial effects of Lactobacillus curvatus CWBI-B28 in pork meat and cocultures by limiting bacteriocin degradation. Meat Sci., 80(3), 640-648.
Nykänen A., Lapvetäinen A., Hietanen R.M. & Kallio H., 1998. Effects of whey, whey-derived lactic acid and sodium lactate on the surface microbial counts of rainbow trout packed in vacuum pouches. Lebensm. Wiss. Technol., 31, 361-365.
Nykänen A., Lapvetäinen A., Hietanen R.M. & Kallio H., 1999. Applicability of lactic acid and nisin to improve the microbiological quality of cold-smoked rainbow trout. Z. Lebensm. Unters. Forsch. A, 208(2), 116-120.
O'Sullivan L., Ross R.P. & Hill C., 2002. Potential of bacteriocin-producing lactic acid bacteria for improvements in food safety and quality. Biochimie, 84, 593-604.
Petäjä E., Eerola S. & Petäjä P., 2000. Biogenic amines in cold-smoked fish fermented with lactic acid bacteria. Eur. Food Res. Technol., 210, 280-285.
Rodgers S., 2001. Preserving non-fermented refrigerated foods with microbial cultures: a review. Trends Food Sci. Technol., 12, 276-284.
Schillinger U., Geisen R. & Holzapfel W.H., 1996. Potential of antagonistic microorganisms and bacteriocins for the biological preservation of foods. Trends Food Sci. Technol., 7, 58-64.
Shelef L.A. & Seiter J.A., 1993. Indirect antimicrobials. In: Branen A.L. & Davidson P.M., eds. Antimicrobials in food. New York, USA: Marcel Dekker, 539-569.
Spanggaard B. et al., 2001. The probiotic potential against vibriosis of the indigenous microflora of rainbow trout. Environ. Microbiol., 3, 755-765.
Stansby M., 1962. Proximate composition of fish. In: Heen E. & Kreuzer R., eds. Fish in nutrition. London: Fishing News (Books) Ltd.
Vandamme P. et al., 1996. Polyphasic taxonomy, a consensus approach to bacteria systematics. Microbiol. Rev., 60(2), 407-438.
Wessels S. & Huss H.H., 1996. Suitability of Lactococcus lactis subsp. lactis ATCC 11454 as a protective culture for lightly preserved fish products. Food Microbiol., 13, 323-332.
Woese C.R., 1987. Bacterial evolution. Microbiol. Rev., 51, 221-271.
Yang R., Johnson M.C. & Ray B., 1992. Novel method to extract large amounts of bacteriocins from lactic acid bacteria. Appl. Environ. Microbiol., 58, 3355-3359.

