- Accueil
- Volume 14 (2010)
- numéro spécial 2
- Étude de stratégies de culture de Dunaliella tertiolecta combinant haute densité cellulaire et accumulation de lipides en vue de produire du biodiesel
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Étude de stratégies de culture de Dunaliella tertiolecta combinant haute densité cellulaire et accumulation de lipides en vue de produire du biodiesel

Résumé
Les microalgues sont des organismes qui utilisent la lumière comme source d’énergie pour fixer le CO2. Certaines espèces peuvent accumuler, dans des conditions de croissance particulières, le carbone sous forme de lipides (triglycérides). Cette propriété a conduit les scientifiques à envisager la culture de ces microorganismes pour produire des biocarburants. L’étude décrite ci-après se base sur la culture d’une microalgue verte biflagellée, Dunaliella tertiolecta, mesurant entre 5 et 10 µm. Deux objectifs sont étudiés conjointement dans cet article : d’une part, la cinétique de croissance et d’autre part, la teneur en huile. Un plan d’expériences a été mené afin d’étudier l’influence de la concentration en chlorure de sodium, en nitrate et en phosphate du milieu de culture sur ces deux aspects. La technique de fluorescence permet de déterminer la quantité d’huile au sein des microalgues. Les résultats expérimentaux ont mis en évidence que favoriser la cinétique de croissance se fait au détriment de la teneur en huile. L’effet d’une carence spontanée induisant un déficit en un nutriment essentiel stoppe la croissance mais favorise le stockage de lipides. L’effet permet d’atteindre des pourcentages massiques en lipides de l’ordre de 19 %.
Abstract
Study of culture strategies of Dunaliella tertiolecta combining high cell density and accumulation of lipids to produce biodiesel. Microalgae are photosynthetic organisms using light to capture CO2. Some species can accumulate, under specific growth conditions, carbon as lipids (triglycerides). This characteristic led the scientists to think about cultivating this microorganism to produce biodiesel. The following study is based on the cultivation of a 5 to 10 µm length green biflagellate microalgae, Dunaliella tertiolecta. Two objectives will be presented in parallel: first, the growth rate and then the oil content. An optimal design of experiment has been used to determine the influence of the concentration of different components in the medium as sodium chloride, nitrate and phosphate on the two responses. The fluorescence technique allows measurements of oil level within the microalgae. The experimental results show that increasing the growth leads to an oil level reduction. The sudden depletion (stress) of an essential nutrient stops the growth but increase the lipids’ storage. A nitrate stress allows lipid dry mass percentage of around 19%.
Table des matières
1. Introduction
1Certaines microalgues peuvent accumuler jusqu’à environ 50 % de leur poids sec en lipides. Il existe entre 200 000 et plusieurs millions d’espèces, ce qui constitue un réel potentiel pour la recherche et pour l’industrie. Suite au choc pétrolier de 1973, des travaux ont été entrepris par le National Renewable Energy Laboratory afin de produire du biocarburant à partir de microalgues (Cadoret et al., 2008). Le projet a été arrêté en 1996 suite à la non-rentabilité du procédé. Actuellement, cet axe de recherches a été relancé à travers le monde en réponse à la prise de conscience de l’impact de la production massive des gaz à effets de serre sur le climat et à l’augmentation vertigineuse du prix du baril de pétrole. La reprise des recherches dans ce domaine permet aussi d’envisager une autonomie énergétique vis-à-vis des pays producteurs de pétrole. Grâce à un rendement de croissance beaucoup plus élevé que les espèces oléagineuses terrestres, la culture des microalgues permet d’augmenter le rendement de production d’huile par unité de surface d’un facteur 30. De plus, lors de leur croissance, les algues fixent en moyenne 1,8 kg de CO2 par kg de biomasse.
2L’espèce étudiée dans nos laboratoires, Dunaliella tertiolecta (UTEX LB 999), peut stocker jusqu’à 35 % de son poids sec en lipides (Packer, 2009) avec un taux de croissance élevé (temps de doublement de 4,8 heures) (Cadoret et al., 2008). C’est une microalgue verte biflagellée mesurant entre 5 et 10 µm de diamètre.
2. Matériel et méthodes
2.1. Conditions de cultures
3Les microalgues de type Dunaliella tertiolecta (UTEX LB 999, University of Texas) sont cultivées en Erlenmeyers de 250 ml. Les lampes utilisées pour la culture sont des lampes « fluora 77 » de 18 et 36 W (Osram). L’intensité lumineuse reçue par les microalgues est constante sur une période de 24 h et est d’environ 7 200 lx. Les cultures sont placées sur une table orbitale afin d’éviter la sédimentation (170 tours.min-1) et de s’assurer une répartition « homogène » de l’éclairage. Il n’y a pas de bullage d’air ni de CO2.
2.2. Milieu de culture standard
4Le milieu de culture (1 l) de Dunaliella tertiolecta contient : NaCl (10 g), NaNO3 (1 g), KNO3 (1 g), MgCl2.6H2O (1,5 g), MgSO4.7H2O (0,28 g), KCl (0,2 g), CaCl2.2H2O (0,2 g), NaHCO3 (43 mg), KH2PO4 (35 mg), Na2EDTA (60 mg), FeCl3.6H2O (7,76 mg), MnCl2.4H2O (3,28 mg), ZnCl2 (400 µg, UCB), CoCl2.6H2O (160 µg, UCB), Na2MoO4.2H2O (320 µg, UCB), Vitamine B12 (20 µg, Sigma Aldrich). Tous ces produits viennent de chez Merck, sauf indiqué.
2.3. Mesure de croissance
5La croissance des microalgues est mesurée grâce à un turbidimètre (Optek, Fundalux) travaillant dans le domaine du proche infrarouge dans la gamme des longueurs d’ondes de 840 à 910 nm. La longueur du trajet optique est de 10 mm.
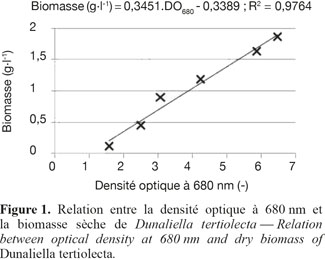
6La spectrophotométrie est également utilisée à la longueur d’onde de 680 nm (Shimadzu UV mini 1240). La linéarité de la relation entre la densité optique à 680 nm (DO680) et la biomasse a été démontrée pour Dunaliella tertiolecta (Figure 1).
2.4. Détermination de la teneur en lipides par fluorescence
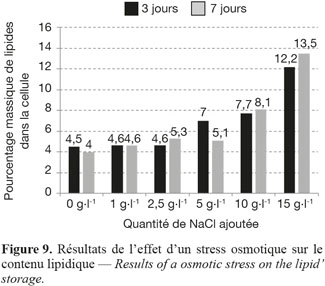
7La mesure des lipides est réalisée grâce à un spectrofluorimètre (Varioskan, Thermo Electron Corporation). Le Nile Blue A Oxazone (Figure 2) ou Rouge du Nil (NR) (C20H18N2O2, Sigma Aldrich) est un fluorochrome liposoluble utilisé pour déterminer la quantité de lipides neutres présents au sein des microalgues. Le rouge du Nil est dilué (1 mg.ml-1) dans du diméthylsulfoxyde (DMSO).
8Microscopie optique. L’efficacité du marqueur, contrôlée par l’utilisation d’un microscope optique équipé d’un module de fluorescence (Zeiss Primo Star iLED), permet de visualiser la pénétration du colorant dans les cellules de Dunaliella tertiolecta (Figure 3).

9Calibration de la quantification lipidique par fluorescence. D’après Huang et al. (2009), la calibration peut être réalisée grâce à un standard de trioléine (C57H104O6, Sigma Aldrich).
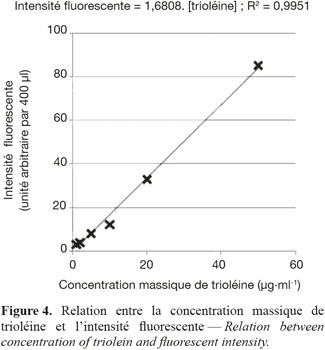
10La trioléine est ajoutée à un même volume de chloroforme avant d’être diluée dans de l’isopropanol pour réaliser des solutions intermédiaires de 0,1, 0,2, 0,5 et 1,0 mg.ml-1. L’isopropanol est utilisé comme solvant car il possède un très faible bruit de fond en fluorescence. Les standards de travail de 1,0, 2,0, 5,0 et 10,0 µg.ml-1 sont préparés en portant 100 µl de chacun des intermédiaires à 10 ml avec de l’eau déminéralisée. Les standards sont ensuite agités vigoureusement (vortex) pendant 1 min pour former des micelles de taille identique. Les longueurs d’onde d’excitation et d’émission sont respectivement de 480 et 625 nm. La calibration réalisée entre la masse de trioléine et l’intensité fluorescente est linéaire et reproductible (Figure 4).
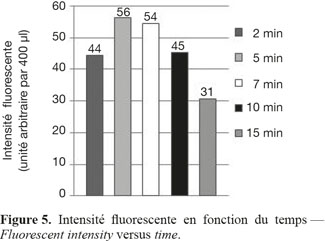
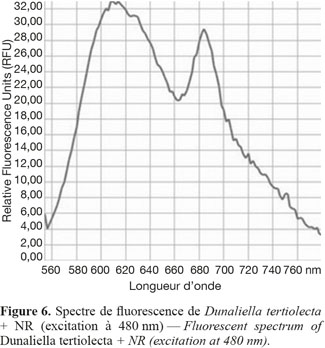
11Mesure des teneurs en lipides dans les échantillons de microalgues. Dix µl de colorant (1 mg.ml-1 NR dans DMSO) sont ajoutés à un volume de 5 ml de suspension algale. Suite aux essais d’optimisation, il est conseillé d’attendre 5 min avant de réaliser la mesure de fluorescence afin que le signal soit maximum et de permettre d’avoir la meilleure sensibilité (Figure 5). Le spectre de fluorescence (excitation = 480 nm) met en évidence un pic correspondant aux lipides neutres (vers 610 nm) et un pic d’auto-fluorescence de la chlorophylle à 685 nm (Figure 6).
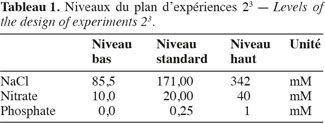
12Plan d’expériences à deux niveaux et trois facteurs. Afin de déterminer comment optimiser la croissance des microalgues ainsi que leur pourcentage en lipides, un plan d’expériences 23 a été mené. La teneur de trois éléments essentiels du milieu de culture a été modifiée : la concentration en NaCl, en nitrate et en phosphate. Le tableau 1 indique les niveaux inférieurs et supérieurs pour les trois facteurs retenus.
13La réponse du plan d’expériences s’exprime sous la forme de l’équation :
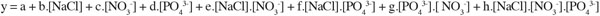
14Cette méthodologie expérimentale devrait permettre de mettre en évidence d’éventuelles interactions ou des effets antagonistes entre les paramètres étudiés.
15Les expérimentations ont été réalisées suivant la matrice d’expériences présentée au tableau 2.
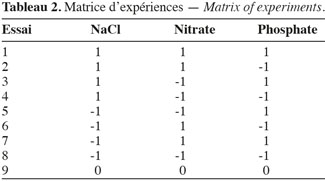
16Pour réaliser les cultures, 20 ml d’inoculum sont ajoutés à 150 ml de milieu de culture modifié suivant la théorie du plan d’expériences. Les densités optiques des échantillons sont mesurées dès la mise en route des cultures permettant un suivi des phases de croissance. Les réponses en augmentation de biomasse et en pourcentage lipidique sont mesurées après 20 jours de culture.
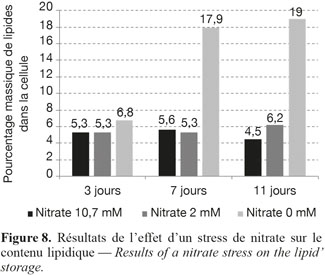
17Augmentation du contenu lipidique via un stress osmotique et un stress en nitrate. Pour augmenter la fraction lipidique au sein de microalgues, il faut appliquer un stress. Les conditions du milieu de culture sont modifiées brutalement. Les stress identifiés peuvent être de différentes natures : carences en éléments nutritifs ou choc osmotique. Ces conditions de stress conduisent à un arrêt de la croissance. Lors de ces essais, les milieux de culture standard ont été modifiés en fin de croissance exponentielle. La première expérience a consisté à modifier la concentration en NaCl du milieu, avec des ajouts de 0 à 15 g.l-1 de NaCl supplémentaires. Les mesures du contenu lipidique ont été réalisées par fluorescence après 3 et 7 jours de stress. La seconde expérience a consisté à modifier la concentration en nitrate du milieu de culture (diminution de la concentration en nitrate de 10 mM à 0 mM) et à mesurer les lipides après 3, 7 et 11 jours.
3. Résultats et discussion
3.1. Résultats du plan d’expériences
18Réponse en augmentation de biomasse. La biomasse est mesurée à T0, premier jour de l’inoculation, ainsi que tous les 2 jours pendant 20 jours. L’augmentation de biomasse est exprimée en soustrayant la biomasse obtenue au temps T0 à celle mesurée après 20 jours de culture (Tableau 3). Ce paramètre, représentant l’évolution de la biomasse, a été privilégié par rapport à un paramètre purement cinétique (e.g. le taux de croissance durant la phase de croissance exponentielle de la culture).

19Ce choix est motivé par le fait que la culture microalgale est divisée en plusieurs phases (latence, croissance exponentielle, phase stationnaire, mort cellulaire), chacune de durée variable suivant la composition du milieu de culture. De plus, grâce à ce paramètre, l’aspect « productivité de biomasse » (mg.h-1) peut être facilement observable. Les courbes de croissance des neuf essais sont reportées sur la figure 7. La matrice d’expériences ainsi que la matrice des réponses permettent d’exprimer les coefficients de l’équation associée au plan d’expériences (Tableau 4).
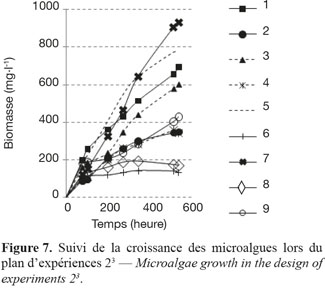
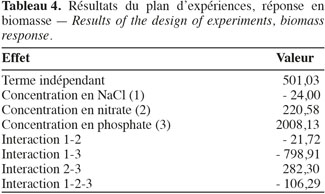
20Les résultats permettent de dégager une tendance par rapport aux facteurs indépendants. Il est préférable de diminuer la concentration de NaCl pour favoriser la croissance. Au contraire, un milieu riche en nitrate et en phosphate accélère significativement la cinétique de croissance.
21Réponse en contenu lipidique. Le contenu lipidique a été mesuré après 20 jours de croissance. Grâce à l’équation de calibration des lipides (Figure 4) et grâce à la relation linéaire entre la biomasse et la densité optique (Figure 1), l’intensité fluorescente peut être transformée en % de lipides par rapport au poids sec de biomasse (Tableau 5).
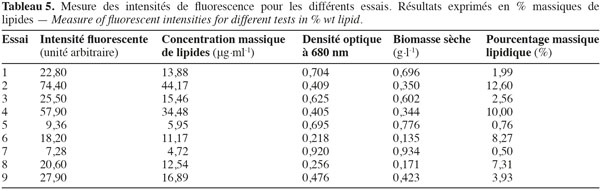
22Les résultats permettent de dégager des tendances pour les trois facteurs étudiés (Tableau 6). En effet, augmenter la concentration en NaCl du milieu favorise un contenu lipidique important. En revanche, les facteurs « nitrate » et « phosphate » agissent négativement sur la teneur en huile. L’essai 2 a permis d’atteindre le pourcentage lipidique le plus élevé de 12 %. Favoriser la croissance se fait au détriment du pourcentage en huile dans les microalgues et inversement. C’est pourquoi il peut être intéressant d’imaginer une culture en deux phases : une phase de croissance exponentielle suivie ensuite d’une phase de stockage de carbone sous forme de lipides grâce à l’effet d’un stress.

3.2. Résultats des effets des stress
23La concentration en nitrate a été diminuée à 10,7 mM, 2 mM et 0 mM. Les mesures des lipides ont été réalisées après 3, 7 et 11 jours. Après 11 jours dans un milieu où la concentration en nitrate est nulle, les microalgues ont stocké jusqu’à 19 % de lipides (Figure 8).
24Dans le milieu de culture standard (10 g.l-1 de NaCl), une quantité variable (de 0 g.l-1 à 15 g.l-1) de NaCl a été ajoutée au milieu. Les mesures des lipides ont été réalisées après 3 et 7 jours de stress. L’ajout de 15 g.l-1 de NaCl au milieu de culture standard permet d’atteindre des concentrations massiques de lipides de 13,5 % (Figure 9). Cette augmentation est expliquée par le fait que l’algue réagit au stress osmotique par la production de quantités massives de glycérol servant à synthétiser les triglycérides et les phospholipides microalgaux. En effet, le glycérol intracellulaire sert à équilibrer osmotiquement le sel extracellulaire (Chitlaru et al., 1991).
4. Conclusion
25Les conditions de cultures des microalgues doivent être contrôlées afin d’atteindre des cinétiques de croissance et des contenus lipidiques importants. Cet aspect est primordial pour obtenir une productivité en lipides intéressante. On remarque que les facteurs favorables à la croissance (nitrate et phosphate) limitent la quantité d’huile au sein des microalgues. Augmenter la concentration en NaCl du milieu favorise le stockage des lipides mais limite fortement la croissance. Il faut trouver un compromis entre croissance et richesse en lipides. Si les microalgues subissent un stress en fin de croissance exponentielle, elles peuvent augmenter leur contenu lipidique et atteindre 13 % de lipides en cas de stress osmotique et 19 % de lipides en cas de stress de nitrate. Des études ultérieures permettront d’optimiser ces teneurs. Ainsi, dans une première approche, la culture des microalgues pourrait être scindée en deux phases : une phase de croissance rapide dans un milieu riche en nitrate et une phase de stockage des lipides après augmentation de la salinité du milieu.
Bibliographie
Cadoret J.-P. & Bernard O., 2008. La production de biocarburant lipidique avec des microalgues : promesses et défis. J. Soc. Biol., 202(3), 201-211.
Chitlaru E. & Pick U., 1991. Regulation of glycerol synthesis in response to osmotic changes in Dunaliella. Plant Physiol., 96(1), 50-60.
Elsey D., Jameson D., Raleigh B. & Cooney M.J., 2006. Fluorescent measurement of microalgal neutral lipids. J. Microbiol. Methods, 68(3), 639-642.
Huang G.-H., Chen G. & Chen F., 2009. Rapid screening method for lipid production in alga based on Nile red fluorescence. Biomass Bioenergy, 33, 1386-1392.
Priscu J., Priscu L. & Palmisano A., 1990. Estimation of neutral lipid levels in Antarctic sea ice microalgae by Nile red fluorescence. Antarct. Sci., 2(2), 149-155.
Packer M., 2009. Algal capture of carbon dioxide; biomass generation as tool for greenhouse gas mitigation with reference to New Zealand energy strategy and policy. Energy Policy, 37, 3428-3437.
Pour citer cet article
A propos de : Amaury Massart
Université de Mons (UMONS). Faculté polytechnique. Service de Chimie et Biochimie appliquées. Rue de l’Épargne, 56. B-7000 Mons (Belgique). E-mail : amaury.massart@umons.ac.be
A propos de : Élise Aubry
Université de Mons (UMONS). Faculté polytechnique. Service de Chimie et Biochimie appliquées. Rue de l’Épargne, 56. B-7000 Mons (Belgique).
A propos de : Anne-Lise Hantson
Université de Mons (UMONS). Faculté polytechnique. Service de Chimie et Biochimie appliquées. Rue de l’Épargne, 56. B-7000 Mons (Belgique).






