- Accueil
- Volume 14 (2010)
- numéro 4
- La respiration hétérotrophe dans les sols agricoles : description des facteurs importants et comparaison de modèles semi-mécanistes existants
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
La respiration hétérotrophe dans les sols agricoles : description des facteurs importants et comparaison de modèles semi-mécanistes existants

Notes de la rédaction
Reçu le 11 janvier 2010, accepté le 30 mars 2010
Résumé
La respiration hétérotrophe du sol est un processus complexe. De nombreux facteurs biotiques et abiotiques le gouvernent. Dans les écosystèmes agricoles plus particulièrement, l'influence des pratiques culturales et du mode de gestion des résidus de culture est considérable. Les effets du changement climatique sur le phénomène sont encore incertains. Certaines études tendent à montrer qu'une rétroaction positive pourrait s'exercer. Une meilleure connaissance des mécanismes à l'œuvre est donc indispensable. Pour y arriver, de nombreux modèles semi-mécanistes ont été mis au point. L'amélioration majeure qu'ils ont développée par rapport aux modèles empiriques consiste à répartir le contenu en carbone du sol en différents réservoirs pour décrire plus précisément la dynamique du carbone dans le sol. Cette répartition s'effectue sur base des constantes de décomposition. Cependant, les principaux modèles actuels couvrent des échelles spatio-temporelles très variées et présentent de nombreuses différences entre eux. Celles-ci sont mises en évidence dans cet article et les principaux facteurs directeurs du processus sont également passés en revue.
Abstract
Soil heterotrophic respiration in croplands: description of important driving factors and comparison of existing semi-mechanistic models. Soil heterotrophic respiration is a complex process which is governed by many biotic and abiotic factors. More specifically, in the agricultural ecosystems the influence of cultural practices and residue management techniques is important. Global change impacts on the phenomenon are still unclear. Some studies suggest that a positive feedback may occur. Therefore, it is necessary to get to a better knowledge of the mechanisms involved. To reach this goal, many semi-mechanistic models have been developed. Compared to empiric models, they allow a better understanding of soil carbon dynamics by distributing total soil carbon content into several pools. This carbon allocation is based on carbon decomposition constants. However, these models work at very different spatial and temporal scales and many differences exist between them. These ones are put forward in this paper and the main biotic and abiotic soil heterotrophic respiration factors are also described.
Table des matières
1. Introduction
1Les sols contiennent des quantités considérables de carbone organique (Amundson, 2001) et en constituent le principal réservoir terrestre (Schrumpf et al., 2008). Les rôles écologiques et économiques exercés par ces quantités de matière organique sont importants (Lal, 2004). Les sols sont soumis à des pertes de carbone importantes via les phénomènes de décomposition de la matière organique (Rees et al., 2005), d'érosion et de lessivage des composés organiques. Le changement climatique pourrait notamment conduire à une augmentation très significative des émissions de carbone dues au processus de décomposition, auquel est associée la respiration hétérotrophe du sol (Schrumpf et al., 2008). La structure du sol pourrait en être affectée de manière importante. Cela rendrait les sols plus facilement érodables et plus sensibles à la compaction et au ruissellement (Lal, 2004). Prévenir et contrer la diminution des stocks de carbone du sol permettraient donc d'éviter une aggravation du changement climatique (Paustian et al., 2000 ; Lal, 2004 ; IPCC, 2007).
2Le développement de l'agriculture constitue un des enjeux les plus importants des années à venir sur les plans économique, environnemental et social. En Europe, un tiers des terres émergées y est vouée (Smith et al., 2005). Les agrosystèmes peuvent subir des pertes de carbone du sol, dont l'importance à l'échelle régionale semble largement dépendante des pratiques culturales utilisées et des conditions pédo-climatiques (Vleeshouwers et al., 2002 ; Goidts et al., 2007).
3La quantification du flux de dioxyde de carbone (CO2) émis par les écosystèmes lors de la respiration hétérotrophe du sol est rendue difficile par la complexité de ce processus. Celle-ci est liée à la grande diversité biologique des sols, à l'hétérogénéité de ce milieu ainsi qu'aux variations pédoclimatiques et culturales rencontrées d'un site à l'autre et même au sein d'un site donné. De plus, outre ces nombreux facteurs qui influencent la production du CO2, la quantification du flux de respiration du sol est rendue encore plus complexe par la diffusion subséquente du CO2 produit dans les pores du sol, qui est elle-même influencée par les conditions pédoclimatiques et culturales. Il faut cependant bien noter que l'échelle spatio-temporelle à laquelle le phénomène est étudié conditionne tant le mode d'action des différents facteurs précités que l'importance du processus de diffusion du CO2. En effet, ce dernier processus est surtout important à considérer lorsque l'étude est réalisée à une échelle très fine.
4La complexité du processus rend difficiles les approches strictement mécanistes. Ainsi, de très nombreux modèles empiriques ont été utilisés à différentes échelles pour décrire la dépendance de la respiration du sol essentiellement à la température (e.g. Lloyd et al., 1994) et à la teneur en eau du sol (e.g. Bunnell et al., 1977). À côté de cette approche empirique, pour améliorer la compréhension du processus et prédire l'évolution des stocks de carbone du sol, de nombreux modèles semi-mécanistes ont été mis au point. Ils permettent de simuler la dynamique du carbone dans les sols et la production de CO2 qui lui est associée. Par rapport aux modèles empiriques, l'apport principal de ces modèles est de répartir le carbone du sol en différentes entités (réservoirs) discrètes. Celles-ci sont constituées sur base de la résistance des composés carbonés à l'action microbienne, qui détermine leur temps de résidence dans le sol (Shibu et al., 2006). Les modèles suivants sont parmi les plus utilisés : CENTURY (Parton et al., 1987), DNDC (Li et al., 1992), ROTHC (Coleman et al., 1997; 1999), PATCIS (Fang et al., 1999), DAYCENT (Parton et al., 1998) et CN-SIM (Petersen et al., 2005). Citons également le modèle CASTANEA (Dufrêne et al., 2005) dont le module décrivant la dynamique du carbone du sol a été adapté d'après CENTURY. Certains de ces modèles permettent uniquement de simuler la dynamique de la matière carbonée dans le sol (ROTHC et PATCIS), d'autres lient les cycles du carbone et de l'azote (CN-SIM et DNDC) et les plus complexes modélisent les interactions entre le sol, les végétaux et l'atmosphère (CENTURY, DAYCENT et CASTANEA). Les modèles de cette dernière catégorie possèdent chacun leur propre sous-modèle de décomposition de la matière organique. Notons par ailleurs qu'il existe des modèles encore plus complexes (SOMKO, Gignoux et al., 2001 ; QSOIL, Ågren et al., 1996) dans lesquels la matière organique est scindée en une infinité de réservoirs. Ces modèles s'avèrent toutefois difficiles à paramétrer et à manipuler, en raison notamment de l'approche analytique qui y est développée.
5Les objectifs de cet article sont de passer en revue les facteurs importants intervenant dans le processus de décomposition de la matière organique, en particulier dans les sols agricoles et de comparer les principaux modèles semi-mécanistes qui permettent de quantifier le processus, afin de faire ressortir leurs spécificités et leurs limites.
2. Le processus de respiration hétérotrophe
2.1. Définition
6Dans les sols, la respiration hétérotrophe est le processus qui permet la décomposition de la litière (résidus de cultures en sol agricole) et de la matière organique du sol sous l'action des micro-organismes qui y vivent. En présence d'oxygène, l'assimilation et la dégradation du substrat par les micro-organismes s'accompagnent d'une production de CO2. Elle constitue avec la respiration autotrophe du sol – racinaire et mycorhizienne – une des deux sources majeures de CO2 en provenance du sol. La respiration totale du sol est la somme de ces deux composantes de production, auxquelles il convient d'associer le transport par diffusion du CO2 au travers des pores du sol (Perrin, 2005 ; Luo et al., 2006). Ce dernier processus n'est explicitement pris en compte que lors de la description du mécanisme à une échelle très fine. Les contributions respectives des composantes de respiration hétérotrophe et autotrophe peuvent varier de manière importante (de 10 à 90 %) d'un site à l'autre (Hanson et al., 2000).
2.2. Les agents du processus
7Les agents de décomposition de la matière organique sont multiples, allant de la microflore (bactéries et champignons au sens large) à la microfaune (invertébrés) (Wardle et al., 1997). La composition des communautés microbiennes (Rousk et al., 2007) ainsi que la chronologie d'intervention des différents types d'organismes vivants (Wardle et al., 1997) sont notamment liées à la composition biochimique des résidus végétaux (§ 2.3.). La quantité de micro-organismes dans les sols est considérable. Par exemple, Aon et al. (2001) ont dénombré un nombre important de bactéries (107-108 CFU.g sol-1)1 et de champignons (104-105 CFU.g sol-1) présents dans un sol agricole argentin. La majeure partie des micro-organismes du sol (80-85 %) sont dans un état de dormance (Stenström et al., 2001 ; Fontaine et al., 2003) et ne sont donc pas actifs. L'apport de matière organique fraiche au sol stimulerait l'activation de ces derniers. Cette modification à court terme du taux de décomposition de la matière organique en réaction à un apport de substrat est appelée le « priming effect » (Fontaine et al., 2003).
8L'activité microbienne du sol se fait par le biais des enzymes que les micro-organismes produisent et qui participent activement aux processus de recyclage et de transformation de la matière organique (Aon et al., 2001). Une fois libérées dans les sols, les enzymes sont adsorbées sur les particules minérales sous l'action de forces électrostatiques, ioniques, covalentes, hydrophobes et de liaisons hydrogènes et de van der Waals. Leur efficacité catalytique, en plus d'être dépendante de la température, peut alors varier selon la nature et les propriétés du substrat auquel elles se lient (Huang et al., 2005). La stabilité biologique de la matière organique est ainsi contrôlée à la fois par sa structure chimique et par les nombreux mécanismes de protection que peut offrir la matrice du sol (Baldock et al., 2000) (§ 2.3.).
2.3. De multiples facteurs agissant à différentes échelles spatiales et temporelles
9La complexité des sols, les interactions entre leurs composantes (Huang et al., 2005) ainsi que les nombreux facteurs intervenant dans la respiration hétérotrophe rendent difficile la compréhension de ce processus. Les facteurs influençant la respiration hétérotrophe du sol sont les variables climatiques, dont essentiellement la température et l'humidité du sol, la texture et la structure du sol, le pH, la disponibilité en oxygène et dans les agrosystèmes plus particulièrement, le type de culture, la composition biochimique des résidus qui en proviennent et les pratiques culturales du sol. Dans un modèle de respiration du sol, la négligence d'un de ces éléments peut conduire à de mauvaises estimations des flux émis par le sol (Kirschbaum, 1995).
10La température du sol. La température est la variable directrice la plus importante du processus de respiration hétérotrophe (Kirschbaum, 1995 ; 2006 ; Kätterer et al., 1998). La sensibilité de ce mécanisme à la température pourrait bien être un élément déterminant dans l'évolution future des échanges de dioxyde de carbone entre les écosystèmes et l'atmosphère (Davidson et al., 2006 ; Luo et al., 2006). Kirschbaum (1995 ; 2006) a notamment suggéré que l'assimilation de carbone était moins sensible à la température que la respiration hétérotrophe, ce qui pourrait amener le réchauffement climatique à induire une rétroaction positive des écosystèmes. Des contradictions apparaissent quant à la sensibilité à la température de la décomposition des différentes formes de carbone du sol. La majorité des études ne considèrent aucune différence de sensibilité à la température entre les formes de carbone présentes dans le sol (Townsend et al., 1997). Toutefois, certains travaux, dont celui mené par Giardina et al. (2000) suggèrent que la décomposition du carbone stable du sol, qui en constitue la majeure partie, serait insensible à la température, induisant des réponses à la température différentes selon le type de carbone.
11La plupart des études montrent que la respiration augmente exponentiellement avec la température dans une plage de valeurs usuelles. Il est généralement admis (Kätterer et al., 1998) que le Q10 (facteur par lequel le taux de respiration est multiplié pour une augmentation de la température de 10 °C) a une valeur proche de 2. Davidson et al. (2006) insistent toutefois sur le fait que le Q10 n'est égal à 2 que dans des conditions bien spécifiques, liées principalement au substrat, aux conditions expérimentales et à la gamme des températures considérées.
12Un optimum est généralement atteint pour une température proche de la limite supérieure des températures rencontrées sur un site donné (Ratkowsky et al., 1983 ; Pietikäinen et al., 2005). La température optimale peut varier selon le type d'écosystème. Par exemple, dans une expérimentation menée en laboratoire sur des sols forestiers et agricoles originaires du Sud de la Suède, Pietikäinen et al. (2005) ont estimé qu'elle pouvait varier entre 25 et 30 °C. Passé l'optimum, le taux de respiration commence à diminuer et à partir de 45-50 °C, températures auxquelles la majorité des enzymes commencent à être dénaturées, la respiration chute abruptement.
13Il faut bien garder à l'esprit que, d'un site à l'autre et même au sein d'un site donné, la dépendance de la respiration à la température peut être influencée par d'autres facteurs tels que la disponibilité en substrat et la teneur en eau (Gu et al., 2004 ; Kirschbaum, 2006).
14La teneur en eau du sol. La teneur en eau du sol est un autre facteur environnemental très important. Dans la majorité des cas, la forme de la réponse à la teneur en eau est telle que les flux de CO2 sont faibles aux faibles teneurs en eau, atteignent un optimum pour des teneurs en eau proches de celles correspondant à la capacité au champ et diminuent ensuite drastiquement aux teneurs en eau élevées (Luo et al., 2006). Les effets d'un stress hydrique sont essentiellement de réduire la disponibilité en substrat et d'induire la dormance ou la sporulation, de telle manière que l'activité des micro-organismes est réduite. Pour des teneurs en eau optimales, les pores du sol sont remplis environ à moitié d'eau et d'air, la première occupant la microporosité et le dernier la macroporosité. Cela permet tant l'accès des micro-organismes au substrat que la diffusion de l'oxygène à ceux-ci. Enfin, lorsque l'eau occupe toute la porosité, la diffusion de l'oxygène jusqu'aux micro-organismes n'est plus suffisante.
15En général, sur une même journée, les variations de teneur en eau dans le sol sont faibles. En revanche, des évènements pluvieux ponctuellement importants survenant après de longues périodes sèches sont suivis de pics d'émission de CO2 en provenance du sol (Kelliher et al., 2004 ; Xu et al., 2004). Ces derniers s'expliquent d'abord par un phénomène d'évacuation du CO2 contenu dans les pores du sol, puis par la remise en solution du substrat qui contribue à la réactivation du processus de respiration.
16Par ailleurs, il semble clair que les facteurs température et humidité du sol interagissent ; la teneur en eau du sol, au travers de la disponibilité du substrat, exercerait en effet un rôle important dans la réponse de la respiration à la température (Liu et al., 2006).
17La texture et la structure du sol. Les sols sont des systèmes ouverts complexes, échangeant continuellement de l'énergie et de la matière avec l'extérieur (Batjes et al., 1992). Ce sont des milieux très hétérogènes qui sont composés d'une matrice solide, constituée de matière minérale et de matière organique, d'une microporosité et d'une macroporosité déterminées respectivement par la texture et la structure du sol et de multiples organismes vivants.
18La texture du sol joue un rôle important dans l'accessibilité des micro-organismes à la matière organique qu'ils décomposent. En particulier, les particules d'argile, en se liant à la matière organique, protègent celle-ci des attaques enzymatiques (Baldock et al., 2000 ; Huang et al., 2005). La texture du sol influence également la diffusion du CO2 dans le sol en interagissant de manière importante avec la teneur en eau (Bouma et al., 2000). En un site donné, la texture du sol ne se modifie pas ou très peu au cours du temps. Elle peut cependant différer d'un point à l'autre d'une même parcelle et, en un même point, évoluer avec la profondeur du sol.
19La texture du sol détermine notamment les pratiques agricoles à utiliser, les deux facteurs jouant un rôle sur la structure du sol. Cette dernière, qui conditionne notamment le niveau d'aération et de drainage de celui-ci, influence fortement les taux de respiration des micro-organismes décomposeurs (Parton et al., 1987). La structure du sol est affectée par les pratiques culturales (voir ci-dessous) et par la qualité et la quantité de matière organique qui déterminent les possibilités d'agrégation des particules de sol. Dès lors, la structure du sol peut varier tant d'un site à l'autre qu'au sein d'un même site lorsque des changements de gestion du sol et des résidus de culture interviennent.
20La quantité et la composition biochimique des résidus de culture et du substrat disponible dans le sol. Les matières assimilables proviennent directement des résidus de culture (feuilles, tiges et racines restant sur le champ à la récolte), de la matière organique contenue dans le sol ou encore de substances relâchées par les racines au cours du développement de la culture (rhizodéposition) (Rees et al., 2005). Une limitation en substrat se traduit par une diminution des taux de respiration.
21La dynamique de décomposition de la matière organique dépend pour beaucoup de sa composition biochimique (Rousk et al., 2007). En effet, les proportions entre les composés hydrosolubles tels que le glucose et les acides aminés, les hydrates de carbone polymérisés tels que la cellulose et l'hémicellulose, et la lignine (polymère complexe constitué de cycles aromatiques) influencent l'activité des organismes décomposeurs (Yadav et al., 2007). Ces différents composés n'ont pas les mêmes temps de dégradation et peuvent varier de 14 jours pour l'hémicellulose à 500 jours pour la lignine (Killham, 1994). De plus, les proportions de ces composés et donc les temps de dégradation varient en fonction du type de plante, des organes et des stades phénologiques (Henriksen et al., 1999). Ainsi, les variations de ce facteur se marquent non seulement entre sites et régions agricoles, mais également d'une année à l'autre dans le cas de rotations culturales.
22Les composés hydrosolubles sont utilisés en premier par les micro-organismes ou sont perdus par lessivage. Ensuite sont dégradées successivement l'hémicellulose, la cellulose et la lignine. Différentes bactéries et champignons, et les enzymes spécifiques qu'ils produisent, sont impliqués dans la dégradation des celluloses et hémicelluloses. La lignine, elle, est presque exclusivement dégradée par des champignons (Baldock et al., 2000 ; Yadav et al., 2007). La concentration en lignine dans le matériau augmente progressivement (Baldock et al., 2000), ce qui ralentit le taux de décomposition au fil du temps (Yadav et al., 2007).
23L'azote, le phosphore et le soufre, autres éléments présents dans le sol et dans différents composés des résidus végétaux tels que les polysaccharides, les protéines, les acides aminés, les graisses et les cires jouent également un rôle dans la dégradation de la matière organique. L'azote est d'ailleurs souvent considéré comme un élément limitant dans les processus de décomposition (Jalota et al., 2006 ; Yadav et al., 2007) car il est nécessaire au métabolisme des organismes décomposeurs. Toutefois, la compréhension de l'interaction entre la disponibilité en azote et les composés carbonés aux différentes étapes de la décomposition reste encore à améliorer (Wang et al., 2004).
24Les pratiques culturales. Les pratiques agricoles influencent de manière importante les stocks de carbone organique des sols (Paustian et al., 2000 ; West et al., 2002 ; Lal, 2004 ; Chatskikh et al., 2008 ; La Scala et al., 2008) qui représentent de 80 à 103 t C·ha-1 pour les terres cultivées à l'échelle mondiale (Lal, 2004). Le type de travail du sol, le recours à des cultures intermédiaires, l'intensité de culture, le type de rotation culturale, l'apport de fertilisants organiques ou encore la restitution des résidus au sol sont autant de pratiques susceptibles de jouer un rôle sur la séquestration du carbone dans le sol (Arrouays et al., 2002). Hutchinson et al. (2007) estiment qu'en Europe, les terres agricoles pourraient séquestrer entre 90 et 120 Tg C par an si les meilleures techniques culturales existantes étaient appliquées. La quantification des effets induits par le recours à ces différentes pratiques est toutefois affectée par de larges incertitudes (Hutchinson et al., 2007) qui peuvent notamment être liées aux variations climatiques et à la méthode d'estimation utilisée.
25Les sols soumis à des labours réguliers (conventional tillage) voient leur contenu en carbone diminuer à long terme (Chatskikh et al., 2008 ; La Scala et al., 2008), cet effet dépendant toutefois des conditions pédoclimatiques. Le labour désagrège les particules de sol, réduit la protection des composés organiques labiles et rapidement assimilables vis-à-vis des attaques enzymatiques et augmente la porosité du sol, ce qui améliore la diffusion des gaz et l'accès à l'eau pour les micro-organismes décomposeurs (La Scala et al., 2008). Les techniques du labour réduit (reduced tillage) et du non-labour (no-till) favoriseraient au contraire l'augmentation (ou au moins la stabilisation) de la quantité de carbone dans des sols précédemment soumis au labour (Paustian et al., 2000 ; Chatskikh et al., 2008). Par exemple, West et al. (2002) rapportent qu'en moyenne aux États-Unis, le passage du labour (conventional tillage) au non-labour (no-till) conduirait à une séquestration de carbone d'environ 0,3 ± 0,1 t C·ha-1 par an. Leur estimation prend également en compte la réduction de la consommation d'énergies fossiles liée au passage du labour conventionnel au non-labour. Cependant, le non-labour aurait des effets différents d'un site à l'autre et dans les cas de sols mal drainés à fine texture, il pourrait se révéler peu avantageux (Hutchinson et al., 2007). Le non-labour serait notamment susceptible de générer plus d'émissions de N2O (Six et al., 2004 ; Chatskikh et al., 2008). Pour Six et al. (2004), il est important de considérer les impacts de cette technique sur la variation des émissions des trois gaz à effet de serre les plus importants (CO2, N2O, CH4). En effet, si à court terme le non-labour permet d'augmenter la séquestration de carbone, les grandes quantités de N2O émises causent une rétroaction positive sur le climat. Ce serait seulement au bout d'une dizaine d'années et sous des conditions climatiques humides que le recours à cette technique permettrait d'atténuer le changement climatique.
26La restitution des pailles est une autre technique qui pourrait contribuer à réduire les pertes de carbone des écosystèmes. En effet, selon Paustian et al. (2000), laisser les résidus de culture sur le champ permet de maximiser l'utilisation de l'eau, de la chaleur et des éléments nutritifs. Cela est susceptible de favoriser l'augmentation de la production de biomasse par rapport à la décomposition et donc, de conduire à une accumulation de carbone plus importante dans le sol à long terme. Globalement, le stockage de carbone lié à l'enfouissement des pailles se situe aux alentours de 0,1 à 0,25 t C·ha-1 par an (Arrouays et al., 2002).
3. Modéliser le processus de respiration hétérotrophe
3.1. Échelles spatio-temporelles
27Actuellement, pour simuler la dynamique du carbone dans le sol (ainsi que le processus de respiration hétérotrophe qui y est associé), il existe de nombreux modèles de différents niveaux de complexité (Shibu et al., 2006). Ils couvrent des échelles spatio-temporelles très variables d'un modèle à l'autre (Figure 1) qui sont liées aux objectifs poursuivis par les études auxquelles ils se rapportent.
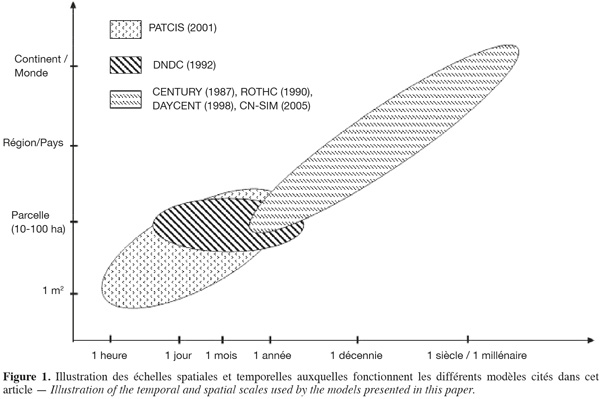
28Par l'utilisation de modèles travaillant à large échelle, on cible essentiellement des objectifs de réalisation de bilans carbonés des sols et de prédiction de l'évolution de ces stocks face à des changements de climat, de sol ou de modes de gestion des écosystèmes. En revanche, si l'objectif est d'améliorer la compréhension des mécanismes à l'œuvre, le modèle doit fonctionner à une échelle suffisamment fine pour intégrer les différentes composantes à l'œuvre.
29Dans cette dernière catégorie, on citera le modèle PATCIS qui fonctionne avec un pas de temps horaire ou journalier et quantifie les flux de respiration au niveau d'une parcelle forestière (Fang et al., 1999).
30À l'autre extrême, les modèles CENTURY et ROTHC utilisent des données mensuelles et leurs simulations peuvent couvrir des périodes allant de plusieurs siècles à plusieurs millénaires. Entre les deux, DAYCENT et CN-SIM adoptent un pas de temps journalier qui permet de mieux rendre compte des variations rapides des flux de gaz traces (CO2, NO2, NOx et CH4) avec la température et l'humidité du sol (Parton et al., 1998 ; Petersen et al., 2005).
3.2. Dynamique du carbone dans le sol
31La plupart des modèles dynamiques actuels sont construits selon une approche compartimentale, où la matière organique du sol est répartie dans différents réservoirs caractérisés par des temps de résidence différents (Gu et al., 2004 ; Zimmermann et al., 2007).
32Toutefois, la répartition de la matière organique entre ces réservoirs est difficilement vérifiable expérimentalement (Petersen et al., 2005 ; Trumbore, 2006; Nieder et al., 2008) car elle ne correspond pas vraiment à une réalité physique mais à une commodité de raisonnement. Ceci contribue à rendre délicat le paramétrage de ces modèles (Nieder et al., 2008). Le nombre de réservoirs inclus dans un modèle donné résulte généralement d'un compromis entre le minimum nécessaire pour tenir compte des différents taux de décomposition de la matière organique et l'échelle temporelle des simulations envisagées (Shibu et al., 2006). Il peut varier de deux, pour les modèles décrivant la dynamique du carbone à court terme, à sept pour des études à long terme.
33La production de CO2 via les flux de respiration est associée aux transferts de carbone d'un réservoir à un autre. La variation du contenu en carbone de chaque réservoir est très généralement modélisée par une cinétique du 1er ordre (Équation 1)

où Cx, kx, Ax et 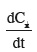
34sont respectivement le contenu en carbone du réservoir x [t C·ha-1], le taux de décomposition du réservoir x [par j], la quantité de carbone apportée au réservoir x [t C·ha-1 par jour] et la variation temporelle du contenu en carbone du réservoir x [t C·ha-1 par jour].
35Avec cette formulation, la biomasse d'organismes décomposeurs n'est pas explicitement prise en compte, ni l'interaction entre cette dernière et la quantité de substrat disponible (Wutzler et al., 2008).
36Se basant sur le fait que la décomposition de la matière organique est majoritairement due à l'activité des enzymes du sol (§ 2.2.), de plus récentes études préconisent de modéliser le processus via une cinétique enzymatique standard, du type Michaelis-Menten, afin d'arriver à décrire le processus de manière plus mécaniste (Davidson et al., 2006 ; Wutzler et al., 2008).
3.3. Influence de la qualité du substrat
37Le rapport C:N est fréquemment utilisé pour représenter de manière numérique la composition biochimique générale des plantes (Nicolardot et al., 2001). Plusieurs études ont toutefois suggéré que le rapport lignine:N était plus approprié (Wang et al., 2004 ; Jalota et al., 2006). Ce dernier est utilisé dans les modèles sous la forme d'une relation linéaire (CENTURY, ROTH-C) afin de répartir le carbone organique des résidus végétaux en ses composantes structurale et métabolique.
3.4. Influence de la texture du sol
38L'influence de la texture du sol et plus particulièrement de la fraction argileuse, se traduit généralement dans les modèles par un facteur multiplicatif des constantes de décomposition, qui rend compte de l'effet protecteur des particules d'argile sur les composés carbonés en décomposition. Ainsi, plus le sol contient d'argile, plus les taux de respiration sont diminués et plus les parts de carbone migrant vers les réservoirs lents augmentent (Parton et al., 1987 ; Coleman et al., 1997).
3.5. Fonctions de réponse à la température et à la teneur en eau
39Les modèles semi-mécanistes actuels utilisent des fonctions de réponse à la température et à la teneur en eau du sol qui se présentent sous la forme de facteurs multiplicatifs réducteurs du taux de décomposition maximum (Burke et al., 2003). Ces fonctions revêtent différentes formes dans les modèles cités plus haut (Figure 2 et Figure 3).
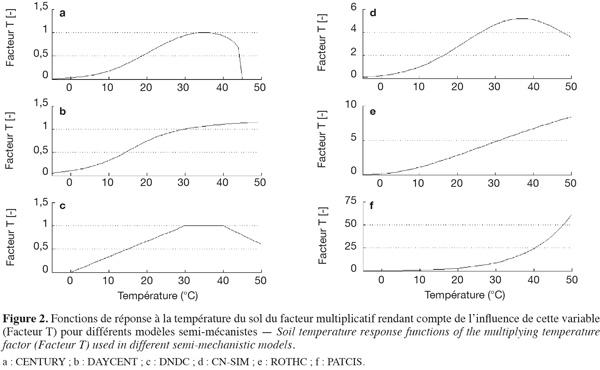
40Si toutes les courbes présentées ici tiennent bien compte de l'augmentation du taux de respiration avec la température (Figure 2), la forme de la relation reste un point de désaccord entre modèles (Burke et al., 2003). Des différences importantes peuvent ainsi être observées entre les résultats fournis par les modèles (Bauer et al., 2008). Toutefois, si l'approche intégrant une température optimale est plus proche de la réalité, cela ne signifie pas que ces courbes offrent nécessairement une meilleure quantification du phénomène. En effet, sous nos latitudes, la température excède rarement les 30-35 °C et en-dessous de ces températures-là, les courbes de forme purement exponentielle permettent une bonne quantification du processus.
41Étant donné la grande diversité des organismes décomposeurs du sol, la mise au point d'une relation flux-température qui traduirait le processus de manière mécaniste reste une tâche difficile.
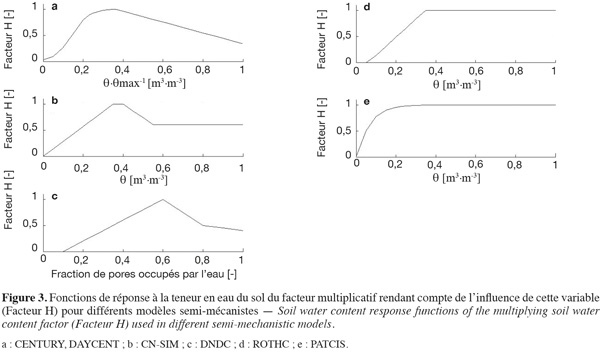
42Une représentation des fonctions de réponse à la teneur en eau utilisées dans les différents modèles est donnée à la figure 3. Les valeurs atteintes par ces fonctions sont comprises entre 0 et 1 pour tous les modèles considérés ici. Les variables indépendantes sont soit la teneur en eau volumique du sol (θv, [m3·m-3]), soit le potentiel hydrique du sol (Ψ, [Pa], utilisé dans CN-SIM mais qui est ici transformé en teneur en eau volumique pour faciliter la comparaison) ou encore la fraction des pores du sol occupés par l'eau [-].
3.6. Pratiques culturales
43Dans les modèles semi-mécanistes actuels, la prise en compte de l'influence des pratiques culturales et de la structure du sol qui leur sont liées se fait de manière tout à fait empirique. Ainsi, par exemple, Chatskikh et al. (2008) ont modifié CN-SIM (Petersen et al., 2005) pour tenir compte des pratiques culturales et en particulier des différentes techniques de labour. Le taux de décomposition de la matière organique y est multiplié par un « facteur de labour » dont la valeur résulte d'une calibration sur des données existantes. Leite et al. (2004) ont utilisé CENTURY, où le « facteur de labour » adopte empiriquement une valeur différente pour chaque réservoir, de manière à adapter l'influence des pratiques culturales au type de carbone considéré. L'étude de Leite et al. (2004), appliquée au milieu tropical, a révélé une bonne aptitude de CENTURY à refléter les changements de stocks de carbone inhérents à différentes pratiques culturales.
44La Scala et al. (2008) ont développé un modèle qui permet de suivre l'évolution temporelle (à court terme) de la quantité de CO2 émis par un sol nu labouré en fonction de celle produite par un sol non labouré. Le concept sous-jacent est que la rupture des agrégats du sol cause une libération de carbone.
4. Conclusion et perspectives
45La décomposition des résidus de culture et de la matière organique du sol est un processus complexe car il se déroule dans un milieu hétérogène et est contrôlé par de très nombreux facteurs biotiques et abiotiques qui interagissent. De plus, dans les agrosystèmes, les facteurs anthropiques jouent un rôle prépondérant.
46La température et l'humidité du sol sont les facteurs qui expliquent la plus large part des variations temporelles et spatiales de la respiration hétérotrophe d'un sol agricole. Pour cette raison, elles sont les variables explicatives de nombreux modèles empiriques mis au point pour quantifier le processus.
47Des modèles semi-mécanistes ont été mis au point afin de simuler la dynamique des composés carbonés dans le sol, essentiellement à long terme. La diversité de ces modèles tient au fait qu'ils couvrent des échelles spatio-temporelles parfois très différentes, de telle sorte que les processus ne sont pas intégrés de la même manière. L'amélioration majeure de ces modèles par rapport aux modèles empiriques consiste en la répartition du carbone total du sol en différents réservoirs sur base de la résistance des composés carbonés à l'action microbienne. Leur organisation en réservoirs les rend pratiques à manipuler et offre de réelles possibilités pour étudier l'influence de différentes pratiques culturales. Ils ont l'avantage de pouvoir, tout en restant dans les limites de leur conception, être adaptés à d'autres sites sans trop de difficultés. Cependant, la manière de répartir le carbone dans ces différentes entités reste actuellement un point critique qui nécessite d'être investigué plus amplement.
48À côté de l'amélioration de la connaissance des effets des pratiques culturales sur la dynamique du carbone dans les sols agricoles, la question de la sensibilité de la respiration hétérotrophe à la température constituera l'un des points les plus importants dans la compréhension de ce processus et de son évolution future (Davidson et al., 2006). De plus, la prise en compte des processus microbiologiques dans les modèles permettrait également d'améliorer la compréhension de la respiration des sols.
49Remerciements
50Cette étude est financée par le F.R.S-FNRS (Belgique).
Bibliographie
Ågren G. & Bosatta E., 1996. Theoretical ecosystem ecology: understanding element cycles. Cambridge, UK: Cambridge University Press.
Amundson R., 2001. The carbon budget in soils. Annu. Rev. Earth Planet. Sci., 29, 535-562.
Aon M.A. et al., 2001. I. Spatio-temporal patterns of soil microbial and enzymatic activities in an agricultural soil. Appl. Soil Ecol., 18, 239-254.
Arrouays D. et al., éds, 2002. Contribution à la lutte contre l'effet de serre. Stocker du carbone dans les sols agricoles de France ? Rapport d'expertise. Paris : INRA.
Baldock J.A. & Skjemstad J.O., 2000. Role of soil matrix and minerals in protecting natural organic materials against biological attack. Org. Geochem., 31, 697-710.
Batjes N.H. & Bridges E.M., 1992. A review of soil factors and processes that control fluxes of heat, moisture and greenhouse gases. Technical paper 23. Wageningen, The Netherlands: International Soil Reference and Information Centre.
Bauer J. et al., 2008. Sensitivity of simulated soil heterotrophic respiration to temperature and moisture reduction functions. Geoderma, 145, 17-27.
Bouma T.J. & Bryla D.R., 2000. On the assessment of root and soil respiration for soils of different textures: interactions with soil moisture contents and soil CO2 concentrations. Plant Soil, 227, 215-221.
Bunnell F.L., Tait D.E.N., Flanagan P.W. & Van Cleve K., 1977. Microbial respiration and substrate weight loss. I: a general model of the influences of abiotic variables. Soil Biol. Biochem., 9, 33-40.
Burke I.C. et al., 2003. Evaluating and testing models of terrestrial biogeochemistry: the role of temperature in controlling decomposition. In: Canham C.D., Cole J.J. & Lauenroth W.K., Models in ecosystem science. Princeton, NJ, USA: Princeton University Press.
Chatskikh D. et al., 2008. Effects of reduced tillage on net greenhouse gas fluxes from loamy sand soil under winter crops in Denmark. Agric. Ecosyst. Environ., 128, 117-126.
Coleman K. et al., 1997. Simulating trends in soil organic carbon in long-term experiments using ROTHC-26.3. Geoderma, 81, 29-44.
Coleman K. & Jenkinson D.S., 1999. ROTHC-26.3. A model for the turnover of carbon in soil. Model description and windows users guide. Harpenden, UK: IACR Rothamsted.
Davidson E.A. & Janssens I.A., 2006. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change. Nature, 440(9), 165-173.
Dufrêne E. et al., 2005. Modelling carbon and water cycles in a beech forest. Part I: model description and uncertainty analysis on modelled NEE. Ecol. Modell., 185, 407-436.
Fang C. & Moncrieff J.B., 1999. A model for soil CO2 production and transport. 1: Model development. Agric. Forest Meteorol., 95, 225-236.
Fontaine S., Mariotti A. & Abbadie L., 2003. The priming effect of organic matter: a question of microbial competition? Soil Biol. Biochem., 35, 837-843.
Giardina C.P. & Ryan M.G., 2000. Evidence that decomposition rates of organic carbon in mineral soil do not vary with temperature. Nature, 404, 858-861.
Gignoux J. et al., 2001. Design and test of a generic cohort model of soil organic matter decomposition: the SOMKO model. Global Ecol. Biogeogr., 10, 639-660.
Goidts E. & van Wesemael B., 2007. Regional assessment of soil organic carbon changes under agriculture in Southern Belgium (1955-2005). Geoderma, 141, 341-354.
Gu L., Post W.M. & King A.W., 2004. Fast labile carbon turnover obscures sensitivity of heterotrophic respiration from soil to temperature: A model analysis. Global Biogeochem. Cycles, 18, GB1022, doi:10.1029/2003GB002119.
Hanson P.J., Edwards N.T., Garten C.T. & Andrews J.A., 2000. Separating root and soil microbial contributions to soil respiration: a review of methods and observations. Biogeochemistry, 48, 115-146.
Henriksen T.M. & Breland T.A., 1999. Evaluation of criteria for describing crop residue degradability in a model of carbon and nitrogen turnover in soil. Soil Biol. Biochem., 31, 1135-1149.
Huang P.-M., Wang M.-K. & Chiu C.-Y., 2005. Soil mineral – organic matter – microbe interactions: impacts on biogeochemical processes and biodiversity in soils. Pedobiologia, 49, 609-635.
Hutchinson J.J., Campbell C.A. & Desjardins R.L., 2007. Some perspectives on carbon sequestration in agriculture. Agric. Forest Meteorol., 142(2-4), 288-302.
IPCC, 2007. Couplings between changes in the climate system and biogeochemistry. In: Working Group 1. Fourth assessment report "The physical science basis". Bern, Switzerland: IPCC.
Jalota R.K., Dalal R.C. & Harms B.P., 2006. Effects of litter and fine root composition on their decomposition in a rhodic paleustalf under different land uses. Commun. Soil Sci. Plant Anal., 37, 1859-1875.
Kätterer T., Reichstein M. & Andrén O., 1998. Temperature dependence of organic matter decomposition: a critical review using literature data analyzed with different models. Biol. Fertil. Soils, 27, 258-262.
Kelliher F.M. et al., 2004. Limitations to carbon mineralization in litter and mineral soil of young and old ponderosa pine forests. Forest Ecol. Manage., 191, 201-213.
Killham K., 1994. Soil ecology. Cambridge, UK: Cambridge University Press.
Kirschbaum M.U.F., 1995. The temperature dependence of soil organic matter decomposition, and the effect of global warming on soil organic storage. Soil Biol. Biochem., 27(6), 753-760.
Kirschbaum M.U.F., 2006. The temperature dependence of organic matter decomposition – still a topic of debate. Soil Biol. Biochem., 38, 2510-2518.
Lal R., 2004. Soil carbon sequestration to mitigate climate change. Geoderma, 123, 1-22.
La Scala N. Jr. et al., 2008. Short-term temporal changes of soil carbon losses after tillage described by a first-order decay model. Soil Tillage Res., 99, 108-118.
Leite L.F.C. et al., 2004. Simulating trends in soil organic carbon of an acrisol under no-tillage and disc-plow systems using the CENTURY model. Geoderma, 120, 283-295.
Li C., Frolking S. & Frolking T.A., 1992. A model of nitrous oxide evolution from soil driven by rainfall events: 1. Model structure and sensitivity. J. Geophys. Res., 97, 9759-9776.
Liu H.S. et al., 2006. Respiratory substrate availability plays a crucial role in the response of soil respiration to environmental factors. Appl. Soil Ecol., 32, 284-292.
Lloyd J. & Taylor J.A., 1994. On the temperature dependence of soil respiration. Funct. Ecol., 8, 315-323.
Luo Y. & Zhou X., 2006. Soil respiration and the environment. Amsterdam, The Netherlands; Boston, USA: Elsevier Academic Press Inc.
Nicolardot B., Recous S. & Mary B., 2001. Simulation of C and N mineralisation during crop residue decomposition: a simple dynamic model based on the C:N ratio of the residues. Plant Soil, 228, 83-103.
Nieder R. & Benbi D.K., 2008. Modelling Carbon and Nitrogen dynamics in the soil-plant-atmosphere system. In: Carbon and Nitrogen in the terrestrial environment. New York, USA: Springer Science & Business Media.
Parton W.J., Schimel D.S., Cole C.V. & Ojima D.S., 1987. Analysis of factors controlling soil organic matter levels in great plains grasslands. Soil Sci. Soc. Am. J., 51, 1173-1179.
Parton W.J., Hartman M., Ojima D. & Schimel D., 1998. DAYCENT and its land surface submodel: description and testing. Global Planet. Change, 19, 35-48.
Paustian K., Six J., Elliott E.T. & Hunt H.W., 2000. Management options for reducing CO2 emissions from agricultural soils. Biogeochemistry, 48, 147-163.
Perrin D., 2005. Flux de respiration de sols forestiers : analyse et modélisation à différentes échelles spatiales et temporelles. Thèse de doctorat : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Petersen B.M., Berntsen J., Hansen S. & Jensen L.S., 2005. CN-SIM. A model for the turnover of soil organic matter. I. Long-term carbon and radio-carbon development. Soil Biol. Biochem., 37, 359-374.
Pietikäinen J., Pettersson M. & Bååth E., 2005. Comparison of temperature effects on soil respiration and bacterial and fungal growth rates. FEMS Microbiol. Ecol., 52, 49-58.
Ratkowsky D.A. et al., 1983. Model for bacterial culture growth rate throughout the entire biokinetic temperature range. J. Bacteriol., 154(3), 1222-1226.
Rees R.M., Bingham I.J., Baddeley J.A. & Watson C.A., 2005. The role of plants and land management in sequestering soil carbon in temperate arable and grassland ecosystems. Geoderma, 128, 130-154.
Rousk J. & Bååth E., 2007. Fungal and bacterial growth in soil with plant materials of different C/N ratios. FEMS Microbiol. Ecol., 62, 258-267.
Schrumpf M., Schumacher J., Schöning I. & Schulze E.-D., 2008. Monitoring carbon stock changes in European soils: process understanding and sampling strategies. In: The continental-scale greenhouse gas balance of Europe. Ecological Studies 203. New York, USA: Springer.
Shibu M.E., Leffelaar P.A., Van Keulen H. & Aggarwal P.K., 2006. Quantitative description of soil organic matter dynamics. A review of approaches with reference to rice-based cropping systems. Geoderma, 137, 1-18.
Six J. et al., 2004. The potential to mitigate global warming with no-tillage management is only realized when practised in the long-term. Global Change Biol., 10(2), 155-160.
Smith P. et al., 2005. Carbon sequestration potential in European croplands has been overestimated. Global Change Biol., 11, 2153-2163.
Stenström J., Svensson K. & Johansson M., 2001. Reversible transition between active and dormant microbial states in soil. FEMS Microbiol. Ecol., 36, 93-104.
Townsend A.R., Vitousek P.M., Desmarais D.J. & Tharpe A., 1997. Soil carbon pool structure and temperature sensitivity inferred using CO2 and 13CO2 incubation fluxes from five Hawaiian soils. Biogeochemistry, 38, 1-17.
Trumbore S., 2006. Carbon respired by terrestrial ecosystems - recent progress and challenges. Global Change Biol., 12, 141-153.
Vleeshouwers L.M. & Verhagen A., 2002. Carbon emission and sequestration by agricultural land use: a model study for Europe. Global Change Biol., 8, 519-530.
Wang W.J., Baldock J.A., Dalal R.C. & Moody P.W., 2004. Decomposition dynamics of plant materials in relation to nitrogen availability and biochemistry determined by NMR and wet-chemical analysis. Soil Biol. Biochem., 36, 2045-2058.
Wardle D.A. & Lavelle P., 1997. Linkages between soil biota, plant litter quality and decomposition. In: Cadisch G. & Giller K.E., eds. Driven by nature: plant litter quality and decomposition. Wallingford, USA: CABI Publishing, 107-124.
West T.O. & Marland G., 2002. A synthesis of carbon sequestration, carbon emissions, and net carbon flux in agriculture: comparing tillage practices in the United States. Agric. Ecosyst. Environ., 91, 217-232.
Wutzler T. & Reichstein M., 2008. Colimitation of decomposition by substrate and decomposers - a comparison of model formulations. Biogeosciences, 5, 749-759.
Xu L., Baldocchi D.D. & Tang J., 2004. How soil moisture, rain pulses, and growth alter the response of ecosystem respiration to temperature. Global Biogeochem. Cycles, 18, doi: 10.1029/2004GB002281.
Yadav V. & Malanson G., 2007. Progress in soil organic matter research: litter decomposition, modelling, monitoring and sequestration. Progr. Phys. Geogr., 31(2), 131-154.
Zimmermann M. et al., 2007. Measured soil organic matter fractions can be related to pools in the RothC model. Eur. J. Soil Sci., 58, 658-667.
Notes
Pour citer cet article
A propos de : Pauline Buysse
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Physique des Biosystèmes. Avenue de la Faculté, 8. B-5030 Gembloux (Belgique). E-mail : Pauline.Buysse@ulg.ac.be
A propos de : Marc Aubinet
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Physique des Biosystèmes. Avenue de la Faculté, 8. B-5030 Gembloux (Belgique).






