- Portada
- Volume 11 (2007)
- numéro 2
- Les chémokines et leurs récepteurs : rôle dans les infections virales et dans les pathologies cancéreuses
Vista(s): 0 (0 ULiège)
Descargar(s): 0 (0 ULiège)
Les chémokines et leurs récepteurs : rôle dans les infections virales et dans les pathologies cancéreuses

Notes de la rédaction
Reçu le 24 avril 2007, accepé le 3 mai 2007.
Résumé
Les chémokines sont des cytokines dont le rôle principal est l’activation cellulaire et la stimulation de la migration des leucocytes. C’est en interagissant avec des récepteurs, exprimés à la surface cellulaire et couplés aux protéines G (GPCRs), qu’elles assurent leurs diverses fonctions. Elles sont en effet impliquées dans la régulation de nombreux processus biologiques tels que l’apoptose, la prolifération, l’angiogenèse, l’hématopoïèse ou l’organogenèse. Elles maintiennent l’homéostasie du compartiment lymphocytaire et coordonnent le fonctionnement du système immunitaire. Par ailleurs, les chémokines et leurs récepteurs constituent des cibles idéales pour certains virus. Il est intéressant de constater que de nombreux cancers sont caractérisés par un dérèglement de leur expression ou de leur activité.
Abstract
The chemokines and their receptors: the main functions of chemokines are cell activation and stimulation of leukocyte migration. By interacting with G protein-coupled receptors, these proteins regulate many biological processes like apoptosis, proliferation, angiogenesis, hematopoiesis or organogenesis. They maintain the homeostasis of the lymphocyte compartment and ensure correct functioning of the immune system. Interestingly, the chemokines and their receptors are ideal targets for viruses. Furthermore, most cancers are characterized by a default of their expression or their activity.
Tabla de contenidos
1. Introduction
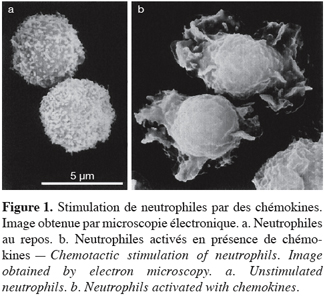
1Appartenant à la famille des cytokines, les chémokines exercent des fonctions importantes de communication intercellulaire. Leurs propriétés chémoattractantes constituent leur point commun majeur et sont à l’origine de leur dénomination (chemoattractant cytokines). Les chémokines régulent de nombreux processus biologiques tels que la prolifération, l’apoptose, l’angiogenèse, le développement des organes lymphoïdes ou encore l’hématopoïèse, mais leur rôle principal est d’activer et de contrôler la migration des leucocytes (Figure 1). Alors qu’elles participent activement au maintien de l’homéostasie lymphocytaire en conditions physiologiques, la dérégulation de l’expression des chémokines est également associée à plusieurs maladies.
2. Structure et classification des chémokines
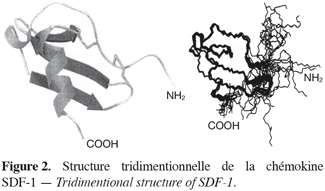
2Les chémokines sont des petites protéines très basiques dont la taille varie entre 6 et 14 kDa. Il en existe une cinquantaine. La plupart d’entre elles possèdent quatre résidus cystéine caractéristiques qui forment deux ponts disulfures, un entre le premier et le troisième résidu cystéine et un entre le deuxième et le quatrième résidu cystéine. Alors que l’homologie de séquence peut être très faible entre les chémokines, la structure tertiaire globale, comprenant notamment trois feuillets b, est étonnamment similaire (Clark-Lewis et al., 1995). La figure 2 représente la structure tridimensionnelle de la chémokine SDF-1.
3Selon le nombre d’acides aminés présents entre les deux premières cystéines (situées dans la partie N-terminale), les chémokines sont classées en quatre groupes : CC, CXC, CX3C ainsi que le groupe C qui comprend la lymphotactine (XCL1), seule chémokine contenant uniquement 2 cystéines correspondant au deuxième et au quatrième résidus cystéines chez les autres chémokines (Kelner et al., 1994). Le groupe CXC est encore subdivisé en deux catégories : en fonction de la présence ou de l’absence d’un motif ELR (glutamate-leucine-arginine) en amont du premier résidu cystéine, on distingue les chémokines ELR-CXC qui exercent principalement leur action sur les neutrophiles, des chémokines non-ELR-CXC agissant plutôt sur les lymphocytes (Rossi, Zlotnik, 2000). Cette classification structurale fait aujourd’hui office de nomenclature de référence mais les noms communs donnés précédemment aux chémokines sont encore largement utilisés, comme par exemple SDF-1 (CXCL12), SLC (CCL21), ELC (CCL19), MIP-3a (CCL20), etc. (Olson, Ley, 2002) (Tableau 1).
4Les chémokines peuvent également être classées au niveau fonctionnel. Ainsi, il existe deux types de chémokines : les chémokines pro-inflammatoires et les chémokines constitutives (Brandes et al., 2000).
5Les chémokines constitutives (ou « homéostatiques ») sont produites dans les organes lymphoïdes et dans certains organes non-lymphoïdes tels que la peau et les muqueuses. Elles régulent le trafic lymphocytaire et la localisation des lymphocytes au sein de ces organes pendant la lymphopoïèse mais également pour maintenir l’immunosurveillance ; SDF-1, BCA-1, ELC et SLC en sont des exemples. Certaines de ces chémokines semblent également être indispensables pour la formation de ces organes (Cyster et al., 1999 ; Ngo et al., 1999).
6Les chémokines pro-inflammatoires (ou « inductibles ») sont produites au niveau de sites d’inflammation par des cellules de tissus ou des leucocytes infiltrés, activés par des cytokines pro-inflammatoires ou après contact avec un agent pathogène. Le LPS, l’IL-1b et le TNFa (tumor necrosis factor) font partie des molécules capables d’induire l’expression de chémokines pro-inflammatoires. Ces dernières recrutent les différents types cellulaires impliqués dans une réaction immunitaire (Moser, Willimann, 2004).
7Cependant, la distinction entre chémokines pro-inflammatoires et chémokines constitutives n’est pas absolue, certaines chémokines appartenant aux deux familles.
3. Expression des chémokines
8La capacité des chémokines à stimuler et à diriger la migration des leucocytes in vivo est leur principale fonction. Certaines chémokines, comme la fractalkine, sont exprimées à la surface cellulaire (Imai et al., 1997) mais la plupart sont sécrétées et doivent, pour induire la migration des leucocytes, être immobilisées sur une cellule ou sur la matrice extracellulaire. Ces protéines hautement basiques interagissent donc avec les glycosaminoglycanes chargés négativement. Il est intéressant de noter que différents types de chémokines se lient à différents glycosaminoglycanes avec des affinités diverses (Kuschert et al., 1999). L’immobilisation sélective d’une chémokine à un site donné peut être une étape régulatrice déterminante pour l’action de cette chémokine au niveau de certains tissus ou sites d’inflammation. De plus, une oligomérisation de chémokines a lieu sur les glycosaminoglycanes et peut ainsi induire la formation d’un gradient chémotactique (Hoogewerf et al., 1997). à proximité de leur site de production, les chémokines peuvent même former des oligomères d’ordre supérieur, créant ainsi une zone de haute concentration à proximité d’une zone d’inflammation ou de recirculation, causant la migration des leucocytes vers ce lieu d’intérêt.
4. Les récepteurs à chémokines
9Les chémokines exercent leur activité en interagissant avec des récepteurs exprimés à la surface des cellules. La nomenclature des récepteurs à chémokines est basée sur le groupe de chémokines auquel son ligand appartient. Ainsi, les récepteurs correspondant aux chémokines du groupe CXC seront appelés CXCR1, 2, 3, 4, etc. (revu par Tanaka et al., 2005) (Tableau 1).
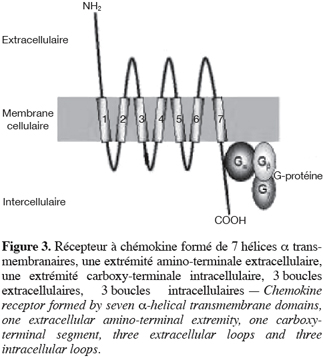
10Ces récepteurs présentent tous une structure tertiaire semblable : il s’agit de récepteurs transmembranaires à sept hélices a, comprenant une extrémité amino-terminale extracellulaire, trois boucles extracellulaires, trois boucles intracellulaires et une extrémité carboxy-terminale intracellulaire. Ces récepteurs sont couplés à une protéine G et font donc partie de la superfamille des GPCR (G Protein Coupled Receptor) (Wu et al., 1993) (Figure 3).
4.1. Activité biologique des récepteurs à chémokines
11Dans la plupart des situations, les chémokines agissent en tant que monomères. L’interaction chémokine-récepteur est rendue possible par deux sites de liaisons : le premier est une boucle exposée dans la région située entre le deuxième et le troisième résidu cystéine de la chémokine. Ce site est considéré comme une région d’interaction de faible affinité et se lie à l’extrémité amino-terminale extracellulaire du récepteur. Le second site de liaison n’est autre que la partie N-terminale de la chémokine, située avant le premier résidu cystéine et interagissant avec une boucle extracellulaire du récepteur. Ce site de liaison est la partie la plus variable chez toutes les chémokines et est donc déterminant pour l’affinité et la spécificité de la liaison ligand-récepteur. Il est également indispensable à l’induction d’un signal de transduction (Moser, Willimann, 2004).
12Les conséquences de la liaison d’une chémokine à son récepteur ont déjà fait l’objet de plusieurs études, aussi bien in vivo qu’in vitro. Un effet commun à toutes les chémokines est l’induction d’une réponse chémotactique chez des cellules exprimant le récepteur, vers une zone de haute concentration en chémokines. Le mécanisme de chémotactisme inclut un rapide changement de forme de la cellule (polarisation cellulaire), la formation de lamellipodes, des cycles de polymérisation/dépolymérisation des filaments d’actine, l’expression en surface des intégrines leucocytaires ainsi que l’interaction de ces dernières aux molécules d’adhérence cellulaire CAM (Cell Adhesion Molecule), appartenant à la superfamille des Ig-like, présentes sur l’endothélium (Wymann et al., 1990 ; Parsey, Lewis, 1993).
13Tous ces mécanismes découlent d’une série de signaux intracellulaires. Suite à la liaison d’une chémokine à son récepteur, la protéine G hétérotrimérique (sous-unités a, b, g) couplée au récepteur active une molécule effectrice ancrée dans ou située à proximité de la membrane cellulaire. Il s’agit généralement d’une phospholipase C (PLC) qui, à partir du phosphatidylinositol (PI), génère de l’inositol triphosphate (IP3) et du diacylglycérol (DAG). Ceci induit une augmentation du taux de Ca++ intracellulaire ainsi que l’activation de la protéine kinase C (PKC). Suite à l’activation de GTPases, la restructuration du cytosquelette conduit à des changements de forme, la migration et l’adhérence des cellules (Baggiolini et al., 1994 ; Baggiolini, 1998). D’autres effets, comme l’activation de protéines kinases et de facteurs de transcription, sont également rapportés.
14Suite à la liaison d’une chémokine à son récepteur, ce dernier est internalisé et la cellule subit une période réfractaire pendant laquelle elle ne peut plus répondre à une chémokine par le même récepteur. Ce mécanisme joue un rôle déterminant dans la durée du trafic, de la migration et de la rétention des leucocytes au niveau des tissus (Neel et al., 2005).
4.2. Spécificité des couples chémokines-récepteurs
15Les couples chémokines-récepteurs varient fortement en termes de sélectivité. Certaines chémokines se lient à un seul récepteur, et vice versa, comme CXCR4 et SDF-1, CXCR5 et BCA-1, CCR6 et MIP-3a ou encore CCR10 et CTACK (D'Apuzzo et al., 1997 ; Baba et al., 1997 ; Legler et al., 1998 ; Homey et al., 2000). Certains récepteurs sont par contre capables de se lier à deux ou trois chémokines différentes. C’est notamment le cas de CCR7, qui se lie à SLC et ELC (Yoshida et al., 1997 ; Yoshida et al., 1998), ou de CXCR3, qui se lie à IP-10 à MIG et à I-TAC (Loetscher et al., 1996 ; Cole et al., 1998). Beaucoup d’autres récepteurs sont moins sélectifs. CCR3 se lie par exemple à eotaxin, eotaxin-2 et 3, MCP-2, 3 et 4, CCL6, leukotactin-1, ESkine et à RANTES (Tanaka et al., 2005). Cette dernière chémokine est quant à elle capable de se lier à CCR1, 2 et 3 avec une relativement grande affinité (Murphy et al., 2000).
4.3. Expression des récepteurs
16Parmi les récepteurs à chémokine, on distingue ceux qui sont exprimés exclusivement par un nombre restreint de leucocytes (voir par un seul type cellulaire) et ceux qui le sont plus largement. CXCR4, par exemple, est présent sur les lymphocytes T et B, les monocytes, les neutrophiles et les cellules dendritiques. Il est en fait le récepteur le plus largement exprimé au sein des leucocytes. CXCR1 et CXCR2 sont également exprimés sur la plupart des leucocytes mais ne semblent être fonctionnels que sur les neutrophiles, les mastocytes et les monocytes. CXCR3, CXCR5 et CXCR6 sont présents uniquement sur les cellules de la lignée lymphoïde. CCR1, CCR2 et CCR4-10 sont exprimés principalement sur les lymphocytes, les monocytes et les cellules dendritiques (Nilsson et al., 1999).
17Tout comme leurs ligands, l’expression des récepteurs à chémokines est régulée par toute une série de stimuli (Syrbe et al., 1999). L’IL-2, par exemple, induit l’expression de CCR1, CCR2 et CXCR3 sur les lymphocytes T. En synergie avec l’IL-4, l’IL-2 provoque également l’expression de CCR3. CCR5 est induit par les cytokines pro-inflammatoires de la réponse Th1 et est réprimé par IL-10. L’expression de CXCR4 est activée par l’IFN-g et réprimée par l’IL-4. L’activation des lymphocytes influence l’expression de certains récepteurs à chémokines. Ainsi, l’activation des cellules T/B par leur TCR/BCR modifie l’expression de CCR7, CCR8, CXCR5, CXCR4, etc. (Bleul et al., 1998).
5. Rôle des chémokines dans l’organogenèse et le trafic lymphocytaire
18Les chémokines jouent un rôle primordial dans la formation des organes lymphoïdes primaires et secondaires, assurent la différenciation et la maturation des cellules progénitrices et contribuent au maintien de l’homéostasie leucocytaire en régulant la recirculation des différents types cellulaires dans les organes lymphoïdes secondaires (Ansel, Cyster, 2001).
19De nombreuses chémokines sont exprimées dans le thymus : MDC, TARC, SLC, SDF-1, TECK, ELC. Ces chémokines attirent spécifiquement différents types cellulaires. Ainsi, MDC attire les cellules T activées, TARC les cellules T du sang périphérique, SLC les cellules T matures, etc. SDF-1, TECK et ELC seraient quant à elles impliquées dans l’attraction et le développement des thymocytes (Zlotnik, Yoshie, 2000). Ces résultats suggèrent que les chémokines contrôlent la compartimentalisation observée dans les organes lymphoïdes primaires et coordonnent le développement des lymphocytes T (Godiska et al., 1997 ; Vicari et al., 1997).
20Les cellules stromales de la moelle, quant à elles, produisent la chémokine SDF-1 en grande quantité. Celle-ci est capable d’attirer les cellules progénitrices et de les mettre en contact avec les cellules stromales qui produisent différents facteurs de croissance et de différenciation cellulaire nécessaires à la maturation des lymphocytes B (D’Apuzzo et al., 1997 ; Bowman et al., 2000). Les expériences prouvent que les souris déficientes pour SDF-1 ou CXCR4 présentent de graves problèmes au niveau de l’hématopoïèse et du développement des systèmes nerveux et vasculaires (Tachibana et al., 1998).
21Les organes lymphoïdes secondaires jouent un rôle critique dans l’initiation de la réponse immune en servant de sites d’activation des lymphocytes T et B naïfs par l’interaction de ces derniers avec les cellules mémoires circulantes et les cellules dendritiques en provenance des sites d’inflammation. Ces interactions sont la base de la sélection, de la prolifération et de la programmation des cellules T et B envers un anti-gène spécifique, permettant ainsi la migration des sous-types adéquats de lymphocytes vers les sites d’inflammation où l’agent pathogène pourra être détruit (Cyster, 1999). Ces événements se passent dans les ganglions, la rate, les plaques de Peyer ou les amygdales, selon l’endroit où la cellule dendritique a rencontré l’antigène, mais également en fonction de la présence sur les lymphocytes de récepteurs à chémokines et de molécules d’adhérence spécifiques.
22Les cellules dendritiques expriment fortement les récepteurs associés aux chémokines inflammatoires (CXCR1, CCR1, 2, 5, 6), ce qui leur permet de suivre un gradient chémotactique vers les sites d’inflammation. Une fois à cet endroit, les cellules dendritiques maturent l’antigène et deviennent sensibles aux facteurs TNF-a et IFN-g, avec comme conséquence, une expression plus faible des récepteurs CCR1 et CCR5. De plus, les cellules dendritiques en maturation présentent une expression plus importante de CXCR4, CCR4 et CCR7, responsables de la migration des cellules dendritiques vers les organes lymphoïdes secondaires (Sallusto, Lanzavecchia, 2000).
23L’entrée des lymphocytes naïfs dans les organes lymphoïdes secondaires (rate, ganglions, plaques de Peyer) a lieu via leur migration à travers les HEVs (High Endothelial Venules). Les expériences in vitro montrent que la chémokine SLC est requise pour l’adhérence des lymphocytes T à la surface de l’endothélium (Campbell et al., 1998). De même, les études réalisées in vivo sur des souris mutées CCR7-/- (récepteur de SLC) montrent que les cellules T et dendritiques ne parviennent pas à migrer à travers l’endothélium (Forster et al., 1999). Des effets similaires sont observés chez les souris qui n’expriment pas SLC au niveau des organes lymphoïdes (Gunn et al., 1999). Une fois à l’intérieur des organes lymphoïdes (rate, ganglions et plaques de Peyer), les lymphocytes T et les cellules dendritiques migrent vers les zones T par un processus qui requiert, d’une part, l’expression de CCR7 à la surface des lymphocytes T et, d’autre part, l’expression de SLC et ELC à l’intérieur des zones T par les cellules dendritiques et les macrophages (Cyster, 2000). En absence de ELC ou SLC, le homing des lymphocytes B au niveau des organes lymphoïdes secondaires est moins altéré que pour les lymphocytes T. Par contre, le blocage des récepteurs CCR7 et CXCR4 diminue fortement la migration des lymphocytes B au niveau des ganglions et des plaques de Peyer (Okada et al., 2002). Dans les plaques de Peyer, un troisième récepteur intervient dans le homing des cellules B, il s’agit du récepteur CXCR5 (Okada et al., 2002). Au sein du ganglion, le couple BCA-1/CXCR5 est également responsable de la migration des lymphocytes B vers les zones B germinales (Cyster et al., 2000). Produite par les cellules stromales et dendritiques folliculaires (Gunn et al., 1998), la chémokine BCA-1 est, par ailleurs, indispensable à la formation de ces follicules (Ansel et al., 2000).
6. Implication des chémokines dans certaines pathologies
6.1. Les chémokines et les virus
24Vu le rôle qu’ils jouent dans le homing lymphocytaire, les chémokines et leurs récepteurs constituent des cibles privilégiées pour les virus. Interférer dans le fonctionnement des couples chémokines-récepteurs constitue un moyen efficace d’échapper à la sélection immune.
25Plusieurs cas sont ainsi connus chez l’homme :
26– La protéine p35 des poxvirus qui se lie aux chémokines de type CC avec une affinité plus grande que leurs récepteurs (Carfi et al., 1999). De tels exemples existent pour le cytomégalovirus, les herpesvirus, etc.
27– Certains virus modifient l’expression de chémokines ou récepteurs à chémokines. Ainsi, des patients infectés par HTLV-1 voient leurs taux plasmatiques de CCL2, CCL11, CCL24, CXCL10 et CXCL9 largement modifiés (Guerreiro et al., 2006). Il a également été prouvé que l’expression de MIP-3a/CCL20 était activée in vitro par la protéine virale Tax (Imaizumi et al., 2002).
28– Un autre exemple bien connu est le virus HIV. Les protéines virales Tat et gp120 sont capables d’interagir sur plusieurs récepteurs à chémokines, notamment CXCR4 et CCR5 (Berger et al., 1999). Gp120 peut, ex vivo, inhiber la migration des lymphocytes B en réponse aux chémokines SDF-1 (CXCL12), MIP-3a (CCL20) et SLC (CCL21) (Badr et al., 2005). CXCR4 et CCR5 ont également été identifiés comme étant co-récepteurs pour l’entrée du virus HIV dans les cellules lymphocytaires T CD4+ (Feng et al., 1996 ; Bleul et al., 1996).
29– L’herpesvirus associé au sarcome de Kaposi synthétise certaines virokines (chémokines virales),identiques à MIP-2 notamment, qui bloquent plusieurs récepteurs de type CC et CXC et rend les cellules infectées insensibles aux chémokines associées à ces récepteurs (Nakano et al., 2003).
6.2. Angiogenèse, cancers et métastases
30Hormis leur rôle dans la migration et l’organogenèse, les chémokines sont impliquées dans divers mécanismes pathologiques, comme le développement de tumeurs et métastases (Vicari, Caux, 2002 ; Kulbe et al., 2004).
31L’angiogenèse est un processus biologique par lequel des vaisseaux sanguins sont générés. Or, le développement d’une tumeur solide nécessite une vascularisation suffisante pour garantir un approvisionnement continu en oxygène et en nutriments. Alors que les chémokines ELR-CXC sont des facteurs angiogènes potentiels, capables de stimuler le chémotactisme des cellules endothéliales, la plupart des chémokines non-ELR-CXC sont des facteurs angiostatiques forts, inhibant la chémoattraction des cellules endothéliales (Rossi, Zlotnik, 2000). De nombreux exemples de pathologies pour lesquelles la balance entre chémokines ELR-CXC et non-ELR-CXC est altérée sont rapportés dans la littérature (Strieter et al., 1995). Récemment, des études ont d’ailleurs montré que l’administration de la chémokine MIG, combinée à un traitement chimiothérapeutique à base de cisplatine, avait des effets thérapeutiques dans différents modèles de carcinomes murins, grâce aux propriétés angiostatiques de Mig (Zhang et al., 2006).
32Les chémokines sont également largement impliquées dans le développement de métastases. En effet, les cellules tumorales modifient généralement l’expression de leurs récepteurs à chémokines. Alors que certains récepteurs à chémokines voient leur expression diminuée ou inhibée, d’autres sont surexprimés. Ainsi, la migration des métastases n’est pas aléatoire mais est déterminée par les récepteurs qu’elles expriment et donc par le type de cancer dont elles proviennent (Tanaka et al., 2005). D’une manière générale, CXCR4 est le récepteur à chémokine le plus fréquemment exprimé par les cellules cancéreuses (cancers du poumon à petites cellules, du pancréas, astrogliomes, myélomes ou lymphomes à cellules B) (Kim et al., 2006). SDF-1, le ligand de CXCR4, possède en effet un pouvoir chémoattractant puissant et est exprimé dans de nombreux tissus. Par ailleurs, SDF-1 favorise la survie et la croissance des cellules tumorales et induit la sécrétion de cytokines (Balkwill, 2004a).
33De même, l’expression exacerbée de CXCR4 est observée sur les lymphocytes B de leucémies humaines comme l’ALL (Acute Lymphoblastic Leukemia, leucémie lymphocytaire aiguë), l’AML (Acute Myeloid Leukemia, leucémie myéloïde aiguë) ou encore la CLL (Chronic Lymphocytic Leukemia, leucémie lymphoïde chronique) (Lopez-Giral et al., 2004 ; Balkwill, 2004b ; Corcione, et al., 2006 ; Dommange et al., 2006). De manière générale, les maladies lymphoprolifératives sont caractérisées par une modification de l’expression d’un ou plusieurs récepteur(s) à chémokine(s) (Pistoia et al., 2006 ; Wu et al., 2006). Par exemple, le développement de la CLL est caractérisé par une surexpression des récepteurs CXCR4, CXCR5 et CCR7 sur les lymphocytes B (Lopez-Giral et al., 2004 ; Wong, Fulcher, 2004), expliquant la tendance qu’ont les cellules tumorales à envahir la moelle et des tissus lymphoïdes tels que les ganglions. Bloquer l’entrée et l’accumulation de ces cellules dans les ganglions s’avérerait donc crucial. C’est pourquoi des études préliminaires ont été réalisées dans le but d’élaborer une thérapie contre la CLL à base d’anticorps monoclonaux dirigés contre CCR7. Ces anticorps anti-CCR7 permettent non seulement d’inhiber la migration des cellules CLL en réponse à ELC/CCL19 (le ligand de CCR7) in vitro, mais induisent également la lyse des cellules leucémiques en activant une réponse cytotoxique liée au complément (Alfonso-Perez et al., 2006). Actuellement, l’implication des chémokines et de leurs récepteurs dans le développement de maladies lymphoprolifératives fait l’objet de nombreuses recherches et sa compréhension ouvre des voies thérapeutiques intéressantes pour la lutte contre les leucémies humaines et les cancers en général.
7. Conclusion
34Les chémokines sont des cytokines chémoattractantes impliquées dans la régulation de diverses fonctions biologiques telles que la coordination des processus de migration cellulaire, nécessaires au fonctionnement optimal du système immunitaire, ou encore l’organogenèse, l’activation cellulaire, etc. De plus, les chémokines et leurs récepteurs participent au développement de diverses pathologies et constituent une cible privilégiée pour les virus. Elles sont donc d’un intérêt majeur pour la recherche et le développement de nouvelles voies thérapeutiques, notamment dans la lutte contre les cancers.
35Remerciements
36Nous remercions le Fonds national de la Recherche scientifique (FNRS) et l’Opération Télévie pour le soutien financier. R.K. (Directeur de Recherches) et L.W. (Directeur de Recherches) sont membres du FNRS.
Bibliographie
Alfonso-Perez M., Lopez-Giral S., Quintana NE., Loscertales J., Martin-Jimenez P., Munoz C. (2006). Anti-CCR7 monoclonal antibodies as a novel tool for the treatment of chronic lymphocyte leukemia. J. Leuk. Biol. 79, p. 1157–1165.
Ansel KM., Cyster JG. (2001). Chemokines in lymphopoiesis and lymphoid organ development. Curr. Opin. Immunol. 13, p. 172–179.
Ansel KM., Ngo VN., Hyman PL., Luther SA., Forster R., Sedgwick JD., Browning JL., Lipp M., Cyster JG. (2000). A chemokine-driven positive feedback loop organizes lymphoid follicles. Nature 406, p. 309–314.
Baba M., Imai T., Nishimura M., Kakizaki M., Takagi S., Hieshima K., Nomiyama H., Yoshie O. (1997). Identification of CCR6, the specific receptor for a novel lymphocyte-directed CC chemokine LARC. J. Biol. Chem. 272, p. 14893–14898.
Badr G., Borhis G., Treton D., Moog C., Garraud O., Richard Y. (2005). HIV type 1 glycoprotein 120 inhibits human B cell chemotaxis to CXC chemokine ligand (CXCL) 12, CC chemokine ligand (CCL)20, and CCL21. J. Immunol. 175, p. 302–310.
Baggiolini M. (1998). Chemokines and leukocyte traffic. Nature 392, p. 565–568.
Baggiolini M., Dewald B., Moser B. (1994). Interleukin-8 and related chemotactic cytokines--CXC and CC chemokines. Adv. Immunol. 55, p. 97–179.
Balkwill F. (2004a). Cancer and the chemokine network. Nat. Rev. Cancer 4, p. 540–550.
Balkwill F. (2004b). The significance of cancer cell expression of the chemokine receptor CXCR4. Semin. Cancer Biol. 14, p. 171–179.
Berger EA., Murphy PM., Farber JM. (1999). Chemokine receptors as HIV-1 coreceptors: roles in viral entry, tropism, and disease. Annu. Rev. Immunol. 17, p. 657–700.
Bleul CC., Farzan M., Choe H., Parolin C., Clark-Lewis I., Sodroski J., Springer TA. (1996). The lymphocyte chemoattractant SDF-1 is a ligand for LESTR/fusin and blocks HIV-1 entry. Nature 382, p. 829–833.
Bleul C., Schultze JL., Springer TA. (1998). B lymphocyte chemotaxis regulated in association with microanatomic localization, differentiation state, and B cell receptor engagement. J. Exp. Med. 187, p. 753–762.
Bowman EP., Campbell JJ., Soler D., Dong Z., Manlongat N., Picarella D., Hardy RR., Butcher EC. (2000). Developmental switches in chemokine response profiles during B cell differentiation and maturation. J. Exp. Med. 191, p. 1303–1318.
Brandes M., Legler DF., Spoerri B., Schaerli P., Moser B. (2000). Activation-dependent modulation of B lymphocyte migration to chemokines. Int. Immunol. 12, p. 1285–1292.
Campbell J., Bowman EP., Murphy K., Youngman KR., Siani MA., Thompson DA., Wu L., Zlotnik A., Butcher EC. (1998). 6-C-kine (SLC), a lymphocyte adhesion-triggering chemokine expressed by high endothelium, is an agonist for the MIP-3beta receptor CCR7. J. Cell. Biol. 141, p. 1053–1059.
Carfi A., Smith CA., Smolak PJ., McGrew J., Wiley DC. (1999). Structure of a soluble secreted chemokine inhibitor vCCI (p35) from cowpox virus. Proc. Natl Acad. Sci. USA 96, p. 12379–12383.
Clark-Lewis I., Kim KS., Rajarathnam K., Gong JH., Dewald B., Moser B., Baggiolini M., Sykes BD. (1995). Structure-activity relationships of chemokines. J. Leuk. Biol. 57, p. 703–711.
Cole KE., Strick CA., Paradis TJ., Ogborne KT., Loetscher M., Gladue RP., Lin W., Boyd JG., Moser B., Wood DE., Sahagan BG., Neote K. (1998). Interferon-inducible T cell alpha chemoattractant (I-TAC): a novel non-ELR CXC chemokine with potent activity on activated T cells through selective high affinity binding to CXCR3. J. Exp. Med. 187, p. 2009–2021.
Corcione A., Arduino N., Ferretti E., Pistorio A., Spinelli M., Ottonello L., Dallegri F., Basso G., Pistoia V. (2006). Chemokine receptor expression and function in childhood acute lymphoblastic leukemia of B-lineage. Leuk. Res. 30, p. 365–372.
Cyster JG. (1999) Chemokines and cell migration in secondary lymphoid organs. Science 286, p. 2098–2102.
Cyster JG. (2000). Leukocyte migration: scent of the T zone. Curr. Biol. 10, p. R30–R33.
Cyster JG., Ngo VN., Ekland EH., Gunn MD., Sedgwick JD., Ansel KM. (1999). Chemokines and B-cell homing to follicles. Curr. Top. Microbiol. Immunol. 246, p. 87–92.
Cyster JG., Ansel KM., Reif K., Ekland EH., Hyman PL., Tang HL., Luther SA., Ngo VN. (2000). Follicular stromal cells and lymphocyte homing to follicles. Immunol. Rev. 176, p. 181–193.
D’Apuzzo M., Rolink A., Loetscher M., Hoxie JA., Clark-Lewis I., Melchers F., Baggiolini M., Moser B. (1997). The chemokine SDF-1, stromal cell-derived factor 1, attracts early stage B cell precursors via the chemokine receptor CXCR4. Eur. J. Immunol. 27, p. 1788–1793.
Dommange F., Cartron G., Espanel C., Gallay N., Domenech J., Benboubker L., Ohresser M., Colombat P., Binet C., Watier H., Herault O. (2006). CXCL12 polymorphism and malignant cell dissemination/tissue infiltration in acute myeloid leukemia. FASEB J. 20, p. 1913–1915.
Feng Y., Broder CC., Kennedy PE., Berger EA. (1996). HIV-1 entry cofactor: functional cDNA cloning of a seven-transmembrane, G protein-coupled receptor. Science 272, p. 872–877.
Forster R., Schubel A., Breitfeld D., Kremmer E., Renner-Muller I., Wolf E., Lipp M. (1999). CCR7 coordinates the primary immune response by establishing functional microenvironments in secondary lymphoid organs. Cell 99, p. 23–33.
Godiska R., Chantry D., Raport CJ., Sozzani S., Allavena P., Leviten D., Mantovani A., Gray PW. (1997). Human macrophage-derived chemokine (MDC), a novel chemoattractant for monocytes, monocyte-derived dendritic cells, and natural killer cells. J. Exp. Med. 185, p. 1595–1604.
Guerreiro JB., Santos SB., Morgan DJ., Porto AF., Muniz AL., Ho JL., Teixeira AL. Jr., Teixeira MM., Carvalho EM. (2006). Levels of serum chemokines discriminate clinical myelopathy associated with human T lymphotropic virus type 1 (HTLV-1)/tropical spastic paraparesis (HAM/TSP) disease from HTLV-1 carrier state. Clin. Exp. Immunol. 145, p. 296–301.
Gunn MD., Ngo VN., Ansel KM., Ekland EH., Cyster JG., Williams LT. (1998). A B-cell-homing chemokine made in lymphoid follicles activates Burkitt’s lymphoma receptor-1. Nature 391, p. 799–803.
Gunn MD., Kyuwa S., Tam C., Kakiuchi T., Matsuzawa A., Williams LT., Nakano H. (1999). Mice lacking expression of secondary lymphoid organ chemokine have defects in lymphocyte homing and dendritic cell localization. J. Exp. Med. 189, p. 451–460.
Homey B., Wang W., Soto H., Buchanan ME., Wiesenborn A., Catron D., Muller A., McClanahan TK., Dieu-Nosjean MC., Orozco R., Ruzicka T., Lehmann P., Oldham E., Zlotnik A. (2000). Cutting edge: the orphan chemokine receptor G protein-coupled receptor-2 (GPR-2, CCR10) binds the skin-associated chemokine CCL27 (CTACK/ALP/ILC). J. Immunol. 164, p. 3465–3470.
Hoogewerf AJ., Kuschert GS., Proudfoot AE., Borlat F., Clark-Lewis I., Power CA., Wells TN. (1997). Glycosaminoglycans mediate cell surface oligomerization of chemokines. Biochemistry 36, p. 13570–13578.
Imai T., Hieshima K., Haskell C., Baba M., Nagira M., Nishimura M., Kakizaki M., Takagi S., Nomiyama H., Schall TJ., Yoshie O. (1997). Identification and molecular characterization of fractalkine receptor CX3CR1, which mediates both leukocyte migration and adhesion. Cell 91, p. 521–530.
Imaizumi Y., Sugita S., Yamamoto K., Imanishi D., Kohno T., Tomonaga M., Matsuyama T. (2002). Human T cell leukemia virus type-I Tax activates human macrophage inflammatory protein-3 alpha/CCL20 gene transcription via the NF-kappa B pathway. Int. Immunol. 14, p. 147–155.
Kelner GS., Kennedy J., Bacon KB., Kleyensteuber S., Largaespada DA., Jenkins NA., Copeland NG., Bazan JF., Moore KW., Schall TJ. (1994). Lymphotactin: a cytokine that represents a new class of chemokine. Science 266, p. 1395–1399.
Kim J., Mori T., Chen SL., Amersi FF., Martinez SR., Kuo C., Turner RR., Ye X., Bilchik AJ., Morton DL., Hoon DS. (2006). Chemokine receptor CXCR4 expression in patients with melanoma and colorectal cancer liver metastases and the association with disease outcome. Ann. Surg. 244, p. 113–120.
Kulbe H., Levinson NR., Balkwill F., Wilson JL. (2004). The chemokine network in cancer-much more than directing cell movement. Int. J. Dev. Biol. 48, p. 489–496.
Kuschert GS., Coulin F., Power CA., Proudfoot AE., Hubbard RE., Hoogewerf AJ., Wells TN. (1999). Glycosaminoglycans interact selectively with chemokines and modulate receptor binding and cellular responses. Biochemistry 38, p. 12959–12968.
Legler DF., Loetscher M., Roos RS., Clark-Lewis I., Baggiolini M., Moser B. (1998). B cell-attracting chemokine 1, a human CXC chemokine expressed in lymphoid tissues, selectively attracts B lymphocytes via BLR1/CXCR5. J. Exp. Med. 187, p. 655–660.
Loetscher M., Gerber B., Loetscher P., Jones SA., Piali L., Clark-Lewis I., Baggiolini M., Moser B. (1996). Chemokine receptor specific for IP10 and mig: structure, function, and expression in activated T-lymphocytes. J. Exp. Med. 184, p. 963–969.
Lopez-Giral S., Quintana NE., Cabrerizo M., Alfonso-Perez M., Sala-Valdes M., De Soria VG., Fernandez-Ranada JM., Fernandez-Ruiz E., Munoz C. (2004). Chemokine receptors that mediate B cell homing to secondary lymphoid tissues are highly expressed in B cell chronic lymphocytic leukemia and non-Hodgkin lymphomas with widespread nodular dissemination. J. Leuk. Biol. 76, p. 462–471.
Moser B., Willimann K. (2004). Chemokines: role in inflammation and immune surveillance. Ann. Rheum. Dis. 63 (suppl 2), p. 84–89.
Murphy PM., Baggiolini M., Charo IF., Hebert CA., Horuk R., Matsushima K., Miller LH., Oppenheim JJ., Power CA. (2000). International union of pharmacology. XXII. Nomenclature for chemokine receptors. Pharmacol. Rev. 52, p. 145–176.
Nakano K., Isegawa Y., Zou P., Tadagaki K., Inagi R., Yamanishi K. (2003). Kaposi’s sarcoma-associated herpesvirus (KSHV)-encoded vMIP-I and vMIP-II induce signal transduction and chemotaxis in monocytic cells. Arch. Virol. 148, p. 871–890.
Neel NF., Schutyser E., Sai J., Fan GH., Richmond A. (2005). Chemokine receptor internalization and intracellular trafficking. Cytokine Growth Factor Rev. 16, p. 637–658.
Ngo VN., Korner H., Gunn MD., Schmidt KN., Riminton DS., Cooper MD., Browning JL., Sedgwick JD., Cyster JG. (1999). Lymphotoxin alpha/beta and tumor necrosis factor are required for stromal cell expression of homing chemokines in B and T cell areas of the spleen. J. Exp. Med. 189, p. 403–412.
Nilsson G., Mikovits JA., Metcalfe DD., Taub DD. (1999). Mast cell migratory response to interleukin-8 is mediated through interaction with chemokine receptor CXCR2/Interleukin-8RB. Blood 93, p. 2791–2797.
Okada T., Ngo VN., Ekland EH., Forster R., Lipp M., Littman DR., Cyster JG. (2002). Chemokine requirements for B cell entry to lymph nodes and Peyer’s patches. J. Exp. Med. 196, p. 65–75.
Olson TS., Ley K. (2002). Chemokines and chemokine receptors in leukocyte trafficking. Am. J. Physiol. Regul. Integr. Comp. Physiol. 283, p. R7–28.
Parsey MV., Lewis GK. (1993). Actin polymerization and pseudopod reorganization accompany anti-CD3-induced growth arrest in Jurkat T cells. J. Immunol. 151, p. 1881–1893.
Pistoia V., Corcione A., Dallegri F., Ottonello L. (2006). Lymphoproliferative disorders and chemokines. Curr. Drug. Targets 7, p. 81–90.
Rossi D., Zlotnik A. (2000). The biology of chemokines and their receptors. Annu. Rev. Immunol. 18, p. 217–242.
Sallusto F., Lanzavecchia A. (2000). Understanding dendritic cell and T-lymphocyte traffic through the analysis of chemokine receptor expression. Immunol. Rev. 177, p. 134–140.
Strieter RM., Polverini PJ., Arenberg DA., Kunkel SL. (1995). The role of CXC chemokines as regulators of angiogenesis. Shock 4, p. 155–160.
Syrbe U., Siveke J., Hamann A. (1999). Th1/Th2 subsets: distinct differences in homing and chemokine receptor expression? Springer Semin. Immunopathol. 21, p. 263–285.
Tachibana K., Hirota S., Iizasa H., Yoshida H., Kawabata K., Kataoka Y., Kitamura Y., Matsushima K., Yoshida N., Nishikawa S., Kishimoto T., Nagasawa T. (1998). The chemokine receptor CXCR4 is essential for vascularization of the gastrointestinal tract. Nature 393, p. 591–594.
Tanaka T., Bai Z., Srinoulprasert Y., Yang BG., Hayasaka H., Miyasaka M. (2005). Chemokines in tumor progression and metastasis. Cancer Sci. 96, p. 317–322.
Vicari AP., Caux C. (2002). Chemokines in cancer. Cytokine Growth Factor Rev. 13, p. 143–154.
Vicari AP., Figueroa DJ., Hedrick JA., Foster JS., Singh KP., Menon S., Copeland NG., Gilbert DJ., Jenkins NA., Bacon KB., Zlotnik A. (1997). TECK: a novel CC chemokine specifically expressed by thymic dendritic cells and potentially involved in T cell development. Immunity 7, p. 291–301.
Wong S., Fulcher D. (2004). Chemokine receptor expression in B-cell lymphoproliferative disorders. Leuk. Lymphoma 45, p. 2491–2496.
Wu D., LaRosa GJ., Simon MI. (1993). G protein-coupled signal transduction pathways for interleukin-8. Science 261, p. 101–103.
Wu S., Gessner R., Taube T., Korte A., von Stackelberg A., Kirchner R., Henze G., Seeger K. (2006). Chemokine IL-8 and chemokine receptor CXCR3 and CXCR4 gene expression in childhood acute lymphoblastic leukemia at first relapse. J. Pediatr. Hematol. Oncol. 28, p. 216–220.
Wymann MP., Kernen P., Bengtsson T., Andersson T., Baggiolini M., Deranleau DA. (1990). Corresponding oscillations in neutrophil shape and filamentous actin content. J. Biol. Chem. 265, p. 619–622.
Yoshida R., Imai T., Hieshima K., Kusuda J., Baba M., Kitaura M., Nishimura M., Kakizaki M., Nomiyama H., Yoshie O. (1997). Molecular cloning of a novel human CC chemokine EBI1-ligand chemokine that is a specific functional ligand for EBI1, CCR7. J. Biol. Chem. 272, p. 13803–13809.
Yoshida R., Nagira M., Kitaura M., Imagawa N., Imai T., Yoshie O. (1998). Secondary lymphoid-tissue chemokine is a functional ligand for the CC chemokine receptor CCR7. J. Biol. Chem. 273, p. 7118–7122.
Zhang R., Tian L., Chen LJ., Xiao F., Hou JM., Zhao X., Li G., Yao B., Wen YJ., Li J., Zhang L., Chen XC., Luo F., Peng F., Jiang Y., Wei YQ. (2006). Combination of MIG (CXCL9) chemokine gene therapy with low-dose cisplatin improves therapeutic efficacy against murine carcinoma. Gene Ther. 13, p. 1263–1271.
Zlotnik A., Yoshie O. (2000). Chemokines: a new classification system and their role in immunity. Immunity 12, p. 121–127.
Para citar este artículo
Acerca de: Catherine Burteau
Faculté universitaire des Sciences agronomiques de Gembloux. Unité de Biologie cellulaire et moléculaire. Avenue Maréchal Juin, 13. B-5030 Gembloux (Belgique). E-mail : burteau.c@fsagx.ac.be
Acerca de: Luc Willems
Faculté universitaire des Sciences agronomiques de Gembloux. Unité de Biologie cellulaire et moléculaire. Avenue Maréchal Juin, 13. B-5030 Gembloux (Belgique).
Acerca de: Richard Kettmann
Faculté universitaire des Sciences agronomiques de Gembloux. Unité de Biologie cellulaire et moléculaire. Avenue Maréchal Juin, 13. B-5030 Gembloux (Belgique).






