- Portada
- Volume 15 (2011)
- numéro 2
- Activité antimicrobienne et composition chimique de l'huile essentielle de Plectranthus aromaticus Roxb. de l'Ile de la Grande Comore
Vista(s): 0 (0 ULiège)
Descargar(s): 0 (0 ULiège)
Activité antimicrobienne et composition chimique de l'huile essentielle de Plectranthus aromaticus Roxb. de l'Ile de la Grande Comore

Notes de la rédaction
Reçu le 27 avril 2010, accepté le 5 octobre 2010
Résumé
Ce travail vise l'étude de l'activité antibactérienne et antifongique et de la composition chimique de l'huile essentielle de Plectranthus aromaticus de l'Ile de la Grande Comore. Cette espèce a fourni une huile essentielle avec un rendement de 1,31 %. Les analyses chromatographiques (CPG et CG-SM) de l'essence de P. aromaticus ont permis d'identifier environ 32 constituants dont trois sont majoritaires : le trans-verbenol (23,11 %), le carvacrol (22,96 %) et le 1,4-cinéol (14,50 %). L'activité antimicrobienne de cette huile a été étudiée vis-à-vis de sept micro-organismes. L'huile essentielle de P. aromaticus s'est révélée antibactérienne et antifongique à faible concentration.
Abstract
Antimicrobial activity and chemical composition of Plectranthus aromaticus Roxb. essential oil from Grande Comore Island. This work aims to study the antibacterial and antifungal activity and chemical composition of Plectranthus aromaticus essential oil from Grande Comore Island. This species has provided an essential oil with a yield of 1.31%. The chromatographic analysis (GC and GC/MS) of the essence of P. aromaticus has identified about 32 constituents which are the most dominant: the trans-verbenol (23.11%), carvacrol (22.96%) and 1,4-cineol (14.50%). The antimicrobial activity of this oil has been studied with respect to seven microorganisms. The essential oil of P. aromaticus has proven antibacterial and antifungal activity at low concentrations.
Tabla de contenidos
1. Introduction
1Le genre Plectranthus (Lamiaceae) regroupe environ 300 espèces. Aux Comores, l'espèce la plus répandue est Plectranthus aromaticus Roxb. [Plectranthus aromatica ou Plectranthus amboinicus (Lour.) Spreng] (Adjanohoun et al., 1982 ; Parra et al., 1999 ; Villate et al., 1999 ; Lukhoba et al., 2006). P. aromaticus, décrite comme originaire d'Inde, est une herbe robuste semi-crassulescente. La tige est couverte de poils laineux avec des feuilles opposées, largement ovales, canées ou arrondies à la base charnue, brièvement acuminées ou arrondies au sommet, à bords crénelés, très odorantes, mesurant de 3 à 5 cm de large ; présence de 4 à 6 paires de nervures latérales proéminentes en dessous. Leurs fleurs sont blanchâtres avec une corolle à deux lèvres disposées autour de l'épi (Adjanohoun et al., 1982 ; Faujour, 2002). Les feuilles sont très fortement et agréablement aromatiques. P. aromaticus pousse sur les terrains vagues et ombragés, dans les zones boisées, en particulier les endroits rocheux, mais peut être trouvée sur de nombreux rochers de granit ou des sols volcaniques. Elle se rencontre quelquefois sur les décombres des cases délabrées ou sur des terres cultivées (Adjanohoun et al., 1982 ; Adjanohoun et al., 1983 ; Gurib-Fakim et al., 2000 ; Faujour, 2002). Le genre Plectranthus est rencontré principalement en Afrique subsaharienne et à Madagascar, mais s'étend au Sud de la péninsule arabique, en Inde et, pour quelques espèces, en Malaisie, Indonésie, Australie et quelques iles du Pacifique (Forster et al., 2002 ; Van Jaarsveld, 2006).
2De nombreuses espèces de Plectranthus sont des plantes d'intérêt ornemental, économique et médicinal. Plusieurs espèces sont utilisées partout dans le monde comme vermicides, antiseptiques et purgatifs, pour le traitement des infections de l'oreille, des maux de dents et d'estomac, comme un remède contre les vomissements, les nausées et un vaste éventail d'autres maladies (Cousins, 1994 ; Lukhoba et al., 2006). Comme beaucoup de Lamiaceae, P. aromaticus fait partie de la pharmacopée traditionnelle. Les feuilles sont utilisées dans la médecine traditionnelle pour le traitement de plusieurs maladies, mais elles servent aussi dans le domaine culinaire pour aromatiser les plats, notamment en Jamaïque, à l'ile Maurice et aux Seychelles (Forster et al., 2002 ; Gurib-Fakim et al., 2004 ; Van Jaarsveld, 2006).
3Aux Comores, les feuilles ont des usages contre la grippe, la toux et la bronchite. La décoction de la plante entière est utilisée comme un sédatif des coliques abdominales et de la dysenterie. Les feuilles sont employées en fumigation contre le paludisme (Monjoin, 1981 ; Faujour, 2002 ; Kaou et al., 2008). En outre, une fois séchées, les feuilles sont très appréciées en tisane. Associé à du miel, le jus extrait ou l'infusion des feuilles traite la toux, le rhume, l'eczéma et les rhumatismes aux Comores, à l'Ile Maurice, à Madagascar et aux Seychelles (Adjanohoun et al., 1982 ; Gurib-Fakim et al., 2001 ; Gurib-Fakim et al., 2004).
4Des études ont été entreprises pour déterminer la composition des huiles essentielles de certaines espèces de Plectranthus (Plectranthus spp., P. aromaticus, P. grandis, P. ornatus et P. frutescens) dans plusieurs pays, notamment aux Seychelles, à l'ile Maurice et au Brésil (Bos et al., 1983 ; Gurib-Fakim et al., 2001 ; de Albuquerque et al., 2007). Cependant, à notre connaissance, aucune étude phytochimique n'a été réalisée sur cette espèce aux Comores. Seules quelques enquêtes ethnobotaniques ont été effectuées sur cette plante par Adjanohoun et al. (1982) et aussi dans le cadre du PLARM (Plantes Aromatiques et Médicinales de l'Océan Indien : Comores, Madagascar, Maurice, Seychelles), 1990-1997. Ainsi, au cours de cette étude, nous nous sommes intéressés à la caractérisation de la composition chimique et à la détermination de l'activité antibactérienne et antifongique de l'huile essentielle de P. aromaticus de l'Ile de la Grande Comore.
2. Matériel et méthodes
2.1. Matériel
5Matériel végétal. Les feuilles de P. aromaticus ont été récoltées au mois de mai 2009 à Bouèni dans la région d'Oichili, village situé à environ 850 m d'altitude sur le flan du volcan Karthala, à l'Est de l'Ile de la Grande Comore. Les échantillons ont subi un séchage à l'ombre de 15 jours pour faciliter leur stockage.
6Micro-organismes étudiés. L'activité antibactérienne et antifongique a été évaluée sur différents micro-organismes.
7Bactéries. Les quatre souches bactériennes (Bacillus subtilis, Escherichia coli, Micrococcus luteus et Staphylococcus aureus) choisies au cours de cette étude sont à l'origine de plusieurs infections (urinaire, intestinale, respiratoire, etc.). Ces souches bactériennes ont été fournies par l'ATCC (American Type Culture Collection). Elles sont entretenues par repiquage sur gélose nutritive favorable à leur croissance pendant 24 h, à l'obscurité et à 37 °C.
8Champignons. Quant aux trois champignons (Aspergillus niger, Penicillium expansum et Penicillium digitatum), ils sont choisis pour leur capacité à contaminer les denrées alimentaires et leur pathogénicité. Ces trois champignons utilisés dans les tests appartiennent à la collection de la mycothèque du Laboratoire de Mycologie du Centre de Recherche Forestière à Rabat. Ils sont cultivés sur le milieu nutritif PDA (Potato Dextrose Agar) pendant 7 jours, à 25 °C et à l'obscurité.
2.2. Méthodes
9Extraction des huiles essentielles. L'extraction des huiles essentielles a été effectuée sur les échantillons par hydrodistillation dans un appareil de type Clevenger (Clevenger, 1928). Pour chaque échantillon, trois distillations ont été réalisées par ébullition pendant 1 h 30 min à partir de 150 g de matériel végétal séché avec 1 l d'eau dans un ballon de 2 l surmonté d'une colonne de 60 cm de longueur relié à un réfrigérant. Le rendement en huile essentielle a été déterminé par rapport à la matière sèche, évalué à partir de 3 échantillons de 30 g séchés durant 48 h à l'étuve à 60 °C. Les échantillons d'huile essentielle ont été stockés à 4 °C à l'obscurité, en présence de sulfate de sodium anhydre.
10Analyse chromatographique. Les analyses chromatographiques ont été effectuées sur un chromatographe en phase gazeuse à régulation électronique de pression de type Hewlett Packard (série HP 6890), équipé d'une colonne capillaire HP-5 (30 m x 0,25 mm) avec une épaisseur de film de 0,25 μm, d'un détecteur FID réglé à 250 °C et alimenté par un mélange de gaz H2/air et un injecteur split-splitless réglé à 250 °C. Le mode d'injection est split (rapport de fuite : 1/50, débit : 66 ml.min-1). Le gaz utilisé est l'azote avec un débit de 1,7 ml.min-1. La température de la colonne est programmée de 50 à 200 °C à raison d'une montée de 4 °C.min-1 pendant 5 min. L'appareil est piloté par un système informatique de type « HP ChemStation », gérant le fonctionnement de l'appareil et permettant de suivre l'évolution des analyses chromatographiques. L'identification des constituants a été réalisée en se basant sur leurs indices de Kováts (IK) et sur la chromatographie en phase gazeuse couplée à la spectrométrie de masse (CG-SM). Cette dernière est réalisée sur un chromatographe en phase gazeuse de type Hewlett-Packard (série HP 6890) couplé avec un spectromètre de masse (série HP 5973). La fragmentation est effectuée par impact électronique sous un champ de 70eV. La colonne utilisée est une colonne capillaire HP-5MS (30m x 0, 25 mm), l'épaisseur du film est de 0,25 μm. La température de la colonne est programmée de 50 à 200 °C à raison de 4 °C.min-1 pendant 5 min. Le gaz vecteur est l'hélium dont le débit est fixé à 1,5 ml.min-1. Le mode d'injection est split (rapport de fuite : 1/70, débit 112 ml.min-1). L'appareil est relié à un système informatique gérant une bibliothèque de spectre de masse NIST 98. Pour les analyses chromatographiques, les huiles essentielles ont été diluées dans le méthanol (1/20 v/v). L'identification des constituants est basée sur la comparaison de leurs spectres de masse (CPG/SM) respectifs avec les spectres de la bibliothèque (NIST 98) et de la bibliographie (Adams, 1995) et sur la base de calcul des indices de Kováts.
2.3. Procédure microbiologique
11Les concentrations minimales inhibitrices (CMI) des huiles essentielles ont été déterminées selon la méthode rapportée par Remmal et al. (1993) et Satrani et al. (2001). Du fait de la non-miscibilité des huiles essentielles à l'eau et donc au milieu de culture, une mise en émulsion a été réalisée grâce à une solution d'agar à 0,2 %. Elle permet d'obtenir, dans le milieu, une répartition homogène des huiles essentielles et d'augmenter au maximum le contact germe/composé. Des dilutions sont préparées au 1/10e, 1/25e, 1/50e, 1/100e, 1/200e, 1/300e et 1/500e dans cette solution d'agar. Dans des tubes à essai contenant chacun 13,5 ml du milieu solide TSA (Tryptic Soja Agar) pour les bactéries et le PDA (Potato Dextrose Agar) pour les champignons, stérilisés à l'autoclave pendant 20 min à 121 °C et refroidis à 45 °C, on ajoute aseptiquement 1,5 ml de chacune des dilutions de façon à obtenir les concentrations finales de 1/100, 1/250, 1/500, 1/1 000, ½ 000, 1/3 000 et 1/5 000 (v/v). On agite les tubes afin de bien disperser l'huile essentielle dans le milieu de culture avant de les verser dans les boites de Petri. Des témoins, contenant le milieu de culture et la solution d'agar à 0,2 % seule, sont également préparés. L'ensemencement se fait par stries à l'aide d'une anse de platine calibrée afin de prélever le même volume d'inoculum. Ce dernier se présente sous forme de bouillon de culture de 24 h pour les bactéries et sous forme d'une suspension dans l'eau physiologique de spores provenant d'une culture de 7 jours dans le PDA pour les champignons. Pour ces derniers, l'ensemencement se fait par dépôt de fragments de 1 cm3 de diamètre, prélevés à partir de la périphérie d'un tapis mycélien et provenant d'une culture de 7 jours dans l'extrait de malt. L'incubation se fait à 37 °C pendant 24 h pour les bactéries et à 25 °C pendant 7 jours pour les champignons. Chaque essai est répété trois fois.
3. Résultat et discussion
3.1. Rendement
12L'huile essentielle des échantillons de P. aromaticus obtenue est de couleur jaunâtre à odeur épicée avec une note de cannelle. Le rendement déterminé par rapport à la matière sèche est de 1,31 %. Cette même espèce originaire des Seychelles a fourni par le même procédé de distillation une huile essentielle de couleur orange clair, à odeur phénolique avec un soupçon de cannelle (Gurib-Fakim, 2001). Sa teneur en huile essentielle était faible par rapport à celle de l'Ile de la Grande Comore et n'a pas dépassé 0,2 %. Le taux enregistré en huile essentielle de P. aromaticus d'origine comorienne est, en outre, très important par rapport à celui d'autres espèces de genre Plectranthus du Brésil, notamment P. grandis (0,1 %) et P. ornatus (0,2 %) (Bos et al., 1983 ; de Albuquerque et al., 2007). Cette différence en rendement peut être attribuée à plusieurs facteurs dont essentiellement, l'origine, l'espèce, la période de récolte, la durée de séchage et la technique d'extraction des huiles essentielles (Russo et al., 1998 ; Van Damme, 2001 ; Karousou et al., 2005 ; Pibiri, 2005 ; Loziene et al., 2005 ; Curado et al., 2006).
3.2. Composition chimique
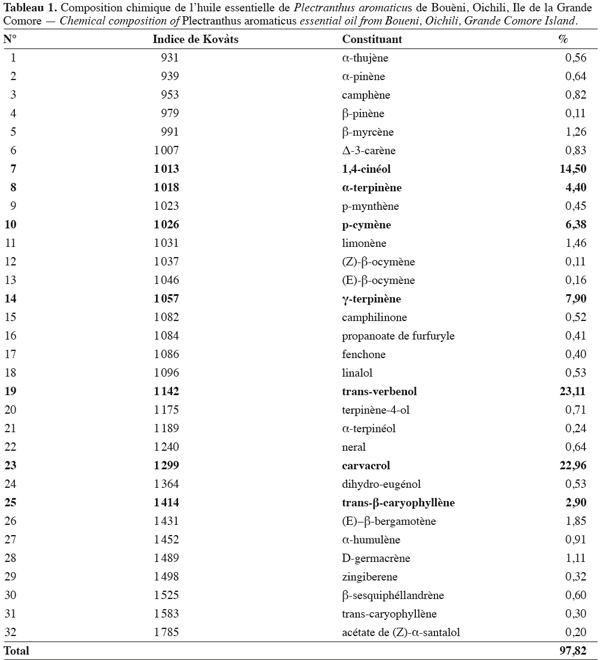
13L'huile essentielle de P. aromaticus a été analysée par CPG-FID et par CPG-SM. Les résultats obtenus ont permis d'identifier 32 constituants représentant environ 97,82 % de cette essence (Tableau 1). Les principaux composés sont le trans-verbenol (23,11 %), le carvacrol (22,96 %), le 1,4-cinéol (14,50 %), le γ-terpinène (7,90 %), le p-cymène (6,38 %), l'α-terpinène (4,40 %) et le trans-β-caryophyllène (2,90 %). Une analyse de l'huile essentielle de P. aromaticus des Seychelles, étudiée par Gurib-Fakim en 2001, a donné comme composés majoritaires le p-cyminène (45,7 %), le p-cymène (11,8 %), le carvacrol (9,9 %) ; le γ-terpinène (9,3 %), l'α-terpinène (4,6 %), le limonène (3,6 %) et le β-caryophyllène (2,7 %). On note que la composition chimique de l'huile essentielle de P. aromaticus de l'Ile de la Grande Comore est différente de celle des Seychelles. On remarque aussi que le trans-verbenol, composé majoritaire de l'huile essentielle de P. aromaticus d'origine comorienne, est complètement absent dans celle en provenance des Seychelles. Par contre, l'huile essentielle de P. aromaticus de l'Ile de la Grande Comore ne contient pas du p-cyminène qui est le composé majoritaire de l'huile originaire des Seychelles. En outre, l'huile essentielle de P. aromaticus étudiée est plus riche en carvacrol (22,96 %) par rapport à la seychelloise (9,99 %). Une étude a été menée par Bos et al. (1983) sur l'huile essentielle de Plectranthus frutescens du Brésil et il a trouvé que le carvacrol est le composé majoritaire avec une teneur de 60 %. Par ailleurs, la composition chimique de l'huile essentielle de Plectranthus grandis du Brésil est caractérisée par la dominance d'eugénol, du trans-β-caryophyllène et du D-germacrène (de Albuquerque et al., 2007). Ces mêmes auteurs ont observé que l'essence de Plectranthus ornatus est riche en eugénol et en thymol. Les constituants de ces espèces de Plectranthus sont donc très différents de ceux de l'huile essentielle de P. aromaticus. Ceci montre que la composition chimique des huiles essentielles des Plectranthus dépend de l'espèce, de la provenance et du patrimoine génétique (Boira et al., 1998 ; Russo et al., 1998 ; Thomson et al., 2003 ; Karousou et al., 2005 : Loziene et al., 2005).
3.3. Activité antibactérienne de l'huile essentielle
14Au cours de nos investigations, l'activité antimicrobienne a été évaluée en observant le pouvoir inhibiteur de notre échantillon d'huile essentielle de P. aromaticus à différentes concentrations sur les bactéries et les champignons à tester. Les résultats sont regroupés dans le tableau 2.

15En effet, l'huile essentielle de P. aromaticus a montré un important effet inhibiteur contre les micro-organismes étudiés. Toutes les souches microbiennes ont été inhibées à la concentration de 1/500 v/v. Les micro-organismes les plus sensibles à cette huile essentielle étaient Micrococcus luteus et Penicillium digitatum dont la croissance a été arrêtée à la faible concentration de 1/1000 v/v. Suite à ces résultats, l'huile essentielle de P. aromaticus de l'Ile de la Grande Comore a manifesté des caractéristiques antibactériennes et antifongiques très intéressantes sur les micro-organismes testés. Ceci est en accord avec les investigations de plusieurs auteurs qui ont montré que l’essence de Plectranthus aromaticus inhibe le développement mycélien de Staphylococcus aureus et qu’elle a un pouvoir antimicrobien (Gurgel et al., 2009 ; Da Costa et al., 2010). Les propriétés antimicrobiennes des huiles essentielles de plusieurs plantes aromatiques et médicinales ont été attribuées à leur profil chimique et surtout aux alcools terpéniques (Kurita et al., 1982 ; Bouchikhi, 1994 ; Tantaoui-Elarki et al., 1994 ; Faid et al., 1996 ; Chang et al., 2001 ; Karaman et al., 2001 ; Baydat et al., 2004 ; Pibiri, 2005 ; Satrani et al., 2006). En effet, l'action antimicrobienne de l'huile essentielle de P. aromaticus originaire de Bouèni s'explique par sa richesse en alcools terpéniques et en phénols dont le taux global est d'environ 62 % (Lee et al., 1985 ; Tantaoui-Elarki et al., 1994 ; Obeng-Ofori et al., 1997 ; Prates et al., 1998 ; Inouye et al., 2001 ; Pibiri, 2005 ; Suschke et al., 2006). En outre, le fort pouvoir inhibiteur de cette huile contre les micro-organismes est dû essentiellement à ces principaux constituants, le trans-verbenol (23 %), le carvacrol (22,05 %) et le 1,4-cinéol (14,33 %). Plusieurs travaux ont montré que ces trois composés sont dotés d'un grand pouvoir antibactérien et antifongique (Chaumont et al., 1989 ; Lattaoui et al., 1994 ; Senatore et al., 2004 ; Malecky, 2007 ; Nikitina et al., 2009). En plus, l’activité antimicrobienne de l’huile essentielle de P. aromaticus peut être attribuée au phénomène de synergie entre tous les constituants volatils. Selon plusieurs études (Franchomme, 1981 ; Gueldner, 1985 ; Kivanc et al., 1988 ; Thomson et al., 2003 ; Burt, 2004 ; Zhiri et al., 2005 ; Viuda-Martos et al., 2008), les interactions synergiques entre les différents composés peuvent être l'origine d'une activité beaucoup plus prononcée que celle prévisible pour les composés majoritaires.
4. Conclusion
16Plectranthus aromaticus a fourni une huile essentielle avec un rendement assez important de 1,31 %. Les analyses chromatographiques et spectrométriques ont permis de déterminer la composition chimique des huiles essentielles de cette plante pour environ 97,8 % des constituants. Plectranthus aromaticus présente une huile essentielle dont les trois principaux composés sont le trans-verbenol (23,11 %), le carvacrol (22,96 %) et 1,4-cinéol (14,50 %). Grâce à sa richesse en composés phénoliques et en alcools terpéniques, l'essence de P. aromaticus s'est révélée efficace contre les sept micro-organismes étudiés à faible concentration. Ces résultats préliminaires peuvent être complétés par d'autres études plus approfondies (tests toxicologiques, mode d'application, cout, etc.) afin d'exploiter les propriétés antibactériennes et antifongiques de l'huile de P. aromaticus d'origine comorienne. Elle peut être employée comme agent conservateur des denrées alimentaires et dans différents domaines tels que l'industrie phytosanitaire, cosmétique et pharmaceutique. En plus, avec son rendement élevé en huile essentielle et sa facilité de culture, P. aromaticus pourrait être développé dans le cadre d'une politique de valorisation et de diversification des plantes aromatiques et médicinales des Comores.
Bibliographie
Adams R.P., 1995. Identification of essential oil components by gaz chromatography/mass spectroscopy. Carol Stream, IL, USA: Allured.
Adjanohoun E.J. et al., 1982. Contribution aux études ethnobotaniques aux Comores. Paris : ACCT.
Adjanohoun E.J. et al., 1983. Contribution aux études ethnobotaniques et floristiques aux Seychelles. Paris : ACCT.
Baydat H., Sagdic O., Ozkan G. & Karadogan T., 2004. Antibacterial activity and composition of essential oils from Origanum, Thymus and Satureja species with commercial importance in Turkey. Food Control, 15, 169-72.
Boira H. & Blanquer A., 1998. Environmental factors affecting chemical variability of essential oils in Thymus piperella L. Biochem. Syst. Ecol., 26, 811-822.
Bos R. et al., 1983. La composition de l'huile essentielle dans les feuilles de C. aromaticus Bentham et leur importance en tant que composante de l'espèce Antiaphthosea. Pharm. Weekbl. Ned. Sci. Ed., 5, 129-134.
Bouchikhi T., 1994. Activité antimicrobienne de quelques huiles essentielles. Thèse de doctorat d’État : Université Blaise Pascal, Clermont-Ferrand (France).
Burt S., 2004. Essential oils: their antibacterial properties and potential applications in foods. Int. J. Food Microbiol., 94, 223-253.
Chang S.T., Chen P.F. & Chang S.C., 2001. Antibacterial activity of leaf essential oils and their constituents from Cinnamomum osmophloem. J. Ethnopharmacol., 77, 123-127.
Chaumont J.P. & Leger D., 1989. Propriétés antifongiques de quelques phénols et composés chimiquement très voisins. Relations structure-activité. Plant Med. Phytother., 23(2), 124-126.
Clevenger J.F., 1928. Apparatus for the determination of volatile oil. J. Am. Pharm. Assoc., 17(4), 346-351.
Cousins D.J., 1994. Medicinal, essential oil, culinary herb and pesticidal plants of the Labiatae. Wallingford, UK: CAB International, 226-234.
Curado M.A. et al., 2006. Environmental factors influence on chemical polymorphism of the essential oils of Lychnophora ericoides. Phytotherapy, 67, 2363-2369.
Da Costa José G.M., Pereira Carla K.B., Rodrigues Fabiola F.G. & Delima Sidney G., 2010. Chemical composition, antibacterial and fungicidal activities of leaf oil of Plectranthus amboinicus (Lour.) Spreng. J. Essential Oil Res., 22(2), 183-185.
de Albuquerque R.L. et al., 2007. Chemical composition and antioxidant activity of Plectranthus grandis and P. ornatus essential oils from north-eastern Brazil. Flavour Fragrance J., 22(1), 24-26.
Faid M., Charal M. & Mosaddak M., 1996. Chemical composition and antimicrobial activities of two aromatic plants: Origanum majorana L. and O. compactum Benth. J. Essent. Oil Res., 8, 657-664.
Faujour A., 2002. Contribution à l'amélioration des soins de santé primaires par une investigation scientifique de la pharmacopée traditionnelle populaire des Comores. Bilan de la phase pilote du projet. Moroni : CNDRS.
Forster P.L., Van Jaarsveld E.J. & Eggli U., 2002. Illustrated handbook of succulent plants. Dicotyledons. Berlin ; New York, USA: Springer, Ill. XLVIII c, d, e, g, h, 291-303.
Franchomme P., 1981. L'aromatologie à visée anti-infectieuse. Phytomédecine, 1-2, 25-47.
Gueldener R.C., Wilson D.M. & Heidt A., 1985. Volatile compounds inhibiting Aspergillus's flavus. J. Agric. Food, 33, 413-419.
Gurgel A.P.A.D. et al., 2009. Antibacterial effects of Plectranthus amboinicus (Lour.) Spreng (Lamiaceae) in Methicillin Resistant Staphylococcus aureus (MRSA). Biol. Res., 3(3-4), 117-122.
Gurib-Fakim A. & Guého J., 2000. Plantes médicinales des Comores, de Madagascar, des Mascareignes (Maurice et Rodrigues) et des Seychelles. Rapport ethnobotanique et phytochimique sur le projet « Inventaire et Étude des Plantes Médicinales et des Plantes Aromatique des États de l’Océan Indien (1990-1997) ». Quatre Bornes, Ile Maurice : Commission de l’Océan Indien/European Union.
Gurib-Fakim A., Guého J. & Bissoondoyal M.D., 2001. Plantes médicinales de Maurice (Cucurbitaceae-Oxalidaceae). Vol. 2. Ile Maurice : Éditions de l’Océan Indien.
Gurib-Fakim A. & Brendler T., 2004. Medicinal and aromatic plants of Indian Ocean Islands: Madagascar, Comoros, Seychelles and Mascareignes. 2nd ed. Stuttgart, Germany: Medpharm GmbH Scientific Publishers.
Inouye S., Takizawa T. & Yawamagushi H., 2001. Antibacterial activity of essential oils and their majors constituents against respiratory tract pathogens by gaseous contact. J. Antimicrob. Chemother., 47, 565-573.
Kaou A.M. et al., 2008. Antimalarial activity of crude extracts from nine African medicinal plants. J. Ethnopharmacol., 116, 74-83.
Karaman S., Digrak M., Ravid U. & IIcim A., 2001. Antibacterial and antifungal activity of the essential oil of Thymus revolutus Celak from Turkey. J. Ethnopharmacol., 76, 183-186.
Karousou R., Koureas D.N. & Kokkini S., 2005. Essential oil composition is related to the natural habitats: Coridothymus capitatus and Satureja thymbra in NATURA 2000 sites of Crete. Phytochemistry, 66, 2668-2673.
Kivanc M. & Akgül A., 1988. Effect of some essential oil components on the growth of food borne bacteria and synergism with some food ingredients. Flavour Fragrance J., 3, 95-98.
Kurita N. & Koike S., 1982. Synergetic antimicrobial effect of sodium chloride and essential oils components. Agric. Biol. Chem., 46, 159-165.
Lattaoui N. & Tantaoui-Elaraki A., 1994. Individual and combined antibacterial activity of the main components of three thyme essential oils. Riv. Ital. EPPOS, 13, 13-19.
Lee K.-H., Ibuka T., Wu Y. & Geissman T.A., 1985. Structure-antimicrobial activity relationships among the sesquiterpenes lactones and related compounds. Photochemistry, 16, 1171-1181.
Loziene K. & Venskutonis P.R., 2005. Influence of environmental and genetic factors on the stability of essential oil composition of Thymus pulegioides. Biochem. Syst. Ecol., 33, 517-525.
Lukhoba C.W., Simmonds M.S.J. & Paton A.I., 2006. Plectranthus: a review of ethnobotanical uses. J. Ethnopharmacol., 103, 1-24.
Malecky M., 2007. Métabolisme des terpénoïdes chez les caprins. Thèse de doctorat : Institut des Sciences et Industries du Vivant et de l’Environnement, AgroParisTech (France).
Monjoin M., 1981. Possibilité d'utiliser la médecine traditionnelle pour améliorer les soins de santé primaires aux Comores. Thèse de doctorat : Université de Bordeaux II (France).
Nikitina L.E. et al., 2009. Synthesis and antifungal activity of compounds of the pinane series. Pharm. Chem. J., 43(5), 20.
Obeng-Ofori D., Reichmuth C.H., Bekele & Hassanali A., 1997. Biological activity of 1,8-cineole, a major component of essential oil of Ocimum kenyense (Ayobeingira) against stored product beetles. J. Appl. Entomol., 121, 237-243.
Parra A.V. et al., 1999. Plectranthus amboinicus (Lour.) Spreng. (Oregano Francés). Estudio toxicogenético de un extracto fluido y del aceite esencial. Rev. Cubana Plant. Med., 3(2), 68-73.
Pibiri P., 2005. Assainissement microbiologique de l'air et de systèmes de ventilation au moyen d'huiles essentielles. Thèse de doctorat : Faculté Environnement Naturel, Architectural et Construit, EPFL (Suisse).
Prates H.T. et al., 1998. Insecticidal activity of monoterpenes against Rhyzopertha dominica F. and Tribolium castaneum H. J. Stored. Prod. Res., 34, 243-249.
Remmal A. et al., 1993. Improved method for determination of antimicrobial activity of essential oils in agar medium. J. Essent. Oil Res., 5(2),179-184.
Russo M., Galleti G., Bocchini P. & Garnacini A., 1998. Essential oil chemical composition of wild populations of Italian oregano spice (Origanum vulgare ssp. hirtum (Link) letswaart): a preliminary evaluation of their use in chemotaxonomy by cluster analysis. 1. Inflorescences. J. Agric. Food Chem., 46, 3741-3746.
Satrani B. et al., 2001. Composition chimique et activité antimicrobienne des huiles essentielles de Satureja calamintha et Satureja alpina du Maroc. Ann. Falsif. Expert. Chim. Toxicol., 94(956), 241-250.
Satrani B., Farah A. & Talbi M., 2006. Effet de la distillation sur la composition chimique et l’activité antimicrobienne des huiles essentielles de Myrte (Myrtus communis L.) du Maroc. Acta Bot. Gallica, 153(2), 235-242.
Senatore F. et al., 2004. Composition and antimicrobial activity of the essential oil of Achillea falcata L. (Asteraceae). Flavour Fragrance J., 20(3), 291-294.
Suschke U., Geiss H.K. & Reichling J., 2006. Antibacterial activity of the essential oils of catnip (Nepeta cataria L.) and lemon balm (Melissa officinalis L.) against clinical isolates from the respiratory tract. Planta Med., 72, 992.
Tantaoui-Elaraki A. & Beraoud L., 1994. Inhibition of growth and aflatoxin production in Aspergillus parasiticus by essential oils of selected plant materials. J. Environ. Pathol. Toxicol. Oncol., 13, 67-72.
Thomson J.D. et al., 2003. Qualitative and quantitative variation in monoterpene co-occurrence and composition in the essential oil of Thymus vulgaris chemotypes. J. Chem. Ecol., 29(4), 859-880.
Van Damme P., 2001. Pesticide, drug and essential oil crops. In: Raemakers R.H., ed. Crop production in tropical Africa. Brussels, Belgium : Directorate General for International Cooperation (DGIC), 1155-1166.
Van Jaarsveld E., 2006. The Southern African Plectranthus and the art of turning shade to glade. Cape, South Africa: Fernwood Press.
Villate M.L. et al., 1999. Plectranthus amboinicus (Lour.) Spreng. (oregano francés): efecto antimuscarinico y potenciación de la adrenilina. Rev. Cubana Plant. Med., 1(4), 29-32.
Viuda-Martos M., Ruiz-Navajas Y., Fernandez-Lopez J. & Perez-Alvarez J.A., 2008. Antibacterial activity of different essential oils obtained from spices widely used in Mediterranean diet. Int. J. Food Sci. Technol., 43, 526-531.
Zhiri A. & Baudoux D., 2005. Huiles essentielles chémotypées et leurs synergies : aromathérapie scientifique. Luxembourg : Édition Inspir Development.
Para citar este artículo
Acerca de: Said Omar Said Hassane
Université Ibn Tofail. Faculté des Sciences. Unité de Formation et de Recherche des Génies des Procédés. Laboratoire de Biotechnologie, Environnement et Qualité. BP 133. MA-14000 Kenitra (Maroc) ‑ Faculté des Sciences et Techniques. Université des Comores. BP 2585. COM-Moroni (Comores) ‑ Centre National de Documentation et de la Recherche Scientifique (CNDRS). BP 169. COM-Moroni (Comores).
Acerca de: Badr Satrani
Centre de Recherche Forestière. BP 763. MA-10050 Rabat Agdal (Maroc). E-mail : badrsat@yahoo.fr
Acerca de: Mohamed Ghanmi
Centre de Recherche Forestière. BP 763. MA-10050 Rabat Agdal (Maroc).
Acerca de: Nazik Mansouri
Centre de Recherche Forestière. BP 763. MA-10050 Rabat Agdal (Maroc) – Université Sidi Mohamed Ben Abdellah. Faculté des Sciences Dhar El Mahraz. BP 2202. MA-30000 Fès (Maroc).
Acerca de: Hayria Mohamed
Université Sidi Mohamed Ben Abdellah. Faculté des Sciences Dhar El Mahraz. BP 2202. MA-30000 Fès (Maroc).
Acerca de: Abdelaziz Chaouch
Université Ibn Tofail. Faculté des Sciences. Unité de Formation et de Recherche des Génies des Procédés. Laboratoire de Biotechnologie, Environnement et Qualité. BP 133. MA-14000 Kenitra (Maroc).






