- Accueil
- Volume 15 (2011)
- numéro 2
- Structure de l'amidon de maïs et principaux phénomènes impliqués dans sa modification thermique
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Structure de l'amidon de maïs et principaux phénomènes impliqués dans sa modification thermique

Notes de la rédaction
Reçu le 28 juillet 2008, accepté le 5 octobre 2010
Résumé
La structure des granules d'amidon de maïs et les principaux phénomènes impliqués dans leurs modifications thermiques sont présentés dans cette revue. Il ressort des connaissances actuelles dans le domaine que les granules d'amidon de maïs (Zea mays L.) sont des entités semi-cristallines, composées principalement d'amylose et d'amylopectine, pouvant subir des réorganisations profondes au cours de leur traitement thermique. La gélatinisation, les transitions vitreuses, les phénomènes de relaxation, la rétrogradation et la formation de complexes amylose-lipides sont les principaux phénomènes impliqués dans ces restructurations et sont à la base des modifications des propriétés techno-fonctionnelles des produits à base d'amidon soumis au chauffage.
Abstract
Structures and phenomena occurring during the heat treatment of cornstarch. The structure of cornstarch and the modifications induced during the heat treatments are presented in this review. Current knowledge indicate that the starch granules are semi-crystalline entities composed mainly by amylose and amylopectin, undergoing deep reorganizations during the heat treatments. Gelatinization, glass transitions, relaxation phenomena, retrogradation and the formation of amylose-lipids complexes are the major phenomena involved in these reorganisations, and are the basis of changes of the techno-functional properties of cornstarch-based products during their heat treatment.
Table des matières
1. Introduction
1L'amidon est, après la cellulose, la principale substance glucidique synthétisée par les végétaux supérieurs à partir de l'énergie solaire. Il constitue une source énergétique indispensable à l'alimentation des êtres vivants et de l'homme en particulier. Les sources d'amidon les plus importantes sont représentées par les céréales, les tubercules et les légumineuses. Certains fruits peuvent également être riches en amidon.
2L'étude de l'amidon peut être envisagée en le considérant soit comme une entité physique caractérisée par une diversité de forme et de taille (Singh et al., 2003), soit comme une entité chimique composée principalement de polymères de glucose ayant une structure cristalline typique (Jenkins et al., 1995) et présentant des comportements particuliers en fonction des conditions hydro-thermiques auxquelles ils ont été soumis et des interactions qu'ils peuvent établir avec d'autres constituants (Tolstoguzov, 2003), soit encore comme entité de caractérisation des espèces en botanique (Reichter, 1913).
3À l'état natif, l'amidon est insoluble dans l'eau froide et est constitué de granules dont la taille, la composition et les propriétés physico-chimiques et fonctionnelles dépendent de l'origine botanique (Li et al., 1994 ; Seetharaman et al., 2001 ; Sandhu et al., 2005) et des conditions de culture (Paterson et al., 2001 ; Hardacre et al., 2006).Ces propriétés peuvent cependant évoluer en fonction des traitements auxquels les granules sont soumis.
4Les modifications que les traitements thermiques induisent sur les amidons ont l'avantage d'être perçues comme naturelles et sont de ce fait mieux acceptées par les consommateurs, comparativement aux modifications induites par voie chimique (Jacobs, 1998). La maitrise de ces modifications nécessite cependant que les mécanismes mis en jeu dans la transformation de la structure des granules soient identifiés et les conditions de leur occurrence connues.
5Les connaissances sur la structure des amidons et les mécanismes de leurs transformations sont éparses et incomplètes (Tang et al., 2006). La présente revue synthétise les connaissances actuelles sur la structure des granules d'amidons de maïs et sur les réorganisations qu'ils subissent pendant leurs traitements thermiques.
2. Structures et composition des granules d'amidon de maïs
2.1. Composition des granules d'amidon de maïs
6Les granules d'amidon sont composés d'une proportion d'amylose et d'amylopectine variable selon la variété de maïs. Seetharaman et al. (2001) rapportent des teneurs en amylose variant entre 16,1 et 23,3 % après analyse de 35 variétés différentes de maïs ; Sandhu et al. (2004) ont quant à eux observé des teneurs en amylose variant entre 15,3 et 25,1 %. Les amidons de certaines variétés sont essentiellement composés d'amylopectine, tandis que d'autres sont beaucoup plus riches en amylose (Rahman et al., 2007).
7L'amylose est un homopolymère linéaire de 600 à 6 000 unités D-glucosyl liées par des liaisons ◊-D-glucopyranoses (1-4) et par de très rares liaisons ◊-D-glycopyranoses (1-6). Il forme des complexes d'inclusion en présence d'acides gras, d'alcools, d'agents tensioactifs et d'autres composés apolaires (Schoch et al., 1944 ; Kugimiya et al., 1980 ; Tester et al., 1990). La formation de ces complexes peut modifier certaines propriétés technofonctionnelles de l'amidon, dont notamment la résistance à l'hydrolyse enzymatique, l'aptitude des granules au gonflement et leur comportement rhéologique à l'empesage (Kim et al., 1993 ; Kar et al., 2005 ; Jaisut et al., 2008). L'amylopectine est un homopolymère extrêmement ramifié, composé de dizaines de milliers d'unités glucose (sous la forme D-glucopyranose) et comportant des zones de ramification résultant de la formation de liaisons ◊-(1-6). Chez les céréales, l'amylopectine comporte principalement deux types de chaines : les premières présentent un degré de polymérisation (DP) de l'ordre de 45 unités de glucose et forment le squelette sur lequel viennent se greffer des chaines plus courtes du second type, ayant un DP compris entre 15 et 20 unités de glucose (Hizukuri, 1985 ; Oates, 1997). L'amylopectine est le constituant majeur de la phase cristalline du granule. Ji et al. (2004) associent la résistance thermique des amidons extraits de certaines lignées de maïs au pourcentage élevé de courtes chaines d'amylopectine présent dans leurs parties cristallines. Cette résistance résulterait principalement du grand nombre de ramifications dans la structure cristalline de ces amidons, ce qui leur conférerait une plus grande résistance à la désarticulation pendant leur traitement thermique.
2.2. Organisation structurale des granules de l'amidon
8Les granules d'amidon sont des entités semi-cristallines organisées sur une échelle à quatre niveaux : l'échelle moléculaire (~ Å), l'échelle lamellaire (~ 90Å), l'échelle dite de croissance radiale (~ 0,1 µm) et l'échelle granulaire (Waigh et al., 2000).
9La structure granulaire est assurée par des liaisons glucosidiques qui forment les homopolymères (amylose et amylopectine) à la base de la formation des granules, ainsi que par des interactions de Van der Waals et des ponts hydrogène qui stabilisent l'organisation des polymères d'hydrates de carbone en doubles hélices (échelle moléculaire). L'empilement des doubles hélices en structures cristallines (échelle lamellaire) et la succession des phases amorphes et cristallines (échelle de croissance radiale) constituent le granule d'amidon (Van den Berg, 1981 ; Imberty et al., 1991).
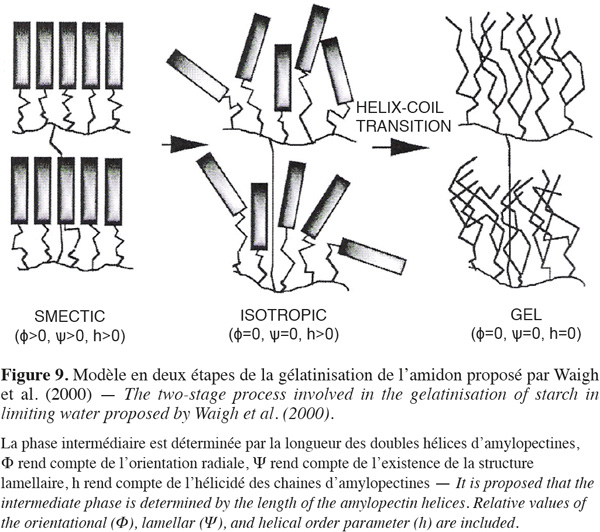
10À l'état natif, le granule d'amidon comporte des zones cristallines et des zones amorphes disposées sous forme de structures lamellaires concentriques (French, 1984). Les parties cristallines, dispersées dans une phase amorphe discontinue, sont constituées principalement de chaines d'amylopectines organisées en doubles hélices, groupées densément (clusters), parallèles les unes aux autres (Figure 1), alors que l'amylose et les points de ramification des liaisons ◊-D-glycopyranoses (1-6) des amylopectines sont principalement localisés dans les parties amorphes du granule (Imberty et al., 1991 ; Jenkins et al., 1996).
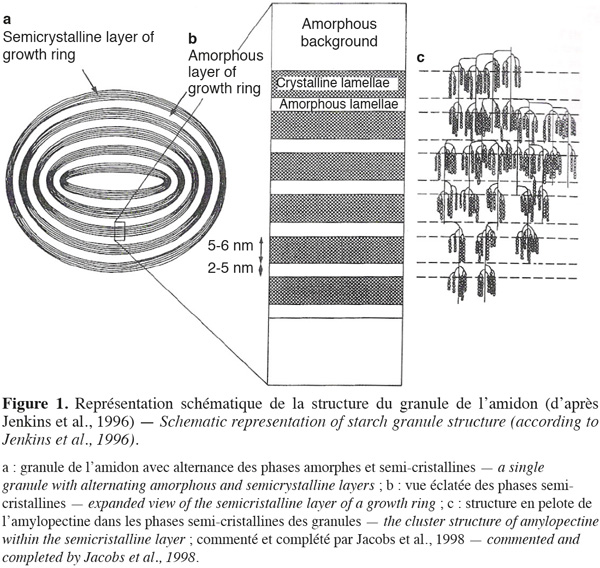
2.3. Structure cristalline des granules d'amidon de maïs
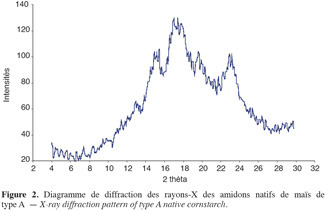
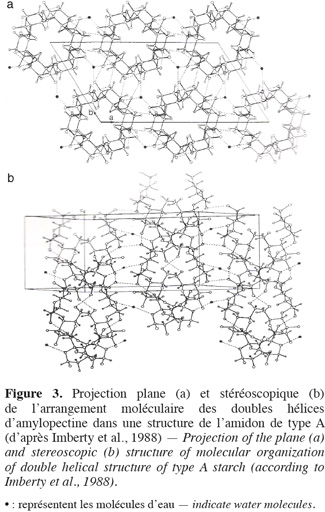
11En fonction de l'arrangement des monomères de glucose présents dans les doubles hélices d'amylopectines, du nombre de molécules d'eau emprisonnées dans la structure, du degré de ramification d'amylopectines et des interactions diverses entre les polymères présents, les phases cristallines des amidons présentent différentes formes cristallines (Imberty et al., 1988). Ces formes cristallines peuvent être identifiées à l'aide de diagramme de diffraction des rayons X. À l'état natif, le diagramme de diffraction des rayons X des amidons de maïs est de type A (Figure 2) avec des pics majeurs de diffraction observés aux angles d'émission (2 théta) de 15 ; 17 ; 18 ; 20 et 23 (Imberty et al., 1988). Dans cet état, les doubles hélices d'amylopectines cristallisent en conformation monoclinique, emprisonnant en leur sein quatre molécules d'eau pour chaque tour d'hélice (Figure 3).
2.4. Granulométrie, morphologie et hétérogénéité des granules d'amidon de maïs
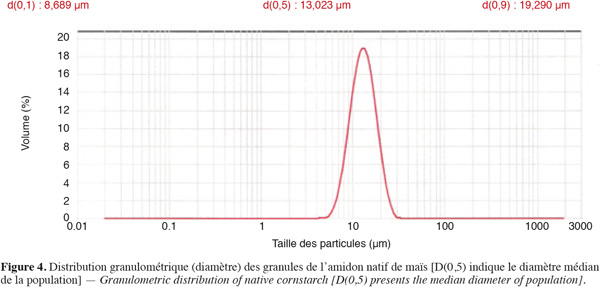
12À l'état natif, les granules de l'amidon de maïs présentent des diamètres qui s'échelonnent de 1 à 20 µm (Singh et al., 2003), avec un diamètre médian situé autour de 13 µm (Figure 4).
13Débarrassés des protéines adhérentes à leur surface et d'autres éléments de la matrice originelle, les granules de l'amidon de maïs présentent des formes polyédriques. Au microscope sous lumière polarisée, ils apparaissent comme des sphéro-cristaux qui s'illuminent en étant traversés par une croix noire (Figure 5).

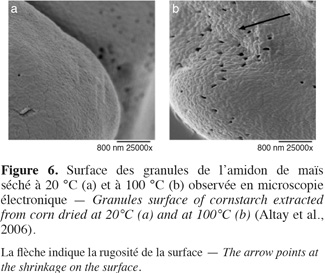
14La microscopie électronique a permis de montrer l'existence de micropores (Figure 6) à la surface des amidons de maïs (Fannon et al., 1992 ; Altay et al., 2006) et de mettre en évidence leur structure lamellaire (French, 1984). D'après Fannon et al. (1992), la présence de ces micropores serait responsable de l'amélioration de la susceptibilité des amidons à l'hydrolyse.
15Les propriétés physico-chimiques et fonctionnelles des amidons de maïs dépendent des variétés d'où ils ont été extraits (Li et al., 1994 ; Mua et al., 1997 ; Seetharaman et al., 2001 ; Sandhu et al., 2004 ; Sandhu et al., 2007). Ces propriétés sont le reflet à l'échelle macroscopique d'une ou de plusieurs caractéristiques structurales des granules constituant la population des amidons de la variété.
16Les caractéristiques des granules, pris individuellement, peuvent varier au sein d'une même population d'amidon en fonction de la taille de ceux-ci. Opérant une séparation des granules issus d'une même population d'amidon, en fonction de leur taille, Sahai et al. (1996) ont montré que les différentes fractions granulométriques obtenues présentent des degrés de cristallinité et des indices de solubilité différents. Ceci ne peut s'expliquer que par des différences dans l'architecture interne des granules, liées à leur taille. D'après Sahai et al. (1994), les granules d'amidon de grande taille sont plus sensibles aux traitements thermiques et à l'hydrolyse enzymatique que les granules de petite taille.
2.5. Relation structure-fonction chez les granules d'amidon de maïs
17Les propriétés fonctionnelles des amidons de maïs sont étroitement liées à la structure des granules (Malumba et al., 2009). Mua et al. (1997) ont étudié les relations existant entre les propriétés fonctionnelles, la structure moléculaire de l'amylose et de l'amylopectine, le comportement thermique des amidons pendant l'empesage et la formation des gels. D'après ces auteurs, les chaines d'amylose de haut poids moléculaire permettent d'obtenir des gels visqueux et fermes. Les amidons pourvus d'amylopectines de haut degré de ramification (> 1,5), de courte chaine (DP 15-18) et de degré de cristallinité élevé (> 28 %) conduiraient à des pics de viscosité à températures élevées pendant l'empesage, à des empois de faible viscosité et à des gels moins fermes que ceux obtenus avec des amidons pourvus d'amylopectine de haut degré de polymérisation. Mua et al. (1998) ont montré en outre que l'enthalpie de gélatinisation des amidons est essentiellement due à la fusion de l'amylopectine et est corrélée avec le degré de ramification de cette dernière. L'amylopectine de haut degré de ramification induit des rétrogradations importantes pendant la conservation des gels.
18Il ressort des travaux visant à mettre en évidence le rôle du rapport amylose/amylopectine dans les granules que les amidons riches en amylose présentent une rigidité thermique et enzymatique importante (Saito et al., 2001 ; Sandhu et al., 2005 ; Liu et al., 2007).
19Les propriétés rhéologiques des amidons sont en outre directement liées à la taille des granules (Christianson et al., 1983 ; Evans et al., 1992 ; Tsai et al., 1997 ; Nayouf et al., 2003 ; Sandhu et al., 2007) ainsi qu'à leur aptitude à diffuser l'amylose en milieu continu pendant le chauffage (Evans et al., 1992 ; Lu et al., 2007).
3. Modifications structurales des amidons lors des traitements thermiques
20Le comportement des amidons lors des traitements thermiques résulte des restructurations de l'architecture interne des granules. La gélatinisation, les transitions vitreuses, la formation de complexes amylose-lipides et de la rétrogradation sont les phénomènes les plus étudiés.
3.1. La gélatinisation
21Phénomène et conditions d'occurrence. La gélatinisation est la transformation la plus remarquable que subissent les amidons pendant leurs traitements thermiques en milieu aqueux. Elle est caractérisée par la modification irréversible de plusieurs paramètres dont la taille et la cristallinité des granules (Atwel et al., 1988) (Figure 7). Du point de vue macroscopique, elle se traduit par la modification de la viscosité et de la texture des empois d'amidon (Doublier et al., 1987 ; Mabit et al., 2003 ; Lu et al., 2007).

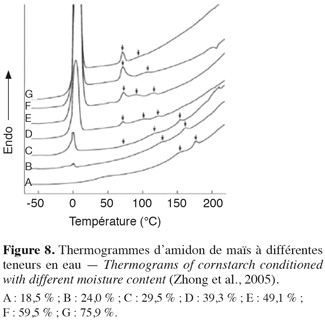
22La gélatinisation nécessite la présence d'eau en quantité suffisante dans le milieu. Spigno et al. (2004) ont montré que les énergies d'activation de la gélatinisation diminuent avec l'augmentation de la teneur en eau, pour se stabiliser à partir de 60 % d'eau. Donovan (1979), Biliaderis et al. (1980) et Malumba et al. (2010) ont montré qu'à faibles teneurs en eau, les amidons gélatinisent à des températures beaucoup plus élevées. Zhong et al. (2005) ont montré par analyse calorimétrique différentielle (ACD), qu'aux teneurs en eau inférieures à 29,5 %, l'endotherme de gélatinisation se déporte à des températures élevées et se dédouble (Figure 8).
23La gélatinisation est également affectée par les prétraitements physiques et thermiques auxquels l'amidon est soumis. Maache-Rezzoug et al. (2008) ont montré que les températures de gélatinisation des amidons prétraités par Détente Instantanée Contrôlée (DIC) augmentent avec la pression appliquée lors de ce prétraitement.
24Mécanismes de gélatinisation. La gélatinisation est avant tout un phénomène impliquant la fusion des phases cristallines, constituées par l'empilement ordonné des doubles hélices d'amylopectine structurées en lamelles (Zobel et al., 1988 ; Tester et al., 1990 ; Cooke et al., 1992 ; Jenkins et al., 1998 ; Jane et al., 1999 ; Waigh et al., 2000) et une solubilisation de l'amylose préalablement dispersé dans les phases amorphes des granules.
25Waigh et al. (2000) ont suggéré un scénario de gélatinisation en milieu aqueux durant lequel la disparition de l'arrangement lamellaire des doubles hélices d'amylopectine, associé à la perte de la cristallinité des granules, et la disparition de la structure en double hélice des chaines d'amylopectine interviennent simultanément
26En étudiant la cristallinité des granules par diffraction des rayons X, la structure en double hélice d'amylopectine par spectroscopie de résonnance magnétique nucléaire, ainsi que les enthalpies de gélatinisation des amidons en présence d'un excès d'eau, Cooke et al. (1992) ont observé la concomitance de la perte de la cristallinité et de la disparition de la structure en double hélice d'amylopectine. Ces auteurs attribuent l'enthalpie de gélatinisation observée à la disparition de la structure en double hélice des amylopectines (dédoublement des chaines d'amylopectines dans les parties cristallines du granule).
27Dans un environnement où la teneur en eau du milieu est limitée, Waigh et al. (2000) proposent un autre modèle décomposant la gélatinisation des amidons en deux étapes distinctes (Figure 9). La perte de l'arrangement lamellaire (perte de la cristallinité) apparaitrait en premier lieu (transition smectic-isotropic) pendant la montée en température du système et serait suivie du dédoublement des brins d'amylopectines initialement présents dans les doubles hélices (perte de l'ordre moléculaire) aux températures plus élevées.
28Ce modèle permet d'expliquer le dédoublement des pics observé en ACD des amidons en présence d'eau en quantité réduite, ainsi que la disparition précoce de la cristallinité des granules, bien avant leur complète gélatinisation (Svensson et al., 1995).
29En étudiant la gélatinisation des amidons soumis aux traitements thermiques en présence des teneurs en eau réduite par ACD, Donovan et al. (1983) et Lim et al. (2001) ont également observé le dédoublement de pic de gélatinisation avec une perte de biréfringence des granules associée à un seul de ces deux pics.
3.2. Transitions vitreuses et phénomènes de relaxation
30La transition vitreuse est un phénomène dont l'importance technologique est reconnue depuis de très nombreuses années. Elle affecte principalement les substances amorphes ou les zones amorphes des matériaux partiellement cristallins (Le Meste et al., 1990).
31Phénomènes et conditions d'occurrence. Aux basses températures, les molécules qui constituent les phases amorphes des granules d'amidon sont peu mobiles et figées dans un état vitreux (Zeleznak et al., 1987). Lorsque la température des granules augmente, la mobilité des composants des phases amorphes s'accroît, rendant ces phases plus flexibles (visco-élastiques) (Roos, 1995). Le passage des solides amorphes d'un état vitreux à un état caoutchouteux sous l'effet de la chaleur est une caractéristique de tous les polymères et constitue la transition vitreuse (Flory, 1971). Cette transition se traduit par une variation de la chaleur spécifique mesurable par l'analyse calorimétrique différentielle (Zeleznak et al., 1987).
32Les transitions vitreuses ne sont pas faciles à mettre en évidence chez l'amidon. En effet, les températures auxquelles elles apparaissent varient avec le degré de polymérisation des constituants des phases amorphes et avec la teneur en eau du produit (Slade et al., 1988 ; Slade et al., 1991 ; Roos, 1995 ; Simatos, 2002). L'hétérogénéité de la longueur des chaines d'amylose de la phase amorphe (Hizukuri et al., 1981), les chevauchements des transitions thermiques, les variations des conditions d'analyse et la sensibilité limitée des appareils disponibles sont les facteurs qui expliquent que l'identification des températures de transition vitreuse des amidons soit aussi malaisée.
33Chanvrier et al. (2005) ont observé deux pics de transition vitreuse d'amidon de maïs à 10 % de teneur en eau, respectivement à 55 °C et 110 °C. Lim et al. (2001) ont observé une transition vitreuse des amidons de maïs à 15 % de teneur en eau intervenant à 52,3 °C, alors qu'en présence d'un excès d'eau, les mêmes échantillons présentent des transitions vitreuses aux températures de l'ordre de -9,3 °C.
34Outre l'existence des transitions vitreuses de l'amidon, de nombreux auteurs ont mis en évidence par ACD la présence d'un pic endothermique à des températures légèrement inférieures à celle des transitions vitreuses des amidons (Kalichevsky et al., 1992 ; Shogren, 1992 ; Lim et al., 2001). Ce pic, attribué au phénomène de relaxation de la phase amorphe des granules à l'état vitreux, résulte des réarrangements ayant lieu dans le solide amorphe figé dans un état métastable (Lim et al., 2001). Les phénomènes de relaxation traduisent une évolution du matériau vitreux vers un équilibre, sans nécessairement donner lieu à une augmentation significative de la mobilité moléculaire de la phase amorphe.
35Modifications induites par les transitions vitreuses et la relaxation. Les transitions vitreuses, quoique n'induisant pas de modifications majeures des phases cristallines des granules, jouent cependant un rôle non négligeable dans la définition des propriétés de mise en œuvre des amidons (Della Valle et al., 2006). Au-delà de la simple restructuration des constituants de la phase amorphe, les transitions vitreuses peuvent modifier le comportement des amidons pendant la gélatinisation (Yost et al., 1986 ; Slade et al., 1988 ; Kweon et al., 2008). Ces modifications sont principalement dues aux interactions que les chaines d'amylose, présentes dans les phases amorphes, peuvent établir entre elles et avec les composés des phases cristallines du granule. Marchant et al. (1978) ont été les premiers auteurs à proposer une théorie « d'interdépendance des énergies » qui gouvernent la stabilité des cristallites d'amidon et la conformation moléculaire de l'amylose dans les phases amorphes des granules.
36D'après cette théorie, les transitions vitreuses, ainsi que les phénomènes de relaxation, en modifiant la conformation moléculaire des polymères présents dans les phases amorphes des granules, affectent également la stabilité des cristallites au travers des entrelacements des chaines d'amyloses avec les extrémités d'amylopectines qui constituent les cristallites. En retour, les phases cristallines, en subissant la fusion pendant la gélatinisation, augmentent la proportion des constituants amorphes au sein des granules et influencent ainsi la mobilité moléculaire dans ces phases. L'interdépendance des modifications de structures des phases amorphes et des phases cristallines sont probablement à la base des modifications des propriétés thermiques des amidons prétraités, soit à des teneurs en eau réduites, soit à des températures n'induisant pas une complète gélatinisation en milieu saturé en eau (annealing) (Jacobs et al., 1998).
3.3. La rétrogradation
37Phénomènes et conditions d'occurrence. Pendant la gélatinisation, les granules d'amidon gonflent, deviennent flexibles ; certains éclatent et laissent diffuser l'amylose dans le milieu continu. Au refroidissement, lorsque la concentration en amidon le permet, les polymères diffusés en milieu continu forment un réseau tridimensionnel, emprisonnant l'eau et les résidus des granules éclatés en leur sein. Pendant leur conservation à basses températures, les gels formés à l'empesage durcissent et donnent lieu à des modifications des propriétés texturales (Miles et al., 1985). Le terme rétrogradation désigne les changements intervenant dans la structure des granules et dans leur milieu de dispersion au cours du refroidissement ou pendant la conservation des empois d'amidon aux basses températures (Hermansson et al., 1996). Ces changements résultent d'une réorganisation de l'amylose et de l'amylopectine après la gélatinisation et tendent à conférer à ces derniers un nouvel équilibre conformationnel. En effet, quoique chimiquement très proches, l'amylose et l'amylopectine sont incompatibles en solutions concentrées et se séparent spontanément à des températures inférieures à 90 °C. Il s'ensuit la formation de deux phases, composées à plus de 70 % du même polymère (Buléon et al., 1990).
38Modifications induites à la rétrogradation de l'amidon. La rétrogradation comporte des restructurations à court terme qui impliquent principalement des modifications structurales de l'amylose, ainsi que des changements apparaissant après de longues durées de conservation des empois, que l'on attribue à la recristallisation de l'amylopectine. Les réarrangements de l'amylose semblent être à la base des modifications qui ont lieu au cours du refroidissement des empois juste après la gélatinisation ; ils sont responsables du développement de la texture du gel. Pendant la conservation des gels d'amidon, la texture semble être principalement affectée par la recristallisation de l'amylopectine, phénomène qui s'accompagne d'une libération partielle de l'eau emprisonnée dans le gel et d'une séparation de phase appelée synérèse (Miles et al., 1985).
39La rétrogradation dépend de nombreuses variables dont notamment la structure de l'amylose et de l'amylopectine, le rapport amylose/amylopectine, la concentration en amidon, son origine botanique et la concentration en d'autres constituants du milieu (Jacobson et al., 1997). Elle est d'autant plus importante que les amidons sont riches en amylopectine (Fredriksson et al., 1998) et peut induire des phénomènes non désirés comme le rassissement des produits de boulangerie (Morris, 1990 ; Keetels, 1995).
40D'après Jouppila et al. (1998), la cinétique de rétrogradation dépend de la teneur en eau du gel et de la température de sa conservation. Pour autant que cette température soit inférieure à 90 °C, la recristallisation de l'amylopectine pendant la rétrogradation aboutit à la formation de structures d'autant plus parfaites que la température de conservation augmente.
3.4. Formation de complexe amylose-lipides
41Phénomènes et conditions d'occurrence. En présence de lipides, le comportement thermique des amidons se modifie, avec apparition d'un endotherme réversible qui résulte de la formation d'un complexe attribué à l'amylose et aux acides gras. Schoch et al. (1944) ainsi que Mikus et al. (1946) sont les premiers auteurs à avoir mis en évidence ces complexes, ainsi que certains de leurs effets sur le comportement des amidons. Schoch et al. (1944) ont montré que les acides gras précipitent l'amylose en milieu aqueux sous la forme d'un complexe microcristallin. Mikus et al. (1946) ont précisé la nature hélicoïdale de ce complexe, avec le positionnement interne de la partie apolaire des acides gras dans le complexe formé.
42En étudiant par ACD le comportement thermique des amidons de maïs avec ou sans extraction préalable des matières grasses par le méthanol, Kugimiya et al. (1980) ont montré l'existence du pic endothermique réversible attribuable à la formation du complexe d'inclusion entre les polymères de l'amidon et les lipides. L'inexistence d'un tel pic dans les amidons extraits des variétés de maïs dépourvues d'amylose (waxy) a confirmé la nature amylosique du polymère interagissant avec les lipides pour former ces complexes d'inclusion. Kugimiya et al. (1980) et Zobel et al. (1988) ont établi, par diffraction des rayons X, la forme cristalline de type V de ces complexes hélicoïdaux et ont montré que ceux-ci, à défaut d'exister préalablement dans les granules, peuvent être induits par le traitement thermique de l'amidon en présence d'acides gras.
43La complexation de l'amylose par les lipides dépend du degré de polymérisation de celui-ci, de la longueur des acides gras mis en œuvre et des températures de complexation. Les longues chaines d'amylose induisent la formation de beaucoup plus de complexes amylose-lipides et améliorent leur thermostabilité (Gelders et al., 2004). La structure des complexes formés varie cependant en fonction de la température à laquelle la complexation se réalise (Gelders, 2005). Aussi, les traitements thermiques des produits riches en amidon en présence des lipides, comme c'est le cas au séchage du maïs, peuvent générer des modifications des propriétés techno-fonctionnelles attribuables à la formation des complexes amylose-lipides.
44Modifications induites par la formation des complexes amylose-lipides. De nombreux auteurs associent plusieurs modifications des amidons soumis aux traitements thermiques à la formation des complexes amylose-lipides. Hoover et al. (1996), Kaur et al. (2000), Nakazawa et al. (2004), Olayinka et al. (2008) et Raphaelides et al. (2008) expliquent la diminution de la solubilité et de l'aptitude au gonflement des granules d'amidons par la formation de ces complexes.
45D'après Lim et al. (2001), les traitements thermiques des amidons de maïs induisent une formation des complexes amylose-lipides supplémentaires, qui se traduit par l'augmentation des enthalpies de fusion de ces complexes à l'ACD. Donovan et al. (1983) attribuent également l'augmentation des températures de gélatinisation des amidons prétraités thermiquement à la synthèse des complexes amylose-lipides supplémentaires.
46Le mécanisme de formation de ces complexes lors des traitements thermiques et leur implication dans la modification des propriétés des amidons demeurent encore mal compris. Ce qui est actuellement admis est la formation accrue de ces complexes dans les amidons riches en amylose (Blazek et al., 2008) et en lipides (Nakazawa et al., 2004), ainsi que l'amplification du caractère résistant des amidons riches en ces composés lorsqu'ils sont soumis à des traitements thermiques en milieu à faible teneur en eau (Ito et al., 1999 ; Kishida et al., 2001 ; Liu et al., 2007).
4. Conclusion
47À l'état natif, les granules d'amidon sont des systèmes complexes comportant des phases cristallines constituées de doubles hélices d'amylopectine groupées densément, dispersées dans une phase amorphe discontinue riche en amylose située au niveau des ramifications d'amylopectines. L'amidon de maïs présente une morphologie cristalline de type A, caractérisée par une grande compacité et une meilleure stabilité thermique.
48Les propriétés développées par différentes populations d'amidons reflètent les caractéristiques structurales des granules, attribuables à la variété d'où ils ont été extraits. Au sein d'une même population, ces propriétés peuvent varier en fonction de la taille des granules. Les amidons natifs des variétés courantes de maïs présentent des diamètres qui s'échelonnent de 1 à 20 µm suivant une distribution unimodale, avec un diamètre médian situé autour de 13 µm.
49Lorsqu'ils sont portés à des températures élevées, les granules subissent des phénomènes de gélatinisation, des transitions vitreuses, des relaxations des phases amorphes, des rétrogradations et peuvent donner lieu à la formation de complexes amylose-lipides supplémentaires. La gélatinisation des amidons implique des restructurations des phases cristallines ; les transitions vitreuses et les phénomènes de relaxations traduisent quant à eux des restructurations ayant lieu au sein des phases amorphes des granules. Ces différentes phases appartenant aux mêmes entités granulaires peuvent interagir et donner lieu à des modifications attribuables aux granules d'amidon considérés comme entités à part entière.
50Des relations étroites existent entre la structure des granules d'amidon et les propriétés macroscopiques qu'ils développent lorsqu'ils sont soumis à des traitements thermiques. Ces propriétés semblent être liées principalement à la structure de l'amylose et de l'amylopectine ; aux interactions pouvant exister entre ces deux fractions majeures des granules ; à la taille des granules ainsi qu'à la nature du milieu environnant les granules au chauffage.
51Abréviation
52ACD : analyse calorimétrique différentielle
Bibliographie
Altay F. & Gunasekaran S., 2006. Influence of drying temperature, water content, and heating rate on gelatinization of corn starches. J. Agric. Food Chem., 54, 4235-4245.
Atwell W.A. et al., 1988. The terminology associated with basic starch phenomena. Cereal Foods World, 33, 306-311.
Biliaderis C.G., Maurice T.J. & Vose J.R., 1980. Starch gelatinization phenomena studied by differential scanning calorimetry. J. Food Sci., 45, 1669-1680.
Blazek J. & Copeland L., 2008. Pasting and swelling properties of wheat flour and starch in relation to amylose content. Carbohydr. Polym., 71, 380-387.
Buléon A., Colonna P. & Leloup V., 1990. Les amidons et leurs dérivés dans les industries des céréales. Ind. Aliment. Agric., 6, 515-531.
Chanvrier H., Colonna P., Della Valle D. & Lourdin D., 2005. Structure and mechanical behavior of corn flour and starch-zein based materials in the glassy state. Carbohydr. Polym., 59, 109-119.
Christianson D.D. & Bagley E.B., 1983. Apparent viscosity of dispersions of swollen cornstarch granules. Cereal Chem., 60(2), 116-121.
Cooke D. & Gidley M.J., 1992. Loss of crystalline and molecular order during starch gelatinization: origin of the anthalpic transition. Carbohydr. Res., 227, 103-112.
Della Valle G., Colonna P. & Vergnes B., 2006. Texturation des biopolymères en milieux concentrés. In : Colonna P. & Della Valle G., eds. Mise en œuvre des matières agroalimentaires. Vol. 2. Paris : Lavoisier, 113-166.
Donovan J.W., 1979. Phase transitions of the starch-water system. Biopolymers, 18, 263-275.
Donovan W., Lorenz K. & Kulp K., 1983. Differential scanning calorimetry of heat-moisture treated wheat and potato starches. Cereal Chem., 60(5), 381-387.
Doublier J.L., Llamas G. & Le Meur M.A., 1987. Rheological investigation of cereal starch pastes and gels. Effect of pasting procedures. Carbohydr. Polym., 7, 251-257.
Evans I.D. & Lips A., 1992. Viscoelasticity of gelatinized starch dispersions. J. Texture Stud., 23, 69-86.
Fannon J.E., Hauber R.J. & BeMiller J.N., 1992. Surface pores of starch granules. Cereal Chem., 69(3), 284-288.
Flory P., 1971. Principles of polymer chemistry. Ithaca, NY, USA; London: Cornell University Press.
Fredriksson H. et al., 1998. The influence of amylose and amylopectin characteristics on gelatinization and retrogradation properties of different starches. Carbohydr. Polym., 35, 119-134.
French D., 1984. Organisation of starch granules. In: Whistler R.L., Bemiller J.N. & Paschall E.F., eds. Starch: chemistry and technology. 2nd ed. New York, USA: Academic Press Inc.
Gelders G., 2005. Structure and properties of maltodextrins and their lipid inclusion complexes. PhD thesis: Katholieke Universiteit Leuven (Belgium).
Gelders G.G., Vanderstuken T.C., Goesaert H. & Delcour J.A., 2004. Amylose-lipid complexation: a new fractionation method. Carbohydr. Polym., 56, 447-458.
Hardacre A.K. & Clark S.M., 2006. The effect of hybrid and growing environment on the rheological properties of starch and flour from maize (Zea mays L.) grain dried at four temperatures. Int. J. Food Sci. Technol., 41, 144-150.
Hermansson A.-M. & Svegmark K., 1996. Developments in the understanding of starch functionality. Trends. Food Sci. Technol., 7, 345-353.
Hizukuri S., 1985. Relationship between the distribution of the chain length of amylopectine and the crystalline structure of starch granules. Carbohydr. Res., 141, 295-306.
Hizukuri S., Takeda Y. & Yasuda M., 1981. Multi-branched nature of amylose and the action of debranching enzymes. Carbohydr. Res., 91, 205-213.
Hoover R. & Manuel H., 1996. The effect of heat-moisture treatment on the structure and physicochemical properties of normal maize, waxy maize, dull waxy maize and amylomaize V starches. J. Cereal Sci., 23, 153-162.
Imberty A. et al., 1988. The double-helical nature of the crystalline part of A-starch. J. Mol. Biol., 201, 365-378.
Imberty A., Buléon A., Tran V. & Pérez S., 1991. Recent advances in knowledge of starch. Starch, 43(10), 375-384.
Ito T. et al., 1999. Effect of raw and heat-moisture-treated high-amylose corn starches on the process of digestion in the rat digestive tract. J. Sci. Food Agric., 79, 1203-1207.
Jacobs H., 1998. Impact of annealing on physico-chemical properties of starch. PhD thesis: Katholieke Universiteit Leuven (Belgium).
Jacobs H. & Delcour J.A., 1998. Hydrothermal modification of granular starch, with retention of the granular structure: a review. J. Agric. Food Chem., 48(8), 2895-2905.
Jacobson M.R., Obanni M. & BeMiller J.N., 1997. Retrogradation of starches from different botanical sources. Cereal Chem., 74(5), 511-518.
Jaisut D. et al., 2008. Effects of drying temperature and tempering time on starch digestibility of brown fragrant rice. J. Food Eng., 86, 251-258.
Jane J. et al., 1999. Effects of amylopectin branch chain length and amylose content on the gelatinization and pasting of starch. Cereal Chem., 76(5), 629-637.
Jenkins P.J. & Donald A.M., 1995. The influence of amylose on starch granule structure. Int. J. Biol. Macromol., 17(6), 315-321.
Jenkins P.J. & Donald A.M., 1996. Application of small-angle neutron scattering to the study of the structure of starch granules. Polymer, 25, 5559-5568.
Jenkins P.J. & Donalds A.M., 1998. Gelatinisation of starch: a combined SAXS/WAXS/DSC and SANS study. Carbohydr. Res., 308, 133-147.
Ji Y. et al., 2004. Waxy maize starch subpopulations with different gelatinization temperatures. Carbohydr. Polym., 57, 177-190.
Jouppila K., Kansikas J. & Roos Y.H., 1998. Factors affecting crystallization and crystallization kinetics in amorphous corn starch. Carbohydr. Polym., 36, 143-149.
Kalichevsky A. et al., 1992. The glass transition of amylopectine measured by DSC, DMTA and NMR. Carbohydr. Polym., 18, 77-88.
Kar A. et al., 2005. Influence of lipid extraction process on the rheological characteristics, swelling power, and granule size of rice starches in excess water. J. Agric. Food. Chem., 53, 8259-8264.
Karim A.A., Norziah M.H. & Seow C.C., 2000. Methods for the study of starch retrogradation. Food Chem., 71, 9-36.
Kaur K. & Singh N., 2000. Amylose-lipid complex formation during cooking of rice flour. Food Chem., 71, 511-517.
Keetels C., 1995. Retrogradation of concentrated starch systems ; mechanism and consequences for product properties. PhD thesis: Wageningen University (The Netherlands).
Kim W.S. & Seib P.A., 1993. Apparent restriction of swelling in cooked noodles by lipids in some commercial wheat flours. Cereal Chem., 70(4), 367-372.
Kishida T., Nogami H., Himeno S. & Ebihara K., 2001. Heat-moisture treatment of high amylose cornstarch increases its resistant starch content but not its physiologic effects in rats. J. Nutr., 131, 2716-2721.
Kugimiya M., Donovan J.W. & Wong R.Y., 1980. Transitions of amylose-lipid complexes in starch: a calorimetric study. Starch, 32(8), 265-270.
Kweon M., Slade L. & Levine H., 2008. Role of glassy and crystalline transitions in the responses of corn starches to heat and high pressure treatments: prediction of solute-induced barostability from solute-induced thermostability. Carbohydr. Polym., 72, 293-299.
Le Meste M. & Simatos D., 1990. La transition vitreuse : incidences en technologie alimentaire. Ind. Aliment. Agric., 107, 5-11.
Li J., Berke T.G. & Glover D.V., 1994. Variation of thermal properties of starch in tropical maize germ plasm. Cereal Chem., 71(1), 87-90.
Lim S.-T., Chang E.-H. & Chung H.-J., 2001. Thermal transition characteristics of heat-moisture treated corn and potato starches. Carbohydr. Polym., 46, 107-115.
Liu X. et al., 2007. Heat-moisture treatment of high-amylose corn starch increases dietary fiber content and lowers plasma cholesterol in ovariectomized rats. J. Food Sci., 72(9), s652-s658.
Lorenz K. & Kulp K., 1982. Cereal- and root starch modification by heat-moisture treatment. I. Physico-chimical properties. Starch, 34(2), 50-54.
Lu T.-J., Duh C.-S., Lin J.-H. & Chang Y.-H., 2007. Effect of granular characteristics on the viscoelastic properties of composites of amylose and waxy starches. Food Hydrocolloids, 22, 164-173.
Maache-Rezzoug Z. et al., 2008. Structural modifications and thermal transitions of standard maize starch after D.I.C. hydrothermal treatment. Carbohydr. Polym., 74(4), 802-812.
Mabit J., Loisel C., Fayolle F. & Legrand J., 2003. Determination of volume fraction submitted to high shear in a scrapped surface heat exchanger. J. Food Eng., 57, 165-172.
Malumba P. et al., 2009. Influence of drying temperature on functional properties of wet-milled starch granules. Carbohydr. Polym., 75, 299-306.
Malumba P. et al., 2010. Comparative study of the effect of drying temperatures and heat-moisture treatment on the physicochemical and functional properties of corn starch. Carbohydr. Polym., 79, 633-641.
Marchant J.L. & Blanshard M.V., 1978. Studies of the dynamics of the gelatinization of starch granules employing a small angle light scattering system. Starch, 30(8), 257-264.
Mikus F.F., Hixon R.M. & Rundle R.E., 1946. The complexes of fatty acids with amylose. J. Am. Chem. Soc., 68, 1115-1123.
Miles M.J., Morris V.J., Orford P.D. & Ring S.G., 1985. The roles of amylose and amylopectin in the gelation and retrogradation of starch. Carbohydr. Res., 135, 271-281.
Morris V.J., 1990. Starch gelation and retrogradation. Trends. Food Sci. Technol., 1, 2-6.
Mua J.P. & Jackson D.S., 1997. Relationships between functional attributes and molecular structure of amylose and amylopectin fractions from corn starch. J. Agric. Food Chem., 45, 3848-3854.
Mua J.P. & Jackson D.S., 1998. Retrogradation and gel textural attributes of corn starch amylose and amylopectine fractions. J. Cereal Sci., 27, 157-166.
Nakazawa Y. & Wang Y.-J., 2004. Effect of annealing on starch-palmitic acid interaction. Carbohydr. Polym., 57, 327-335.
Nayouf M., Loisel C. & Doublier J.L., 2003. Effect of thermomechanical treatment on the rheological properties of crosslinked waxy corn starch. J. Food Eng., 59, 209-219.
Oates C.G., 1997. Towards an understanding of starch granule structure and hydrolysis. Trends. Food Sci. Technol., 8(11), 375-382.
Olayinka O.O., Adebowale K.O. & Olu-Owolabi B.I., 2008. Effect of heat-moisture treatment on physicochemical properties of white sorghum starch. Food Hydrocolloids, 22(2), 225-230.
Paterson J.L., Hardacre A., Li P. & Rao M.A., 2001. Rheology and granule size distribution of corn starch dispersions from two genotypes and grown in four regions. Food Hydrocolloids, 15, 453-459.
Rahman S. et al., 2007. Resistant starch in cereals: exploiting genetic engineering and genetic variation. J. Cereal Sci., 46, 251-260.
Raphaelides S. & Georgiadis N., 2008. Effect of fatty acids on the rheological behaviour of amylomaize starch dispersions during heating. Food Res. Int., 41, 75-88.
Reichter E.T., 1913. The differentiation and specificity of starches in relation to genera, species, etc. : the stereochemistry applied to protoplasmic processes and products, and as a strictly scientific basis for the classification of plants and animals. Part I. Washington, D.C., USA: Carnegie Institution of Washington.
Roos Y., 1995. Characterization of food polymers using state diagrams. J. Food Eng., 24, 339-360.
Sahai D. & Jackson D.S., 1994. Structure and chemical properties of partially heated corn starch granules. Starch, 46(12), 457-463.
Sahai D. & Jackson D.S., 1996. Structural and chemical properties of native corn starch granules. Starch, 48, 249-255.
Saito K. et al., 2001. Effect of raw and heat-moisture treated high-amylose corn starch on fermentation by the rat cecal bacteria. Starch, 53, 424-430.
Sandhu K.S., Singh N. & Kaur M., 2004. Characteristics of the different corn types and their grain fractions: physicochemical, thermal, morphological, and rheological properties of starches. J. Food Eng., 64, 119-127.
Sandhu K.S., Singh N. & Malhi N.S., 2005. Physicochemical and thermal properties of starches separated from corn produced from crosses of two germ pools. Food Chem., 89, 541-548.
Sandhu K.S. & Singh N., 2007. Some properties of corn starches II : physicochemical, gelatinization, retrogradation, pasting and textural properties. Food Chem., 101, 1499-1507.
Schoch T. & Williams C., 1944. Adsorption of fatty acid by the linear component of corn starch. J. Am. Chem. Soc., 66, 1232.
Seetharaman K. et al., 2001. Thermal and functional characterization of starch from Argentinean corn. Cereal Chem., 78, 379-386.
Shogren R.L., 1992. Effect of moisture-content on the melting and subsequent physical aging of corn starch. Carbohydr. Polym., 19, 83-90.
Simatos D., 2002. Propriétés de l'eau dans les produits alimentaires : activité de l'eau, diagrammes de phase et d'états. In : Le Meste M., Simatos D. & Lorient D., eds. L'eau dans les aliments. Paris : Lavoisier, 49-83.
Singh N. et al., 2003. Morphological, thermal and rheological properties of starches from different botanical sources. Food Chem., 81, 219-231.
Slade L. & Levine H., 1988. Non-equilibrium melting granular starch: Part I. Temperature location of the glass transition associated with gelatinization of A-type cereal starches. Carbohydr. Polym., 8, 183-208.
Slade L. & Levine H., 1991. Beyond water activity: recent advances based on an alternative approach to the assessment of food quality and safety. Crit. Rev. Food Sci. Nutr., 30, 115-360.
Spigno G. & De Faveri D.M., 2004. Gelatinization kinetics of rice starch studied by non-isothermal calorimetric technique: influence of extraction method, water concentration and heating rate. J. Food Eng., 62, 337-344.
Stute R., 1992. Hydrothermal modification of starches: the difference between annealing and heat/moisture-treatment. Starch, 44(6), 205-214.
Svensson E. & Eliasson A.-C., 1995. Crystalline changes in native wheat and potato starches at intermediate water levels during gelatinization. Carbohydr. Polym., 26, 171-176.
Tang H., Mitsunaga T. & Kawamura Y., 2006. Molecular arrangement in blocklets and starch granule architecture. Carbohydr. Polym., 63, 555-560.
Tester R. & Morrison W.R., 1990. Swelling and gelatinization of cereal starches. I. Effects of amylopectin, amylose, and lipids. Cereal Chem., 67, 551-557.
Tolstoguzov V., 2003. Thermodynamic considerations of starch functionality in foods. Carbohydr. Polym., 51, 99-111.
Tsai M., Li C. & Lii C., 1997. Effect of granular structures on the pasting behaviors of starches. Cereal Chem., 74(6), 750-757.
Van den Berg C., 1981. Vapour sorption equilibria and other water starch interactions: a physico-chemical approach. PhD thesis: Agricultural University Wageningen (The Netherlands).
Waigh T.A., Gidley M.J., Komanshek B.U. & Donald A.M., 2000. The phase transitions in starch during gelatinization: a liquid crystalline approach. Carbohydr. Res., 328, 165-176.
Yost D.A. & Hoseney R.C., 1986. Annealing and glass transition of starch. Starch, 38(9), 289-292.
Zhong Z. & Sun S., 2005. Thermal characterization and phase behavior of cornstarch studied by differential scanning calorimetry. J. Food Eng., 69, 453-459.
Zeleznak K.J. & Hoseney R.C., 1987. The glass transition in starch. Cereal Chem., 64(2), 121-124.
Zobel H.F., Young S.N. & Rocca L.A., 1988. Starch gelatinization: an X-ray diffraction study. Cereal Chem., 65(6), 443-446.






