- Accueil
- Volume 15 (2011)
- numéro 2
- Action des cultures protectrices : cas des germes lactiques sur la flore alimentaire indésirable
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Action des cultures protectrices : cas des germes lactiques sur la flore alimentaire indésirable

Notes de la rédaction
Reçu le 22 février 2010, accepté le 24 aout 2010
Résumé
Les cultures protectrices ont été utilisées depuis des siècles dans la fermentation d'une variété de produits alimentaires. La capacité de conservation des aliments par ces cultures est attribuée à la production de métabolites antimicrobiens, notamment des acides organiques et des bactériocines. Mais pour garantir une extension de la durée de conservation et une meilleure sécurité des aliments, la démarche consistant à multiplier les barrières antimicrobiennes dans la matrice alimentaire s'avère nécessaire. Cette démarche utilise généralement la température, l'activité de l'eau (Aw), le pH, le potentiel redox (Eh), les conservateurs chimiques, les emballages sous vide, l'atmosphère modifiée, la haute pression hydrostatique (HHP) et l'UV comme barrières additionnelles aux cultures protectrices et/ou leurs composés antimicrobiens (principalement les bactériocines). Cet article passe en revue la bibliographie récente décrivant les cultures protectrices et les différentes voies qu'elles utilisent pour inhiber la flore indésirable. Sont également brièvement présentés : la classification, la biosynthèse, le mécanisme d'action des bactériocines produites par ces cultures protectrices et enfin l'avantage d'utiliser des barrières additionnelles en appoint aux cultures protectrices et/ou leurs bactériocines.
Abstract
Protective action of cultures: the case of lactic bacteria against undesirable food flora. Protective strains have been used for centuries in the fermentation of a variety of food. The preservative ability of these strains in food is attributed to the production of antimicrobial metabolites including organic acids and bacteriocins. But to secure an extension of shelf life and better food safety, the multiple antimicrobial barriers approach is required. This approach typically uses the principal hurdles temperature (higher or lower), water activity (Aw), pH, redox potentiel (Eh), chemical preservatives, vacuum packaging, modified atmosphere, high hydrostatic pressure (HHP) and UV, as additional barriers to protective cultures and/or antimicrobial compounds. This paper reviews the recent literature describing the protective cultures and different ways they use to suppress unwanted flora. Are also briefly presented, classification, biosynthesis, mechanism of action of bacteriocins produced by these cultures and finally the protective benefit of using additional barriers to booster protective cultures and/or their bacteriocins.
Table des matières
I. Introduction
1La contamination et la détérioration des produits alimentaires par les micro-organismes sont un problème qui n'est pas encore sous contrôle malgré la disponibilité de la panoplie de techniques de conservation fiables et adéquates (e.g., réfrigération, congélation, stérilisation, séchage, préservation, etc.). Soucieux de résoudre ce problème tout en se conformant à la demande des consommateurs qui refusent les aliments préparés avec des agents conservateurs d'origine chimique, les fabricants de produits alimentaires se penchent de plus en plus sur des techniques de préservation beaucoup plus douces. Ces techniques douces de préservation conduisent à l'obtention d'aliments présentant un aspect beaucoup plus naturel avec une qualité nutritive excellente. Ces techniques sont notamment basées sur l'activité antimicrobienne naturelle associée à des souches bactériennes agissant comme des cultures protectrices. Ces bactéries ont une longue tradition en matière de sécurité alimentaire et de nombreuses applications potentielles en tant qu'agents de conservation. Ces cultures protectrices regroupent un ensemble d'espèces hétérogènes dont le trait commun est la production de substances antimicrobiennes. Elles appartiennent à divers genres comme Bifidobacterium, Enterococcus, Lactobacillus, Lactococcus, Leuconostoc, Pediococcus, Streptococcus et Carnobacterium. Ces cultures exercent une action antagoniste sur la croissance des micro-organismes indésirables et/ou pathogènes et ce, sans modifier les propriétés organoleptiques du produit (Vermeiren et al., 2004). Ces souches protectrices sont souvent bactériocinogènes ou non bactériocinogènes.
2L'objectif de cette revue bibliographique est donc de faire le point sur l'état des connaissances en matière de cultures protectrices utilisant les bactéries lactiques comme fil conducteur. Nous examinerons donc successivement les phénomènes d'inhibition engendrés par les principaux métabolites synthétisés par ces cultures protectrices et l'avantage de créer des barrières ou obstacles multiples par combinaison de différents processus et méthodes de conservation pour inhiber la croissance microbienne dans les matrices alimentaires.
2. Définition d'une culture protectrice
3Une culture protectrice est une culture antagoniste ajoutée à un produit alimentaire pour inhiber les bactéries pathogènes et/ou altérantes et ainsi prolonger sa date de péremption en modifiant le moins possible ses propriétés organoleptiques (Vermeiren et al., 2004).
4La caractéristique qui fait l'unité de ce groupe bactérien est la production de l'acide lactique à partir de différents substrats carbonés. En dehors de ce point commun, les nombreux genres et espèces qui constituent ce groupe présentent une grande diversité de caractéristiques morphologiques et physiologiques. Cela se traduit par l'existence, au sein des espèces, de nombreuses souches possédant des propriétés technologiques différentes (Desmazeaud, 1998). Les cultures protectrices sont constituées généralement de cellules vivantes, procaryotes et hétérotrophes dont les caractéristiques sont les suivantes : bacilles ou coques gram+, généralement immobiles, asporulés, aérotolérants, chimiotrophes et ne possédant ni catalase, ni nitrate-réductase, ni cytochrome oxydase (Stiles et al., 1997). Le genre le plus fréquemment isolé des levains est le genre Lactobacillus.
2.1. Le genre Lactobacillus
5Les lactobacilles sont présents naturellement dans la nature et sont rarement pathogènes. Ce sont des cellules allongées, régulières en forme de bâtonnets ou coccobacilles isolés ou en chainettes de taille variable, asporogènes, immobiles ou mobiles grâce à des flagelles péritriches, anaérobies facultatifs. Leurs exigences nutritionnelles complexes et leurs températures de croissance (2 à 53 °C) sont très variables d'une espèce à l'autre, mais elles sont toutes acidophiles avec un pH optimal de croissance de 5,5 à 6,2. Leurs pourcentages en GC sont de 36 à 47. Leur mode de fermentation donne lieu à une classification répartie en trois groupes distincts :
6– Le groupe I regroupe les lactobacilles homofermentaires stricts qui ne fermentent que les hexoses par la voie d'Embden-Meyerhof en produisant presque exclusivement du lactate. Ce groupe comprend notamment Lb. acidophilus, Lb. farciminis, Lb. johnsonii, Lb. amylovorus, Lb. paralimentarius (Cai et al., 1999), Lb. delbrueckii subsp. delbrueckii, Lb. delbrueckii subsp. lactis, Lb. delbrueckii subsp. bulgaricus (Torriani et al., 1999), Lb. nantensis (Valcheva et al., 2006) ;
7– Le groupe II renferme les lactobacilles homo-hétérofermentaires facultatifs qui fermentent les hexoses, mais aussi les pentoses en lactate et acétate par la voie d'Embden-Meyerhof. Il s'agit en particulier de Lb. alimentarius, Lb. casei, Lb. curvatus, Lb. plantarum, Lb. graminis, Lb. paracasei, Lb. paraplantarum, Lb. pentosus, Lb. sakei (Stiles et al., 1997). Ces espèces bactériennes sont présentes dans les végétaux fermentés comme l'ensilage et dans les produits carnés et laitiers fermentés ;
8– Le groupe III regroupe les lactobacilles hétérofermentaires stricts qui fermentent les hexoses en lactate, acétate (ou éthanol) et CO2. Les pentoses aussi sont fermentés en lactate et en acétate. Ces Lactobacillus ont un faible pouvoir acidifiant et produisent des substances aromatiques. Il s'agit notamment de Lb. brevis, Lb. buchneri, Lb. fermentum, Lb. hilgardii, Lb. fructivorans, Lb. panis (Wiese et al., 1996), Lb. pontis, Lb. reuteri, Lb. hammesii (Valcheva et al., 2005), Lb. sanfranciscensis, Lb. spicheri, Lb. kimchii et Lb. frumenti (Müller et al., 2000). Ces espèces se retrouvent dans les levains de panification et les produits laitiers fermentés (Oheix, 2003).
9Activité antimicrobienne des cultures protectrices. Les cultures protectrices, notamment les bactéries lactiques, ont un rôle fondamental dans l'inhibition des flores non lactiques, dont certaines sont préjudiciables à la qualité des produits alimentaires. Cette action est due à l'abaissement du pH (qui inhibe la croissance de la plupart des germes non lactiques), à la toxicité des acides organiques, du peroxyde d'hydrogène et du diacétyle, mais aussi à la sécrétion de bactériocines (composés bactéricides) et des substances antifongiques (Desmazeaud, 1998).
10Cultures protectrices bactériocinogènes. Les cultures protectrices bactériocinogènes sont généralement constituées de bactéries lactiques représentant un groupe hétérogène de micro-organismes produisant des bactériocines en plus des produits de métabolisme. Elles colonisent et sont impliquées dans un grand nombre de fermentations spontanées de produits alimentaires comme les produits laitiers, carnés, halieutiques, végétaux et les céréales (Stiles et al., 1997), ce qui a conduit à la reconnaissance de leur statut GRAS (Generally Recognized As Safe) (Klaenhammer et al., 2005). Actuellement, ces bactéries lactiques regroupent treize genres bactériens différents : Lactobacillus, Bifidobacterium, Leuconostoc, Lactococcus, Enterococcus, Streptococcus, Pediococcus, Carnobacterium, Oenococcus, Weissella, Aerococcus, Tetragenococcus et Vagococcus. Elles sont principalement utilisées en tant que starter dans les produits alimentaires fermentés où elles permettent de développer certaines caractéristiques organoleptiques et d'augmenter la durée de conservation (Hugenholtz et al., 1999). Les bactériocines produites par ces cultures sont, selon Garneau et al. (2002), des molécules de nature protéique, sécrétées dans le milieu extracellulaire et douées d'une activité bactéricide dirigée essentiellement contre des bactéries taxonomiquement proches de la souche productrice et contre certains pathogènes tels que Bacillus, Clostridium et Listeria. Ces bactériocines, selon Diep et al. (2002), représentent une large classe de substances antagonistes qui varient considérablement du point de vue de leur poids moléculaire, de leurs propriétés biochimiques, de leur spectre d'action et de leur mode d'action. Toutes les bactériocines produites par des bactéries lactiques décrites jusqu'à présent ont une activité dirigée uniquement contre les bactéries Gram+ car la membrane externe des bactéries Gram- ne permet pas aux bactériocines d'atteindre la membrane interne, siège de leur activité.
11Il convient de signaler, par ailleurs, que l'effet de ces cultures protectrices dans les denrées alimentaires peut être limité par des mutations génétiques occasionnant un arrêt de la synthèse des métabolites antimicrobiens. La diffusion de la bactériocine à travers les matrices solides peut également être limitée et elle peut être désactivée par des enzymes (Kouakou et al., 2008). À côté de ces cultures bactériocinogènes, il existe des cultures non bactériocinogènes qui ne produisent pas de bactériocines, mais agissent en produisant des métabolites tels que des acides organiques (acide lactique et acétique), le peroxyde d'hydrogène et le diacétyle. Leurs effets antimicrobiens résultent de l'accroissement de la concentration de ces métabolites suite à la croissance des bactéries lactiques (Alves et al., 2006).
2.2. Législation et règlementations pour l'application des bactériocines
12D'un point de vue législatif, les bactériocines sont utilisées en tant qu'additifs alimentaires. Jusqu'à présent, seule la nisine, un lantibiotique, est acceptée comme additif alimentaire (E234) (Guinane et al., 2005). En général, l'application des bactéries productrices de bactériocines dans les produits alimentaires peut être intéressante tant au niveau législatif qu'économique. L'utilisation de souches bactériocinogènes comme additifs alimentaires ne nécessite pas une législation particulière dans de nombreux pays (par exemple, USA) si le micro-organisme possède le statut de GRAS. Mais s'il s'agit d'utiliser de la bactériocine purifiée comme conservateur, la substance doit obligatoirement être approuvée comme GRAS. Pour que cet agrément soit accordé, la bactériocine doit être génétiquement et chimiquement identifiée et caractérisée. Son utilisation et son efficacité doivent être démontrées ; le processus de fabrication doit être décrit, le dosage utilisé pour la quantification et pour la normalisation du peptide doit aussi être démontré. Les donnés toxicologiques et le sort de la molécule après ingestion sont également nécessaires (Ananou et al., 2007).
2.3. Activité antifongique des cultures protectrices
13Des substances comme l'acide phényllactique et l'acide 4-hydroxy-phényllactique, isolées des souches de Lb. plantarum 21B et 20B, ont montré une activité inhibitrice contre Aspergillus, Penicillium et Monilia. Par ailleurs, une gamme d'acides organiques tels que les acides acétique, formique, caproïque, propionique, butyrique et valérique libérés par Lb. sanfranciscensis CB1, possèdent le même effet contre Aspergillus, Fusarium, Penicillium et Monilia. Ces acides agissent d'une manière synergique (Lavermicocca et al., 2003 ; Gobbetti et al., 2005).
3. Mécanisme d'inhibition de la flore indésirable par les principaux métabolites
3.1. Par production d'acides organiques
14Au niveau de la bactérie cible, les premières structures touchées par l'acidification du milieu extracellulaire sont évidemment les macromolécules de surface (flagelle, pili, récepteur chimique, protéines périplasmiques, paroi, etc.). Les bactéries cibles ont peu de possibilités de protéger ces structures : soit elles modifient la structure des sites de fixation des composés acides au niveau de leurs membranes, soit elles évitent la perte de mobilité suite au stress acide en modulant ou en utilisant une voie métabolique alternative (Metzner et al., 2004). Si, pour une raison quelconque, les bactéries cibles n'arrivent pas à modifier la structure des sites ou proposer une alternative pour éviter la perte de mobilité due au stress acide, les protons vont entrer dans la cellule par le changement de gradient de concentration autour de la paroi bactérienne (Dilworth et al., 1999). La baisse du pH intracellulaire (pHint) provoquée par cet afflux de protons entraine des perturbations de flux métabolique et des dommages au niveau des macromolécules de surface (Foster, 1999). Cette baisse de pHint va aussi favoriser l'oxydation des lipides, modifiant ainsi leur état d'ionisation et de facto leurs propriétés d'interaction avec les autres constituants cellulaires. Le même phénomène est observé pour les protéines, pour lesquelles une baisse de pH va entrainer une augmentation des charges positives, donc une modification de leur état d'ionisation qui va modifier leur configuration spatiale et altérer leur fonctionnalité. Cette modification de l'état d'ionisation va également perturber la transcription des gènes. Au bas pH, l'ADN lui-même est fragmenté par altération des bases puriques et pyrimidiques (Cotter et al., 2003).
15Il convient de signaler que c'est la production d'acides organiques, notamment l'acide lactique et acétique, qui est à la base de la diminution du pH du milieu et, par conséquent, de la chute du pHint des bactéries cibles. L'acide lactique est le métabolite majeur produit par les bactéries lactiques. Au cours de la fermentation, lorsqu'on atteint des niveaux de pH bas, une grande quantité de l'acide lactique est contenue dans sa forme indissociée (AH). Cette forme indissociée étant lipophile, elle peut diffuser passivement à travers la membrane, se dissocier dans le cytoplasme et provoquer une chute du pHint par la libération des protons, détruisant ainsi le gradient électrochimique de proton de la bactérie cible. Il s'en suit une augmentation de la turgescence cellulaire et une inhibition des voies métaboliques par l'accumulation de la forme anionique (A-) interagissant avec les protéines. On note aussi une altération de la perméabilité membranaire qui engendrerait une perturbation des systèmes de transport de substrats (Cotter et al., 2003).
16En effet, l'acide acétique produit à faible échelle lors de la fermentation peut interagir avec les membranes cellulaires pour causer une acidification intracellulaire et une dénaturation protéique. Son activité antimicrobienne est plus efficace que celle de l'acide lactique, étant donné sa plus grande valeur de pKa (acide lactique 3,08 et acide acétique 4,75) et son grand pourcentage en formes non dissociées par rapport à l'acide lactique à un pH donné (Cotter et al., 2003). L'acide acétique est plus inhibiteur de Listeria monocytogenes que l'acide lactique, car ce dernier, en abaissant le pH du milieu, favorise l'augmentation de la toxicité de l'acide acétique. Ils agissent donc de façon synergique (Ahmad et al., 1989).
3.2. Par production de bactériocines
17Les bactériocines inhibant la flore indésirable et les bactéries Gram+ potentiellement pathogènes telles que Listeria monocytogenes et Staphylococcus aureus, sont produites par différentes espèces de cultures protectrices comme Lb. sakei (Tantillo et al., 2002), Lb. curvatus (Benkerroum et al., 2005), Lb. plantarum (Enan et al., 1996), Lb. casei (Vignolo et al., 1993), Pediococcus acidilactici (Foegeding et al., 1992), Lactococcus lactis (Benkerroum et al., 2005), Enterococcus faecium (Line et al., 2008), Staphylococcus xylosus (Papamanoli et al., 2002), Staphylococcus carnosus (Papamanoli et al., 2002), etc. Selon leurs caractéristiques structurelles et leurs activités biologiques, trois classes de bactériocines ont été définies (Diep et al., 2002) :
18– Classe I : les lantibiotiques (taille < 5 KDa) renferment dans leur séquence des acides aminés inhabituels tels que la lanthionine et la β-méthyl-lanthionine ;
19– Classe II : petits peptides non lantibiotiques (taille < 10 KDa) thermorésistants ;
20– Classe III : protéines thermolabiles de poids moléculaire supérieur à 30 KDa.
21En complément à ces trois classes, on note un quatrième groupe (la classe IV) qui renferme de petits peptides cationiques de structure cyclique (Maqueda et al., 2004).
22Les bactériocines présentent des modes d'action similaires. Il se forme en effet un pore dans la membrane de la cellule cible, occasionnant une perméabilité de celle-ci et donc une dissipation de la force proton motrice, entrainant la mort cellulaire (Bauer et al., 2005). Le mécanisme de formation des pores n'est pas connu, même si l'hypothèse la plus courante est l'association de différentes molécules de la bactériocine (Diep et al., 2007).
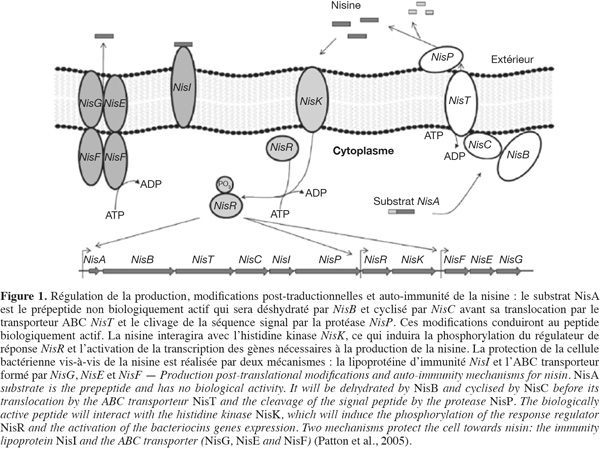
23Le mécanisme de la biosynthèse des bactériocines par les bactéries est généralement régulé par un système de Quorum Sensing qui est un mécanisme de régulation contrôlant l'expression de gènes localisés soit sur le chromosome, comme c'est le cas de la mersacidine (Altena et al., 2000), soit sur un plasmide, comme c'est le cas de la sakacine A (Axelsson et al., 1995), ou sur un transposon, comme c'est le cas de la nisine (Rauch et al., 1992) et de la lacticine 481 (Dufour et al., 2000). Les transposons étant des fragments linéaires d'ADN double-brin qui peuvent « sauter », avec ou sans réplication simultanée, du chromosome bactérien sur un plasmide ou d'un site sur un autre site du chromosome (Mainil, 2005). Les bactériocines excrétées dans le milieu extracellulaire sont d'abord produites sous forme de pré-peptides non biologiquement actifs, puis subissent des modifications post-traductionnelles pour devenir des peptides actifs. Dans le cas de la nisine par exemple, trois types de transposons d'une taille de 70 kb contenant les gènes responsables de la synthèse de nisine ont été identifiés chez Lc. lactis sp. (Rauch et al., 1992 ; Rauch et al., 1994). Les types I et II regroupent les transposons conjugatifs portant respectivement les gènes de structure nisA et nisZ codant pour le pré-peptide de la nisine A et Z. Les membres du type III contiennent le gène de structure nisZ mais sont non conjugatifs, c'est-à-dire ne possédant pas de gènes de résistance aux antibiotiques. Les transposons portent également les gènes codant pour des protéines impliquées dans les modifications post-traductionnelles du pré-peptide. Ces gènes sont nommés nisB, nisC et nisP : le gène nisB pour la déshydratation, le nisC pour la cyclisation et le nisP pour le clivage du peptide signal. Le gène responsable du transport de la bactériocine du milieu intracellulaire vers le milieu extracellulaire de la souche productrice est noté (nisT). Ceux qui sont responsables de son immunité contre sa propre bactériocine sont notés nisI, nisF, nisE et nisG, et ceux qui codent pour les facteurs de régulation de la transcription sont notés nisK et nisR (Kleerebezem et al., 2001). La production de nisine évolue en fonction de la phase de croissance. Elle débute au milieu de la phase exponentielle pour atteindre un maximum à la fin de cette phase de croissance (Kleerebezem et al., 2001). La régulation se fait via la transcription d'un peptide d'induction toujours par un système de type « Quorum Sensing ». La densité du peptide d'induction présent dans le milieu induit l'activation de l'expression des gènes (Kleerebezem, 2004). Comme la nisine, la biosynthèse de la sakacine P (bactériocine appartenant à la sous-classe IIa) produite par Lactobacillus curvatus CWBI-B28 (Dortu et al., 2008 ; Privat et al., 2010) est régulée également par un système de Quorum Sensing à trois gènes principaux qui code respectivement pour un peptide d'induction, une histidine kinase et un régulateur de réponse (Eijsink et al., 2002). En effet, la bactériocine est d'abord produite sous la forme d'un pré-peptide non biologiquement actif dont la séquence N-terminale (contenant une vingtaine d'acides aminés) appelée séquence signal est clivée par le domaine protéasique du transporteur ABC lors de son passage à travers la membrane plasmidique vers le milieu extracellulaire. Le pré-peptide devient ainsi un peptide biologiquement actif (Ennahar et al., 2000). Lorsque le milieu extérieur s'appauvrit en cet élément biologiquement actif (bactériocines), le peptide d'induction est produit à basse concentration dans le milieu intracellulaire comme un pré-peptide de bas poids moléculaire hydrophobe et stable à la chaleur. La partie N-terminale de ce peptide d'induction est clivée au niveau d'un doublet glycine lors de son excrétion par le transporteur ABC exactement comme dans le cas du pré-peptide (Eijsink et al., 2002). À une certaine concentration externe du peptide d'induction, l'histidine kinase transmembranaire est activée. Il s'en suit une phosphorylation du régulateur de réponse et l'activation de l'expression des gènes de structure, d'immunité et de transport : ici, c'est le pré-peptide qui est produit et va suivre les différentes étapes pour se transformer en un peptide biologiquement actif. Le système est donc auto-induit (Drider et al., 2006). L'organisation génétique et le mécanisme de production d'un lantibiotique (exemple de la nisine) sont montrés à la figure 1. Cependant, il a été récemment suggéré que le gène codant pour le régulateur de réponse de la sakacine P (sppR) pouvait produire deux protéines presque identiques : une protéine complète et une autre avec l'extrémité N-terminale tronquée. Cette deuxième protéine tronquée peut alors réprimer l'expression des gènes codant pour la sakacine P, probablement par interférence avec la molécule complète (Straume et al., 2007). Il convient de signaler, par ailleurs, que certaines bactériocines de classe IIa sont excrétées par un système appelé « sec-dependent pathways » (Keyser et al., 2003), ce mécanisme étant basé sur la translocation du peptide par un pore aqueux composé de plusieurs protéines (Rusch et al., 2007). Les peptides signaux de ces bactériocines ne contiennent pas de doublet glycine, mais seront quand même clivés par une peptidase durant la translocation (Sanchez et al., 2007). À ce jour, peu d'informations sont disponibles concernant la régulation de la production des bactériocines de classe IIb. Cependant, il a été montré qu'un système de régulation à trois composantes, identique à celui retrouvé pour les bactériocines de classe IIa, est impliqué dans la production de l'ABP-118 par Lactobacillus salivarius subsp. salivarius UCC118 et des plantaricines E/F et J/K par Lactobacillus plantarum C11 (Oppegard et al., 2007).
4. Facteurs influençant l'efficacité des bactériocines dans les systèmes alimentaires
24L'application de bactériocines, en particulier la nisine, dans les systèmes alimentaires a été largement étudiée (Dhindale et al., 2009). On sait maintenant que la production et l'activité des bactériocines dans les systèmes alimentaires peuvent être influencées par de nombreux facteurs, notamment ceux affectant négativement la production : conditions physiques et composition chimique inadéquates des aliments (pH, température, nutriments, etc) ; perte spontanée de la capacité de production des bactéries ; inactivation par les phages de la souche bactériocinogène ; antagonisme et effet des autres micro-organismes dans les aliments (Hornbæk et al., 2004). L'efficacité de l'activité des bactériocines dans les aliments est négativement affectée par l'apparition de cellules résistant à la bactériocine ainsi que la formation de spores. En outre, dans les produits solides, les bactéries cibles peuvent former des microcolonies ou des biofilms dont la résistance aux bactériocines peut être plus élevée (Schöbitz et al., 2003). Il y a aussi les conditions environnementales inadéquates telles que la forte rétention des molécules de bactériocine par les composants du système alimentaire (protéines, graisses), l'inactivation des bactériocines par les additifs chimiques censés protéger le produit, la dégradation de la bactériocine par les protéases (Kouakou et al., 2008), la diffusion et la solubilité plus lente et/ou la distribution irrégulière des molécules de bactériocine dans la matrice alimentaire (Kouakou et al., 2008).
4.1. Le stress subi par la bactérie cible
25L'exposition des bactéries cibles à une condition environnementale défavorable, tel un pH modérément acide avant un stress, va lui conférer une résistance bien supérieure à celle observée quand le stress est appliqué directement (Foster et al., 1990). La réponse des bactéries au stress est donc une réponse adaptative. Elle est fonction de l'état physiologique initial dans lequel la cellule se trouve, de l'intensité et de la nature du stress subi. Il a été démontré que des protéines de stress sont produites lorsqu'une bactérie est soumise à des conditions défavorables. Ainsi, chez Salmonella typhimurium, 60 et 48 protéines de stress sont exprimées respectivement en phase exponentielle et en phase stationnaire de croissance (Audia et al., 2001). Le rôle de ces protéines est de prévenir et de réparer les dommages subis par les macromolécules. Les protéines de stress peuvent permettre la régulation de l'expression des gènes de résistance, comme les facteurs de transcription σB chez les bactéries Gram+ ou σS pour les entérobactéries ou être directement impliquées dans la résistance au stress acide comme la glutamate décarboxylase (GAD). L'ensemble des mécanismes de résistance au stress est complexe et fait intervenir de multiples facteurs à différents niveaux de la machinerie cellulaire.
26Les facteurs σB et σS interviennent au niveau des signaux extracellulaires et sont associés de façon générale à la réponse des cellules induite par différents stress. Codés par le gène RpoS, les facteurs σB et σS permettent l'activation d'un grand nombre de gènes (Wemekamp-Kamphuis et al., 2004). Par exemple, des mutants σB- de Listeria monocytogenes sont 10 000 fois plus sensibles à un stress acide que les cellules natives. Mais une fois adaptés, ces mutants deviennent 10 fois plus résistants que les mutants non adaptés, ce qui met en évidence des réponses adaptatives dépendantes et indépendantes du facteur σB (Abee et al., 1999).
5. Cultures protectrices comme conservateurs biologiques
27Les études focalisées sur l'application de cultures protectrices comme conservateurs biologiques dans les aliments ont montré plusieurs avantages, dont notamment l'extension de la durée de conservation des aliments, la réduction de la transmission de maladies via la chaine alimentaire et la réduction des pertes économiques liées à la dégradation bactérienne (Thomas et al., 2000). Mais la capacité de conservation des aliments par ces cultures est attribuée principalement à la production d'un métabolite noble qui est la bactériocine. Cela dit, il faut s'assurer que la bactériocine produite par la souche bactériocinogène ait un large spectre d'activité vis-à-vis des bactéries cibles, sans que la flore utile dans certains produits soit affectée. Il faut s'assurer également que la souche bactériocinogène incorporée ne détériore pas la qualité organoleptique de l'aliment fermenté. Les conditions de culture (température, pH, Aw, exigences nutritionnelles dans l'aliment) doivent également convenir au développement du micro-organisme souhaité (Rodgers, 2001). Il est établi par ailleurs que malgré que toutes ces conditions soient satisfaites, certains pathogènes alimentaires tels que Listeria restent difficilement contrôlables par les cultures protectrices. Il a été rapporté à ce propos que les bactériocines produites par plusieurs bactéries lactiques exercent un effet bactéricide transitoire contre L. monocytogenes, souvent suivi par une nouvelle croissance de Listeria (phénomène de rebond) dans les modèles alimentaires contenant la souche bactériocinogène (Bhatti et al., 2004). Ce phénomène de rebond pourrait être dû à des facteurs qui limitent sérieusement l'activité de la bactériocine (la faible production de bactériocine due à une carence en nutriments, le piège que constitue la matrice alimentaire pour la bactériocine, l'action de la matière grasse, des protéines, des sels, des protéases, etc.) (Schillinger et al., 1991). Pour remédier à ces problèmes, les chercheurs et les industriels de l'agro-alimentaire vont privilégier d'autres alternatives, notamment celles se rapportant à l'action combinée de différents processus et méthodes de conservation pour inhiber la croissance microbienne. Ce concept de barrière ou obstacle technologique a été appliqué pour la première fois par Leistner en 1978 (Leistner, 1978). Cet auteur stipule que la sécurité microbienne, la stabilité ainsi que la qualité sensorielle et nutritionnelle des aliments sont meilleures lorsque celles-ci sont basées sur l'application combinée de conservateurs que les micro-organismes présents dans les denrées alimentaires sont incapables de surmonter. Une application intelligente de cette technologie nécessite une meilleure compréhension des évènements et interactions se déroulant entre les différentes barrières dans les aliments, ainsi que les réponses physiologiques des micro-organismes pendant la conservation des aliments (Leistner, 2000). Les différents obstacles ou traitements multiples dans les aliments ont non seulement un effet additif sur la stabilité microbienne, mais également un effet synergique. Ils offrent des réactions de stress non agressives qui perturbent la stabilité des bactéries cibles, tout en évitant l'épuisement des métabolites des cultures protectrices (Leistner, 1995).
28En pratique, cela signifie qu'il est plus efficace d'employer différents facteurs de préservation de faible intensité qu'un facteur de forte intensité, car l'utilisation combinée de plusieurs facteurs de préservation peut produire un effet synergique.
29Les principales barrières employées dans la sécurité alimentaire sont la température, l'activité de l'eau (Aw), le pH, le potentiel redox (Eh), les conservateurs chimiques, les emballages sous vide, l'atmosphère modifiée, la haute pression hydrostatique (HHP), les UV et la flore compétitive (LAB productrice de composés antimicrobiens). Plusieurs auteurs (Chawla et al., 2004) ont recommandé l'utilisation combinée des bactériocines produites par la flore compétitive avec les méthodes de conservation citées ci-dessus pour créer une série d'obstacles lors du processus de fabrication afin de réduire la détérioration des aliments par les micro-organismes. En effet, ces différentes barrières influent positivement sur l'activité de nombreuses bactériocines en augmentant la perméabilité des membranes cellulaires des bactéries cibles (Ananou et al., 2009).
30Par exemple, la combinaison de la HHP et de la nisine a été efficace contre les micro-organismes indésirables dans les fromages. Cette combinaison était également efficace contre S. carnosus et les spores de B. subtilis. Une réduction significative de L. innocua a également été observée lorsqu'on combine la nisine à une faible valeur de pH 5,5 à 20 ºC. Cependant, les cellules nisine-résistantes repoussent. Mais, lorsqu'on applique un troisième obstacle comme la température de réfrigération, une réduction spectaculaire de la population de Listeria est observée. On a une prolongation du temps de stockage de 10 jours dans le lactosérum (Gallo et al., 2007a). L'ajout de la nisine avant le traitement aux champs électriques pulsés (PEF) a accru la sensibilité de L. innocua au PEF dans le traitement de lactosérum (Gallo et al., 2007b).
31La combinaison de basses températures, du lactate de sodium et/ou du citrate de sodium avec la nisine contrôle efficacement la croissance d'Arcobacter butzleri sur le poulet (Long et al., 2003). La combinaison de la pédiocine à une pression hydrostatique élevée, le tout combiné à une température élevée, agit en synergie et provoque une réduction significative de la viabilité de S. aureus, L. monocytogenes, E. coli O157:H7, Lb. sakei et Le. mesenteroides (Kalchayanand et al., 1998). La combinaison de la pédiocine au diacétate de sodium agit en synergie contre L. monocytogenes à température ambiante et à basse température (Schlyter et al., 1993).
32Les entérocines A et B ont été utilisées en combinaison avec le HHP pour accroître la sécurité dans le jambon cuit contre L. monocytogenes. Ce pathogène était en dessous de la limite de détection à la fin du stockage (Garriga et al., 2002).
33Un traitement thermique modéré, combiné à l'entérocine AS-48, augmente l'efficacité de la bactériocine contre S. aureus dans le lait (Muñoz et al., 2007). Aussi, lorsque cette bactériocine est combinée à des substances telles que le sodium tripolyphosphate (STPP), le lactate ou encore à de l'acide organique à pH 4,5, on observe une augmentation de l'activité de l'entérocine AS-48 contre S. aureus due à un effet synergique des éléments en présence (Ananou et al., 2007). Les agents perméabilisants de paroi tels que l'EDTA ou STPP, en combinaison avec un traitement thermique léger ou encore en présence de conditions acides ou alcalines, peuvent fragiliser la paroi de certaines bactéries comme E. coli O157:H7, de sorte à renforcer l'activité antimicrobienne de l'entérocine AS-48 (Ananou et al., 2007).
6. Conclusion
34L'utilisation des cultures protectrices dirigées contre la flore indésirable et particulièrement contre des souches pathogènes (Listeria), pourrait aboutir à leur utilisation comme agents naturels pour une meilleure conservation des produits alimentaires fermentés. Cette application, en cours avec les cultures protectrices bactériocinogènes, doit être développée en combinaison avec des substances antimicrobiennes autres que les bactériocines pour multiplier les barrières ou obstacles susceptibles de fragiliser les bactéries cibles. Une meilleure compréhension des interactions entre cultures protectrices, barrières antimicrobiennes et organismes cibles est nécessaire afin d'optimiser cette utilisation. D'un point de vue fondamental, l'émergence d'une nouvelle technologie rassemblant plusieurs obstacles antimicrobiens dans une même matrice nous conduit à l'étude de leur évolution en comparant les relations structure-fonction des différents variants.
Bibliographie
Abee T. & Wouters J.A., 1999. Microbial stress response in minimal processing. Int. J. Food Microbiol., 50, 65-91.
Ahmad N. & Marth E.H., 1989. Behaviour of Listeria monocytogenes at 7, 13, 21 and 35 degree in tryptose broth acidified with acetic, citric or lactic acid. J. Food Prot., 52, 688-695.
Altena K., Guder A., Cramer C. & Bierbaum G., 2000. Biosynthesis of the lantibiotic mersacidin: organization of a type B lantibiotic gene cluster. Appl. Environ. Microbiol., 66, 2565-2571.
Alves V.F., Martinez R.C.R., Lavrador M.A.S. & De Martinis E.C.P., 2006. Antilisterial activity of lactic acid bacteria inoculated on cooked ham. Meat Sci., 74(4), 623-627.
Ananou S., Maqueda M., Martínez-Bueno M. & Valdivia E., 2007. Biopreservation, an ecological approach to improve the safety and shelf-life of foods. In: Méndez-Vilas A., ed. Communicating current research and educational topics and trends in applied microbiology, Vol. 1, 475-486.
Ananou S. et al., 2009. Evaluation of an enterocin AS-48 enriched bioactive powder obtained by spray drying. Food Microbiol., 27, 58-63.
Audia J.P., Webb C.C. & Foster J.W., 2001. Breaking through the acid barrier: an orchestrated response to proton stress by enteric bacteria. Int. J. Med. Microbiol., 291, 97-106.
Axelsson L. & Holck A., 1995. The genes involved in production of and immunity to sakacin A, a bacteriocin from Lactobacillus sake Lb706. J. Bacteriol., 177, 2125-2137.
Bauer R. & Dicks L.M.T., 2005. Mode of action of lipid II-targeting lantibiotics. Int. J. Food Microbiol., 101, 201-216.
Benkerroum N. et al., 2005. Lyophilized preparations of bacteriocinogenic Lactobacillus curvatus and Lactococcus lactis subsp. lactis as potential protective adjuncts to control Listeria monocytogenes in dry-fermented sausages. J. Appl. Microbiol., 98, 56-63.
Bhatti M., Veeramachaneni A. & Shelef L.A., 2004. Factors affecting the antilisterial effects of nisin in milk. Int. J. Food Microbiol., 97, 215-219.
Cai Y. et al., 1999. Lactobacillus paralimentarius sp. nov., isolated from sourdough. Int. J. Syst. Bacteriol., 49, 1451-1455.
Chawla S.P. & Chander R., 2004. Microbiological safety of shelf-stable meat products prepared by employing hurdle technology. Food Control, 15, 559-563.
Cotter P.D. & Hill C., 2003. Surviving the acid test: responses of Gram+ bacteria to low pH. Microbiol. Mol. Biol. Rev., 67, 429-453.
Desmazeaud M., 1998. Bactéries lactiques et qualité des fromages. Jouy-en-Josas, France : Laboratoire de Recherches laitières, INRA.
Dhindale A.K., Shete S.M., Singh B. & Sirohi S.K., 2009. Potential of bacteriocin (Nisin) to modify in vitro rumen fermentation as compared with monensin. Indian J. Dairy Sci., 62(3), 187-191.
Diep D.B. & Nes I.F., 2002. Ribosomally synthesized antibacterial peptides in Gram+ bacteria. Curr. Drug Targets, 3, 107-122.
Diep D., Salehian Z., Holo H. & Nes I.F., 2007. Common mechanisms of target cell recognition and immunity for class II bacteriocin. Proc. Natl Acad. Sci., 104, 2384-2389.
Dilworth M.J. & Glenn A.R., 1999. Problems of adverse pH and bacterial strategies to combat it. Novartis Found. Symp., 221, 4-14.
Dortu C. et al., 2008. Anti-listeria activity of bacteriocin-producing Lactobacillus curvatus CWBI-B28 and Lactobacillus sakei CWBI-B1365 on raw beef and poultry meat. Lett. Appl. Microbiol., 47, 581-586.
Drider D. et al., 2006. The continuing story of class IIa bacteriocin. Microbiol. Mol. Biol. Rev., 70(2), 564-582.
Dufour A., Rince A., Uguen P. & Le Pennec J.P., 2000. IS1675, a novel lactococcal insertion element, forms a transposon-like structure including the lacticin 481 lantibiotic operon. J. Bacteriol., 182, 5600-5605.
Eijsink V.G. et al., 2002. Production of class II bacteriocins by lactic acid bacteria; an example of biological warfare and communication. Antonie van Leeuwenhoek, 81(1-4), 639-654.
Enan G., el-Essawy A.A., Uyttendaele M. & Debevere J., 1996. Antibacterial activity of Lactobacillus plantarum UG1 isolated from dry sausage: characterization, production and bactericidal action of plantaricin UG1. Int. J. Food Microbiol., 30, 189-215.
Ennahar S., Sashihara T., Sonomoto K. & Ishizaki A., 2000. Class IIa bacteriocins: biosynthesis, structure and activity. FEMS Microbiol. Rev., 24, 85-106.
Foegeding P.M., Thomas A.B., Pilkington D.H. & Klaenhammer T.R., 1992. Enhanced control of Listeria monocytogenes by in situ-produced pediocin during dry fermented sausage production. Appl. Environ. Microbiol., 58, 884-890.
Foster J.W., 1999. When protons attack: microbial strategies of acid adaptation. Curr Opin. Microbiol., 2, 170-174.
Foster J.W. & Hall H.K., 1990. Adaptive acidification tolerance response of Salmonella typhimurium. J. Bacteriol., 172, 771-778.
Gallo L.I., Pilosof A.M.R. & Jagus R.J., 2007a. Effective control of Listeria innocua by combination of nisin, pH and low temperature in liquid cheese whey. Food Control, 18, 1086-1092.
Gallo L.I., Pilosof A.M.R. & Jagus R.J., 2007b. Effect of the sequence of nisin and pulsed electric fields treatments and mechanisms involved in the inactivation of Listeria innocua in whey. J. Food Eng., 79, 188-193.
Garneau S., Martin N.I. & Vederas J.C., 2002. Two-peptide bacteriocins produced by lactic acid bacteria. Biochemistry, 84, 577-592.
Garriga M. et al., 2002. Bactericidal synergism through bacteriocins and high pressure in a meat model system during storage. Food Microbiol., 19, 509-518.
Gobbetti M., De Angelis M., Corsetti A. & Di Cagno R., 2005. Biochemistry and physiology of sourdough lactic acid bacteria. Trends Food Sci. Tech., 16, 57-69.
Guinane C.M., Cotter P.D., Hill C. & Ross P., 2005. A review: microbial solutions to microbial problems; lactococcal bacteriocins for the control of undesirable biota of food. J. Appl. Microbiol., 98, 1316-1325.
Hornbæk T., Brocklehurst T.F. & Budde B.B., 2004. The antilisterial effect of Leuconostoc carnosum 4010 and leucocins 4010 in the presence of sodiumchloride and sodium nitrite examined in a structured gelatin system. Int. J. Food Microbiol., 92, 129-140.
Hugenholtz J. & Kleerebezem M., 1999. Metabolic engineering of lactic acid bacteria: overview of the approaches and results of pathway rerouting involved in food fermentations. Curr. Opin. Biotechnol., 10(5), 492-497.
Kalchayanand N., Sikes A., Dunne C.P. & Ray B., 1998. Factors influencing death and injury of foodborne pathogens by hydrostatic pressure-pasteurization. Food Microbiol., 15, 207-214.
Keyser J., van der Does C. & Driessen A., 2003. The bacterial translocase: a dynamic protein channel complex. Cell. Mol. Life Sci., 60, 2034-2052.
Klaenhammer T.R., Barrangou R., Logan Buck B. & Azcarate-Peril M.A., 2005. Genomic features of lactic acid bacteria effecting bioprocessing and health. FEMS Microbiol. Rev., 29, 393-409.
Kleerebezem M., 2004. Quorum sensing control of lantibiotic production; nisin and subtilin autoregulate their own biosynthesis. Peptides, 25, 1405-1414.
Kleerebezem M. & Quadri L.E., 2001. Peptide pheromone-dependent regulation of antimicrobial peptide production in Gram+ bacteria: a case of multicellular behavior. Peptides, 22, 1579-1596.
Kouakou P. et al., 2008. Enhancing the antilisterial effect of Lactobacillus curvatus CWBI-B28 in pork meat and cocultures by limiting bacteriocin degradation. Meat Sci., 80, 640-648.
Lavermicocca P., Valerio F. & Visconti A., 2003. Antifungal activity of phenyllactic acid against molds isolated from bakery products. Appl. Environ. Microbiol., 69(1), 634-640.
Leistner L., 1978. Hurdle effect and energy saving. In: Downey W.K., ed. Food quality and nutrition. London: Applied Science Publishers, 553-557.
Leistner L., 1995. In: Could G.W., ed. Principles and applications of hurdle technology, new methods of food preservation. London: Blackie Academic & Professional, 1.
Leistner L., 2000. Basic aspects of food preservation by hurdle technology. Inter. J. Food Microbiol., 55, 181-186
Line J.E. et al., 2008. Isolation and purification of Enterocin E-760 with broad antimicrobial activity against Gram+ and Gram- bacteria. Antimicrob. Agents Chemother., 52(3), 1094-1100.
Long C. & Phillips C.A., 2003. The effect of sodium citrate, sodium lactate and nisin on the survival of Arcobacter butzleri NCTC 12481 on chicken. Food Microbiol., 20, 495-502.
Mainil J., 2005. Génétique et régulation de la virulence bactérienne : vers la version moléculaire des postulats de Koch. Ann. Méd. Vét., 149(C), 24-32.
Maqueda M. et al., 2004. Peptide AS-48: prototype of new class of cyclic bacteriocins. Curr. Protein Pept. Sci., 5(5), 399-416.
Metzner M., Germer J. & Hengge R., 2004a. Multiple stress signal integration in the regulation of the complex sigma S-dependent csiD-ygaF-gabDTP operon in Escherichia coli. Mol. Microbiol., 51, 799-811.
Müller M., Ehrmann M. & Vogel R., 2000. Lactobacillus frumenti sp. nov., a new lactic acid bacterium isolated from rye-bran fermentations with a long fermentation period. Int. J. Syst. Evol. Microbiol., 50, 2127-2133.
Muñoz A. et al., 2007. Inhibition of Staphylococcus aureus in dairy products by enterocin AS-48 produced in situ and ex situ: bactericidal synergism with heat. Int. Dairy J., 17, 760-769.
Oheix N., 2003. Caractérisation moléculaire des bactéries lactiques des levains de panification. Mémoire d'ingénieur : École Nationale d'Ingénieurs des Techniques des Industries Agricoles et Alimentaires (ENITIAA), Nantes (France).
Oppegard C. et al., 2007. The two-peptide class II bacteriocins: structure, production and mode of action. J. Mol. Microbiol. Biotechnol., 13(4), 210-219.
Papamanoli E., Kotzekidou P., Tzanetakis N. & Litopoulou-Tzanetaki E., 2002. Characterization of micrococcaceae isolated from dry fermented sausage. Food Microbiol., 19, 441-449.
Patton G.C. & Van Der Donk W.A., 2005. New developments in lantibiotic biosynthesis and mode of action. Curr. Opin. Microbiol., 8, 543-551.
Privat et al., 2010. Plasmid-associated bacteriocin production by Lactobacillus LMG21688 suppresses Listeria monocytogenes growth rebound in a food system. FEMS Microbiol. Lett., 306(1), 37-44.
Rauch P.J.G. & de Vos W.M., 1992. Characterization of the novel nisin-sucrose conjugative transposon Tn5276 and its insertion in Lactococcus lactis. J. Bacteriol., 174, 1280-1287.
Rauch P.J.G., Beerthuyzen M.M. & De Vos W.M., 1994. Distribution and evolution of nisinsucrose elements in Lactococcus lactis. Appl. Environ. Microbiol., 60, 1798-1804.
Rodgers S., 2001. Preserving non-fermented refrigerated foods with microbial cultures: a review. Trends Food Sci. Technol., 12, 276-284.
Rusch S. & Kendall D., 2007. Interactions that drive sec-dependent bacterial protein transport. Biochemistry, 46, 9665-9673.
Sanchez J. et al., 2007. Amino acid and nucleotide sequence, adjacent genes and heterologous expression of hiracin JM79, a sec-dependent bacteriocin produced by Enterococcus hirae DCH5, isolated from Mallard ducks (Anas platyrhynchos). FEMS Microbiol. Lett., 270, 227-236.
Schillinger U., Kaya M. & Lücke F.K., 1991. Behavior of Listeria monocytogenes in meat and its control by a bacteriocin-producing strain of Lactobacillus sake. J. Appl. Bacteriol., 70, 473-478.
Schlyter J.H. et al., 1993. The effects of diacetate with nitrite, lactate, or pediocin on the viability of Listeria monocytogenes in turkey slurries. Int. J. Food Microbiol., 19, 271-281.
Schöbitz R., Suazo V., Costa M. & Ciampi L., 2003. Effects of a bacteriocin-like inhibitory substance from Carnobacterium piscicola against human and salmon isolates of Listeria monocytogenes. Int. J. Food Microbiol., 84, 237-244.
Stiles M.E. & Holzapfel W., 1997. Lactic acid bacteria of foods and their current taxonomy. Int. J. Food Microbiol., 36(1), 1-29.
Straume D., Kjos M., Nes I.F. & Diep D.B., 2007. Quorum-sensing based bacteriocin production is down-regulated by N-terminally truncated species of gene activators. Mol. Genet. Genomics, 278(3), 283-293.
Tantillo M.G., Di P.A & Novello L., 2002. Bacteriocin-producing Lactobacillus sake as starter culture in dry sausages. New Microbiol., 25, 45-49.
Thomas L., Maillard J.-Y., Lambert R.J.W & Russell A.D., 2000. Development of resistance to chlorhexidine acetate in Pseudomonas aeruginosa and the effect of residual concentration. J. Hosp. Infect., 46, 297-303.
Torriani S., Zapparoli G. & Dellaglio F., 1999. Use of PCR-based methods for rapid differentiation of Lactobacillus delbrueckii subsp. bulgaricus and L. delbrueckii subsp. lactis. Appl. Environ. Microbiol., 65(10), 4351-4356.
Valcheva R. et al., 2005. Lactobacillus hammesii sp. nov., isolated from french sourdough. Int. J. Syst. Evol. Microbiol, 55, 763-767.
Valcheva R. et al., 2006. Lactobacillus nantensis sp. nov. isolated from French wheat sourdough. Int. J. Syst. Evol. Microbiol., 56, 587-591.
Vermeiren L., Devlieghere F. & Debevere J., 2004. Evaluation of meat born lactic acid bacteria as protective cultures for the biopreservation of cooked meat products. Int. J. Food Microbiol., 96(2), 149-164.
Vignolo G.M., Suriani F., Pesce de Ruiz Holgado A. & Olivier G., 1993. Antibacterial activity of lactobacterial strains isolated from dry fermented sausages. J. Appl. Microbiol., 75, 344-349.
Wemekamp-Kamphuis H.H. et al., 2004. Identification of sigma factor sigma B-controlled genes and their impact on acid stress, high hydrostatic pressure, and freeze survival in Listeria monocytogenes EGD-e. Appl. Environ. Microbiol., 70, 3457-3466.
Wiese B., Strohmar W., Rainey F. & Diekmann H., 1996. Lactobacillus panis sp. nov., from sourdough with a long fermentation period. Int. J. Syst. Bacteriol., 46(2), 449-453.
Pour citer cet article
A propos de : Kouakou Privat
Univ. Liège - Gembloux Agro-Bio Tech. Centre Wallon de Biologie Industrielle (CWBI). Unité de Bio-industries. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : pkouakou@doct.ulg.ac.be
A propos de : Philippe Thonart
Univ. Liège - Gembloux Agro-Bio Tech. Centre Wallon de Biologie Industrielle (CWBI). Unité de Bio-industries. Passage des Déportés, 2. B-5030 Gembloux (Belgique).






