- Accueil
- Volume 15 (2011)
- numéro 4
- Apport de l'approche multicouche et du signal isotopique pour la compréhension de la respiration du sol en écosystème forestier
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Apport de l'approche multicouche et du signal isotopique pour la compréhension de la respiration du sol en écosystème forestier

Notes de la rédaction
Reçu le 17 novembre 2010, accepté le 12 avril 2011
Résumé
Le flux de dioxyde de carbone émanant du sol participe de manière prépondérante au cycle du carbone. On estime son amplitude à 68 ± 4 Pg C par an. En forêt tempérée, il représente approximativement 60-80 % des émissions totales de CO2 de l'écosystème (respiration de l'écosystème). Compte tenu de l'ampleur de ce flux et des conséquences qu'aurait une quelconque modification de son amplitude sur le chargement en dioxyde de carbone de l'atmosphère, il est primordial d'améliorer la connaissance des mécanismes qui le régissent et de connaitre précisément l'influence des variables du milieu (édaphiques et climatiques). Cet article vise à montrer l'intérêt d'effectuer des analyses multicouches des mécanismes à l'origine de ce flux (transport et production) plutôt que de restreindre les études à la surface du sol. De plus, cet article souligne le bénéfice apporté par l'outil isotopique pour améliorer la compréhension mécaniste de ce flux.
Abstract
Relevance of multilayer approach and isotopic signal in the understanding of soil respiration in forest ecosystem. Soil CO2 efflux is one of the most important flux in carbon cycle. Its amplitude is estimated to 68 ± 4 Pg C per year. In temperate forest, it represents approximately 60-80% of total CO2 emissions from the ecosystem (ecosystem respiration). Given its magnitude and the consequences of any amplitude change on the atmosphere carbon dioxide content, it is essential to improve knowledge of the mechanisms that govern it and know precisely the influence of environmental variables (edaphic and climatic). This paper aims to show the interest of conducting multilayer analysis of the mechanisms causing this flow (transport and production) rather than restricting the study to the soil surface. In addition, this article highlights the isotopic tool benefits to improve the mechanistic understanding of this efflux.
Table des matières
1. Introduction
1Les répercussions d'un changement climatique sur notre environnement ne sont plus équivoques. Elles justifient l'intérêt de la communauté scientifique pour une meilleure connaissance des processus à la base des perturbations engendrées. Les modèles qui tentent actuellement d'améliorer les projections climatiques futures doivent impérativement tenir compte des rétroactions, parfois complexes, qui lient le climat aux processus à l'origine de l'augmentation de la concentration en gaz à effet de serre de l'atmosphère (Denman et al., 2007). Parmi ces rétroactions, l'interaction entre le cycle du carbone et le climat est, sans conteste, primordiale (Denman et al., 2007).
2Le flux de CO2 émis par le sol (FS) participe de manière prépondérante au cycle du carbone. Il représente la composante majeure du flux de CO2 émis par les écosystèmes terrestres. À l'échelle globale, on estime son amplitude à 68 ± 4 Pg C par an (Raich et al., 1992). Il constitue en grandeur la seconde composante du cycle du carbone après la productivité primaire brute1 estimée à 120 Pg C par an (Raich et al., 1992). À titre de comparaison, la combustion d'énergie fossile libère dans l'atmosphère 6,4 Pg C par an (Denman et al., 2007). Il s'ensuit qu'un faible changement dans l'amplitude de ce flux peut modifier, de manière non négligeable, la concentration en CO2 de l'atmosphère (Raich et al., 1992). Plus particulièrement, sa sensibilité aux variables climatiques telles que la température et les précipitations est déterminante. En effet, si, comme le souligne Kirschbaum (1995 ; 2006), l'assimilation photosynthétique est moins sensible à la température que le flux de dioxyde de carbone du sol, le réchauffement climatique pourrait être à l'origine d'une rétroaction positive des écosystèmes qui nourriraient l'effet de serre. Il est, de fait, connu que FS augmente avec la température (Fang et al., 2001 ; Davidson et al., 2005 ; Kirschbaum, 2006 ; Luo et al., 2006). Cependant, malgré le nombre de publications sur le sujet, des incertitudes pèsent encore sur les modalités de sa réponse aux variables climatiques (Kirschbaum, 2006).
3Des variabilités spatiales (parcellaires, écosystémiques, régionales et entre les différents biomes) et temporelles (journalières, hebdomadaires, saisonnières et interannuelles) du flux de CO2 du sol sont abondamment rapportées dans la littérature (Ekblad et al., 2001 ; Xu et al., 2001 ; Ekblad et al., 2005 ; Luo et al., 2006). Elles résultent des variations d'intensité des processus biochimiques et des processus de transport du CO2 dans le sol (Luo et al., 2006). Ces intensités sont elles-mêmes gouvernées par les variables environnementales et édaphiques telles que la température, l'humidité, la quantité et la qualité (C/N) du substrat (humus, litière, racines mortes, C soluble dissous, etc.) et le type de sol (Bunnel et al., 1977 ; Raich et al., 1992 ; Fang et al., 2001 ; Janssens et al., 2003 ; Davidson et al., 2005 ; Luo et al., 2006). Leurs variations à toutes les échelles rendent difficiles les extrapolations temporelles et spatiales entre les différents points de mesure nécessaires pour estimer le bilan carboné à l'échelle régionale et globale.
4À l'heure actuelle, la plupart des modèles développés pour expliquer les variations observées se basent sur une approche essentiellement empirique. On utilise alors des régressions statistiques pour mettre en relation FS avec les variables les plus influentes. Ces modèles, de structure généralement simple, n'identifient pas les processus fondamentaux qui gouvernent FS. De plus, ils sont difficilement transposables d'un site à l'autre. De ce fait, ils ne peuvent être utilisés pour décrire l'impact du changement climatique sur FS (Davidson et al., 2005).
5De ce qui précède, on comprend tout l'intérêt d'améliorer la compréhension mécaniste de ce flux. Deux processus majeurs gouvernent ce dernier : la production de CO2 au sein du sol et son transport depuis son lieu de production jusqu'à l'interface avec l'atmosphère. Une meilleure compréhension mécaniste implique donc la prise en compte de ces deux processus dans les modèles (Jassal et al., 2004).
6On distingue deux composantes principales à l'origine de la production de dioxyde de carbone dans le sol, en l'espèce la respiration hétérotrophe (respiration des micro-organismes saprophytiques) et la respiration autotrophe (respiration de la rhizosphère). Ces deux composantes répondent différemment aux variables environnementales et par conséquent, au réchauffement climatique (Kuzyakov, 2006 ; Suleau et al., 2011). Les agents de production (biomasse racinaire et populations microbiennes) et les principaux facteurs influençant ces sources (température, humidité, substrat) présentent une variabilité temporelle et spatiale, à la fois horizontale et verticale (Davidson et al., 1995 ; Davidson et al., 2006). Cette dernière n'est souvent pas prise en compte dans les modèles, alors qu'un changement climatique aura probablement un impact différent sur les diverses couches de sol. La connaissance de la répartition verticale des sources est essentielle à la compréhension de la dynamique du carbone dans le sol (Pumpanen et al., 2003 ; Tang et al., 2003 ; Davidson et al., 2006). L'approche multicouche de la respiration contribue à la détermination de la distribution verticale des sources grâce à la prise en compte des phénomènes de transport et de stockage du CO2.
7L'étude du transport du CO2 dans le sol est essentielle pour d'une part, comprendre les variations temporelles de FS à courte échelle et d'autre part, quantifier et répartir la production totale entre les couches de sol à partir des observations en surface. Le processus de transport du CO2 est responsable de la différence observée, dans certaines situations, entre le taux de production de dioxyde de carbone et le flux échangé en surface. Parmi les facteurs affectant ce processus, les principaux sont les paramètres physiques du sol, comme la porosité, et la teneur en eau. Il est important de ne pas perdre de vue la variabilité de ces paramètres le long du profil vertical du sol.
8Compte tenu de la complexité des processus impliqués (multiplicité des sources, variabilité des agents et des facteurs influant), l'étude de la composition isotopique en C (12C et 13C) s'avère être un outil puissant d'analyse des mécanismes liés au flux de CO2 du sol. Les isotopes peuvent constituer un outil de traçage. Par exemple, le suivi des fluctuations de composition isotopique du CO2 (12CO2 et 13CO2) permet notamment de mettre en évidence le temps de réaction ou de parcours du C à travers le continuum « atmosphère-plante-sol » (Ekblad et al., 2005). Ils peuvent également être utilisés comme identificateur de l'importance des différentes sources (Plain et al., 2009).
9Une approche multicouche de la respiration du sol complémentée par l'outil isotopique permettra, sans conteste, l'amélioration des modèles prédictifs du flux de dioxyde de carbone émis par le sol. À ce titre, cette revue bibliographique a pour objectifs de détailler et montrer comment jusqu'à présent :
10– les modèles multicouches offrent un apport mécaniste dans l'étude de l'échange de dioxyde de carbone entre le sol et l'atmosphère en passant en revue les processus à l'origine de cet échange et en soulignant leur variabilité verticale,
11– l'outil isotopique peut être utilisé pour améliorer la description des processus de production et de transport du CO2 dans le sol.
12L'article se subdivisera en deux parties principales traitant respectivement de ces objectifs.
2. Processus à la base du flux de CO2 du sol et variabilité verticale
2.1. Production du CO2 dans le sol
13Les respirations hétérotrophe et autotrophe regroupent dans leur définition plusieurs sous-composantes. La première se réfère à la production de CO2 par les micro-organismes saprophytiques (bactéries, champignons, actinomycètes) et la macrofaune du sol (invertébrés macroscopiques, petits mammifères) lors de la minéralisation de la matière organique. Notons toutefois que la contribution de la macrofaune au flux de CO2 du sol se limite à quelques pour cent et est donc généralement négligeable (Kuzyakov, 2006). La seconde représente le CO2 émis lors de la respiration des tissus racinaires et des micro-organismes de la rhizosphère (champignons mycorhiziens, bactéries associées) qui consomment, via les racines, le C alloué par l'arbre. En effet, les racines libèrent diverses substances, nommées rhizodépots, qui sont ensuite consommées par les micro-organismes de la rhizosphère. On distingue trois types de rhizodépots en fonction de leur mode de libération :
14– les exsudats racinaires solubles (sucres, acides aminés, hormones, vitamines),
15– les sécrétions racinaires (enzymes, polymères d'hydrates de carbone),
16– les lysats (produits de l'autolyse cellulaire) (Luo et al., 2006).
17L'oxydation des composés organiques et la décarbonatation du sol constituent une autre source de CO2. Toutefois, ces contributions ne sont significatives que dans certaines situations pédologiques et climatiques particulières (Kuzyakov, 2006) rarement rencontrées en forêt. Nous ne tiendrons, de ce fait, plus compte de ces sources dans la suite de cet article.
18Comme nous l'avons mentionné dans l'introduction, les agents ainsi que les facteurs qui conditionnent la production varient dans le temps et dans l'espace (Davidson et al., 2006). Nous détaillons ci-après leur variabilité verticale.
19La biomasse racinaire, qui influe directement la quantité de CO2 produite lors de la respiration, n'est pas distribuée de manière uniforme le long d'un profil vertical de sol (Vargas et al., 2008). De nombreuses études ont montré que la densité de racines fines (< 2 mm), principales sources de CO2 de la rhizosphère, décroit avec la profondeur dans la plupart des écosystèmes forestiers (Zhou et al., 2007). Cette densité varie, en outre, en fonction des conditions environnementales et des saisons. Par exemple, Vargas et al. (2008) montrent que la dynamique de densité des racines fines est influencée par la température et l'humidité du sol. Les organismes du sol présentent également une distribution verticale. Environ 65 % de la biomasse microbienne totale se situent dans les 25 premiers cm du sol (Frey, 2007). En dessous, la densité microbienne diminue typiquement de façon linéaire voire de façon plus abrupte. La macrofaune du sol joue un rôle primordial sur le fractionnement de la matière organique, en particulier la litière. Elle participe également à la structuration du sol (les vers de terre par exemple) et a, de ce fait, un impact indirect sur les processus de production des autres acteurs du flux de CO2 du sol. En effet, la structure influence directement la circulation des fluides (liquides et gaz) et donc les niches des racines et micro-organismes. Par conséquent, elle conditionne l'accès des micro-organismes à la matière organique du sol. La densité de présence de la macrofaune évolue également le long du profil de sol. Les collemboles présentent, par exemple, un pic de présence dans les 5 premiers cm du sol et sont quasi absents en dessous de 10 cm. L'abondance et l'activité de la biomasse du sol dépendent de la texture, du pH, de la température, de la disponibilité en eau et en matières organiques. En outre, la composition et la diversité des communautés microbiennes changent le long du profil vertical du sol. Alors que les bactéries Gram-, les champignons et les protozoaires sont abondants en surface, la proportion des bactéries Gram+ et des actinomycètes augmente avec la profondeur (Frey, 2007).
20À l'instar des agents de production, les principaux facteurs influençant la productivité de dioxyde de carbone (quantité de CO2 produite par unité de biomasse productrice), comme la température, l'humidité et le substrat, varient verticalement. Ainsi, à l'échelle saisonnière/journalière, le sol s'échauffe progressivement au printemps/en matinée depuis sa surface jusqu'aux couches inférieures. En automne/fin de journée, un refroidissement s'opère dans le même sens. Les variations de température relevées en surface sont supérieures à celles observées en profondeur. De même, les sols connaissent également une importante variation verticale de leur teneur en eau. À nouveau, les fluctuations mesurées en surface sont supérieures à celles observées en profondeur. Enfin, l'apport en substrat carboné est important à la surface du sol mais dépend aussi du profil racinaire. L'apport en carbone par les racines peut en effet être considérable (Ekblad et al., 2001).
21Si la communauté scientifique s'accorde de manière unilatérale sur la différence de contribution de chacun des horizons au flux de CO2 du sol, force reste de constater les difficultés qui subsistent encore pour la quantifier et établir les relations qui la lient aux caractéristiques du sol. La solution la plus communément rencontrée pour investiguer cette contribution consiste à combiner des mesures de profil de concentration et un modèle de transport du CO2.
2.2. Transport du CO2 dans le sol
22Il est courant de supposer l'homogénéité horizontale du sol lorsqu'on travaille à l'échelle de la parcelle (Simunek et al., 1993 ; Fang et al., 1999). Cette hypothèse admet alors que l'hétérogénéité verticale est plus importante que l'hétérogénéité horizontale. Le dioxyde de carbone produit par les racines et les micro-organismes d'une couche de sol est soit stocké dans cette couche, soit transféré vers les couches voisines (inférieure et supérieure). Par conséquent, la quantité de CO2 stockée au sein d'une couche est régulée par les flux de production et de transport du CO2. L'équation de conservation de la masse traduisant cela s'écrit alors (Simunek et al., 1993 ; Fang et al., 1999) :

23où CT est la concentration totale en CO2 à une profondeur z et à un instant donné (mol CO2.m-3),
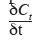 est le taux de stockage/déstockage du CO2 dans une couche, F représente les flux de CO2 (mol CO2.m-2.s-1) engendrés par les processus de transport et émis selon la direction et S est un coefficient qui prend en compte les éventuelles sources ou puits de CO2 (mol CO2.m-3.s-1).
est le taux de stockage/déstockage du CO2 dans une couche, F représente les flux de CO2 (mol CO2.m-2.s-1) engendrés par les processus de transport et émis selon la direction et S est un coefficient qui prend en compte les éventuelles sources ou puits de CO2 (mol CO2.m-3.s-1).
24On distingue plusieurs types de transport de CO2 dans le sol. Parmi eux, certains se déroulent en phase gazeuse et d'autres en phase liquide dans le sol. La contribution du transport en phase liquide n'est significative que dans des conditions bien particulières (sol proche de la saturation) peu fréquentes en présence d'un couvert forestier. Ce mode de transport est donc négligé dans la suite de la synthèse. On décrit ci-dessous les principaux types de transport en phase gazeuse.
25Diffusion en phase gazeuse. Le moteur du transport diffusif est le gradient de concentration. La diffusion du CO2 dans le sol obéit à la première loi de Fick (Fang et al., 1999 ; Jassal et al., 2004 ; Pumpanen et al., 2008). Le flux diffusif est dès lors proportionnel au gradient de concentration et au coefficient de diffusivité du CO2 du sol. On trouve, dans la littérature, plusieurs formulations de ce coefficient. Les plus couramment citées sont celles de Penman (1940), Milligton et al. (1961), Moldrup et al. (1997), Moldrup et al. (1999) et Moldrup et al. (2000). Toutes ces formulations requièrent la connaissance de paramètres physiques du sol tels que la porosité occupée par l'air et la teneur en eau volumique.
26Le gradient vertical de CO2 peut être important puisque la concentration en CO2 varie fortement le long du profil vertical du sol. De manière générale, elle augmente avec la profondeur (Luo et al., 2006). L'importance du gradient dépend du profil des facteurs conditionnant la production et le transport du CO2, à savoir la température, l'humidité, le substrat et les paramètres physiques du sol tels que la texture et la porosité. D'après l'étude menée par Lewicki et al. (2003) sur des sites californiens, la concentration en CO2 varie de 320 à 1 000 mol.mol-1 dans les couches superficielles et de 17 500 à 32 000 mol.mol-1 dans les couches profondes.
27Advection verticale en phase gazeuse. L'advection en phase gazeuse, mouvement de masse d'air incluant le CO2, apparait suite à des fluctuations de la pression atmosphérique qui créent une différence de pression entre le sol et l'atmosphère. Un gradient vertical s'établit alors dans le sol. Ces fluctuations apparaissent de plusieurs manières : changement de température, vents soufflant en surface, etc. (Massman et al., 1997). Le flux qui en découle est proportionnel à la concentration en CO2 en phase gazeuse (mol CO2.m-3) et à la vitesse du mouvement de l'air dû au gradient de pression dans le sol (m.s-1).
28Modèle flux gradient. On accepte communément que la diffusion en phase gazeuse est de loin le mécanisme de transport le plus important (Fang et al., 1999 ; Luo et al., 2006). De nombreux auteurs considèrent d'ailleurs uniquement ce type de transport dans les modèles dits « flux-gradient ». Ils utilisent alors la loi de Fick pour déterminer le flux de CO2 échangé à l'interface entre deux couches de sol à partir de mesures de concentration en CO2 à différents niveaux. Ces mesures répétées dans le temps permettent aussi d'estimer le stockage en CO2 au sein d'une couche pour accéder finalement à la répartition verticale des sources selon l'équation 1 (Tang et al., 2003 ; Hirano, 2005 ; Jassal et al., 2005 ; Turcu et al., 2005 ; Davidson et al., 2006 ; De Sutter et al., 2008 ; Pumpanen et al., 2008). D'après l'étude menée par Davidson et al. (2006) sur une forêt tempérée (Forêt de Harvard, Massachusetts, USA), la production de dioxyde de carbone de l'horizon organique O représente environ 40-48 % du flux annuel de CO2 mesuré en surface. Les recherches conduites par Pumpanen et al. (2008) sur une forêt boréale (Finlande) montrent que les contributions au flux de CO2 mesuré en surface sont respectivement de 70 %, 20 %, 10 % pour les horizons O+A, B et C. Jassal et al. (2005) concluent que 75 % du flux de CO2 est originaire des 20 premiers cm de sol dans une forêt de Douglas (Vancouver, Canada).
3. Apport de l'utilisation des isotopes stables
29Dans les paragraphes qui suivent, nous rappelons brièvement quelques principes fondamentaux de l'approche isotopique. Ensuite, nous abordons l'apport des isotopes stables dans l'étude du flux de CO2 du sol, sans occulter les incertitudes qui pèsent actuellement.
3.1. Définition de la composition et de la discrimination isotopique
30Le carbone possède deux isotopes stables, le 13C et le 12C. Un composé est caractérisé par son rapport isotopique qui se définit comme suit : R = 13C/12C. Dans la littérature, la composition isotopique (13C en ‰) est définie selon :
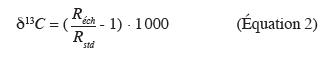
31avec, Réch, le rapport isotopique de l'échantillon et Rstd, le rapport isotopique du standard international (Roche Pee Dee Bélemnite).
32Le standard international est souvent plus riche en 13C par rapport aux échantillons organiques. De ce fait, la signature isotopique est, dans nos domaines, négative et ce, d'autant plus que l'échantillon est pauvre en 13C.
33À titre d'exemple, la composition isotopique de l'atmosphère est fort différente de celle des plantes (Ghashghaie et al., 2001) :

34Cette différence est due à un phénomène de discrimination isotopique, également appelé fractionnement, entre les molécules contenant du 12C et du 13C. De manière générale, on définit la discrimination isotopique comme un changement de composition isotopique lors d'un processus.
3.2. Discrimination isotopique
35Afin de tirer les bénéfices de l'outil isotopique, il faut impérativement élucider au préalable certains points :
36– les lieux de discrimination,
37– l'amplitude de discrimination,
38– les facteurs influençant l'amplitude de discrimination.
39L'étude des variations temporelles de 13C de FS pourra ensuite apporter des informations sur le temps de parcours/résidence et sur la provenance du C émis.
40Contrairement aux nombreuses études dédiées à la discrimination isotopique se produisant lors de la photosynthèse (Farqhuar et al., 1989 ; Brugnoli et al., 2000), les travaux menés sur le fractionnement isotopique au cours de la production de CO2 sont moins fréquents et les quelques résultats publiés souffrent de contradictions. Certains avancent l'absence de fractionnement isotopique au cours de la respiration (Lin et al., 1997 ; Roche et al., 1999 ; Ekblad et al., 2001), si bien que le CO2 respiré affiche, selon eux, la même composition isotopique que le substrat dont il est issu (matières organiques et photoassimilats). D'autres, par contre, postulent qu'une discrimination isotopique se produit au cours de la respiration (Duranceau et al., 1999 ; Ghashghaie et al., 2001 ; Bathellier et al., 2008), de telle sorte que le CO2 respiré se trouve enrichi en 13C par rapport aux carbohydrates dont il provient. À ce stade, aucune des études précitées ne s'impose de manière absolue. C'est notamment dû aux multiples processus impliqués et à la difficulté de définir le substrat respiré (sucre, amidon, réserve azotée, etc.) (Bowling et al., 2008). Ci-après, nous distinguons les processus de discrimination liés :
41– à la production par la composante autotrophe,
42– à la production par la composante hétérotrophe,
43– au transport du CO2.
44Une section est ensuite consacrée à l'étude de la variabilité temporelle de la signature isotopique de FS.
45Discrimination liée à la composante autotrophe. On ne peut aborder la discrimination isotopique liée à la respiration autotrophe (Ra) sans évoquer le fractionnement isotopique se produisant au cours de l'assimilation photosynthétique puisque le substrat utilisé provient des photoassimilats. Les plantes discriminent contre le 13C lors de la photosynthèse. La diffusion à travers les stomates et la carboxylation (réaction avec la Rubisco) du 13CO2 est plus lente que celle du 12CO2. Il en résulte que la plante est appauvrie en 13C comparativement au CO2 de l'air (Farquhar et al., 1989). Cette discrimination est souvent évaluée au moyen du modèle simple suivant :

46où a et b sont les fractionnements se produisant respectivement lors de la diffusion du CO2 et lors de la carboxylation et ci et ca sont les pressions partielles de CO2 respectivement dans les espaces intercellulaires et dans de l'air ambiant.
47L'amplitude de cette discrimination peut varier au cours du temps. Par exemple, sous des conditions environnementales conduisant à une fermeture des stomates (sècheresse), ci décroît et la discrimination photosynthétique diminue (équation 3). Il s'ensuit que la biomasse foliaire ainsi que les sucres foliaires sont moins appauvris en 13C (Bowling et al., 2008). Ensuite, la biosynthèse de composés à partir du C fixé lors de la photosynthèse implique toute une série de réactions biochimiques dans lesquelles un changement isotopique peut se produire. On parle alors de discrimination post-photosynthétique. D'après Bowling et al. (2008), cette dernière entraine, quasi systématiquement, un 13C spécifique à chaque composé organique de la plante. Par exemple, ils montrent que le saccharose et l'amidon sont enrichis en 13C par rapport à la biomasse foliaire et que la lignine et les lipides en sont appauvris. Après la discrimination post-photosynthétique, l'existence d'un fractionnement lors de la respiration mitochondrienne demeure sujette à contradictions. Le peu de connaissances actuelles proviennent exclusivement d'études menées en laboratoire. Si, d'après Bowling et al. (2008), la respiration des racines est significativement appauvrie en 13C par rapport à la biomasse foliaire, le mécanisme responsable de cet appauvrissement demeure inconnu. D'autres études doivent être menées afin de pallier les manquements dans ce domaine.
48Discrimination liée à la composante hétérotrophe. Deux processus peuvent être à l'origine d'un changement de 13C lors la respiration hétérotrophe :
49– un fractionnement direct dû au catabolisme microbien,
50– une utilisation préférentielle d'un type de substrat (ex : sucres, celluloses) par rapport à un second (ex : lignines, lipides) de composition isotopique distincte (Blagodatskaya et al., 2010 ; Ngao et al., 2011).
51On distingue en effet deux types de discrimination : le fractionnement isotopique per se (effet discriminant direct) et l'utilisation préférentielle d'un composé par rapport à un autre, de nature différente, et présentant une signature isotopique distincte (effet discriminant indirect) (Blagodatskaya et al., 2010 ; Ngao et al., 2011). Par exemple, un fractionnement per se se produit lors de la photosynthèse. Lors de la respiration hétérotrophe, par contre, on parle parfois d'utilisation préférentielle, par les micro-organismes, de substrats largement disponibles par rapport à d'autres moins disponibles et ayant une composition isotopique distincte. Dans les deux cas précités (photosynthèse et respiration hétérotrophe), on observe une différence de signature isotopique entre le substrat de réaction et le produit. Toutefois, dans le second, la différence ne provient pas d'un véritable fractionnement isotopique au cours de la décomposition (Ngao et al., 2011).
52Ces deux processus peuvent, en outre, se produire simultanément. D'après Blagodatskaya et al. (2010), il convient d'accorder ces variations au second processus. Selon eux, le fractionnement direct est négligeable lors de la respiration microbienne. Leurs résultats sont en accord avec l'étude menée antérieurement par Ekblad et al. (2002). Toutefois, à l'heure actuelle, il n'existe aucun accord pour déterminer lequel de ces deux processus explique au mieux la variation de 13C du CO2 lors de la respiration hétérotrophe À ce titre, d'autres études doivent être réalisées afin de clarifier ce point (Ngao et al., 2011).
53Fractionnement lors du transport du CO2 dans le sol. D'après Amundson (1998) et Yakir et al. (2000), le CO2 échangé à la surface du sol est appauvri en 13C par rapport à celui présent dans le sol. Il s'agit d'une discrimination isotopique se produisant lors du transport diffusif du dioxyde de carbone, compte tenu de la différence du coefficient de diffusivité des deux espèces isotopiques. Le 13CO2 s'accumule dans le sol par rapport au 12CO2. Il s'ensuit l'établissement de deux gradients (13CO2 et 12CO2) verticaux distincts. À l'équilibre, les différentes espèces isotopiques diffusant en raison de leur propre gradient, la 13C de FS correspond à la 13C de la production. Cette dernière est, dans ces conditions, 4,4 ‰ inférieure à la 13C de la [CO2] dans le sol. Cependant, les fluctuations temporelles des conditions environnementales (température et humidité du sol) d'une part et la présence d'autres processus de transport d'autre part, par nature très fluctuants en intensité (advection), font que cet état d'équilibre est rarement atteint à courte échelle de temps.
54De ce qui précède, on comprend l'intérêt d'approfondir nos connaissances concernant le fractionnement isotopique se produisant lors des processus de production et de transport de dioxyde de carbone dans le sol, sans quoi des questions fondamentales resteront sans réponse.
55Variabilité temporelle du 13C du flux de CO2 du sol. Malgré les incertitudes mentionnées ci-dessus, l'étude de la variabilité temporelle du 13C de FS fournit des renseignements utiles pour une meilleure compréhension des mécanismes à son origine. On montre notamment que l'étude de ces variations, sur plusieurs échelles de temps, permet la mise en évidence de phénomènes distincts.
56Sur une période de quelques jours, il est possible de déterminer le temps de transfert du C post-photosynthétique des feuilles jusqu'aux racines. Ekblad et al. (2001) étudient les variations d'abondance naturelle en 13C du flux de dioxyde de carbone au-dessus du sol d'une forêt boréale mixte. Au cours d'une saison de végétation, ils observent des variations allant de -21,6 ‰ à -26,5 ‰. Ils établissent alors des corrélations avec les variables météorologiques et montrent que l'humidité relative de l'air mesurée 1 à 4 jours avant l'échantillonnage du CO2 explique au mieux les variations de signature isotopique observées. Ils suggèrent alors que les valeurs élevées de 13C résultent de l'effet de l'humidité de l'air sur le fractionnement isotopique du C durant la photosynthèse, compte tenu de son effet sur la conductance stomatique. Ils concluent que 1 à 4 jours sont nécessaires pour transférer le C post-photosynthétique de la canopée (arbres de 25 m de haut) aux racines et ensuite à la surface du sol.
57Sur une échelle de temps de quelques heures, la discrimination photosynthétique ne fluctue pas assez pour expliquer les variations horaires de 13C de FS. C'est donc à d'autres facteurs qu'il convient de les attribuer. On peut les imputer à plusieurs hypothèses :
58– soit à des changements journaliers dans la nature des substrats respirés (sucre, amidon, réserve azotée),
59– soit à des changements d'amplitude de certaines sources suite à une modification des conditions environnementales (température, humidité),
60– soit à une modification de la discrimination isotopique en réponse à une modification des mêmes facteurs environnementaux,
61– soit aux processus de transport du CO2.
62En outre, pour qu'un changement d'amplitude de certaines sources induise une modification 13C de FS, il faut que ces sources présentent une signature propre distincte.
63Kodama et al. (2008) mettent en évidence de telles variations au cours d'une étude réalisée dans la forêt de Hartheim (Freiburg, Allemagne). La composition isotopique de FS est corrélée avec la température et l'humidité du sol. Ces deux variables peuvent influencer distinctement les différentes sources de CO2 (Lloyd et al., 1994 ; Kirschbaum, 1995 ; Ekblad et al., 2005). Il y a, selon eux, tout lieu de penser que les variations de composition isotopique observées au cours d'une journée résultent d'un changement relatif dans les contributions autotrophe et hétérotrophe à la respiration totale du sol (Kodama et al., 2008). Comme mentionné supra, cette hypothèse ne peut expliquer les variations de 13C de FS que si le CO2 produit par les micro-organismes et par les racines présente une signature isotopique distincte. Or, d'après les récentes études de Chemidlin Prévost-Bouré et al. (2009) et Plain et al. (2009), rien n'est moins certain. Marron et al. (2008) tirent des conclusions similaires lors d'une étude sur les variations saisonnières et journalières de la composition isotopique du flux de CO2 du sol. Des comparaisons entre les variations observées et les valeurs de composition isotopique mesurées en laboratoire à partir d'échantillons de racines, de litière et de sol, ils observent non seulement que les variations saisonnières et journalières du 13C sont du même ordre de grandeur mais qu'elles sont, de surcroît, comprises entre la valeur du 13C de la respiration des racines et de la litière relevée en laboratoire. Ces résultats suggèrent que les variations temporelles de composition isotopique du C sont associées aux changements dans la contribution relative de ces deux compartiments (racines et litière) au cours d'une journée et d'une saison.
64Notons toutefois que ces études ne suggèrent que des hypothèses qui ne pourront être acceptées qu'après avoir levé les incertitudes décrites au § 3.2. La quatrième hypothèse (cf. supra) concernant la fluctuation dans le fractionnement apparent en raison du transport du CO2 de son lieu de production vers la surface, pourra néanmoins être facilement vérifiée par une approche multicouche de la respiration du sol et de sa signature isotopique. Celle-ci consisterait en la mesure simultanée de :
65– la concentration en CO2,
66– de sa composition isotopique à plusieurs profondeurs,
67– du flux de CO2,
68– de sa signature isotopique en surface.
4. Conclusion
69Le flux de dioxyde de carbone émis par le sol est une des principales sources de dioxyde de carbone dans l'atmosphère. À ce titre, on comprend l'intérêt des scientifiques de mieux le cerner et de pallier les nombreuses incertitudes qui demeurent à l'heure actuelle quant à la réponse de ce flux aux variables environnementales (température, humidité, évènements extrêmes, etc.). Une prédiction précise des effets d'un changement du climat sur ce flux n'est naturellement possible que si la compréhension des mécanismes qui en sont à l'origine est mieux maitrisée.
70Comme nous l'avons signalé, ce flux est le résultat d'une combinaison de processus de production et de transport. Il est dès lors impératif de confronter ces deux mécanismes dans les analyses. L'ensemble des facteurs influençant ces processus varient le long du profil vertical du sol, avec pour conséquence une incidence différente d'un changement climatique sur la production et le transport du dioxyde de carbone dans le sol selon les caractéristiques de ses horizons. Peu d'études sont consacrées à la répartition verticale de sources de dioxyde de carbone et à ses interactions avec les conditions du milieu. Se contenter d'étudier le phénomène à la surface du sol ne suffit pas à une approche mécaniste. C'est donc aux analyses multicouches de la respiration qu'il convient d'accorder une importance particulière.
71Nous avons montré que la compréhension des mécanismes implique leur étude sur une échelle de temps assez courte de manière à prendre en compte l'ensemble des processus impliqués. Plus particulièrement, le transport est responsable de la différence observée entre la production et le FS à courtes échelles de temps.
72Enfin, nous avons relevé l'intérêt que constituent les analyses isotopiques dans ce type d'étude. Malgré les nombreuses incertitudes qui pèsent encore à l'heure actuelle, l'outil isotopique s'avère déjà un outil efficace d'analyse des mécanismes qui ne pourra s'améliorer que par une participation accrue des scientifiques à des campagnes de mesures.
73Dans le futur, une meilleure compréhension des mécanismes à l'origine du flux de dioxyde de carbone échangé entre le sol et l'atmosphère donnera la possibilité, au final, de proposer aux personnes chargées de la gérance d'écosystèmes, des pratiques de gestion permettant de limiter les émissions de gaz à effet de serre par les écosystèmes terrestres, voire d'accroître les possibilités de stockage de C dans le sol.
74Remerciements
75Cette étude est financée par le Fonds pour la Formation à la Recherche dans l'Industrie et dans l'Agriculture (FRIA-FRS-FNRS Belgique).
Bibliographie
Amundson R., Stern L., Baisden T. & Wang Y., 1998. The isotopic composition of soil and soil respired CO2. Geoderma, 82, 83-114.
Bathelier C. et al., 2008. Metabolic origin of the δ13C of respired CO2 in roots of Phaseolus vulgaris. New Phytol., 181, 387-399.
Blagodatskaya E., Yuyukina T., Blagodatsky S. & Kuzyakov Y., 2010. Turnover of soil organic matter and microbial biomass under C3–C4 vegetation change: consideration of 13C fractionation and preferential substrate utilization. Soil Biol. Biochem., 43, 159-166.
Bowling D.R., Tans P. & Monson R., 2001. Partitioning net ecosystem carbon exchange with isotopic flux of CO2. Global Change Biol., 7, 127-145.
Bowling D.R., Pataki D.E. & Randerson J.T., 2008. Carbon isotopes in terrestrial ecosystem pools and CO2 fluxes. New Phytol., 178, 24-40.
Brugnoli E. & Farquar G., 2000. Photosynthetic fractionation of carbon isotopes. In: Leegood R., Sharkey T. & von Caemmerer S. Photosynthesis: physiology and metabolism. Vol. 9. Dordrecht, The Netherlands: Kluwer, 399-434.
Bunnell F.L., Tait D. & Flanagan P.W., 1977. Microbial respiration and substrate weight loss: a model of the influence of chemical composition. Soil Biol. Biochem., 9, 41-47.
Chemidlin Prévost-Bouré N. et al., 2009. Root exclusion through trenching does not affect the isotopic composition of soil CO2 efflux. Plant Soil, 319, 1-13.
Ciais P. et al., 1995. A large northern hemisphere terrestrial CO2 sink indicated by the 13C/12C ratio of atmospheric CO2. Science, 269(5227), 1098-1102.
Davidson E.A. & Trumbore S.E., 1995. Gas diffusivity and production of CO2 in deep soils of eastern Amazon. Tellus, 47b, 550-565.
Davidson E.A., Janssens I. & Luo Y., 2005. On the variability of respiration in terrestrial ecosystems: moving beyond Q10. Global Change Biol., 11, 1-11.
Davidson E.A., Savage K., Trumbore S. & Borken W., 2006. Vertical partitioning of CO2 production within a temperate forest soil. Global Change Biol., 12, 944-956.
Denman et al., 2007. Couplings between changes in the climate system and biogeochemistry. In: Solomon S. et al., eds. Climate change 2007: the physical science basis. Contribution of working group I to the fourth assessment report of the Intergovernmental Panel on Climate Change. Cambridge, UK; New York, NY, USA: Cambridge University Press.
DeSutter T.M., Sauer T.J., Parkin T.B. & Heitman J.L., 2008. A subsurface, closed-loop system for soil carbon dioxide and its application to the gradient efflux approach. Soil Biol. Biochem., 1, 126-134.
Duranceau M. et al., 1999. 13C of CO2 respired in the dark in relation to 13C of leaf carbohydrates in Phaseolus vulgaris L. under progressive drought. Plant Cell Environ., 22, 515-523.
Ekblad A. & Högberg P., 2001. Natural abundance of 13C in CO2 respired from forest soils reveals speed of link between tree photosynthesis and root respiration. Oecologia, 127, 305-308.
Ekblad A., Nyberg G. & Högberg P., 2002. 13C-discrimination during microbial respiration of added C3-, C4-, and 13C-labelled sugars to C3-forest soil. Oecologia, 131, 245-249.
Ekblad A., Boström B., Holm A. & Comstedt D., 2005. Forest soil respiration rate and 13C is regulated by recent above ground weather conditions. Oecologia, 143, 136-142.
Epron D. et al., 2004. Spatial and temporal variations of soil respiration in a Eucalyptus Plantation in Congo. Forest Ecol. Manage., 202, 149-160.
Fang C. & Moncrieff J.B., 1999. A model for soil CO2 production and transport. 1: Model development. Agric. Forest Meteorol., 95, 225-236.
Fang C. & Moncrieff J.B., 2001. The dependence of soil CO2 efflux on temperature. Soil Biol. Biochem., 33, 155-165.
Farquhar G., Ehleringer J. & Hubick K., 1989. Carbon isotope discrimination and photosynthesis. Annu. Rev. Plant. Phys. Plant Mol. Biol., 40, 503-537.
Frey S.D., 2007. Spatial distribution of soil organisms. In: Paul E.A. Soil microbiology, ecology, and biochemistry. Oxford, UK: Academic Press, Elsevier, 283-300.
Ghashghaie J., Tcherkez G., Cornic G. & Deleens E., 2001. Utilisation de la spectrométrie de masse isotopique en physiologie végétale. In : Barbier-Brygoo H., Joyard J., Morot-Gaudry J.F. & Gaymard F., eds. Génomique fonctionnelle chez les végétaux : du gène à la fonction. Paris : INRA-CNRS, 97-105.
Hirano T., 2005. Seasonal and diurnal variation in topsoil and subsoil respiration under snowpack in a temperate deciduous forest. Global Biogeochem. Cycles, 19, GB2011.
Janssens I. et al., 2003. Climatic influences on seasonal & spatial differences in soil CO2 efflux. In: Valentini R. Fluxes of carbon, water & energy of European forests. Vol. 163. Berlin; Heidelberg, Germany: Springer-Verlag, 235-252.
Jassal R.S. et al., 2004. A model of the production and transport of CO2 in soil: predicting soil CO2 concentration and CO2 efflux from a forest floor. Agric. Forest Meteorol., 124, 219-236.
Jassal R.S. et al., 2005. Relationship between soil CO2 concentrations and forest-floor CO2 effluxes. Agric. Forest Meteorol., 130, 176-182.
Kirschbaum M., 1995. The temperature dependance of soil organic matter decomposition, and the effect of global warming on soil organic storage. Soil Biol. Biochem., 27, 753-760.
Kirschbaum M., 2006. The temperature dependance of organic matter decomposition-still a topic of debate. Soil Biol. Biochem., 38(9), 2510-2518.
Kodama N. et al., 2008. Temporal dynamics of the carbon isotope composition in a Pinus sylvestris stand: from newly assimilated organic carbon respired carbon dioxyde. Oecologia, 156, 737-750.
Kuzyakov Y., 2006. Sources of CO2 efflux from soil and review of partitioning methods. Soil Biol. Biochem., 38(3), 425-448.
Lewicki J.L. et al., 2003. Shallow soil CO2 flow along the San Andreas and Calaveras Faults, California. J. Geophys. Res. Solid Earth, 108, 2187.
Lin G. & Ehleringer J.R., 1997. Carbon isotopic fractionation does not occur during dark respiration in C3 and C4 plants. Plant Physiol., 114, 391-394.
Lloyd J. & Taylor J., 1994. On the temperature dependance of soil respiration. Funct. Ecol., 8, 315-323.
Luo Y. & Zhou X., 2006. Soil respiration and the environment. Amsterdam, The Netherlands; Boston, MA, USA: Elsevier Academic Press.
Marron N., Plain C., Longdoz B. & Epron D., 2008. Seasonal and daily time course of the 13C composition in soil CO2 efflux recorded with a tunable diode laser spectrophotometer (TDLS). Plant Soil, 318, 137-151.
Massman W.J. & Sommerfeld R.A., 1997. A model investigation of turbulence-driven pressure-pumping effects on the rate of diffusion of CO2, N2O, and CH4 through layered snowpacks. J. Geophys. Res., 102, 18,851-18,863.
Millington R. & Quirk J., 1961. Permeability of porous solids. Trans. Faraday Soc., 57, 1200-1207.
Moldrup P., Olesen T., Rolston D. & Yamaguchi T., 1997. Modeling diffusion and reaction in soils: VII. Predicting gas and ion diffusivity in undisturbed and sieved soils. Soil Sci., 162, 632-640.
Moldrup P. et al., 1999. Modeling diffusion and reaction in soils: VIII. Gas diffusion predicted from single-potential diffusivity or permeability measurements. Soil Sci., 164, 75-81.
Moldrup P. et al., 2000. Predicting the gas diffusion coefficient in undisturbed soil from soil water characteristics. Soil Sci. Soc. Am. J., 64, 94-100.
Ngao J. & Cotrufo M., 2011. Carbon isotope discrimination during litter decomposition can be explained by selective use of substrate with differing 13C. Biogeosci. Discuss., 8, 51-82.
Penman H.L., 1940. Gas and vapor movements in soil: the diffusion of vapors through porous solids. J. Agric. Sci., 30, 437-462.
Plain C. et al., 2009. Tracing of recently assimilated carbon in respiration at high temporal resolution in the field with a tuneable diode laser absorption spectrometer after in situ 13CO2 pulse labelling of 20-year-old beech trees. Tree Physiol., 29(11), 1433-1445.
Pumpanen J., Illvesniemi H. & Hari P., 2003. Process-based model for predicting soil carbon dioxide efflux and concentration. Soil Sci. Soc. Am. J., 67, 402-413.
Pumpanen J. et al., 2008. Respiration in boreal forest soil as determined from carbon dioxide concentration profile. Soil Physics, 72, 1187-1196.
Raich J. & Schlesinger W., 1992. The global carbon dioxyde flux in soil respiration and its relationship to vegetation and climate. Tellus, 44b, 81-99.
Roche C. & Bariac T., 1999. Interactions biosphère-atmosphère aux échelles locales et composition isotopique (13C, 18O) du CO2 atmosphérique : application à la forêt landaise. Thèse de doctorat : Université de Paris 06 (France).
Simunek J. & Suarez D., 1993. Modeling of carbon dioxide transport and production in soil: model development. Water Resour. Res., 29, 487-497.
Suleau M. et al., 2011. Respiration of three Belgian crops: partitioning of total ecosystem respiration in its heterotrophic, above- and below-ground autotrophic components. Agric. Forest Meteorol., 151(5), 633-643.
Tang J., Baldocchi D., Qi Y. & Xu L., 2003. Assessing soil CO2 efflux using continuous measurements of CO2 profiles in soils with small solid-state sensors. Agric. Forest Meteorol., 118, 207-220.
Turcu V.E., Jones S.B. & Or D., 2005. Continuous soil carbon dioxide and oxygen measurements and estimation of gradient-based gaseous flux. Soil Sci. Soc. Am. J., 4, 1161-1169.
Vargas R. & Allen M.F., 2008. Environmental controls and the influence of vegetation type, fine roots and rhizomorphs on diel and seasonal variation in soil respiration. New Phytol., 179(2), 460-471.
Xu M. & Qi Y., 2001. Soil-surface CO2 efflux and its spatial and temporal variations in a young ponderosa pine plantation in northern California. Global Change Biol., 7, 667-677.
Yakir D. & Sternberg L., 2000. The use of stable isotopes to study ecosystem gaz exchange. Oecologia, 123, 297-311.
Zhou Z. & Shangguan Z., 2007. Vertical distribution of fine roots in relation to soil factors in Pinus tabulaeformis Carr. forest of the Loess Plateau of China. Plant Soil, 291, 119-129.
Notes
Pour citer cet article
A propos de : Stéphanie Goffin
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Physique des Biosystèmes. Avenue de la Faculté, 8. B-5030 Gembloux (Belgique). E-mail : Stephanie.goffin@ulg.ac.be
A propos de : Bernard Longdoz
INRA. UMR1137. Écologie et Écophysiologie forestières. Centre Nancy. F-54280 Champenoux (France).
A propos de : Marc Aubinet
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Physique des Biosystèmes. Avenue de la Faculté, 8. B-5030 Gembloux (Belgique).






