- Home
- Volume 15 (2011)
- numéro 4
- Les monoterpènes : sources et implications dans la qualité de l'air intérieur
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Les monoterpènes : sources et implications dans la qualité de l'air intérieur

Editor's Notes
Reçu le 10 aout 2010, accepté le 8 février 2011.
Résumé
Les terpènes sont des substances ubiquistes des environnements intérieurs. Leurs sources soit d'origine biogène, soit d'origine anthropique, sont très variées : plantes d'intérieur, matériaux de construction et d'aménagement à base de bois, mobiliers et fournitures en bois, produits de nettoyage, désodorisants d'ambiance, bougies parfumées, etc. Toutefois, malgré leur caractère naturel, ces composés peuvent avoir des effets non négligeables sur la santé des occupants. En effet, certains terpènes sont reconnus comme irritants ou allergènes. De plus, ils réagissent avec d'autres molécules pour former des produits secondaires, plus nocifs tels que le formaldéhyde. De nombreuses études ont démontré que les réactions entre l'ozone et les terpènes produisaient des particules ultrafines ainsi que de nombreux composés dont le formaldéhyde, l'acétaldéhyde, l'acétone, etc. Toutefois, peu d'études ont été réalisées dans les milieux intérieurs afin d'y démontrer l'évolution des terpènes et des polluants secondaires. Les techniques d'analyse les plus fréquemment employées pour l'analyse des terpènes sont la TD-GC-SM, dont le mode de prélèvement dépend du système d'introduction des échantillons, soit le prélèvement sur tube d'adsorbant, soit le prélèvement dans un récipient. Les constructions à base de bois et les matériaux écologiques favorisent de plus hautes concentrations en terpènes dans les milieux intérieurs. Cette occurrence doit-elle susciter notre intérêt ? Le présent article a pour objectif de faire le point sur les connaissances relatives aux terpènes, et plus précisément sur les sources de monoterpènes dans les milieux intérieurs et leur implication dans sa qualité.
Abstract
Monoterpenes: sources and implications in the indoor air quality. Terpenes are recurrent in indoor environments. Their sources, biogenic or anthropological origin, are very varied: plants, wooden building materials, household products and furnishings, paints, air fresheners, perfumed candles. However, in spite of their natural character, these compounds can have significant effects on occupant's health. Indeed, some monoterpenes are recognized as irritating or allergenic. Furthermore, they react with the other molecules to form potentially more harmful secondary products such as formaldehyde. Numerous studies demonstrated that reactions between monoterpenes and ozone produced airborne particulate matter as well as secondary pollutants among which formaldehyde, acetaldehyde and acetone. However, few studies were realized in the indoor to demonstrate the terpenes and secondary pollutants evolution. The most frequently used technique for the monoterpenes analysis is the TD-GC-MS. The sampling mode depends on the sample introduction system, either the sampling on sorbent tube, or the sampling in a tank. The attraction for the wooden constructions and ecological materials leads to higher indoor monoterpenes concentrations. Has this occurrence to arouse our interest? The present article has the objective to review the knowledge relative to terpenes, and more exactly on the monoterpenes sources in indoor and their implication in its quality.
Table of content
1. Introduction
1De nos jours, un individu passe en moyenne près de 90 % de son temps dans les environnements intérieurs. De ce fait, la qualité de l'air intérieur est essentielle pour le bien être des habitants. Ces atmosphères se révèlent particulièrement riches en composés organiques volatils (COV). Plusieurs causes peuvent expliquer l'abondance et la diversité des espèces chimiques présentes dans l'air intérieur. On peut citer, entre autres, l'isolation accrue des bâtiments, l'utilisation croissante de nouveaux matériaux (construction, ameublement, etc.) et de produits à usage domestique qui ont contribué à diversifier les espèces et leurs sources d'émission (Weschler, 2009).
2Les constructions à ossature bois connaissent un succès grandissant auprès des candidats bâtisseurs. Ce type de construction offre de nombreux avantages dont notamment un mode de construction rapide, une meilleure isolation et une meilleure gestion des couts et des déchets. Toutefois, la proportion en bois y est nettement supérieure comparée aux constructions classiques. La présence de composés organiques volatils en quantités importantes, tels que les monoterpènes, est suspectée. En effet, les monoterpènes peuvent provenir des matériaux à base de bois mais également des peintures, des vernis et des produits de nettoyage (Hollender et al., 2002). Ces dernières années, des études ont rapporté que les concentrations en monoterpènes dans les milieux intérieurs ont fortement augmenté suite à l'utilisation récurrente de produits naturels pour la construction des maisons et des mobiliers, etc. (Weschler, 2009).
3Les monoterpènes possédant une liaison carbone-carbone insaturée peuvent réagir avec de nombreux agents oxydants tels que l'O3 et les radicaux OH° et NO3°. Ces agents ont été retrouvés dans les milieux intérieurs (Nøjgaard et al., 2006). De nombreuses études de laboratoire en chambre d'exposition et même sur site ont traité les mécanismes de réaction des monoterpènes avec l'O3 et la formation d'aérosols secondaires et de produits de réaction tels que, parmi d'autres, le formaldéhyde, l'acétaldéhyde et l'acétone (Nøjgaard et al., 2006 ; Sarwar et al., 2007 ; Zuraimi et al., 2007).
4Ainsi, les monoterpènes pourraient influencer, de manière directe et indirecte, la qualité de l'air intérieur. Certains articles ont démontré l'implication des hautes concentrations en monoterpènes dans le déclenchement d'irritations de la peau, des yeux et des muqueuses chez l'homme voire d'allergies (Meesters et al., 2008).
5Le présent article a pour objectif de faire le point sur les connaissances relatives aux monoterpènes dans les milieux intérieurs, et plus précisément sur les sources et les implications des monoterpènes sur la qualité de l'air de ces milieux.
2. Présentation des monoterpènes
6Les terpènes sont très répandus dans la nature. En effet, les plantes vasculaires produisent des terpènes volatils, notamment au niveau des organes foliaires. Ces molécules sont synthétisées à la suite du couplage d'au moins deux entités à 5 carbones dont la structure est celle de l'isoprène ou 2-méthylbuta-1,3-diène (Charlwood et al., 1991). Les terpènes les plus communs sont les monoterpènes, formés de deux isoprènes et ayant pour formule brute C10H16. Ils peuvent être linéaires ou cycliques et comptent de nombreux isomères.
7Composés organiques volatils biogènes en raison de leur faible poids moléculaire, les monoterpènes sont des hydrocarbures non azotés, très réactifs et d'une courte durée de vie. Bien que les terpènes soient essentiellement des hydrocarbures, de nombreux dérivés (alcools, aldéhydes et cétones) sont également considérés comme des composés terpéniques et dénommés terpénoïdes. Il n'y a pas de fonction chimique commune aux terpènes, seule leur structure et leur biosynthèse en font une catégorie.
8En tant que métabolites secondaires des plantes, les monoterpènes présentent une diversité chimique très importante, permettent à la plante de se défendre face aux facteurs de stress biotique et abiotique, constituent des signaux chimiques à travers lesquels la plante communique avec son environnement (plantes et autres organismes), n'ont pas de fonction universelle et sont différemment représentés dans les divers familles, genres et espèces, ce qui permet de les utiliser comme marqueurs chémotaxonomiques (Lafuente, 2006).
3. Sources des monoterpènes
9Les sources de monoterpènes dans les environnements intérieurs sont très diverses. Deux types peuvent être distingués ; les sources biogènes et les sources anthropiques.
10Les monoterpènes, métabolites secondaires des plantes, sont émis par les plantes vivantes mais également par tous les matériaux en bois ou à base de bois, tels que les meubles, les revêtements de sol ou de mur, les fournitures, les planchers en bois et dérivés du bois (OSB, contre-plaqué, etc.) (Salthammer et al., 1999 ; Hodgson et al., 2000 ; Aoki et al., 2007).
11De plus, certains monoterpènes sont ajoutés dans divers produits de consommation utilisés dans nos environnements intérieurs pour leurs propriétés physico-chimiques et odoriférantes (parfum, solvant, etc.). Ces produits de consommation sont entre autres les peintures naturelles ou écologiques (Lamorena et al., 2007 ; Toftum et al., 2008), les huiles essentielles (Su et al., 2007), les parfums et produits de soins personnels (Corsi et al., 2007), les produits de nettoyage et désodorisants d'ambiance (Singer et al., 2006a). L'emploi de ces produits augmente considérablement les concentrations en monoterpène dans les milieux intérieurs.
12En raison des nombreuses sources d'émission, les monoterpènes sont parmi les composés organiques volatils (COVs) les plus fréquemment retrouvés dans les milieux intérieurs (Tableau 1).
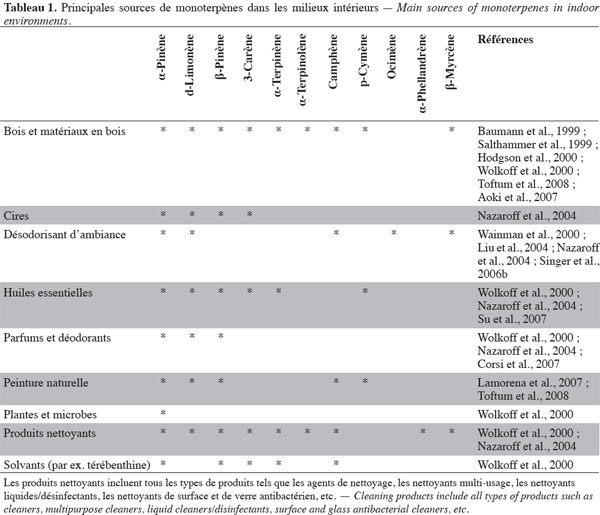
13Des études d'émission ont été réalisées sur divers matériaux en bois et dérivés ainsi que sur divers produits de consommation afin d'évaluer les taux d'émission en COVs et plus particulièrement en monoterpènes. Ces études d'émission ont été effectuées à différentes échelles (Tableau 2).
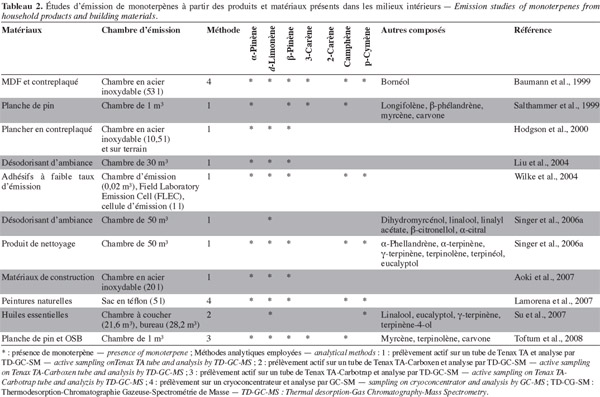
14Parmi les monoterpènes mesurés, l'α-pinène et le limonène sont les plus fréquents. L'α-pinène est en général un des composés dominants des émissions du pin, tandis que le limonène est principalement émis par les épicéas et pins et il est fréquemment retrouvé dans les produits de nettoyage (Molhave et al., 2000).
15Le tableau 3 présente les niveaux de concentration en monoterpènes mesurés dans divers environnements intérieurs. Ces dernières années, des concentrations plus importantes en monoterpènes dans l'air intérieur ont été reportées et expliquées par l'utilisation croissante de produits naturels (produits de nettoyage et désodorisants à base d'huiles essentielles, peintures naturelles, etc.) et de matériaux et mobiliers à base de bois, de matériaux de construction naturels ou recyclés (Saarela et al., 2003 ; Uhde et al., 2007).
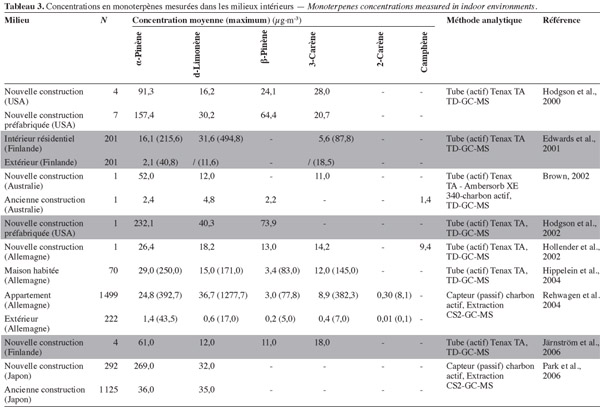
16Les gammes de concentration en monoterpènes reportées dans la littérature pour les milieux intérieurs sont très variables et comprises, selon les études, entre 0,01 à 270,00 µg.m-3 (Tableau 3). De plus, des niveaux élevés en monoterpènes ont été observés pour les nouvelles habitations, notamment en bois, et après rénovation. Ces niveaux de concentrations diminuent, cependant, très significativement avec l'âge des matériaux sur base de leurs profils d'émissions (Järnström et al., 2006 ; Park et al., 2006 ; Herbarth et al., 2010). Des niveaux encore plus élevés peuvent également être observés durant et après l'utilisation de produits ménagers (les niveaux reportés pour le d-limonène sont de 300 à 6 000 µg.m-3) (Singer et al., 2006a).
4. Méthode d'analyse des terpènes
17La revue de Lockwood (2001) présente les techniques d'extraction et de concentration couplées à la séparation chromatographique utilisées pour l'analyse des terpénoïdes volatils présents dans de nombreuses matrices (plantes, micro-organismes, air, etc.).
18La chromatographie en phase gazeuse est la technique de séparation la plus largement employée pour la caractérisation des terpènes. Les monoterpènes sont prélevés, par pompage ou par diffusion (Sunesson et al., 1999) sur un tube d'adsorbant. Les composés sont ensuite récupérés soit par une désorption thermique, soit par une désorption liquide au solvant. La désorption liquide a longtemps été employée pour l'analyse des monoterpènes dans les milieux intérieurs (Rehwagen et al., 2003 ; Park et al., 2006). Toutefois, cette technique a été reconnue moins sensible, consommatrice de solvant (sulfure de carbone, par exemple) et prédisposée à plus d'erreurs (Harper, 2000).
19Actuellement, les principales techniques employées pour l'identification et la quantification de monoterpènes sont la thermodésorption (TD) couplée à la chromatographie gazeuse (GC) avec soit la spectrométrie de masse (SM) ou la détection par ionisation de flamme (FID) (Lockwood, 2001).
20La TD-GC-SM/FID a été présentée sous différentes configurations suivant les étapes d'introduction et de concentration de l'échantillon. Les composés volatils peuvent être prélevés soit sur un tube d'adsorbant, soit dans un récipient (sac Tedlar, canister, seringue, etc.). Les analytes, extraits du tube d'adsorbant ou du récipient, sont ensuite concentrés sur un piège refroidi soit par un fluide cryogénique (de - 30 °C à - 150 °C), soit par effet Peltier (- 10 °C). Le piège est chauffé et les composés sont envoyés sur la colonne chromatographique. Dans certaines configurations, la tête de la colonne peut également être refroidie par un fluide cryogénique. Ces techniques ont été employées pour l'analyse d'échantillons d'air prélevés sur sites, dans des chambres ou des cellules d'émission (références citées aux tableaux 2 et 3).
21La thermodésorption présente de nombreux avantages, mais également quelques inconvénients. Parmi les avantages, on peut citer une préparation minime des échantillons, l'absence de solvant, une large gamme de concentration étudiée. Toutefois, la thermodésorption n'est adaptée qu'à l'analyse des composés stables à de hautes températures (Harper, 2000).
22La capacité d'adsorption d'un adsorbant pour un composé donné est caractérisée par son volume de percée, qui représente le volume de gaz à partir duquel le composé n'est plus totalement retenu. Ainsi, le prélèvement sera quantitatif pour un composé donné si le volume prélevé est inférieur au volume de percée de ce composé. Le volume de percée est fonction de l'adsorbant (nature, masse, granulométrie, surface spécifique, diamètre des pores, etc.), du composé à adsorber (nature, concentration, etc.), du milieu (température, humidité relative, composition chimique du mélange gazeux à prélever, etc.) et des conditions de prélèvement (débit, dimensions de l'échantillonneur, etc.) (Simon et al., 1995).
23Pour l'analyse environnementale des monoterpènes, plusieurs adsorbants ont été proposés tels que le charbon actif, le Carbopack B, le Carboxen 569, le Tenax TA, le Tenax GC, le Tenax GR (Lockwood, 2001) et le Chromosorb 106 (Sunesson et al., 1998). Quelques études ont également comparé différents adsorbants les plus fréquemment employés pour le suivi des COVs. Sunesson et al. (1998) ont démontré que le Chromosorb 106 est plus adapté à l'analyse des monoterpènes par prélèvement passif dans des milieux de travail présentant de fortes concentrations en terpènes tels que les scieries, tandis que Hollender et al. (2002) ont montré que le Tenax GR donnait de meilleurs résultats pour le prélèvement actif des monoterpènes dans les milieux intérieurs présentant des concentrations de 1 à 100 μg.m-3.
24Cependant, le Tenax TA a été employé dans la majorité des études traitant de l'analyse de monoterpènes. Bien que le Tenax TA possède de bonnes propriétés (faible niveau de blanc, stable à hautes températures, faible adsorption de l'eau, peu d'artefacts, inerte, applicable à une large gamme de composés, etc.), il présente toutefois quelques inconvénients. Les composés adsorbés, dont les monoterpènes, peuvent réagir ensemble ainsi qu'avec des espèces réactives (O3, radical NO3°, etc.) de l'air qui passe à travers le tube d'adsorbant (Cœur et al., 1997 ; Schrader et al., 2001 ; Arnts, 2010).
25En fonction du milieu analysé, et plus précisément dans les environnements soumis à de grandes variations des conditions (humidité, température, concentration en composés cibles, concentration en composés oxydants (O3, radical NO3°, etc.), acidité, etc.), certaines précautions doivent être prises lors de l'étape de prélèvement. En présence de fortes teneurs en O3 (de l'ordre de 300 µg.m-3), la nécessité d'un filtre à ozone a été démontrée (Calogirou et al., 1996). L'utilisation de filtres à NO2 lors du prélèvement a été suggérée afin d'éviter la dégradation du Tenax TA et des terpènes par le NO2 (Clausen et al., 1996 ; Pommer et al., 2002). Strömvall et al. (1992) ont également conseillé de réaliser un prétraitement des cartouches d'adsorbant avec du thiosulfate de sodium (Na2S2O3) comme antioxydant et de l'hydrogénocarbonate de sodium (NaHCO3) comme tampon pour prévenir les décompositions et réarrangements acides sur l'adsorbant.
26D'autres techniques ont également été proposées pour l'analyse des monoterpènes lors d'essais en chambre de simulation, telles que la micro-extraction sur phase solide (SPME)-GC-SM (López et al., 2006 ; Bouvier-Brown et al., 2007), la spectrométrie de masse par transfert de protons (PTR-MS) (Vartiainen et al., 2006 ; Bouvier-Brown et al., 2007), la spectrométrie infrarouge (Rohr et al., 2003), la spectroscopie infrarouge à transformée de Fourier (FT-IR) (Lamorena et al., 2007). La PTR-MS permet de quantifier des composés organiques volatils (COVs) présents dans l'air en temps réel.
5. Schéma réactionnel des terpènes : les produits de réaction des terpènes
27De par leurs liaisons carbone-carbone insaturées, les monoterpènes peuvent facilement interagir avec des oxydants (O3, radicaux OH° et NO3°) et par conséquent, générer une variété de polluants organiques tant dans la phase gazeuse que dans la phase condensée. Ces produits de réaction peuvent avoir un impact significatif sur la qualité de l'air intérieur. On distingue ainsi les composés primaires, tels que les terpènes émis par de nombreuses sources des milieux intérieurs, des composés secondaires résultant de l'interaction des composés primaires avec d'autres molécules (Weschler, 2000 ; Wolkoff et al., 2000).
28L'étude des monoterpènes et de leur processus de dégradation dans les milieux extérieurs a été traitée par de nombreux chercheurs (Atkinson et al., 2003 ; Berndt et al., 2003 ; Iinuma et al., 2004). Toutefois, la dynamique de réactions des monoterpènes est différente dans les milieux intérieurs, notamment pour les composés photosensibles (Fan et al., 2005). Les réactions chimiques se réalisant dans les environnements intérieurs sont très variées et très complexes (les réactions de l'ozone avec le NO, le NO2 et les hydrocarbures insaturés, la décomposition thermique des nitrates de peroxyacétyle (PAN, formule CH3COO2NO2), les réactions de radicaux libres, etc.).
29L'ozone entre dans l'environnement intérieur avec la ventilation et est typiquement présent à l'intérieur à des niveaux (5-300 µg.m-3) qui représentent de 20 à 70 % des niveaux extérieurs (Weschler, 2000 ; Udhe et al., 2007). L'ozone peut également être introduit par des sources internes, incluant les systèmes de production d'ozone (Weschler, 2000 ; Hubbard et al., 2005), certains purificateurs d'air (Niu et al., 2001 ; Britigan et al., 2006) et les équipements de bureau tels les imprimantes et les photocopieurs (Lee et al., 2001).
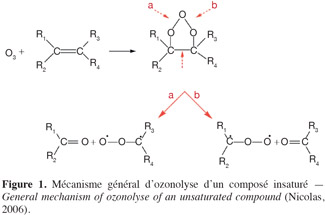
30L'ozone peut réagir avec beaucoup de substances chimiques présentes dans l'air. Afin d'étudier la réactivité de l'ozone en phase gazeuse, il est nécessaire de prendre en compte les conditions thermodynamiques, cinétiques, les concentrations des espèces et le taux de renouvellement de l'air. Malgré des caractéristiques thermodynamiques favorables, les réactions impliquant l'ozone sont cinétiquement limitées dans les environnements intérieurs et n'entrainent pas de diminution significative de la concentration en ozone. Toutefois, les composés possédant une ou plusieurs liaisons carbone-carbone insaturées tels que les monoterpènes insaturés possèdent des temps de réaction suffisamment rapides pour modifier la composition chimique de l'air intérieur (Weschler, 2000). Les produits issus de ces réactions d'ozonolyse peuvent être des ozonides primaires et secondaires, des radicaux libres (Criegee, hydroxyles, alkyles, hydroperoxyles, alkoxyles), des hydroperoxydes, des peroxydes d'hydrogène, des peroxy-hémiacétals, des époxydes, des aldéhydes (formaldéhyde, acétaldéhyde, etc.), des cétones (acétone, etc.), des acides (acide formique, etc.), des composés polyfonctionnels ou bien encore des aérosols organiques secondaires (Nazaroff et al., 2004 ; Udhe et al., 2007). La figure 1 présente le schéma réactionnel entre les alcènes et l'ozone. Certains de ces sous-produits et de produits de réaction se révèlent parfois plus irritants et nocifs que leurs précurseurs, entrainant ainsi la formation d'air de moins bonne qualité. En termes d'exposition des occupants à ces substances, leur impact sanitaire peut s'avérer plus important que l'ozone ou les COVs parents (Weschler, 2004).
31De nombreuses études portent sur les réactions d'ozonolyse des monoterpènes. Les expérimentations réalisées en laboratoire à différentes échelles concernent à la fois les composés seuls, les composés présents en mélange, les produits de consommation ou les matériaux de construction et les produits de ces réactions. Parmi les différentes configurations, sont retrouvés les tubes de réaction (Wolkoff et al., 2000 ; Nøjgaard et al., 2007), les systèmes de ventilation (Fick et al., 2005), les chambres en Téflon (Wainman et al., 2000 ; Destaillats et al., 2006 ; Lamorena et al., 2007 ; Coleman et al., 2008), les chambres en acier inoxydable (Liu et al., 2004 ; Fan et al., 2005 ; Aoki et al., 2007 ; Sarwar et al., 2007), les chambres en verre (Nicolas el al., 2007 ; Toftum et al., 2008), les chambres simulant des environnements intérieurs (Singer et al., 2006b ; Zuraimi et al., 2007).
32Les monoterpènes peuvent également réagir, dans une moindre mesure, avec les radicaux OH° et NO3° (Yu et al., 2008). De plus, le radical OH°, produit de la réaction O3-alcène, possède un pouvoir oxydant très puissant et peut réagir avec d'autres espèces chimiques, voire même le COV parent ou les COV formés par l'ozonolyse, pour donner de nouveaux composés stables contenant un ou plusieurs groupements fonctionnels de type carbonyle, carboxylate et hydroxyle. La transformation d'une partie de l'ozone en OH° conduit à des réactions d'ozonolyse des alcènes cinétiquement plus favorables (Weschler et al., 1999 ; Destaillats et al., 2006).
33En dehors des produits d'ozonolyse précédemment cités, les réactions induites par l'ozone constituent également des sources d'aérosols organiques secondaires (AOS). Ces AOS sont principalement des particules submicroniques (< 2,5 μm) et constituent un groupe important de produits de réactions initiées par l'ozone. Elles sont formées par les produits d'oxydation dont les pressions de vapeur sont faibles. Ces composés sont partagés entre la phase gazeuse et la surface des aérosols existants ou nouvellement formés par nucléation (Nazaroff, 2004 ; Weschler, 2006).
34De nombreuses recherches ont ainsi démontré que l'augmentation de la concentration des AOS en suspension dans l'air est une conséquence des réactions d'oxydation en phase gazeuse des terpènes (Wainman et al., 2000 ; Rohr et al., 2003 ; Weschler et al., 2003 ; Liu et al., 2004 ; Fan et al., 2005 ; Hubbard et al., 2005 ; Destaillats et al., 2006 ; Singer et al., 2006b ; Vartiainen et al., 2006 ; Aoki et al., 2007 ; Lamorena et al., 2007 ; Toftum et al., 2008). Toutefois, les sources d'AOS dans les environnements intérieurs sont très diverses. Les principales sources de ces aérosols étant les processus de combustion, la cuisine et les activités de nettoyage, les AOS produits à partir de la réaction entre l'ozone et les terpènes ne représentent qu'une faible proportion de l'ordre du pourcent (Afshari et al., 2005).
35Les facteurs gouvernant les concentrations en polluants secondaires gazeux et particulaires dans les environnements intérieurs sont nombreux : l'émission directe à partir des sources intérieures, les systèmes de ventilation et de filtration, le taux de renouvellement de l'air, l'adsorption sur les surfaces intérieures (Nazaroff, 2004). D'autres facteurs influencent également la réaction entre les terpènes et l'ozone ; le taux d'échange de l'air, l'humidité relative, la température, les concentrations initiales en ozone et en terpènes, la présence d'autres composés tels que le NO2 et des acides. L'influence de ces facteurs a été étudiée par de nombreux chercheurs (Wilkins et al., 2003 ; Destaillats et al., 2006 ; Nøjgaard et al., 2006 ; Singer et al., 2006b ; Aoki et al., 2007 ; Sarwar et al., 2007 ; Zuraimi et al., 2007 ; Langer et al., 2008 ; Fadeyi et al., 2009 ; Chen et al., 2010).
6. Impact sur la santé et la qualité de l'air perçu
36La pollution de l'air intérieur est une préoccupation scientifique grandissante suite à l'accumulation de nombreuses substances organiques pouvant se révéler délétères. En effet, la pollution de l'air à l'intérieur des locaux peut accroître, entre autres, les risques de phénomènes d'irritation, de sensibilisation allergique, de troubles respiratoires chroniques ou aigus. Les revues bibliographiques de Belpomme et al. (2007) et Bernstein et al. (2008) font état de la contribution de la pollution de l'air intérieur dans le développement de maladies graves telles que des cancers et des leucémies.
37Les monoterpènes peuvent agir de manière directe ou indirecte sur la santé des occupants. Certains terpènes peuvent présenter des propriétés irritantes ou allergènes, tandis que leurs produits de réaction peuvent posséder des effets potentiels voire nocifs sur la santé. Le mélange des produits de réaction semble être plus irritant, odorant et/ou préjudiciable à l'homme et son environnement que leurs précurseurs. De plus, les particules organiques en suspension sont connues pour pénétrer dans le système respiratoire plus facilement (Wolkoff et al., 2000 ; Weschler, 2004). La problématique des particules secondaires sur la santé n'a pas été abordée dans cette revue.
38Les risques pour la santé engendrés dans les environnements intérieurs résultent principalement des expositions par inhalation et par contact. De plus, une large gamme de sensibilité des occupants pouvant être attendue et la relation dose-réponse pour ces composés étant pratiquement inconnue pour les concentrations observées dans les environnements intérieurs, l'évaluation des effets des terpènes sur la santé et le confort dans les environnements intérieurs est, par conséquent, difficile.
39Certains articles ont démontré l'implication des hautes concentrations en α-pinène, β-pinène, ∆³-carène, p-cymène et d-limonène dans le déclenchement d'irritations occasionnelles de la peau, des yeux et des muqueuses chez l'homme. Des expositions prolongées peuvent également expliquer d'autres symptômes tels que les dermatites de contact allergiques et non allergiques, les dysfonctionnements chroniques des poumons et des irritations des voies respiratoires (Meesters et al., 2008). Ces précédentes études ont été réalisées avec des niveaux de concentration élevés de l'ordre du mg.m-3 similaires aux niveaux de concentration rencontrés dans les milieux de travail tels que les scieries et magasins de bois (Erikson et al., 2004). À l'inverse des milieux professionnels, les occupants des environnements intérieurs sont normalement exposés aux monoterpènes à des concentrations plus faibles et sur de plus longues périodes (Molhave et al., 2000).
40Le limonène, terpène le plus largement étudié, est reconnu comme sensibilisant par contact de la peau ainsi que ses produits d'oxydation (carvone, limonène oxyde, limonène-2-hydroperoxyde) (Karlberg et al., 1999). Le limonène est aussi repris dans la liste des allergènes de contact identifiés par le comité scientifique des produits cosmétiques et des produits non alimentaires (SCCNFP) (Dunn et al., 2006).
41D'après la revue de Lockwood (2001), l'α-pinène est également suspecté d'être un sensibilisant. Suite à des expositions de l'ordre de 10 µg.m-3 d'α-pinène dans l'air, des possibles inductions d'allergie de contact de la peau sont suspectées et le trans-verbenol, métabolite principal de l'α-pinène, peut être détecté dans les urines des individus.
42Toutefois, le faible potentiel d'irritation aigüe des yeux de quatre monoterpènes (α-pinène, α-terpinéol, 3-carène et limonène) étudiés en produits purs a été observé par Molhave et al. (2000). Ainsi, cette étude a montré que si les terpènes eux-mêmes peuvent être relativement sans danger, leurs produits de dégradation devraient être considérés avec précaution. La contribution de ces produits de dégradation sur l'irritation des yeux et du système respiratoire a été démontrée (Wolkoff et al., 2006). Ces affirmations ont été appuyées par de nombreux essais sur des souris et des études d'exposition sur l'homme (Wolkoff et al., 2000 ; Clausen et al., 2001 ; Wilkins et al., 2003 ; Nøjgaard et al., 2005 ; Tamas et al., 2006 ; Gminski et al., 2010).
43Les émissions chimiques provenant des matériaux et produits de consommation utilisés dans les environnements intérieurs ont également été évaluées en tant que facteurs de risques supplémentaires sur la santé. Mendel (2007) a résumé 21 études épidémiologiques traitant de ce sujet. Bien que les études disponibles soient limitées et que les relations de causes à effets ne soient pas systématiquement démontrées, les conclusions générales ont suggéré des effets respiratoires et allergiques néfastes associés avec certains matériaux d'intérieurs, dont les matériaux émettant du formaldéhyde, les plastiques et les peintures récemment appliquées. Il a également rapporté des associations entre les concentrations de produits chimiques présents à l'intérieur et des effets allergiques ou respiratoires chez les nourrissons et les enfants. Le formaldéhyde est actuellement le polluant à risque le plus couramment ciblé. Ce composé est un irritant des muqueuses et a, depuis 2004, été reconnu comme cancérigène pour les humains (groupe 1) par l'Agence Internationale pour la Recherche du Cancer (Cogliano et al., 2005).
44D'autres auteurs ont également étudié l'influence de la composition et des émissions des produits de consommation tels les parfums et les huiles essentielles et ont montré les effets possibles de ces produits sur la santé et la qualité de l'air intérieur (Lessenger, 2001 ; Rastogi et al., 2001 ; Buckley et al., 2003 ; Corsi et al., 2007 ; Su et al., 2007 ; Chiu et al., 2009).
7. Conclusion
45La présente revue bibliographique montre que les monoterpènes, de par leurs nombreuses sources, peuvent être présents à des niveaux de concentrations très variables et potentiellement élevés dans les environnements intérieurs. Ces niveaux peuvent également augmenter suite à des travaux de rénovation ou l'utilisation de produits riches en ces composés.
46En fonction des gammes de concentrations rencontrées mais également de l'occurrence simultanée d'agents oxydants tels que l'ozone, les monoterpènes auront un impact plus ou moins important sur la qualité de l'air intérieur. À faible concentration, une odeur agréable leur sera attribuée. À l'inverse, à des concentrations élevées (répertoriées dans la littérature de l'ordre du mg.m-3), des risques d'irritation et d'allergies seront suspectés.
47En réponse à la question concernant l'occurrence des monoterpènes dans les milieux intérieurs, des études complémentaires tant sur la caractérisation de ces environnements que sur la dynamique de réaction des monoterpènes dans les milieux intérieurs, sont nécessaires notamment à l'aide de techniques analytiques performantes telle la TD-GC-SM.
Bibliographie
Afshari A., Matson U. & Ekberg L.E., 2005. Characterization in indoor sources of fine and ultrafine particules: a study conducted in a full-scale chamber. Indoor Air, 15, 141-150.
Aoki T. & Tanabe S.I., 2007. Generation of sub-micron particles and secondary pollutants from building materials by ozone reaction. Atmos. Environ., 41, 3139-3150.
Arnts R.R., 2010. Evaluation of adsorbent sampling tube materials and Tenax TA for analysis of volatile biogenic organic compounds. Atmos. Environ., 44, 1579-1584.
Atkinson R. & Arey J., 2003. Gas-phase tropospheric chemistry of biogenic volatile organic compounds: a review. Atmos. Environ., 37(suppl. 2), S197-S219.
Baumann M.G.D., Batterman S.A. & Zhang G.H., 1999. Terpene emissions from particleboard and medium-density fiberboard products. Forest Prod. J., 49, 49-56.
Belpomme D. et al., 2007. The multitude and diversity of environmental carcinogens: review. Environ. Res., 115, 414-429.
Berndt T., Böge O. & Stratmann F., 2003. Gas-phase ozonolysis of α-pinene: gaseous products and particle formation. Atmos. Environ., 37, 3933-3945.
Bernstein J.A. et al., 2008. The health effects of non industrial indoor air pollution. J. Allergy Clin. Immunol., 121, 585-591.
Bouvier-Brown N.C., Holzinger R., Palitzsch K. & Goldstein A.H., 2007. Quantifying sesquiterpene and oxygenated terpene emissions from live vegetation using solid-phase microextraction fibers. J. Chromatogr. A., 1161, 113-120.
Britigan N., Alshawa A. & Nizkorodov S.A., 2006. Quantification of ozone levels in indoor environments generated by ionisation and ozonolysis air purifiers. J. Air Waste Manage. Assoc., 56, 601-610.
Brown S.K., 2002. Volatile organic pollutants in new and established buildings in Melbourne, Australia. Indoor Air, 12, 55-63.
Buckley D.A., Rycroft J.G., White I.R. & McFadden J.P., 2003. The frequency of fragrance allergy in patch-tested patients increases with their age. British J. Dermatol., 149, 986-989.
Calogirou A. et al., 1996. Decomposition of terpenes by ozone during sampling on Tenax. Anal. Chem., 68, 1499-1506.
Charlwood B.V. & Banthorpe D.V., 1991. Terpenoids. In: Dey P.M. & Harborne J.B., eds. Methods in plant biochemistry. Vol. 7. London: Academic Press, 43-98.
Chen X. & Hopke P.K., 2010. A chamber study of secondary organic aerosol formation by limonene ozonolysis. Indoor air, 20, 320-328.
Chiu H.H. et al., 2009. Constituents of volatile organic compounds of evaporating essential oil. Atmos. Environ., 43, 5743-5749.
Clausen P.A. & Wolkoff P., 1996. Degradation products of Tenax TA formed during sampling and thermal desorption analysis: indicators of reactive species indoors. Atmos. Environ., 31, 715-725.
Clausen P.A., Wilkins C.K., Wolkoff P. & Nielsen G.D., 2001. Chemical and biological evaluation of a reaction mixture of R-(+)-limonene/ozone. Formation of strong airway irritants. Environ. Int., 26, 511-522.
Cœur C., Jacob V., Denis I. & Foster P., 1997. Decomposition of α-pinene and sabinene on solid sorbents, Tenax TA and carboxen. J. Chromatogr. A., 786, 185-187.
Cogliano V.J. et al., 2005. Meeting report: summary of IARC monographs on formaldehyde, 2-butoxyethanol, and 1-tert-butoxy-2-propanol. Environ. Health Perspect., 113, 1205-1208.
Coleman B.K., Lunden M.M., Destaillats H. & Nazaroff W.W., 2008. Secondary organic aerosol from ozone-initiated reactions with terpene-rich household products. Atmos. Environ., 42, 8234-8245.
Corsi R.L. et al., 2007. Personal reactive clouds: introducing the concept of near-head chemistry. Atmos. Environ., 41, 3161-3165.
Destaillats H. et al., 2006. Indoor secondary pollutants from household product emissions in the presence of ozone: a bench-scale chamber study. Environ. Sci. Technol., 40, 4421-4428.
Dunn M.S. et al., 2006. Targeted multidimensional gas chromatography for the quantitative analysis of suspected allergens in fragrance products. J. Chromatogr. A., 1130, 122-129.
Edwards R.D., Jurvelin J., Saarela K. & Jantunen M., 2001. VOC concentrations measured in personal samples and residential indoor, outdoor and workplace environments in EXPOLIS-Helsinki, Finland. Atmos. Environ., 35, 4531-4543.
Eriksson K. & Wiklund L., 2004. Dermal exposure to monoterpenes during wood work. J. Environ. Monit., 6, 563-568.
Fadeyi M.O., Weschler C.J. & Tham K.W., 2009. The impact of recirculation, ventilation and filters on secondary organic aerosols generated in indoor chemistry. Atmos. Environ., 43, 3538-3547.
Fan Z., Weschler C.J., Han I.K. & Zhang J.J., 2005. Co-formation of hydroperoxides and ultra-fine particles during the reactions of ozone with a complex VOC mixture under simulated indoor conditions. Atmos. Environ., 39, 5171-5182.
Fick J. et al., 2005. Ozonolysis of monoterpenes in mechanical ventilation systems. Atmos. Environ., 39, 6315-6325.
Gminski R., Tang T. & Mersch-Sundermann V., 2010. Cytotoxicity and genotoxicity in human lung epithelial A549 cells caused by airborne volatile organic compounds emitted from pine wood and oriented strand boards. Toxicol. Lett., 196, 33-41.
Harper M., 2000. Sorbent trapping of volatile organic compounds from air: review. J. Chromatogr. A., 885, 129-151.
Herbarth O. & Matysik S., 2010. Decreasing concentrations of volatile organic compounds (VOC) emitted following home renovations. Indoor Air, 20, 141-146.
Hippelein M., 2004, Background concentrations of individual and total volatile organic compounds in residential indoor air of Schleswig-Holstein, Germany. J. Environ. Monit., 6, 745-752.
Hodgson A.T., Rudd A.F., Beal D. & Chandra A., 2000. Volatile organic compound concentrations and emission rates in new manufactured and site-built houses. Indoor Air, 10, 178-192.
Hodgson A.T., Beal D. & Mcllvaine J.E.R., 2002. Sources of formaldehyde, other aldehydes and terpenes in a new manufactured house. Indoor Air, 12, 235-242.
Hollender J., Sandner F., Möller M. & Dott W., 2002. Sensitive indoor air monitoring of monoterpenes using different adsorbents and thermal desorption gas chromatography with mass-selective detection. J. Chromatogr. A., 962, 175-181.
Hubbard H.F., Coleman B.K., Sarwar G. & Corsi R.L., 2005. Effects of an ozone-generating air purifier on indoor secondary particles in three residential dwellings. Indoor Air, 15, 432-444.
Iinuma Y., Böge O., Gnauk T. & Herrmann H., 2004. Aerosol-chamber study of α-pinene/O3 reaction: influence of particle acidity on aerosol yields and products. Atmos. Environ., 38, 761-773.
Järnström H., Saarela K., Kalliokoski P. & Pasanen A.P., 2006. References values for indoor air pollutants concentrations in new, residential buildings in Finland. Atmos. Environ., 40, 7178-7191.
Karlberg A.T., Basketter D., Goossens A. & Lepoittevin J.P., 1999. Regulatory classification of substances oxidized to skin sensitizers on exposure to air. Review article. Contact Dermatitis, 40, 183-188.
Lafuente E.O., 2006. Stratégies d'émission de composés organiques volatils (COV) par quatre espèces végétales méditerranéennes. Thèse de doctorat : Université de Provence (France).
Lamorena R.B., Jung S.-G., Bae G.-N. & Lee W., 2007. The formation of ultra-fine particles during ozone-initiated oxidations with terpenes emitted from natural paint. J. Hazard. Mater., 141, 245-251.
Langer S. et al., 2008. Ultrafine particles produced by ozone/limonene reactions in indoor air under low/closed ventilation conditions. Atmos. Environ., 42, 4149-4159.
Lee S.C., Lam S. & Fai H.K., 2001. Characterization of VOCs, ozone, and PM10 emissions from office equipment in an environmental chamber. Build. Environ., 36, 837-842.
Lessenger J.E., 2001. Occupational acute anaphylactic reaction to assault by perfume spray in the face. J. Am. Board Fam. Pract., 14, 137-140.
Liu X., Mason M., Krebs K. & Sparks L., 2004. Full-scale chamber investigation and simulation of air freshener emissions in the presence of ozone. Environ. Sci. Technol., 38, 2802-2812.
Lockwood G.B., 2001. Techniques for gas chromatography of volatile terpenoids from a range of matrices. Rev. J. Chromatogr., 936, 23-31.
López P., Huerga M.A., Batlle R. & Nerin C., 2006. Use of solid phase microextraction in diffusive sampling of the atmosphere generated by different essential oils. Anal. Chim. Acta, 559, 97-104.
Meesters R.J., Duisken M., Jähnigen H. & Hollender J., 2008. Sensitive determination of monoterpene alcohols in urine by HPLC-FLD combined with ESI-MS detection after online-solid phase extraction of the monoterpene-coumarincarbamate derivatives. J. Chromatogr. B., 875, 444-450.
Mendell M.J., 2007. Indoor residential chemical emissions as risk factors for respiratory and allergic effects in children: a review. Indoor Air, 17, 259-277.
Mølhave L. et al., 2000. The eye irritation and odor potencies of four terpenes which are major constituents of the emissions of VOCs from Nordic Soft Woods. Indoor Air, 10, 315-318.
Nazaroff W.W., 2004a. Indoor particle dynamics. Indoor Air, 14(suppl. 7), 175-183.
Nazaroff W.W. & Weschler C.J., 2004b. Cleaning products and air fresheners: exposure to primary and secondary air pollutants. Atmos. Environ., 38, 2841-2865.
Nicolas M., 2006. Ozone et qualité de l'air intérieur : interactions avec les produits de construction et de décoration. Thèse de doctorat : Université Paris 7 – Denis Diderot (France).
Nicolas M., Ramalho O. & Maupetit F., 2007. Reactions between ozone and building products: impact on primary and secondary emissions. Atmos. Environ., 41, 3129-3138.
Niu J., Tung T.C.W. & Burnett T.J., 2001. Ozone emission rate testing and ranking method using environmental chamber. Atmos. Environ., 35, 2143-2151.
Nøjgaard J.K., Christensen K.B. & Wolkoff P., 2005. The effect on human eye blink frequency of exposure to limonene oxidation products and methacrolein. Toxicol. Lett., 156, 241-251.
Nøjgaard J.K. et al., 2006. The effect of nitrogen dioxide on particle formation during ozonolysis of two abundant monoterpenes indoors. Atmos. Environ., 40, 1030-1042.
Nøjgaard J.K., Nørgaard A.W. & Wolkoff P., 2007. On-line analysis of secondary ozonides from cyclohexene and d-limonene ozonolysis using atmospheric sampling townsend discharge ionization mass spectrometry. Atmos. Environ., 41, 8345-8354.
Park J.S. & Ikeda K., 2006. Variations of formaldehyde and VOC levels during 3 years in new and older homes. Indoor Air, 16, 129-135.
Pommer L., Fick J., Andersson B. & Nilsson C., 2002. Development of a NO2 scrubber for accurate sampling of ambient levels of terpenes. Atmos. Environ., 36, 1443-1452.
Rastogi S.C., Heydorn S., Johansen J.D. & Basketter D.A., 2001. Fragrance chemicals in domestic and occupational products. Contact Dermatitis, 45, 221-225.
Rehwagen M., Schlink U. & Herbarth O., 2003. Seasonal cycle of VOCs in apartments. Indoor Air, 13, 283-291.
Rohr A.C., Weschler C.J., Koutrakis P. & Spengler J.D., 2003. Generation and quantification of ultrafine particles through terpenes/ozone reaction in a chamber setting. Aerosol Sci. Technol., 37, 65-78.
Saarela K. et al., 2003. Exposure of population and microenvironmental distributions of volatile organic compound concentrations in the EXPOLIS study. Atmos. Environ., 37, 5563-5575.
Salthammer T., Schwarz A. & Fuhrmann F., 1999. Emission of reactive compounds and secondary products from wood-based furniture coatings. Atmos. Environ., 33, 75-84.
Sarwar G. & Corsi R., 2007. The effects of ozone/limonene reactions on indoor secondary organic aerosols. Atmos. Environ., 41, 959-973.
Schrader W., Geiger J., Klockow D. & Korte E.H., 2001. Degradation of α-pinene on Tenax during sample storage: effects of daylight radiation and temperature. Environ. Sci. Technol., 35, 2717-2720.
Simon V., Riba M.L., Waldhart A. & Torres L., 1995. Breakthrough volume of monoterpenes on Tenax TA: influence of temperature and concentration for α-pinene. J. Chromatogr. A., 704, 465-471.
Singer B.C., Destaillats H., Hodgson A.T. & Nazaroff W.W., 2006a. Cleaning products and air fresheners: emissions and resulting concentrations of glycol ethers and terpenoids. Indoor Air, 16, 179-191.
Singer B.C. et al., 2006b. Indoor secondary pollutants from cleaning product and air freshener use in the presence of ozone. Atmos. Environ., 40, 6696-6710.
Strömvall A.M. & Petersson G., 1992. Protection of terpenes against oxidative and acid decomposition on adsorbent cartridges. J. Chromatogr., 589, 385-389.
Su H.J., Chao C.J., Chang H.Y. & Wu P.C., 2007. The effects of evaporating essential oils on indoor air quality. Atmos. Environ., 41, 1230-1236.
Sunesson A.L. et al., 1999. Evaluation of two adsorbents for diffusive sampling and thermal desorption-gas chromatographic analysis of monoterpenes in air. J. Environ. Monit., 1, 45-50.
Tamas G., Weschler C.J., Toftum J. & Fanger P.O., 2006. Influence of ozone-limonene reactions on perceived air quality. Indoor Air, 16, 168-178.
Toftum J., Freund S., Salthammer T. & Weschler C.J., 2008. Secondary organic aerosols from ozone-initiated reactions with emissions from wood-based materials and a green paint. Atmos. Environ., 42, 7632-7640.
Udhe E. & Salthammer T., 2007. Impact of reaction products from building materials and furnishings on indoor air quality. A review of recent advances in indoor chemistry. Atmos. Environ., 41, 3111-3128.
Vartiainen E. et al., 2006. Formation and growth of indoor air aerosol particles as a result of d-limonene oxidation. Atmos. Environ., 40, 7882-7892.
Wainman T., Zhang J., Weschler C.J. & Lioy P.J., 2000. Ozone and limonene in indoor air: a source of submicron particule exposure. Environ. Health Perspect., 108, 1139-1145.
Weschler C.J., 2000. Ozone in indoor environments: concentrations and chemistry. Indoor Air, 10, 269-288.
Weschler C.J., 2004. New directions: ozone-initiated reaction product indoors may be more harmful than ozone itself. Atmos. Environ., 38, 5715-5716.
Weschler C.J., 2006. Ozone's impact on public health: contributions from indoor exposures to ozone and products of ozone-initiated chemistry. Review. Environ. Health Perspect., 114, 1489-1496.
Weschler C.J., 2009. Changes in indoor pollutants since the 1950s. Atmos. Environ., 43, 153-169.
Weschler C.J. & Shields H.C., 1999. Indoor ozone/terpene reactions as a source of indoor particles. Atmos. Environ., 33, 2301-2312.
Weschler C.J. & Shields H.C., 2003. Experiments probing the influence of air exchange rates on secondary organic aerosols derived from indoor chemistry. Atmos. Environ., 37, 5621-5631.
Wilke O., Jann O. & Brödner D., 2004. VOC- and SVOC-emissions from adhesives, floor coverings and complete floor structures. Indoor Air, 14(Suppl 8), 98-107.
Wilkins C.K. et al., 2003. Upper airway irritation of terpene/ozone oxidation products (TOPS). Dependence on reaction time, relative humidity and initial ozone concentration. Toxicol. Lett., 143, 109-114.
Wolkoff P., Clausen P.A., Wilkins C.K. & Nielsen G.D., 2000. Formation of strong airway irritants in terpene/ozone mixtures. Indoor Air, 10, 82-91.
Wolkoff P., Wilkins C.K., Clausen P.A. & Nielsen G.D., 2006. Organic compounds in office environments. Sensory irritation, odor, measurements and the role of reactive chemistry. Indoor Air, 16, 7-19.
Yu Y. et al., 2008. Photooxidation of α-pinene at high relative humidity in the presence of increasing concentrations of NOx. Atmos. Environ., 42, 5044-5060.
Zuraimi M.S., Weschler C.J., Tham K.W. & Fadeyi M.O., 2007. The impact of building recirculation rates on secondary organic aerosols generated by indoor chemistry. Atmos. Environ., 41, 5213-5223.
To cite this article
About: Christelle Marlet
Univ. Liège-Gembloux Agro-Bio Tech. Unité de Chimie analytique. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : marlet_christelle@msn.com
About: Georges Lognay
Univ. Liège-Gembloux Agro-Bio Tech. Unité de Chimie analytique. Passage des Déportés, 2. B-5030 Gembloux (Belgique).






