- Home
- volume 16 (2012)
- numéro 1
- Effet structurant de la plante hôte chez la bruche de l'arachide, Caryedon serratus (Olivier, 1790) (Coleoptera : Bruchidae)
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Effet structurant de la plante hôte chez la bruche de l'arachide, Caryedon serratus (Olivier, 1790) (Coleoptera : Bruchidae)

Editor's Notes
Reçu le 9 décembre 2010; accepté le 7 juin 2011.
Résumé
Vingt-six populations de la bruche de l'arachide obtenues de gousses de cinq plantes hôtes (Arachis hypogaea L., Bauhinia rufescens Lam., Cassia sieberiana DC., Piliostigma reticulatum (DC.) Hochst. et Tamarindus indica L.) de quatre localités du Sénégal sont comparées par électrophorèse basée sur six loci de quatre systèmes enzymatiques. La structuration des populations de Caryedon serratus Olivier a été analysée en utilisant les estimateurs de Weir et Cockerham des F-statistiques de Wright. La valeur de θ (0,235) et le dendrogramme des distances génétiques de Rogers ont révélé un fort degré de différenciation génétique entre bruches inféodées à des plantes hôtes différentes. En excluant les échantillons issus de C. sieberiana responsables du taux élevé de différenciation, l'analyse montre que les populations forment des races hôtes partiellement isolées en fonction de leur plante hôte (θ = 0,035). Les distances géographiques entre localités ne semblent pas influencer la structuration génétique des différentes populations.
Abstract
Structuring effect of the host plant in the groundnut bruchid, Caryedon serratus (Olivier, 1790) (Coleoptera: Bruchidae). Twenty-six samples of the groundnut seed-beetle which were reared from pods of five different host plants (Arachis hypogaea L., Bauhinia rufescens Lam., Cassia sieberiana DC., Piliostigma reticulatum (DC.) Hochst. and Tamarindus indica L.) in four localities of Senegal were compared using electrophoresis based on six loci of four enzymatic systems. The population structure of Caryedon serratus Olivier was analysed using Weir and Cockerham's estimator of Wright's F-statistics. θ value (0.235) and the dendrogram of Rogers'genetic distances revealed a high degree of genetic differentiation between host plants. Genetic analysis without C. sieberiana samples indicated that populations form host races which are partially isolated according to their host plants (θ = 0.035). Geographical distances between localities are not decisive for genetic structuration of C. serratus populations from a given host plant.
Table of content
1. Introduction
1L'arachide (Arachis hypogaea L.) est une légumineuse originaire d'Amérique du Sud, probablement de la partie orientale de la Bolivie. Elle fut introduite en Afrique occidentale, principalement au Sénégal, vers la fin du 16e siècle où elle s'est peu à peu imposée comme la principale culture de rente. Elle occupe actuellement une place prépondérante dans le système économique du Sénégal où sa culture couvre plus de la moitié des surfaces cultivables. Cette légumineuse rapporte chaque année environ 80 milliards de FCFA, ce qui représente 40 % de l'ensemble des exportations du pays (Sembène, 2006). Très riche en protéines et en calories (50 % de lipides, 25 % de protéines), cette plante oléagineuse constitue également un apport nutritif très important pour les populations locales (Ndiaye, 1991).
2Après la récolte, très peu d'insectes sont capables d'attaquer l'arachide en coque ; parmi ceux-ci, celui qui provoque le plus de dégâts dans les stocks est un coléoptère appartenant à la famille des Bruchidae : Caryedon serratus Olivier. Communément appelé bruche de l'arachide, C. serratus a été décrit en 1790 par Olivier à partir de récoltes faites par Geoffroy de Villeneuve. Au Sénégal, ce ravageur possède plusieurs plantes hôtes naturelles, principalement des Caesalpiniaceae arborescentes, dont les plus importantes sont Bauhinia rufescens Lam., Cassia sieberiana DC., Piliostigma reticulatum (DC.) Hochst. et Tamarindus indica L. L'observation de la phénologie de ces différentes espèces hôtes de C. serratus montre qu'elle n'est pas identique mais on peut cependant en tirer une règle générale. Toutes fleurissent d'aout à octobre et produisent des gousses qui mûrissent au début de la saison sèche (novembre-décembre). Elles restent longtemps sur l'arbre puis tombent au sol où elles se dégradent lentement. Presqu'aucune gousse de ces plantes hôtes de C. serratus ne subsiste sur l'arbre pendant la saison des pluies (aout à octobre), à l'exception de celles de B. rufescens qui fructifient toute l'année.
3Insecte généraliste initialement connu comme la bruche de T. indicus (tamarinier), C. serratus s'est secondairement attaqué à l'arachide au début du 20e siècle. C'est en Afrique occidentale et particulièrement au Sénégal que furent signalées ses premières attaques (Roubeaud, 1916). Depuis, son aire d'extension ne cesse de s'accroître lentement, jusqu'à s'étendre actuellement à la plupart des régions chaudes du globe. Son expansion parait liée au commerce du tamarin et à l'exportation de l'arachide. Ainsi, elle est apparue au Congo vers 1970 suite à l'importation de semences provenant du Sénégal (Delobel, 1995). Pour expliquer les premières infestations de l'arachide par C. serratus, certains auteurs (Matokot et al., 1987 ; Delobel, 1995) ont pensé à l'apparition au Sénégal d'une lignée particulière, adaptée à l'arachide et qui serait à l'origine de tous les foyers actuels. Les dégâts occasionnés par C. serratus sur les productions d'arachide du Sénégal peuvent aller jusqu'à 83 % de perte quantitative après une durée de stockage de quatre mois (Ndiaye, 1991). De plus, les trous faits dans la coque par les larves favorisent l'attaque d'autres insectes tels que Trogoderma spp. Berthold., Tribolium spp. (Herbst), Oryzaephilus mercator (Fauvel), Ephestia cautella (Walker) et facilitent la contamination par un champignon (Aspergillus flavus) producteur d'une substance cancérigène : l'aflatoxine.
4L'infestation de l'arachide par C. serratus pose cependant le problème des modalités de son passage de ses plantes hôtes sauvages précitées à fructification épigée à une Fabaceae cultivée (arachide) dont la fructification est hypogée. On ignore, par exemple, pourquoi cette bruche ne s'attaque pas à l'arachide dans toutes les zones où elle coexiste avec cette légumineuse cultivée (Gagnepain et al., 1986 ; Delobel et al., 1991). Par ailleurs, des études sur le comportement de ponte de C. serratus (Robert, 1984 ; Ali-Diallo, 1991) mettant en relief le rôle du substrat de développement larvaire et d'autres portant sur l'analyse morphométrique (Sembène et al., 1996), ont amené divers auteurs (Ali-Diallo, 1991 ; Ndiaye, 1991 ; Delobel, 1995) à penser qu'il existe un certain degré d'isolement entre populations inféodées à des hôtes spécifiques (races hôtes).
5Une lutte écologique contre ce ravageur, respectueuse de la santé des consommateurs et de l'environnement, reposant sur des alternatives à la voie chimique (dangereuse et couteuse), ne peut se développer sans la connaissance du statut des populations responsables de l'infestation primaire de l'arachide. La question est donc de déterminer la structure génétique des populations inféodées à chacune des plantes hôtes afin de quantifier les flux géniques et le degré d'isolement entre populations « sauvages » et populations liées à l'arachide.
6Dans un précédent article (Sembène et al., 1998), nous avons discuté de la richesse allélique, du polymorphisme enzymatique et de la diversité génétique de C. serratus. Nous présentons ici les résultats d'une analyse de la différenciation génétique par électrophorèse enzymatique de populations sénégalaises de C. serratus liées à cinq plantes hôtes. Les comparaisons portent d'une part sur des populations allopatriques (mais issues du même hôte) et d'autre part, sur des populations sympatriques issues d'hôtes différents.
2. Matériel et méthodes
2.1. Échantillons de C. serratus
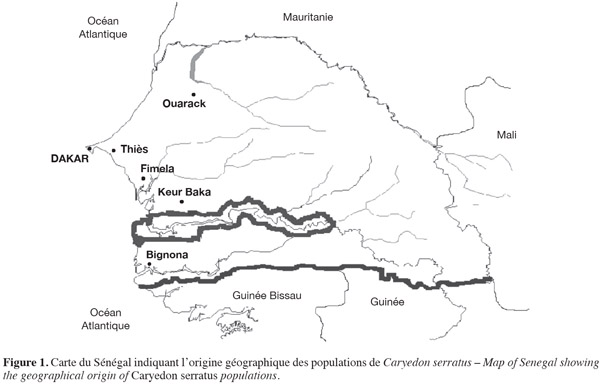
7Les spécimens de C. serratus étudiés proviennent de gousses récoltées sur différentes espèces de plantes hôtes, entre 2005 et 2007, pendant la saison sèche (de décembre à mai), période où les populations de bruches sont les plus abondantes. Les échantillons ont été stratifiés selon deux critères, à savoir : l'espèce hôte et l'origine géographique. Les plantes échantillonnées sont B. rufescens, C. sieberiana, P. reticulatum, T. indica et A. hypogaea. Les gousses sont ramenées et gardées au laboratoire dans des sacs en plastique à température ambiante (35 ± 2 °C) et une hygrométrie de 75 ± 5 % pendant au moins deux mois. Pour chaque plante hôte naturelle, les cocons formés à l'extérieur sont isolés dans des boites de Petri. Ceci permet d'éviter l'émergence des adultes dans les sacs qui engendrerait une seconde génération. Les insectes récoltés dès leur émergence sont gardés dans l'alcool 100. Les échantillons d'arachide sont prélevés au champ durant le séchage ou pendant le stockage dans les greniers. Les échantillons sont obtenus de quatre principaux sites (Ouarack, Thiès, Fimela, Keur Baka) du Sénégal (Figure 1). Un échantillon de bruches inféodées à C. sieberiana est obtenu de Bignona dans la région de Casamance. Dans certaines localités (Thiès et Fimela), deux échantillons d'une même plante sont récoltés. Chaque échantillon est codé en utilisant la première lettre du nom de la plante hôte et les deux premières lettres du nom de la localité où il a été récolté. Par exemple, Bou est obtenu des gousses de B. rufescens récoltées à Ouarack ; Cfi des gousses de C. sieberiana récoltées à Fimela. Le terme « population » est utilisé pour des C. serratus obtenues d'une plante hôte donnée. Tous les spécimens utilisés dans nos expériences sont identifiés par Alex Delobel, Museum d'Histoire Naturelle de Paris (MHNP). Des spécimens (et leurs pièces génitales) provenant de chacune des plantes hôtes sont conservés au Laboratoire de Zoologie des Invertébrés Terrestres à l'Institut Fondamental d'Afrique Noire (I.F.A.N.) Cheikh Anta DIOP de Dakar et au MHNP. Au total, 26 échantillons ont été analysés, chacun comptant 40 individus, soit un total de 1 040 individus.
2.2. Étude électrophorétique
8Extraction. Chaque bruche est broyée vivante dans 100 μl de tampon constitué de Tris (0,1 M), de L-cystéine (0,04 M) et de Triton à 10 %. Le pH est ajusté à 7,4. Les broyats récupérés dans des tubes Eppendorf sont ensuite centrifugés. L'extrait utilisé est récupéré entre le surnageant (lipidique) et le dépôt (solide) avec une seringue et sert à imbiber un papier Whatman de 15 mm de long et 6 mm de large. Les papiers imbibés sont immédiatement utilisés pour les électrophorèses.
9Migration et révélation. La migration est effectuée dans un gel d'amidon (12 %) de 1 cm d'épaisseur sur 17 x 17 cm à pH = 7,3. La préparation des gels d'amidon et les techniques de migration utilisées dans cette étude sont décrites par Pasteur et al. (1987). Le tampon de gel est composé de Tris (0,02 M) et d'acide maléique (0,01 M). Le tampon de migration (pH = 7,3) comporte du Tris (0,1 M) et de l'acide maléique (0,1 M). La migration, induite par un potentiel constant de 120 volts, dure 15 h. Les solutions de révélation spécifiques des différents systèmes enzymatiques sont préparées selon le protocole de Lebrun et al. (1990). Pour stopper l'activité enzymatique, la solution de révélation est remplacée par de l'acide acétique à 7 % pendant 1 h environ. Les gels sont ensuite placés pendant 12 h au réfrigérateur dans une solution de glycérol à 15 % puis séchés à 60 °C pendant 4 h. Douze systèmes enzymatiques sont testés : 6-Phosphogluconate-déshydrogénase (PGD), Glucose-phosphate-isomérase (PGI), Phosphoglucomutase (PGM), Hexokinase (HK), Malate-déshydrogénase (MDH), Leucine-amino-peptidase (LAP), Glutamate-oxaloacétate-transaminase (GOT), Isocitrate-déshydrogénase (ICD), Estérases (EST), Alcool-deshydrogénase (ADH), Diaphorase (DIA), Endopeptidase (ENDO).
2.3. Analyses des données
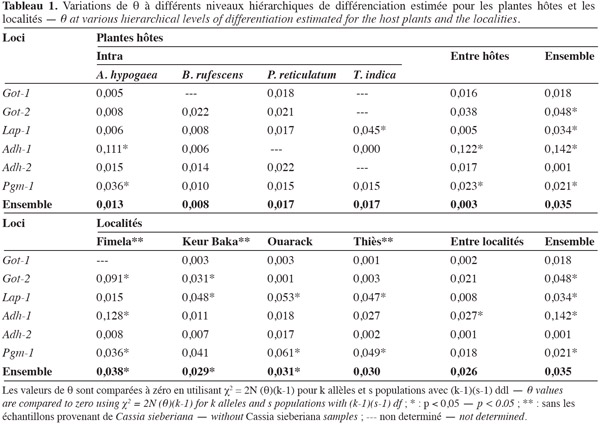
10La lecture des zymogrammes permet d'établir les génotypes de chaque individu. Ces données sont traitées à l'aide de trois logiciels : Biosys-1 V 1.7 (Swofford et al., 1981) pour déterminer les fréquences alléliques et construire un dendrogramme à partir des distances génétiques de Rogers (1972) ; Genepop V 1.2 (Raymond et al., 1994) pour tester la déviation des échantillons par rapport à l'équilibre de Hardy-Weinberg ; Fstat V 1.2 pour évaluer la différenciation génétique des populations. L'estimateur θ de Weir et al. (1984) des F-statistiques (Wright, 1978) est utilisé afin de tenir compte du biais introduit par la taille des échantillons par rapport à l'effectif total. θ (degré de différenciation génétique entre populations) correspond au Fst de Wright. Ces analyses ont été faites selon deux critères : la plante hôte et l'origine géographique. La différence des valeurs de θ et f par rapport à 0 est testée par χ2 = 2N (θ)(k-1) pour k allèles et s populations avec (k-1)(s-1)df.
11Les données sont ensuite utilisées pour la construction d'arbres phylogénétiques en utilisant l'algorithme du Neighbor-joining (Saitou et al., 1987) et la méthode UPGMA basée sur les distances de Rogers (1972). La robustesse de la topologie des arbres a été établie par rééchantillonnage (bootstrapping) en effectuant 2 000 tirages qui ont porté sur les individus et les loci. La distance génétique de Nei a été utilisée pour quantifier les distances génétiques entre les différentes souches. Le flux génique entre l'arachide et chacune des plantes hôtes « sauvages » est calculé à partir de la relation Fst = 1/(4Nm +1) où Nm est le nombre effectif de migrants par génération (Wright, 1931).
3. Résultats
12La description de la migration des systèmes enzymatiques et les fréquences alléliques des 26 échantillons sont données dans Sembène et al. (1998). En tenant compte de tous les loci, l'ensemble des échantillons obtenus de B. rufescens, C. sieberiana et T. indica sont en équilibre de Hardy-Weinberg (p > 0,05), tandis que ceux provenant de P. reticulatum et de l'arachide sont en déséquilibre panmictique (p < 0,05). Pour l'ensemble des loci et des échantillons, la probabilité d'écart à la panmixie est hautement significative (χ2 = 622,3 ; p < 0,001).
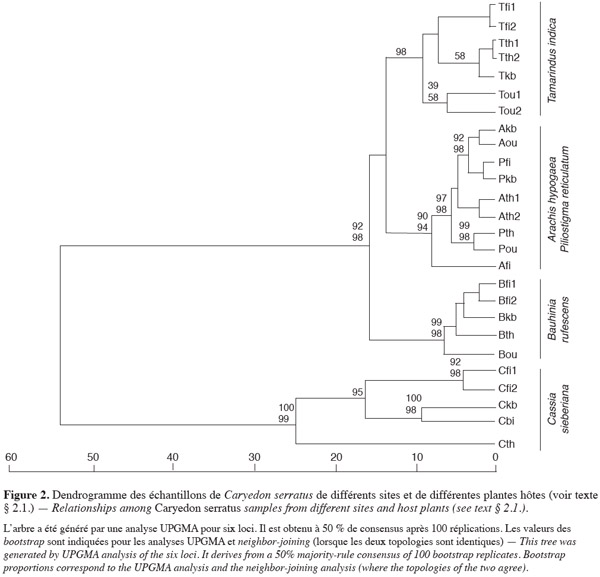
13La valeur de θ (0,235) des 20 échantillons révèle que 23,5 % de la variabilité totale est due à une différenciation génétique entre échantillons. La population C. sieberiana se différencie de toutes les autres et est responsable de 85,1 % de la différenciation génétique totale. La structuration génétique intra- et inter-plantes hôtes et intra- et inter-localités (Tableau 1) est alors analysée en excluant les bruches inféodées à C. sieberiana. θ est alors réduit à 0,035. La différenciation génétique intra-hôte n'est pas significative, les C. serratus inféodés à une même plante hôte sont génétiquement très homogènes entre elles. Afi diffère cependant des autres échantillons provenant de l'arachide, bien que la divergence génétique à l'intérieur de l'arachide soit statistiquement nulle (Tableau 1). Par contre 74,2 % de la divergence génétique totale est due à une variance entre plante hôte (θ inter-hôte = 0,026) ; Got-2, Adh-1 et Pgm-1 sont les loci les plus discriminants. La part de la variance génétique entre localités (θ = 0,003) dans la différenciation génétique des échantillons n'est pas significative (Tableau 1). La divergence génétique à l'intérieur d'une localité est par contre voisine de celle obtenue entre plantes hôtes. Les distances géographiques entre échantillons ne sont pas déterminantes en ce qui concerne les ressemblances ou les différences génétiques. Aucun isolement par la distance n'est observé sur les échantillons (p < 0,01). Par contre, le rôle de la plante hôte est essentiel dans le déterminisme génétique des populations. Le dendrogramme (Figure 2) montre que la structuration génétique est liée au fait que la bruche de l'arachide se développe sur plusieurs plantes hôtes. Les échantillons provenant de C. sieberiana sont largement séparés de tous les autres et sont portés par une forte valeur de bootstrap. La distance génétique de Nei entre C. sieberiana et les échantillons génétiquement les plus proches est de 0,5. Les populations de C. serratus inféodées à B. rufescens se distinguent comme un groupe homogène et sont portées par une forte valeur de bootstrap (99). Les populations inféodées à T. indica sont distinctes de celles inféodées à l'arachide et à P. reticulatum. Elles sont portées par une forte valeur de bootstrap (Figure 2).
14Le flux génique est élevé entre arachide et P. reticulatum (Nm = 250). Il est moins important entre T. indica et l'arachide (11) et entre B. rufescens et l'arachide (6). Il est statistiquement nul entre C. sieberiana et arachide (0,2).
4. Discussion
15Pour comprendre la structure des communautés biologiques observées aujourd'hui, il est nécessaire d'en retracer l'histoire, afin de séparer les composantes historiques (au sens d'une échelle de temps évolutive) des composantes écologiques récentes. Les méthodes d'analyses comparatives, de plus en plus performantes, permettent ainsi de discriminer la part relative des contraintes phylogénétiques ou environnementales dans la distribution d'un caractère (ou d'une stratégie) au sein d'un groupe d'espèces pour lequel on dispose d'une phylogénie robuste. En effet, du fait de leur apparentement, les individus d'une même clade ne constituent pas des échantillons indépendants au sens statistique du terme. Par conséquent, toute comparaison de caractères biologiques ou écologiques ne pourra se faire avec rigueur que si l'on peut apprécier le degré d'interdépendance entre les données. Une solution est de reconstruire la phylogénie de la population étudiée pour apprécier les relations d'apparentement des espèces étudiées. Le cas C. serratus / plantes hôtes semble être l'un des exemples les plus pertinents du phénomène de différenciation sympatrique chez les insectes phytophages (Sembène et al., 1998).
16Rappelons que dans cette étude, la population est considérée comme étant un ensemble d'individus se reproduisant sur une même plante dans une même localité. La souche est définie comme un ensemble d'individus issus d'une même plante hôte, quelle que soit la localité. Le concept de races hôtes (biotypes) n'est évoqué qu'après analyses des données et leur discussion par rapport à la problématique générale de l'évolution des insectes phytophages.
4.1. Équilibre panmictique
17Une déviation significative par rapport à l'équilibre panmictique est observée chez P. reticulatum et chez l'arachide. Ceci s'explique par le fait que les infestations proviennent d'un nombre réduit de femelles. En effet, sur P. reticulatum, la dynamique des populations de C. serratus est dominée par l'alternance d'une période assez courte (de novembre à février) où les gousses mûres sont abondantes sur l'hôte et d'une longue période (mars à octobre) où celles-ci deviennent de plus en plus rares, puis apparemment absentes. Lorsque les premières gousses atteignent la maturité, en novembre, les populations de C. serratus sont généralement très faibles. Les taux d'infestation relevés sur P. reticulatum en novembre sont d'environ 2 à 4 œufs pour 1 000 gousses. En échantillonnant les premières sorties de bruches, on obtient des populations qui consisteraient donc en un mélange des F1 d'un nombre limité de fondatrices. Le même constat peut être fait sur l'arachide nouvellement récoltée, les taux d'infestation initiaux sont de l'ordre de 1 œuf pour 10 000 graines (Matokot et al., 1987 ; Sembène, 1997). Les populations inféodées à B. rufescens sont au contraire en équilibre panmictique. Cet arbuste fructifie toute l'année. Les taux d'infestation ne présentent pas de fluctuations de même ampleur que celles observées sur Piliostigma. La persistance des gousses de B. rufescens durant toute l'année est une situation favorable à la panmixie. T. indica est dans une situation intermédiaire. Le tamarinier présente en effet une période de fructification maximale en mars-avril. Cependant, compte tenu d'une forte variabilité inter-arbres, il est possible de trouver dans une région donnée quelques gousses mûres tout au long de l'année (Ndiaye, 1991). De plus, les fruits du tamarinier, constituant une source habituelle de préparation de certains aliments et boissons au Sénégal, peuvent constituer un habitat de développement favorable au maintien de la bruche de l'arachide jusqu'à la maturation des nouvelles gousses. Cette situation favoriserait la panmixie.
18En considérant l'ensemble des échantillons, le test de χ2 révèle, pour l'ensemble des loci, une importante déviation par rapport à l'équilibre de Hardy-Weinberg (χ2 = 251,4 ; ddl = 152). Ces populations ne semblent donc pas constituer un « ensemble génétique uniforme » ; les croisements entre elles ne se passeraient pas au hasard (effet Wahlund). Ainsi, tout laisse à penser qu'elles sont génétiquement bien différenciées.
4.2. Structure des populations
19La valeur de θ = 0,235 révèle qu'environ 23,5 % de la variabilité génétique de C. serratus est due à une différenciation inter-échantillon. Cette valeur est du même ordre de grandeur que des valeurs de Fst interprétées comme caractéristiques d'une forte différenciation génétique chez d'autres coléoptères comme Oreina cacaliae Schrank avec un Fst = 0,234 (Rowell-Rahier, 1992) ; Coccinella septempunctata L. avec un Fst = 0,290 (Krafsur et al., 1992).
20La population C. sieberiana se différencie nettement de toutes les autres. L'isolement allozymique de ces bruches pourrait s'expliquer soit par un début de différenciation sympatrique qui pourrait s'accentuer par une reproduction préférentiellement homogamique, soit par l'existence sur C. sieberiana d'une espèce jumelle de C. serratus. Les bruches inféodées à cette espèce hôte ne présentent pourtant aucune différence anatomique comparées à celles provenant de l'arachide, de B. rufescens, de Piliostigma ou de T. indica. La comparaison morphologique à tous les stades de développement et l'étude des capacités d'hybridation des deux populations sont donc nécessaires pour confirmer les différentes hypothèses.
21Hormis l'isolement des bruches inféodées à C. sieberiana, il est clair que la différenciation génétique obtenue entre les différentes souches s'explique par un effet structurant de la plante hôte. Les flux géniques entre plantes hôtes identiques semblent se faire de manière homogène à l'intérieur du Sénégal en l'absence de barrière géographique ou climatique. Au vu de ces résultats, il est évident que la polyphagie supposée de C. serratus est mise en doute. La bruche de l'arachide serait en fait constituée au Sénégal de plusieurs populations spécialistes (biotypes), chacune d'elles étant inféodée à une plante ou à un groupe de plantes hôtes mais l'isolement entre elles n'est que partiel.
22Les bruches inféodées à B. rufescens se distinguent nettement des autres. Cette différenciation du groupe Bauhinia pourrait s'expliquer par le fait que B. rufescens est un arbuste qui fructifie toute l'année, situation qui favorise la persistance de l'habitat et du support de développement, facteurs essentiels à la formation et au maintien de races hôtes chez les insectes phytophages. Dans le même ordre d'idée, les accouplements préférentiels sont favorisés et l'effectif efficace conservé, même si on observe des goulots d'étranglement durant la saison des pluies où le taux de mortalité des œufs est très élevé et où le nombre d'adultes diminue de façon drastique (Pierre et al., 1990).
23Les bruches inféodées à T. indica forment aussi un biotype. L'existence de gousses chez certains écotypes durant toute l'année et la persistance de graines résiduelles de T. indica sont favorables au maintien de la bruche de l'arachide sur cet hôte jusqu'à la maturation des nouvelles gousses. Quelques individus « épars » peuvent aller infester de l'arachide stockée ou les premières gousses de P. reticulatum qui mûrissent. Ces bruches sont beaucoup plus sujettes à des migrations vers l'arachide ou P. reticulatum que le biotype infestant B. rufescens (Pierre et al., 1990).
24Les bruches inféodées à P. reticulatum et celles obtenues des gousses d'arachide en séchage sont quant à elles allozymiquement indissociables. Les flux géniques entre elles sont très importants. Les deux populations présentent d'ailleurs des ressemblances morphométriques (Sembène et al., 1996).
4.3. Formation de races hôtes
25Toute différenciation génétique observée chez un insecte phytophage s'accompagne nécessairement, en l'absence de barrières extrinsèques aux flux de gènes, de la mise en place d'un isolement reproductif pré- ou post-zygotique. Or, il n'y a que de rares exemples d'apparition, au sein de populations sympatriques, d'un isolement reproductif lié à la nature de la plante hôte (Mitter et al., 1979). Les conditions d'une telle spéciation seraient peu probables selon Futuyma et al. (1980). Les hypothèses de ces derniers sont combattues par de nombreux auteurs pour lesquels il y a au moins autant de variabilité génétique liée au choix de l'hôte chez des populations sympatriques qu'entre populations allopatriques nettement isolées. Les accouplements devraient cependant se faire de préférence avec des partenaires provenant de la même plante hôte (Bush et al., 1982). Dans le cas de la bruche de l'arachide, l'accouplement entre partenaires consanguins chez les hôtes sauvages est favorisé par « effet de proximité ». En effet, l'indéhiscence de la plupart des gousses des plantes hôtes de C. serratus empêche la dispersion des graines de chacune d'elles ; une souche peut alors maintenir ses cycles de développement sur les gousses accrochées ou sur celles tombées sous la canopée d'un arbre donné. Les larves de quatrième stade tombent généralement au sol pour la nymphose. Les adultes qui émergent des cocons, sur cette même surface réduite, n'ont certainement pas besoin de se déplacer loin pour trouver un partenaire sexuel. Ceci favorise les accouplements entre partenaires consanguins et le dépôt des œufs par la femelle sur l'espèce dont elle est issue. D'ailleurs sur les plans théoriques et expérimentaux, les travaux de laboratoire menés au cours des 40 dernières années ont montré qu'un isolement reproductif peut apparaitre entre des populations encore reliées par des flux de gènes, à condition que la sélection favorisant les individus adaptés à chacun des hôtes soit forte comparativement à ces flux (Rice et al., 1993). L'idée générale actuelle est que l'isolement reproductif pré-zygotique va, dans ce cas, se développer du fait de corrélations fortuites (pléiotropie/entrainement génétique ou « auto-stop génique ») entre les caractères qui seront sélectionnés dans l'environnement de chacun des hôtes, mais qui n'entrainent pas d'isolement reproductif, et d'autres caractères responsables de l'isolement reproductif (Miyatake et al., 1999). Les travaux de Rice et al. (1993) indiquent aussi qu'un phénomène de spéciation peut se produire sans qu'il y ait allopatrie. D'autre part, comme le soulignent Bernays et al. (1994), la tendance à la spécialisation dans l'exploitation des plantes hôtes a été l'un des principaux facteurs à l'origine de la diversification des insectes phytophages. Comme exemple d'un tel phénomène, on citera le cas du nymphalide Euphydrias editha (Boisduval) qui s'est adapté à Plantago lanceolata (L.) introduit par les éleveurs en Amérique du Nord (Singer et al., 1988), de la punaise Jadera haematomola (Herrich-Schaeffer) qui a ajouté à son spectre d'hôtes des graines de Sapindacae ornementales introduites (Carroll et al., 1992), de Rhogoletis pomonella (Walsh) qui, en Amérique du Nord, est passé de l'aubépine au pommier (Bush, 1994 ; Feder et al., 1994 ; Bush et al., 1998).
4.4. Infestation de l'arachide
26Les reconstructions phylogénétiques permettent aujourd'hui de proposer des scenarii quant à l'évolution des préférences alimentaires chez certains groupes. Chez la bruche de l'arachide, la ressemblance morphologique (Sembène et al., 1996) et allozymique des bruches inféodées à P. reticulatum et de celles infestant l'arachide, de même que l'importance des flux géniques calculés entre ces deux souches, permettent d'affirmer aujourd'hui que les C. serratus inféodées à P. reticulatum ont été à l'origine de l'infestation de l'arachide au début du siècle, par allotrophie. Cette population s'est, sans doute, étendue comme une tache d'huile pour infester les récoltes d'arachide dans une grande partie de l'Afrique occidentale. L'absence de gousses sauvages durant la période pluvieuse (sauf chez B. rufescens) et l'introduction de l'arachide dans l'environnement de plantes sauvages ont favorisé le passage des populations inféodées à P. reticulatum sur l'arachide. On peut dire qu'actuellement, les adultes de C. serratus qui émergent à la fin de la saison sèche (période où il y a encore quelques gousses sur les arbres) des rares gousses de P. reticulatum en décomposition sur le sol, sont responsables de l'infestation initiale des nouvelles récoltes. En effet, ces bruches trouvent pendant la saison des pluies de quoi s'alimenter (pollen, nectar). Ceci confirme les résultats de travaux de laboratoire ayant mis en évidence qu'en présence de nourriture adéquate (pollen, eau), des possibilités de survie d'une durée moyenne de 80 à 90 jours ont été observées (Delobel, 1989 ; Sembène, 1997). Ceci permet d'envisager des longévités dans la nature dépassant très largement trois mois.
5. Conclusion
27Au vu de l'ensemble de ces résultats, il est évident que la polyphagie supposée de Caryedon serratus est mise en doute. La bruche de l'arachide serait constituée de plusieurs races hôtes. Il en existe plusieurs au Sénégal, chacun d'elles étant inféodées à une plante ou un groupe de plantes hôtes ; l'isolement entre elles n'est que partiel.
28En dehors des mécanismes théoriques d'isolement génétique dont nous venons de discuter, il est nécessaire de mettre en évidence d'autres facteurs favorisant la formation et le maintien de races hôtes chez la bruche C. serratus : choix du site de la ponte et la fécondité des femelles ; l'interfécondité des différentes souches et la survie des larves ; la reconnaissance et la fidélité à l'hôte, la capacité migratoire. Ceci permettrait sans doute de mieux comprendre le mécanisme évolutif qui a induit les C. serratus inféodées à Piliostigma à s'adapter au Sénégal, sans doute après de multiples tentatives avortées. L'apparition de nouveaux centres d'infestation de l'arachide (Afrique centrale, Inde, etc.) éloignés du foyer originel (Sénégal) nous amène cependant à nous demander si la population de C. serratus qui attaque cette denrée d'une grande importance économique, est génétiquement la même partout dans le monde.
29Remerciements
30Ce travail a été rendu possible grâce au soutien financier de l'Institut de Recherche pour le Développement (DSF-IRD) et de la Fondation internationale pour la Science (IFS).
31Les auteurs remercient aussi A. Cœur-d'Acier, Ingénieur à l'INRA, pour ses relectures combien instructives de cet article.
Bibliographie
Ali-Diallo B., 1991. Biologie de Caryedon serratus (Ol.) en présence de ses plantes-hôtes sur le terrain et en conditions expérimentales. Thèse : Université de Niamey (Niger).
Bernays E.A. & Chapman R.F., 1994. Host-plant selection by phytophagous insects. New York, USA: Edition Chapman & Hall.
Bush G.L., 1994. Sympatric speciation in animals: new wine in old bottles. Trends Ecol. Evol., 9, 285-288.
Bush G.L. & Diehl S.R., 1982. Host shifts, genetic models of sympatric speciation and the origin of parasitic insect species. In: Visser J.H. & Minks A.K., eds. Proceedings of the 5th International Symposium Insect-Plant Relationships, 1-4 March 1982, Wageningen, The Netherlands. Wageningen, The Netherlands: Centre for Agricultural Publication and Documentation.
Bush G.L. & Smith J.S., 1998. The genetics and ecology of sympatric speciation. Res. Popul. Ecol., 40(2), 175-187.
Carroll S.P. & Boyd C., 1992. Host race radiation in the soapberry bug: natural history with the history. Evolution, 46(4), 1052-1069.
Delobel A., 1989. Uscana caryedoni (Hym.: Trichogrammatidae) : possibilités d'utilisation en lutte biologique contre la bruche de l'arachide, Caryedon serratus (Col.: Bruchidae). Entomophaga, 34, 351-363.
Delobel A., 1995. The shift of Caryedon serratus Ol. from wild Caesalpiniaceae to groundnuts took place in West Africa (Coleoptera: Bruchidae). J. Stored Prod. Res., 31, 101-102.
Delobel A. & Matokot L., 1991. Control of stored groundnut insect pests in African subsistence farming. In: Fleurat-Lessard F. & Ducom P., eds. Proceedings of the 5th International Working Conference on Stored-Product Protection, 9-14 September 1990, Bordeaux, France. Bordeaux, France : Imprimerie du Médoc, 1599-1607.
Feder J.L. et al., 1994. Host fidelity is an effective premating barrier between sympatric races of the apple maggot fly. Proc. Natl. Acad. Sci. U.S.A., 91, 7990-7994.
Futuyma D.J. & Mayer G.C.,1980. Non-allopatric speciation in animals. Syst. Zool., 29, 254-271.
Gagnepain C., Gillon Y. & Leroux J.M., 1986. Caryedon serratus (Col. Bruchidae), principal insecte consommateur des gousses de Piliostigma thonningii (Caesalpiniaceae) en savane de Lamto (Côte d'Ivoire). Ann. Soc. Entomol. Fr., 22(4), 457-467.
Krafsur E.S., Obrycki J.J. & Flanders R.V., 1992. Gene flow in populations of the Seven-Spotted Lady Beetle, Coccinella septempunctata. Heredity, 83, 440-444.
Lebrun P. & Chevallier M.H., 1990. Starch and polyacrilamide gel electrophoresis of Hevea : brasiliensis a laboratory manual. Montpellier, France : CIRAD-IRCA.
Matokot L., Mapangou-Divassa S. & Delobel A., 1987. Évolution des populations de Caryedon serratus (Ol.) dans les stocks d'arachide au Congo. Agric. Trop., 42, 69-74.
Mitter C. & Futuyma D.J., 1979. Population genetic consequences of feeding habits in some forest Lepidoptera. Genetics, 92, 1005-1021.
Miyatake T. & Shimizu T., 1999. Genetic correlations between life-history and behavioral traits can cause reproductive isolation. Evolution, 53(1), 201-208.
Ndiaye S., 1991. La bruche de l'arachide dans un agrosystème du centre-ouest du Sénégal : contribution à l'étude de la contamination en plein champ et dans les stocks de l'arachide (Arachis hypogaea L.) par Caryedon serratus (Ol.) (Coleoptera-Bruchidae) ; rôle des légumineuses hôtes sauvages dans le cycle de cette bruche. Thèse : Université de Pau et des Pays de l'Adour (France).
Pasteur N. et al., 1987. Manuel technique de génétique par électrophorèse des protéines. Paris : Lavoisier Tech et Doc.
Pierre D. & Huignard J., 1990. The biological cycle of Caryedon serratus Boh (Coleoptera, Bruchidae) on one of its host plants Bauhinia rufescens Lam. (Caesalpinioideae) in a Sahelian zone. Acta Oecol., 11, 93-101.
Raymond M. & Rousset F., 1995. Genepop (V. 1.2): a population genetics software for exact tests ecumenicism. J. Hered., 86, 248-249.
Rice W.R. & Hostert E.E., 1993. Laboratory experiments on speciation: what have we learned in 40 years? Evolution, 47(6), 1637-1653.
Robert P., 1984. Contribution à l'étude de l'écologie de la bruche de l'arachide : Caryedon serratus Ol. (Coléoptère, Bruchidae), sur ses différentes plantes-hôtes. Thèse : Université François Rabelais de Tours (France).
Rogers J.S., 1972. Measures of genetic similarity and genetic distance. In: Studies in Genetics. VII. Austin, TX, USA: University of Texas Publication 7213, 145-153.
Roubaud E., 1916. Les insectes et la dégénérescence des arachides au Sénégal. Mém. Comité Etud. Hist. Sci. Afr. Occident. Fr., 1, 363-438.
Rowell-Rahier M., 1992. Genetic structure of leaf-beetles populations: microgeographic and sexual differentiation in Oreina cacaliae and O. speciosissima. Entomol. Exp. Appl., 65, 247-257.
Saitou N. & Nei M., 1987. The neighbor-joining method: a new method for reconstructing phylogenetic trees. Mol. Biol. Evol., 4, 406-425.
Sembène M., 1997. Modalités d'infestation de l'arachide par la bruche Caryedon serratus (Olivier) en zone soudano-sahélienne : identification morphométrique et génétique de populations sauvages et adaptées. Thèse 3e cycle : Université Cheikh Anta Diop, Dakar (Sénégal).
Sembène M., 2006. The origin of groundnut infestation by the seed beetle Caryedon serratus (Coleoptera – Bruchidae): results from Cytochrome and ITS1 gene sequences. J. Stored Prod. Res., 42, 97-111.
Sembène M. & Delobel A., 1996. Identification morphométrique de populations soudano-sahéliennes de bruche de l'arachide, Caryedon serratus (Olivier) (Coleoptera Bruchidae). J. Afr. Zool., 110, 357-366.
Sembène M., Brizard J.P. & Delobel A., 1998. Allozyme variation among populations of groundnut seed-beetle Caryedon serratus (Ol.) (Coleoptera : Bruchidae) in Senegal. Insect Sci. Appl., 18, 77-86.
Singer M.C. & Thomas M.D., 1988. Heritability of oviposition preference and its relationship to offspring performance within a single insect population. Evolution, 42, 977-985.
Swofford D.L. & Selander R.B., 1981. Biosys-1, release 1, a computer program for the comprehensive analysis of allelic variation in genetics. Urbana, IL, USA: Department of Genetics and Development, University of Illinois.
Weir B.S. & Cockerham C.C., 1984. Estimating F-statistics for the analysis of population structure. Evolution, 38, 1358-1370.
Wright S., 1931. Evolution in mendelian populations. Genetics, 16, 97-159.
Wright S., 1978. Evolution and the genetics of populations. Vol. 4. Variability within and among natural populations. Chicago, IL, USA: University of Chicago Press.
To cite this article
About: Mbacké Sembène
Faculté des Sciences et techniques. Département de Biologie animale. B.P. 5005. SN-Dakar (Sénégal).
About: Khadim Kébé
Faculté des Sciences et techniques. Département de Biologie animale. B.P. 5005. SN-Dakar (Sénégal). E-mail : khadim.kebe@ird.fr
About: Alex Delobel
247 avenue Paul-Langevin. F-92260 Fontenay-aux-Roses (France).






