- Accueil
- volume 16 (2012)
- numéro 2
- Sauvetage d'embryons chez les légumineuses alimentaires en général et dans le genre Phaseolus en particulier (synthèse bibliographique)
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Sauvetage d'embryons chez les légumineuses alimentaires en général et dans le genre Phaseolus en particulier (synthèse bibliographique)

Notes de la rédaction
Reçu le 13 mai 2011, accepté le 15 février 2012
Résumé
L'amélioration génétique de Phaseolus vulgaris L. par hybridation interspécifique avec les espèces Phaseolus coccineus L. et Phaseolus polyanthus Greenm., utilisées comme parents femelles, donne souvent lieu à des avortements d'embryons au stade de développement globulaire. La culture in vitro des embryons aux stades cordiforme âgé ou cotylédonaire aboutit à des plantes hybrides, mais avec des pourcentages de réussite très faibles. Différents travaux de culture in vitro réalisés chez des génotypes autofécondés de Phaseolus et à partir d'embryons aux stades globulaire ou cordiforme jeune ont permis de régénérer des plantules. Cependant, les problèmes d'enracinement et l'arrêt de croissance limitent le nombre de plantules en croissance. L'analyse des résultats de sauvetage d'embryons obtenus lors des hybridations interspécifiques chez d'autres légumineuses alimentaires, appartenant aux genres Lupinus, Cajanus, Cicer, Lens et Trifolium, a permis d'identifier des solutions qui peuvent aider à résoudre les problèmes d'incompatibilité rencontrés chez Phaseolus.
Abstract
A review of embryos rescue in food legumes in general and in the genus Phaseolus in particular. Genetic improvement of Phaseolus vulgaris L. by interspecific hybridization with Phaseolus coccineus L. and Phaseolus polyanthus Greenm., used as female parents, often gives rise to embryo abortion at globular developmental stage. In vitro culture of embryos at cotyledonary and torpedo shaped stages, leads to hybrid plants, but with very low percentages of success. Several investigations of in vitro culture in selfed genotypes of Phaseolus and from embryos at globular or young heart shaped stages have allowed to regenerate some young plantlets. However, problems of rooting and stopping of growth restrict the number of developing plantlets. Analysis of the results achieved from interspecific embryo rescue in others food legumes of the genus Lupinus, Cajanus, Cicer, Lens and Trifolium, helped to identify some solutions to resolve incompatibility problems in Phaseolus.
Table des matières
1. Introduction
1Phaseolus vulgaris L. (haricot commun) est une légumineuse alimentaire originaire d'Amérique centrale et du Sud (Chacón et al., 2005). Elle est économiquement la plus importante des cinq espèces cultivées de Phaseolus. En effet, elle représente plus de 90 % de la production mondiale de haricots (Singh, 1992). Avec 22 % de protéines dans ses graines, elle contribue à l'équilibre alimentaire dans des régions d'altitude des pays du Sud (Broughton et al., 2003). De plus, cette légumineuse constitue une source primordiale de revenus pour les petits exploitants en Afrique subsaharienne, par exemple au Malawi où elle a rapporté en 2005 un quart de l'ensemble des revenus des ménages (PABRA, 2007). Cependant, son rendement moyen en 2008 était plus bas en Afrique (avec 0,61 t·ha-1) qu'en Amérique du Nord et dans l'Union européenne (2 t·ha-1 et 1,7 t·ha-1, respectivement) (Faostat, 2005). Les maladies auxquelles P. vulgaris est très sensible sont responsables en grande partie des faibles productions observées chez cette légumineuse. L'exploration du pool génique secondaire de P. vulgaris révèle chez Phaseolus coccineus L. et Phaseolus polyanthus Greenm. des caractères agronomiques intéressants, d'autant plus utiles pour l'amélioration du haricot commun qu'ils sont rares ou inexistants au sein du pool génique primaire (Hillocks et al., 2006 ; Miklas et al., 2006). Malheureusement, l'amélioration de P. vulgaris par hybridation interspécifique avec les deux espèces donneuses, utilisées comme parents femelles (♀), se solde souvent par des avortements très précoces des embryons hybrides, particulièrement au stade de développement globulaire. Ces avortements résultent de la mise en place des barrières post-zygotiques qui entravent l'alimentation normale de l'embryon (Lecomte et al., 1998 ; Geerts et al., 2002 ; Baudoin et al., 2004).
2La culture in vitro est utilisée comme alternative pour produire des hybrides interspécifiques. Mais leur régénération n'est possible qu'avec des embryons qui ont dépassé le stade cordiforme jeune et souvent avec de faibles taux de réussite (Lecomte, 1997).
3Pourtant, de meilleurs taux de réussites d'hybridations interspécifiques avec recours à l'embryoculture ont été rapportés grâce à des techniques performantes lors des croisements réalisés chez de nombreuses légumineuses alimentaires appartenant aux genres Cicer, Cajanus, Lupinus, Lens et Trifolium. L'analyse des résultats des travaux d'embryoculture réalisés lors de ces croisements nous permettrait d'identifier des solutions possibles pour contourner les obstacles rencontrés chez Phaseolus.
4Notre étude commence par une synthèse des résultats de différents travaux d'embryoculture réalisés dans les croisements interspécifiques au sein du complexe P. vulgaris – P. polyanthus – P. coccineus. L'absence de production d'hybrides interspécifiques avec recours au sauvetage d'embryons globulaires nous a conduit à analyser les résultats des principaux travaux d'embryoculture réalisés avec les trois espèces autofécondées du complexe cité ci-dessus. Tenant compte des problèmes d'enracinement et de l'arrêt de croissance des embryons germés rapportés durant la culture des embryons de Phaseolus et particulièrement des embryons globulaires, nous avons analysé les résultats les plus pertinents obtenus durant l'embryoculture chez les légumineuses alimentaires appartenant aux genres Cicer, Cajanus, Lupinus, Lens et Trifolium, afin d'identifier leurs potentialités chez Phaseolus.
2. Hybridations interspécifiques avec recours à l'embryoculture chez Phaseolus
5Lors des travaux d'amélioration génétique du haricot commun, les hybrides interspécifiques sont exploités pour introduire des gènes utiles naturellement absents ou faiblement exprimés au sein du pool génique primaire de P. vulgaris. Cette introgression est possible chez la légumineuse si les deux espèces donneuses P. polyanthus ou P. coccineus sont utilisées en tant que parents femelles. Cependant, ce sens de croisement aboutit à un avortement précoce de l'embryon qui intervient dans 60 % des cas au stade de développement globulaire (Lecomte, 1997). Malheureusement, aucun hybride n'a pu être obtenu en ayant recours à la culture d'embryons globulaires. Les hybrides interspécifiques régénérés proviennent d'embryons isolés de l'ovule aux stades plus avancés, c'est-à-dire aux stades cordiforme âgé ou cotylédonaire. Les résultats obtenus lors de nombreux travaux d'embryoculture (Nassar, 1978 ; Mok et al., 1978 ; Alvarez et al., 1981 ; Shii et al., 1982 ; Prendota, 1984 ; Camarena et al., 1987 ; etc.) réalisés au cours des hybridations interspécifiques dans le genre Phaseolus ont été synthétisés par Lecomte (1997) et Geerts et al. (1999). Les pourcentages de régénération relevés dans la littérature oscillent entre 0 et 27 % selon les croisements (Lecomte, 1997).
3. Embryoculture chez les espèces pures du genre Phaseolus
3.1. Culture d'embryons au stade cordiforme jeune
6Les recherches dans le domaine de l'embryoculture sont réalisées chez les espèces pures dans le but de mettre au point un protocole de culture d'embryons au stade globulaire. Malheureusement, à ce stade très précoce, l'extraction des embryons de l'ovule provoque la perte du suspenseur qui s'est révélé indispensable au développement in vitro chez les embryons cordiformes jeunes (Geerts et al., 1999).
7Les recherches effectuées au cours des travaux d'embryoculture réalisés à l'Université de Liège - Gembloux Agro-Bio Tech ont permis de mettre au point et/ou d'utiliser différents milieux de culture d'embryons isolés de l'ovule au stade cordiforme jeune. Les compositions chimiques des principaux milieux mis au point à ce jour sont reprises dans le tableau 1. Selon les étapes de culture, on distingue : les milieux de maturation et germination nommés milieu G1 de Mergeai et al. (1997) ou P1 de Geerts et al. (1999), le milieu de déshydratation G6 de Hu et al. (1995) et deux milieux G7 de Mergeai et al. (1997) modifiés par Geerts et al. (1999) et Geerts (2001), le milieu G7g d'induction de racines et le milieu G7c d'enracinement ou de production de plantules.
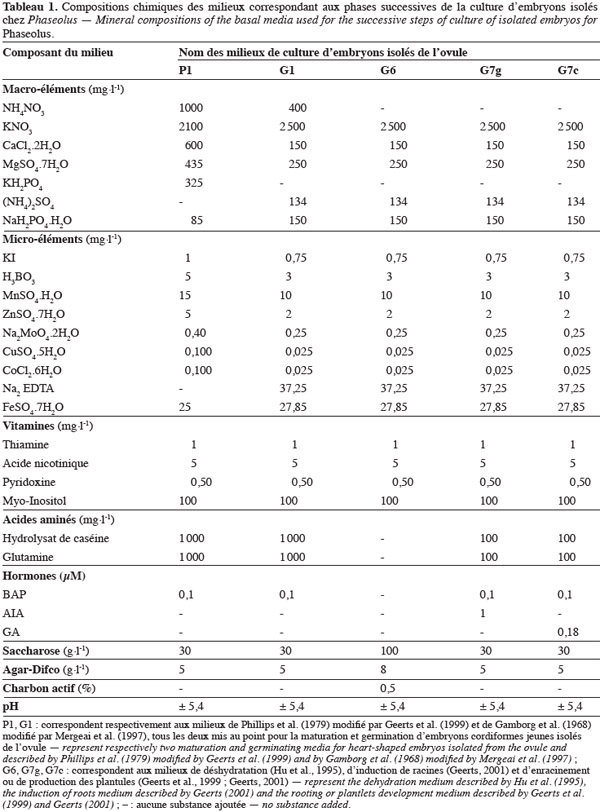
8Un embryon cordiforme jeune (Figure 1A) est en maturation lorsqu'il augmente de volume et développe un méristème apical caulinaire entre les deux cotylédons (Figure 1B). Par contre, il est en germination lorsqu'il produit des primordia foliaires à partir du méristème apical caulinaire avec une élongation de la radicule (Figure 1C). Les plantules sont produites si les explants présentent au moins une feuille trifoliolée et plusieurs racines secondaires.
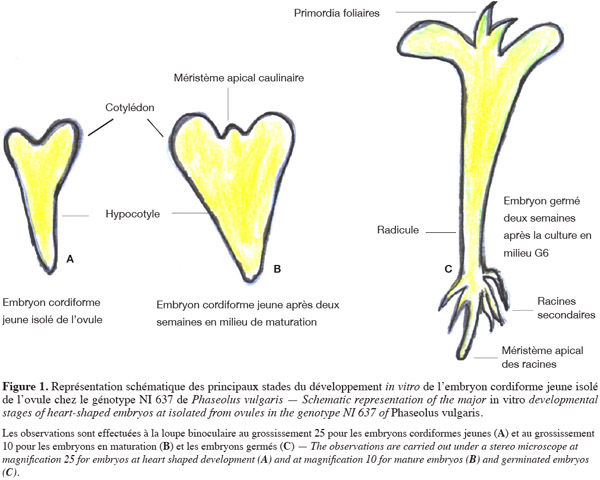
9Mergeai et al. (1997) ont commencé par mettre au point les deux milieux de culture G1 et G7 pour la culture d'embryons cordiformes jeunes isolés de l'ovule chez la variété 'Bico de Ouro' de P. vulgaris (NI 637). Ces milieux ont favorisé, d'une part, la maturation des embryons cordiformes jeunes isolés de l'ovule (milieu G1) et, d'autre part, le développement des embryons germés en plantules (milieu G7). Durant ces mêmes travaux, ces deux milieux ont été appliqués avec succès pour la maturation et la production de plantules à partir des embryons cordiformes jeunes isolés de l'ovule chez d'autres génotypes autofécondés de P. vulgaris et de P. polyanthus. Le premier milieu G1 est préparé à partir des sels minéraux du milieu B5 de Gamborg et al. (1968) enrichi en NH4NO3 (400 mg·l-1) et en glutamine ainsi qu'en hydrolysat de caséine (HC) (1 g·l-1 chacun). Le second milieu nommé G7 de Mergeai et al. (1997) permet l'enracinement et la production des plantules. Il se distingue du milieu G1 par l'absence d'un complément de NH4NO3 aux sels B5 et par une concentration 10 fois moindre en glutamine et hydrolysat de caséine (soit 100 g·l-1 chacun). Par la suite, des modifications chimiques de ces deux milieux ont été recommandées par Lecomte (1997), Geerts et al. (1999) et Geerts (2001). Concernant le milieu G1, Lecomte (1997) propose l'addition du magnésium et du calcium dans la mesure où le milieu G1 ainsi modifié favorise la survie et la maturation des embryons isolés de l'ovule au stade globulaire. Tenant compte des modifications proposées par Lecomte (1997), un milieu P1 est recommandé pour la maturation et la germination des embryons cordiformes jeunes de Phaseolus (Geerts et al., 1999). En effet, ce milieu P1 contient les sels de Phillips et al. (1979) plus riches en calcium et magnésium que les sels de G1. Comparativement au milieu G1, une croissance équilibrée des cotylédons et une amélioration de la germination des embryons cordiformes jeunes ont été obtenues avec le milieu P1 chez P. vulgaris et P. polyanthus (Geerts et al., 1999). L'efficacité de ce milieu P1 a également été rapportée au sein d'un autre laboratoire, lors de la culture des embryons cordiformes jeunes isolés de l'ovule chez le cultivar 'ICA Pijao' de P. vulgaris et chez deux génotypes (PI535272 et PI535272) de Phaseolus angustissimus A.Gray (Schryer et al., 2005). Dans le but d'empêcher la germination précoce des embryons cordiformes jeunes chez ces deux dernières espèces, Schryer et al. (2005) recommandent l'addition de 1,9 µM d'ABA (acide abscissique) dans le milieu P1, tandis que la moitié (0,095 µM) de cette substance a été recommandée chez NI 637 de P. vulgaris (Lecomte, 1997). Cependant, la germination proprement dite n'est possible qu'après transfert des embryons matures dans un milieu sans ABA (Lecomte, 1997 ; Schryer et al., 2005). Malgré cela, le développement de ces derniers dépend de la présence d'un suspenseur intact (Geerts et al., 1999). En effet, le suspenseur sert non seulement à fixer l'embryon dans l'ovule, mais il représente en plus un lieu de synthèse et de transport d'hormones, comme les auxines, qui jouent un rôle considérable durant les premières étapes de l'embryogenèse comme la mise en place de la polarité de l'embryon (Friml et al., 2003 ; Umehara et al., 2007 ; Kawashima et al., 2010). Contrairement à l'ABA, l'addition de 0,1 µM de BAP (N6-benzylaminopurine) dans le milieu G1 de maturation et de germination entraine la formation de cals et/ou l'hyperhydricité des embryons en culture chez P. vulgaris (NI 637) (Lecomte, 1997). Selon ces auteurs, il convient donc de retirer la BAP du milieu G1 de maturation et germination afin d'obtenir un développement satisfaisant des embryons cordiformes jeunes isolés de l'ovule. Ce même auteur a aussi recommandé le retrait de cette hormone du milieu G7 d'enracinement ou de production de plantules de Mergeai et al. (1997), du fait qu'elle entraine dans la majorité des cas un arrêt de développement des plantules. Par ailleurs, l'addition de 0,18 µM de GA (acide gibbérellique) dans le milieu G7 (contenant 0,1 µM de BAP) donne un milieu G7c qui améliore significativement l'enracinement et le développement des embryons germés en plantules (Geerts et al., 1999). Or, dans les travaux plus récents réalisés dans un autre laboratoire, Schryer et al. (2005) ont pu produire dans certains cas des plantules à partir de la culture d'embryons cordiformes jeunes isolés avec l'ajout de la BAP (0,25 µM) dans un milieu de « germination ». Dans d'autres cas, ces auteurs ont obtenu des plantules peu enracinées. L'insuffisance de l'enracinement de ces dernières a été résolue par Schryer et al. (2005) après le microgreffage in vitro de P. vulgaris sur l'espèce P. angustissimus, comme nous l'avons illustré en figure 2.
10L'introduction d'un milieu G6 de « déshydratation » (Hu et al., 1995) entre l'étape de maturation et germination et l'étape de production de plantules, favorise significativement la germination et le développement des embryons germés en plantules (Geerts et al., 1999).
11L'introduction d'un milieu G7g d'induction de racines entre G6 de « déshydratation » et G7c de production de plantules a permis de résoudre les difficultés d'enracinement des plantules. Ce nouveau milieu G7g se distingue du milieu G7 par l'addition de 1 µM d'AIA (acide 3-indole-acétique) (Geerts, 2001). Le milieu G7c se distingue quant à lui de G7 par l'addition de 0,18 µM de GA (Geerts et al., 1999), comme déjà signalé plus haut.
3.2. Sauvetage d'embryons globulaires
12Culture en milieu à composition variable. Ce système de culture encore nommé culture en double couche a été mis au point pour la première fois lors de la culture des embryons très précoces (mesurant 50 µm de longueur) chez Capsella bursa pastoris (L.) Medik. (Monnier, 1976). Il consiste à cultiver des embryons globulaires sur un milieu dont la composition varie au cours du temps pour rencontrer en permanence leurs besoins osmotiques et nutritifs. Ce type de culture est réalisé avec un dispositif dans lequel un ou deux milieux de composition chimique différente sont imbriqués. On assiste ainsi à une diffusion des composants minéraux et/ou organiques du milieu le plus riche vers le milieu le plus pauvre. Ce mode de culture permet sans transfert ni manipulation risqués la poursuite du développement des embryons globulaires ou plus jeunes (les proembryons). Appliqué à P. vulgaris et en utilisant deux milieux de maturation et germination G1 modifiés, il a permis le développement des embryons du stade globulaire jusqu'au stade cotylédonaire (Lecomte, 1997). Toutefois, un développement embryonnaire satisfaisant n'est obtenu que si la couche supérieure est dépourvue d'hormones (Lecomte, 1997)
13Culture d'ovules. Des travaux préliminaires réalisés chez le génotype NI 637 de P. vulgaris ont montré que la culture d'embryons globulaires via la culture d'ovules, provenant des gousses récoltées 4 jours après pollinisation (JAP), dans un milieu G1 de maturation et germination enrichi en saccharose, aboutit après environ 40 jours de culture à la germination in ovulo. Cependant, le taux de germination obtenu reste très faible (8 %) (Dherte1, communication personnelle). De plus, le transfert des embryons germés dans le milieu G7 de Mergeai et al. (1997) n'a pas permis d'obtenir de plantules. D'après l'auteur de cette étude, l'échec dans la production des plantules serait lié à l'absence de formation de racines, comme rapporté dans certains cas, lors de la culture d'embryons cordiformes jeunes isolés de l'ovule (Mergeai et al., 1997 ; Lecomte, 1997).
14Culture de gousses. Une réduction progressive de la pression osmotique durant les 10 premiers jours de l'embryogenèse, dans les gousses de P. vulgaris et P. polyanthus, a permis de mettre au point une technique de culture de gousses pour la culture des embryons globulaires (Geerts et al., 2000 ; Geerts, 2001). Cette technique consiste à réaliser la culture de jeunes gousses pendant une semaine successivement sur trois milieux à osmolarité décroissante, nommés milieu P00 à 580 mosm, milieu P01 à 450 mosm et milieu P01 à 350 mosm, dont les compositions chimiques sont reprises dans le tableau 2. Ce procédé permet le développement à l'intérieur des gousses des proembryons ou embryons globulaires jusqu'au stade cotylédonaire (Geerts et al., 2000 ; Geerts, 2001). En effet, le pourcentage d'embryons en croissance est plus élevé lorsque la culture de gousses est successivement réalisée sur les trois milieux à pression osmotique décroissante précités, comparativement à la culture dans un milieu à composition unique, milieu P01 à 350 mosm. Or, ce dernier mode de culture de gousses en milieu unique P01 à 350 mosm est recommandé au sein d'un autre laboratoire par Schryer et al. (2005). Ces derniers auteurs ont en effet observé à l'extraction des embryons nécrosés durant la culture de gousses âgées de 2 JAP chez un cultivar ('ICA Pijao') de P. vulgaris et chez deux génotypes (PI535272 et PI535272) de P. angustissimus, lorsque la culture est réalisée dans les trois milieux à pression osmotique décroissante précités. Le milieu unique (P01 à 350 mosm) a, par contre, favorisé le développement des proembryons jusqu'au stade cordiforme jeune (Schryer et al., 2005).
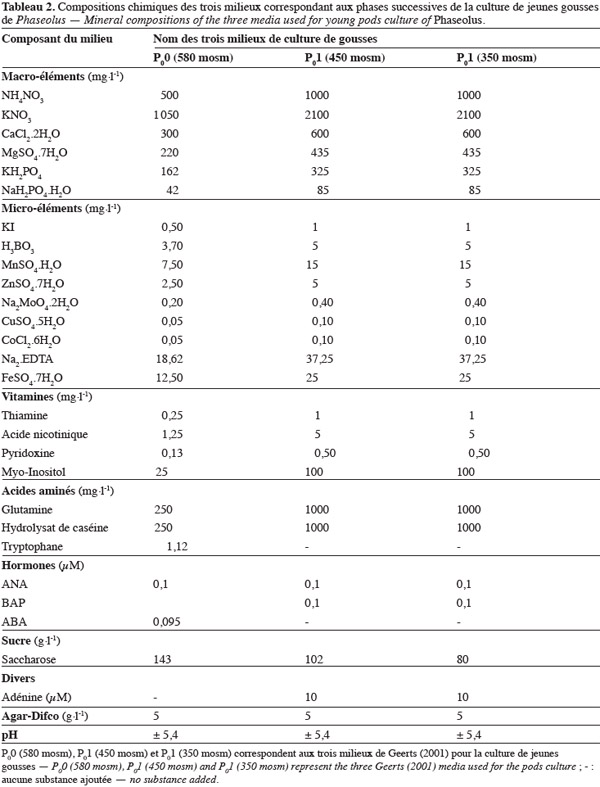
15La culture préalable de gousses (Geerts, 2001) suivie de la culture d'embryons isolés de l'ovule successivement dans les milieux G1 (ou P1), G6, G7g et G7c (Tableau 1) a permis pour la première fois d'obtenir des plantules à partir de la culture d'embryons globulaires chez un génotype (NI 637) de P. vulgaris. Malheureusement, l'absence de formation des racines et l'arrêt de développement des embryons germés ont limité à un pourcentage de 2,8 % le taux de plantules régénérées (Geerts et al., 2000 ; Geerts, 2001). Schryer et al. (2005) qui ont aussi réalisé la culture préalable de gousses (dans un milieu unique) suivie de la culture d'embryons isolés de l'ovule successivement dans deux milieux de Phillips et al. (1979) modifiés ont obtenu une amélioration du taux de plantules enracinées et en conséquence du taux de plantules régénérées. En effet, ces auteurs ont obtenu un pourcentage de 12,5 % de régénération chez le cultivar 'ICA Pijao' de P. vulgaris en associant à l'embryoculture le microgreffage in vitro (Gulati et al., 2001) des plantules peu enracinées de P. vulgaris sur le porte-greffe P. angustissimus (Figure 2).
4. Utilisation de l'embryoculture au cours des hybridations interspécifiques chez différentes légumineuses alimentaires
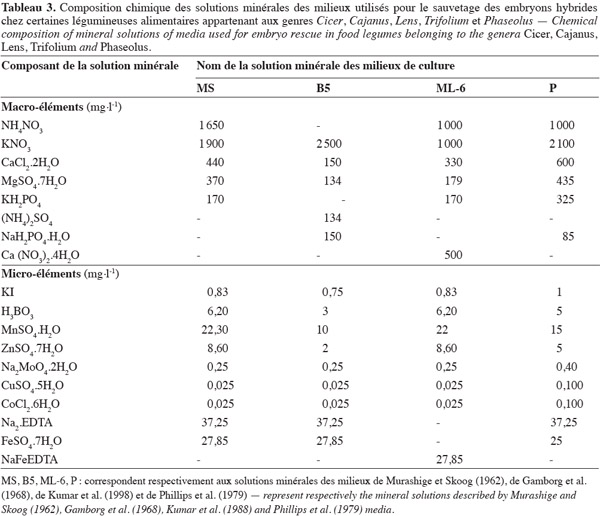
16Les milieux utilisés pour la culture in vitro des embryons sont mis au point généralement à partir des solutions minérales des milieux de références comme les milieux MS de Murashige et Skoog (1962), B5 de Gamborg et al. (1968), ML-6 de Kumar et al. (1988) et P de Phillips et al. (1979). Leur composition minérale est rapportée dans le tableau 3.
4.1. Utilisation de l'embryoculture dans le genre Lens
17Cohen et al. (1984) furent les premiers à produire des plantes hybrides au sein du genre Lens grâce à la culture préalable d'ovules lors des croisements entre la lentille cultivée, Lens culinaris Medik. (♀) et les lentilles sauvages, comme Lens nigricans M.Bieb. ssp. ervoides (Brign.) Lad. ou Lens nigricans M.Bieb. ssp. nigricans Godr. La technique d'embryoculture utilisée a consisté à la culture d'ovules suivie de la culture d'embryons isolés, respectivement, dans deux milieux différents par leur concentration (décroissante) en saccharose. Au début, les ovules âgés de 14 JAP (renfermant des embryons au stade cordiforme jeune) sont cultivés dans un milieu MS modifié enrichi en saccharose (10 %) jusqu'à la germination. Les embryons germés isolés de l'ovule ont ensuite produit des plantules après leur transfert dans le même milieu MS, mais à teneur réduite en saccharose (3 %). Pour les croisements impliquant les mêmes espèces et dont les ovules plus âgés renferment des embryons au stade cotylédonaire, Fratini et al. (2006) recommandent un milieu unique et à faible teneur en saccharose (1 %) tant pour la culture d'ovules que pour la culture d'embryons germés isolés de l'ovule. En effet, ces auteurs observent l'apparition de cals hyperhydriques au niveau de la zone racinaire lorsque les embryons germés sont transférés dans un milieu contenant 3 % de saccharose, comme dans le protocole de Cohen et al. (1984), alors que ces troubles n'apparaissent pas avec un milieu à 1 % de saccharose. Ces deux travaux révèlent l'importance d'une réduction de la teneur en saccharose dans les milieux de culture d'embryons selon leur stade de développement et aussi dans le milieu d'enracinement ou de production de plantules. Par ailleurs, les résultats des travaux réalisés chez l'espèce cultivée L. culinaris ont montré que les méristèmes axillaires du nœud cotylédonaire des embryons cordiformes germés in ovulo sont actifs dans l'induction et le développement des pousses (Polanco et al., 2001). Ces dernières sont obtenues dans un milieu MS en présence d'un mélange hormonal approprié à chaque cultivar. L'enracinement des pousses adventives obtenues est observé après leur transfert dans un milieu MS enrichi en auxines (AIA), notamment chez le cultivar 'Verdina' dont des pousses avaient été préalablement induites dans un milieu MS renfermant l'ANA. Il est à noter que l'effet favorable de ce traitement préalable des pousses à l'ANA sur l'enracinement des plantules est aussi signalé lors du sauvetage d'embryons hybrides du niébé, Vigna unguiculata (L.) Walp. (Kouadio, 2007).
4.2. Utilisation de l'embryoculture dans le genre Cajanus
18Des hybrides sont obtenus grâce à l'embryoculture dans les croisements entre le pois cajan, Cajanus cajan (L.) Millsp. utilisé comme parent mâle (♂) et une espèce sauvage appartenant à son pool génique secondaire, Cajanus acutifolius (F. Muell.) Maesen (Mallikarjuna et al., 2002) ou à son pool génique tertiaire Cajanus platycarpus (Benth.) Maesen (Mallikarjuna et al., 2006). Le sauvetage des embryons hybrides a été réalisé via la culture d'embryons au stade cotylédonaire et suivant les protocoles de Mallikarjuna et al. (1995) et Mallikarjuna (1998). Ces deux protocoles ont la particularité d'intégrer une étape d'induction ou de multiplication de pousses, afin d'augmenter la probabilité de régénérer des hybrides interspécifiques et de compenser le faible effectif d'embryons hybrides pouvant atteindre les stades cordiforme âgé ou cotylédonaire. Les pousses adventives hybrides C. cajan x C. acutifolius sont enracinées séparément après leur transfert dans un milieu MS contenant un mélange d'auxines (ANA et AIB) (Mallikarjuna, 1998 ; Mallikarjuna et al., 2002). Par contre, l'enracinement des pousses adventives hybrides C. cajan x C. platycarpus est obtenu après leur transfert dans le même milieu d'enracinement MS mais dix fois moins concentré en sels minéraux et en auxines (Mallikarjuna et al., 1995 ; Mallikarjuna et al., 2006).
4.3. Utilisation de l'embryoculture dans le genre Trifolium
19Les hybrides interspécifiques de Trifolium sont obtenus à partir de la culture d'embryons cordiformes jeunes et grâce à une étape d'induction ou de multiplication de pousses similaire à celle réalisée dans le genre Cajanus. Dans ce cas, l'enracinement des plantules hybrides adventives est obtenu après leur transfert dans un milieu à la fois moins riche en sels minéraux et en saccharose (Roy et al., 2004 ; Řepková et al., 2006). Par ailleurs, les travaux d'embryoculture réalisés chez l'espèce autofécondée Trifolium repens L. ont montré que la culture en double couche de Monnier (1976) et la culture d'ovules favorisent le développement des proembryons jusqu'au stade cotylédonaire (Hałdaś et al., 2002), comme rapporté chez Phaseolus (Lecomte, 1997).
4.4. Utilisation de l'embryoculture dans le genre Lupinus
20La production d'hybrides interspécifiques est difficile dans le genre Lupinus (Vuillaume et al., 1986a ; Wilson et al., 2008). Cependant, quelques résultats intéressants obtenus chez cinq espèces (Lupinus albus L., Lupinus mutabilis Sweet, Lupinus luteus L., Lupinus angustifolius L. et Lupinus polyphyllus Lindl.) autofécondées méritent d'être soulignés. Tenant compte des difficultés de prélèvement des embryons aux stades globulaire ou cordiforme jeune, Vuillaume et al. (1986b) ont réalisé la culture d'ovules ou de demi-ovules afin d'obtenir à l'extraction, des embryons plus âgés appropriés à la culture in vitro. Grâce à ces deux techniques, ces auteurs n'ont obtenu une croissance des embryons qu'à partir des explants renfermant des embryons au stade cordiforme jeune chez l'espèce L. albus. Les ovules ont été cultivés sur un support papier filtre formant un pont au-dessus d'un milieu MS liquide en présence d'un mélange des deux hormones ANA et BAP. Par contre, les demi-ovules ont été noyés dans le même milieu MS, mais gélosé avec une faible teneur en agar Difco (5 g·l-1) et en l'absence d'hormones. Ce dernier milieu (sans hormone) s'est aussi révélé favorable aussi bien à la germination qu'au développement en plantules des embryons isolés de l'ovule aux stades cordiforme âgé ou cotylédonaire chez deux espèces autofécondées L. albus et L. mutabilis. Cependant, la survie des plantules obtenues dépend du génotype. Chez L. mutabilis, les plantules régénérées se développent normalement, tandis que chez L. albus, les plantules se mettent rapidement à jaunir et meurent. D'après Vuillaume et al. (1986b), ce jaunissement est attribué à la teneur en calcium du milieu MS. En utilisant un milieu liquide renfermant une teneur en calcium moindre par rapport au milieu MS, le milieu B5 de Gamborg et al. (1968) concentré 1,5 fois, Kasten et al. (1991) ont régénéré des plantes chez les cinq espèces citées ci-dessus. Cependant, le développement des embryons dépendait de l'espèce ou du cultivar en présence. Une meilleure survie des embryons est obtenue avec ce milieu additionné d'ABA, chez les cinq espèces sauf chez les cultivars 'Topaz' de L. luteus et 'Turkus' de L. angustifolius. En effet, le cultivar 'Topaz', par exemple, a survécu dans ce même milieu sans l'addition d'ABA. La technique de culture in vitro de Kasten et al. (1991) consiste à déposer une fine couche de milieu liquide sur un milieu B5 solidifié avec 7 g·l-1 d'agar Difco. En utilisant une autre technique de culture en milieu liquide, la culture sur papier filtre formant un pont au-dessus du milieu liquide et le milieu de Kasten et al. (1991) enrichi en saccharose (90 g·l-1) et en hydrolysat de caséine (0,75 g·l-1), Wilson et al. (2008) ont obtenu chez L. angustifolius des plantules à partir de la culture d'embryons cordiformes jeunes isolés de l'ovule. L'échec dans la création d'hybrides interspécifiques au sein du complexe L. albus – L. mutabilis – L. luteus – L. angustifolius – L. polyphyllus (Vuillaume et al., 1986a ; Wilson et al., 2008) s'explique par l'absence d'embryons à l'extraction. D'après ces auteurs, la fécondation n'aurait pas eu lieu. Cette absence de fécondation serait liée à la différence des formules chromosomiques (2n = 40 pour L. angustifolius, 2n = 52 pour L. luteus ; 2n = 50 pour L. albus et 2n = 48 pour L. mutabilis et L. polyphyllus), ainsi qu'à la distance phylogénétique entre les différentes espèces parentales (Crouch et al.2, 2005 cités par Wilson et al., 2008).
4.5. Utilisation de l'embryoculture dans le genre Cicer
21Les croisements entre certains génotypes de l'espèce cultivée Cicer arietinum L. (♀) et deux génotypes (ICCW 37/38) d'une espèce sauvage Cicer pinnatifidum Jaub. & Spach appartenant à son pool génique tertiaire ont été réussis grâce au recours à l'embryoculture selon le protocole de Mallikarjuna (1999). Ce protocole consiste à réaliser la culture d'ovules (contenant des embryons au stade cotylédonaire) suivie de la culture d'embryons isolés de l'ovule sur un support papier filtre, comme chez Lupinus (Vuillaume et al., 1986b), dans un milieu liquide ML-6 de Kumar et al. (1988) en présence d'un mélange des deux hormones : AIA et ZEA (zéatine). Les plantules régénérées présentant un bon système racinaire sont ensuite acclimatées. Pour atteindre le stade cotylédonaire des embryons requis pour la culture in vitro, Mallikarjuna (1999) applique in situ une solution contenant un mélange de régulateurs de croissance (GA, ANA et KN [kinétine]) sur le pédoncule des fleurs du parent femelle C. arietinum. Cependant, la production des hybrides interspécifiques C. arietinum (♀) x C. pinnatifidum dépend de l'enracinement des plantules régénérées in vitro. D'après cet auteur, l'enracinement des plantules varie suivant le génotype du parent femelle C. arietinum. Dans le but d'améliorer l'effectif des hybrides, Mallikarjuna et al. (2007) et Mallikarjuna et al. (2008) ont eu recours à une étape d'enracinement supplémentaire par rapport au protocole de Mallikarjuna (1999). Cette étape appliquée à des croisements entre C. arietinum et l'espèce sauvage Cicer bijugum K.H.Rech consiste à transférer pendant une courte durée (5 jours) les pousses peu enracinées dans un milieu ML-6 enrichi en AIB (acide indole butyrique) avant de les cultiver dans un milieu ML-6 d'enracinement sans hormone (Mallikarjuna et al., 2007). Pour le croisement entre C. arietinum et C. pinnatifidum, des pousses peu enracinées ont donné des plantules mieux enracinées après le microgreffage in situ (Mallikarjuna et al., 2008). Ce dernier système d'enracinement des pousses in situ est similaire au microgreffage in vitro (Gulati et al., 2001) illustré sur la figure 2. Mais, in situ, ce processus consiste à transférer le greffon issu de la pousse hybride régénérée in vitro sur l'épicotyle du porte-greffe (ou pousse enracinée) obtenu par germination in situ des graines de l'espèce cultivée C. arietinum. Ces deux derniers travaux de Mallikarjuna et al. (2007) et Mallikarjuna et al. (2008) ont révélé l'importance de l'enracinement des pousses dans le succès des hybridations interspécifiques pour optimiser le taux de réussite des hybrides après acclimatation.
22Par ailleurs, les résultats obtenus à partir de la culture des ovules autofécondés (renfermant des embryons cordiformes jeunes) selon le protocole de Mallikarjuna (1999) chez différents génotypes des deux espèces parentales C. arietinum et C. bijugum ont montré qu'une meilleure germination des embryons isolés de l'ovule et leur développement en plantules sont obtenus avec un milieu de culture sans hormone (Clarke et al., 2006). En effet, d'après ces auteurs, ce dernier milieu de culture favorise la germination des embryons isolés de l'ovule, en réduisant la formation de cals, comme cela est rapporté lors de la culture d'embryons isolés de l'ovule chez Lupinus (Vuillaume et al., 1986b).
5. Conclusion et perspectives
23La culture in vitro est généralement utilisée comme alternative pour la production des hybrides interspécifiques. Dans le genre Phaseolus, les résultats obtenus à ce jour montrent que la culture d'embryons isolés de l'ovule est la seule technique qui permet de régénérer, dans certains cas, des hybrides interspécifiques. Cependant, le succès reste limité à des stades de développement cordiforme âgé ou cotylédonaire. Aucun hybride n'a pu être obtenu à partir d'embryons aux stades globulaire ou cordiforme jeune, comme chez les différentes légumineuses alimentaires analysées dans cette étude. Les travaux réalisés chez les espèces pures de Phaseolus ont montré que la culture de gousses (renfermant les embryons globulaires), d'une part, et la culture d'embryons cordiformes jeunes isolés de l'ovule, d'autre part, aboutissent dans certains cas à la régénération de plantes. Dans d'autres cas, l'absence d'enracinement in vitro limite leur développement en plantules.
24Chez les cinq genres dont les travaux d'embryoculture ont été analysés dans cette étude, il apparait que la technique de culture d'ovules constitue la principale voie pour aboutir à la production des hybrides interspécifiques, à condition que les embryons qu'ils renferment aient atteint les stades cordiforme ou cotylédonaire. Ce dernier stade de développement embryonnaire peut être atteint in situ par l'application de régulateurs de croissance à la pollinisation afin de retarder l'avortement précoce des embryons. Ce traitement hormonal in situ permet dans certains cas d'augmenter les chances de régénérer des hybrides interspécifiques en améliorant l'effectif des gousses formées ou d'embryons cotylédonaires requis pour le sauvetage in vitro. Dans d'autres cas, les probabilités d'obtenir les hybrides interspécifiques ont été améliorées grâce à une étape supplémentaire d'embryoculture, comme la micropropagation des pousses. Cette étape de multiplication des pousses est réalisée afin de compenser le faible effectif d'embryons pouvant atteindre le stade cotylédonaire. Ces pousses sont généralement induites à partir des méristèmes axillaires du nœud cotylédonaire. Concernant l'enracinement, celui-ci a lieu dans certains cas, après le transfert des explants dans un milieu pauvre, soit en saccharose ou en sels minéraux, soit pour les deux composantes à la fois. Dans d'autres cas, l'enracinement a lieu après avoir mis en présence au préalable les explants à des auxines plus stables que l'AIA (ANA ou AIB), ceci avant de les transférer dans un milieu d'enracinement avec ou sans hormones. Les plantules enracinées peuvent encore être produites par microgreffage in vitro ou in situ. Les potentialités offertes par l'usage d'un milieu à teneur réduite en saccharose (1 %) sur l'enracinement in vitro et la régénération de plantules hybrides dans le genre Lens peuvent être utilisées chez Phaseolus. Dans ce cas, on devrait tester les concentrations en saccharose inférieures à 3 % dans les milieux G7g d'induction de racines et G7c d'enracinement ou de production de plantules chez Phaseolus. L'effet positif du traitement préalable à l'AIB des pousses adventives hybrides C. arietinum x C. bijugum montre leur efficacité sur l'enracinement in vitro et la régénération des hybrides. Le remplacement de l'AIA par l'AIB ou une autre auxine plus stable que l'AIA, comme l'ANA, dans le milieu d'induction de racines G7g peut conduire à une amélioration de l'enracinement in vitro chez Phaseolus. Le processus du microgreffage in vitro qui a permis d'améliorer l'effectif des plantules enracinées in vitro chez le cultivar 'ICA Pijao' de P. vulgaris, d'une part, et le microgreffage in situ qui a facilité la production des plantules hybrides enracinées dans le genre Cicer, d'autre part, pourraient permettre d'améliorer le taux de régénération des hybrides interspécifiques dans le genre Phaseolus. L'induction des pousses adventives à partir des bourgeons axillaires du nœud cotylédonaire obtenue lors de la régénération de L. culinaris et des hybrides des genres Cajanus et Trifolium peut constituer une alternative intéressante chez Phaseolus : cette technique permettrait de régénérer des plantules par microbouturage de nœuds cotylédonaires isolés des plantules en arrêt de croissance, un obstacle fréquemment observé en culture in vitro des embryons chez ce genre.
Bibliographie
Alvarez H.N., Asher P.D. & Davis W., 1981. Interspecific hybridization in Euphaseolus through embryo rescue. Hortscience, 16, 541-543.
Baudoin J.-P. et al., 2004. Interspecific hybridization with Phaseolus vulgaris L.: embryo development and its genetics. In: Pandalai S.G., ed. Recent research developments in genetics and breeding. Vol. 1, Part II. Kerala, India: Research Signpost, Trivandrum, 349-364.
Broughton W.J. et al., 2003. Beans (Phaseolus spp.) model food legumes. Plant Soil, 252, 55-128.
Camarena M.F. & Baudoin J.-P., 1987. Obtention des premiers hybrides interspécifiques entre Phaseolus vulgaris L. et Phaseolus polyanthus Greenm. avec le cytoplasme de cette dernière forme. Bull. Rech. Agron. Gembloux, 22(1), 43-55.
Chacón M.I., Pickersgill S.B. & Debouck D.G., 2005. Domestication patterns in common bean (Phaseolus vulgaris L.) and the origin of the Mesoamerican and Andean cultivated races. Theor. Appl. Genet., 110(3), 432-444.
Clarke H.J. et al., 2006. Embryo rescue and plant regeneration in vitro of selfed chickpea (Cicer arietinum L.) and its wild annual relatives. Plant Cell Tissue Organ Cult., 85(2), 197-204.
Cohen D., Ladizinsky G., Ziv M. & Muehlbauer F.J., 1984. Rescue of interspecific Lens hybrids by means of embryo culture. Plant Cell Tissue Organ Cult., 3(4), 343-347.
Faostat, 2005. Crops, http://faostat.fao.org/site/567/default.aspx#ancor, (07/04/10).
Fratini R. & Ruiz M.L., 2006. Interspecific hybridization in the genus Lens applying in vitro embryo rescue. Euphytica, 150(1-2), 271-280.
Friml J. et al., 2003. Efflux-dependent auxin gradients establish the apical-basal axis of Arabidopsis. Nature, 426, 147-153.
Gamborg O.L., Miller R.A. & Ojima K., 1968. Nutrient requirements of suspension cultures of soybean root cells. Exp. Cell Res., 50(1), 151-158.
Geerts P., 2001. Study of embryo development in Phaseolus in order to obtain interspecific hybrids. Thèse de doctorat : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Geerts P., Mergeai G. & Baudoin J.-P., 1999. Rescue of early heart-shaped embryos and plant regeneration of Phaseolus polyanthus Greenm. and Phaseolus vulgaris L. Biotechnol. Agron. Soc. Environ., 3(3), 141-148.
Geerts P., Sassi K., Mergeai G. & Baudoin J.-P., 2000. Development of an in vitro pod culture technique for young pods of Phaseolus vulgaris L. In Vitro Cell. Dev. Biol.-Plant, 36(6), 481-487.
Geerts P., Toussaint A., Mergeai G. & Baudoin J.-P., 2002. Study of the early abortion in reciprocal crosses between Phaseolus vulgaris L. and Phaseolus polyanthus Greenm. Biotechnol. Agron. Soc. Environ., 6(2), 109-119.
Gulati A., Schryer A.P. & McHughen A., 2001. Regeneration and micrografting of lentil shoots. In Vitro Cell. Dev. Biol.-Plant, 37(6), 798-802.
Haldas W. & Przywara L., 2002. In vitro culture of immature zygotic embryos of white clover (Trifolium repens L.). Acta Biol. Cracoviensia, 44, 213-222.
Hillocks R.J. et al., 2006. Phaseolus bean improvement in Tanzania, 1959-2005. Euphytica, 150(1-2), 215-231.
Hu C.Y. & Zanettini M.H.B., 1995. Embryo culture and embryo rescue for wide cross hybrids. In: Gamborg O.L. & Phillips G.C., eds. Plant cell, tissue and organ culture: fundamental methods. Heidelberg, Germany: Springer, 129-141.
Kasten W. & Kunert R., 1991. A culture method for isolated immature embryos of different Lupinus species. Biol. Zentralbl., 110(4), 290-300.
Kawashima T. & Goldberg R.B., 2010. The suspensor: not just suspending. Trends Plant Sci., 15(1), 23-30.
Kouadio D., 2007. Étude de la diversité génétique de Vigna unguiculata (L.) Walpers par l'analyse des barrières d'incompatibilité. Thèse de doctorat : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Kumar A.S., Gamborg O.L. & Nabors M.W., 1988. Plant regeneration from cell suspension cultures of Vigna aconitifolia. Plant Cell Rep., 7, 138-141.
Lecomte B., 1997. Étude du développement embryonnaire in vivo et in vitro dans le genre Phaseolus L. Thèse de doctorat : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Lecomte B., Longly B., Crabbe J. & Baudoin J.-P., 1998. Étude comparative du développement de l'ovule chez deux espèces de Phaseolus : P. polyanthus et P. vulgaris. Biotechnol. Agron. Soc. Environ., 2(1), 77-84.
Mallikarjuna N., 1998. Ovule culture to rescue aborting embryos from pigeonpea (Cajanus cajan L. Millspaugh) wide crosses. Indian J. Exp. Biol., 36(2), 225-228.
Mallikarjuna N., 1999. Ovule and embryo culture to obtain hybrids from interspecific incompatible pollinations in chickpea. Euphytica, 110(1), 1-6.
Mallikarjuna N. & Moss J.P., 1995. Production of hybrids between Cajanus platycarpus and Cajanus cajan. Euphytica, 83(1), 43-46.
Mallikarjuna N. & Saxena K.B., 2002. Production of hybrids between Cajanus acutifolius and C. cajan. Euphytica, 124(1), 107-110.
Mallikarjuna N., Jadhav D. & Reddy P., 2006. Introgression of Cajanus platycarpus genome into cultivated pigeonpea, C. cajan. Euphytica, 149(1-2), 161-167.
Mallikarjuna N. et al., 2007. Progress in interspecific hybridization between Cicer arietinum and wild species C. bijugum. J. SAT Agric. Res., 5(1), 1-3.
Mallikarjuna N. & Jadhav D.R., 2008. Techniques to produce hybrid between Cicer arietinum L. x C. pinnatifidum Jaub. Indian J. Genet., 68(4), 398-405.
Mergeai G., Schmit V., Lecomte B. & Baudoin J.-P., 1997. Mise au point d'une technique de culture in vitro d'embryons immatures de Phaseolus. Biotechnol. Agron. Soc. Environ., 1(1), 49-58.
Miklas P.N., Kelly J.D., Beebe S.E. & Blair M.W., 2006. Common bean breeding for resistance against biotic and abiotic stresses: from classical to MAS breeding. Euphytica, 147(1-2), 105-131.
Mok D.W.S., Mok M.C. & Rabakoarihanta A., 1978. lnterspecific hybridization of Phaseolus vulgaris with P. lunatus and P. acutiflolius. Theor. Appl. Genet., 52, 209-215.
Monnier M., 1976. Culture in vitro de l'embryon immature de Capsella Bursa-pastoris Moench. Paris : Museum National d'Histoire Naturelle, Laboratoire de Biologie végétale.
Murashige T. & Skoog F., 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant., 15(3), 473-497.
Nassar M.A.N., 1978. Studies of reciprocal interspecific hybridizations between Phaseolus coccineus L. and Phaseolus vulgaris L. PhD thesis: University of Southampton, Biology Department (England).
PABRA, 2007. Études sur l'impact du haricot : le cas du Malawi. Alliance panafricaine de recherche sur le haricot, 3, 1-4, http://www.pabra.org/pdfs/outlook_dec07_fr.pdf, (04/06/11).
Phillips G.C. & Collins G.B., 1979. In vitro tissue culture of selected legumes and plant regeneration from callus cultures of red clover. Crop Sci., 19, 59-64.
Polanco M.C. & Ruiz M.L., 2001. Factors that affect plant regeneration from in vitro culture of immature seeds in four lentil cultivars. Plant Cell. Tissue Organ Cult., 66(2), 133-139.
Prendota K., 1984. Recherches sur l'utilisation de Phaseolus acutifolius A.Gray pour l'amélioration du haricot commun (Phaseolus vulgaris L.). Thèse de doctorat : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Řepková J., Jungmannova B. & Jakesova H., 2006. Identification of barriers to interspecific crosses in the genus Trifolium. Euphytica, 15(1), 39-48.
Roy A.K. et al., 2004. Interspecific hybridization of Trifolium alexandrinum with T. constantinopolitanum using embryo rescue. Plant Cell Rep., 22(9), 705-710.
Schryer P.A., Lu B.R., Vandenberg A. & Bett K.E., 2005. Rapid regeneration of Phaseolus angustissimus and P. vulgaris from very young zygotic embryos. Plant Cell Tissue Organ Cult., 83(1), 67-74.
Shii C.T., Rabakoarihanta A., Mok M.C. & Mok D.W.S., 1982. Embryo development in reciprocal crosses of Phaseolus vulgaris L. and P. coccineus L. Theor. Appl. Genet., 62(1), 59-64.
Singh S.P., 1992. Common bean improvement in the tropics. Plant Breed. Rev., 10, 199-269.
Umehara M., Ikeda M. & Kamada H., 2007. Endogenous factors that regulate plant embryogenesis: recent advances. Jpn. J. Plant Sci., 1(1), 1-6.
Vuillaume E. & Hoff T., 1986a. Essais d'hybridation interspécifique entre Lupinus albus L. et Lupinus mutabilis Sweet. Influence des conditions de culture et du génotype. Agronomie, 6(10), 919-924.
Vuillaume E. & Hoff T., 1986b. Développement in vitro d'embryons immatures de Lupinus albus L. et de Lupinus mutabilis Sweet par culture de gousses, d'ovules ou d'embryons isolés. Agronomie, 6(10), 925-930.
Wilson J.G., Clements J.C., Quealy J. & Yang H., 2008. Development of an interspecific hybridisation protocol for Lupinus. In: Palta J.A. & Berger J.B., eds. Lupins for health and wealth proceedings of the 12th International Lupin Conference, 14-18 September, 2008, Fremantle, Western Australia. Canterbury, New Zealand: International Lupin Association.
Notes
Pour citer cet article
A propos de : Eugénie Barikissou
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Phytotechnie tropicale et d’Horticulture. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : ebarikissou@yahoo.fr
A propos de : Jean-Pierre Baudoin
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Phytotechnie tropicale et d’Horticulture. Passage des Déportés, 2. B-5030 Gembloux (Belgique).






