- Accueil
- volume 16 (2012)
- numéro 2
- Identité et écologie des espèces forestières commerciales d’Afrique centrale : le cas de Milicia spp. (synthèse bibliographique)
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Identité et écologie des espèces forestières commerciales d’Afrique centrale : le cas de Milicia spp. (synthèse bibliographique)

Notes de la rédaction
Reçu le 23 juin 2011, accepté le 8 décembre 2011
Résumé
Le terme iroko regroupe les deux espèces du genre africain Milicia et désigne le bois qui en est dérivé. Malgré une importance économique reconnue depuis plus de deux siècles et une diminution sensible des densités de population du fait de l'exploitation, les connaissances scientifiques utiles à la gestion durable de l'iroko font défaut, particulièrement en Afrique centrale. L'existence même d'une spéciation au sein du genre Milicia mérite d'être revérifiée : les caractères utilisés pour séparer les deux taxa Milicia excelsa (Welw.) C.C.Berg et Milicia regia (A.Chev.) C.C.Berg sont peu consistants et une révision de ces traits distinctifs permettrait de réétudier le niveau de vulnérabilité des populations de Milicia spp., et donc de revoir les stratégies de gestion de ce groupe taxonomique. M. regia n'a fait l'objet que de rares études écologiques, tandis que M. excelsa, plus largement distribuée, a retenu l'attention scientifique en Afrique de l'Ouest, dans une certaine mesure. Dans tous les cas, les traits d'histoire de vie conditionnant la diversité génétique et le taux de régénération naturelle méritent d'être identifiés ou mieux décrits. En particulier, les connaissances existantes sur les populations reproductrices, les facteurs régulant la floraison, les patrons de fructification et de dispersion des diaspores, ainsi que d'autres caractères qui amènent à décrire l'iroko comme un arbre pionnier (besoins en lumière, dormance des graines) devraient être mieux documentés. Enfin, la dynamique même des populations naturelles de juvéniles devra également être mieux caractérisée. En l'absence de données fines en écologie, la durabilité de nombreuses ressources ligneuses commerciales est tributaire d'actions sylvicoles, lesquelles peuvent être couteuses et ne pas être garanties sur le long terme.
Abstract
Identity and ecology of Central African timber tree species: the case of Milicia spp., a review. Iroko designates the two African tree species Milicia excelsa (Welw.) C.C.Berg and Milicia regia (A.Chev.) C.C.Berg known as highly valuable in the timber trade. Despite its economical importance and a decrease in population densities due to exploitation, there is a significant lack of ecological and sylvicultural knowledge required for a sustainable management of iroko. In West Africa, M. excelsa has received more attention from scientists than M. regia, but several topics clearly need further investigations or outcomes cannot be transferred in the context of Central African rainforests. A first thing to verify is whether speciation really occurred in the genus Milicia: morphological differences between the two species are very low, and a revision in this genus may lead to some rearrangements of conservatory and management policies related to this taxonomic group. Furthermore, (i) patterns related to the reproductive phenology and its controlling factors, (ii) gene flow among and between populations and individuals regarding life history traits, influence of human activities and paleoecological perturbations, and (iii) dynamics of seedling populations are among aspects that require emphasis in order to propose efficient tools for forest managers. Unless scientists provide these crucial data, the abundance of iroko in tropical rainforests will only depend on expensive plantations activities.
Table des matières
1. Introduction
1L'Afrique centrale possède le second plus grand massif continu de forêts denses tropicales (Mayaux et al., 2006). Bien que régressant à raison de 0,16 % par an (Duveiller et al., 2008), ces forêts font partie des écosystèmes tropicaux les mieux préservés (FAO, 2011), mais aussi les plus méconnus en termes de caractérisation de leur biodiversité (Doucet, 2003). Si l'agriculture itinérante sur brûlis et les besoins en énergie domestique constituent aujourd'hui les principales sources de déforestation en Afrique (Damette et al., 2011), l'exploitation forestière, même légale, peut menacer la pérennité de certaines espèces ligneuses (Jennings et al., 2001). En ne ciblant que les tiges bien conformées parmi un nombre très restreint d'espèces commerciales, elle réduit les populations de semenciers, ce qui pourrait affecter à long terme la diversité génétique et les capacités de régénération des espèces concernées. La gestion durable de ces espèces commerciales demande une bonne connaissance de leur autoécologie, des éléments clés de la dynamique de leurs populations et de leur histoire évolutive ayant pu amener à la distribution spatiale, à l'abondance et la structuration de la diversité génétique des populations intraspécifiques. À travers l’exemple de l’iroko, l'un des principaux arbres commerciaux d'Afrique, nous illustrons le niveau insuffisant de connaissances actuelles sur ces espèces en mettant particulièrement en évidence les aspects botaniques, écologiques et génétiques fondamentalement importants pour un aménagement durable intégré ou la conservation de ces ressources (Sheil et al., 2000 ; Szaro et al., 2005).
2L'appellation « iroko » désigne les deux espèces du genre Milicia : Milicia excelsa (Welw.) C.C.Berg et Milicia regia (A.Chev.) C.C.Berg, très semblables sur le plan morphologique (Ofori et al., 2003). Les premières traces écrites de l'utilisation de l'iroko en Europe datent du début du 20e siècle (Mauriès, 1970) : alors dénommé African oak, l'iroko était importé par les Anglais et servait dans la construction navale. L'importation de ce bois ne prit toutefois de l'ampleur en Europe que vers 1913. L'importance du bois d'iroko fut telle que l'arbre fit l'objet très tôt d'études sylvicoles et une monographie lui fut consacrée au cours de la première moitié du 20e siècle (Tondeur, 1939). Très vite, l'iroko s'est toutefois avéré sensible aux rythmes d'exploitation pratiqués dans certains pays, au point qu'une réduction sensible de ses effectifs ait été signalée localement (Hawthorne, 1995 ; Joker, 2002), provoquant l'instauration de mesures particulières d'exploitation ou de commercialisation de ce bois.
3Bien que l'importance économique de l'iroko ait suscité de nombreuses études scientifiques, celles-ci demeurent fragmentaires et n'ont principalement été menées que dans des pays d'Afrique de l'Ouest et de l'Est (Ebert, 2004 ; Ofori, 2007a ; Ofori, 2007b). Outre l'objectif global de proposer une revue bibliographique actualisée des Milicia, le présent document cherche surtout à relever les thématiques méritant davantage d'efforts de recherche dans un souci d'exploitation et d'aménagement durables des populations des deux espèces. Dans la suite du document, le terme « iroko » désigne les deux taxa, tandis que nous préciserons le nom latin d'une des deux espèces si l'information ne se rapporte qu'à elle seule.
2. Distribution géographique et principales caractéristiques de l'arbre
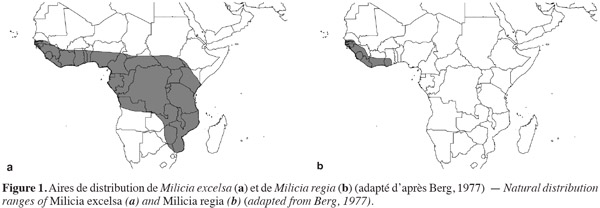
4L'iroko a une large distribution sur le continent africain, allant de la Guinée Bissau à l'Éthiopie et jusqu'en Angola et au Zimbabwe en direction du Sud. Toutefois, l'espèce M. regia, elle, aurait une distribution plus limitée, se confinant du Sénégal au Ghana (Berg, 1977) (Figure 1). L'iroko se rencontre dans les forêts sempervirentes et semi-décidues, voire dans des forêts galeries en savanes (Nichols et al., 1998).
5L'arbre atteint une hauteur maximale de 45 à 50 m pour un diamètre de l'ordre de 2,5 m (Ofori, 2007a). L'écorce a une teinte allant du gris au brun foncé et présente des lenticelles jaunâtres. Le tronc cylindrique et généralement droit est dépourvu de branches sur une hauteur de 15 à 30 m. Il possède parfois de faibles empattements à sa base et exsude abondamment un latex blanc jaunâtre lorsqu'il est entaillé. Chez les arbres adultes, les racines sont souvent superficielles et proéminentes. La cime a une forme étalée, avec des branches obliquement ascendantes. Les feuilles, simples et alternes, sont de forme elliptique à oblongue, mesurant 6 à 20 cm de long pour 4 à 10 cm de large.
6Si les grands traits morphologiques sont identiques entre les deux taxa au point qu'ils aient été et soient encore couramment confondus (Engler, 1894 ; Chevalier, 1912 ; Ofori et al., 2003), certaines caractéristiques végétatives et reproductrices peu faciles à appréhender différeraient significativement entre M. excelsa et M. regia (Berg, 1977 ; Hawthorne et al., 2006).
3. Le débat phylogénétique autour de l'iroko : une ou deux espèces de Milicia ?
3.1. L'origine du débat
7En 1869, Welwitsch décrit l'espèce Morus africana, observée dans les forêts primaires de l'Angola. Quelques années plus tard, l'espèce est successivement transférée dans le genre Maclura Nutt. (Bureau, 1873), puis dans Chlorophora Gaudich par Bentham et al. (1880). Chlorophora comprenait alors deux espèces : l'arbre américain Chlorophora tinctoria (L.) Benth. & Hook. et Chlorophora excelsa (Welw.) Benth. & Hook. Par la suite, plusieurs autres espèces furent incluses dans ce genre : Chlorophora tenuifolia (Engler, 1894), Chlorophora alba et Chlorophora regia (Chevalier, 1912). De ces trois nouvelles descriptions, seule Chlorophora regia a été confirmée par d'autres botanistes comme étant probablement une nouvelle espèce (Rendle, 1916 ; Aubréville, 1959 ; Berg, 1977). À noter que deux autres espèces malgaches (Chlorophora greveana et Chlorophora humbertii) furent aussi ajoutées à la liste des Chlorophora (Léandri, 1948), mais elles furent transférées ultérieurement dans les genres Allaeanthus Thw. (Capuron, 1968) et Broussonetia Vent. (Berg, 1977).
8Le genre Milicia fut proposé pour la première fois par Sim (1909) pour deux espèces : Milicia africana et Milicia spinosa. Rendle (1916) puis Berg (1977) confirmèrent par la suite qu'il s'agissait de Chlorophora. En 1982, Berg publia une analyse critique des genres Maclura, Chlorophora et Milicia. Il y concluait d'une part que le genre Chlorophora pouvait être inclus dans le vaste genre Maclura et d'autre part, que les deux espèces africaines de Chlorophora différaient notablement de Chlorophora tinctoria (américain). L'auteur proposa alors que les Chlorophora africains (C. regia et C. excelsa) soient placés dans le genre Milicia. Les dénominations M. excelsa et M. regia sont actuellement les plus répandues et aucune autre analyse critique des liens phylogénétiques au sein des genres Chlorophora et Milicia n'a plus été menée. À noter que Sim n'ayant jamais fourni ou désigné un lectotype des Milicia qu'il avait décrits, ce nom a pu être approprié par Berg (1982).
9Le débat aurait pu être clos si la différenciation botanique entre les deux Milicia n'avait pas été si faible, générant des confusions parmi des botanistes confirmés (Ofori et al., 2003). Ainsi par exemple, Auguste Chevalier qui avait pourtant bien décrit les deux espèces dans un ouvrage paru en 1912 (Chevalier, 1912), estimait que l'iroko commun dans la forêt gabonaise du Bas-Ogooué correspondrait en majorité au taxon M. regia. Or, seule M. excelsa a été décrite par la suite au Gabon (Berg et al., 1984 ; White et al., 1996 ; Doucet, 2003). Par ailleurs, l'un des spécimens décrits par Chevalier (1912) comme étant C. regia provient du Nord du Bénin, pays qui n'abriterait que M. excelsa (White, 1966). Ofori (2007b) signale aussi que M. regia est présente au Nigéria, mais y aurait été introduite via des provenances de la Sierra Leone. Dans les régions où sont présentes les deux espèces, les forestiers ne font aucune distinction entre elles, leurs bois étant très similaires (White, 1966 ; Ofori, 2007a). La similitude morphologique est telle que si une spéciation du genre s'avérait exacte, elle serait d'origine assez récente et des hybrides existeraient, compliquant la tâche des botanistes (Joker, 2002).
3.2. Quelles différences morpho-botaniques entre les deux espèces ?
10Le tableau 1 résume les caractéristiques botaniques pouvant servir à distinguer les deux espèces. Selon plusieurs auteurs, les caractéristiques foliaires sont les traits les plus utiles pour distinguer les deux taxa (Aubréville, 1959 ; Berg, 1977 ; Nyong'o et al., 1994 ; Hawthorne et al., 2006) : non seulement ces feuilles seraient de formes assez dissemblables pour un œil exercé, mais surtout, elles présenteraient différentes nervations. Le nombre de nervures secondaires chez M. regia n'excèderait pas 11 paires, tandis qu'il varierait de 12 à 22 paires chez M. excelsa. De plus, à l'aide d'une bonne loupe, il serait possible de distinguer des poils courts entre les nervilles de cette dernière, M. regia étant généralement glabre. On notera aussi que la disposition des feuilles chez les juvéniles diffèrerait d'une espèce à l'autre selon Berg (1977) : les feuilles sont placées dans un même espace plan chez M. regia, tandis qu'elles forment une spirale chez M. excelsa. Par ailleurs, M. excelsa présenterait un calice avec un collier dense de poils raides à la base, structure absente chez M. regia. Cette caractéristique est toutefois ardue à vérifier au quotidien, du fait des petites dimensions des organes floraux, mais aussi de par la difficulté à obtenir simplement de tels organes, la floraison étant très éphémère chez l'iroko (Nyong'o et al., 1994).
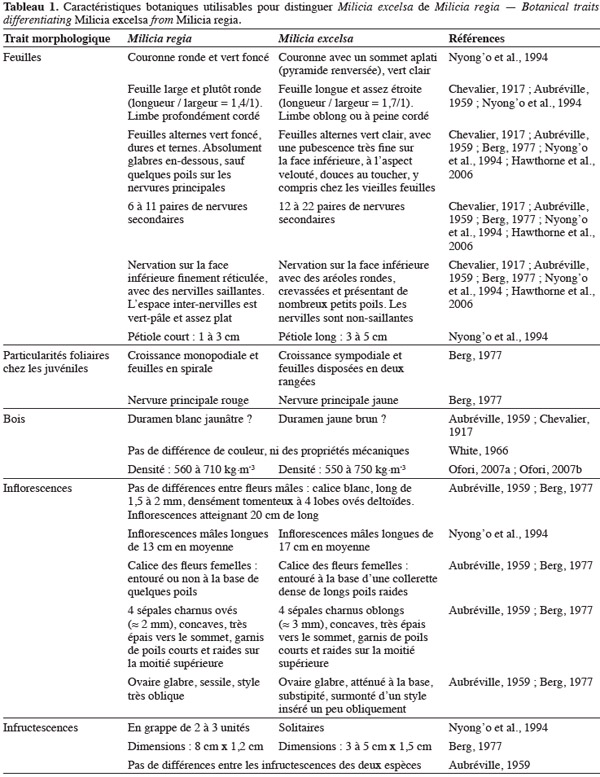
11Certains critères distinctifs seraient critiquables. Ainsi, les dimensions des infructescences ne devraient pas être d'une grande utilité pour distinguer les deux espèces (Aubréville, 1959), en dépit des observations de Berg (1977) à ce sujet. Plusieurs sources rapportent des différences de couleur du duramen chez l'iroko et ces variations avaient été associées soit aux espèces (Chevalier, 1917 ; Aubréville, 1959), soit au sexe des arbres (White, 1966), l'iroko étant dioïque. Selon White (1966) et GERDAT (1973), il n'y aurait pas de corrélation entre d'une part l'espèce, les conditions de l'habitat ou le sexe de l'arbre et d'autre part, la couleur plus ou moins foncée du bois.
12Sur la base de ces observations, on peut légitimement se poser des questions sur la pertinence de ces critères botaniques comme preuves de spéciation. Sur le plan biologique, la spéciation suppose l'existence d'une barrière reproductive (partielle ou totale) entre deux espèces voisines, grâce entre autres à l'incompatibilité de certaines caractéristiques phénologiques, florales ou physiologiques (Koffi, 2010). En dehors de la seule présence de poils autour du calice de M. excelsa (mais cela peut-il être un frein à la pollinisation entre les deux taxa ?), les fleurs et fruits des deux espèces sont fort similaires et elles fleurissent durant la même période (Nyong'o et al., 1994). Les tests d'aptitudes reproductives interspécifiques étant particulièrement ardus à mener chez les arbres, de telles questions peuvent être aujourd'hui résolues à l'aide des marqueurs moléculaires, reconnus comme étant des outils performants de délimitation taxonomique (Duminil et al., 2009).
3.3. Que nous apprennent les études génétiques sur ces deux espèces ?
13À l'heure actuelle, il n'existe que deux études qui aient tenté de distinguer génétiquement les deux espèces et ce, dans une très faible mesure. Ouinsavi et al. (2006) ont été les premiers à développer des marqueurs microsatellites spécifiques aux deux espèces, mais ils ne donnèrent que des valeurs du taux d'hétérozygotie, qui pourrait être un peu plus faible chez M. excelsa que chez M. regia. Ces données ne peuvent servir à caractériser les deux espèces car les différences n'ont pas été statistiquement testées. Par ailleurs, leurs résultats proviennent d'échantillons non représentatifs : 30 individus de M. excelsa et 10 de M. regia issus de deux pays.
14Sur la base d'un seul marqueur microsatellite chloroplastique, Ofori et al. (2003) ont pu mettre en évidence trois haplotypes. Ils ont ensuite proposé une association entre ces haplotypes et les deux espèces. Les associations établies sont critiquables dans la mesure où les individus génotypés n'avaient pas été préalablement identifiés comme appartenant à une espèce précise. En effet, du fait des difficultés de distinction morphologique, l'hypothèse de base de l'étude était que les accessions issues des forêts denses sempervirentes correspondaient à M. regia, tandis que celles prélevées dans les forêts semi-décidues étaient des M. excelsa. De plus, un seul de ces trois haplotypes s'est avéré spécifique d'un type forestier bien précis (les forêts semi-décidues). Ensuite, sur la base de marqueurs de type ISSR (Inter-Simple Sequence Repeat), la même étude a révélé une distance génétique 1,5 fois plus grande entre les populations des deux types forestiers qu'au sein de chaque formation végétale. Mais une fois de plus, cet écart génétique n'a pas été statistiquement testé.
15En somme, ces études ne permettent de tirer aucune conclusion quant au niveau de différenciation des deux taxa. De plus, la question de l'hybridation n'a jamais été abordée, alors qu'elle est fortement suspectée (Nichols et al., 1998 ; Joker, 2002). Or, étudier les liens phylogénétiques entre deux espèces si proches aurait un intérêt certain pour la conservation de l'iroko. En effet, M. regia est considérée comme « vulnérable » par l'IUCN, tandis que M. excelsa est reprise dans la catégorie « presque menacée » (www.redlist.org). S'il s'avérait que les deux taxa sont suffisamment proches au point que leurs hybrides soient fertiles sur le long terme, ce seraient les stratégies de conservation et d'aménagement proposées pour les populations d'iroko d'Afrique de l'Ouest par Ofori et al. (2007) qui devraient être revues.
4. Importance socio-économique de l'iroko
4.1. Le bois d'iroko dans le commerce international
16Le seul matériau faisant l'objet d'un commerce international chez l'iroko est le bois, indistinct entre les deux espèces (Tableau 1 ; White, 1966 ; GERDAT, 1973 ; Hawthorne, 1995).
17À l'état frais, le bois parfait d'iroko est brun-jaune, tandis que l'aubier tend vers une teinte blanchâtre. En vieillissant à l'air libre, le bois de cœur brunit de façon plus ou moins marquée et prend alors un aspect de vieux chêne avec des nuances dorées (Gérard et al., 1998). Il se sèche bien à l'air ou en séchoir ; une fois séché, il bouge peu en service (Ofori, 2007a). Le grain est moyen à grossier avec des traces de vaisseaux très apparentes et creuses. Le bois est mi-lourd et mi-dur, avec une densité moyenne de l'ordre de 0,550 à 0,760 à 15% d'humidité (Gérard et al., 1998). Au point de vue des propriétés mécaniques, on compare souvent l'iroko au chêne, mais il est plus voisin encore du teck (Tondeur, 1939 ; GERDAT, 1973). Le bois est considéré comme non imprégnable (classe d'imprégnabilité 4) et a une bonne résistance vis-à-vis des champignons de pourriture, des termites, des attaques de Lyctus spp. et des térébrants marins (Gérard et al., 1998 ; Ofori, 2007a). C'est un bois durable à très durable qui résiste également bien aux acides et bases (classes de durabilité I et II ; ATIBT, 1986). Il peut ainsi être utilisé sans traitement de préservation dans les emplois où un risque de réhumidification fréquente existe (Gérard et al., 1998) et Sen et al. (2009) précisent qu'il fait partie des bois tropicaux les plus résistants en conditions d'immersion marine permanente (pendant un an).
18Le bois d'iroko est ainsi employé en agencements et menuiseries d'intérieur et d'extérieur, en construction navale (pont et boiserie intérieure des navires) et charpenterie marine, pour les traverses de chemin de fer, les charpentes, les paillasses de laboratoire, l’ébénisterie, la parqueterie, les planches profilées pour la décoration et la charpente (ATIBT, 1986 ; Ofori, 2007a). Il peut être aussi utilisé en placages tranchés, mais rarement en placages déroulés (Ofori, 2007a).
19La production moyenne annuelle de bois d'iroko par les cinq principaux exportateurs d'Afrique centrale (Cameroun, Gabon, R.D. du Congo, République du Congo et République Centrafricaine) a été d'environ 138 000 m³ en 2007 et 2008 (ATIBT, 2010). En fonction de l'année, l'iroko fait partie des trois à six essences les plus exploitées dans quatre de ces pays et les principaux importateurs européens sont : le Royaume-Uni, l'Allemagne, le Portugal, la France, l'Espagne et l'Italie. Globalement, les exportations de grumes et de sciages d'iroko ont sensiblement diminué au cours des dernières décennies (Ofori, 2007a). Afin de réduire la menace de raréfaction à long terme, certains pays producteurs ont pris des mesures censées limiter la production de bois d'iroko :
20– un permis spécial est exigé pour son exploitation au Ghana, en Tanzanie, en Côte d'Ivoire et au Mozambique (WCMC, 1998 ; Ofori, 2007a) ;
21– son exploitation a été récemment interdite officiellement en Ouganda, bien qu'il continue de faire l'objet d'un commerce illégal entre ce pays et le Kenya (Ebert, 2004) ;
22– les bois indigènes, dont l'iroko, sont interdits d'exploitation au Kenya par un décret présidentiel (WCMC, 1998) ;
23– l'État d'Oyo au Nigéria a instauré un moratoire de 10 ans sur l'exploitation de l'iroko (WCMC, 1998).
24Il est à noter aussi que des pays tels que le Ghana, la Tanzanie, la Côte d'Ivoire, le Gabon et le Cameroun interdisent l'exportation des grumes ; seuls les sciages sont autorisés à cette fin (WCMW, 1998 ; Ofori, 2007a).
4.2. Les perceptions locales de l'iroko
25Certaines ethnies d'Afrique de l'Ouest et de l'Est en Côte d'Ivoire, au Togo, au Bénin, au Nigéria et en Ouganda considèrent l'iroko, tout comme le fromager (Ceiba pentandra [L.] Gaertn.), comme un arbre qui abrite des génies ou des sorciers (Mollet et al., 2000 ; Azonkponon, 2001 ; Tabuti, 2007). Ces croyances autour de l'iroko ont contribué à sa conservation dans la mesure où elles engendrent la sacralisation de nombreux arbres (Mollet et al., 2000).
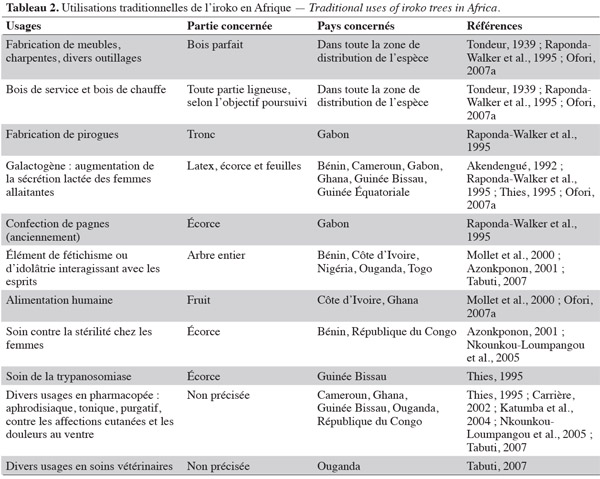
26D'un autre côté, une multitude de remèdes, breuvages et produits d'alimentation sont dérivés de différentes parties de l'arbre (Tableau 2). La fonction galactogène est sans doute la plus citée dans la zone de distribution de l'iroko. Il est à noter aussi que Milicia est fréquemment maintenue dans les champs en général, et dans les cacaoyères en particulier, afin de fournir l'ombrage nécessaire à cette spéculation tout en offrant les autres services mentionnés dans le tableau 2 (Mollet et al., 1995).
27Par ses vertus commerciales, magico-religieuses, médicinales et agronomiques, le savoir rural autour de cet arbre est non négligeable. Ce savoir a été renforcé au cours des dernières décennies par diverses études écologiques et sylvicoles conduites principalement au Ghana et partiellement en Ouganda.
5. Reproduction et régénération de l'iroko
28La gestion efficace d'une espèce commerciale nécessite une connaissance assez fine de l'écologie de ses populations et en particulier de sa niche de régénération. À l'heure actuelle, la plupart de la documentation existante se rapporte à l'autoécologie et à la sylviculture de M. excelsa. M. regia a été très peu étudiée, probablement parce qu'elle est confondue avec M. excelsa et que sa distribution géographique est plus limitée.
29La large distribution de M. excelsa ainsi que sa présence et sa persistance dans une grande variété d'habitats témoignent d'un préférendum écologique relativement large (Nichols et al., 1998). Typiquement, les espèces des stades précoces de la succession ou pionnières, telles que l'iroko (Hawthorne, 1995), présentent des traits d'histoire de vie et des caractéristiques physiologiques qui en font de bons colonisateurs (Ricklefs et al., 2005) :
30– une production abondante de petites graines,
31– lesquelles seraient dispersées à large échelle,
32– elles seraient longévives qui plus est (elles seraient dormantes afin d'être intégrées dans la banque de graines du sol),
33– enfin, la germination donnerait lieu à des plantules se développant vigoureusement afin de limiter les nuisances de la concurrence.
34Les données actuellement disponibles ne permettent de vérifier ces hypothèses que dans une certaine mesure.
5.1. Exigences abiotiques globales
35Bien que présentant des distributions sympatriques, les deux espèces d'iroko semblent avoir des tolérances écologiques assez distinctes. Mais les informations recensées à ce titre sont peu nombreuses et parfois contradictoires. Il est simplement rapporté que les deux espèces vivent aussi bien en forêt qu'en savane, M. regia étant toutefois nettement plus abondante dans les forêts très humides de la bande côtière et M. excelsa préférant les formations moins humides et plus ouvertes de l'intérieur des pays (White, 1966 ; Berg, 1977 ; Hawthorne, 1995). Toutefois, Aubréville (1959) a signalé une forte abondance de M. regia dans les galeries forestières et savanes de la Casamance.
36En dehors de cette distinction maintes fois reprise par d'autres auteurs, les précisions quant à leurs préférences abiotiques n'ont concerné que M. excelsa. Par exemple, une description des deux espèces est fournie par Ofori (2007a) et Ofori (2007b), mais cet auteur ne donne que les exigences environnementales de M. excelsa. Il précise qu'on la trouve normalement à moins de 1 500 m d'altitude (bien qu'elle ait été trouvée à 4 500 m d'altitude sur le mont Kilimandjaro [FAO, 1986]), sous une température moyenne annuelle comprise entre 25 et 35 °C et une pluviométrie de l'ordre de 1 150 à 1 900 mm par an. Mis à part sa rareté sur les sols asphyxiants et inondés, les préférences pédologiques de M. excelsa n'ont été guère étudiées. Tandis que Hawthorne (1995) rapporte que l'espèce n'aurait pas de préférence particulière concernant la richesse du sol, Ofori (2007a) estime qu'elle s'installe davantage sur les sols riches (en potassium et en phosphore) et serait de fait une indicatrice de la fertilité des sols.
5.2. Les besoins en lumière
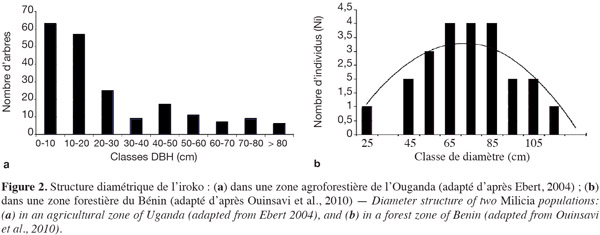
37L'iroko est décrit comme une héliophile stricte, nécessitant un ensoleillement maximal pour sa croissance, quel que soit le stade de développement considéré (Hawthorne, 1995 ; Ofori, 2007a : Ofori, 2007b). Le caractère « héliophile strict » de M. excelsa devrait être toutefois nuancé : Agyeman et al. (1994) rapportent que les meilleurs rythmes de croissance des juvéniles d'iroko s'observent à 42 % de la radiation solaire maximale, durant les quatre premiers mois de vie des plantules. Par ailleurs, la survie des juvéniles de 13 mois d'âge ne serait pas affectée par des taux de radiation solaire compris entre 2 et 37 % (Nichols et al., 1999). On peut ainsi supposer que des plantules d'iroko puissent persister pendant un certain temps dans les sous-bois forestiers peu denses. Néanmoins, le fait que la régénération naturelle semble plus abondante en milieux ouverts que sous canopée (Tondeur, 1939) et que la structure diamétrique soit mieux équilibrée en zones peu fermées (Figure 2) tend à attester d'un besoin important en lumière à un stade donné. La période seuil de sa tolérance à l'ombrage demeure toutefois inconnue à l'heure actuelle.
5.3. La disponibilité des diaspores dans l'espace et dans le temps
38Les perturbations de la voute forestière surviennent de manière imprévisible et la disponibilité des diaspores sur de larges étendues et à tout moment de l'année est une stratégie reproductive typique des espèces pionnières (Dalling et al., 2009). Le seul travail décrivant la phénologie reproductive de l'iroko est celui de Nyong'o et al. (1994), bien que d'autres indices des phénophases puissent provenir de l'analyse des herbiers et descriptions botaniques (Aubréville, 1959 ; Berg, 1977 ; Berg et al., 1984) ou d'observations ponctuelles (Tondeur, 1939 ; Osmaston, 1965 ; Ebert, 2004). Globalement, il en ressort que l'iroko tend à fructifier une fois par an vers la fin de la principale saison sèche, et pour une durée n'excédant guère un mois. La production de graines peut être très abondante, même si elle varie fortement d'un arbre à l'autre (Nyong'o et al., 1994). Les paramètres influençant les variations de cette production ne sont pas connus, bien qu'on puisse supposer qu'elle soit régie principalement par :
39– les caractères génétiques intrinsèques de l'arbre (White et al., 2007) ;
40– la date de floraison et la synchronisation de la floraison entre pieds mâles et femelles (Freitas et al., 2008) ;
41– la densité de population et l'isolement des individus (Ricklefs et al., 2005).
42Les graines sont petites (environ 2 mm de diamètre) et contenues dans des fruits juteux et sucrés consommés par divers animaux (Osmaston, 1965). Les disperseurs de ces semences ont été partiellement étudiés en Afrique de l'Ouest (Okon, 1975 ; Taylor et al., 1999) et en Ouganda (Osmaston, 1965). Ces trois études ont montré le principal rôle joué par la chauve-souris Eidolon helvum Kerr 1792 dans ces zones, tandis que Aubréville (1959) et Nyong'o et al. (1994) désignaient plutôt des oiseaux comme principaux disperseurs de l'iroko en Afrique de l'Ouest. White et al. (1996) désignent les primates et les oiseaux comme principaux disperseurs au Gabon, tandis que Tondeur (1939) signalait l'implication d'antilopes et rongeurs dans cette fonction en R.D. du Congo. Le manque de concordance entre ces récits découle d'observations limitées aussi bien dans le temps que dans l'espace. Il doit être également mis en relation avec la faune localement présente.
43L'identification des disperseurs d'une plante demeure néanmoins un élément écologique fondamental à déterminer dans la mesure où l'efficacité de la régénération naturelle et la structure génétique des populations de plantes sont influencées localement par la nature même des disperseurs (Howe et al., 1982). Dans tous les cas, les animaux potentiellement disperseurs de l'iroko augurent d'une dispersion à grande distance. Dès lors, du fait d'une production abondante de semences et malgré une fructification peu étalée dans le temps, le système de reproduction et de dispersion chez l'iroko optimiserait la probabilité que le recrutement puisse s'établir dans des sites forestiers imprévisiblement favorables (les trouées dans la canopée).
44La profusion du recrutement pourrait être renforcée en cas de dormance des graines d'iroko. Hopkins et al. (1987) et Dalling et al. (2009) ont par exemple montré que des graines d'espèces pionnières tropicales peuvent demeurer viables dans le sol pendant 2 à 30 ans. Hall et al. (1980) ont noté la présence de quelques graines d'iroko dans des échantillons de sols forestiers tropicaux. Bien qu'elle constitue une précieuse indication, cette seule étude ne peut être une preuve du caractère dormant de ces semences, d'autant plus que d'autres travaux rapportent une viabilité semencière nulle après 3 à 6 mois chez cette espèce (Tondeur, 1939 ; Ofori, 2007a). De nouvelles études de la composition de la banque de graines du sol pourraient être multipliées afin de vérifier cette hypothèse, mais des tests directs de dormance tégumentaire et/ou physiologique chez les graines d'iroko pourraient également être préconisés.
5.4. La dynamique de la régénération naturelle
45Par le passé, deux études ont abordé la dynamique de la régénération naturelle de cette essence : Pendje (1994) et Nichols et al. (1999). L'expérimentation de Pendje (1994) a été toutefois réalisée en zone agroforestière et les résultats s'apparentent davantage à ce qui s'observe en plantation. En outre, ces deux études avaient aussi une durée d'observation très limitée dans le temps (maximum 13 mois). De plus, elles n'ont pris en compte que des populations de juvéniles installées à proximité immédiate de semenciers isolés afin de tester aussi l'hypothèse de Janzen-Connell (Ricklefs et al., 2005). Les résultats de Nichols et al. (1999) montrent que le nombre moyen de plantules par semencier est très faible (6,5 juvéniles par arbre mère). La croissance moyenne en hauteur a été estimée à 4 cm par an après un suivi de 10 mois et il n'y avait pas de corrélation entre ce paramètre et l'intensité de la radiation solaire. Aucune information n'a été fournie au sujet de la croissance diamétrique ou des taux de recrutement annuels.
46Par contre, les données de croissance issues de plantations expérimentales sont davantage abondantes. Le tableau 3 résume les observations répertoriées. Ces données semblent montrer des performances globalement meilleures en plein découvert qu'en sous-bois ou en chablis. La croissance en hauteur notée sur certains sites (Dupuy et al., 1991 ; Wagner et al., 2002 ; Ebert, 2004) est élevée et concorde avec les traits des espèces pionnières. L'accroissement diamétrique moyen couramment retenu pour l'iroko est d'environ 5 mm par an, valeur confirmée par des études des cernes de croissance en forêt centrafricaine (Durrieu de Madron, 2003). Il faut aussi préciser que les plantations d'iroko sont fortement attaquées par un insecte gallicole Phytolyma lata (Wlaker, 1852) qui serait responsable de l'échec de nombre d'essais (White, 1966). Les meilleures performances enregistrées à ce jour proviennent d'expérimentations agroforestières réalisées en Ouganda et en Tanzanie : l'accroissement annuel moyen en diamètre y variait de 1,6 à 2,1 cm par an pour des arbres âgés de 35 à 75 ans (Ebert, 2004). De plus, ces résultats ont montré une relation quasi-linéaire entre l'âge des arbres et leur diamètre (coefficient de détermination R² = 0,84 ; p < 0,01), contrairement à la tendance notée par Durrieu de Madron (2003) à partir de l'analyse des cernes (croissance diamétrique moyenne significativement plus élevée dans les faibles classes de diamètre).
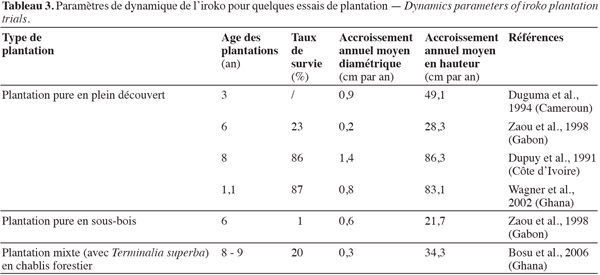
47Les paramètres techniques nécessaires à la modélisation de la dynamique des populations d'iroko sont donc partiellement disponibles en plantation. Ils restent par contre largement déficitaires en conditions naturelles. Or, l'exploitation de cette espèce étant quasi exclusivement confinée aux forêts naturelles, toute généralisation de ces résultats serait critiquable. Par ailleurs, la croissance diamétrique est un trait faiblement à moyennement héritable qui nécessite des estimations locales (White et al., 2007).
5.5. Les preuves génétiques et palynologiques du caractère pionnier et colonisateur de l'iroko
48Au vu de la préférence de l'iroko pour les milieux ouverts, d'aucuns pourraient s'étonner de sa présence remarquable dans les forêts denses humides guinéo-congolaises.
49L'expansion des populations d'iroko dans les massifs forestiers denses humides a sans doute été favorisée par les régressions forestières majeures passées. Les études palynologiques effectuées par Maley et al. (1998) au Cameroun ont montré que l'importante régression forestière due à la glaciation survenue entre 20 000 et 10 000 ans BP n'a quasiment pas affecté les populations des taxa tels que Milicia et Celtis. Ceci met aussi en évidence une bonne plasticité climatique chez ces taxa par rapport à d'autres espèces ligneuses caractéristiques des forêts denses. Mieux encore, il ressort de la même étude que les densités de Milicia auraient pu s'accroître rapidement et significativement lors de l'expansion forestière subséquente, à la faveur probablement des facteurs climatiques davantage favorables et d'une dispersion efficace de grandes quantités de semences. La même tendance colonisatrice a dû se produire au sein des forêts gabonaises lors des régressions enregistrées vers 2 800 ans BP et entre 1 400 et 500 ans BP (Ngomanda et al., 2007 ; Giresse et al., 2008). Par ailleurs, on sait que les populations humaines locales avaient fortement migré au sein du massif des forêts denses humides d'Afrique centrale, créant ainsi des conditions propices au maintien des espèces héliophiles, par la pratique de l’agriculture itinérante sur brûlis (Doucet, 2003).
50Les études génétiques à l'aide de marqueurs moléculaires pourraient renseigner sur l'histoire démographique de l'espèce, et sur la diversité et la structure génétique des populations actuelles (Plana, 2004). Les investigations de cet ordre réalisées en Afrique de l'Ouest n'apportent malheureusement que de faibles précisions sur ces sujets (Ofori et al., 2003). Faisant ressortir un niveau de diversité assez bas dans certaines populations, elles n'ont toutefois pas testé si cela était indicateur de colonisations récentes ou au contraire, de goulots d'étranglement survenant dans ces populations (Cornuet et al., 1997).
6. Conclusion et recommandations
51Malgré une bibliographie assez abondante sur les traits écologiques de l'iroko, de nombreux points demeurent peu ou mal décrits. Alors que des efforts de recherche ont été menés en Afrique de l'Ouest sur M. excelsa, l'Afrique centrale reste largement à la traine, bien qu'elle constitue aujourd'hui la principale région exploitant cette espèce. Une gestion durable de M. excelsa nécessite un approfondissement des connaissances relatives :
52– aux patrons et aux traits d'histoire de vie gouvernant le cycle de reproduction et de régénération de l'espèce ;
53– à l'influence de ces traits de vie sur la diversité génétiques des populations d'iroko, en relation avec les types d'habitats colonisés ;
54– aux niveaux de différenciation génétique entre les populations.
55Pour ce dernier point, la distribution continue de l'espèce à travers une large partie du continent africain suggérerait un flux de gènes important et donc une faible différenciation, en dépit des longues phases d'aridification climatique et de fragmentation forestière observées tout au long du Quaternaire (de 1,8 millions d'années à aujourd'hui). Si toutefois une structuration génétique spatiale marquée était démontrée, elle mettrait en évidence une capacité de dispersion bien plus limitée qu'attendu, ainsi que le rôle éventuel des refuges forestiers de la dernière période glaciaire dans l'organisation de la diversité.
56M. regia a été très négligée jusqu'à présent et une grande partie de l'information disponible sur l'iroko ne concerne que M. excelsa. Fondamentalement, il est déjà surprenant de noter que M. regia, pourtant décrite comme un arbre de forêt humide, soit présente au Sénégal et absente des forêts denses humides d'Afrique centrale. Même si le Dahomey Gap a pu limiter sa dispersion, ce couloir climatique sec allant de l'Est du Ghana à l'Est du Bénin ne s'est installé que récemment (vers 4 000 ans BP), à une période où l'espèce aurait déjà dû être présente dans les forêts du Bas-Guinéen. Cela n'est qu'une des nombreuses questions relatives à l'écologie de l'iroko, qui demeurent sans réponse à l'heure actuelle.
Bibliographie
Agyeman V.K., Swaine M.D. & Thompson J., 1994. Responses of tropical forest tree seedlings to irradiance and the derivation of a light response index. J. Ecol., 87, 815-827.
Akendengué B., 1992. Medicinal plants used by the fang traditional healers in Equatorial Guinea. J. Ethnopharmacol., 37, 165-173.
ATIBT, 1986. Atlas des bois tropicaux. Tome 1 : Afrique. Paris : ATIBT.
ATIBT, 2010. Statistiques 2009. Lett. ATIBT, 32, 4-25.
Aubréville A., 1959. La flore forestière de la Côte d'Ivoire. Tome 1. 2e éd. Nogent-sur-Marne, France : Centre Technique Forestier Tropical.
Azonkponon N., 2001. Conservation in situ de l’iroko (Milicia excelsa [Welw.] C.C.Berg) dans l’aire culturelle vodun du Bénin. Cotonou : Faculté des Sciences Agronomiques/Université Nationale du Bénin.
Bentham G. & Hooker J.D., 1880. Urticaceae. Genera Plant., 3(1), 341-395.
Berg C.C., 1977. Revisions of African Moraceae (excl. Dorstenia, Ficus, Musanga, Myrianthus). Bull. Jardin Bot. Nat. Belg., 47, 267-407.
Berg C.C., 1982. The reinstatement of the genus Milicia Sim (Moraceae). Bull. Jardin Bot. Nat. Belg., 52, 225-229.
Berg C.C., Hijman M.E.E. & Weerdenburg J.C.A., 1984. Flore du Gabon n°26. Moracées. Paris : Museum National d'Histoire Naturelle.
Bosu P. et al., 2006. Survival and growth of mixed plantations of Milicia excelsa and Terminalia superba 9 years after planting in Ghana. For. Ecol. Manage., 233, 352-357.
Bureau E., 1873. Moraceae. In: De Candolle A., ed. Prodromus systematis naturalis regni vegetabilis 17. Paris : Sumptibus Sociorum Treuttel & Würtz, 211-279.
Capuron R., 1968. Vingt fiches botaniques d'essences forestières de Madagascar. Paris : Centre Technique Forestier Tropical.
Carrière S.M., 2002. L'abattage sélectif : une pratique agricole ancestrale au service de la régénération forestière. Bois For. Trop., 272, 45-62.
Chevalier A., 1912. Novitates florae africanae. Urticaceae. Bull. Soc. Bot. Fr., 58/8d, 207-211.
Chevalier A., 1917. Les végétaux utiles d'Afrique tropicale française. La forêt et les bois du Gabon. Paris : Challamel.
Cornuet J.M. & Luikart G., 1997. Description and power analysis of two tests for detecting recent population bottlenecks from allele frequency data. Genetics, 144, 2001-2014.
Dalling J.W. & Brown T.A., 2009. Long-term persistence of pioneer species in tropical rain forest soil seed banks. Am. Nat., 173, 531-535.
Damette O. & Delacote P., 2011. Unsustainable timber harvesting, deforestation and the role of certification. Ecol. Econ., 70, 1211-1219.
Doucet J.-L., 2003. L’alliance délicate de la gestion forestière et de la biodiversité dans les forêts du centre du Gabon. Thèse de doctorat : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Duguma B. et al., 1994. Growth of ten multipurpose tree species on acid soils in Sangmelima, Cameroon. Agrofor. Syst., 27, 107-119.
Duminil J. & Di Michele M., 2009. Plant species delimitation: a comparison of morphological and molecular markers. Plant Biosyst., 143, 528-542.
Dupuy B. & Mille G., 1991. Les plantations à vocation de bois d'œuvre en Afrique intertropicale humide. Rome : FAO.
Durrieu de Madron L., 2003. Accroissement diamétrique du bété et de l'iroko. Bois For. Trop., 275, 85-87.
Duveiller G., Defourny P., Desclée B. & Mayaux P., 2008. Deforestation in Central Africa: estimates at regional, national and landscape levels by advanced processing of systematically distributed Landsat extracts. Remote Sens. Environ., 112(5), 1969-1981.
Ebert S.J., 2004. Silvicultural potential of Milicia excelsa - I-TOO. Working paper n°18. Freiburg, Germany: I-TOO.
Engler G.H.A., 1894. Moraceae africanae 1. Bot. Jahrb., 20, 139-150.
FAO, 1986. Some medicinal forest plants of Africa and Latin America. Roma: FAO.
FAO, 2011. Situation des forêts du monde 2011. Rome : FAO.
Freitas L. & Bolmgren K., 2008. Synchrony is more than overlap: measuring phenological synchronization considering time length and intensity. Rev. Bras. Bot., 31, 721-724.
Gérard J. et al., 1998. Synthèse sur les caractéristiques technologiques de référence des principaux bois commerciaux africains. Série FORAFRI 11. Montpellier, France : CIRAD-Forêt.
GERDAT, 1973. Iroko. Bois For. Trop., 148, 33-45.
Giresse P., Mvoubou M., Maley J. & Ngomanda A., 2008. Late-Holocene equatorial environments inferred from deposition processes, carbon isotopes of organic matter, and pollen in three shallow lakes of Gabon, West-Central Africa. J. Paleolimnol., 41, 369-392.
Hall J.S. & Swaine M.D., 1980. Seed stocks in Ghanaian forest soils. Biotropica, 12, 256-263.
Hawthorne W.D., 1995. Ecological profiles of Ghanaian forest trees. Tropical Forestry Papers 29. Oxford, UK: Oxford Forestry Institute.
Hawthorne W.D. & Jongkind C., 2006. Woody plants of Western African forests. Kew, UK: Royal Botanic Gardens.
Hopkins M.S. & Graham A.W., 1987. The viability of seeds of rainforest species after experimental soil burials under tropical wet lowland rainforest in North Eastern Australia. Aust. J. Ecol., 12, 97-108.
Howe H.F. & Smallwood J., 1982. Ecology of seed dispersal. Annu. Rev. Ecol. Evol. Syst., 13, 201-228.
Jennings S.B., Brown N.D., Boshier D.H. & Whitmore T.C., 2001. Ecology provides solution to the maintenance of genetic diversity in sustainably managed tropical rain forests. For. Ecol. Manage., 154, 1-10.
Joker D., 2002. Milicia excelsa (Welw.) C.C.Berg. Seed Leaflet 63, http://www.dfsc.dk/pdf/Seedleaflets/Milicia %20excelsa_63_int.pdf, (14/02/04).
Katumba B.M., Boffa J.M., Abigaba G. & Okorio J., 2004. Domestication of medicinal tree species in the Victoria lakeshore region. Uganda J. Agric. Sci., 9, 84-88.
Koffi K.G., 2010. Étude de la variabilité et de la phylogéographie de Santiria trimera (Burseraceae). Implications pour une conservation durable des forêts humides d'Afrique. Thèse de doctorat : Université libre de Bruxelles (Belgique).
Léandri J., 1948. Contribution à l'étude des Moracées de Madagascar (Moroideae). Mem. Inst. Sci. Madagascar Ser. B, 1, 1-37.
Maley J. & Brenac P., 1998. Vegetation dynamics, palaeoenvironments and climatic changes in the forests of Western Cameroon during the last 28,000 years B.P. Rev. Palaeobot. Palynol., 99, 157-187.
Mauriès G., 1970. Époques des premières importations de bois exotiques. Bull. Inf. Cent. Techn. Bois Guyane, 53, 27-29.
Mayaux P. et al., 2006. Cartographie et évolution du couvert forestier en Afrique centrale. In : Devers D. & Vande Weghe J.-P., eds. Les Forêts du Bassin du Congo - État des Forêts 2006. Maryland, USA : CARPE, 80-89.
Mollet M., Tiki-Manga T., Kengue J. & Tchoundjeu Z., 1995. The « top 10 » species in Cameroon: a survey of farmers’ views on trees. Agrofor. Today, 7, 3-4.
Mollet M., Téré H. & Herzog F., 2000. Ligneux à usages multiples dans les systèmes agraires tropicaux : une étude de cas de Côte d'Ivoire. Schweiz. Z. Forstwes., 151, 355-364.
Ngomanda A. et al., 2007. Lowland rainforest response to hydrological changes during the last 1,500 years in Gabon, Western Equatorial Africa. Quat. Res., 67, 411-425.
Nichols J.D. et al., 1998. Distribution and abundance of Milicia excelsa species in Ghana. Ghana J. For., 6, 1-7.
Nichols J.D. et al., 1999. Patterns of seedling survival in the tropical African tree Milicia excelsa. J. Trop. Ecol., 15(4), 451-461.
Nkounkou-Loumpangou C. et al., 2005. Inventaire des plantes médicinales utilisées dans le traitement de l'infertilité féminine à Brazzaville. Phytothérapie, 6, 252-259.
Nyong'o R.N., Cobbinah J.R. & Appiah-Kwarteng J., 1994. Flowering and fruiting patterns in Milicia excelsa and Milicia regia Welw. Ghana J. For., 1, 19-29.
Ofori D.A., 2007a. Milicia excelsa (Welw.) C.C.Berg. In: Louppe D., Oteng-Amoako A.A. & Brink M., eds. Prota: Timbers/Bois d’œuvre 1. Wageningen, The Netherlands: PROTA.
Ofori D.A., 2007b. Milicia regia (A.Chev.) C.C.Berg. In: Louppe D., Oteng-Amoako A.A. & Brink M., eds. Prota: Timbers/Bois d’œuvre 1. Wageningen, The Netherlands: PROTA.
Ofori D.A., Swaine M.D., Cobbinah J.R. & Price H., 2003. Genetic diversity and biodiversity conservation guidelines for Milicia species in Ghana. Ghana J. For., 11, 27-38.
Ofori D.A. & Cobbinah J.R., 2007. Integrated approach for conservation and management of genetic resources of Milicia species in West Africa. Forest Ecol. Manage., 238, 1-6.
Okon E.E., 1975. Fruit bats at Ife: their roosting and food preferences. Niger. Field, 39, 33-40.
Osmaston H.A., 1965. Pollen and seed dispersal in Chlorophora excelsa and other Moraceae, and in Parkii flilicoidea (Mimosaceae), with special reference to the role of the fruit bat, Eidolon helvum. Commonwealth For. Rev., 44, 96-104.
Ouinsavi C. et al., 2006. Novel microsatellite DNA markers for the threatened African endemic tree species, Milicia excelsa (Moraceae), and cross-species amplification in Milicia regia. Mol. Ecol. Notes, 6, 480-483.
Ouinsavi C. & Sokpon N., 2010. Morphological variation and ecological structure of iroko (Milicia excelsa [Welw.] C.C.Berg) populations across different biogeographical zones in Benin. Int. J. For. Res., doi:10.1155/2010/658396.
Pendje G., 1994. Stratégies de régénération de neuf essences commerciales de forêt tropicale (Mayombe, Zaïre). Thèse de doctorat : Université Pierre et Marie Curie, Paris (France).
Plana V., 2004. Mechanisms and tempo of evolution in the African Guineo-Congolian rainforest. Philos. Trans. R. Soc. Lond., Ser. B, 359, 1585-1594.
Raponda-Walker A. & Sillans R., 1995. Les plantes utiles du Gabon. Libreville : Édition Sépia.
Rendle A.B., 1916. Moraceae. In: Prain D. Flora of tropical Africa. 6/2. London: Reeve, 19-78.
Ricklefs R.E. & Miller G.L., 2005. Écologie. Bruxelles : Éditions De Boeck Université.
Sen S., Sivrikaya H. & Yalçin M., 2009. Natural durability of heartwoods from European and tropical Africa trees exposed to marine conditions. Afr. J. Biotechnol., 8, 4425-4432.
Sheil D. & Van Heist M., 2000. Ecology for tropical management. Int. For. Rev., 2, 261-270.
Sim T.R., 1909. Forest flora and forest resources of Portuguese East Africa. Aberdeen, Scotland: Taylor & Henderson.
Szaro R.C., Angelstam P. & Sheil D., 2005. Information needs for ecosystem forestry. In: Sayer J.A. & Maginnis S., eds. Forests in landscapes: ecosystem approaches to sustainability. Cambridge, UK: IUCN, 31-46.
Tabuti J.R.S., 2007. The uses, local perceptions and ecological status of 16 woody species of Gadnumire Sub-county, Uganda. Biodivers. Conserv., 16, 1901-1915.
Taylor D.A.R., Kankam B.O. & Wagner M.R., 1999. The role of the fruit bat Eidolon helvum in seed dispersal, survival, and germination in Milicia excelsa, a threatened West African hardwood. Flagstaff, AZ, USA: Northern Arizona University, http://www.for.nau.edu/cms/content/view/521/715, (28/06/10).
Thies E., 1995. Principaux ligneux (agro-)forestiers de la Guinée. Zone de transition. GTZ n°253. Bonn, Germany: GTZ im TZ-Verlag.
Tondeur G., 1939. Monographie forestière du Chlorophora excelsa Benth. et Hook. Bull. Agric. Congo Belge, 30(2), 163-198.
Wagner M.R. et al., 2002. Integrated pest management to sustain iroko production in Ghana, West Africa. Forest Institute of Ghana, http://www.for.nau.edu/ghana/irokopresentation/, (08/03/2003).
WCMC, 1998. Contribution to an evaluation of tree species using the new CITES listing criteria. Cambridge, UK: World Conservation Monitoring Centre (UNEP-WCMC).
Welwitsch F.M.J., 1869. Sertum angolense. Trans. Linn. Soc. Bot., 27, 1-110.
White L. & Abernethy K., 1996. Guide de la végétation de la Réserve de la Lopé, Gabon. Libreville : Projet ECOFAC.
White M.G., 1966. A comparison of Chlorophora excelsa (Welw.) Benth and Hook (F.) and C. regia A.Chev., (Fam. Moraceae). Commonwealth For. Rev., 45(124), 150-153.
White T.L., Adams W.T. & Neale D.B., 2007. Forest genetics. Cambridge, UK: CABI Publishing.
Zaou P.K., Mapaga D., Nguema S.N. & Deleporte P., 1998. Croissance de treize essences de bois d’œuvre plantées en forêt gabonaise. Bois Forêts Trop., 256(2), 21-32.
Pour citer cet article
A propos de : Kasso Daïnou
Univ. Liège - Gembloux Agro-Bio Tech. Laboratoire de Foresterie des Régions tropicales et subtropicales. Unité de Gestion des Ressources forestières et des Milieux naturels. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : kdainou@ulg.ac.be
A propos de : Jean-Louis Doucet
Univ. Liège - Gembloux Agro-Bio Tech. Laboratoire de Foresterie des Régions tropicales et subtropicales. Unité de Gestion des Ressources forestières et des Milieux naturels. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
A propos de : Brice Sinsin
Université d'Abomey-Calavi. Laboratoire d'Écologie appliquée. 01 BP 526. Cotonou (Bénin).
A propos de : Grégory Mahy
Univ. Liège - Gembloux Agro-Bio Tech. Unité Biodiversité et Paysage. Passage des Déportés, 2. B-5030 Gembloux (Belgique).






