- Portada
- volume 16 (2012)
- numéro 4
- Principes toxiques, toxicité et technologie de détoxification de la graine de Jatropha curcas L. (synthèse bibliographique)
Vista(s): 0 (0 ULiège)
Descargar(s): 0 (0 ULiège)
Principes toxiques, toxicité et technologie de détoxification de la graine de Jatropha curcas L. (synthèse bibliographique)

Notes de la rédaction
Reçu le 6 novembre 2011, accepté le 3 juillet 2012
Résumé
L’utilisation des tourteaux issus de la trituration de graines de Jatropha curcas pour l’alimentation du bétail est limitée car ils présentent des teneurs plus ou moins élevées, selon les variétés, en composés toxiques et antinutritionnels dont les plus importants sont les esters de phorbol et la curcine. Ces esters de phorbol, diterpènes caractéristiques des Euphorbiaceae, sont connus pour leur action inflammatoire entrainant une irritation et une toxicité pour les insectes, les poissons et les mammifères. Ces composés sont parfois totalement dégradés dans le sol et leur teneur peut être réduite par des procédés physiques, chimiques ou biologiques, avec un taux de réduction compris entre 50 et 95 %. La curcine est une toxalbumine à activité lectinique, irritante, inactivée par des traitements thermiques à 121 °C pendant 30 min. D’autres facteurs antinutritionnels sont également présents, tels que des saponines et un inhibiteur de l’activité de trypsine. Ce dernier composé interfère avec les processus de digestion et sa réduction se fait également grâce à des traitements thermiques, chimiques ou biologiques. L’élimination de ces molécules ou la réduction de leur teneur est nécessaire pour la valorisation des tourteaux de J. curcas dans la filière de l’alimentation du bétail.
Abstract
Toxic principles, toxicity and technology of detoxification of Jatropha curcas L. seed: a review. The use of meal from the crushing of Jatropha curcas seed for livestock feed is limited owing to the variable amounts of seed available. This availability depends on the level and variety of toxic and antinutritional compounds contained in the seed at a given time; the most important of these compounds are phorbol esters and curcin. The phorbol esters present in J. curcas seed are Euphorbiaceae diterpenes, known for their inflammatory action resulting in irritation and toxicity to insects, fish and mammals. These compounds are sometimes completely degraded in soil and they may be reduced by physical, chemical or biological processes, with a reduction ratio of between 50 and 95%. Curcin is an irritating toxalbumin with lectin activity; it is inactivated by heat treatment at 121 °C for 30 min. Other antinutritional compounds are also present in J. curcas seed, such as saponins and an inhibitor of trypsin activity. This trypsin-inhibiting compound interferes with the digestion process and its reduction is achieved through thermal, chemical or biological treatments. The elimination of, or at least a reduction in the levels of, these molecules represents a prerequisite for using J. curcas meal in the livestock feed sector.
Tabla de contenidos
1. Introduction
1Jatropha curcas L. (Euphorbiaceae) est un arbuste originaire d’Amérique, largement distribué dans les zones tropicales et subtropicales d’Afrique et d’Asie. Ses graines sont riches en composés lipidiques dont la teneur moyenne représente 36,3 % de la matière sèche (MS) de la graine entière (Ginwal et al., 2004) ou 56,75 % de la MS de l’amande (Makkar et al., 1998). L’huile, considérée comme un combustible potentiel de substitution au diesel, pourrait être utilisée dans les moteurs à explosion soit directement, soit après raffinage. Le tourteau issu de la trituration des graines est utilisé comme fertilisant organique (Staubmann et al., 1997) ; il pourrait être valorisé en alimentation du bétail car il présente un niveau en protéines brutes pouvant atteindre 61,2 % de la MS, valeur supérieure à celle du tourteau de soja (45,7 % de la MS) (Makkar et al., 1998). Mais cette utilisation est limitée par la présence de certains métabolites toxiques et facteurs antinutritionnels.
2L’objectif de cette synthèse est de passer en revue les métabolites toxiques et antinutritionnels majeurs accumulés dans la graine de Jatropha, d’en évaluer leur toxicité et de recenser les techniques utilisables pour réduire leur présence dans les tourteaux.
2. Inventaire des principales toxines
3L’analyse chimique des graines de J. curcas a mis en évidence la présence de substances toxiques pour les animaux ou l’homme, mais aussi de facteurs antinutritionnels (Tableau 1). Parmi ces composés, on trouve des esters de phorbol (Makkar et al, 1997 ; Makkar et al., 1998 ; Martínez-Herrera et al., 2006), des molécules – notamment la curcine – à activité lectinique, un inhibiteur de la trypsine et des saponines (Aderibigbe et al., 1997). Certains composés sont des métabolites secondaires qui, contrairement aux métabolites primaires, ne participent pas directement au développement des plantes, mais peuvent intervenir dans leur protection contre les agressions des pathogènes et des herbivores, ou dans leur reproduction par attraction de pollinisateurs (Raven et al., 2003). On identifie trois types principaux de métabolites secondaires : les terpénoïdes, les alcaloïdes et les molécules phénoliques. Les esters de phorbol font partie des terpénoïdes et sont les composés les plus toxiques dans J. curcas et les saponines font partie des composés phénoliques. Par contre, curcine et inhibiteur de trypsine sont des protéines (métabolites primaires).
3. Les terpénoïdes et esters de phorbol
4Les terpénoïdes ou terpènes sont des polymères d’une unité à cinq atomes de carbone ayant pour base un diène conjugué dont le nom commun est isoprène (2-méthylbuta-1,3-diène) (Garret et al., 2000). Ils sont formés par un assemblage progressif d’unités isoprènes (en C5). Chaque unité isoprène (Figure 1) a « une tête », l’atome de carbone 1 et « une queue », l’atome de carbone 4 (Johnson, 2003).
5Les terpènes sont des substances généralement lipophiles qui ont souvent une fonction de défense contre les insectes et les herbivores (Vollhardt et al., 2004). Tous les terpènes et leurs dérivés sont issus de la voie de biosynthèse de l’acide mévalonique (Hopkins, 2003) dont le précurseur est l’acétyl-coenzyme A (acétyl-CoA), intermédiaire du catabolisme respiratoire des glucides et des acides gras. Parmi les terpènes, les diterpènes sont les plus fréquemment rencontrés. Chez les Euphorbiaceae et les Thymelaeaceae, ces composés sont souvent très irritants pour la peau et sont toxiques non seulement pour les mammifères, mais aussi pour les phytoparasites (Marshall et al., 1985). Par ailleurs, certains diterpènes sont promoteurs de tumeurs ou co-cancérogènes. Ils favorisent la croissance des tumeurs après une exposition à une dose sub-carcinogénique d’un agent cancérigène, mais ne sont ni mutagènes ni cancérogènes (Hecker, 1987). Paradoxalement, beaucoup de ces composés ont démontré des effets anti-tumoraux. Ainsi, le taxol (paclitaxel) est un diterpène complexe, isolé de l’écorce des troncs d’if du Pacifique (Taxus brevifolia) qui s’est avéré être un produit très efficace contre le développement des tumeurs cancéreuses chez l’homme (Vollhart et al., 2004).
6Chez les plantes, il existe des diterpènes polyhydroxylés. Rassemblés sous le nom de tiglianes (Figure 2), ils constituent un groupe de composés tétracycliques dont les cycles sont désignés par les lettres A, B, C et D (Haas et al., 2000). Le phorbol (Figure 3) fait partie des tiglianes et possède cinq groupes hydroxyles pouvant subir des réactions d’estérification. On distingue deux types de phorbol (α et β) (Figure 4) qui diffèrent dans leur groupement -OH au niveau du cycle C. Ce groupement rend le phorbol actif (β) ou inactif (α) selon le positionnement spatial du cycle D. Dans le phorbol β, le groupement -OH est en saillie vers le lecteur, au contraire de la position α (Goel et al., 2007).
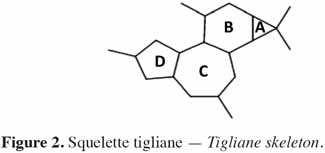
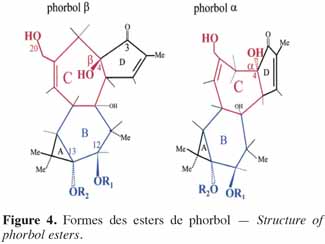
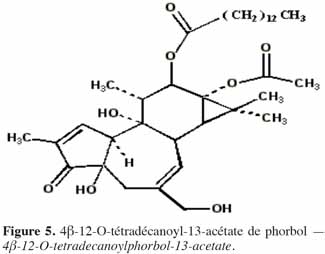
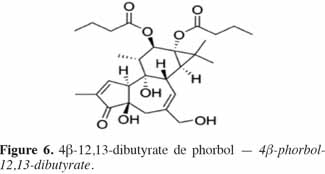
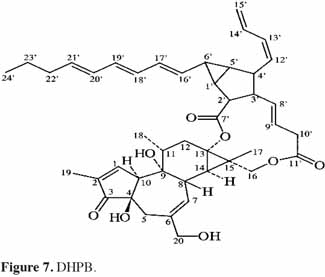
7Le phorbol donne, par condensation à diverses molécules acides, des esters dont les plus répandus sont le TPA (4β-12-O-tétradécanoylephorbol-13-acétate) (Figure 5) et le PDBu (4β-phorbol-12,13-dibutyrate) (Figure 6). Le TPA est également dénommé PMA (phorbol 12-myristate-13-acétate) (Silinsky et al., 2003). Ce composé se caractérise par une estérification en C12 avec l’acide tétradécanoïque ou acide myristique [CH3(CH2)12COOH] et en C13 avec l’acide acétique (CH3COOH). Le PDBu, quant à lui, se caractérise par une estérification en C12 et C13 avec l’acide butyrique [CH3(CH2)2COOH]. Hirota et al. (1988) ont également mis en évidence un nouveau type d’ester de phorbol possédant une structure macrocyclique diester d’acide carboxylique. Isolé à partir de l’huile des graines de J. curcas, il s’agit du DHPB (12-déoxy-16-hydroxyphorbol-4′-[12′,14′-butadienyl]-6′-[16′,18′,20′-nonatrienyl]-bicyclo[3.1.0]hexane-(13-O)-2′-[carboxylate]-(16-O)-3′-[8′-acide butanoïque-10′]ate ; C44H54O8). C’est un ester du 12-déoxy-16-hydroxyphorbol dont la partie carboxylique est une structure en anneau bicyclique qui présente une liaison en O13 et O16 (Figure 7). En outre, Haas et al. (2002) ont montré que les graines de J. curcas renfermaient cinq autres esters de phorbol dont la structure de base est celle du 12-déoxy-16-hydroxyphorbol. Ils se différencient par l’apparition d’unité hexane bicyclo[3.1.0] ou d’unité cyclobutane au niveau des fragments d’acide dicarboxylique. En général, il s’agit de molécules solubles dans l’acétone, le diméthylsulfoxyde, l’acétate d’éthyle, l’éthanol ou encore le chlorure de méthylène. Par contre, elles sont pratiquement insolubles dans l’eau et sont sensibles à des conditions acides et alcalines. Leur point de fusion est d’environ 72 °C. Les esters de phorbol sont présents dans l’amande des graines à des concentrations variant de 0,1 à 0,7 % de la MS (Makkar et al., 2009a), alors que dans certaines variétés de Jatropha, notamment mexicaines, leur concentration est négligeable (0,01 % de la MS).
3.1. Toxicité
8La toxicité alimentaire des graines de Jatropha a souvent été signalée chez les animaux. Ainsi, Ahmed et al. (1979) ont mis en évidence chez des veaux nourris par sonde intragastrique de graines de J. curcas à des doses uniques de 0,25 g·kg-1 d’aliment et plus, une forte mortalité associée à des atteintes hépatiques, digestives, rénales et pulmonaires. Ils confirment les observations d’Adam et al. (1975) sur des chèvres nourries aux mêmes doses de graines de Jatropha et qui ont présenté des symptômes similaires suivis de mortalité. Marshall et al. (1985) ont montré une activité insecticide des esters de phorbol sur une espèce de lépidoptère parasite du cotonnier, avec une concentration qui inhibe la croissance de 50 % des parasites à une teneur de 3 µg·g-1 de milieu de culture et une concentration létale absolue à 20 µg·g-1. Becker et al. (1998) ont constaté que des carpes rejettent des aliments contenant des esters de phorbol à partir d’une incorporation à 31 mg d’esters de phorbol par kg d’aliment. Auparavant, Gandhi et al. (1995) ont rapporté qu’à la toxicité létale par voie orale (à partir de 9 ml d’huile de Jatropha par kg de poids vif chez le rat) s’ajoute celle par contact. En effet, chez le lapin, une application cutanée occasionne une forte réaction inflammatoire avec œdème, érythème et nécrose, 4 h après l’application de la fraction toxique, isolée par solvants. Enfin, Li et al. (2010) ont observé que chez des souris, l'administration par voie intra-gastrique d’esters de phorbol entrainait une gastro-entérite hémorragique aigüe, avec une dose létale médiane à 27,34 mg·kg-1 de poids vif.
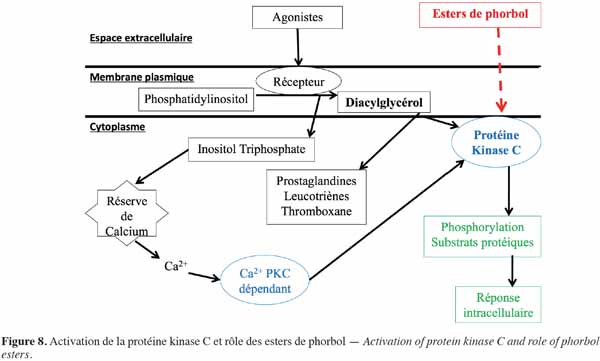
9Les esters de phorbol agissent de manière préférentielle sur les membranes biologiques (Figure 8). Ils s’intercalent dans la membrane cellulaire par le biais de récepteurs dont l’occupation active la protéine kinase C (PKC) (Blumberg et al., 1987). La PKC est présente dans tous les tissus, des mammifères aux insectes, en concentration importante dans les tissus neuronaux. Cette enzyme joue un rôle essentiel dans la transduction du signal qui régule la croissance et la différenciation cellulaire. Elle phosphoryle spécifiquement les résidus sérine et thréonine des protéines, leur permettant de réguler et de coordonner différentes voies métaboliques cellulaires (Aitken, 1987). L'activateur naturel de la PKC est le diacylglycérol dont la synthèse dépend d’une phosphodiestérase. Cette enzyme, sous l’influence de divers agonistes extracellulaires, hydrolyse des phospholipides membranaires, en particulier le phosphatidylinositol, en diacylglycérol intégré à la membrane plasmique et en inositol triphosphate qui diffuse dans le cytoplasme cellulaire. Ce dernier est responsable du déclenchement de la libération de calcium à partir des réserves internes, tandis que le diacylglycérol sert de précurseur à la production d’acide arachidonique nécessaire pour la synthèse des prostaglandines, des leucotriènes et du thromboxane et active également les PKC. Lors de l’activation, les PKC sont transportées vers la membrane plasmique pour lui permettre de jouer son rôle dans la transduction des signaux moléculaires et donc de donner une réponse biologique (Goel et al., 2007). Les esters de phorbol agissent sur les PKC de la même manière que le diacylglycérol. Il s’ensuit ainsi une activation importante de cette enzyme, aussi bien au niveau cytoplasmique que membranaire, lui permettant d’agir notamment dans la médiation de la réponse cellulaire aux stimuli extracellulaires conduisant en particulier à la prolifération et à la différenciation cellulaire ou à l'apoptose. Ces phénomènes se traduisent principalement par une inflammation ou une progression tumorale (Goel et al., 2007). D’ailleurs, chez la souris, Evans et al. (1987) ont montré que le meilleur test pour évaluer l'activité pro-inflammatoire de l'ester de phorbol est la détermination de l'érythème sur la peau. L'apparition de l'érythème ne semble pas due à un effet direct des esters de phorbol sur la peau, mais à la libération, sous l’effet des esters de phorbol, de médiateurs endogènes de l'inflammation au niveau de la micro vascularisation. Par ailleurs, Hecker (1987) a montré que, dans une population à risque, une inflammation chronique causée par les esters de phorbol peut entrainer l’activation de virus oncogènes pouvant participer à un éventuel développement tumoral.
3.2. Procédés de mise en évidence des esters de phorbol
10Au cours des procédés d’isolement, les esters de phorbol naturels sont relativement instables et sensibles à des réactions d’oxydation, d’hydrolyse, de transestérification et d’épimérisation (Haas et al., 2002). Leur isolement doit donc être réalisé en milieu anaérobie. Aussi, les solvants d’extraction doivent être dégazés et l’extraction effectuée sous un flux continu d’azote ou d’argon. Les protocoles d’isolement se basent sur l’estérification des groupes fonctionnels hydroxyles des esters de phorbol par des agents chimiques. Les esters de phorbol ainsi dérivés sont séparés par des méthodes de chromatographie en phase liquide haute performance (High Performance Liquid Chromatography – HPLC). L’extrait contenant les esters de phorbol peut être purifié en utilisant la chromatographie sur couche mince (Thin-Layer Chromatography – TLC), tandis que la structure du composé obtenu est déterminée par spectrométrie de masse (Goel et al., 2007).
11Pour quantifier les esters de phorbol, Makkar et al. (1997) ont broyé des graines de J. curcas dans du dichlorométhane en présence de sable abrasif. Le filtrat obtenu a été soumis aux ultra-sons et le résidu a été séché sous vide, puis dissout dans du tétrahydrofurane et filtré avant d’être analysé par HPLC. La phase stationnaire de la colonne analytique et de la pré-colonne était une phase inverse C18. Les phases mobiles utilisées en mode gradient comportaient de l’acide O-phosphorique, de l’acétonitrile et du tétrahydrofurane, tous dégazés par ultrasons. En réalisant la séparation à température ambiante (22 °C) et à un débit de 1,3 ml·min-1, les esters de phorbol (de quatre types) sont élués entre 41 et 48 min et détectés à 280 nm. Martínez-Herrera et al. (2006) ont obtenu une séparation satisfaisante à température ambiante, avec une même colonne analytique (250 x 4 mm), un même débit de 1,3 ml·min-1 en utilisant un gradient d’élution composé d’un mélange d’acétonitrile et d’eau, après une extraction au méthanol suivie d’une centrifugation. Les pics d’esters de phorbol apparaissent dans ces conditions entre 26 et 31 min et sont détectés à 280 nm. Dans cette approche, les résultats ont été exprimés en phorbol-12-myristate 13-acétate (apparu entre 34 et 36 min).
4. Les protéines
4.1. La curcine
12Certaines protéines, appelées protéines de stockage, sont produites par les plantes et accumulées de manière à constituer des réserves d’acides aminés et d’énergie, qui sont mobilisées en particulier lors du processus de germination des graines. Parmi ces protéines, les lectines (Kaufmann et al., 1999) ou hémagglutinines peuvent constituer souvent 6 à 11 % des protéines totales des graines de nombreuses plantes. Chez les végétaux, elles se rencontrent essentiellement chez les Fabaceae (légumineuses) et les Euphorbiaceae, mais on les trouve aussi chez les champignons, les bactéries et les animaux. Elles peuvent constituer pour la plante un moyen de repousser les herbivores, grâce à leur affinité pour les glycoprotéines membranaires de la muqueuse digestive, entrainant des troubles gastro-intestinaux. Plus généralement, leur capacité à se lier à des sucres les fait intervenir dans les phénomènes de reconnaissance de symbiotes, de pathogènes, mais aussi de grains de pollen. Par ailleurs, elles ont la propriété d’agglutiner spécifiquement les hématies (Hopkins, 2003). Ainsi, leur présence est mise en évidence par des réactions de précipitation avec des oligosaccharides, par exemple des particules de latex recouvertes de résidus de sucre (Kaul et al., 1991) et des réactions d’agglutination de cellules végétales et animales, telles que les éryhtrocytes (Gordon et al., 1974).
13La curcine ou curcasine est une lectine produite par J. curcas. Cette toxalbumine est proche de la ricine produite par Ricinus communis et de la crotine produite par Croton tiglium (Seigler, 1998), plantes appartenant toutes à la famille des Euphorbiaceae. Bien que toutes les parties de la plante contiennent de la curcine, l’amande des graines présente les plus fortes concentrations, mais la coque en est dépourvue. Les propriétés irritantes des graines de J. curcas, de la variété toxique, en particulier pour les personnes qui les manipulent, sont généralement attribuées à la présence de curcine. Cependant, les teneurs en curcine étant similaires entre les variétés de Jatropha non toxiques et toxiques, il semble que ce composé ne soit pas le principal élément toxique des graines de Jatropha (Makkar et al., 1998). Dans la plante, la curcine joue un rôle défensif et confère une immunité contre de nombreux ravageurs. Stirpe et al. (2006) ont montré que la curcine présente une activité inhibitrice contre certains virus de plantes, de champignons et d’animaux, permettant une application possible dans l’agriculture.
14La curcine et la ricine font partie d’une famille très diversifiée de « protéines inactivant les ribosomes » (ribosome inactivating protein – RIP) qui comprennent de nombreuses toxines bactériennes ou de plantes supérieures. Ces inhibiteurs de la synthèse protéique agissent en inactivant des sous-unités ribosomales (Millard et al., 2008). On distingue trois types d’inhibiteurs de la synthèse protéique. Les RIP de type 1, auxquelles appartient la curcine, sont des N-glycosidases monomériques à faible capacité de liaison cellulaire ou d’internalisation. Par contre, les RIP de type 2, notamment la ricine, sont composées de deux sous-unités structurelles reliées par un pont disulfure, une chaine A de nature enzymatique, la N-glycosidase, et une chaine B qui a des sites de fixation où adhèrent des sucres ayant la configuration du D-galactose (Stirpe et al., 1986). Cette dernière se lie à un glycane à la surface cellulaire et facilite l’endocytose, rendant ainsi ces RIP particulièrement toxiques. Enfin, les RIP de type 3, moins connues, sont des précurseurs inactifs de N-glycosidase, moins communs. La curcine inhibe la synthèse des protéines in vitro, de manière comparable à la ricine, mais elle se révèle 1 000 fois moins toxique en raison de son incapacité à pénétrer les cellules. Cependant, à l’inverse de beaucoup de RIP de type 1, elle contient un résidu de cystéine qui peut former un pont disulfure avec un anticorps activé conférant à celui-ci une cytotoxicité maximale (Luo et al., 2007). Il faut noter que l’on retrouve les RIP de type 1 dans de nombreuses matières végétales comestibles, comme des grains de céréales, les betteraves, les épinards, rendant ainsi peu probable le fait que la présence de curcine dans les graines de J. curcas puisse être un obstacle à leur valorisation en alimentation animale.
4.2. L’inhibiteur de l’activité de trypsine
15Selon Ryan (1990), les plantes comme J. curcas ont développé des stratégies de lutte passive ou des mécanismes de résistance induite. La production de protéines de défense comme les inhibiteurs de protéases, réduisant la digestibilité des tissus de la plante pour certaines espèces animales, fait partie de la seconde catégorie. Il s’agit en général de protéines qui forment des complexes avec les protéases permettant d’inhiber leur activité protéolytique. On en trouve souvent dans les tissus et les liquides qui sont vulnérables à l’action de protéases : le sérum sanguin, les cellules acineuses pancréatiques, mais aussi les tissus de stockage des plantes, en particulier les graines. La présence d’inhibiteurs en forte concentration dans les aliments peut modifier de manière significative les processus de digestion et interférer avec la croissance et le développement de l’animal. Chez les monogastriques nourris avec des tourteaux contenant de tels inhibiteurs, l’inactivité enzymatique résultant de la formation des complexes avec la trypsine et la chymotrypsine entraine une hypersécrétion d’enzymes pancréatiques (Rackis et al., 1981). Une stimulation chronique conduit à l’hypertrophie du pancréas et ainsi une inhibition de la croissance des jeunes animaux par perte fécale excessive de protéines non digérées.
5. Les saponines
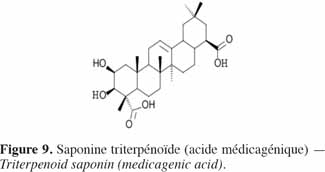
16Les saponines sont des triterpènes glycosidiques (Figure 9) de haut poids moléculaire formés d’une partie aglycone, la sapogénine – triperpenoïde ou stéroïde – liée avec une partie glycosidique – chaine latérale osidique (glucose, galactose, acide glucoronique, xylose, rhamnose ou méthylose) (Seigler, 1998). Largement distribuées dans le règne végétal, elles ont des propriétés détergentes et forment facilement des mousses en solution aqueuse. Historiquement, de nombreuses plantes contenant des saponines sont utilisées comme savons. Les saponines sont amères et se révèlent être très toxiques, notamment pour les poissons, par leur activité hémolytique (Kaufmann et al., 1999). Aderibigbe et al. (1997) ont mis en évidence moins de saponines (en moyenne 2,3 % de la MS) dans les tourteaux d’amande de J. curcas que dans le tourteau de soja (4,7 % de la MS) ; dans ce dernier toutefois, les saponines sont non hémolytiques et inoffensives pour la consommation animale (Liener, 1979).
6. Procédés de détoxification des tourteaux de graines de Jatropha
17En raison de la présence de composés toxiques et de facteurs antinutritionnels dans les graines de certaines variétés de J. curcas, l’huile mais aussi les tourteaux issus de l’extraction de l’huile ne peuvent être valorisés tels quels. Une détoxification totale est généralement nécessaire pour la plupart des applications, en particulier la nutrition. Diverses méthodes physiques, chimiques ou biologiques de détoxification partielle sont rapportées dans la littérature, selon le mode d’extraction de l’huile. Lorsque la détoxification est réalisée par voie mécanique (trituration), l’ester de phorbol se répartit en moyenne à raison de 70 % dans l’huile et de 30 % dans les tourteaux (Makkar et al., 2009a). Si Aregheore et al. (2003) ont montré que des traitements thermiques (121 °C pendant 30 min) ne modifient pas la concentration en esters de phorbol dans les tourteaux de Jatropha, l’inactivation de la curcine peut être réalisée par un traitement à la chaleur humide : 80 % d’humidité, à 130 °C, pendant 30 min (Aregheore et al., 1998 ; Chivandi et al., 2004). De même, les inhibiteurs de la trypsine peuvent être facilement éliminés par la cuisson ordinaire et le traitement à la chaleur humide. Makkar et al. (1998) ont également montré que des graines de Jatropha grillées pendant environ 15 min deviennent exemptes de facteurs antitrypsiques. Martínez-Herrera et al. (2006) ont confirmé que ces facteurs peuvent être inactivés à plus de 98 % par un traitement thermique à 121 °C pendant 25 min environ. Par contre, les saponines sont des molécules thermostables et sont considérées comme des facteurs antinutritionnels, surtout pour les monogastriques. Leur ingestion ne provoque en général que des retards de croissance et une valeur énergétique réduite de la ration, sans mortalité.
18Le mode d’extraction de l’huile présente une incidence non négligeable sur les teneurs en esters de phorbol. L’extraction par solvant permet d’extraire 99 % de l’huile, ce qui n’est pas le cas avec une extraction par presse, en mode artisanal (Beerens, 2007).
19Haas et al. (2000) ont tenté, par voie chimique, de réduire les teneurs en esters de phorbol dans l’huile de J. curcas. Le raffinage de l’huile par dégommage (élimination des phosphatides) à l’aide d’acide phosphorique, suivi de neutralisation à l’hydroxyde de sodium et désodorisation par distillation à la vapeur à 200 °C, n’a réduit la teneur en esters de phorbol que d’environ 50 %. Cependant, un effet destructeur sur les esters de phorbol a été observé lors de la désodorisation d’échantillons d’huile à des températures élevées (260 °C) en présence d’hydroxyde de sodium (Makkar et al., 2009b). Le méthanol d’une part, et l’hydroxyde de sodium combiné à l’hypochlorite de sodium d’autre part, se sont révélés efficaces pour détruire les esters de phorbol. Aregheore et al. (2003) ont, grâce à ces deux traitements, réduit la concentration en esters de phorbol de respectivement 95 et 93 %. Ces résultats ont été confirmés par Ahmed et al. (2009) qui ont montré que l’extraction des esters de phorbol avec le méthanol permettait de diminuer en moyenne le niveau d’esters de phorbol dans l’huile de Jatropha de 85 %. Devappa et al. (2010a), quant à eux, ont réduit d’environ 80 % les teneurs en esters de phorbol de l’huile après dilution au méthanol, évaporation et raffinage. Plus polaires que les principaux lipides présents dans les tourteaux de Jatropha, les esters de phorbol ne peuvent être extraits efficacement par des solvants apolaires tels que l’hexane. Chivandi et al. (2004) ont appliqué, à des amandes broyées, un traitement industriel impliquant d’une part, une double extraction au solvant (hexane-éthanol) accompagnée d’une phase extrusion-traitement à la vapeur et d’autre part, le même traitement suivi d’une nouvelle extraction à l’hexane ainsi qu’une extrusion par voie humide. Ils ont ainsi réduit les teneurs en esters de phorbol de respectivement 71 et 88 %. Enfin, Rakshit et al. (2008) avaient observé qu’après extraction à l’hexane, un traitement à l’hydroxyde de sodium permettait de réduire les teneurs en esters de phorbol de 88 et 89 % pour respectivement les graines décortiquées et les graines non décortiquées, contre 90 et 81 % respectivement avec l’hydroxyde de calcium. Par ailleurs, Martínez-Herrera et al. (2006) ont montré que sur des tourteaux décortiqués obtenus par solvant, une extraction à l’éthanol, avec ou sans autoclavage, permettait de réduire les teneurs en esters de phorbol de plus de 95 %, contre 18 % avec un simple traitement au bicarbonate de sodium. Ils ont ainsi confirmé la forte affinité des esters de phorbol avec les alcools les plus simples, modérément polaires. L’utilisation de l’éthanol présente, selon eux, l’avantage de ne laisser aucun résidu toxique dans les tourteaux. Cette même extraction à l’éthanol permettrait, en outre, de baisser la teneur en saponines de ces tourteaux d’environ 50 % et, suivie d’un traitement au bicarbonate de sodium puis d’un chauffage à 121 °C pendant 30 min, elle permettrait également de diminuer les teneurs en curcine d’environ 94 %. Concernant les saponines, Abou-Arab et al. (2010) sont parvenus à des résultats similaires, ou meilleurs (soit 51,33 % de réduction), sur des amandes des graines de Jatropha délipidées en combinant traitements chimiques (éthanol et bicarbonate de sodium) et thermiques.
20Les méthodes de dégradation biologique des composés toxiques ont été appliqués à du tourteau de Jatropha obtenu par pressage hydraulique de la graine. Belewu et al. (2010) ont réduit d’environ 77 %, par fermentation fongique, la quantité d’esters de phorbol et de près de 95 % la teneur en saponines dans des tourteaux inoculés avec Aspergillus niger. Il s’agit, selon eux, d’une technique relativement simple pouvant facilement être adoptée. Par ailleurs, Devappa et al. (2010b) ont émis l’hypothèse que les principaux composés toxiques présents dans le tourteau de Jatropha devaient se retrouver dans le sol. Ils ont montré que les esters de phorbol, purs ou présents dans un tourteau, étaient complètement biodégradés dans le sol, en une vingtaine de jours à 23 °C et en moins de 15 jours au-delà de 32 °C. Les produits de dégradation obtenus semblent moins toxiques puisqu’ils ne présentent aucun effet sur des mollusques, alors que toutes les préparations à base de graines de J. curcas montrent une activité molluscicide et larvicide (Rug et al., 2000). Cette dégradation semble favorisée par l’humidité du sol. Ces observations laissent penser que les champignons pourraient être utilisés pour faciliter la dégradation de certains composés toxiques.
7. Conclusion
21La graine de J. curcas est riche en différents composés toxiques et facteurs antinutritionnels parmi lesquels les esters de phorbol constituent la fraction la plus importante d’un point de vue toxicologique. Localisés dans la partie lipidique de l’amande, ils peuvent constituer un risque pour le bétail et les humains par leur effet irritant pour la peau ou les muqueuses et leur action hémolytique. L’élimination complète de ces diterpènes polyhydroxylés est nécessaire afin d’utiliser sans crainte l’huile de Jatropha dans l’industrie ou en médecine humaine. Par ailleurs, la valorisation en l’état des tourteaux issus de la trituration de la graine, en alimentation animale ou humaine, est à exclure pour la grande majorité des variétés cultivées, mais elle pourrait être envisagée moyennant différentes méthodes de détoxification. Des traitements thermiques permettent la réduction, voire la suppression, des composés toxiques protéiques ou associés aux protéines (curcine et inhibiteur de trypsine). Ces méthodes sont sans effet sur les esters de phorbol et les saponines dont la teneur n’est réduite de manière significative que par l’action des solvants organiques. Dans ce cas, les alcools simples permettent d’obtenir les meilleurs résultats. Une approche biologique mettant en jeu une fermentation fongique a pu effectivement diminuer les teneurs en composés toxiques et autres facteurs antinutritionnels. L’approfondissement des recherches dans ce domaine, en favorisant la dégradation des composés toxiques, semble être très prometteuse et pourrait constituer la méthode la plus écologiquement rationnelle et économique pour traiter les tourteaux de J. curcas.
22Remerciements
23Les auteurs remercient la Commission Universitaire au Développement (CUD) de la Belgique qui a permis ce travail, à travers le financement du programme interuniversitaire ciblé sur l’amélioration par des techniques agroécologiques des systèmes de production agricole intégrant le Jatropha dans la zone ouest du bassin arachidier sénégalais.
Bibliographie
Abou-Arab A.A. & Abu-Salem F.M., 2010. Nutritional quality of Jatropha curcas seeds and effects of some physical and chemical treatments on their anti-nutritional factors. Afr. J. Food Sci., 4(3), 93-103.
Adam S.E. & Magzoub M., 1975. Toxicity of Jatropha curcas for goats. Toxicology, 4(3), 347-354.
Aderibigbe A.O. et al., 1997. Chemical composition and effect of heat on organic matter – and nitrogen – degradability and some antinutritional components of Jatropha meal. Anim. Feed Sci. Technol., 67(2-3), 223-243.
Ahmed O.M.M. & Adam S.E.I., 1979. Effects of Jatropha curcas on calves. Vet. Pathol., 16(4), 476-482.
Ahmed W.A. & Salimon J., 2009. Phorbol ester as toxic constituents of tropical Jatropha curcas seed oil. Eur. J. Sci. Res., 31(3), 429-436.
Aitken A., 1987. The activation of protein kinase C by daphnane, ingenane and tigliane diterpenoid esters. Bot. J. Linean Soc., 94(1-2), 247-263.
Aregheore E.M., Makkar H.P.S. & Becker K., 1998. Assessement of lectin activity in a toxic and a non-toxic variety of Jatropha curcas using latex agglutination and haemagglutination methods and inactivation of lectin by heat treatments. J. Sci. Food Agric., 77(3), 349-352.
Aregheore E.M., Becker K. & Makkar H.P.S., 2003. Detoxification of a toxic variety of Jatropha curcas using heat and chemical treatments, and preliminary nutritional evaluation with rats. S. Pac. J. Nat. Sci., 21(1), 51-56.
Becker K. & Makkar H.P.S., 1998. Effects of phorbol esters in carp (Cyprinus carpio L.). Vet. Human Toxicol., 40(2), 82-86.
Beerens P., 2007. Screw-pressing of Jatropha seeds for fuelling purposes in less developed countries. Eindhoven, The Netherlands: Eindhoven University of Technology, Department of Sustainable Energy Technology.
Belewu M.A. & Sam R., 2010. Solid state fermentation of Jatropha curcas kernel cake: proximate composition and antinutritional components. J. Yeast Fungal Res., 1(3), 44-46.
Blumberg P.M. et al., 1987. Phorbol esters as probes of the modulatory site on protein kinase C – an overview. Bot. J. Linean Soc., 94(1-2), 283-292.
Chivandi E., Mtimuni J.P., Read J.S. & Makuza S.M., 2004. Effects of processing method on phorbol esters concentration, total phenolics, trypsin inhibitor activity and the proximate composition of the Zimbabwean Jatropha curcas provenance: a potential livestock feed. Pak. J. Biol. Sci., 7(6), 1001-1005.
Devappa R.K. et al., 2010a. Quality of biodiesel prepared from phorbol ester extracted Jatropha curcas oil. J. Am. Oil Chem. Soc., 87(6), 697-704.
Devappa R.K., Makkar H.P.S. & Becker R.K., 2010b. Biodegradation of Jatropha curcas phorbol esters in soil. J. Sci. Food Agric., 90(12), 2090-2097.
Evans F.J. & Edwards M.C., 1987. Activity correlations in the phorbol esters series. Bot. J. Linean Soc., 94(1-2), 231-246.
Gandhi V.M., Cherian K.M. & Mulky M.J., 1995. Toxicological studies on ratanjyot oil. Food Chem. Toxicol., 33(1), 39-42.
Garret R.H. & Grisham C.M., 2000. Biochimie. Bruxelles : De Boeck Université.
Ginwal H.S., Rawat P.S. & Srivastava R.L., 2004. Seed source variation in growth performance and oil yield of Jatropha curcas L. in Central India. Silvae Genetica, 53(4), 186-192.
Goel G., Makkar H.P.S., Francis G. & Becker K., 2007. Phorbol esters: structure, biological activity, and toxicity in animals. Int. J. Toxicol., 26(4), 279-288.
Gordon J.A. & Marquardt M.D., 1974. Factors affecting hemagglutination by concavalin A and soybean agglutinin. BBA, Biomembr., 332(2), 136-144.
Haas W. & Mittelbach M., 2000. Detoxification experiments with the seed oil from Jatropha curcas L. Ind. Crops Prod., 12(2), 111-118.
Haas W., Sterk H. & Mittelbach M., 2002. Novel 12-deoxy-16-hydroxyphorbol diesters isolated from the seed oil of Jatropha curcas. J. Nat. Prod., 65(10), 1434-1440.
Hecker E., 1987. Tumour promoters of the irritant diterpene ester type as risk factors of cancer in man. Bot. J. Linean Soc., 94(1-2), 197-219.
Hirota M. et al., 1988. A new tumor promoter from seed oil of Jatropha curcas L., an intramolecular diester of 12-deoxy-16-hydroxyphorbol. Cancer Res., 48, 5800-5804.
Hopkins W.G., 2003. Physiologie végétale. Bruxelles : De Boeck Université.
Johnson W., 2003. Invitation à la chimie organique. Bruxelles : De Boeck Université.
Kaufmann P.B. et al., 1999. Natural products from plants. Boca Raton, FL, USA: CRC Press LLC.
Kaul R., Read J. & Mattiasson B., 1991. Screening for plants lectins by latex agglutination tests. Phytochemistry, 30(12), 4005-4009.
Li C.-Y. et al., 2010. Toxicity of Jatropha curcas phorbol esters in mice. Food Chem. Toxicol., 48, 620-626.
Liener I.E., 1979. The nutritional significance of plant protease inhibitors. Proc. Nutr. Soc., 38(1), 109-113.
Luo M.J. et al., 2007. Cloning, expression, and antitumor activity of recombinant protein of curcin. Russ. J. Plant Physiol., 54(2), 202-206.
Makkar H.P.S., Becker K., Sporer F. & Wink M., 1997. Studies on nutritive potential and toxic constituents of different provenances of Jatropha curcas. J. Agric. Food Chem., 45, 3152-3157.
Makkar H.P.S., Aderibigde A.O. & Becker K., 1998. Comparative evaluation of non-toxic and toxic varieties of Jatropha curcas for chemical composition, digestibility, protein degradability and toxic factors. Food Chem., 62(2), 207-215.
Makkar H.P.S. & Becker K., 2009a. Jatropha curcas, a promising crop for the generation of biodiesel and value-added coproducts. Eur. J. Lipid Sci. Technol., 111(8), 773-787.
Makkar H.P.S., Maes J., De Greyt W. & Becker K., 2009b. Removal and degradation of phorbol ester during pre-treatment and transesterification of Jatropha curcas oil. J. Am. Oil Chem. Soc., 86(2), 173-181.
Marshall G.T., Klocke J.A., Lin L.-J. & Kinghorn A.D., 1985. Effects of diterpene esters of tigliane, daphnane, and lathyrane types on pink bollworm, Pectinophora gossipiella saunders (Lepidoptera: gelechiidae). J. Chem. Ecol., 11(2), 191-206.
Martinez-Herrera J. et al., 2006. Chemical composition, toxic/antimetabolic constituents, and effects of different treatments on their levels, in four provenances of Jatropha curcas L. from Mexico. Food Chem., 96, 80-89.
Millard C.B. & Leclaire R.D., 2008. Ricin and related toxins: review and perspective. In: Romano J.A., Lukey B.J. & Salem H., eds. Chemical warfare agents: chemistry, pharmacology, toxicology, and therapeutics. 2nd ed. Boca Raton, FL, USA: CRC Press LLC, 423-467.
Rackis J.J. & Gumbmann M.R., 1981. Protease inhibitors: physiological properties and nutritional significance. In: Ory R.L. Antinutrients and natural toxicants in foods. Westport, CT, USA: Food and Nutrition Press.
Rakshit K.D. et al., 2008. Toxicity studies of detoxified Jatropha meal (Jatropha curcas) in rats. Food Chem. Toxicol., 46(12), 3621-3625.
Raven P.H., Evert R.F. & Eichhorn S.E., 2003. Biologie végétale. Bruxelles : De Boeck Université.
Rug M. & Ruppel A., 2000. Toxic activities of the plant Jatropha curcas against snail hosts and larvae of schistosomes. Trop. Med. Int. Health, 5(6), 423-430.
Ryan C.A., 1990. Protease inhibitors in plants: genes for improving defenses against insects and pathogens. Annu. Rev. Phytopathol., 28, 425-449.
Seigler D.S., 1998. Plant secondary metabolism. Norwell, MA, USA: Kluwer Academic Publishers.
Silinsky E.M. & Searl T., 2003. Phorbol esters and neurotransmitter release: more than just protein kinase C? Br. J. Pharmacol., 138(7), 1191-1201.
Staubmann R. et al., 1997. Biogas production from Jatropha curcas press-cake. Appl. Biochem. Biotechnol., 63-65(1), 457-467.
Stirpe F. & Barbieri L., 1986. Ribosome-inactivating proteins up to date. FEBS Lett., 195(1-2), 1-8.
Stirpe F. & Battelli M.G., 2006. Ribosome-inactivating proteins: progress and problems. Cell. Mol. Life Sci., 63(16), 1850-1866.
Vollhart K.P.C. & Schore N.E., 2004. Traité de chimie organique. Bruxelles : De Boeck Université.
Para citar este artículo
Acerca de: Thierry Daniel Tamsir Nesseim
Université de Thiès. École Nationale Supérieure d’Agriculture. Département Productions animales. Route de Khombole km 3. BP A 296. SN-Thiès (Sénégal). E-mail : tnesseim@univ-thies.sn – Univ. Liège. Faculté de Médecine vétérinaire. Département de Productions animales. Boulevard de Colonster, 20. B-4000 Liège (Belgique).
Acerca de: Marianne Fillet
Univ. Liège. Faculté de Médecine. Département de Pharmacie. Avenue de l’Hôpital, 1. B-4000 Liège (Belgique).
Acerca de: Guy Mergeai
Univ. Liège - Gembloux Agro-Bio Tech. Département Phytotechnie tropicale et Horticulture. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Acerca de: Abdoulaye Dieng
Université de Thiès. École Nationale Supérieure d’Agriculture. Département Productions animales. Route de Khombole km 3. BP A 296. SN-Thiès (Sénégal).
Acerca de: Jean-Luc Hornick
Univ. Liège. Faculté de Médecine vétérinaire. Département de Productions animales. Boulevard de Colonster, 20. B-4000 Liège (Belgique).






