- Accueil
- Volume 17 (2013)
- numéro 1
- Stockage de carbone et flux de gaz à effet de serre en prairie (synthèse bibliographique)
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Stockage de carbone et flux de gaz à effet de serre en prairie (synthèse bibliographique)

Notes de la rédaction
Reçu le 13 février 2012, accepté le 14 novembre 2012
Résumé
Dans l’optique d’une atténuation des émissions de Gaz à Effet de Serre (GES) des systèmes d’élevage, les écosystèmes prairiaux peuvent jouer un rôle important vu leur potentiel de séquestration de carbone (C) dans les sols. Une évaluation pertinente de la contribution des systèmes d’élevage herbivores aux émissions de GES nécessite donc de raisonner en termes de bilan, en considérant à la fois les sources de GES et leur compensation via la séquestration de carbone par les prairies. Cette synthèse, basée sur des résultats expérimentaux recensés dans la littérature, fait apparaitre l’importance de considérer conjointement les flux des trois principaux GES : dioxyde de carbone (CO2), protoxyde d’azote (N2O), méthane (CH4). De plus, les bilans de C et de GES des parcelles présentent une grande variabilité, essentiellement liée aux conditions pédoclimatiques et aux modes de gestion. Cet article souligne la nécessité de poursuivre les mesures à l’échelle de la parcelle et ce, pendant suffisamment d’années, de manière à établir des bilans robustes et intégrant la variabilité interannuelle. Enfin, il met en évidence la nécessité d’améliorer la compréhension des mécanismes contrôlant les différents échanges, en relation avec les facteurs environnementaux et les modes de gestion et ce, afin de pouvoir proposer des itinéraires techniques capables de maintenir un puits de carbone minimum, tout en limitant les émissions de méthane et de protoxyde d’azote.
Abstract
Carbon sequestration and greenhouse gas fluxes in grassland. A review. Grassland carbon (C) sequestration can play an important role in mitigating total greenhouse gas (GHG) emissions of livestock production systems. An accurate inventory of livestock production system contribution to GHG emissions requires to think in terms of global budget, by considering both the GHG sources and the mitigation potential trough grassland soil carbon sequestration. There is a huge variability in C and GHG balances of grasslands that is mainly due to management practices and climatic conditions. The present article shows that, to reduce the uncertainties of the results, long term measurements at the field scale are necessary. Also, it shows the importance of taking into account the fluxes of the three main GHGs (carbon dioxide, nitrous oxide, methane) into account when calculating the GHG budget. This article also highlights the need for a better understanding of the mechanisms driving the fluxes, in relation to environmental factors and management practices, in order to propose mitigation strategies able to enhance soil carbon sequestration in soils and to reduce methane and nitrous oxide emissions.
Table des matières
1. Introduction
1L’agriculture a pour vocation première de satisfaire les besoins alimentaires des citoyens. Pourtant, à l’heure actuelle, le secteur agricole et plus particulièrement les systèmes d’élevage sont perçus comme étant préjudiciables à l’environnement (FAO, 2006). En effet, ces systèmes de production généreraient, tenant compte des émissions directes et indirectes, pratiquement 20 % des émissions anthropiques totales de gaz à effet de serre (GES) (FAO, 2006). Ce chiffre comprend les émissions de l’ensemble de la filière, depuis la production des aliments en amont jusqu’à la fabrication et le transport des produits alimentaires en aval (FAO, 2006). Plus spécifiquement, les systèmes d’élevage seraient responsables de 9 % des émissions anthropiques de dioxyde de carbone (CO2), 65 % des émissions anthropiques de protoxyde d’azote (N2O) et 37 % des émissions anthropiques de méthane (CH4) (FAO, 2006). Il apparait donc essentiel de développer des systèmes de production capables de répondre aux impératifs d’atténuation des émissions et d’adaptation aux changements climatiques.
2Dans les systèmes d’élevage, les prairies permanentes sont souvent utilisées pour fournir du fourrage aux ruminants, soit directement durant la saison de pâturage, soit sous forme de foin ou d’ensilage durant la période hivernale (Flechard et al., 2007). Le potentiel de séquestration de carbone (C) dans le sol de ces écosystèmes pérennes leur permet de jouer un rôle important dans l’atténuation des émissions de GES (Soussana et al., 2007 ; Schulze et al., 2009 ; Soussana et al., 2010). De fait, la séquestration de C des prairies permanentes a été estimée par Lal (2004) entre 0,01 et 0,3 Gt C par an, ce qui pourrait compenser jusqu’à 4 % des émissions globales de GES (Soussana et al., 2010). Il apparait donc primordial de raisonner en termes de bilan, en considérant à la fois les sources de GES et leur compensation via les puits de carbone. Une évaluation pertinente des systèmes d’élevage nécessite donc en premier lieu l’établissement du bilan de carbone et de GES à l’échelle de la parcelle.
3L’objectif de cet article est de faire l’état des connaissances relatives au rôle des écosystèmes prairiaux dans le bilan de GES des exploitations d’élevage. Dans cette optique, nous mettrons en évidence le potentiel de séquestration de carbone des prairies et leur importance dans l’atténuation du bilan de GES. De même, nous montrerons qu’une approche globale, estimant conjointement les flux de carbone et des trois principaux GES à l’échelle de la prairie en relation avec les facteurs environnementaux et les modes de gestion est indispensable lors de l’étude des bilans des parcelles. Pour ce faire, nous décrirons les processus à l’origine des flux de carbone et de GES à l’échelle de la parcelle, ainsi que leurs facteurs influents. Nous quantifierons ces flux sur base des résultats expérimentaux recensés dans la littérature et nous établirons les bilans de carbone et de GES à l’échelle de la parcelle à partir des mesures de ces flux. Finalement, en nous appuyant sur l’analyse des résultats expérimentaux des bilans publiés dans la littérature, nous identifierons les verrous en termes de connaissance et de méthodologie qui devraient faire l’objet de futures recherches.
2. Flux de gaz à effet de serre à l’échelle d’un écosystème prairial
4Les prairies contribuent à l’échange de nombreux composés gazeux avec l’atmosphère (Soussana et al., 2006) dont les trois principaux gaz à effet de serre qui sont par ordre d’importance : le CO2 échangé avec le sol et la végétation, le N2O et le CH4, tous deux échangés avec le sol (Soussana et al., 2007). En prairie gérée et pâturée s’ajoutent les flux de carbone et de GES liés à la présence des ruminants et à la fertilisation (Soussana et al., 2006). Tous ces flux sont présentés à la figure 1. Le bilan de GES (NGHG, g CO2 équivalents·m-2·an-1) d’un écosystème prairial s’écrit (GIEC, 2007) :
5NGHG = kCO2 x (NBP – FCH4-C) + PRGN2O x FN2O + PRGCH4 x FCH4 (Équation 1)
6où kCO2 est le rapport des masses molaires du CO2 et du carbone (44/12 g CO2-C) ; NBP est la productivité nette du biome (g C·m-2·an-1) ; FN2O est le flux de N2O (g N2O ·m-2·an-1) et FCH4 le flux de CH4 (g CH4·m-2·an-1). La NBP correspondant au bilan des flux de C aux frontières du système (parcelle), elle inclut les flux de CH4 qui doivent donc être soustraits du premier terme pour éviter une double comptabilisation dans le bilan de GES. Les flux de N2O et de CH4 sont exprimés en termes d’équivalents CO2 (CO2 equiv.) en effectuant le produit de la masse de chaque gaz et de son pouvoir de réchauffement global (PRG). Ce facteur permet de comparer, sur une période de temps définie, le forçage radiatif d’un kg de GES donné par rapport à celui d’un kg de CO2. Sur une échelle de 100 ans, le PRG du N2O (PRGN2O) est de 298 et le PRG du CH4 (PRGCH4) est de 25 (GIEC, 2007).
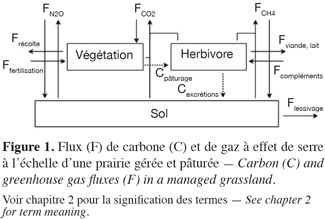
7Par convention, les flux d’importation (entrées) dans le système sont comptés négativement et les flux d’exportation (sorties) positivement. Les flux de C, N2O et CH4 sont étudiés spécifiquement aux paragraphes 2.1, 2.2 et 2.3 respectivement.
2.1. Flux de dioxyde carbone et de carbone organique
8Les végétaux chlorophylliens d’un écosystème prairial absorbent du CO2 par photosynthèse. La quantité de carbone assimilée constitue la productivité primaire brute (GPP). La respiration totale de l’écosystème (TER) correspond au CO2 réémis par les végétaux, le sol et les êtres vivants (microfaune, petits mammifères). La différence entre ces deux flux opposés est appelée l’échange net de l’écosystème (FCO2) (Chapin et al., 2006 ; Moureaux et al., 2008).
9En prairie (pâturée et/ou fauchée), la nature, la fréquence et l’intensité des interventions culturales jouent un rôle primordial dans le bilan de carbone (Soussana et al., 2004 ; Soussana et al., 2010). Ces interventions induisent notamment des exportations (fauche, production de lait et de viande), des importations (fertilisation organique, compléments alimentaires au bétail) et des flux internes (flux liés au pâturage) de carbone. Dans un régime de fauche, la majeure partie de la productivité primaire est exportée sous forme de foin ou d’ensilage (Frécolte). À l’opposé, les applications de fumier et de lisier, provenant le plus souvent de l’exploitation même, constituent des apports de carbone (Ffertilisation) (Soussana et al., 2010). Sous un pâturage intensif, jusqu’à 60 % de la biomasse sèche au-dessus du sol est ingérée par le bétail (Cpâturage). Ce chiffre peut être plus faible en pâturage extensif (Soussana et al., 2010). Lorsque cela s’avère nécessaire, de la nourriture complémentaire peut être apportée au bétail. Ces entrées constituent donc des apports de carbone (Fcompléments ; Mudge et al., 2011). La plus grande partie du carbone organique ingéré par le bétail au pâturage est digestible (jusqu’à 75 % pour des fourrages très digestes) et est respirée peu de temps après l’ingestion (respiration du bétail, terme faisant partie de la TER) (Jungbluth et al., 2001 ; Soussana et al., 2007 ; Sauvant et al., 2009). Par voie de conséquence, seule une faible part du carbone ingéré est exportée sous forme de viande (Fviande : 0,6 % de Cpâturage ; Allard et al., 2007 – 4,3 % de Cpâturage ; Sauvant et al., 2009) ou de lait (Flait : 4 à 21 % de Cpâturage ; Jaksic et al., 2006 ; Faverdin et al., 2007 ; Lassey, 2007). Le carbone non digestible (de 25 à 40 % de l’ingéré selon la digestibilité de l’herbe) retourne au sol sous forme d’excrétions, principalement des fèces (Cexcrétions) (Soussana et al., 2007). Des pertes additionnelles (de 3 à 8 % suivant la digestibilité du fourrage ; Pinares-Patino et al., 2003 ; Lassey, 2007 ; Martin et al., 2010) ont aussi lieu sous forme de méthane lors de la fermentation entérique (FCH4-C, voir § 2.3.). Une partie du carbone importé peut également être dissoute dans l’eau et lessivée (Flessivage) (Kindler et al., 2011). Finalement, s’il n’est pas lessivé, respiré par le sol, la végétation ou le bétail, exporté lors de la fauche, de la traite ou de l’abattage, le carbone assimilé par la prairie ou apporté sous forme d’effluents peut être stocké dans le sol. Ces flux de stockage, s’ils sont relativement faibles en valeur instantanée, s’accumulent sur de longues périodes, ce qui explique que les prairies permanentes présentent des stocks élevés de carbone, principalement localisé dans les racines et le sol (Jones et al., 2004 ; Soussana et al., 2004).
10Les variations du stock de carbone d’un écosystème prairial peuvent s’obtenir en réalisant le bilan des différents flux à l’échelle de la parcelle (Productivité nette du Biome, NBP, g C·m-2·an-1 voir Équation 2). Cette approche nécessite de prendre en compte non seulement les flux de GES échangés entre l’écosystème et l’atmosphère (FCO2, FCH4-C), mais également les flux de C organique aux frontières de la parcelle :
11NBP = FCO2 + FCH4-C + Ffertilisation + Fcompléments + Frécolte + Fviande, lait + Flessivage (Équation 2)
12Des évaluations de l’échange net de CO2 (FCO2) des prairies au moyen de techniques micro-météorologiques sont en cours depuis plusieurs années en Europe (Jaksic et al., 2006 ; Gilmanov et al., 2007 ; Soussana et al., 2007 ; Klumpp et al., 2011a). Les études de synthèse montrent que les prairies européennes se comportent en moyenne comme des puits nets de CO2-C, d’une intensité comparable à celle des forêts tempérées (Gilmanov et al., 2007 ; Soussana et al., 2007 ; Schulze et al., 2009 ; tableau 1).

13Comme les exportations de carbone organique (FCH4-C + Frécolte + Fviande, lait + Flessivage) sont supérieures aux importations (Ffertilisation + Fcompléments), leur prise en compte dans le bilan de carbone réduit la séquestration nette. Même si ces flux peuvent constituer une part non négligeable du bilan, la tendance à la séquestration n’est pas inversée et les prairies se comportent en moyenne comme des puits de carbone (Tableau 1). Toutefois, la variabilité intersite est très importante vu les différences de conditions pédoclimatiques et de mode de gestion. Le tableau 2 présente une revue de la littérature d’études étudiant l’impact sur le bilan :
14i. du mode de gestion,
15ii. des conditions pédologiques,
16iii. des conditions climatiques,
17iv. du mode de gestion en interaction avec la variabilité climatique.
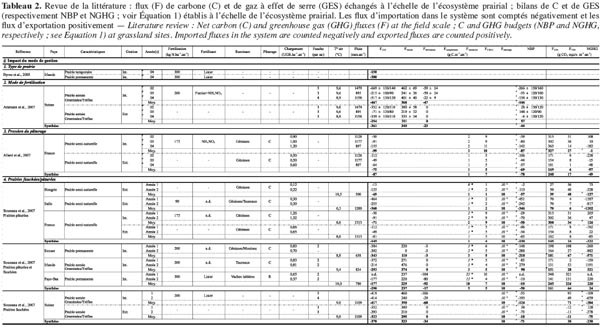
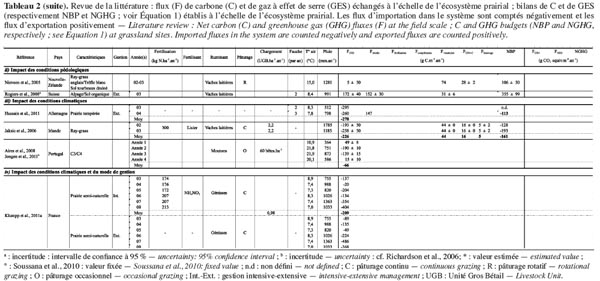
18Ce tableau synthétise les résultats des études décrites dans le paragraphe suivant.
19Le mode de gestion implique le type de prairie (prairies permanentes ou non : Byrne et al., 2005), le mode de fertilisation (Ammann et al., 2007) ou encore la pression du pâturage (Allard et al., 2007). Soussana et al. (2007) ont montré que si le puits de carbone était plus important en prairie pâturée qu’en prairie fauchée, son importance diminuait toutefois avec l’intensité d’utilisation de l’herbe à travers la fauche ou le pâturage. Allard et al. (2007) ont confirmé ce résultat en montrant que la séquestration de carbone par unité de surface était favorisée par une gestion plus extensive à condition que les nutriments ne soient pas limitants. D’autres auteurs (Nieveen et al., 2005 ; Rogiers et al., 2008) ont également montré que toutes les prairies ne se comportaient pas comme des puits mais que, selon les conditions pédologiques du sol (sol organique, sol tourbeux), elles pouvaient devenir des sources nettes de carbone. Au-delà de la variabilité intra et intersite, la variabilité interannuelle liée aux conditions climatiques (précipitations, température et rayonnement) peut également être importante. Certaines études ont analysé ponctuellement l’impact des conditions extrêmes sur les bilans de carbone en prairies (Suyker et al., 2003 ; Ciais et al., 2005 ; Harper et al., 2005 ; Jaksic et al., 2006 ; Ammann et al., 2007 ; Aires et al., 2008 ; Heimman et al., 2008 ; Teuling et al., 2010 ; Hussain et al., 2011 ; Jongen et al., 2011) et ont montré que des vagues de chaleur et des conditions sévères de sècheresse entrainaient une diminution de la séquestration de carbone, voire même une inversion des puits en sources. À plus long terme, ces effets dépendraient néanmoins du mode de gestion. En effet, Klumpp et al. (2011a), en analysant les flux de CO2 de deux parcelles adjacentes soumises à un mode de gestion différencié, ont montré que la séquestration de carbone était d’autant moins sensible aux épisodes de sècheresse que les prairies étaient soumises à une gestion plus intensive.
20À l’heure actuelle, l’analyse des variations intra et interannuelles des flux de C de parcelles soumises aux mêmes conditions pédoclimatiques mais à un mode de gestion différencié est encore trop peu documentée (Allard et al., 2007 ; Ammann et al., 2007 ; Jacobs et al., 2007 ; Schmitt et al., 2010 ; Klumpp et al., 2011a). Même si ces études requièrent une infrastructure lourde, elles sont primordiales car elles permettent de cerner avec plus de certitudes l’impact des modes de gestion en interaction avec la variabilité climatique. Une meilleure compréhension des interactions climat-gestion permettrait de mieux comprendre les mécanismes contrôlant le potentiel de séquestration de C et donc d’identifier des pratiques agricoles favorisant la séquestration de carbone tout en tenant compte des effets des changements climatiques (Klumpp et al., 2011a). Enfin, si les flux de carbone autres que FCO2 constituent une part non négligeable du bilan, seul un nombre limité d’études ont établi un bilan carboné complet à l’échelle de la parcelle (plus particulièrement pour des prairies pâturées, voir tableau 2). De plus, ces flux ne sont généralement pas mesurés mais évalués sur base de données bibliographiques. Une meilleure connaissance de l’ampleur de ces différents flux (notamment Fleach ; Kindler et al., 2011) et des facteurs régissant les échanges est nécessaire et faciliterait le développement de pratiques de gestion favorisant la séquestration de C.
2.2. Flux de protoxyde d’azote
21La formation biogénique de N2O dans les sols des prairies résulte essentiellement des processus microbiologiques de nitrification et de dénitrification (Figure 2). La nitrification est l’oxydation, en conditions aérobies, de l’ion ammonium (NH4+) en nitrites (NO2-) et nitrates (NO3-) respectivement sous l’action de bactéries nitreuses et nitrifiantes. Le N2O est un sous-produit de la nitrification. La dénitrification est la réduction, sous l’action de bactéries dénitrifiantes et en conditions anaérobies, des ions nitrates en ions nitrites, oxyde nitrique (NO), N2O et finalement diazote (N2). Le N2O est donc un intermédiaire de la dénitrification qui est produit si le taux d’oxygène (O2) est suffisant pour satisfaire les besoins des bactéries du sol, la dénitrification s’arrêtant alors à ce stade. Le N2O peut alors être consommé par les bactéries dénitrifiantes du sol. Parfois, la consommation de N2O par le sol est supérieure à la production, le sol agit alors comme un puits de N2O (Flechard et al., 2005 ; Chapuis-Lardy et al., 2007 ; Neftel et al., 2007). Les émissions de N2O dues à la dénitrification sont généralement considérées comme étant plus importantes que celles induites par nitrification (Skiba et al., 2000). La production de N2O dans les sols est fortement influencée par la disponibilité en N minéral (NH4+ et NO3-), la température mais aussi par des facteurs altérant le potentiel d’oxydoréduction du sol comme l’humidité, la texture et le C organique du sol (Skiba et al., 2000 ; Saggar et al., 2004a ; Flechard et al., 2007 ; Cantarel et al., 2011). De plus, des pratiques agricoles comme le labour, la compaction, l’irrigation et le drainage, en influençant les conditions physiques du sol (i.e. aération et contenu en eau) affectent la production et le transport du N2O (Yamulki et al., 2002).
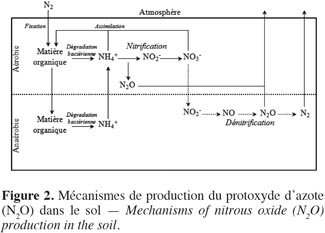
22Les émissions de N2O sont caractérisées par une extrême variabilité spatiale liée à l’hétérogénéité des sols, de la répartition de la matière organique, des sites anoxiques et des apports d’azote (Mathieu et al., 2006). La variabilité temporelle (intra et interannuelle) est également très élevée, en relation avec la variabilité climatique. Les travaux de Flechard et al. (2007) ont montré que près de 50 % de la variabilité temporelle des émissions de N2O pouvait être expliquée par la température et l’humidité du sol, avec des émissions augmentant dans des environnements chauds et humides. Des pics d’émission d’une durée de quelques jours et d’une intensité nettement supérieure aux émissions quotidiennes ont été également observés en périodes de gel-dégel ou après des épisodes de précipitations (Leahy et al., 2004 ; Flechard et al., 2005). Cela s’explique par l’occurrence temporaire de conditions anoxiques favorisant la dénitrification (Soussana et al., 2006). Le reste du temps, de faibles émissions, voire même une assimilation, ont été mesurées (Flechard et al., 2005 ; Chapuis-Lardy et al., 2007 ; Neftel et al., 2007). Vu leur continuité dans le temps, ces faibles flux ne peuvent être négligés dans les bilans annuels (Conen et al., 2007).
23En prairie, une fertilisation azotée, sous forme d’engrais minéraux de synthèse (nitrates, nitrates d’ammonium, urée, etc.) ou organiques (fumier ou lisier), est souvent nécessaire pour soutenir la productivité (Flechard et al., 2007). Si les conditions de sol sont optimales à la production de N2O, ces apports d’azote stimulent alors rapidement les émissions (Skiba et al., 2000 ; Leahy et al., 2004 ; Flechard et al., 2007). Pour un sol et des conditions climatiques donnés, les émissions de N2O induites par la fertilisation sont fortement liées aux quantités d’azote apporté (Skiba et al., 2000 ; Jones et al., 2007 ; Soussana et al., 2010). Les émissions dépendent également de la forme de l’azote épandu (minéral/organique : Barton et al., 2001 ; Jones et al., 2007, voir tableau 3), de la forme de l’engrais (solide/liquide : Saggar et al., 2004b) et des conditions climatiques avant (humidité du sol) et après apport (température et pluviométrie) (Saggar et al., 2004b ; Flechard et al., 2007 ; Jones et al., 2007). Les émissions sont aussi très variables dans le temps et fonction de la nature du sol, de sa teneur en eau et de sa capacité à réduire le N2O en N2 (Skiba et al., 2000 ; Saggar et al., 2004b). Des pics d’émission ont ainsi été observés directement après les épandages et pouvaient durer de quelques heures à quelques jours pour ensuite retomber à des valeurs de bruits de fond une fois le substrat appauvri en azote (Skiba et al., 2000 ; Leahy et al., 2004).
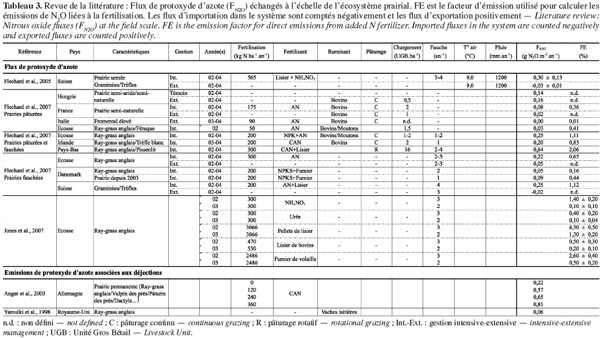
24Au pâturage, le retour d’azote au sol sous forme de matières fécales et d’urine augmente fortement la concentration d’azote et de carbone disponible et constitue donc une source potentielle de N2O (Yamulki et al., 1998 ; Yamulki et al., 2000). Simon et al. (1998) ont estimé les pertes sous forme de N2O à 2 % de l’azote présent dans les déjections. Les émissions sont fortement variables dans l’espace et dans le temps, vu la distribution non uniforme des excrétions et la variabilité de la charge en bétail et des conditions climatiques au moment du rejet (Anger et al., 2003 ; Saggar et al., 2004b ; Saggar et al., 2007). À l’instar des émissions liées à la fertilisation, des pics d’émissions ont été mesurés de 10 à 15 jours après les rejets d’urine (Flessa et al., 1996 ; Yamulki et al., 1998). Pour les fèces, cette durée pouvait varier de 10 jours à 4 mois après la déposition (Yamulki et al., 1998). Selon Saggar et al. (2004b), la variabilité des émissions est d’autant plus grande que les conditions de sol (teneur en eau) sont favorables à la production de N2O. Au-delà des émissions engendrées par les rejets de matières fécales et d’urine, le bétail, en piétinant le sol, modifie ses propriétés (aération et teneur en eau) et favorise donc les conditions anaérobies nécessaires à la dénitrification (Saggar et al., 2004a ; Saggar et al., 2004b ; Flechard et al., 2007). Cela accroit la variabilité spatiale et temporelle des émissions.
25Actuellement, les méthodes d’estimation considèrent que les émissions annuelles de N2O à l’échelle de la parcelle sont proportionnelles aux apports d’azote. Le Groupe Intergouvernemental d’Étude du Climat (GIEC) préconise l’utilisation d’un facteur d’émission moyen de 1,25 % (0,25-2,25 %) (GIEC, 2001). Ce facteur a néanmoins été remis en cause ces dernières années notamment par Flechard et al. (2007) qui ont proposé un facteur annuel moyen largement inférieur de 0,72 % (0,01-3,56 %). Ces facteurs globaux d’émission peuvent néanmoins fortement varier, entrainant de larges incertitudes qui peuvent aller jusqu’à 50 % des estimations globales à l’échelle de la parcelle (Flechard et al., 2007 ; voir tableau 3). Ces incertitudes résultent essentiellement de la variabilité spatiale et temporelle des émissions, de leur nature sporadique et des limitations des méthodes de mesures (Skiba et al., 2000 ; Saggar et al., 2004b ; Flechard et al., 2007 ; Jones et al., 2011). Selon Flechard et al. (2007), il est essentiel de poursuivre les mesures à long terme à l’échelle de la parcelle afin de réduire ces incertitudes. Jones et al. (2011) recommandent d’ailleurs de mesurer les flux de N2O à l’échelle de la parcelle d’une part, à l’aide de mesures en chambre, afin de mieux comprendre et quantifier les processus contrôlant les flux et d’autre part, à l’aide de techniques micro-météorologiques, afin de pouvoir tenir compte de la variabilité spatiale et temporelle des flux. Ils soulignent également le fait qu’il est nécessaire de mettre en place des protocoles de mesures standardisés pour l’ensemble de la communauté scientifique afin de réduire les incertitudes portant sur les mesures et sur les facteurs globaux d’émission.
2.3. Flux de méthane
26Flux de méthane échangé avec le sol. Dans les sols, le méthane se forme naturellement en conditions anaérobies lors de la dégradation de la matière organique par les micro-organismes méthanogènes. Les émissions de méthane des prairies naturellement drainées sont par conséquent négligeables (Soussana et al., 2010). Par contre, sous l’action de bactéries méthanotrophes qui oxydent en CO2 le méthane atmosphérique, les sols des prairies aérobies peuvent devenir des puits de méthane (Boeckx et al., 2001). La capacité d’oxydation d’un sol prairial dépend notamment de sa température et de son humidité. Ainsi, le taux d’oxydation est plus important en été, lorsque les sols sont chauds et secs et le taux de saturation en eau des pores du sol faible (Saggar et al., 2007). Le taux d’oxydation dépend également du mode de gestion de la parcelle. Plus particulièrement, Li et al. (2007) et Saggar et al. (2007) ont montré que la présence du bétail et, par conséquent, le taux de chargement, tendent à diminuer la capacité d’oxydation des sols prairiaux. Cela serait dû aux rejets d’urine sur le sol qui inhibent l’activité enzymatique des bactéries méthanotrophes, mais également au bétail qui, en piétinant le sol, modifie ses propriétés et favorise les conditions anaérobies (Li et al., 2007 ; Saggar et al., 2007). Les résultats de ces deux études sont présentés au tableau 4.
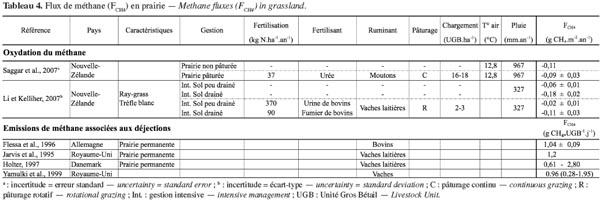
27Au pâturage, les matières fécales fraichement émises par le bétail sont une source potentielle de méthane. En effet, elles constituent un substrat chaud, humide, contenant des micro-organismes et des réserves de carbone facilement fermentescibles (Jarvis et al., 1995 ; Saggar et al., 2004b). Ces émissions sont influencées par la quantité de matières fécales excrétées, elle-même liée au type et à la quantité de nourriture ingérée (Jarvis et al., 1995 ; Saggar et al., 2004b), par la charge en bétail et la durée du pâturage. La forme des excrétions (solide/liquide), leur taille ainsi que le laps de temps pendant lequel elles restent intactes avant d’être décomposées sont aussi des facteurs déterminants (Saggar et al., 2004b). Les conditions climatiques et de sol jouent également un rôle non négligeable. Ainsi, des précipitations élevées, entrainant des conditions de sol humides, empêchent les matières fécales de sécher et maintiennent un environnement anaérobie, propice à la formation de méthane (Holter, 1997 ; Yamulki et al., 1999). À l’instar des émissions de N2O, les émissions de méthane liées aux matières fécales sont très variables dans le temps et dans l’espace (Saggar et al., 2004b). Des pics d’émissions ont en effet été mesurés directement après l’excrétion pour finalement retomber à des valeurs de bruit de fond après 10 à 20 jours (Jarvis et al., 1995 ; Flessa et al., 1996 ; Holter, 1997). Le tableau 4 synthétise les résultats recensés dans la littérature. En plus des émissions de méthane du sol liées aux déjections animales, il faut également tenir compte des émissions liées à la fertilisation organique. Le principal facteur déterminant l’ampleur de la production de méthane est la quantité de matière organique disponible dans les effluents (Saggar et al., 2004b). Tout comme les émissions de N2O, des pics d’émissions ont été mesurés directement après les épandages, suite au dégagement des gaz entrainés durant le stockage (Saggar et al., 2004b). Ces émissions interviennent toutefois pour une part très faible dans le bilan.
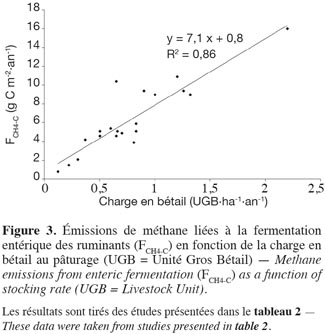
28Émissions de méthane liées au processus de fermentation entérique. Les émissions de méthane par les ruminants sont dues à des réactions de fermentation dans le rumen, appelées fermentation entérique. Situé à l’entrée du tube digestif, le rumen est une large chambre anaérobie et fermentative qui contribue à 70 % de la totalité de la digestion de la biomasse végétale ingérée, principalement constituée de glucides (sucres, amidon, cellulose, hémicellulose, pectines). Le CH4 produit est évacué par la gueule ou les naseaux respectivement par éructation ou respiration. Les facteurs influençant les émissions sont liés d’une part à l’animal lui-même (race, type génétique, âge, poids, type de production animale et activité physique) et d’autre part, à la ration ingérée (quantité, composition chimique, digestibilité et interaction entres les aliments au sein de la ration) (Boadi et al., 2004 ; Vermorel et al., 2008 ; Martin et al., 2010). Cependant, à l’échelle de la parcelle, les émissions entériques par unité de surface dépendent principalement du nombre d’animaux (Soussana et al., 2010) et augmentent donc avec la charge en bétail (Allard et al., 2007 ; Soussana et al., 2007 ; voir tableau 2). Ce propos est illustré à la figure 3 qui présente l’évolution de FCH4-C avec la charge en bétail pour les études reprises dans le tableau 2.
3. Bilan de gaz à effet de serre à l’échelle de l’écosystème prairial
3.1. Méthode de mesures
29Pour mesurer les termes du bilan de GES à l’échelle de la parcelle (g CO2 equiv·m-2·an-1), différentes méthodes existent (Denmead, 2008). Le choix de l’une ou l’autre dépend des moyens techniques disponibles et des objectifs à atteindre (échelle de mesure, type de flux, etc.) (Soussana et al., 2006).
30La méthode des chambres (Klumpp et al., 2011b), simple d’un point de vue technique, est la méthode de mesure directe la plus souvent utilisée pour mesurer le flux net de GES. Dans une enceinte close placée sur la surface expérimentale (< 1 m²), le flux se déduit de l’augmentation sur plusieurs heures (chambre statique) ou de la pente de l’évolution temporelle sur quelques minutes de la concentration du gaz mesuré (chambre dynamique) dans la chambre. Les mesures étant représentatives du flux en un point de la surface d’étude et à un moment donné, il est nécessaire de multiplier les points de mesure (variabilité spatiale et temporelle). Les chambres automatiques, basées sur le principe de la chambre dynamique, peuvent fournir des mesures à haute résolution temporelle (toutes les demi-heures), mais leur extrapolation à l’échelle de la parcelle est difficile car les dispositifs ne couvrent qu’une faible superficie (Di Marco et al., 2004). Les mesures manuelles, utilisant un système portatif basé sur le même principe, permettent de prendre en compte la variabilité spatiale des flux mais n’ont pas une résolution temporelle suffisante pour rendre compte de la réponse du flux aux conditions météorologiques (Suleau et al., 2011). Dans ces conditions, le meilleur compromis consiste à utiliser simultanément les deux dispositifs (Moureaux et al., 2008 ; Suleau et al., 2011).
31À l’échelle de la parcelle, les mesures micro-météorologiques ont l’avantage à la fois de rendre compte de la variabilité temporelle et d’intégrer la variabilité spatiale. Ainsi, la méthode des fluctuations turbulentes consiste à mesurer le flux net en effectuant la moyenne semi-horaire des produits instantanés de la composante verticale de la vitesse du vent et de la concentration du gaz. Les bases théoriques et les modes de mise en œuvre de cette méthode de mesure ont été revus par Aubinet et al. (2012). Malgré les difficultés de réaliser ces mesures en continu et de développer des algorithmes d’évaluation des données manquantes (Falge et al., 2001), cette technique est celle qui fournit le taux de couverture de données le plus élevé. Elle permet donc un suivi à long terme des flux (de plusieurs mois à plusieurs années) avec une haute résolution temporelle et offre ainsi la possibilité de mieux cerner les épisodes d’émission ou de séquestration des GES, contrairement aux mesures par chambre. Cette méthode fournit également une évaluation des flux intégrée sur une grande surface (≈ 1 hectare) (Aubinet et al., 2012). Cette intégration a, d’une part, l’avantage de gommer la variabilité spatiale des flux et de fournir une estimation plus représentative de l’échange net de l’écosystème et, d’autre part, le désavantage de fournir un flux net qui résulte de la combinaison de processus distincts qu’il n’est pas toujours facile de distinguer. Par ailleurs, la zone d’empreinte du flux varie avec la direction du vent et les conditions de stabilité, ce qui rend la mesure difficilement interprétable sur des sites hétérogènes (Aubinet et al., 2012). Si la méthode de covariance de turbulence est actuellement la plus répandue pour mesurer en continu le flux net de CO2 échangé par les écosystèmes terrestres (Gilmanov et al., 2007 ; Soussana et al., 2007), elle est encore peu utilisée pour des composés tels que le N2O et le CH4 (Edwards et al., 2003 ; Leahy et al., 2004 ; Neftel et al., 2007 ; Skiba et al., 2009 ; Kroon et al., 2010 ; Neftel et al., 2010), du fait notamment du cout élevé des analyseurs.
3.2. Résultats des bilans à l’échelle de la parcelle
32Lorsqu'on s'intéresse au bilan de GES des prairies, une approche globale, estimant conjointement les flux de carbone et des trois principaux GES est indispensable. En effet, si les prairies se comportent en moyenne comme des puits de carbone, lorsqu’on intègre les émissions de N2O et de CH4 dans le bilan, la séquestration de GES diminue fortement, avec une contribution plus importante du CH4 (Soussana et al., 2007). Le tableau 2 synthétise les résultats recensés dans la littérature des bilans de C et, le cas échéant, de GES. Si, selon les études de Soussana et al. (2007), les prairies européennes étaient en moyenne des puits de GES, ces auteurs ont néanmoins souligné le fait qu’une forte variabilité pouvait exister entre sites et entre années, en relation avec la variabilité climatique et le mode de gestion. Ils ont notamment montré que les sites gérés de manière intensive par le pâturage et la fauche se comportaient comme des sources de GES.
33Puisque les modes de gestion sont un des principaux facteurs régissant les flux, les prairies possèdent un potentiel considérable d’atténuation des émissions (GIEC, 2007). Cependant, il faut éviter que l’adaptation d’un mode de gestion pour réduire les émissions d’un GES donné induise l’augmentation des émissions d’un autre (Six et al., 2004 ; Allard et al., 2007 ; Soussana et al., 2007 ; Vuichard et al., 2007a ; Vuichard et al., 2007b). Ainsi, des pratiques agricoles favorisant la séquestration de carbone (fertilisation, pâturage) pourraient engendrer des émissions supplémentaires de N2O et CH4, contrebalançant alors le puits de carbone (Soussana et al., 2010). Au contraire, Allard et al. (2007), en comparant les bilans de GES sur trois années de mesures de deux parcelles soumises à un mode de gestion différencié, ont montré que sous un mode de gestion plus extensif, la réduction de la charge en bétail et l’absence de fertilisation induisait une forte diminution des émissions de CH4 et N2O par unité de surface. Ces résultats sont synthétisés au tableau 2. Néanmoins, à court terme, ce mode de gestion semblait également réduire le potentiel de stockage de carbone dans le sol. En effet, contrairement à la parcelle intensive, la NBP et le puits de GES de la parcelle extensive diminuait au cours des trois années. Il faut remarquer que les incertitudes portant sur les résultats ne sont pas présentées dans l’étude. On peut cependant s’attendre à ce que les différences entres les deux bilans de GES soient plus faibles que les incertitudes elles-mêmes.
34S’il est manifeste que les flux de GES associés au mode de gestion et plus particulièrement au pâturage interviennent pour une part non négligeable dans les bilans de GES à l’échelle de la parcelle, leurs impacts à long terme sur les bilans sont néanmoins encore peu connus. Un compromis semble en effet nécessaire pour maintenir d’un côté une capacité de puits de carbone minimum tout en limitant de l’autre les émissions de N2O et CH4 (Allard et al., 2007 ; Soussana et al., 2007).
4. Conclusion
35Les changements climatiques s’imposent comme un nouveau défi à relever par l’agriculture, non seulement en termes d’atténuation des émissions de GES mais également en termes d’adaptation, car il ne peut y avoir de durabilité agricole et alimentaire sans durabilité environnementale. Cet article montre que, de par leur potentiel de séquestration de carbone dans les sols, les prairies permanentes peuvent jouer un rôle important dans l’atténuation des émissions de GES des systèmes d’élevage. Nous avons vu que les variations du stock de carbone du sol des prairies pouvaient se calculer en réalisant le bilan des flux à l’échelle de la parcelle. Cette méthode fournit une résolution temporelle élevée et les changements du stock de carbone du sol peuvent se détecter d’une année à l’autre. Les résultats présentés montrent une grande variabilité liée aux modes de gestion et aux conditions pédoclimatiques essentiellement. Soussana et al. (2007) insistent sur la nécessité de poursuivre et développer les analyses sur d’autres sites et ce, afin de réduire les incertitudes portant sur les résultats. Nous avons montré également qu’une approche globale, estimant conjointement l’ensemble des flux de C et de GES en relation avec les facteurs environnementaux et les modes de gestion, est indispensable afin d’identifier des pratiques de gestion capables de maintenir un puits de carbone minimum tout en limitant les émissions de N2O et de CH4. Enfin, même s’il existe un potentiel considérable d’atténuation des émissions de GES des systèmes d’élevage (GIEC, 2007), il n’existe pas de pratiques universellement transposables. Les stratégies de réduction doivent donc être évaluées de manière individuelle. Elles doivent également intégrer les paramètres environnementaux (l’eau, le sol, la biodiversité, etc.) et les enjeux économiques et sociaux de l’activité agricole de la région étudiée pour contribuer de cette manière à la durabilité des systèmes d’élevage.
36Remerciements
37Cette étude est financée par le Service public de Wallonie - Direction Générale Opérationnelle de l’Agriculture, des Ressources naturelles et de l’Environnement - Département du Développement - Direction de la Recherche - Belgique. Projet D31-1235.
Bibliographie
Aires L.M., Pio C.A. & Pereire J.S., 2008. Carbon dioxide exchange above a Mediterranean C3/C4 grassland during two climatologically contrasting years. Global Change Biol., 14, 539-555.
Allard V. et al., 2007. The role of grazing management for the net biome productivity and greenhouse gas budget (CO2, N2O and CH4) of semi-natural grassland. Agric. Ecosyst. Environ., 121, 47-58.
Ammann C. et al., 2007. The carbon budget of newly established temperate grassland depends on management intensity. Agric. Ecosyst. Environ., 121, 5-20.
Anger M., Hoffmann C. & Kühbauch W., 2003. Nitrous oxide emissions from artificial urine patches applied to different N‐fertilized swards and estimated annual N2O emissions for differently fertilized pastures in an upland location in Germany. Soil Use Manage., 19(2), 104‐111.
Aubinet M., Vesala T. & Papale D., 2012. Eddy covariance: a practical guide to measurements and data analysis. Springer verlag.
Barton L. & Schipper L.A., 2001. Regulation of nitrous oxide emissions from soils irrigated with dairy farm effluent. J. Environ. Qual., 30, 1881-1887.
Boadi D., Benchaar C., Chiquette J. & Massé D., 2004. Mitigation strategies to reduce enteric methane emissions from dairy cows: update review. Can. J. Anim. Sci., 84(3), 319‐335.
Boeckx P. & Van Cleemput O., 2001. Estimates of N2O and CH4 fluxes from agricultural lands in various regions in Europe. Nutr. Cycling Agroecosyst., 60, 35-47.
Byrne K.A., Kiely G. & Leahy P., 2005. CO2 fluxes in adjacent new and permanent temperate grasslands. Agric. Forest Meteorol., 135, 82-92.
Cantarel A., Bloor J., Deltroy N. & Soussana J.F., 2011. Effects of climate change drivers on nitrous oxide fluxes in an upland temperate grassland. Ecosystems, 14, 223-233.
Chapin III F.S. et al., 2006. Reconciling carbon-cycle concepts, terminology, and methods. Ecosystems, 9, 1041-1050.
Chapuis-Lardy L. et al., 2007. Soils, a sink for N2O? A review. Global Change Biol., 13, 1-17.
Ciais P. et al., 2005. Europe-wide reduction in primary productivity caused by the heat and drought in 2003. Nature, 437, 529-533.
Conen F. & Neftel A., 2007. Do increasingly depleted δ15N values of atmospheric N2O indicate a decline in soil N2O reduction? Biogeochemistry, 82, 321-326.
Denmead O.T., 2008. Approaches to measuring fluxes of methane and nitrous oxide between landscapes and the atmosphere. Plant Soil, 309(5), 5-24.
Di Marco C. et al., 2004. Field scale N2O flux measurements from grassland using eddy covariance. Water Air Soil Pollut. Focus, 4, 143-149.
Edwards G.C. et al., 2003. A diode laser based gas monitor suitable for measurement of trace gas exchange using micrometeorological technique. Agric. Forest Meteorol., 115, 71-89.
Falge E. et al., 2001. Gap filling strategies for defensible annual sums of net ecosystem exchange. Agric. Forest Meteorol., 107, 43-69.
FAO, 2006. Livestock’s long shadows: environmental issues and options. FAO : Rome.
Faverdin P. et al., 2005. Bidirectional soil/atmosphere N2O exchange over two mown grassland systems with contrasting management practices. Global Change Biol., 11, 2114-2127.
Flechard C.R. et al., 2007. Effects of climate and management intensity on nitrous oxide emissions in grassland systems across Europe. Agric. Ecosyst. Environ., 121, 135-152.
Flessa H. et al., 1996. Influence of cattle wastes on nitrous oxide and methane fluxes in pasture land. J. Environ. Qual., 25(6), 1366‐1370.
GIEC, 2001. Climate change 2001: the scientific basis (Contribution of Working Group I to the third assessment report of the IPCC). Cambridge, UK: Cambridge University Press.
GIEC, 2007. Climate change 2007: the scientific basis (Contribution of Working Group I to the third assessment report of the IPCC). Cambridge, UK: Cambridge University Press.
Gilmanov T. et al., 2007. Partitioning European grassland net ecosystem CO2 exchange into gross primary productivity and ecosystem respiration using light response function analysis. Agric. Ecosyst. Environ., 121, 93-120.
Harper C.W. et al., 2005. Increased rainfall variability and reduced rainfall amount decreases soil CO2 flux in a grassland ecosystem. Global Change Biol., 11, 322-334.
Heimann M. & Reichstein M., 2008. Terrestrial ecosystem carbon dynamics and climate feedbacks. Nature, 451, 289-292.
Holter P., 1997. Methane emissions from Danish cattle dung pats in the field. Soil Biol. Biochem., 29(1), 31‐37.
Hussain M.Z., Grünwald T. & Tenhunen J.D., 2011. Summer drought influence on CO2 and water fluxes of extensively managed grassland in Germany. Agric. Ecosyst. Environ., 141, 67-76.
Jacobs C.M.J., Jacobs A.F.G. & Bosveld F.C., 2007. Variability of annual CO2 exchange from Dutch grasslands. Biogeosciences, 4, 803-816.
Jaksic V. et al., 2006. Net ecosystem exchange of grassland in contrasting wet and dry years. Agric. For. Meteorol., 139(3‐4), 323‐334.
Jarvis S.C., Lovell R.D. & Panayides R., 1995. Patterns of methane emission from excreta of grazing animals. Soil Biol. Biochem., 27(12), 1581‐1588.
Jones M.B. & Donnelly A., 2004. Carbon sequestration in temperate grassland ecosystems and the influence of management, climate and elevated CO2. New Phytol., 164, 423-439.
Jones S.K., Rees R.M., Skiba U.M. & Ball B.C., 2007. Influence of organic and mineral N fertiliser on N2O fluxes from a temperate grassland. Agric. Ecosyst. Environ., 121, 74-83.
Jones S.K. et al., 2011. Nitrous oxide emissions from managed grassland: a comparison of eddy covariance and static chamber measurements. Atmos. Meas. Tech., 4, 2179-2194.
Jongen M., Pereira J.S., Aires L.M. & Pio C.A., 2011. The effects of drought and timing of precipitation on the inter-annual variation in ecosystem-atmosphere exchange in a Mediterranean grassland. Agric. For. Meteorol., 151, 595-606.
Jungbluth T., Hartung E. & Brose G., 2001. Greenhouse gas emissions from animal houses and manure stores. Nutr. Cycling Agroecosyst., 60(1‐3), 133‐145.
Kindler R. et al., 2011. Dissolved carbon leaching from soil is a crucial component of the net ecosystem carbon balance. Global Change Biol., 17, 1167-1185.
Klumpp K., Tallec T., Guix N. & Soussana J.F., 2011a. Long-term impacts of agricultural practices and climatic variability on carbon storage in a permanent pasture. Global Change Biol., 17, 3534-3545.
Klumpp K., Bloor J.M.G., Ambus P. & Soussana J.F., 2011b. Effects of clover density on N2O emissions and plant-soil N transfers in a fertilised upland pasture. Plant Soil, 343, 97-107.
Kroon P.S. et al., 2010. Uncertainties in eddy covariance flux measurements assessed from CH4 and N2O observations. Agric. Forest Meteorol., 150, 806-816.
Lal R., 2004. Soil carbon sequestration impacts on global climate change and food security. Science, 304, 1623-1627.
Lassey K.R., 2007. Livestock methane emission: from the individual grazing animal through national inventories to the global methane cycle. Agric. For. Meteorol., 142(2‐4), 120‐132.
Leahy P., Kiely G. & Scanlon T.M., 2004. Managed grasslands: a greenhouse gas sink or source?, Geophys. Res. Lett., 31(20).
Li Z. & Kelliher F.M., 2007. Methane oxidation in freely and poorly drained grassland soils and effects of cattle urine application. J. Environ. Qual., 36(5), 1241‐1248.
Martin C., Morgavi D.P. & Doreau M., 2010. Methane mitigation in ruminants: from microbe to the farm scale. Animal, 4(3), 351-365.
Mathieu O. et al., 2006. Emissions and spatial variability of N2O, N2 and nitrous oxide mole fraction at the field scale, revealed with 15N isotopic techniques. Soil Biol. Biochem., 38(5), 941-951.
Moureaux C., Bodson B. & Aubinet M., 2008. Mesure des flux de CO2 et bilan carboné de grandes cultures : état de la question et méthodologie. Biotechnol. Agron. Soc. Environ., 12(3), 303-315.
Mudge P.L. et al., 2011. Carbon balance of an intensively grazed temperate pasture in two climatically contrasting years. Agric. For. Meteorol., 144, 271-280.
Neftel A. et al., 2007. Experimental assessment of N2O background fluxes in grassland systems. Tellus, 59B, 470-482.
Neftel A. et al., 2010. N2O exchange over managed grassland: application of a quantum cascade laser spectrometer for micrometeorological flux measurements. Agric. For. Meteorol., 150(6), 775‐785.
Nieveen J.P., Campbell D.I., Schipper L.A. & Blair I.A.N.J., 2005. Carbon exchange of grazed pasture on a drained peat soil. Global Change Biol., 11, 607-618.
Pinares‐Patino C.S., Baumont R. & Martin C., 2003. Methane emissions by Charolais cows grazing a monospecific pasture of timothy at four stages of maturity. Can. J. Anim. Sci., 83(4), 769‐777.
Richardson A.D. et al., 2006. A multi-site analysis of random error in tower-based measurements of carbon and energy fluxes. Agric. For. Meteorol., 136, 1-18.
Rogiers N. et al., 2008. Impact of past and present land-management on the C-balance of a grassland in the Swiss Alps. Global Change Biol., 14, 2613-2625.
Saggar S. et al., 2004a. Modelling nitrous oxide emissions from dairy‐grazed pastures. Nutr. Cycling Agroecosyst., 68(3), 243‐255.
Saggar N. et al., 2004b. A review of emissions of methane, ammonia, and nitrous oxide from animal excreta deposition and farm effluent application in grazed pastures. New Zealand J. Agric. Res., 47, 513-544.
Saggar S., Hedley C.B., Giltrap D.L. & Lambie S.M., 2007. Measured and modelled estimates of nitrous oxide emission and methane consumption from a sheep‐grazed pasture. Agric. Ecosyst. Environ., 122(3), 357‐365.
Sauvant D. & Giger‐Reverdin S., 2009. Les variations du bilan carbone des ruminants d’élevage. In : 16e Rencontres autour des Recherches sur les Ruminants, 2-3 décembre 2009, Centre des Congrès de la Villette, Paris. Paris : INRA Éditions.
Schmitt M. et al., 2010. Land use affects the net ecosystem CO2 exchange and its components in mountain grasslands. Biogeoscience, 8, 2297-2309.
Schulze E.D. et al., 2009. Importance of methane and nitrous oxide for Europe's terrestrial greenhouse‐gas balance. Nat. Geosci., 3(1), 842‐850.
Simon J.C., Decau M-L. & Morvan T., 1998. Facteurs de variation du devenir de l'azote des déjections bovines sur les surfaces fourragères. In : 5e Rencontres autour des Recherches sur les Ruminants, 2-3 décembre 1998, Centre des Congrès de la Villette, Paris. Paris : Institut de l’Élevage.
Six J. et al., 2004. The potential to mitigate global warming with no-tillage management is only realized when practiced in the long-term. Global Change Biol., 10, 155-160.
Skiba U. & Smith K.A., 2000. The control of nitrous oxide emissions from agricultural and natural soils. Chemosphere Global Change Sci., 2, 379-386.
Skiba U. et al., 2009. Biosphere‐atmosphere exchange of reactive nitrogen and greenhouse gases at the NitroEurope core flux measurement sites: measurement strategy and first data sets. Agric. Ecosyst. Environ., 133(3‐4), 139‐149.
Soussana J.F. et al., 2004. Carbon cycling and sequestration opportunities in temperate grasslands. Soil Use Manage., 20, 219-230.
Soussana J.F. et al., 2006. Bilans de gaz à effet de serre en prairies et cultures : méthodologies et résultats. Fourrages, 186, 193-204.
Soussana J.F. et al., 2010. Mitigating the greenhouse gas balance of ruminant production systems through carbon sequestration in grasslands. Animal, 4(3), 334‐350.
Suleau M. et al., 2011. Respiration of three Belgian crops: partitioning of total ecosystem respiration in its heterotrophic, above- and below-ground autotrophic components. Agric. For. Meteorol., 151, 633-643.
Suyker A.E., Verma S.B. & Burba G.G., 2003. Year-round observations of the net ecosystem exchange of carbon dioxide in a native tallgrass prairie. Global Change Biol., 7, 279-289.
Teuling A.J., Seneviratne S.I. & Stöckli R., 2010. Contrasting response of European forest and grassland energy exchange to heatwaves. Nat. Geosci., 3, 722-727.
Vermorel M. et al., 2008. Évaluation quantitative des émissions de méthane entérique par les animaux d’élevage en 2007 en France. INRA Prod. Anim., 21, 403-418.
Vuichard N. et al., 2007a. Estimating the greenhouse gas fluxes of European grasslands with a process-based model: 1. Model evaluation from in situ measurements. Global Biogeochem. Cycles, 21, GB1004, doi:10.1029/ 2005GB002611.
Vuichard N. et al., 2007b. Estimating the greenhouse gas fluxes of European grasslands with a process-based model: 2. Simulations at the continental level. Global Biogeochem. Cycles, 21, GB1005, doi:10.1029/2005GB002612.
Yamulki S., Jarvis S.C. & Owen P., 1998. Nitrous oxide emissions from excreta applied in a simulated grazing pattern. Soil Biol. Biochem., 30, 491-500.
Yamulki S., Jarvis S.C. & Owen P., 1999. Methane emission and uptake from soils as influenced by excreta deposition from grazing animals. J. Environ. Qual., 28(2), 676-682.
Yamulki S. et al., 2000. Effects of dung and urine amendments on the isotopic content of N2O released from grasslands. Rapid Commun. Mass Spectrom., 14, 1356-1360.
Yamulki S. & Jarvis S.C., 2002. Short‐term effects of tillage and compaction on nitrous oxide, nitric oxide, nitrogen dioxide, methane and carbon dioxide fluxes from grassland. Biol. Fertil. Soils, 36(3), 224‐231.
Pour citer cet article
A propos de : Elisabeth Jérôme
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Physique des Biosystèmes. Avenue de la Faculté, 8. B-5030 Gembloux (Belgique). E-mail : Elisabeth.Jerome@ulg.ac.be
A propos de : Yves Beckers
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Zootechnie. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
A propos de : Bernard Bodson
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Phytotechnie des Régions tempérées. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
A propos de : Christelle Degard
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Physique des Biosystèmes. Avenue de la Faculté, 8. B-5030 Gembloux (Belgique).
A propos de : Christine Moureaux
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Phytotechnie des Régions tempérées. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
A propos de : Marc Aubinet
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Physique des Biosystèmes. Avenue de la Faculté, 8. B-5030 Gembloux (Belgique).






