- Home
- volume 10 (2006)
- numéro 3
- Effets œstrogéniques du macéré aqueux des feuilles de Holarrhena floribunda (G. Don) Dur & Schinz chez la rate ovariectomisée
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Effets œstrogéniques du macéré aqueux des feuilles de Holarrhena floribunda (G. Don) Dur & Schinz chez la rate ovariectomisée

Editor's Notes
Reçu le 10 novembre 2004, accepté le 27 décembre 2005
Résumé
Les effets œstrogéniques des extraits aqueux des feuilles de Holarrhena floribunda ont été évalués par des tests utérotrophiques chez la rate ovariectomisée, traitée pendant sept jours par voie sous cutanée. Les lots constitués ont reçu respectivement 50, 100, 200 mg.kg-1 de Holarrhena floribunda et 100 et 200 mg.kg-1 de Holarrhena floribunda plus 25 mg.kg-1 de 17-b-œstradiol. L’évaluation a porté sur les poids frais et sec de l’utérus, le poids frais des glandes surrénales, l’ouverture vaginale des rates, le taux de protéines et de cholestérol dans les cornes utérines. L’administration des extraits totaux seuls aux doses de 100 et 200 mg.kg-1 ont entraîné une augmentation des poids frais et sec de l’utérus, des poids frais des glandes surrénales, l’ouverture vaginale, une augmentation du taux protéique et une diminution du taux de cholestérol dans les cornes utérines. L’administration simultanée des extraits aux doses de 100 et 200 mg.kg-1 et de 25 mg.kg-1 de 17-b-œstradiol, donnent les mêmes résultats mais l’augmentation est moindre que l’effet de l’œstradiol et des différentes doses pris séparément. Ces résultats montrent que les extraits aqueux des feuilles de Holarrhena floribunda contiennent des substances œstrogéniques qui se comportent comme des agonistes partiels et que Holarrhena floribunda est un phytœstrogène faible.
Abstract
Oestrogenic effects of macerated aqueous extracts of the leaves of Holarrhena floribunda (G. Don) Dur & Schinz on ovariectomized rat. Estrogenic effects of aqueous extracts of leaves of Holarrhena floribunda have been evaluated by uterotrophic assay. Ovariectomized mice were used and treated subcutaneously during seven days with 50, 100, 200 mg.kg-1 doses of Holarrhena floribunda and with 100, 200 mg.kg-1 doses of Holarrhena floribunda plus 25 mg.kg-1 of œstradiol 17-b. Estrogenic activity was analysed by uterine dry and wet weight, surrenal gland wet weight, vaginal opening, protein and cholesterol level in uteri horn. Administration of extracts to the doses of 100 and 200 mg.kg-1 exhibits increase of uterine dry and wet weight, surrenal gland wet weight, vaginal opening, protein levels and decrease of level of cholesterol in uterine horn. The results suggest that, aqueous extracts of Holarrhena floribunda possesses estrogenic type effect. But when 100 and 200 mg.kg-1 of Holarrhena floribunda were given alone with 25 mg.kg-1 of estradiol 17-b, the estrogenic effect was slight. These results supposed that H. floribunda is a weak phytoestrogen and the aqueous extracts of the leaves behad as partial agonistic.
Table of content
1. Introduction
1Les œstrogènes sont connus depuis fort longtemps pour leur implication chez les mammifères dans de nombreux processus biologiques fondamentaux tels que la régulation des hormones sexuelles, la biosynthèse des récepteurs à la progestérone, le développement et la différenciation cellulaire (Henderson et al., 1991 ; Clarke et al., 1991 ; Kang et al., 2000). Cette implication s’illustre notamment par les effets observés in vivo, en particulier chez les femelles (rates ou souris entières ou ovariectomisées) soumises à des traitements avec des substances œstrogéniques pures ou présentes dans des extraits de plantes. L’un des effets les plus remarquables et qui a servi de fondement à la modélisation du protocole expérimental en vue de son utilisation standardisée, est représenté par l’activité utérotrophique. En effet, depuis fort longtemps, l’utérus s’est révélé être l’organe par excellence mettant bien en évidence de manière assez caractéristique les effets des substances œstrogéniques chez la femelle (Prakash, Roy, 1984 ; Kuivan, Desombe, 1985 ; Burdette et al., 2002). Leur administration à des rates immatures ou ovarectomisées provoque une augmentation importante de la masse et du poids de l’utérus, une ouverture du méat vaginal, une cornification des cellules de la muqueuse vaginale des rates, une réduction du taux de cholestérol et un accroissement des teneurs en protéines totales dans les cornes utérines (Telefo et al., 1998 ; Wang et al., 2000 ; Harris et al., 2002).
2Plusieurs plantes de la pharmacopée africaine ont la réputation de soigner aussi bien les affections de la sphère génitale (blennorragie, syphilis, etc.) que de corriger certains dysfonctionnements de la fonction de reproduction tels que la stérilité. Sur la base des usages séculaires et des résultats obtenus par plusieurs tradithérapeutes locaux, de nombreux auteurs ont essayé d’approfondir les connaissances sur ces plantes. C’est ainsi que pour Holarrhena floribunda (G. Don) Dur et Schinz, une Apocynacée très répandue en Afrique de l’Ouest et du Centre, d’usage connu pour le traitement des infections microbiennes génitales, la stérilité et l’accroissement de la fertilité, on peut citer les importantes contributions de Aké-Assi (1992), Nacoulma (1996), Tamboura et al. (1998) et Arbonnier (2000).
3L’étude de la composition chimique des feuilles de H. floribunda a permis de mettre en évidence la présence entre autres d’alcaloïdes steroïdiques, de la connessine, de la progestérone et des flavonoïdes (Paris, Foucaud, 1959 ; Goutarel, 1964). Cette présence des flavonoïdes fut confirmée au sein du laboratoire par Millogo en 1998 dans les feuilles de H. floribunda. Comme l’ont montré certains auteurs (Hodek et al., 2002 ; Cemeli et al., 2004 ; Valachovicova et al., 2004 ; Zieran et al., 2004), les flavonoïdes sont des substances pouvant présenter des activités oestrogéniques.
4Cependant, dans la limite de nos connaissances à ce jour, nous ne disposons d’aucune donnée relative à la vérification expérimentale in vivo de l’efficacité des extraits de cette plante sur la fonction de reproduction de la femelle. Le but de cette étude est de rechercher les éventuels effets œstrogéniques d’un traitement à l’aide d’extraits du macéré aqueux des feuilles de H. floribunda sur l’utérus et les surrénales.
2. Matériel et méthodes
2.1. Mode de récolte et préparation des extraits
5Les feuilles de H. floribunda ont été récoltées à la fin de la saison pluvieuse, avant le lever du jour à Gampela, située à 15 km au nord-est de Ouagadougou (Burkina Faso). L’identification a été effectuée au Laboratoire de Botanique du CNRST où se trouve un spécimen authentifié. Les feuilles sont lavées à grande eau puis séchées sous ventilation artificielle à l’abri du soleil et de la poussière. Une fois séchées, les feuilles sont réduites en poudre et scellées dans des sachets hermétiques. Cinquante grammes du broyat sont mis à macérer dans 500 ml d’eau distillée. La macération est faite pendant 24 heures sous agitation magnétique, à l’abri de la lumière en recouvrant les béchers de papiers aluminium. Le macéré est ensuite recueilli et centrifugé. Le surnageant est filtré, congelé et lyophilisé. Après 72 heures de lyophilisation, on obtient une poudre jaune, d’odeur piquante avec un rendement de 26 %. Le lyophilisat est conservé dans un dessiccateur pour éviter toute humidification.
2.2. Les produits chimiques
6Les produits chimiques utilisés sont le 17-b-œstradiol (SIGMA-France) et l’huile d’arachide de laboratoire (SIGMA-France).
2.3. Les animaux et les traitements
7Pour les expérimentations, ce sont des rates WISTAR provenant de l’élevage Charles Rivers (France) qui ont été utilisées. A l’animalerie, les rates ont librement accès à l’eau et à la nourriture et sont soumises chaque jour à 10 heures d’obscurité et 14 heures de lumière. La température moyenne dans l’animalerie est de 22 ± 3 °C, l’humidité relative de 50 ± 10 %. Les rates sont ovariectomisées à 21 jours d’âge sous anesthésie générale à la kétamine. Le poids moyen des rates en début d’expérience est de 170,95 ± 3,39 g. Quinze jours après les ovariectomies, les rates sont réparties en 7 lots de 6 sujets. Il a été fait au préalable un alottement raisonné pour minimiser la différence de poids vif moyen entre les lots. Les traitements se présentaient comme suit :
8– lot 1 : témoin reçoit de l’eau distillée ;
9– lot 2 : 25 mg 17-b-œstradiol par kg ;
10– lot 3 : 50 mg H. floribunda par kg ;
11– lot 4 : 100 mg H. floribunda par kg ;
12– lot 5 : 200 mg H. floribunda par kg ;
13– lot 6 : 25 mg 17-b-œstradiol par kg + 100 mg H. floribunda par kg ;
14– lot 7 : 25 mg 17-b-œstradiol par kg + 200 mg H. floribunda par kg.
15Les différentes doses de H. floribunda sont préparées de façon extemporanée dans de l’eau distillée et sont administrées par voie sous-cutanée par kilogramme de poids corporel. La solution mère de 17-b-œstradiol est d’abord préparée dans de l’alcool absolu avant d’être diluée dans l’huile d’arachide. L’injection du 17-b-oestradiol se fait par voie sous-cutanée par kilogramme de poids corporel. La durée du traitement est de 7 jours consécutifs.
16Les principaux paramètres de l’activité œstrogénique recherchés ont concerné l’évolution du poids vif des animaux, les modifications macroscopiques au niveau de l’utérus, du vagin et des glandes surrénales, complétés par quelques données biochimiques tels que le taux des protéines totales et le taux de cholestérol dans les cornes utérines.
2.4. Mesure de l’évolution pondérale des animaux
17Les animaux sont d’abord pesés avant la première administration des produits et extraits. La seconde pesée est faite au lendemain de la fin des 7 jours de traitement. A chaque fois, nous utilisons une balance de type Sartorius ayant 500 grammes de portée et une précision à 5 % près.
2.5. Mesure de l’évolution du poids frais et sec de l’utérus et des glandes surrénales.
18Vingt-quatre heures après le dernier traitement, après la dernière pesée, les rates sont sacrifiées par dislocation cervicale. L’utérus et les glandes surrénales sont soigneusement prélevés, séparés des adhérences adipeuses et pesés séparément. L’utérus est ensuite placé à l’étuve pendant 24 heures à 100 °C et pesé à nouveau pour obtenir le poids sec de l’organe.
2.6. Mesure de l’ouverture vaginale
19Chaque matin à heure fixe dans la matinée et ce durant les 7 jours de traitement, les femelles sont inspectées en vue de relevé l’état d’ouverture du méat vaginal. On relève le nombre de femelles présentant un méat ouvert en fonction du traitement et de la dose de produits administrés.
2.7. Mesure du taux de protéines totales et de cholestérol des cornes utérines
20L’utérus entier est broyé dans un Potter avec une solution de NaCl à 0,9 %. Le broyat en solution est centrifugé à 4000 tr/min pendant 10 min. Une partie du surnageant est utilisée pour le dosage des protéines par spectrophotométrie selon la méthode de Bradford basée sur le principe de changement d’absorbance de 465 à 595 nm. Le standard utilisé est le BSA tandis que le réactif est constitué par une solution acide de Bleu de Coomassie (Zor et al., 1996). Une quantité de 0,2 ml de l’autre partie du surnageant est placée dans 10 ml du mélange alcool-acétone. Le solvant organique est éliminé par évaporation dans un bain-marie bouillant et l’extrait séché est dissous dans du chloroforme. Le taux de cholestérol est ensuite déterminé par colorimétrie à 680 nm (Biomérieux, 1987).
2.8. Analyses statistiques
21Les données ont été organisées en utilisant le logiciel STATVIEW version 4.5, les moyennes étant exprimées sous la forme de moyenne ± écart type. L’analyse de variance (ANOVA I) appliquée aux résultats obtenus a permis d’apprécier les effets des différents traitements et doses de produits avec comme niveau de signification 5 %. Le test t de Student a été utilisé pour faire les comparaisons entre les moyennes.
3. Résultats
3.1. Effets des traitements sur l’évolution pondérale et l’ouverture du méat vaginal des rates
22Après 7 jours d’administration, aucun traitement ni dose n’affecte significativement (p > 0,05) l’évolution pondérale des rates vivantes.
23Par contre, avec le traitement à l’œstradiol, toutes les rates (100 %) présentent une ouverture vaginale bien observable. Cependant les doses de 50, 100, 200 mg par kg de H. floribunda induisent seulement respectivement 16 %, 50 %, 83 % de rates avec une ouverture vaginale (Tableau 1).
24Les traitements associant l’œstradiol + 100 mg par kg de H. floribunda et l’œstradiol + 200 mg par kg de H. floribunda provoquent l’ouverture du vagin respectivement 83 % et 100 % de rates.
3.2. Effets des traitements sur l’évolution pondérale de l’utérus et des glandes surrénales
25Les traitements utilisant des doses de 100 et 200 mg par kg de H. floribunda ont induit par rapport au témoin, une augmentation hautement significative (p < 0,001) du poids frais de l’utérus (respectivement de 62 % et 78 %). L’œstradiol administré seul a provoqué également une augmentation très hautement significative (p < 0,001) de 167 % comparativement au témoin. L’effet de l’œstradiol associé à l’une des doses de 100 et 200 mg par kg présente une augmentation comparativement au témoin, avec respectivement un accroissement de 32 % et 6 %. Mais seul l’effet de l’œstradiol + 100 mg par kg de H. floribunda présente une augmentation significative (p < 0,05) par rapport au témoin.
26Les mêmes résultats s’observent également en ce qui concerne le poids sec de l’utérus. L’administration des extraits de H. floribunda aux doses de 100 et 200 mg par kg a provoqué une augmentation très hautement significative (p < 0,001) de 169 % et 205 % comparativement au témoin. L’œstradiol induit une augmentation également très hautement significative (p < 0,001) de 280 % du poids sec de l’utérus comparativement au témoin (Figure 1). L’effet combiné œstradiol + 100 mg par kg de H. floribunda a présenté une augmentation très hautement significative (p < 0,05) de 95 % comparativement au témoin. Le traitement avec l’œstradiol + 200 mg par kg n’a, quant à lui, pas d’effet significatif (p > 0,05) comparativement au témoin.
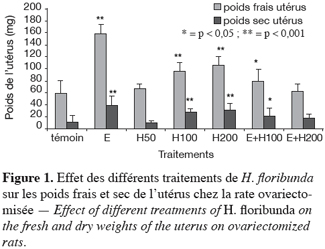
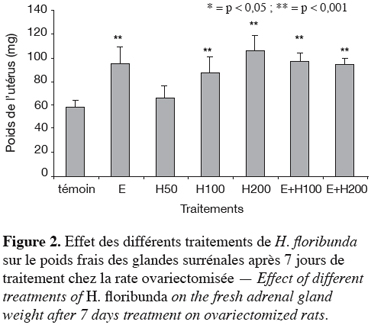
27Le poids frais des glandes surrénales a augmenté très significativement (p < 0,001) avec les doses de 100 et 200 mg par kg respectivement de 49 % et 81 %. L’œstradiol a entraîné une augmentation significative (p < 0,001) du poids frais des glandes surrénales de 62 % comparativement au témoin (Figure 2). Les effets des traitements combinant de l’œstradiol plus les doses de 100 et 200 mg par kg de H. floribunda ont entraîné comparativement au témoin, une augmentation très significative (p < 0,001) respectivement de 66 % et 62 %.
3.3. Effet des traitements sur le taux de protéines et de cholestérol dans les cornes utérines
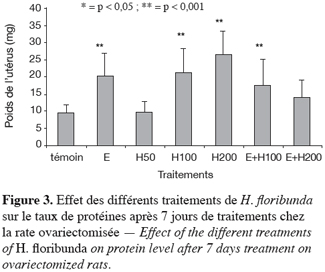
28Le taux des protéines utérines a connu une augmentation très hautement significative (p < 0,001) de 118 % et 169 % au-delà du témoin, respectivement avec les traitements utilisant des extraits dosés à 100 et 200 mg par kg de H. floribunda. L’œstradiol a quant à lui eu pour effet de l’augmenter très significativement (p < 0,001) de 108 % comparé au témoin. L’effet de la combinaison œstradiol plus les doses de 100 et 200 mg par kg de H. floribunda a entraîné respectivement, une augmentation de 79 % et 41 % par rapport au témoin. Seule l’augmentation des effets observés avec l’œstradiol plus 100 mg par kg de H. floribunda s’est révélée significative (p < 0,05) (Figure 3).
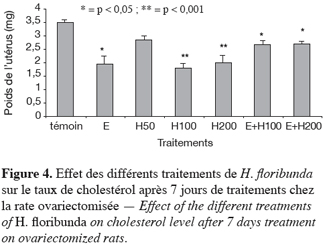
29Le taux de cholestérol diminue de manière significative (p < 0,05) avec les doses de 100 et 200 mg par kg respectivement de 48 et 43 % comparativement au témoin. L’œstradiol a entraîné une diminution significative (p < 0,05) du niveau de cholestérol de 44 % comparativement au témoin.
30Les effets du traitement combinant l’œstradiol + les doses de 100 et 200 mg par kg de H. floribunda ont significativement (p < 0,05) diminué de 23 % le taux de cholestérol utérin comparativement au témoin (Figure 4).
4. Discussion
31Les essais utérotrophiques sont très souvent utilisés comme essais standard pour la mise en évidence d’une activité oestrogénique in vivo (Bachman et al., 1998). L’activité oestrogénique se traduit généralement par des changements morphologiques, histologiques et biochimiques de l’utérus (Diel et al., 2002).
32Dans des travaux antérieurs, nous avons pu évaluer la toxicité générale aiguë des extraits de H. floribunda, lesquels situaient la DL50 autour d’une moyenne de 1500 mg par kg de poids corporel. En nous référant à l’échelle de toxicité de Done (1980), cette valeur permet de classer H. floribunda parmi les plantes faiblement toxiques. Cela explique que l’évolution pondérale et le comportement clinique général des rates traitées n’aient été nullement affectés par les doses d’extraits végétaux testées par la voie sous-cutanée.
33L’augmentation très significative de la masse et des poids frais et sec de l’utérus ainsi que le nombre d’animaux traités présentant une ouverture vaginale confirment bien une activité œstrogénique des extraits aqueux de H. floribunda. Car comme l’ont montré plusieurs auteurs auparavant (Couse, Korach, 1999 ; Pinilla et al., 2001 ; Shivalingappa et al., 2002), l’administration de substances œstrogéniques ou œstrogènes-like à des rates impubères ou ovariectomisées induit une augmentation de la masse et du poids ainsi qu’une imbibition aqueuse accrue de l’utérus, la cornification et l’ouverture de l’orifice vaginal. A la suite des travaux de Clarke et al. (1991) et de Roberts et Sporn (1992) qui ont permis un certain éclairage sur le mécanisme d’action de ces substances, on peut expliquer les effets obtenus par le fait que les œstrogènes stimulent très fortement la prolifération des cellules dans l’endomètre utérin. Cette observation vaut par ailleurs également pour d’autres tissus d’organes sexuels comme les ovaires et les seins, conduisant à des formes de tumeurs rapportées à travers plusieurs cas cliniques en gynécologie.
34En ce qui concerne les glandes surrénales, les résultats que nous avons obtenus sont confortés par ceux rapportés des travaux de Kozvun (1996). Cet auteur a en effet constaté une atrophie et d’importantes modifications histologiques au niveau des glandes surrénales suite à une ovariectomie pratiquée sur des rates adultes. En administrant à des sujets ainsi traités des substances œstrogéniques, les glandes surrénales ont non seulement corrigé leur déficit, mais ont également accru leur masse et leur poids normal.
35L’action œstrogénique des extraits de H. floribunda qui a été bien mise en évidence plus haut est par ailleurs confirmée au niveau biochimique par l’augmentation du taux de protéines et la diminution du taux de cholestérol dans les cornes utérines des rates traitées. En effet, Lee et Lee (1996) ainsi que Kouakou et Benie (2003) qui recherchaient aussi les effets d’autres substances supposées œstrogéniques ont également obtenu une telle augmentation du niveau protéique ainsi que l’imbibition en eau de la masse utérine. Pour ces auteurs, les protéines étant les constituants essentiels des cellules, toute prolifération cellulaire due à l’effet mitogène et anabolisant des œstrogènes, entraînerait également une augmentation du taux de protéines. En ce qui concerne le taux de cholestérol, les travaux de Lundeen et al. (1997), Samman et al. (1999) ont montré que l’administration sous cutanée d’œstrogènes à des rates immatures ou ovariectomisées réduisait les teneurs en cholestérol dans la circulation générale et au niveau des ovaires et des cornes utérines. Comme l’on expliqué certains auteurs comme Strauss et al. (1981), Black et al. (1994), le cholestérol étant le précurseur de la synthèse des hormones steroïdiennes, la diminution de son taux est dû au fait qu’il a été utilisé dans le processus de la stéroidogénèse.
36L’ensemble de ces effets de l’administration d’extraits aqueux de H. floribunda s’est également révélé être dépendant de la dose administrée. A très faible dose, pratiquement aucun effet n’est noté alors qu’à 100 et 200 mg par kg, ils s’affichent très nettement.
37L’augmentation du taux de protéines contribue au rétablissement de la structure des cornes utérines et des glandes surrénales. Les extraits contiendraient donc des substances œstrogéniques qui permettraient la prolifération cellulaire au niveau de l’endomètre de l’utérus et au niveau des glandes surrénales.
38En présence d’œstradiol, les extraits aqueux de H. floribunda ont montré une augmentation des poids frais et sec de l’utérus, du poids frais des glandes surrénales, l’ouverture vaginale des rates ainsi qu’une augmentation du taux protéique et une diminution du taux de cholestérol dans l’utérus. Il faut cependant noter que l’effet du traitement combiné œstradiol + extraits de la plante est moindre que leurs effets individuels. Ce phénomène de compétition entre l’œstradiol et les extraits de la plante est donc partiel. Cela pourrait s’expliquer par le fait que les extraits de H. floribunda et l’œstradiol administrés ensemble chez le même sujet, entrent en compétition sur les mêmes sites de récepteurs. Selon certains auteurs comme Shutt (1976), Hodek et al. (2002), Magee et Rowland (2004), les phytœstrogènes faibles, lorsqu’ils sont administrés à forte dose, peuvent provoquer un déséquilibre hormonal pouvant même entrer en compétition avec l’œstrogène et se comporter comme des anti-œstrogènes. En effet, l’administration simultanée de l’œstradiol et de 100 mg par kg de H. floribunda donne une réponse plus significative que l’administration simultanée de l’œstradiol et de 200 mg par kg de H. floribunda. Ces effets œstrogéniques des extraits aqueux des feuilles de H. floribunda s’expliqueraient par la présence des flavonoïdes. Plusieurs études ont montré l’action des flavonoïdes en tant que substances à activités œstrogéniques (Limer, Speirs, 2004 ; Vaya, Tamir, 2004). Des études menées par Hodek et al. (2002) montrent que de fortes doses de flavonoïdes entraînaient une réduction de l’effet œstrogénique par une interaction avec le cytochrome P450 ou en bloquant le CYP19, une enzyme très importante dans la biosynthèse des œstrogènes. Cela expliquerait la baisse de l’activité œstrogénique lorsque les deux substances sont administrées en même temps.
5. CONCLUSION
39Il ressort de cette étude que les extraits aqueux de H. floribunda présentent des effets œstrogènes-like.Ces effets se traduisent par une augmentation des poids frais et sec de l’utérus, une augmentation du poids frais des glandes surrénales, du taux protéique dans l’utérus, une diminution du taux de cholestérol dans l’utérus et l’ouverture vaginale des rates ovarectomisées. Les effets sont doses dépendants et amoindris lorsque les extraits sont administrés en même temps que l’œstradiol, révélant une forme d’antagonisme partiel entre ces deux substances. Il s’avère donc nécessaire d’approfondir cette étude en la reprenant sur des rates entières non ovariectomisées pour étudier non seulement les mêmes paramètres mais surtout l’influence des extraits sur le cycle sexuel, le poids et l’histologie des ovaires et leur composition biochimique en protéines et en cholestérol. Il serait également intéressant de préciser le type de relations qui existe entre les extraits de la plante et l’œstradiol au niveau des sites d’action.
40Remerciements
41Nous tenons à adresser nos vifs remerciements aux tradipraticiens et aux éleveurs qui ont énormement participé aux enquêtes. Nous remercions toute l’équipe de Neurobiologie et Maîtrise des Fonctions saisonnières de l’INRA de Nouzilly/France pour nous avoir permis d’effectuer un stage de trois mois qui fut bénéfique pour conforter et approfondir certains résultats de cet article.
Bibliographie
Aké-Assi YA. (1992). Contribution au recensement des espèces végétales utilisées traditionnellement sur le plan zootechnique et vétérinaire en Afrique de l’Ouest. Thèse de vétérinaire. Lyon, France : Univ. Claude Bernard, 226 p.
Arbonnier M. (2000). Arbres, arbustes et lianes des zones sèches d’Afrique de l’Ouest. Montpellier et Paris, France : CIRAD-MNHN-UICN, 541 p.
Bachman S., Hellwig J., Jackh R., Christian MS. (1998). Uterotrophic assay of two concentrations of migrates of 23 polystyrenes administered orally (by gavage) to immature female wistar rats. Drug Chem. Toxicol. Suppl. 21, p. 1–30.
Biomérieux (1987). La voie enzymatique en colorimétrie. Charbonnières-Les-Bains, France, 9 p.
Black LJ., Sato M., Rowley ER., Magee DE., Bekele A., Williams DC., Cullinan GG., Bendele R., Kauffman RF., Bensch WR., Frolik CA., Termine JD., Bryant HU. (1994). Raloxifene (LY139481 HCl) prevents bone loss and reduces serum cholesterol without causing uterine hypertrophy in ovariectomized rats. J. Clin. Inves. 93, p. 62–69.
Burdette JE., Liu J., Lantvit D., Lim E., Booth N., Bhat KPL., Hedayat S., Van Breemen RB., Constantinou AI., Pezzuto JM., Farnswosth NR., Bolton J. (2002). Trifolium pratense (Red clover) exhibits estrogenics effects in vivo in ovariectomized Sprague-Dawley rats. J. Nutr. 132, p. 27–30.
Cemeli E., Schmid TE., Aanderson D. (2004). Modulation by flavonoids of DNA damage induced estrogen-like compounds. Environ. Mol. Mutagen. 44 (5), p. 420–600.
Clarke R., Dickson RB., Lippman ME. (1991). The role of steroids hormones and growth factors in the control of normal and malignant breast. In Parker M. (Ed). Nuclear hormone receptors. San Diego, CA, USA: Academic Press, p. 297–319.
Couse JF., Korach KS. (1999). Estrogens receptor null mice : what have we learned and where they lead us ? Endocr. Rev. 20, p. 358–417.
Diel P., Schmidt S., Vollmer G. (2002). In vivo test systems for the quantitative and qualitative analysis of the biological activity of phytoestrogens. J. Chromatogr. B. 777, p. 191–202.
Done AK. (1980). étude de la toxicité : quelques données fondamentales. Tempo Méd. Afr. 7, p. 39–40.
Goutarel R. (1964). Les alcaloïdes stéroidiques des Apocynacées. Vol. 1. Paris : Hermann, p. 166–171.
Harris HA., Katzenellenbogen JA., Katzenellenbogen BS. (2002). Characterization of the biological roles of the estrogen, ER-alpha and ER-beta, in estrogen target tissues in vivo through the use of an ERalpha-selective ligand. J. Clin. Endocrinol. Metab. 143 (11), p. 4172–4177.
Henderson BE., Ross RK., Pike MC. (1991). Towards the primary prevention of cancer. Science 254, p. 1131–1138.
Hodek P., Trefil P., Stibozova M. (2002). Flavonoids-potent and versatile biologically active compounds interacting with cytochromes P450. Chim. Biol. Interactions 139, p. 1–21.
Kouakou K., Benie T. (2003). Effet antifertilisant de Dal-dinia concentrica et Psathyrella efflorescens. Recherches des effets œstrogéniques. Ethnopharmacologia 31, p. 45–57.
Kang KS., Kim HS., Ryu DY., Che JH., Lee YS. (2000). Immature uterotrophic assay is more sensitive than ovariectomiezed uterotrophic assay fort the detection of estrogenicity of p-nonylphenol in Sprague-Dawley rats. Toxicol. Lett. 118, p. 109–115.
Kozvun OI. (1996). The effect of ovariectomy and estradiol on DNA, RNA and protein metabolism in adrenal cortex of rats. Fiziol. Zh. 42 (1), p. 53–58.
Kuivan PC., Desombe ER. (1985). The effects of sequential administration of 17-b-estrogens on the synthesis and secretion of specific protein in immature rats uterus. J. Steroids Biochem. 22, p. 439–451.
Lee PC., Lee W. (1996). In vivo estrogenic action of nonyphenol in immature rats. Bull. Environ. Contam. Toxicol. 57, p. 341–348.
Limer JL., Speirs V. (2004). Phytoestrogen and breast cancer chemoprevention. Breast. Cancer. Res. 6 (3), p. 119–27.
Lundeen SG., Carver JM., Mckean M., Winneker RC. (1997). Characterization of the ovariectomized rat model for the evaluation of estrogen effects on plasma cholesterol levels. Endocrinology 138, p. 1552–1558.
Magee JP., Rowland IR. (2004). Phytoestrogens, their mechanism of action: current evidence for o role in breast and prostate cancer. British J. Nutr. 91, p. 513–531.
Nacoulma-Ouedraogo OG. (1996). Plantes médicinales et pratiques médicinales traditionnelles au Burkina Faso. Cas du plateau central. Thèse de Doctorat ès Sciences naturelles. Univ. Ouagadougou. Tome II, 261 p.
Paris RR., Foucaud A. (1959). Favonoides in the leaves of Holarrhena floribunda (G. Don) Durand, Schinz: isolation of identified as isoquercitroside. C. R. Hebd. Seances Acad. Sci. 248 (18), p. 2634–2635.
Pinilla L., Gonzalez LC., Tena-Sempere M., Aguilar E. (2001). Evidence for an estrogen-like action of Raloxi-fene upon the hypothalamic pituitary unit: Raloxifene inhibits luteinizing hormone secretion and stimulates prolactin secretion in ovariectomized female rate. Neurosci. Lett. 311, p.149–152.
Prakash AO., Roy SK. (1984). Induction of implantation non steroids antifertility agent, 1,2-diethy 1,3-bis (p-methoxyphenyl)-1-propene in rat. Int. J. Fertil. 29, p. 13–15.
Roberts AB., Sporn MB. (1992). Mechanistic interrelationships between two superfamilies: the steroid/retinod receptors and transforming growth factor-b. Cancer Surv. 14, p. 205–220.
Samman S., Lyons Wall PM., Chan GS., Smith SJ., Petocz P. (1999). The effect of supplementation with isoflavones on plasma lipides and oxidiscibility of low density lipoprotein in premenopausal women. Atherosclerosis 147 (2), p. 277–283.
Shivalingappa H., Satyanarayan ND., Purochit MG., Shavanabasappa N., Patil SB. (2002). Effect of the ethanol extract of Rivea hypocrateriformis on the estrous cycle of the rat. J. Endocrinol. 82, p. 11–17.
Strauss JF., III, Sculer LA., Tanaka T. (1981). Cholesterol metabolism by ovarian tissue. Adv. Lipid Res. 18, p. 99.
Shutt AD. (1976). Effets des œstrogènes végétaux sur la reproduction animale. Endeavour 35 (126), p. 110–113.
Tamboura HH., Kabore H., Yameogo SM. (1998). Ethnomedecine et pharmacopée vétérinaire traditionnelle dans le plateau central du Burkina Faso : cas de la province du Passoré. Biotechnol. Agron. Soc. Environ. 2 (3), p. 181–191.
Telefo PB., Moundipa PF., Tchana AN., Tchouanguep Dzickotze C., Mbiapo FT. (1998). Effects of aqueous extract of Aloe buettneri, Justicia insularis, Hibiscus macranthus, Dicliptera verticillata on some physiological and biochimical parameters of reproduction in immature female rats. J. Ethnopharmacol. 63, p. 193–200.
Valachovicova T., Slivova V., Siliva D. (2004). Cellular and physiological effect of soy flavonoids. Min. Rev. Med. Chem. 4 (8), p. 881–887.
Vaya J., Tamir S. (2004). The relation between the chemical structure of flavonoids and their estrogen-like activities. Curr. Med. Chem. 11 (10). p. 1333–1343.
Wang H., Eriksson H., Sahlin L. (2000). Estrogens receptors alpha and beta in the female reproductive tract of the rat during the oestrus cycle. Biol. Reprod. 63, p. 1331–1340.
Zieran O., Geis RB., Tischer S., Schwab P., Matz P., Vollmer G. (2004). Uterine effects of phytoestrogen 6-(1,1 dimethylallyl) naringenin in rat. Plant. Med. 70 (7), p. 590–593.
Zor T., Selinger Z. (1996). Linearization of the bradford protein assay increases its sensitivity : theoretical and experimental studies. Anal. Biochem. 236, p. 302–308.
To cite this article
About: Balé Bayala
Université de Ouagadougou. Unité de Formation et de Recherche en Sciences de la Vie et de la Terre (UFR/SVT). Laboratoire de Physiologie animale. 03 BP 7021 Ouagadougou 03 (Burkina Faso). E-mail : bayala_bale@yahoo.fr
About: Hamidou Hamadou Tamboura
Université de Ouagadougou. Unité de Formation et de Recherche en Sciences de la Vie et de la Terre (UFR/SVT). Laboratoire de Physiologie animale. 03 BP 7021 Ouagadougou 03 (Burkina Faso).
About: Maria Teresa Rubio Pellicer
Institut de l’Environnement et des Recherches Agricoles. Département des Productions animales (INERA/DPA). 03 BP 8645 Ouagadougou 03 (Burkina Faso).
About: Daniel Zongo
Institut National de la Recherche agronomique. Unité Physiologie de la Reproduction et des Comportements (INRA/PRC). F-37380 Nouzilly Tours (France).
About: Amadou Traoré
Institut National de la Recherche agronomique. Unité Physiologie de la Reproduction et des Comportements (INRA/PRC). F-37380 Nouzilly Tours (France).
About: Lamini Ouédraogo
Institut de l’Environnement et des Recherches Agricoles. Département des Productions animales (INERA/DPA). 03 BP 8645 Ouagadougou 03 (Burkina Faso).
About: Benoît Malpaux
Université de Ouagadougou. Unité de Formation et de Recherche en Sciences de la Vie et de la Terre (UFR/SVT). Laboratoire de Physiologie animale. 03 BP 7021 Ouagadougou 03 (Burkina Faso).
About: Laya Sawadogo
Institut National de la Recherche agronomique. Unité Physiologie de la Reproduction et des Comportements (INRA/PRC). F-37380 Nouzilly Tours (France).






