- Accueil
- Volume 17 (2013)
- numéro 2
- Évolution des connaissances sur les fonctionnalités de la fraction protéose-peptone du lait : propriétés techno-fonctionnelles et biologiques (synthèse bibliographique)
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Évolution des connaissances sur les fonctionnalités de la fraction protéose-peptone du lait : propriétés techno-fonctionnelles et biologiques (synthèse bibliographique)

Notes de la rédaction
Reçu le 7 mai 2012, accepté le 21 janvier 2013
Résumé
La fraction protéose-peptone totale (PPT) est définie comme une fraction soluble thermorésistante du lait, représentant environ 10 % des protéines du lactosérum. Elle est divisée en deux classes selon leur origine. D’une part, les fragments de la protéolyse de la caséine β issus de la région N-terminale : ce sont des composés non hydrophobes très solubles β-CN-5P (f1-105/107), β-CN-4P (f1-28) et β-CN-1P (f29-105/107) respectivement dénommés PP5 (14,3 kDa), PP8S (9,9 kDa) et PP8F (4 kDa). D’autre part, la fraction hydrophobe regroupant des glycoprotéines dont les principaux constituants sont la LP28, la LP18 très hydrophobe et un peptide hydrophobe avec des masses moléculaires apparentes respectives de 28 kDa, 18 kDa et 11 kDa. Les PPT présentent de nombreuses fonctionnalités très intéressantes telles que les propriétés techno-fonctionnelles (propriétés émulsifiantes et moussantes) et les propriétés biologiques (inhibition de la lipolyse et activités antimicrobiennes), utilisables comme ingrédients fonctionnels potentiels pour les industriels. En outre, ces propriétés fonctionnelles sont en partie gouvernées par les composants majeurs, notamment les glycoprotéines telles que les LP28 en relation avec leur caractère hydrophobe.
Abstract
The development of knowledge regarding the characteristics of the proteose peptone fraction of milk: Techno-functional and biological properties. A review. The total proteose-peptone fraction (TPP) is defined as a heat-stable soluble fraction of milk, representing about 10% of the whey protein. TPP is divided into two classes according to its origin. The first class consists of proteolysis fragments of the β-casein from the N-terminal region. These are non-hydrophobic fractions, which are the highly soluble β-CN-5P (f1-105/107); β-CN-4P (f1-28) and β-CN-1P (f29-105/107) respectively called PP5 (14.3 kDa), PP8S (9.9 kDa), and PP8F (4 kDa). The second class includes the hydrophobic fractions of glycoproteins, whose major constituents are a glycoprotein LP28, the highly hydrophobic glycoprotein LP18 and a hydrophobic peptide with apparent Mr, respectively 28 kDa, 18 kDa and 11 kDa. TPP has numerous interesting characteristics such as techno-functional properties (emulsifying and foaming actions) and biological properties (lipolysis inhibition and antimicrobial activities), making TPP usable as a potential functional ingredient for industry. In addition, these functional properties are partly governed by the major components including glycoproteins, such as LP28, due to their hydrophobic nature.
Table des matières
1. Introduction
1En 1918, Osborne et Wakeman isolent une fraction azotée résiduelle obtenue après précipitation en milieu sulfurique de la caséine et après coagulation à l’ébullition des albumines et globulines. Celle-ci est ensuite nommée « fraction protéose-peptone » par Rowland (1938). Certains travaux ont porté sur la mise en place de protocoles permettant d’extraire cette fraction (Aschaffenburg, 1946 ; Weinstein et al., 1951a). Après avoir affiné ces protocoles, Pâquet et al. (1988) proposent de définir la protéose-peptone comme la fraction protéique du lait, soluble après un traitement thermique à 95 °C pendant 30 min suivi d’une acidification à pH 4,6.
2Il est rapidement apparu indispensable d’avoir une connaissance plus large, notamment sur la composition et l’origine de cette fraction. Certaines techniques de séparation telles que l’électrophorèse et la chromatographie ont permis la séparation des composants majeurs. Ainsi, cette séparation a abouti à leur identification et a permis de proposer une nomenclature. Ces fractions suscitent beaucoup d’intérêt pour la recherche au vu de leurs fonctionnalités, notamment les activités biologiques et les propriétés physico-chimiques. En 1989, dans une revue bibliographique, Pâquet fait le point sur l’état d’avancement des recherches relatives à la fraction protéose-peptone du lait bovin, plus particulièrement sa composition, les diverses fonctionnalités de la fraction protéose-peptone, ainsi que l’origine de ses composants.
3La fraction protéose-peptone peut être alors définie comme un mélange hétérogène complexe de protéines thermorésistantes du lactosérum dont on ne connait seulement qu’une partie encore à l’heure actuelle. Cette fraction est alors divisée en deux groupes distincts selon leur origine (cf § 2). Ainsi, le premier est constitué d’un mélange complexe de peptides issu de l’hydrolyse de la caséine β par la plasmine bovine (Pâquet, 1989), notamment les composants PP8 et PP5. Le second est un groupe complexe de glycoprotéines très hétérogènes présentes dans le lactosérum dont le constituant majeur est le composant PP3 (Girardet, 1992).
4L’exploitation potentielle des protéose-peptones comme ingrédients fonctionnels dans l’industrie alimentaire et non alimentaire a accru le nombre de travaux publiés au cours de ces deux dernières décennies afin d’ouvrir une véritable voie de valorisation de cette fraction protéique. Celle-ci est cependant freinée à cause de leur faible concentration dans le lait écrémé. L’utilisation du concentré protéique de lactosérum (WPC) comme source alternative pourrait permettre d’accroitre la production des protéose-peptones à une échelle industrielle. C’est en ce sens que s’inscrivent les récentes études menées par Vanderghem et al. (2007) et Innocente et al. (2011a) afin de caractériser les fractions issues du WPC en comparaison avec celles extraites du lait écrémé.
5Dans la présente synthèse bibliographique, nous allons présenter les dernières avancées obtenues sur la composition et l’origine de la fraction protéose-peptone, ainsi que sur leurs propriétés techno-fonctionnelles et biologiques.
2. Composition et origine des fractions protéose-peptones
6Les principaux constituants des fractions protéose-peptones sont la PP3, la PP5 et la PP8 réparties en deux groupes comprenant d’une part, une fraction non hydrophobe (FNHPP) et, d’autre part, une fraction hydrophobe (FHPP) (Sørensen et al., 1993).
7La FNHPP est constituée de nombreux polypeptides dominés majoritairement par la PP5, la PP8F (Fast : rapide) et la PP8S (Slow : lent), respectivement nommés dans l’ordre croissant de leur mobilité électrophorétique (Eigel et al., 1979). L’analyse de leurs séquences permet de déterminer qu’elles correspondent à des fractions résultant d’un mécanisme de dégradation enzymatique de la caséine β par la plasmine bovine (Figure 1) (Andrews et al., 1983). Ainsi, la PP5 correspond aux fragments β-CN-5P (f1-105/107), la PP8F représente le fragment β-CN-4P (f1-28) et la PP8S équivaut aux fragments β-CN-1P (f 29-105/107) de la caséine β. Cette définition des fragments est fonction des proportions de résidus sérines phosphorylés selon la classification adoptée par le « Committee of Nomenclature of the American Dairy Science Association » (Eigel et al., 1984). Les dénominations PP5, PP8F et PP8S seront alors remplacées respectivement par β-CN-5P (f1-105/107), β-CN-4P (f1-28) et β-CN-1P (f29-105/107). Ces hydrolysats issus de la région N-terminale de la caséine β sont très solubles, contrairement aux caséines γ issues de la région C-terminale (Figure 1) très hydrophobes (Swaisgood, 1993).

8La FHPP, quant à elle, comprend les protéines et l’ensemble des polypeptides natifs tels que les trois principaux composants à caractère hydrophobe contenus dans un groupe complexe de glycoprotéines très hétérogènes : la PP3 (28 kDa), une glycoprotéine très hydrophobe (18 kDa) et un peptide hydrophobe (8 kDa) (Pâquet et al., 1988). Le constituant le plus important de ce groupe est la PP3. C’est une glycoprotéine phosphorylée de 28 kDa, désormais appelée lactophorine (LP28) ou lactoglycophorine (Kanno, 1989 ; Girardet et al., 1996) dont l’origine suscite beaucoup d’interrogations, notamment quant à son appartenance à la membrane du globule gras du lait (MGGL). Elle présente en fait une identité antigénique avec les glycoprotéines solubles (SGP) de la MGGL (Kanno, 1989 ; Nejjar et al., 1990). Cette ressemblance est cependant à nuancer en raison de leurs différences de séquences peptidiques (Kanno, 1989 ; Nejjar et al., 1990). De par sa structure, la lactophorine pourrait être synthétisée à partir des glandes mammaires en lactation, tout comme les glycoprotéines de la MGGL. Dans une étude immunologique, il est montré en effet que la LP28 est associée à la MGGL (Sørensen et al., 1997). Cette observation est en accord avec les actions inhibitrices de la LP28 contre la lipase au cours de la lipolyse des produits laitiers, ce qui permet d’ailleurs aux auteurs de confirmer sa présence dans la MGGL.
9La LP28 contient 135 acides aminés et 5 sites phosphorylation (Ser 29, 34, 38, 40 et 46), 2 sites O-glycosylation (Thr 16 et Thr 86) et un site N-glycosylation (Asn 86). Les 135 résidus sont divisés en deux domaines bien distincts : le N-terminal (comprenant de 1 à 97 résidus, en grande partie chargés négativement avec plusieurs sites post-traductionnels) et le C-terminal (de 98 à 135 résidus, chargés positivement affichant un caractère amphiphile) (Campagna et al., 1998).
10Par ailleurs, la LP28 est dégradée par la plasmine à partir de la région C-terminale pour donner certains constituants de la FHPP tels que la LP16 (16 kDa) et la LP18 (18 kDa) (Sørensen et al., 1993). La LP18, correspondant au fragment LP28 (f54-135), représente la fraction très hydrophobe (18 kDa) de la FHPP (Sørensen et al., 1993). Elle existe sous deux formes : un O-glycan en position Thr 86 et un N-glycan en position Asn 86 (Inagaki et al., 2010a).
11La teneur en PPT varie entre 0,5 et 3 g·l-1 (Pâquet, 1989) et leur composition dépend de la conservation, du stade et du nombre de lactation, et du traitement thermique subi par le lait (Larsen et al., 2010). En effet, la teneur en LP28 diminue dans un lait pasteurisé comparativement à celle d’un lait cru (Larsen et al., 2010), tandis que les proportions des hydrolysats issus de la caséine β s’accroissent pendant la conservation dans le lait des animaux atteints de mammite (Merin et al., 2008).
12En outre, des fractions analogues aux PPT du lait de vache ont été détectées dans le lait d’autres espèces animales. Les PPT du lait de vache ont fait l’objet de plusieurs études en raison de leur accessibilité et de leur teneur. Cependant, la caractérisation de leurs homologues dans le lait des autres mammifères n’a fait l’objet que de rares études, notamment le lait de chamelle, le lait de yak ainsi que le lait de jument (Egito et al., 2002 ; Sheng-Hua et al., 2012). Les laits de brebis, de chèvre, de jument et de yak renferment respectivement des teneurs de 1,4 ; 0,6 ; 0,19 et 0,137 g·l-1. Ces teneurs demeurent 3 à 20 fois inférieures à celles du lait de vache, à l’exception de la teneur du lait de brebis. Néanmoins, le taux de LP28 dans les laits de brebis, de chèvre (Mati et al., 1991) et de chameau est 3 fois plus élevé que dans le lait de vache.
3. Les fonctionnalités des fractions protéose-peptones
3.1. Résistance à la dénaturation thermique
13Cette propriété est d’ailleurs la première particularité des PPT (Pâquet, 1989). La résistance de certains constituants, notamment la LP28, aux hautes températures a fait l’objet d’une attention particulière. La LP28 est stable thermiquement en raison de sa structure tétramèrique (Pedersen et al., 2012). La forme tétramère, qui est une association complexe de monomères, reste stable grâce aux interactions hydrophobes générées par la structure α-hélicoïdale de la région C-terminale de la LP28 (Sørensen et al., 1993). Ainsi, la LP28 est capable de se replier à son état d’origine après avoir été soumise à des conditions extrêmes de température et de pH (températures jusqu’à 100 °C et pH 2-9,2). Cette stabilité est indépendante de la concentration en protéines (Pedersen et al., 2012).
3.2. Les propriétés de surface
14L’étude des propriétés de surface constitue une approche fondamentale pour comprendre les mécanismes physico-chimiques à la base des propriétés moussantes et émulsifiantes. Ainsi, les propriétés de surface des PPT ont été mises en évidence aux interfaces gaz-liquide (air-eau) et liquide-liquide (huile-eau) à l’aide de différentes techniques de tensiométrie qui permettent de caractériser les cinétiques d’adsorption et les propriétés mécaniques des films formés.
15Les cinétiques d’adsorption déterminent la capacité moussante et émulsifiante (Tornberg, 1978), tandis que les propriétés mécaniques des films formés traduisent la stabilité (Mac Ritchie, 1991).
16Le phénomène d’adsorption est quantifié par la vitesse d’adsorption et la tension interfaciale à l’équilibre. Les PPT présentent une vitesse d’adsorption de 4,86 mN·m-1 à l’interface air-eau pour une concentration de 0,2 g·100 ml-1 (Innocente et al., 1998a). Cette vitesse d’adsorption entraine une réduction de la tension superficielle initiale de l’eau (72 mN·m-1) qui diminue en fonction de la concentration. Cela permet d’atteindre rapidement une tension superficielle d’équilibre de 34,06 mN·m-1. Cette valeur correspond à 53 % de réduction de la tension superficielle initiale à partir du temps 0.
17Il faut également souligner l’influence de la source d’extraction sur le comportement interfacial des PPT. En effet, les PPT extraites du lait écrémé présentent de plus basses tensions superficielles d’équilibre, ainsi que de grandes valeurs de vitesse d’adsorption par rapport à celles extraites à partir d’un concentré protéique de lactosérum (Innocente et al., 1998a).
18En outre, à l’interface n-dodecane-eau modèle liquide-liquide, la vitesse d’adsorption de 2,89 mN·m-1 rapportée par Innocente et al. (1998a) permet un abaissement de la tension interfaciale qui demeure moins rapide, comparativement à l’interface air-eau. La vitesse d’équilibre atteinte (16 mN·m-1) correspond à une réduction de 67 % de la tension initiale du dodecane (49 mN·m-1). Cela traduit une grande réduction de la tension interfaciale par rapport à la tension superficielle, du fait probablement de leur plus forte affinité avec l’huile (Innocente et al., 1998a).
19En complément aux données cinétiques, les caractéristiques mécaniques des films formés traduisent la stabilité des mousses et des émulsions qui dépendent précisément de la résistance mécanique et des propriétés élastiques du film protéique. Il apparait que les PPT forment à l’interface air-eau des films élastiques capables de résister aux contraintes mécaniques (Innocente et al., 1998a).
20Après la caractérisation des PPT, les constituants tels que les fractions hydrophobes dénommées FHPP ont également été mises en évidence afin de déterminer leur rôle dans les propriétés de surface globale des PPT (Innocente et al., 1998a). Ainsi, aux interfaces air-eau et eau-huile, la HFPP a une vitesse d’adsorption quasi une fois et demi supérieure à celles des PPT, ce qui leur permet d’obtenir des tensions interfaciales d’équilibre plus faibles. Les résultats des propriétés mécaniques des films de la FHPP corroborent ceux de la cinétique d’adsorption. En effet, la FHPP présente des films plus élastiques que les PPT prises globalement. Les bonnes propriétés de surface de la FHPP sont alors associées à leur forte hydrophobicité.
21À la lumière de ces considérations, la FHPP contribuerait majoritairement aux propriétés tensioactives des PPT. Auparavant, cette contribution avait été évoquée par Girardet et al. (1996). Ces auteurs ont noté l’existence d’un lien entre certaines propriétés de la FHPP (la stabilité thermique, les propriétés d’agrégation et l’hydrophobicité) et les propriétés de surface des PPT.
22Ces différentes études montrent que les PPT peuvent être utilisées comme des agents tensioactifs dans la formulation de certains produits alimentaires nécessitant la présence d’un surfactant, en raison de l’activité interfaciale de leur fraction hydrophobe.
3.3. Les propriétés techno-fonctionnelles
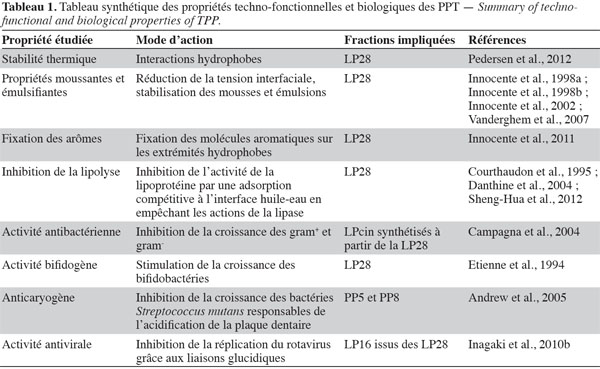
23Les propriétés techno-fonctionnelles des protéines correspondent aux propriétés qui influencent la structure, l’aspect, la texture, la viscosité, la perception en bouche ou la rétention d’arôme du produit alimentaire. Cependant, certaines propriétés techno-fonctionnelles des PPT telles que les propriétés moussantes et émulsifiantes (Tableau 1) sont gouvernées par d’intéressantes propriétés de surface (cf § 3.2.).
24Les propriétés moussantes. D’une façon générale, de nombreuses études sur les protéines associent leur pouvoir moussant à leur capacité à réduire la tension de surface. Très peu d’études ont cependant porté sur les propriétés moussantes spécifiques des PPT. En effet, les PPT pris séparément n’ont jamais fait l’objet d’une étude portant sur leur caractérisation moussante. Leur rôle a été tout de même mis en évidence dans la capacité globale du lait ou du lactosérum à produire une mousse. À ce niveau, les observations restent assez controversées.
25Des auteurs tels que Zhu et al. (1994) notent leur effet négatif sur les propriétés moussantes des protéines du lactosérum (isolat protéique de lactosérum), notamment sur la stabilité de la mousse formée en leur présence. Cette conséquence négative sur la mousse produite est probablement due à leurs actions concurrentielles avec d’autres protéines sériques telles que la β-lactoglobuline et la α-lactalbumine (Zhu et al., 1994). En effet, lorsque la concentration en PPT augmente, la stabilité de la mousse formée avec les protéines du lactosérum diminue. En plus de cette action opposée des protéines sériques, il faut aussi noter celle de certains composants comme les produits de la protéolyse enzymatique (PP5 et PP8) qui ont inévitablement une capacité anti-moussante (Corradini et al., 1994). Mais l’aptitude du lait à donner une mousse avec des caractéristiques souhaitées ne dépend pas uniquement des PPT, elle dépend également de la concentration relative des autres composés azotés qui ont des effets contrastés sur cette propriété du lait.
26Cependant, pour d’autres auteurs, les PPT peuvent constituer de bons agents moussants et seraient même en grande partie responsables de la capacité moussante du lait due, notamment, à son composant PP3. Par exemple, le fromage fouetté contenant 2 % de protéines (p/p) dépourvu des protéines majeures du lactosérum telles que la BSA et la β-lactoglobuline, ainsi que de lactose, peut présenter des qualités de mousse comparables à celles du blanc d’œuf (Girardet et al., 1995).
27Au-delà de cette controverse, en raison de leur excellente propriété de surface intrinsèque à l’interface air-eau, les PPT demeurent d’intéressants candidats comme agents moussants.
28Les propriétés émulsifiantes. À l’instar des propriétés moussantes, les propriétés émulsifiantes des protéines sont en relation avec leurs propriétés tensioactives à l’interface liquide-liquide. L’étude des propriétés émulsifiantes des PPT a véritablement été initiée par Shimizu et al. (1989). Les PPT présentent de meilleures activités émulsifiantes comparativement aux protéines majeures du lactosérum connues pour leur excellente propriété émulsifiante (Shimizu et al., 1989). Cette propriété des PPT est fortement dépendante de la présence de certaines glycoprotéines telles que les LP28 qui semblent avoir une forte affinité pour l’huile (cf § 3.2.) et stabilisent l’émulsion huile-eau (Shimizu et al., 1989).
29Par ailleurs, la méthode turbidimétrique décrite par Pearce et al. (1978) montre également que les propriétés émulsifiantes des PPT sont fonction des concentrations en protéines (Innocente et al., 1998b). En effet, plus la concentration en protéines augmente, plus le temps nécessaire aux molécules pour former un film stable à l’interface huile-eau se réduit. Cela se traduit par un abaissement de la tension interfaciale qui, par voie de conséquence, provoque l’augmentation de la turbidité de l’émulsion.
30En outre, la FHPP présente les plus grandes activités et stabilités émulsifiantes en comparaison avec celles de la β-lactoglobuline (Innocente et al., 1998b). Cette performance s’explique du fait de leur haute hydrophobie qui permettra les interactions des groupement hydrophobes avec la matière grasse (Innocente et al., 1998b).
31Cela permet de considérer la FHPP comme étant responsable des propriétés émulsifiantes des fractions totales de protéose-peptone. Elles présentent une caractéristique structurelle amphiphile qui est conventionnellement considérée comme un module structurel fonctionnel des liaisons lipidiques (Interaction LP28-lipide) (Park et al., 2009).
32La rétention d’arôme. Cette propriété des PPT a été mise en évidence à travers la micro-extraction en phase solide (SPME-GC) couplée à la chromatographie gazeuse. En effet, la micro-extraction en phase solide (SPME) est une méthode appropriée pour étudier la concentration d’arôme absorbée dans une matrice de protéines ou les interactions se produisant entre les protéines et différents composés volatils, qui peuvent avoir un impact sur la perception de saveur (Innocente et al., 2011b). La bonne capacité des PPT à retenir les composés aromatiques est dépendante du pH (Innocente et al., 2011b), de la température ainsi que de la force ionique qui influence également les interactions protéines-composés aromatiques (Jouenne et al., 2000). Par ailleurs, la capacité des PPT à retenir les composés aromatiques est fortement dépendante de la LP28 (Innocente et al., 2011b) en raison de son caractère hydrophobe. Les PPT pourraient de ce fait être utilisées comme ingrédients fonctionnels dans des formulations afin d’améliorer ou de modifier la qualité sensorielle des matrices alimentaires complexes.
33Utilisation des PPT en formulation. Les différentes propriétés moussantes et émulsifiantes ont été mises en évidence dans divers modèles alimentaires réels tels que le pain et certains produits laitiers.
34L’incorporation des protéines du lactosérum dans le pain implique une diminution du volume de celui-ci (Zhu et al., 1994). Cette diminution du volume de pain est attribuée à la présence des PPT qui agissent négativement sur la stabilité de la mousse pendant le traitement au four. En raison de leur faible poids moléculaire, les PPT s’adsorbent plus rapidement aux interfaces et provoquent, au moins en partie, une désorption de la β-lactoglobuline et de la α-lactalbumine, ce qui empêche la formation d’un film cohésif. Ceci se traduit par la suite par l’affaiblissement rapide de la mousse.
35Dans les crèmes glacées, l’incorporation des PPT montre qu’elles peuvent être utilisées dans les formulations des crèmes glacées au même titre que les mono et les diglycérides (Innocente et al., 2002). Ainsi, à l’image des mono et diglycérides, les PPT peuvent contribuer à la déstabilisation partielle des émulsions primaires, nécessaires pour la réussite de l’opération de foisonnement. Les globules gras forment par coalescence partielle un réseau interne de gouttelettes, ce qui confère aux produits foisonnés leur texture et leur stabilité (Aubry et al., 2005). Les PPT pourraient par ailleurs améliorer non seulement certaines propriétés des mix telles que l’augmentation de la viscosité et le taux de foisonnement, mais aussi la stabilité des crèmes glacées (augmentation du temps de fonte).
36Les PPT peuvent être utilisées dans la formulation des crèmes en tant qu’agents émulsifiants : elles interviennent non seulement dans la formation de l’émulsion, mais aussi dans le développement de certaines propriétés telles que la viscosité, la stabilité au crémage et le foisonnement des crèmes. Par ailleurs, les propriétés des crèmes sont fortement dépendantes de la concentration des PPT (Vanderghem et al., 2007). En effet, une amélioration significative des propriétés des crèmes dans un modèle simplifié a été observée à des concentrations supérieures à 2 %. Cet effet positif des PPT est attribué à la formation d’un réseau de globules gras agrégés, à la suite probablement de la désorption des autres protéines de la surface de ceux-ci.
37L’incorporation des PPT dans la formulation des crèmes donne des propriétés sensorielles comparables aux crèmes commerciales standard sans PPT (Innocente et al., 2002). Leur utilisation offre aussi l’avantage de fabriquer des produits 100 % laitiers, sans avoir besoin de recourir aux ingrédients non laitiers (Vanderghem et al., 2007), ce qui pourrait augmenter la valeur marketing desdits produits.
3.4. Les activités biologiques
38Tout comme les propriétés techno-fonctionnelles, les activités biologiques des PPT sont fortement dépendantes de ses constituants majeurs. Ainsi, au cours de ces dernières années, les propriétés biologiques ont été particulièrement consacrées aux fonctionnalités d'un des composants majeurs, notamment la LP28, qui a été considérée comme étant responsable de la plupart des propriétés techno-fonctionnelles des PPT (Tableau 1).
39Inhibition de la lipolyse spontanée du lait. Les PPT protègent les surfaces lipidiques contre l’hydrolyse enzymatique. Cette action inhibitrice de la lipolyse par les PPT est un phénomène interfacial (Girardet et al., 1993) attribué à la LP28. Les mécanismes impliqués sont élucidés par la mesure de la tension interfaciale entre la lipase pancréatique porcine et la LP28 (Courthaudon et al., 1995). Ainsi, l’action d’inhibition de la LP28 n’impliquerait pas une interaction directe avec la lipase, mais serait plutôt le résultat d’une adsorption compétitive à l’interface huile-eau (Girardet et al., 1993 ; Courthaudon et al., 1995). Étant donné que la LP28 est plus tensioactive, elle provoque dès lors une diminution importante de la tension interfaciale, empêchant l’adsorption de la lipase à l’interface huile-eau. Par ailleurs, cette fonctionnalité de la LP28 est confirmée par la méthode in vitro après un temps d’incubation de 45 min à 37 °C (Sheng-Hua et al., 2012). Il faut cependant noter que la PP5 peut également avoir un effet activateur sur cette activité inhibitrice de la LP28 (Sheng-Hua et al., 2012).
40En outre, une autre technique, telle que celle des monocouches, permet de mettre en évidence l’action des PPT sur la lipase (Danthine et al., 2004). En effet, les PPT renforcent la monocouche de la MFGM (complexe protéique du lait) par une augmentation de la pression interfaciale ou par une stabilité de cette pression au cours du temps, empêchant ainsi la lipase d’avoir des interactions avec le film de la monocouche.
41Le rôle joué par Streptococcus dans le processus de coagulation du lait. Ce rôle est attribué aux fragments β-CN-5P (f1-105/107), β-CN-4P (f1-28) et β-CN-1P (f29-105/107) de la caséine β (Merin et al., 2008). En effet, l’infection de la glande mammaire par Streptococcus dysgalactiae entraine une dégradation excessive de la caséine dans le lait au stade de maturation du fromage. Cette infection est spécifiquement dévastatrice à l’égard des propriétés du lait destiné à la production de fromage. Ainsi, la dégradation des caséines conduit à une libération massive des PPT qui affecte le rendement fromager (Merin et al., 2008).
42Activités antimicrobiennes
43Activités antibactériennes
44Les bactéries gram+ et gram-. Les PPT présentent une activité inhibitrice de croissance contre les bactéries gram+ et gram- grâce aux lactophoricines (Campagna et al., 2004). En effet, les lactophoricines sont deux peptides synthétisés à partir de la région C-terminale LP28 (f98 - 135). Ces peptides correspondant aux segments LP28 (f113-135) et LP28 (f119-135) sont dénommées respectivement lactophoricine I (LPcin-I) et lactophoricine II (LPcin-II). L’activité antibactérienne des lactophoricines est en majeure partie attribuée au LPcin-I (23 acides aminés).
45Les bactéries responsables de la carie dentaire « Streptococcus mutans ». Bon nombre de recherches ont identifié les constituants du lait comme étant des substances présentant un effet protecteur contre la carie dentaire, parmi lesquelles sont distinguées les protéines. Les protéines du lait ont ainsi des effets sur la déminéralisation de l'émail dentaire en réduisant l'adhérence des aliments sur la surface de la dent. Comme les caséino-phosphopeptides, les peptides issus de la caséine β, notamment β-CN-5P (f1-105/107) et β-CN-4P (f1-28), étant des phosphopeptides capables de transporter des minéraux tels que le calcium, contribueraient à diminuer l’incidence des caries dentaires (Kanno, 1989 ; Meisel, 1998). Cette action des PPT a été mise en exergue par des études in vitro et in vivo chez des rats de laboratoires (Grenby et al., 2001). Ainsi, l’élimination des autres composants du lait tels que le lactose, la matière grasse, la caséine et d’autres protéines dénaturées par la chaleur, n’influence pas l’effet protecteur dentaire des fractions du lait. Ceci montre que les PPT sont alors une source protectrice contre la carie dentaire. En résumé, les PPT protègent l’émail dentaire en inhibant la croissance des bactéries Streptococcus mutans responsables de l’acidification de la plaque dentaire (Andrews et al., 2006). Cette inhibition pourrait se faire selon l’un ou l’autre des mécanismes suivants :
46– liaison avec le calcium sur la plaque dentaire pour induire un effet tampon contre les acides des bactéries cariogéniques ;
47– actions empêchant la dissociation d’autres ions calcium de la surface de la dent ;
48– formation d’un manteau plus passif et plus protecteur au-dessus de la surface de la dent ;
49– activité antibiotique empêchant la croissance des bactéries cariogéniques ;
50– réduction de la formation du biofilm en empêchant l’adhérence des cellules microbiennes.
51Activité antivirale
52Les Rotavirus, appartenant à la famille des Reoviridae, sont la première cause de diarrhée aigüe sévère chez les enfants dans le monde. Cette infection peut entrainer la gastro-entérite (15-20 % dans les pays industrialisés). Bien qu’elle soit sévère, la mortalité associée reste faible. Elle constitue cependant un important problème de santé publique. Les PPT se sont montrées efficaces contre la réplication de ce virus (Inagaki et al., 2010b). Cette activité inhibitrice est alors attribuée au fragment LP16 de la région C-terminale de la PP3 (Inagaki et al., 2010b). La LP16 inhibe la réplication du rotavirus grâce à ses liaisons glucidiques. De ce fait, les PPT pourraient être utilisées en tant que composants prophylactiques contre les infections rotavirus.
53Autres activités biologiques
54En outre, les PPT semblent stimuler la croissance de la souche industrielle des bifidobactéries (Etienne et al., 1994). En effet, la dégradation des PPT par les enzymes protéolytiques provoque une augmentation de la croissance des bifidobactéries telles que les Bifidobacterium animalis. Cette stimulation est associée aux constituants peptidiques de petites tailles (1 000 à 5 000 Da) et à ceux des composants LP28. Les LP28, en raison de leurs similarités (56 %) avec la GlyCAM-1 (molécule d’adhésion cellulaire dépendante de la glycosylation 1), peuvent être classées dans la famille des molécules GlyCAM-1 (Johnsen et al., 1995). Ces molécules participent à l’adhésion initiale et au roulement des lymphocytes à la surface des cellules endothéliales via leurs interactions avec la sélectine L (Johnsen et al., 1995).
4. Conclusion
55Depuis la précédente synthèse bibliographique (Pâquet, 1989), les propriétés fonctionnelles des PPT au travers de ses constituants ont été de plus en plus finement caractérisées au cours de ces 12 dernières années. Cela a permis de les répartir en deux classes dominées par ses constituants majeurs selon leur origine et leur composition : d’une part, les fractions non hydrophobes regroupant les polypeptides dérivés de la protéolyse de la caséine β et, d’autre part, les fractions hydrophobes comprenant la LP28 et ses dérivés, ainsi que des protéines majeures résiduelles.
56En effet, ces constituants majeurs jouent un rôle important dans les attributs fonctionnels des PPT tant au niveau techno-fonctionnel qu’au niveau biologique. La bonne compréhension de leurs fonctionnalités a permis de mettre en évidence certaines propriétés des PPT telles que des activités biologiques (activités antibactériennes et antivirales).
57L’avancement des connaissances sur les PPT permet désormais de dégager un grand intérêt quant à leur valorisation en tant qu’agents fonctionnels dans les industries alimentaires ou non alimentaires. D’autres propriétés, notamment les propriétés moussantes intrinsèques des PPT, méritent cependant plus d’attentions.
58En outre, les différentes propriétés fonctionnelles des PPT sont en majeure partie gouvernées par la FHPP telle que la LP28. Celle-ci est dorénavant appelée lactophorine ou lactoglycophorine. Elle présente de remarquables propriétés fonctionnelles, notamment les propriétés techno-fonctionnelles et les activités biologiques due à sa région C-terminale amphiphile. Cette région donne, par dégradation enzymatique, la fraction LP18 et par synthétisation, des peptides dénommés lactophoricines. Une attention particulière devrait être portée à l’égard de son origine dont la question demeure posée.
Bibliographie
Andrews A.T. & Alichanidis E., 1983. Proteolysis of caseins and the proteose-peptone fraction of bovine milk. J. Dairy Res., 50, 275-290.
Andrews A.T. et al., 2006. β-CN-5P and β-CN-4P component of bovine milk proteose-peptone: large preparation and influence on the growth of cariogenic microorganisms. Food Chem., 96, 234-241.
Aschaffenburg R., 1946. Surface activity and proteins of milk. J. Dairy Res., 50, 316-329.
Aubry J.M. & Sebag H., 2005. Formulation cosmétique : matières premières, concepts et procédés innovants. Paris : EDP Sciences.
Campagna S. et al., 1998. Conformational studies of a synthetic peptide from the putative lipid-binding domain of bovine milk component PP3. J. Dairy Sci., 81, 3139-3148.
Campagna S. et al., 2004. Antibacterial activity of lactophoricin, a synthetic 23-residues peptide derived from the sequence of bovine milk component-3 of proteose-peptone. J. Dairy Sci., 87, 1621-1626.
Corradini C. & Innocente N., 1994. Influenza della frazione dei proteoso-peptoni sulla formazione della schiuma del latte. Sci. Tecn. Lattiero-Casearia, 45(2), 107-113.
Courthaudon J.L. et al., 1995. Surface activity and competitive adsorption of milk component 3 and porcine pancreatic lipase at the dodecane-water interface. In: Dickinson E. & Lorient D., eds. Food macromolecules and colloid. Cambridge, UK: Royal Society of Chemistry, 58-70.
Danthine S., Blecker C. & Deroanne C., 2004. Lipolysis inhibition by proteose-peptone: an interfacial study. In: Proceedings of the BePCIS seminar: Surfactants self assembly and surfactant at interfaces, 11 February 2004, Gembloux, Belgium.
Egito A.S. et al., 2002. Separation and characterization of mare’s milk αs1-, β-, ҝ-caseins, γ-casein-like, and proteose-peptone component 5-like peptides. J. Dairy Sci., 85, 697-706.
Eigel W.N. & Keeman T.W., 1979. Identification of proteose-peptone component 8-slow as a plasmin-derived fragment of bovine β-casein. Int. J. Biochem., 10, 529-535.
Eigel W.N. et al., 1984. Nomenclature of proteins of cow’s milk: fifth revision. J. Dairy Sci., 67, 1599-1631.
Etienne L., Girardet J.M. & Linden G., 1994. Growth promotion of Bifidobacterium animalis by bovine milk proteose-peptone. Lait, 74, 313-323.
Girardet J.M., 1992. Le composant PP3 des protéose-peptones du lait bovin : obtention, origine, étude de sa partie glycannique, rôle dans la lipolyse. Thèse de doctorat : Université de Nancy I (France).
Girardet J.M. et al., 1993. Study of mechanism of lipolysis inhibition by bovine milk proteose-peptone component 3. J. Dairy Sci., 76, 2156-2163.
Girardet J.M. et al., 1995. Structure of glycoproteins isolated from bovine milk component PP3. Eur. J. Biochem., 234, 939-946.
Girardet J.M. & Linden G., 1996. PP3 component of bovine milk: a phosphorylated whey glycoprotein. J. Dairy Res., 63, 333-350.
Grenby T.H., Andrews A.T., Mistry M. & Williams R.J.H., 2001. Dental caries-protective agents in milk and milk products: investigations in vitro. J. Dent., 29, 83-92.
Inagaki M. et al., 2010a. The multiplicity of n-glycan structures of bovine milk 18 kDa lactophorin (milk glyCAM-1). Biosci. Biotechnol. Biochem., 74(2), 447-450.
Inagaki M. et al., 2010b. The bovine lactophorin C-terminale fragment and PAS6/7 were both potent in the inhibition of human rotavirus replication in cultured epithelial cells and the prevention of experimental gastroenteritis. Biosci. Biotechnol. Biochem., 74(7), 1386-1390.
Innocente N., Corradini C., Blecker C. & Paquot M., 1998a. Dynamic surface properties of proteose-peptone fraction of bovine milk. J. Dairy Sci., 81, 1833-1839.
Innocente N., Corradini C., Blecker C. & Paquot M., 1998b. Emulsifying properties of the total fraction and hydrophobic fraction of bovine milk proteose-peptone. Int. Dairy J., 8, 981-985.
Innocente N., Comparin C. & Corradini C., 2002. Proteose-peptone whey fraction as emulsifier in ice-cream preparation. Int. Dairy J., 12, 69-74.
Innocente N., Biasutti M. & Blecker C., 2011a. HPLC profile and dynamic properties of the proteose-peptone fraction from bovine milk and whey protein concentrate. Int. Dairy J., 21, 222-228.
Innocente N., Marchesini G. & Biasutti M., 2011b. Feasibility of the SPME method for the determination of the aroma retention. Food Chem., 124, 1249-1257.
Johnsen L.B., Sørensen E.S., Petersen T.E. & Berglund L., 1995. Characterization of a bovine mammary gland PP3 cDNA reveals homology with mouse and rat adhesion molecule GlyCAM-1. Biochim. Biophys. Acta, 1620, 171-182.
Jouenne E. & Crouzet J., 2000. Effect of pH on retention of aroma compounds by β-lactoglobulin. J. Agric. Food. Chem., 48, 1273-1277.
Kanno C., 1989. Purification and separation of multiple forms of lactophorin from bovine milk whey and their immunological and electrophoresis properties. J. Dairy Sci., 79, 883-891.
Larsen B.L., Wedholm-Pallas A., Lindmark-Mansson H. & Andren A., 2010. Different proteomic profiles of sweet whey and rennet casein obtained after preparation from raw versus heat-treated skimmed milk. Dairy Sci. Techn., 90, 641-656.
Mac Ritchie F., 1991. Air/water interface studies of proteins. Anal. Chim. Acta, 249, 241-245.
Mati A., Girardet J.M., Xenakis D. & Linden G., 1991. Isolement et caractérisation de la fraction hydrophobe des protéose-peptones des laits bovin, ovin et caprin. Lait, 71, 259-273.
Meisel H., 1998. Overview on milk protein-derived peptides. Int. Dairy J., 8(5-6), 363-373.
Meisel H., 2004. Multifunctional peptides encrypted in milk proteins. BioFactors, 21, 55-61.
Merin U., Fleminger G. & Komanovsky J., 2008. Subclinical udder infection with Streptococcus dysgalactiae impairs milk coagulation proprerties: the emerging role of proteose-peptone. Dairy Sci. Techn., 88, 407-419.
Nejjar J., Pâquet D. & Linden G., 1990. The PP3 component of the proteose-peptone. Extraction from unheated skim milk. Milchwissenschaft, 45, 84-87.
Osborne T.B. & Wakeman A.J., 1918. The protein of cow’s milk. J. Biol. Chem., 33, 7-17.
Pâquet D., 1989. Revue bibliographique : la fraction protéose-peptone du lait. Lait, 69, 1-21.
Pâquet D., Nejjar Y. & Linden G., 1988. Study of a hydrophobic protein fraction isolated from milk proteose-peptone. J. Dairy Sci., 71, 1464-1471.
Park T.J., Kim J.S., Choi S.S. & Kim Y., 2009. Cloning, expression, isotope labeling, purification, and characterization of bovine antimicrobial peptide, lactophoricin in Escherichia coli. Protein Expression Purif., 65(1), 23-29.
Pearce K.N. & Kinsella J.E., 1978. Emulsifying properties of proteins: evaluation of turbidimetric technique. J. Agric. Food Chem., 26, 716-723.
Pedersen L.R.L. et al., 2012. PP3 forms stable tetrameric structures through hydrophobic interactions via the C-terminal amphipathic helix and undergoes reversible thermal dissociation and denaturation. FEBS J., 279, 336-347.
Rowland S.J., 1938. The precipitation of the proteins in milk. I. Casein. II. Total proteins. III. Globulin. IV. Albumin and Proteose-peptone. J. Dairy Res., 9, 30-41.
Sheng-Hua H. et al., 2012. Effects of proteose-peptone fractions from yak milk on lipoprotein lipase lipolysis. Int. J. Dairy Technol., 65(1), 32-37.
Shimizu M., Yamauchi K. & Saito M., 1989. Emulsifying properties of the proteose-peptone fraction obtained from bovine milk. Milchwissenschaft, 44(8), 497-500.
Sørensen E.S. & Petersen T.E., 1993. Purification and characterization of three proteins isolated from the proteose-peptone fraction of bovine milk. J. Dairy Res., 60, 189-192.
Sørensen E.S., Rasmussen L.K., Moller L. & Petersen T.E., 1997. The localization and multimeric nature of component PP3 in bovine milk: purification and characterization of PP3 from caprine and ovine milks. J. Dairy Sci., 80, 3176-3181.
Swaisgood H.E., 1993. Symposium: genetic perspectives on milk protein: comparative studies and nommenclature. J. Dairy Sci., 76(10), 3054-3061.
Tornberg E., 1978. The application of the drop volume technique to measurements of the adsorption of proteins at interfaces. J. Colloid Interface Sci., 64(3), 391-402.
Vanderghem C., Danthine S., Blecker C. & Deroanne C., 2007. Effect of proteose-peptone addition on some physcio-chemical characteristics of recombined dairy creams. Int. Dairy J., 17, 889-895.
Van Boekel M.A.J.S. & Crijns C.L., 1994. Behaviour of the proteose-peptone fraction during renneting of milk. Neth. Milk Dairy J., 48(3), 117-126.
Weinstein B.R., Duncan C.W. & Trout G.M., 1951a. The solar activated flavor of homogenized milk. IV. Isolation and characterization of a whey constituent capable of producing the solar-activated flavour. J. Dairy Sci., 34, 570-576.
Zhu H. & Damodaran S., 1994. Proteose-peptone and physical factors affect foaming properties of whey protein isolate. J. Food Sci., 59(3), 554-560.
Pour citer cet article
A propos de : Gaoussou Karamoko
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Science des Aliments et Formulation. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : karamgao@yahoo.fr
A propos de : Prudent Anihouvi
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Science des Aliments et Formulation. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
A propos de : Christophe Blecker
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Science des Aliments et Formulation. Passage des Déportés, 2. B-5030 Gembloux (Belgique).






