Effet des extraits de compost sur la croissance mycélienne et l’agressivité du Fusarium oxysporum f. sp. radicis-lycopersici
Laboratoire de phytopathologie de l’Ecole Supérieure d’Horticulture et d’Elevage de Chott-Mariem, 4042 Sousse (Tunisie). E-mail : khaled_htn@yahoo.fr
Institut National de Recherche Agronomique de la Tunisie. Pôle Régional de Recherche-Développement agricoles du Centre-Est de Chott-Mariem, 4042 Sousse (Tunisie).
Laboratoire de phytopathologie de l’Ecole Supérieure d’Horticulture et d’Elevage de Chott-Mariem, 4042 Sousse (Tunisie).
Centre Technique de l’Agriculture Biologique de la Tunisie, 4042 Chott-Mariem (Tunisie).
Laboratoire de phytopathologie de l’Ecole Supérieure d’Horticulture et d’Elevage de Chott-Mariem, 4042 Sousse (Tunisie).
Reçu le 10 juin 2005, accepté le 6 décembre 2005
Résumé
L’apport simultané, sur milieu de culture, du Fusarium oxysporum f. sp. radicis-lycopersici et des extraits de composts a révélé que ces derniers induisent une inhibition de la croissance mycélienne du pathogène. Cette inhibition, notée après six jours d’incubation à 25 ° C, est plus importante dans le cas de l’extrait de compost enrichi dans le milieu PDB (Potato Dextrose Broth) où elle peut atteindre les 70 % par rapport au témoin. Le repiquage des plants de tomate préalablement inoculés, par trempage racinaire dans une suspension sporale de F. oxysporum f. sp. radicis-lycopersici, dans un substrat (tourbe, perlite ou le mélange des deux) traité par l’extrait de compost a significativement réduit l’incidence de la fusariose des racines et du collet comparativement au témoin inoculé et non traité. La réduction de l’incidence de la maladie est plus importante quand les plants sont repiqués dans de la tourbe traitée par l’extrait de compost. En effet, ces plants ne montrent aucun signe de flétrissement et présentent un système racinaire vigoureux et une meilleure croissance végétative.
Abstract
Effect of compost tea on mycelial growth and disease severity of Fusarium oxysporum f. sp. radicis-lycopersici. Simultaneous addition, on culture media, of Fusarium oxysporum f. sp. radicis-lycopersici and compost teas revealed that the latest induced the inhibition of the mycelial growth of the pathogen. This inhibition, noted after an incubation period of about six days at 25°C, was more important when compost teas were enriched in PDB (Potato Dextrose Broth), where it may reach 70% compared to the control. Transplantation of tomato seedlings, previously inoculated by a conidial suspension of F. oxysporum f. sp. radicis-lycopersici, in a container media (peat, perlite or the mixture of the two substrates) treated by compost teas has significantly reduced Fusarium crown and root rot incidence compared to inoculated and untreated control seedlings. Disease incidence is more reduced when tomato inoculated plants are transplanted in peat treated by compost teas; indeed, these plants don’t show any wilting and present a vigorous root system and a better vegetative growth.
1. Introduction
1La tomate (Lycopersicon esculentum Mill. « Priscas ») est sujette à deux maladies fusariennes : la flétrissure fusarienne classique (Fusarium wilt) causée par Fusarium oxysporum f. sp. lycopersici Snyder et Hansen et la pourriture des racines et du collet (Fusarium crown and root rot) causée par Fusarium oxysporum f. sp. radicis-lycopersici Jarvis et Shoemaker (Katan et al., 1997). Ce dernier pathogène, signalé sur une culture hors-sol de tomates dans les serres géothermales du sud tunisien durant la campagne 2000–2001 (Hajlaoui et al., 2001 ; Hibar, 2002), a occasionné des dégâts pouvant atteindre 90 % des plantes dans certaines serres.
2Si la lutte chimique, par le benomyl ou le captafol, a donné des résultats encourageants dans la lutte contre ce pathogène (Marios, Mitchell, 1981), l’utilisation répétée des produits de synthèse entraîne souvent la pollution de l’environnement, l’apparition de souches résistantes et augmente la quantité des résidus sur les fruits (Ozbay, Newman, 2004).
3Vu les exigences du marché extérieur sur le plan de la teneur minimale en matière de résidus sur les fruits et dans le but de chercher des alternatives de lutte contre le F. oxysporum f. sp. radicis-lycopersici, on s’est orienté vers la lutte biologique.
4Les extraits de compost ont été largement utilisés par les agriculteurs pour leurs effets bénéfiques sur les plantes. Durant les deux dernières décades, plusieurs études ont montré que les extraits de compost sont efficaces dans le contrôle de plusieurs agents pathogènes (Elad, Shteinberg, 1994 ; Yohalem et al., 1996 ; Reuveni et al., 2002 ; Al-Dahmani et al., 2003).
5L’efficacité des extraits de compost varie considérablement. Cela est dû en partie à la différence de procédures dans la préparation des extraits de compost, la source, la composition, la maturité du compost et la durée de compostage. De plus, les différents agents pathogènes ne se comportent pas de la même façon vis-à-vis des microorganismes contenus dans les extraits de compost (Al-Dahmani et al., 2003).
6L’objectif de ce travail consiste donc, à étudier l’effet de différents extraits de composts sur la croissance mycélienne de F. oxysporum f. sp. radicis-lycopersici et d’évaluer l’agressivité de ce pathogène sur des plants de tomates repiqués dans des substrats traités par ces extrais de compost.
2. Matériels et Méthodes
2.1. Matériels biologiques
7Les extraits de compost. Quatre extraits de compost ont été utilisés dans cette étude. Ils proviennent de quatre types de compost dont les compostions en matériaux de base (Znaidi, 2002) figurent dans le tableau 1.
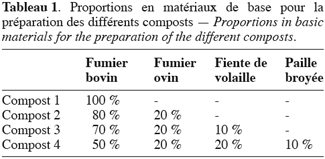
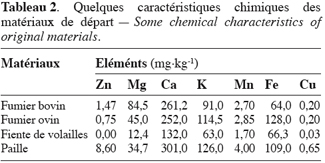
8La composition chimique, en quelques éléments minéraux, des matériaux de départ est présentée dans le tableau 2.
9L’extraction a été réalisée selon la méthode aérobique développée par Weltzien (1992) et qui consiste à ajouter de l’eau de distribution courante aux différents composts (1:1, volume / volume). Le mélange compost et eau a été réalisé dans des containers de 20 litres qui facilitent l’agitation journalière du mélange pendant quelques minutes (5 à 10 min). Cette agitation forcée permet l’introduction et la dissolution de l’air (principalement l’oxygène) dans la solution.
10Après une période d’incubation de 7 jours à une température comprise entre 20 et 22 ° C, mentionné comme étant « le temps d’extraction », les différents mélanges sont filtrés à travers un tamis (Znaïdi, 2002).
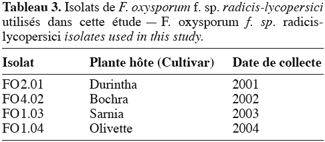
11Les isolats de F. oxysporum f. sp. radicis-lycopersici. Les isolats de F. oxysporum f. sp. radicis-lycopersici ont été obtenus à partir des plants de tomate présentant des symptômes de flétrissement et de pourriture du collet.
12La détermination de la forme spéciale de ce pathogène a été réalisée moyennant des tests de pathogénicité en utilisant une série de cultivars différentiels de tomate (Hibar, 2002). Les isolats les plus virulents sont retenus pour cette étude (Tableau 3).
13Les plants de tomates. Le cultivar de tomate (Lycopersicon esculentum Mill. « Priscas ») utilisé dans cette étude est le « Riogrande ».
14Il est choisi sur base de sa sensibilité vis-à-vis de F. oxysporum f. sp. radicis-lycopersici (Hibar, 2002).
152.2. Effet des extraits de compost sur la croissance mycélienne de F. oxysporum f. sp. radicis-lycopersici
16La technique consiste à placer simultanément, dans la même boîte de Pétri contenant le milieu PDA (Potato Dextrose Agar), une pastille gélosée (6 mm de diamètre) portant le F. oxysporum f. sp. radicis-lycopersici et 100 µl d’extrait de compost déposés dans un puits (6 mm de diamètre) réalisé à l’aide d’un emporte-pièce dans le milieu PDA. La pastille et le puits sont diamétralement opposés et équidistants de 3 cm du centre de la boite. Cet essai est réalisés de deux façons.
17Effet des extraits de compost frais. Cette technique consiste à mettre dans la même boîte de Pétri l’extrait de compost à l’état frais sur un milieu PDA contenant ou non du sulfate de streptomycine à raison de 250 mg.l-1. Cet essai a pour objectif de distinguer séparément l’effet bénéfique des bactéries et des champignons antagonistes contenus dans l’extrait de compost.
18Effet des extraits de compost « amélioré ». Dans cette technique, on a voulu multiplier au préalable les microorganismes contenus dans l’extrait de compost avant son utilisation. La technique consiste à mettre 10 ml d’extrait de compost dans des Erlen-Meyer contenant 100 ml soit du PDB (Potato Dextrose Broth) soit du LPG (milieu Levure Peptone Glucose de base pour les bactéries, composé de 5 g d’extrait de levure, 5 g de peptone de viande et 10 g de glucose dans 1000 ml d’eau distillée). Ces cultures liquides sont incubées à 25 ° C sous une agitation de 220 tours.min-1 pendant 4 à 5 jours.
19L’effet de l’extrait de compost sur la croissance mycélienne est étudié en mettant dans le puits, réalisé dans le milieu PDA, 100 µl d’extrait de compost amélioré.
20Dans les boîtes témoins, l’extrait de compost est remplacé par de l’eau distillée stérile.
21Pour les deux méthodes, l’incubation est réalisée à 25 ° C pendant six jours. La notation du diamètre moyen des colonies traitées est réalisée lorsque les filaments mycéliens atteignent la périphérie de la boite dans les lots témoins.
22L’évaluation de l’inhibition exercée par l’extrait de compost est estimée par le calcul du pourcentage d’inhibition de la croissance mycélienne selon la formule suivante (Hmouni et al., 1996) :
23I (%) = (1- Cn / Co) × 100
24où Cn correspond au diamètre moyen des colonies en présence d’extrait de compost et Co représente le diamètre moyen des colonies témoins.
25Le dispositif expérimental utilisé pour cet essai est celui d’un plan complet à deux facteurs avec répétitions ; le facteur A correspond aux différents traitements, le facteur B représente les isolats de F. oxysporum f. sp. radicis-lycopersici. Le nombre de répétitions est de 5 boîtes par traitement élémentaire et l’essai est répété 2 fois. Une analyse de la variance, associée au test de comparaison des moyennes de Student-Newman-Keuls (si nécessaire), a été effectuée pour distinguer les groupes selon les valeurs des moyennes de variables à tester. Le logiciel utilisé est le SPSS (Statistical Package for the Social Science version 10.0).
2.3. Effet des extraits de compost sur l’expression de la maladie
26Afin de déterminer l’effet des extraits de compost sur l’agressivité de F. oxysporum f. sp. radicis-lycopersici, un essai de lutte in vivo est mis en place, nécessitant les étapes suivantes :
27Préparation du substrat pour le repiquage des plants. La multiplication des microorganismes contenus dans l’extrait de compost a été réalisée dans des boîtes de Roux contenant chacune 600 cm3 de perlite, de tourbe ou d’un mélange (50 % : 50 %) des deux substrats et 200 ml de milieu PDB (préalablement autoclavés pendant 25 min à une température de 120 ° C). Ces boîtes sont incubées à 25 ° C durant 4 semaines après addition de10 ml d’extrait de compost.
28Inoculation et repiquage des plants. Des plants de tomates (cultivar Riogrande), âgés de 20 jours (stade 2-3 feuilles), ont été dépotés et leurs racines lavées. L’inoculation de ces plants a été réalisée par trempage des racines dans une suspension de spores de F. oxysporum f. sp. radicis-lycopersici (107 spore.ml-1) pendant 30 min. Une fois inoculés, ces plants sont transplantés dans le substrat préparé préalablement.
29Des plants traités de la même manière mais repiqués dans un substrat préalablement autoclavé non additionné d’extrait de compost constituent le témoin inoculé et non traité. D’autres dont les racines sont trempées dans l’eau distillée stérile représentent le témoin sain.
30Pour éviter l’effet nutritif de l’extrait de compost sur les plants de tomates (Alvarez et al., 1995), ces derniers sont fertilisés régulièrement à l’aide d’une solution nutritive standard (200 ppm de N ; 54 ppm de P ; 256 ppm de K ; 42 ppm de Mg ; 147 ppm de Ca ; 55 ppm de S ; 1,15 ppm de Fe ; 0,05 ppm de Cu ; 0,1 ppm de Mo ; 0,345 ppm de Zn ; 1 ppm de Mn et 0,3 ppm de B). L’élevage de ces plants est réalisé dans une cellule de serre vitrée sous une température d’environ 25 °C et une photopériode de 12 heures (Pharand et al., 2002).
31L’évaluation des symptômes est réalisée 30 jours après la transplantation des plantules (Woo et al., 1996) en se basant sur une échelle de notation de symptômes proposée par Vakalounakis et Fragkiadakis (1999) et qui comprend quatre valeurs allant de 0 à 3 :
320 : plante saine ; 1 : léger jaunissement, légère pourriture du pivot et des racines secondaires et pourriture du collet ; 2 : jaunissement important des feuilles avec ou sans flétrissement, rabougrissement des plantes, pourriture sévère du pivot et des racines secondaires, pourriture importante du collet et brunissement des vaisseaux de la tige ; 3 : mortalité totale de la plante.
33L’incidence de la maladie (%) est calculée en utilisant la formule suivante (Song et al., 2004) :

34Le dispositif expérimental utilisé pour cet essai est celui d’un plan complet à trois facteurs avec répétitions ; le facteur A correspond aux substrats de culture, le facteur B représente les différents traitements par l’extrait de compost et le facteur C traduit l’inoculation par les différents isolats de F. oxysporum f. sp. radicis-lycopersici. Le nombre de répétitions est de 10 plants par traitement élémentaire. Lorsque nécessaire, une analyse de la variance, associée au test de comparaison des moyennes de Student-Newman-Keuls, a été effectuée pour distinguer les groupes selon les valeurs des moyennes de variables à tester. Le logiciel utilisé est le SPSS.
3. Résultats et discussions
35Dans le but de palier aux problèmes et limites de la lutte chimique (accoutumance, résidus sur les produits traités, durabilité faible), on s’est orienté vers d’autres alternatives de lutte telle que la lutte biologique à l’aide de différents extraits de compost.
3.1. Effet de l’extrait de compost sur la croissance mycélienne de F. oxysporum f. sp. radicis-lycopersici
36L’apport simultané, dans la même boîte de Pétri contenant du PDA non additionné au préalable de sulfate de streptomycine, d’une pastille gélosée portant le pathogène et de 100 µl d’extrait de compost frais a réduit la croissance mycélienne de F. oxysporum f. sp. radicis-lycopersici. Cette réduction varie de 17 à 39 % ; valeur maximum atteinte pour l’isolat FO 4-02 traité par l’extrait 4 (Figure 1). Sur PDA additionné de sulfate de streptomycine, l’inhibition de la croissance mycélienne est plus importante. En effet, mis à part l’extrait 3 pour lequel l’inhibition est de l’ordre de 25 %, les trois autres extraits ont engendré des inhibitions de 39 à 50,5 ; valeur maximum également observée pour l’isolat FO 4-02 traité par l’extrait 4 (Figure 2).
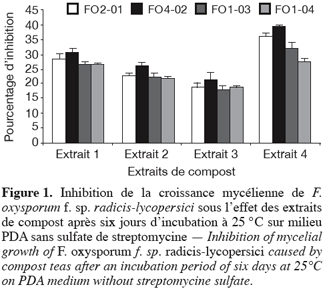
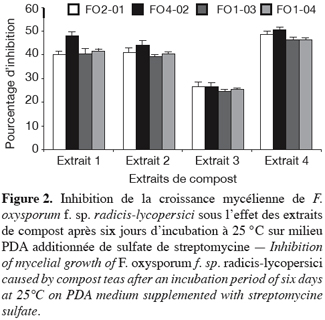
37Cette différence d’inhibition s’expliquerait par le fait que l’addition de l’antibiotique au milieu de culture empêcherait le développement des bactéries et par conséquent favoriserait un développement plus important des champignons antagonistes contenus dans l’extrait de compost.
38Lorsque l’extrait de compost est préalablement amélioré dans le LPG ou dans le PDB, l’inhibition de la croissance mycélienne de F. oxysporum f. sp. radicis-lycopersici observée a été plus importante.
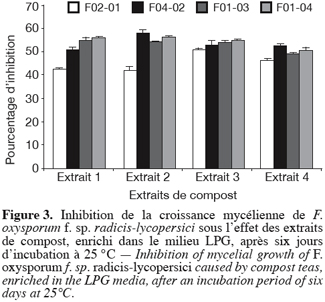
39En effet, les extraits de compost enrichis dans le LPG, ont entraîné une inhibition de la croissance mycélienne comprise entre 42 et 58 % et le pourcentage d’inhibition le plus important (58 %) est obtenu avec l’isolat FO 4-02 traité par l’extrait 2 (Figure 3). La réduction de la croissance mycélienne était encore nettement plus importante quand l’extrait de compost a été amélioré dans le PDB. En effet, dans ce dernier cas le pourcentage d’inhibition a dépassé 70 % pour l’isolat FO 1-04 traité par l’extrait 4 (Figure 4). Les extraits 1 et 2 ont entraîné aussi une inhibition importante de la croissance mycélienne atteignant respectivement entre 62 et 65 % et entre 62 et 68 %.
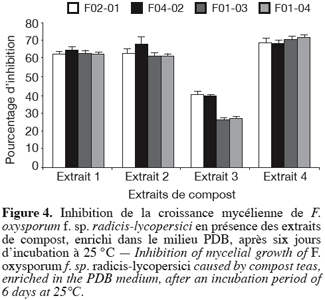
40Testé in vitro, contre certains champignons responsables de la pourriture de tubercules de la pomme de terre (F. solani, F. roseum, F. graminearum et Phytophthora erythroseptica), Znaïdi (2002) avait montré que c’était ce même extrait (extrait 4) qui entraînait le pourcentage d’inhibition de la croissance mycélienne le plus important. Cette inhibition était la plus marquée dans le cas du F. solani.
41Dans ce même sens, Scheuerell et Mahaffee (2004), ont montré que l’ajout aux extraits de compost de 1,2 g de poudre d’algue soluble (Maxicrop), 2,5 ml d’acide humique (Humax) et 3 g de poudre de roche (Target Glacial Dust) dans un litre d’eau, a amélioré significativement le contrôle de la fonte de semis du concombre causée par Pythium ultimum. En effet, par cette amélioration, le contrôle de la maladie est de 100 %.
42Postma et al. (2003) ont remarqué aussi que l’enrichissement du compost par des agents antagonistes, tels que l’isolat M 73 de Verticillium biguttatum, un mycoparasite du Rhizoctonia solani et l’isolat 618-12B17 de Fusarium oxysporum non pathogène, un antagoniste de la flétrissure fusarienne, augmente la fiabilité de l’effet bénéfique du compost dans la suppression des maladies.
43L’effet inhibiteur du compost a également été signalé par Tuitert et al. (1998) qui ont montré que la croissance mycélienne du Rhizoctonia solani a été significativement réduite sous l’action du compost. Cette réduction est plus importante pour une maturité optimale du compost (cinq mois). Ces auteurs ont précisé que c’est la densité mycélienne de ce pathogène qui est beaucoup plus affectée que sa croissance radiale.
3.2. Effet des extraits de compost sur l’incidence de la maladie
44Indépendamment de l’isolat de F. oxysporum f. sp. radicis-lycopersici utilisé, les résultats obtenus montrent que le repiquage des plants de tomates inoculés dans la tourbe traitée par l’extrait de compost a significativement (p < 0,05) réduit l’attaque de ces derniers, et ce, en les comparant à ceux inoculés et transplantés dans la tourbe non traitée par l’extrait de compost.
45En effet, l’incidence de la maladie sur les plants transplantés dans la tourbe traitée par les extraits de compost n’a pas dépassé 17 %. Cette incidence est la plus faible (10,83 %) en utilisant l’extrait 4 (Tableau 4). La figure 5 présente la comparaison entre une plante inoculée témoin et une plante inoculée repiquée dans la tourbe traitée avec l’extrait 4. L’incidence de la maladie est plus élevée (33,33 %) lorsque les plants de tomates sont repiqués dans la perlite traitée par le même extrait ; cela s’explique par le fait que les plants repiqués dans la tourbe ont eu une croissance végétative plus importante par rapport à ceux repiqués dans la perlite.
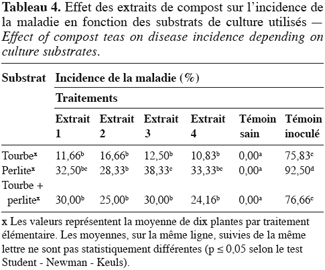

46Cependant, même en utilisant la perlite traitée par les extraits de compost comme substrat de culture, l’incidence de la maladie reste nettement très inférieure à celle obtenue avec le témoin inoculé et non traité par les extraits de compost. En effet, le pourcentage le plus important est obtenu avec l’extrait 3 (38,3 %), alors que cette valeur a dépassé 92 % dans le cas des plants témoins inoculés et repiqués dans la perlite non traitée par l’extrait de compost (Tableau 4).
47Le mélange de la tourbe et de la perlite a engendré des résultats intermédiaires entre ceux de chacun de ces deux substrats utilisés individuellement (Tableau 4).
48La comparaison du système racinaire des plants inoculés et traités par les extraits de composts, que ce soit transplantés dans la tourbe, la perlite ou le mélange des deux, à celui des plants témoins inoculés par le pathogène et repiqués dans le substrat non traité par les extraits de compost, montre une nette différence entre les deux. En effet, pour les plants traités par les extraits de composts, le système racinaire se développe normalement et aucun brunissement ou pourriture n’est observé. La figure 6 montre à titre d’exemple la comparaison entre le système racinaire d’une plante inoculée et repiquée dans la tourbe traitée par l’extrait 4 et les racines d’une plante inoculée témoin.
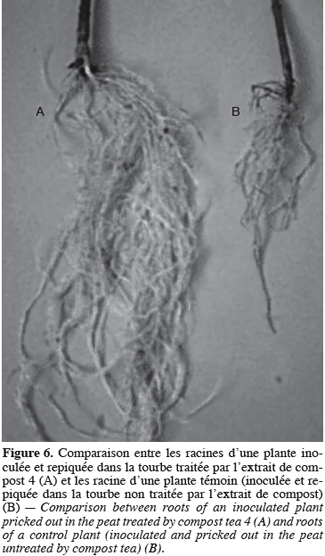
49L’amélioration du système racinaire sous l’action du compost a été observée par Pharand et al. (2002) qui ont montré que le repiquage des plants de tomates, inoculés par F. oxysporum f. sp. radicis-lycopersici, dans un mélange de tourbe et de compost a engendré une faible attaque de ces derniers en les comparant à ceux repiqués uniquement dans la tourbe et dont les racines présentent des nécroses très importantes.
50L’effet bénéfique des extraits de compost a été signalé aussi par Scheuerell et Mahaffee (2004) qui ont montré que l’irrigation par l’extrait de compost d’un substrat de culture inoculé par Pythium ultimum a réduit l’effet de la fonte de semis du concombre causée par ce pathogène.
51Dans ce même sens, Zhang et al. (1998) ont montré que la pulvérisation d’un extrait de compost sur des plants d’Arabidopsis inoculés par Pseudomonas syringae pv. maculicola a réduit significativement la sévérité de la moucheture bactérienne. En effet, le pourcentage des feuilles nécrosées est de 19,9 %, pour les plants d’Arabidopsis repiqués dans le compost et pulvérisé avec l’extrait de compost, alors que cette valeur est de 28,1 % dans le cas des plants repiqués dans la tourbe.
52Il en est de même pour Al-Dahmani et al. (2003) qui ont montré que la pulvérisation sur des plants de tomates de l’extrait de compost préparé à partir du fumier de bovin composté, 24 heures avant leur inoculation par Xanthomonas vesicatoria, a réduit significativement l’intensité de la tache bactérienne en les comparant aux plants témoins traités par l’eau. Ils ont montré aussi que la pulvérisation foliaire des extraits de compost a réduit significativement l’incidence de la tache bactérienne sur les fruits de tomates cultivées en plein champ.
4. Conclusion
53Cette étude a montré l’effet inhibiteur des extraits de compost vis-à-vis de certains isolats de F. oxysporum f. sp. radicis-lycopersici, agent responsable de la pourriture des racines et du collet de la tomate.
54En effet, in vitro, les extraits de compost ont inhibé la croissance mycélienne du pathogène testé. Cette inhibition est plus importante quand les extraits de compost sont préalablement améliorés par culture en milieu LPG ou en milieu PDB. Enrichis dans le PDB, les différents extraits de compost ont limité la croissance mycélienne des isolats de F. oxysporum f. sp. radicis-lycopersici de plus de 70 %. Ces résultas dévoilent le rôle d’agents antagonistes, contenus dans les extraits de compost, pour la lutte biologique contre le pathogène étudié.
55Le traitement du substrat de culture, utilisé pour l’élevage des plants de tomates, par les différents extraits de compost a entravé l’infection par le F. oxysporum f. sp. radicis-lycopersici et son expression et par conséquent a fortement réduit l’incidence de la maladie.
56Cette réduction est plus importante dans le cas des plants inoculés et repiqués dans la tourbe traitée par les extraits de compost. De plus, l’addition des extraits de compost à ce substrat de culture a engendré une amélioration de la croissance végétative des plants de tomates.
57En perspective, il est d’intérêt primordial de tester les extraits de compost à grande échelle par le traitement des substrats de culture utilisables en culture hors-sol, pour réduire l’incidence de la fusariose des racines et du collet de la tomate.
58Remerciements
59Les auteurs tiennent à remercier vivement le Centre Technique d’Agriculture Biologique (Tunisie) et l’Ecole Supérieure d’Horticulture et d’élevage de Chott Mariem pour leur soutien financier.
Bibliographie
Al-Dahmani JH., Abbasi PA., Miller SA., Hoitink HAJ. (2003). Suppression of bacterial spot of tomato with foliar sprays of compost extracts under greenhouse and field conditions. Plant Dis. 87, p. 913–919.
Alvarez MB., Gagné S., Antoun H. (1995). Effect of compost on rhizosphere microflora of the tomato and on the incidence of plant growth-promoting rhizobacteria. Appl. Environ. Microbiol. 61, p. 194–199.
Elad Y., Shteinberg D. (1994). Effect of compost water extracts on grey mold (Botritis cinerea). Crop Prot. 13, p. 109–114.
Hajlaoui MR., Hamza N., Gargouri S., Guermech A. (2001). Apparition en Tunisie de Fusarium oxysporum f. sp. radicis-lycopersici, agent de la pourriture des racines et du collet de la tomate. OEPP/EPPO Bull. 31, p. 505–507.
Hibar K. (2002). La fusariose du collet et des racines de la tomate : Pathogénicité et moyens de lutte. Mémoire de Diplôme d’études approfondies en Protection des Plantes et Environnement. Ecole Supérieure d’Horticulture et d’élevage de Chott Mariem, 54 p.
Hmouni A., Hajlaoui MR., Mlaiki A. (1996). Résistance de Botrytis cinerea aux benzimidazoles et aux dicarboximides dans les cultures abritées de tomate en Tunisie. OEPP/EPPO Bull. 26, p. 697–705.
Katan T., Shlevin E., Katan J. (1997). Sporulation of Fusarium oxysporum f. sp. lycopersici on stem surfaces of tomato plants and aerial dissemination of inoculum. Phytopathology 87, p. 712–719.
Marios JJ., Mitchell DJ. (1981). Effect of fumigations and fungal antagonists on the relationships of inoculum density to infection incidence and disease severity in Fusarium crown rot of tomato. Phytopathology 71, p. 167–170.
Ozbay N., Newman SE. (2004). Fusarium crown and root rot of tomato and control methods. Plant Pathol. J. 3, p. 9–18.
Pharand B., Carisse O., Benhamou N. (2002). Cytological aspects of compost-mediated induced resistance against Fusarium crown and root rot in tomato. Phytopathology 92, p. 424–438.
Postma J., Montanari M., Van Den Boogert PHJF. (2003). Microbial enrichment to enhance the disease suppressive activity of compost. Eur. J. Soil Biol. 39, p. 157–163.
Reuveni R., Raviv M., Krasnovsky A., Freiman L., Medina S., Bar A., Orion D. (2002). Compost induces protection against Fusarium oxysporum in sweet Basil. Crop Prot. 21, p. 583–587.
Scheuerell SJ., Mahaffee WF. (2004). Compost tea as a container medium drench for suppressing seedling damping-off caused by Pythium ultimum. Phytopathology 94, p. 1156–1163.
Song W., Zhou L., Yang C., Cao X., Zhang L., Liu X. (2004). Tomato Fusarium wilt and its chemical control strategies in a hydroponic system. Crop Prot. 23, p. 243–247
Tuitert G., Szczech M., Bollen GJ. (1998). Suppression of Rhizoctonia solani in potting mixtures amended with compost made from organic household waste. Phytopathology 88, p. 764–773.
Vakalounakis DJ., Fragkiadakis GA. (1999). Genetic diversity of Fusarium oxysporum isolates from cucumber: differentiation by pathogenicity, vegetative compatibility and RAPD fingerprinting. Phytopathology 89, p. 161–168.
Weltzien HC. (1992). Biocontrol of foliar fungal disease with compost extracts. In Andrews JH., Hirano SS. (eds.). Microbial Ecology of leaves. New York: Springer-Verlag, p. 430–450.
Woo SL., Zoina A., Del Sorbo G., Lorito M., Nanni B., Scala F., Noveiello C. (1996). Characterization of Fusarium oxysporum f. sp. phaseoli by pathogenic races, VCGs, RFLPs, and RAPD. Phytopathology 86, p. 966–972.
Yohalem DS., Nordheim EV., Andrews JH. (1996). The effect of water extracts of spent mushroom compost on apple scab in the field. Phytopathology 86, p. 914–922.
Zhang W., Han DY., Dick WA., Davis KR., Hoitink HAJ. (1998). Compost and compost water extract-induced systemic acquired resistance in cucumber and Arabidopsis. Phytopathology 88, p. 450–455.
Znaidi A. (2002). Etude et évaluation du compostage de différents types de matières organiques et des effets des jus de composts biologiques sur les maladies des plantes. Master of Science Degree n° 286. Bari : Mediterranean Organic Agriculture, CIHEAM Mediterranean Agronomic Institute, 94 p.

